Dernière mise à jour le 02/03/2026
INNOVAIR NEXTHALER 100 microgrammes/6 microgrammes par inhalation, poudre pour inhalation
Indications thérapeutiques
Le dipropionate de béclométasone appartient à un groupe de médicaments dénommés corticosteroïdes qui ont une action anti-inflammatoire. Ils réduisent le gonflement et l’irritation dans vos poumons.
Le fumarate de formotérol dihydraté appartient à un groupe de médicaments appelés « bronchodilatateurs de longue durée d'action ». Les bronchodilatateurs provoquent un relâchement des muscles qui entourent les voies respiratoires et donc, un élargissement de leur calibre, ce qui facilite l'inspiration et l'expiration de l'air.
Ces deux substances actives facilitent la respiration en soulageant les symptômes tels que l'essoufflement, le sifflement respiratoire et la toux chez les patients asthmatiques ou présentant une bronchopneumopathie chronique obstructive (BPCO). Elles contribuent également à prévenir la survenue des symptômes de l’asthme.
Asthme
INNOVAIR NEXTHALER est utilisé pour traiter l’asthme chez l’adulte.
Si votre médecin vous a prescrit INNOVAIR NEXTHALER, vous êtes probablement dans l’une des deux situations suivantes :
· votre asthme n'est pas correctement contrôlé par des corticoïdes inhalés et des bronchodilatateurs de courte durée d'action utilisés «à la demande ».
ou
· votre asthme répond bien au traitement associant des corticoïdes et des bronchodilatateurs de longue durée d'action.
BPCO
INNOVAIR NEXTHALER est également préconisé pour le traitement symptomatique de la bronchopneumopathie chronique obstructive (BPCO) sévère chez l'adulte. La BPCO est une maladie chronique des poumons causée, le plus souvent, par le tabagisme.
Présentations
> 1 inhalateur(s) multidose(s) acrylonitrile butadiène styrène de 120 dose(s). Chaque inhalateur est conditionné dans un sachet
Code CIP : 266 362-1 ou 34009 266 362 1 0
Déclaration de commercialisation : 01/09/2014
Cette présentation est agréée aux collectivités
- Prix hors honoraire de dispensation : 25,14 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 26,16 €
- Taux de remboursement :65%
> 3 inhalateur(s) multidose(s) acrylonitrile butadiène styrène de 120 dose(s). Chaque inhalateur est conditionné dans un sachet
Code CIP : 34009 302 062 3 2
Déclaration de commercialisation : 07/10/2020
Cette présentation est agréée aux collectivités
- Prix hors honoraire de dispensation : 74,66 €
- Honoraire de dispensation : 2,76 €
- Prix honoraire compris : 77,42 €
- Taux de remboursement :65 %
Service médical rendu (SMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Important | Avis du 01/04/2020 | Inscription (CT) | Le service médical rendu par INNOVAIR NEXTHALER et / FORMODUAL NEXTHALER, 100 µg/6 µg et 200 µg/6 µg, poudre pour inhalation est important dans le traitement continu de l'asthme persistant, dans les situations où l'administration par voie inhalée d'un médicament associant un corticoïde et un bronchodilatateur bêta-2 agoniste de longue durée d'action est justifiée : - chez les patients insuffisamment contrôlés par une corticothérapie inhalée et la prise d'un bronchodilatateur bêta-2 agoniste de courte durée d'action par voie inhalée « à la demande » ou - chez les patients contrôlés par l'administration d'une corticothérapie inhalée associée à un traitement continu par bêta-2 agoniste de longue durée d'action par voie inhalée. |
| Modéré | Avis du 01/04/2020 | Inscription (CT) | Le service médical rendu par INNOVAIR NEXTHALER et / FORMODUAL NEXTHALER, 100 µg/6 µg, poudre pour inhalation est modéré dans le traitement symptomatique des patients ayant une BPCO sévère (VEMS < 50 % de la valeur théorique) et des antécédents d’exacerbations répétées, et chez qui des symptômes respiratoires significatifs persistent malgré un traitement régulier par bronchodilatateur à action prolongée. |
| Modéré | Avis du 17/02/2016 | Extension d'indication | Le service médical rendu par INNOVAIR/FORMODUAL NEXTHALER 100/6 µg, solution pour inhalation en flacon pressurisé est modéré dans le traitement symptomatique des patients ayant une BPCO sévère (VEMS < 50 % de la valeur théorique) et des antécédents d’exacerbations répétées, et chez qui des symptômes respiratoires significatifs persistent malgré un traitement régulier par bronchodilatateur à action prolongée. |
| Important | Avis du 20/11/2013 | Inscription (CT) | La Commission considère que le service médical rendu par INNOVAIR/FORMODUAL NEXTHALER 100/6 µg par dose, poudre pour inhalation est important dans les indications de l’AMM |
Amélioration du service médical rendu (ASMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprés de la HAS (plus d'informations dans l'aide). Les avis et synthéses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur de l'ASMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| V (Inexistant) | Avis du 01/04/2020 | Inscription (CT) | Ces spécialités sont un complément de gamme qui n’apportent pas d’amélioration du service médical rendu (ASMR V) par rapport aux présentations déjà inscrites. |
| V (Inexistant) | Avis du 17/02/2016 | Extension d'indication | INNOVAIR/FORMODUAL NEXTHALER 100/6 µg/dose, solution pour inhalation en flacon pressurisé, n’apporte pas d’amélioration du service médical rendu (ASMR V) par rapport à INNOVAIR/FORMODUAL 100,6 µg/dose, solution pour inhalation en flacon pressurisé. |
| V (Inexistant) | Avis du 20/11/2013 | Inscription (CT) | INNOVAIR/FORMODUAL NEXTHALER 100/6 µg par dose, poudre pour inhalation n’apporte pas d’amélioration du service médical rendu (ASMR V, inexistante) par rapport à INNOVAIR/FORMODUAL 100/6 µg par dose, solution pour inhalation en flacon pressurisé et aux autres associations fixes corticoïde + bêta-2 agoniste de longue durée d’action dans le traitement continu de l’asthme persistant. |
ANSM - Mis à jour le : 04/08/2021
INNOVAIR NEXTHALER 100 microgrammes/6 microgrammes par inhalation, poudre pour inhalation
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Dipropionate de béclométasone anhydre............................................................. 100 microgrammes
Fumarate de formotérol dihydraté........................................................................... 6 microgrammes
Pour une dose mesurée de 10 mg de poudre pour inhalation.
Excipient à effet notoire : chaque dose contient 9,9 mg de lactose.
Pour la liste complète des excipients, voir rubrique 6.1.
L’inhalateur multidoses contient une poudre blanche à blanc cassé.
4.1. Indications thérapeutiques
INNOVAIR NEXTHALER est indiqué chez l’adulte en traitement continu de l'asthme persistant, dans les situations où l'administration par voie inhalée d'un médicament associant un corticoïde et un bronchodilatateur ß2 agoniste de longue durée d'action est justifiée :
· chez les patients insuffisamment contrôlés par une corticothérapie inhalée et la prise d'un bronchodilatateur ß2 agoniste de courte durée d'action par voie inhalée «à la demande».
ou
· chez les patients contrôlés par l'administration d'une corticothérapie inhalée associée à un traitement continu par ß2 agoniste de longue durée d'action par voie inhalée.
Bronchopneumopathie chronique obstructive (BPCO)
Traitement symptomatique des patients présentant une bronchopneumopathie chronique obstructive (BPCO) sévère (VEMS<50% de la valeur théorique) et des antécédents d’exacerbations répétées, et chez qui des symptômes respiratoires significatifs persistent malgré le traitement régulier par bronchodilatateur à action prolongée.
4.2. Posologie et mode d'administration
Posologie
Asthme
INNOVAIR NEXTHALER ne doit pas être utilisé en première intention pour l’initiation d’un traitement de l’asthme. La posologie de INNOVAIR NEXTHALER est individuelle et doit être ajustée en fonction de la sévérité de la maladie, que ce soit à l'initiation ou pendant les phases d'adaptation du traitement. Si le dosage disponible de l'association fixe ne permet pas d'ajuster la posologie de chacun des principes actifs en fonction de l'état clinique du patient, bêta-2 agonistes et corticostéroïdes devront être administrés séparément.
Compte tenu de sa distribution en particules extrafines dans l'aérosol délivré, un ajustement de la posologie peut être nécessaire lorsque INNOVAIR NEXTHALER est initié en remplacement d’une spécialité délivrant des particules non extrafines. Lors de ce remplacement de traitement, la dose quotidienne recommandée de dipropionate de béclométasone pour INNOVAIR NEXTHALER est plus faible que celle des traitements délivrant du dipropionate de béclométasone en particules non extrafines et doit être adaptées aux besoins de chaque patient. Un ajustement posologique n’apparait pas nécessaire lors du remplacement d’INNOVAIR, solution pour inhalation en flacon pressurisé, par INNOVAIR NEXTHALER, poudre pour inhalation.
Il existe deux modalités d’administration thérapeutiques :
A. Traitement continu de fond : INNOVAIR NEXTHALER est utilisé en traitement continu de fond et un bronchodilatateur d’action rapide est utilisé séparément pour soulager les symptômes d’asthme.
B. Traitement continu de fond et, en cas de besoin, pour soulager les symptômes d’asthme : INNOVAIR NEXTHALER est utilisé à la fois en traitement continu de fond et, en cas de besoin, pour soulager les symptômes d’asthme.
A. Traitement continu de fond :
Il convient d’informer les patients qu’ils doivent avoir en permanence à leur disposition un bronchodilatateur d’action rapide en traitement de secours pour traiter les symptômes aigus d’asthme.
Posologies recommandées chez l'adulte âgé de 18 ans et plus :
1 à 2 inhalations 2 fois par jour.
La dose journalière maximale est de 4 inhalations par jour.
B. Traitement continu de fond et, en cas de besoin, pour soulager les symptômes d’asthme :
Les patients prennent quotidiennement INNOVAIR NEXTHALER en traitement continu de fond et utilisent aussi INNOVAIR NEXTHALER en cas de besoin en réponse à la survenue des symptômes d’asthme. Il convient d’informer les patients qu’ils doivent avoir en permanence INNOVAIR NEXTHALER à leur disposition en traitement de secours.
L’utilisation d’INNOVAIR NEXTHALER en traitement continu de fond et pour soulager les symptômes d’asthme sera envisagée notamment chez des patients :
· Ayant un contrôle insuffisant de l’asthme avec recours fréquent au traitement de secours.
· Ayant eu des antécédents d’exacerbations d’asthme ayant nécessité une intervention médicalisée.
Une surveillance médicale attentive des effets indésirables dose-dépendants est nécessaire chez les patients consommant de façon fréquente des doses journalières élevées de INNOVAIR NEXTHALER pour soulager leurs symptômes d’asthme.
Posologies recommandées pour les adultes de 18 ans et plus :
La dose recommandée en traitement continu de fond est d’une inhalation deux fois par jour (une inhalation le matin et une inhalation le soir).
En cas de besoin, pour soulager les symptômes, les patients prendront une inhalation supplémentaire de INNOVAIR NEXTHALER. Si les symptômes persistent après quelques minutes, l’inhalation sera renouvelée.
La dose maximale journalière est de huit inhalations.
Il est fortement recommandé aux patients utilisant fréquemment leur traitement de secours de prendre un avis médical. Ils devront être réévalués et leur traitement de fond reconsidéré.
Posologies recommandées chez l'enfant et l'adolescent de moins de 18 ans :
La sécurité et l’efficacité de INNOVAIR NEXTHALER chez les enfants et les adolescents âgés de moins de 18 ans n’ont pas été établies. Il n’existe pas de données avec INNOVAIR NEXHTALER chez l’enfant de moins de 12 ans. Les données actuellement disponibles chez les adolescents âgés de 12 à 17 ans sont résumées dans les rubriques 4.8 et 5.1, mais elles sont insuffisantes pour établir les recommandations relatives à la posologie adaptée.
Le médecin vérifiera régulièrement que le dosage prescrit de INNOVAIR NEXTHALER est adapté pour un traitement optimal du patient. Il convient de toujours rechercher la dose minimale permettant d'obtenir le contrôle des symptômes.
Lorsque celui-ci est obtenu avec la posologie minimale recommandée de INNOVAIR NEXTHALER, l'administration d'un corticoïde seul pourra être envisagée comme étape suivante dans la recherche du traitement minimal efficace.
Les patients devront être informés de la nécessité de poursuivre le traitement de façon régulière et quotidienne, même si la symptomatologie a régressé.
Bronchopneumopathie chronique obstructive (BPCO)
Posologie recommandée chez l'adulte à partir de 18 ans : 2 inhalations 2 fois par jour
Populations spécifiques :
Il n'y a pas lieu d'ajuster la posologie chez les sujets âgés.
Il n'existe pas de donnée concernant l'emploi de INNOVAIR NEXTHALER en cas d'insuffisance hépatique ou rénale (voir rubrique 5.2).
Mode d’administration
Le dispositif nexthaler est un inhalateur déclenché par l’inspiration. Les patients présentant un asthme modéré à sévère ou une BPCO gardent un débit inspiratoire suffisant pour déclencher la libération de la dose de poudre au travers du dispositif nexthaler (voir la rubrique 5.1). Dans l’intervalle des valeurs limites des débits inspiratoires de ces patients, la dose de poudre délivrée au travers de l’inhalateur nexthaler reste constante.
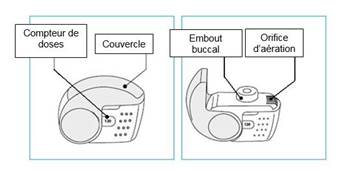
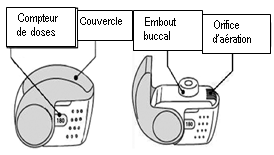
L’utilisation correcte de l’inhalateur nexthaler est essentielle pour l’efficacité du traitement. Il convient d'informer le patient de la nécessité de lire attentivement la notice et de se conformer aux recommandations et modalités d'emploi qui y figurent. Ces instructions figurent également ci-dessous.
Le nombre de doses s’affichant dans la fenêtre du boîtier ne diminuera à la fermeture du couvercle que si le patient a effectué une inspiration au travers de l’inhalateur.
Le couvercle de l’inhalateur ne doit être ouvert que lorsque cela est nécessaire pour une inhalation. Si le couvercle est ouvert puis refermé sans que le patient ait inhalé la dose, celle-ci est renvoyée dans le réservoir de poudre à l’intérieur de l’inhalateur, la dose suivante pourra être inhalée en toute sécurité.
Les patients doivent se rincer la bouche, se gargariser à l'eau ou encore se brosser les dents après l'inhalation (voir rubrique 4.4).
MODE D’EMPLOI DE L’INHALATEUR NEXTHALER
INNOVAIR NEXTHALER est disponible en deux tailles d’inhalateurs :
· un inhalateur contenant 120 inhalations
· un inhalateur contenant 180 inhalations
A. Ce conditionnement contient :
Pour des informations sur le contenu du conditionnement, voir rubrique 6.5.
Si le contenu du conditionnement est différent de celui décrit à la rubrique 6.5, retournez votre inhalateur à la personne qui vous l’a délivré, afin d’en obtenir un nouveau.
B. Mises en garde générales et précautions d’emploi
· Ne pas retirer l’inhalateur du sachet si vous n’avez pas l’intention de l’utiliser immédiatement.
· N’utilisez votre inhalateur que conformément à la prescription de votre médecin.
· Gardez le couvercle fermé jusqu’à ce que vous utilisiez votre inhalateur pour administrer une dose.
· Lorsque vous n’utilisez pas votre inhalateur, conservez-le dans un endroit propre et à l’abri de l’humidité.
· N’essayez pas de démonter votre inhalateur pour une raison quelconque.
C. Principales caractéristiques de votre inhalateur NEXThaler
|
|
Administrer une dose avec votre inhalateur ne nécessite que trois étapes simples : Ouvrir, inhaler, fermer.
D. Avant d’utiliser un nouvel inhalateur Nexthaler
|
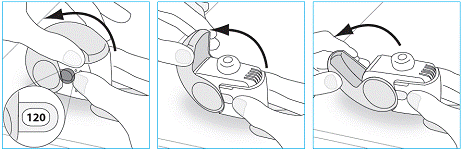
1. Ouvrez le sachet et sortez votre inhalateur |
· N’utilisez pas votre inhalateur si le sachet n’est pas scellé ou est endommagé - retournez-le à la personne qui vous l’a délivré afin d’en obtenir un nouveau.
· Utilisez l’étiquette sur la boite pour y inscrire la date à laquelle vous avez ouvert le sachet.
|
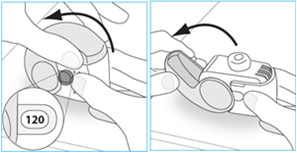
2. Inspectez votre inhalateur |
· Si votre inhalateur est cassé ou apparaît endommagé, retournez-le à la personne qui vous l’a délivré afin d’en obtenir un nouveau.
|
3. Vérifiez la fenêtre du compteur de doses. Si votre inhalateur est neuf, le nombre « 120 » ou « 180 » s’affichera dans la fenêtre du compteur de doses. |
· N’utilisez pas un nouvel inhalateur si le nombre affiché est inférieur à « 120 » ou « 180 » - retournez-le à la personne qui vous l’a délivré afin d’en obtenir un nouveau.
|
|
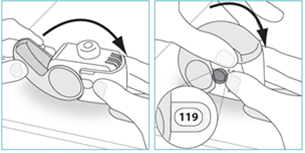
E. Comment utiliser votre inhalateur NEXTHALER
· Si vous n’êtes pas sûr de prendre votre dose correctement, contactez votre pharmacien ou votre médecin.
· Si vous n’êtes pas sûr que le compteur de doses ait diminué après une inhalation, attendez la dose suivante et prenez-la conformément à votre prescription. Ne prenez pas de dose supplémentaire.
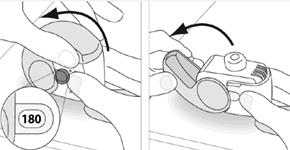
E.1. Ouvrir
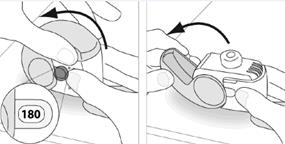
1. Maintenez votre inhalateur fermement en position verticale.
2. Vérifier le nombre de doses restantes : tout chiffre compris entre « 1 » et « 120 » ou « 180 » montre que l’inhalateur contient des doses restantes.
· Si la fenêtre du compteur de doses affiche « 0 », il ne reste aucune dose – jetez votre inhalateur et obtenez-en un nouveau.
3. Ouvrez entièrement le couvercle.
|
|
4. Avant d’inhaler le médicament, expirez autant que vous le pouvez sans être gêné.
· N’expirez pas dans votre inhalateur.
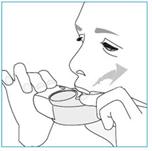
E.2 Inhaler
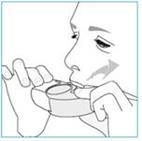
Dans la mesure du possible, tenez-vous debout ou en position assise à la verticale lors de chaque inhalation.
1. Amenez votre inhalateur à votre bouche et placez vos lèvres autour de l’embout buccal.
· Ne recouvrez pas l’orifice d’aération en tenant votre inhalateur.
· N’inhalez pas le produit à travers l’orifice d’aération.
2. Inspirez rapidement et profondément par la bouche.
· Vous pourrez sentir un goût lorsque vous administrez votre dose.
· Vous pourrez entendre ou ressentir un déclic lorsque vous prenez votre dose.
o N’inhalez pas par le nez.
o Ne retirez pas votre inhalateur de vos lèvres au cours de l’inhalation.
|
|
3. Retirez votre inhalateur de votre bouche.
4. Retenez votre respiration pendant 5 à 10 secondes ou aussi longtemps que vous le pouvez sans être gêné.
5. Expirez lentement.
· N’expirez pas dans votre inhalateur.
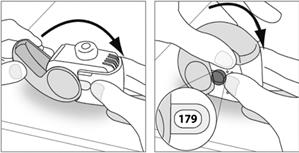
E.3. Fermer
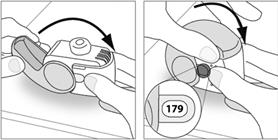
1. Replacez votre inhalateur en position verticale et fermez entièrement le couvercle.
2. Vérifiez que le compteur de doses a reculé d’une unité.
|
|
3. Si vous devez prendre une autre dose, répétez les étapes E.1 à E.3.
F. Nettoyage
· Normalement, il n’est pas nécessaire de nettoyer votre inhalateur.
· Le cas échéant, vous pouvez nettoyer votre inhalateur après utilisation avec un linge ou un tissu sec.
o Ne nettoyez pas votre inhalateur avec de l’eau ou d’autres liquides. Laissez-le sec.
G. Conservation et élimination
Pour des informations sur la conservation et l’élimination, voir rubriques 6.4 et 6.6.
4.4. Mises en garde spéciales et précautions d'emploi
Le traitement de l’asthme est en pratique réalisé par étapes en fonction de la réponse clinique du patient avec éventuellement des explorations fonctionnelles respiratoires. En cas d’inefficacité du traitement ressentie par le patient, la conduite thérapeutique devra être réévaluée. Une augmentation de la consommation de bronchodilatateurs utilisés pour soulager les symptômes aigus d’asthme indique une aggravation de l’asthme qui doit conduire à la réévaluation de la conduite thérapeutique. Une détérioration soudaine ou progressive du contrôle des symptômes d'asthme nécessite un avis médical urgent car elle peut annoncer une évolution vers un état clinique grave engageant le pronostic vital. Il conviendra alors d'envisager une augmentation de la corticothérapie par voie inhalée ou orale ou une antibiothérapie en cas d'infection.
Le traitement par INNOVAIR NEXTHALER ne doit pas être instauré pendant une exacerbation, pendant une aggravation significative ou une déstabilisation aiguë de l'asthme. Des événements indésirables graves liés à l'asthme ainsi que des exacerbations sont possibles pendant le traitement par INNOVAIR NEXTHALER. Le patient devra être informé que si les symptômes d'asthme restent insuffisamment contrôlés ou s'aggravent après la mise en route du traitement par INNOVAIR NEXTHALER, le traitement doit être poursuivi mais un avis médical est requis dès que possible.
Comme avec d'autres produits inhalés, l'augmentation du sifflement bronchique témoignant d'un bronchospasme à la suite de l'inhalation de ce médicament, doit conduire à l'arrêt du traitement par INNOVAIR NEXTHALER et à un examen clinique du patient. La conduite thérapeutique devra être réévaluée pour envisager si nécessaire les alternatives thérapeutiques.
INNOVAIR NEXTHALER ne doit pas être utilisé en traitement de première intention de l'asthme.
Un bronchodilatateur de courte durée d'action que le patient doit garder à portée de main en cas de besoin, devra être prescrit pour le traitement des crises et épisodes aigus d'asthme, c’est-à-dire soit INNOVAIR NEXTHALER (pour les patients qui l’utilisent à la fois en traitement de fond et pour soulager les symptômes d’asthme), soit un bronchodilatateur d’action rapide (pour les patients qui utilisent INNOVAIR NEXTHALER uniquement en traitement de fond).
Il conviendra d'informer le patient que le traitement par INNOVAIR NEXTHALER doit être poursuivi régulièrement et quotidiennement même lorsque les symptômes ont régressé. La prise de INNOVAIR NEXTHALER « à la demande » ne doit s’envisager qu’en réponse à la survenue de symptômes d’asthme dans le but de les soulager, mais elle ne doit pas correspondre à une utilisation préventive systématique telle que pour la prévention de l’asthme d’effort. Pour une telle utilisation, il convient d’avoir recours à un bronchodilatateur d’action rapide seul.
Une fois les symptômes de l’asthme contrôlés, la dose d’INNOVAIR NEXTHALER sera progressivement diminuée, sous contrôle médical régulier. La dose minimale efficace d’INNOVAIR NEXTHALER devra être utilisée (voir rubrique 4.2).
Pneumonie chez les patients présentant une bronchopneumopathie chronique obstructive (BPCO)
Une augmentation de l’incidence des cas de pneumonie, ayant ou non nécessité une hospitalisation, a été observée chez les patients présentant une BPCO et recevant une corticothérapie inhalée. Bien que cela ne soit pas formellement démontré dans toutes les études cliniques disponibles, ce risque semble augmenter avec la dose de corticoïde administré.Les données disponibles ne permettent pas de considérer que le niveau du risque de survenue de pneumonie varie en fonction du corticostéroïde inhalé utilisé.Il convient de rester vigilant chez les patients présentant une BPCO, les symptômes de pneumonie pouvant s’apparenter aux manifestations cliniques d’une exacerbation de BPCO.Le tabagisme, un âge avancé, un faible indice de masse corporelle (IMC) ainsi que la sévérité de la BPCO sont des facteurs de risque de survenue de pneumonie.
Les corticoïdes inhalés peuvent induire des effets systémiques lorsqu'ils sont utilisés pendant longtemps à fortes doses. Ces effets sont beaucoup plus rares avec un traitement administré par voie inhalée que par voie orale. Les effets systémiques possibles sont les suivants: syndrome de Cushing, symptômes cushingoïdes, freination surrénalienne, retard de croissance chez les enfants et adolescents, diminution de la densité minérale osseuse, cataracte, glaucome, et plus rarement des troubles psychologiques ou du comportement incluant une hyperactivité psychomotrice, des troubles du sommeil, une anxiété, une dépression ou une agressivité (en particulier chez l’enfant). Par conséquent, il est important de réduire la dose de corticoïde inhalé jusqu'à la dose minimale efficace pour le contrôle de l'asthme.
L'administration au long cours de corticoïdes par voie inhalée à fortes doses peut provoquer une inhibition de la fonction surrénalienne voire une insuffisance surrénalienne aiguë. Le risque est particulièrement élevé chez les enfants et adolescents de moins de 16 ans recevant des doses de dipropionate de béclométasone supérieures aux doses préconisées. Les situations favorisant l'insuffisance surrénalienne aiguë sont notamment les suivantes: traumatisme, intervention chirurgicale, infection ou diminution trop rapide de la posologie. Les symptômes sont habituellement atypiques, pouvant consister en une anorexie, des douleurs abdominales, une perte de poids, une fatigue, des céphalées, des nausées, des vomissements, une hypotension, des troubles de la conscience, une hypoglycémie et des convulsions. Il faut envisager une corticothérapie de supplémentation par voie systémique couvrant la durée de la période de stress ou en cas d'intervention programmée.
Il convient de rester prudent lors du remplacement de la corticothérapie par voie orale par une corticothérapie par voie inhalée, la freination des fonctions surrénaliennes pouvant persister assez longtemps après l'arrêt de la corticothérapie par voie orale. Les patients ayant nécessité une corticothérapie à forte dose en urgence par le passé ou ayant reçu un traitement prolongé par des corticoïdes inhalés à forte dose sont également exposés à ce risque. Il conviendra donc d'évoquer le risque d'insuffisance surrénalienne persistante en cas de stress ou d'intervention programmée et envisager une corticothérapie de supplémentation dans ces situations. Un avis spécialisé peut être requis avant toute intervention en cas de freination majeure.
INNOVAIR NEXTHALER doit être utilisé avec prudence en cas de tuberculose pulmonaire évolutive ou quiescente et d'infection fongique ou virale des voies respiratoires.
INNOVAIR NEXTHALER doit être administré avec précaution (éventuellement sous surveillance avec enregistrement électrocardiographique) chez les patients présentant les pathologies suivantes : arythmie cardiaque, en particulier bloc auriculo-ventriculaire du troisième degré et tachyarythmie, sténose aortique sous-valvulaire idiopathique, cardiomyopathie obstructive hypertrophique, cardiopathie ischémique, insuffisance cardiaque sévère, hypertension artérielle sévère et anévrisme.
La prudence est également requise chez les patients présentant un allongement de l'intervalle QTc, authentifié ou suspecté, qu'il soit congénital ou iatrogène (QTc > 0,44 secondes). Le formotérol lui-même peut induire un allongement de l'intervalle QTc.
La prudence est également recommandée en cas d'utilisation d’INNOVAIR NEXTHALER chez les patients présentant une thyréotoxicose, un diabète, un phéochromocytome et une hypokaliémie non traitée.
Une hypokaliémie pouvant entraîner des conséquences graves peut être observée lors d'un traitement par bêta-2 agoniste. En cas d'asthme sévère la vigilance est requise car l’hypoxie peut potentialiser cet effet. L'administration concomitante de bêta-2 agonistes avec des médicaments ayant un effet hypokaliémiant ou pouvant potentialiser cet effet comme les dérivés xanthiques, les corticoïdes ou les diurétiques peut induire une augmentation du risque d'hypokaliémie (voir rubrique 4.5). La prudence est particulièrement recommandée en cas d'asthme instable pour lequel la prise de médicaments bronchodilatateurs utilisés «à la demande» est importante et variable au cours de la journée. Il peut être préférable de surveiller la kaliémie dans ces situations.
L'administration de formotérol peut provoquer une augmentation de la glycémie. Des contrôles supplémentaires de la glycémie peuvent donc être justifiés chez les patients diabétiques.
En cas d'anesthésie programmée avec des anesthésiques halogénés, l'administration d’INNOVAIR NEXTHALER devra être interrompue au moins 12 heures avant le début de l'anesthésie, en raison du risque d'arythmie.
Les patients devront se rincer la bouche, se gargariser avec de l'eau ou encore se brosser les dents après l'inhalation de la dose prescrite, afin de réduire le risque de candidose oropharyngée et de dysphonie.
Ce médicament contient du lactose. Le lactose contient de faibles quantités de protéines de lait pouvant être à l’origine de réactions allergiques. Les patients présentant une intolérance au galactose, un déficit total en lactase ou un syndrome de malabsorption du glucose et du galactose (maladies héréditaires rares) ne doivent pas prendre ce médicament.
Troubles visuels
Des troubles visuels peuvent apparaitre lors d’une corticothérapie par voie systémique ou locale. En cas de vision floue ou d’apparition de tout autre symptôme visuel apparaissant au cours d’une corticothérapie, un examen ophtalmologique est requis à la recherche notamment d’une cataracte, d’un glaucome, ou d’une lésion plus rare telle qu’une choriorétinopathie séreuse centrale, décrits avec l’administration de corticostéroïdes par voie systémique ou locale.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Interactions pharmacocinétiques
Le dipropionate de béclométasone est très rapidement métabolisé par des enzymes estérases.
Le métabolisme de la béclométasone est moins dépendant du CYP3A que celui de certains autres corticostéroïdes, et les interactions sont en général peu probables. Néanmoins, en cas d’utilisation concomitante d’inhibiteurs puissants du CYP3A (exemple : ritonavir, cobicistat), le risque d’effets systémiques ne peut pas être exclu. La prudence est requise et une surveillance adaptée est recommandée en cas d’utilisation concomitante de ces produits.
Interactions pharmacodynamiques
L'usage des ß-bloquants (y compris sous forme de collyre) doit être évité chez les sujets asthmatiques. En cas d'utilisation impérative de bêta-bloquants, l'effet du formotérol peut être diminué voire inhibé.
A l'inverse, l'utilisation concomitante d'autres produits ß-adrénergiques peut entraîner un effet additif. Il convient donc de rester prudent lors de la prescription simultanée de formotérol et de théophylline ou d'autres médicaments bêta-adrénergiques.
Un traitement concomitant par la quinidine, le disopyramide, le procaïnamide, les phénothiazines, certains antihistaminiques (par exemple la terfénadine), les inhibiteurs de la monoamine-oxydase et les antidépresseurs tricycliques peut provoquer un allongement de l'intervalle QTc et augmenter le risque d'arythmie ventriculaire.
En outre, la L-dopa, la L-thyroxine, l'ocytocine et l'alcool peuvent altérer la tolérance cardiaque des bêta-2 sympathomimétiques.
Un traitement concomitant par des inhibiteurs de la monoamine-oxydase ou par des médicaments dotés de propriétés similaires, tels que furazolidone et procarbazine, peut provoquer des réactions hypertensives.
Le risque d'arythmie est augmenté chez les patients recevant de façon concomitante des anesthésiants hydrocarbures halogénés.
Un traitement concomitant par des dérivés de la xanthine, des corticoïdes ou des diurétiques risque de potentialiser l'effet hypokaliémiant des agonistes des récepteurs bêta-2 (voir rubrique 4.4). Chez les patients traités par des glycosides digitaliques, l'hypokaliémie peut augmenter le risque d'arythmie.
4.6. Fertilité, grossesse et allaitement
Grossesse
Il n'existe pas de données cliniques pertinentes concernant l'emploi d’INNOVAIR NEXTHALER chez la femme enceinte. Les études animales concernant l'association de dipropionate de béclométasone et de formotérol ont révélé une toxicité sur la reproduction et le fœtus après une exposition systémique élevée (voir rubrique 5.3). Chez l’animal, des doses élevées de corticostéroïde administrées à des femelles gestantes entraînent des anomalies du développement fœtal, notamment des fentes palatines et un retard de la croissance intra-utérine. Du fait de l'effet tocolytique des bêta-2 sympathomimétiques, la prudence est requise dans la période précédant l'accouchement.
L'utilisation du formotérol est déconseillée durant la grossesse et particulièrement en fin de grossesse ou pendant le travail, sauf en l'absence d'alternative dont la sécurité est bien établie.
L’administration d’INNOVAIR NEXTHALER au cours de la grossesse ne doit être envisagée que si les bénéfices attendus prévalent sur les risques potentiels.
Il n'existe pas de données cliniques pertinentes concernant l'emploi d’INNOVAIR NEXTHALER chez la femme qui allaite. Bien qu'il n'y ait pas de données recueillies chez l'animal, il est probable que le dipropionate de béclométasone, comme les autres corticoïdes, soit sécrété dans le lait.
Le passage du formotérol dans le lait humain n'est pas connu, mais sa présence a été décelée chez l'animal pendant l'allaitement.
L'administration de INNOVAIR NEXTHALER chez la femme qui allaite ne sera envisagée que si les bénéfices attendus l'emportent sur les risques potentiels.
La décision d’interrompre l’allaitement ou d’interrompre/de suspendre l’administration d’INNOVAIR NEXTHALER doit prendre en compte le bénéfice de l’allaitement pour l’enfant et le bénéfice du traitement pour la mère.
Fertilité
Aucune donnée n’est disponible en clinique humaine. Au cours des études conduites chez le rat, une dose élevée de dipropionate de béclométasone dans l’association administrée a été associée à une réduction de la fertilité chez les femelles et à une embryotoxicité (voir rubrique 5.3).
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
La survenue de tremblements des extrémités constitue l’effet indésirable le plus fréquent. Au cours d’une étude clinique de 12 semaines sur INNOVAIR NEXTHALER, des tremblements ont été observés uniquement avec la posologie la plus élevée (2 inhalations 2 fois par jour), ils sont apparus plus fréquemment au début du traitement et ont été d’intensité légère. La survenue de tremblements n’a pas entrainé d’abandon de traitement dans les études cliniques.
Expérience acquise au cours des études cliniques conduites chez des patients asthmatiques :
La sécurité d’emploi de INNOVAIR NEXTHALER a été évaluée au cours d’études cliniques contrôlées contre placebo, au cours desquelles un total de 719 patients âgés d’au moins 12 ans, présentant un asthme de sévérité variable, ont été exposés au médicament. Les incidences des effets indésirables indiquées dans le tableau ci-dessous font référence aux patients asthmatiques âgés d’au moins 12 ans, et sont issues des résultats de deux études cliniques pivots conduites avec INNOVAIR NEXTHALER administré aux posologies préconisées dans le Résumé des Caractéristiques du Produit (RCP) pendant une période de 8 à 12 semaines. Aucun trouble psychiatrique n’a été rapporté au cours des études cliniques conduites avec INNOVAIR NEXTHALER, mais cet effet figure dans le tableau ci-dessous en tant qu'effet de classe avec les corticostéroïdes inhalés.
Les effets indésirables rapportés avec l’association fixe de dipropionate de béclométasone et de formotérol (INNOVAIR NEXTHALER) sont indiqués ci-après, par classes de systèmes organes.
La définition des fréquences est la suivante: très fréquent (≥ 1/10), fréquent (≥ 1/100 et <1/10), peu fréquent (≥ 1/1 000 et <1/100), rare (≥ 1/10 000 et < 1/1 000) et très rare (≤ 1/10 000), inconnu (fréquence ne pouvant être estimée à partir des données disponibles).
|
Classe d’organes |
Réaction indésirable |
Fréquence |
|
Infections et infestations |
Pneumonie (chez les patients atteints de BPCO) |
Fréquent |
|
Rhinopharyngite |
Peu fréquent |
|
|
Candidose orale |
Peu fréquent |
|
|
Troubles du métabolisme et de la nutrition |
Hypertriglycéridémie |
Peu fréquent |
|
Troubles psychiatriques |
Hyperactivité psychomotrice, troubles du sommeil, anxiété, dépression, agressivité, troubles du comportement (principalement chez l’enfant) |
Fréquence inconnue |
|
Troubles oculaires |
Vision floue (voir rubrique 4.4) |
Fréquence inconnue |
|
Troubles du système nerveux |
Tremblement |
Fréquent |
|
Céphalée |
Peu fréquent |
|
|
Troubles cardiaques |
Tachycardie |
Peu fréquent |
|
Bradycardie sinusale |
Peu fréquent |
|
|
Angor |
Peu fréquent |
|
|
Ischémie myocardique |
Peu fréquent |
|
|
Troubles respiratoires, thoraciques et médiastinaux |
Irritation de la gorge, crise d’asthme |
Peu fréquent |
|
Dyspnée |
Peu fréquent |
|
|
Douleur oropharyngée |
Peu fréquent |
|
|
Dysphonie |
Peu fréquent |
|
|
Toux |
Peu fréquent |
|
|
Troubles gastro-intestinaux |
Nausée |
Peu fréquent |
|
Troubles généraux et anomalies au site d'administration |
Fatigue |
Peu fréquent |
|
Irritabilité |
Peu fréquent |
|
|
Investigations |
Allongement de l’espace QT à l’électrocardiogramme |
Peu fréquent |
|
Diminution du cortisol libre urinaire |
Peu fréquent |
|
|
Diminution du cortisol sanguin |
Peu fréquent |
|
|
Augmentation de la kaliémie |
Peu fréquent |
|
|
Augmentation de la glycémie |
Peu fréquent |
|
|
Diminution de la progression de l’onde R à l’électrocardiogramme |
Peu fréquent |
Les effets spécifiques du formotérol sont les suivants : tremblements, céphalées, tachycardie, bradycardie sinusale, angor, ischémie myocardique et allongement de l'intervalle QTc.
Les effets indésirables spécifiques du dipropionate de béclométasone sont les suivants: rhinopharyngite, candidose orale, dysphonie, irritation de la gorge, irritabilité, diminution du cortisol libre urinaire, diminution du cortisol sanguin, augmentation de la glycémie.
Les effets indésirables non rapportés au cours des essais cliniques conduits avec INNOVAIR NEXTHALER, mais communément observés lors de l’administration par inhalation de dipropionate de béclométasone sont les mycoses buccales et les pneumonies. Des troubles du goût ont occasionnellement été rapportés lors des traitements par corticostéroïdes inhalés.
Voir rubrique 4.4 pour les mesures visant à prévenir le risque de survenue d’infections buccales fongiques, de candidose orale et de dysphonie.
Les corticoïdes par voie inhalée (par exemple le dipropionate de béclométasone) peuvent avoir des effets systémiques, notamment en cas d'utilisation prolongée de doses fortes : syndrome de Cushing, symptômes cushingoïdes, freination surrénalienne, diminution de la densité minérale osseuse, retard de croissance chez l'enfant et l'adolescent, cataracte et glaucome peuvent être observés (voir aussi rubrique 4.4).
Les effets indésirables non rapportés lors des essais cliniques conduits avec INNOVAIR NEXTHALER, mais communément observés au cours de l’administration de bêta-2 agonistes tel que le formotérol sont les suivants : palpitations, fibrillation auriculaire, extrasystoles ventriculaires, tachyarythmie et hypokaliémie potentiellement grave et augmentation/diminution de la pression artérielle.
Des cas d’insomnie, de sensations vertigineuses, d’agitation et d’anxiété ont occasionnellement été rapportés au cours du traitement par le formotérol inhalé. Le formotérol peut également induire des crampes musculaires et des myalgies.
Des réactions d'hypersensibilité telles que rash, urticaire, prurit, érythème et œdème des yeux, du visage, des lèvres et de la gorge (angioedème) ont également été rapportées.
Comme avec les autres traitements par inhalation, un bronchospasme paradoxal peut survenir, se manifestant par une majoration des sibilants bronchiques, de la toux et une dyspnée survenant immédiatement après l’administration de la dose (voir également rubrique 4.4).
Population pédiatrique
Aucune information n’est disponible sur la sécurité d’emploi de INNOVAIR NEXTHALER chez les enfants âgés de moins de 12 ans. Les données chez les adolescents de 12 à 17 ans sont limitées. Au cours d’une étude clinique randomisée de 12 semaines menée chez des adultes et des adolescents, 162 adolescents âgés de 12 à 17 ans présentant un asthme modéré à sévère ont été traités par INNOVAIR NEXTHALER ou la formulation en solution pour inhalation en flacon pressurisé correspondante à la dose de 1 ou 2 inhalations 2 fois par jour. La fréquence, le type et la sévérité des effets indésirables n’ont pas été différents chez l’adolescent par rapport à l’adulte.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : www.signalement-sante.gouv.fr.
Avec la solution pour inhalation en flacon pressurisé, des doses cumulées allant jusqu'à 12 bouffées par voie inhalée (soit au total 1200 microgrammes de dipropionate de béclométasone et 72 microgrammes de formotérol) administrées lors d'études chez les asthmatiques n'ont pas révélé d'effets délétères sur les fonctions vitales et n'ont pas entrainé d'effets indésirables ni sévères ni graves.
Un surdosage en formotérol peut induire les effets spécifiques des agonistes bêta-2 adrénergiques : nausées, vomissements, céphalées, tremblement, somnolence, palpitations, tachycardie, arythmies ventriculaires, allongement de l'intervalle QTc, acidose métabolique, hypokaliémie, hyperglycémie.
En cas de surdosage en formotérol, la conduite à tenir est la surveillance des fonctions vitales et un traitement symptomatique. Les cas présentant des signes de gravité devront être hospitalisés. Le recours à des bêta-bloquants cardiosélectifs pourra être envisagé, mais avec une grande prudence compte tenu du risque de bronchospasme induit par les bêta-bloquants. Une surveillance de la kaliémie est requise.
Un surdosage aigu par inhalations de dipropionate de béclométasone supérieures aux doses recommandées peut provoquer une inhibition de la fonction surrénalienne. Il n'y a pas lieu d'entreprendre un traitement spécifique, le retour à la normale de la fonction surrénalienne étant obtenu spontanément en quelques jours comme en témoignent les dosages plasmatiques du cortisol. Le traitement devra être poursuivi aux doses adaptées pour le contrôle de l'asthme.
Le surdosage chronique en dipropionate de béclométasone inhalé expose au risque d'inhibition des fonctions surrénaliennes (voir rubrique 4.4). Une surveillance des fonctions surrénaliennes peut être nécessaire. Le traitement devra être poursuivi à la dose adaptée pour le contrôle de l'asthme.
Des doses uniques supérieures aux doses thérapeutiques jusqu’à 800 microgrammes de dipropionate de béclométasone et 48 microgrammes de formotérol, administré par INNOVAIR NEXTHALER sont en général sans risque et bien tolérées.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Mécanisme d’action et effets pharmacodynamiques
INNOVAIR NEXTHALER contient du dipropionate de béclométasone et du formotérol sous forme de poudre, délivrés en un aérosol extrafin avec un diamètre aérodynamique médian en masse (MMAD) compris entre 1,4 à 1,5 µm et un dépôt simultané des deux composants. La taille des particules d’aérosol de INNOVAIR NEXTHALER est en moyenne beaucoup plus petite que celle des particules délivrées par les formulations non extrafines.
Une étude avec produit radiomarqué réalisée chez des adultes asthmatiques a montré une déposition pulmonaire homogène de l’ordre de 42 % de la dose nominale. Les caractéristiques du produit délivré permettent l’utilisation d’une faible dose de corticostéroïde exerçant principalement des effets pharmacodynamiques locaux, équivalents à ceux de la solution pour inhalation pressurisée correspondante (voir « Données cliniques »).
INNOVAIR NEXTHALER contient du dipropionate de béclométasone et du formotérol, principes actifs dont les mécanismes d'action sont différents. Comme avec les autres médicaments par voie inhalée associant un corticoïde et un agoniste bêta-2, les effets additifs des deux principes actifs sont observés en termes de réduction des exacerbations d'asthme.
Dipropionate de béclométasone
Aux doses recommandées, le dipropionate de béclométasone inhalé exerce un effet anti-inflammatoire glucocorticoïde au niveau pulmonaire, ayant pour effet la réduction des symptômes et exacerbations de l'asthme avec des effets indésirables moindres qu'avec les corticoïdes par voie systémique.
Formotérol
Le formotérol est un agoniste bêta-2adrénergique sélectif qui induit une relaxation des muscles lisses bronchiques en cas de bronchoconstriction réversible. L'effet bronchodilatateur apparaît rapidement, en l'espace de 1 à 3 minutes après l'inhalation, et il persiste 12 heures après l'inhalation d'une dose unique.
Efficacité et sécurité clinique
L’efficacité des deux composants de INNOVAIR NEXTHALER, poudre pour inhalation a été évaluée avec le plus faible dosage au cours de trois études distinctes en comparaison à la formulation en solution pour inhalation pressurisée à 100 µg/6 µg chez des patients présentant un asthme persistant modéré à sévère. Dans leur ensemble, les résultats sont en faveur d’une équivalence d’efficacité entre les 2 inhalateurs pour les doses de 1 et 2 inhalations deux fois par jour.
Une première étude avait pour objectif principal l’évaluation de l’efficacité du corticoïde inhalé sur la bronchodilatation (VEMS pré-dose). Une amélioration cliniquement significative du VEMS pré-dose a été observée par rapport à l’inclusion après une période de traitement de trois mois avec 1 inhalation 2 fois par jour et 2 inhalations 2 fois par jour des deux formulations, dans la population des 696 patients présentant un asthme modéré à sévère. L’augmentation moyenne observée était d’au moins 250 ml. Aux doses étudiées Il n’a pas été mis en évidence de différence cliniquement significative sur le VEMS pré-dose entre INNOVAIR NEXTHALER, poudre pour inhalation et INNOVAIR solution pour inhalation en flacon pressurisé. Une relation dose-effet significative a été observée pour le débit expiratoire de pointe (DEP) matinal. La relation dose-effet n’a pas atteint le seuil statistique de significativité pour le VEMS pré-dose. Le contrôle de l’asthme, mesuré par les scores des symptômes matinaux et vespéraux et le pourcentage de jours sans symptômes, était significativement amélioré entre le début et la fin de la période de traitement, notamment avec les deux doses élevées, avec chacune des formulations.
Une seconde étude avait pour objectif principal l’évaluation de l’efficacité du bêta2-agoniste de longue durée d’action de INNOVAIR NEXTHALER. Dans cette étude, l’effet bronchodilatateur a été évalué jusqu’à 12 heures après l’administration de doses uniques, par des mesures successives du VEMS (calcul de l’aire sous la courbe (ASC) du VEMS sur une période couvrant au moins 80 % de la durée d’action du formotérol). L’administration de 1 inhalation et de 4 inhalations des deux substances actives ont significativement amélioré l’ASC0-12 du VEMS comparativement au placebo.
La non-infériorité a été établie pour INNOVAIR NEXTHALER, poudre pour inhalation par rapport à la formulation en solution pour inhalation en flacon pressurisé pour chacune des doses étudiées. La relation dose-effet était statistiquement significative pour les deux formulations entre les doses faibles et élevées.
Dans une troisième étude, après une période avant inclusion de quatre semaines au cours de laquelle l’association fixe de dipropionate de béclométasone et de formotérol en solution pour inhalation en flacon pressurisé a été administrée à la dose de 1 inhalation 2 fois par jour, 755 patients asthmatiques contrôlés ont été randomisés pour recevoir un traitement de 8 semaines avec la même solution pour inhalation en flacon pressurisé, avec INNOVAIR NEXTHALER poudre pour inhalation ou avec du dipropionate de béclométasone 100 µg par dose poudre pour inhalation. Tous les traitements étaient administrés à la dose d’une inhalation deux fois par jour. L’objectif principal était l'évaluation du changement du débit expiratoire de pointe (DEP) matinal moyen entre les valeurs initiales et l’ensemble de la période de traitement. Après 8 semaines de traitement, il n’a pas été mis en évidence de différence sur le critère principal entre les deux inhalateurs contenant les associations médicamenteuses, les deux ayant été significativement plus efficaces que le dipropionate de béclométasone en monothérapie. Aucune différence n’a été observée entre les deux inhalateurs contenant les associations pour ce qui concerne les mesures relatives aux symptômes d'asthme, notamment le score des symptômes évalué par un questionnaire du contrôle de l’asthme et le nombre de jours sans traitement bronchodilatateur utilisé pour traiter les symptômes de l’asthme.
Une étude en ouvert contre placebo a été effectuée afin de vérifier que le débit inspiratoire pouvant être généré au travers de l’inhalateur Nexthaler n’était pas influencé par l’âge du patient, ni par la pathologie ou par sa sévérité, et que ce dispositif permettait donc la libération du médicament chez tout type de patient. Le critère principal a été le pourcentage de patients de chaque tranche d’âge et de chaque groupe de pathologie capables d’activer l’inhalateur. Quatre-vingt-neuf patients, âgés de 5 à 84 ans, incluant des patients présentant un asthme modéré et sévère (respectivement VEMS > 60 % et ≤ 60 % des valeurs théoriques), et des patients présentant une bronchopneumopathies chroniques obstructives (BPCO) modérées et sévères (respectivement VEMS ≥ 50 % et < 50 % des valeurs théoriques) étaient inclus dans l’étude. Tous les patients étudiés, quel que soient leur âge, leur maladie et la sévérité de la maladie, ont été en mesure de générer un débit inspiratoire suffisant pour activer l’inhalateur Nexthaler.
Une étude complémentaire menée en ouvert contre placebo afin d'évaluer le débit inspiratoire généré au travers de la spécialité INNOVAIR NEXTHALER a montré que des patients présentant une BPCO légère à sévère étaient en mesure d’utiliser efficacement le dispositif quel que soit leur état fonctionnel respiratoire.
Population pédiatrique
L’Agence Européenne du Médicament (EMA) a différé l’obligation de soumettre les résultats d’études dans l’asthme avec INNOVAIR NEXTHALER pour les tranches d’âge pédiatriques de 5 à 11 ans et de 12 à 17 ans.
A ce jour, aucune expérience clinique sur INNOVAIR NEXTHALER n’est disponible chez les enfants âgés de 5 à 11 ans, et les données disponibles chez des adolescents âgés de 12 à 17 ans sont limitées.
Au cours d’une étude clinique randomisée de 3 mois, 162 adolescents âgés de 12 à 17 ans atteints d’un asthme modéré à sévère ont reçu soit INNOVAIR NEXTHALER soit la formulation en solution pour inhalation pressurisée correspondante, à la dose de 1 ou 2 inhalations deux fois par jour. La variation du VEMS pré-dose mesurée à la fin du traitement a été supérieure chez les adolescents par rapport aux adultes.
Voir également les rubriques 4.2 et 4.8 pour des informations sur l’utilisation pédiatrique.
5.2. Propriétés pharmacocinétiques
Le dipropionate de béclométasone est une pro-drogue dotée d'une faible affinité de fixation aux récepteurs des glucocorticoïdes et qui est hydrolysée par des enzymes (estérases), donnant naissance à un métabolite actif, le 17-monopropionate de béclométasone, dont l'activité anti-inflammatoire topique est plus intense que celle de la pro-drogue dipropionate de béclométasone.
Absorption, distribution et métabolisme
Après inhalation, le dipropionate de béclométasone est rapidement absorbé par les poumons. Avant l'absorption, il est largement transformé en son métabolite actif, le 17-monopropionate de béclométasone, par des estérases présentes dans la plupart des tissus. La disponibilité systémique du métabolite actif est liée à l'absorption pulmonaire et à l'absorption gastro-intestinale de la fraction déglutie. La biodisponibilité du dipropionate de béclométasone dégluti est négligeable. Cependant, en raison de sa transformation pré-systémique en 17-monopropionate de béclométasone, une partie de la dose absorbée est sous forme de métabolite actif.
L'exposition systémique augmente de façon à peu près linéaire avec la dose inhalée.
Après inhalation de la solution en flacon pressurisé, la biodisponibilité absolue est d'environ 2 % de la dose nominale pour le dipropionate de béclométasone inchangé et 62 % pour le 17-monopropionate de béclométasone.
Après administration intraveineuse, la pharmacocinétique du dipropionate de béclométasone et de son métabolite actif se caractérise par une clairance plasmatique élevée (150 et 120 litres/heure respectivement), avec un volume de distribution à l'état d'équilibre faible pour le dipropionate de béclométasone (20 litres) et une distribution tissulaire plus importante pour son métabolite actif (424 litres).
Le dipropionate de béclométasone est métabolisé principalement (82 %) en son métabolite actif, le 17-monopropionate de béclométasone.
Le taux de liaison aux protéines plasmatiques est modéré (87%).
Elimination
Le dipropionate de béclométasone est essentiellement excrété par voie fécale, principalement sous la forme de métabolites polaires. L'excrétion rénale du dipropionate de béclométasone et de ses métabolites est négligeable. La demi-vie d'élimination terminale est de 0,5 heure pour le dipropionate de béclométasone et de 2,7 heures pour le 17-monopropionate de béclométasone.
Populations particulières
La pharmacocinétique du dipropionate de béclométasone n'a pas été étudiée chez des patients présentant une insuffisance rénale ou hépatique.
Compte tenu de la métabolisation très rapide du dipropionate de béclométasone en des métabolites polarisés (21-monopropionate de béclométasone, 17-monopropionate de béclométasone et béclométasone) par les estérases intestinales, plasmatiques, pulmonaires et hépatiques la modification de la pharmacocinétique et du profil de tolérance du dipropionate de béclométasone en cas d’insuffisance hépatique est peu probable.
Le dipropionate de béclométasone et ses métabolites n'ont pas été retrouvés dans les urines. Par conséquent, l’augmentation de l'exposition systémique en cas d'insuffisance rénale est peu probable.
Formotérol
Absorption et distribution
Après inhalation, le formotérol est absorbé à la fois par les poumons et par le tractus gastro-intestinal. La fraction de la dose inhalée qui est déglutie après administration à l'aide d'un aérosol-doseur est comprise entre 60 % et 90 %. Au moins 65 % de la fraction déglutie sont absorbés par le tractus gastro-intestinal. Les concentrations plasmatiques maximales du principe actif inchangé sont atteintes en l'espace de 0,5 à 1 heure après administration orale. Le taux de liaison du formotérol aux protéines plasmatiques est de 61 à 64 %, avec 34 % de liaison à l'albumine. Dans l'intervalle des concentrations atteintes aux doses thérapeutiques, il n'a pas été observé de saturation de la liaison. Après administration orale, la demi-vie d'élimination est de 2 à 3 heures. L'absorption du formotérol est linéaire après l'inhalation de 12 à 96 µg de fumarate de formotérol.
Métabolisme
Le formotérol est largement métabolisé et la voie de transformation métabolique consiste essentiellement en une conjugaison directe au niveau du groupe hydroxyle phénolique. Le conjugué d'acide glucuronique est inactif. La deuxième voie métabolique essentielle consiste en une O-déméthylation suivie d'une conjugaison au niveau du groupement phénolique 2'-hydroxyle. Les iso-enzymes CYP2D6, CYP2C19 et CYP2C9 du cytochrome P450 interviennent dans la O-déméthylation du formotérol. La transformation métabolique semble se dérouler essentiellement dans le foie. Aux concentrations thérapeutiques, le formotérol n'induit pas d'inhibition des iso-enzymes du CYP450.
Elimination
L'excrétion urinaire du formotérol après une inhalation unique à partir d'un inhalateur de poudre sèche augmente de façon linéaire dans l'intervalle des doses allant de 12 à 96 µg. En moyenne, 8 % et 25 % de la dose sont excrétés respectivement sous forme inchangée et sous forme de formotérol total. Au vu des concentrations plasmatiques enregistrées après l'inhalation d'une dose unique de 120 µg chez 12 sujets sains, la demi-vie d'élimination terminale est en moyenne de 10 heures. Les énantiomères (R,R) et (S,S) représentent respectivement environ 40 % et 60 % du médicament inchangé excrété dans les urines. La proportion relative des deux énantiomères reste constante dans l'intervalle des doses étudiées sans mise en évidence d'une accumulation de l'un des énantiomères après administration répétée.
Après administration orale (40 à 80 µg) chez des sujets sains, 6 % à 10 % de la dose ont été retrouvés dans les urines sous forme inchangée et jusqu'à 8 % de la dose étaient retrouvés sous la forme du glucuronide.
Au total, 67% d'une dose orale de formotérol sont excrétés dans les urines (essentiellement sous forme métabolisée) et le reste est excrété dans les selles. La clairance rénale du formotérol est de 150 ml/min.
Populations particulières
Insuffisance hépatique/rénale : la pharmacocinétique du formotérol n'a pas été étudiée chez des patients présentant une insuffisance hépatique ou rénale.
Données cliniques
L’exposition systémique du dipropionate de béclométasone et du formotérol administrés en association a été comparée à chacun des composants administrés individuellement. Aucun élément n’indique l’existence d’interactions pharmacocinétiques ou pharmacodynamiques (systémiques) entre le dipropionate de béclométasone et le formotérol.
Les propriétés pharmacocinétiques d’INNOVAIR NEXTHALER poudre pour inhalation ont été comparées à celles de la formulation en solution pour inhalation pressurisée. L’analyse du composant corticostéroïde a été réalisée par la mesure du 17-monopropionate de béclométasone, le principal métabolite actif du dipropionate de béclométasone.
L'absorption systémique et le métabolisme du dipropionate de béclométasone ont été rapides et la concentration maximale (Cmax) a été atteinte en 5 minutes après administration de la dose pour les deux traitements. La Cmax était plus élevée (+ 68%) avec INNOVAIR NEXTHALER poudre pour inhalation. L’ASCt était environ 3 fois plus élevée après l'inhalation d’INNOVAIR NEXTHALER par rapport à la solution pour inhalation en flacon pressurisé. La Cmax du 17-monopropionate de béclométasone, le principal métabolite actif, représentant environ 82% des concentrations sanguines totale, a été atteinte en moyenne après 30 min avec INNOVAIR NEXTHALER et 15 min avec la solution pour inhalation en flacon pressurisé. La concentration plasmatique en 17-monopropionate de béclométasone était plus faible (Cmax -49% et ASCt - 29%), après l'inhalation de la poudre pour inhalation par rapport à la solution pour inhalation en flacon pressurisé. Après inhalation d’INNOVAIR NEXTHALER, la concentration maximale (Cmax) de formotérol a été atteinte dans les 5 minutes et a été plus élevée (+ 47%) avec la poudre pour inhalation, alors que l'exposition totale (ASCt) était comparable pour les deux traitements.
Dans une étude, la biodisponibilité systémique pulmonaire a été étudiée en présence de charbon actif afin d’exclure l’absorption du médicament par le tractus gastro-intestinal, et en utilisant la chambre d’inhalation AeroChamber Plus pour le produit de référence (solution pour inhalation pressurisée). Dans cette étude, l'équivalence était observée entre l’inhalateur NEXTHALER et la solution pour inhalation pressurisée en termes de l’ASCt du 17-monopropionate de béclométasone et du formotérol (le rapport poudre pour inhalation/solution pour inhalation pressurisée et les intervalles de confiance à 90 % étaient inclus dans l’intervalle 80-125 %). Cependant la Cmax du 17-monopropionate de béclométasone était plus faible (-38 %) avec le NEXTHALER.
5.3. Données de sécurité préclinique
Les études menées chez le rat pour étudier la toxicité sur la reproduction ont montré des effets dose-dépendants. La présence de doses élevées de dipropionate de béclométasone a été associée à une réduction de la fertilité chez les femelles, à une diminution du nombre d’implantations et à une toxicité embryofœtale. L’effet des doses fortes de corticoïdes chez les animaux gravides provoquant des anomalies du développement fœtal, notamment des fentes palatines et un retard de croissance intra-utérin est connu et les effets constatés avec l'association dipropionate de béclométasone/formotérol étaient donc probablement imputables au dipropionate de béclométasone. Ces effets n'ont été observés qu'avec de fortes expositions systémiques du métabolite actif, le 17-monopropionate de béclométasone (200 fois les taux plasmatiques prévus en clinique). Les études animales ont en outre montré un allongement de la durée de la gestation et de la parturition, s’expliquant par les effets tocolytiques bien connus des β2-sympathomimétiques. Ces effets ont été constatés à des concentrations plasmatiques maternelles de formotérol inférieurs à celle attendues chez les patients traités par INNOVAIR NEXTHALER.
Les études de génotoxicité menées avec l'association dipropionate de béclométasone/formotérol n'indiquent pas de potentiel mutagène. Aucune étude de carcinogénicité n'a été menée avec l'association considérée. Cependant, les données obtenues chez l'animal avec chacun des principes actifs de l'association ne suggèrent aucun risque carcinogène chez l'Homme.
Lactose monohydraté (contient de petites quantités de protéines de lait), stéarate de magnésium.
3 ans.
Après la première ouverture du sachet, le médicament doit être utilisé dans un délai de six mois.
6.4. Précautions particulières de conservation
À conserver dans l’emballage extérieur d’origine, à l’abri de l’humidité.
Ne retirer l’inhalateur de son sachet qu’immédiatement avant la première utilisation.
Avant la première ouverture du sachet :
Pas de précautions particulières de conservation concernant la température.
Après la première ouverture du sachet :
À conserver à une température ne dépassant pas 25°C.
6.5. Nature et contenu de l'emballage extérieur
Chaque boîte contient 1, 2 ou 3 inhalateurs NEXTHALER, qui contiennent chacun 1, 50 g ou 2, 22 g de poudre pour inhalation permettant de délivrer 120 inhalations ou 180 inhalations respectivement. Chaque inhalateur est conditionné dans un sachet protecteur thermoscellé en polyéthylène téréphtalate / aluminium / polyéthylène (PET/Aluminium/PE).
Toutes les présentations peuvent ne pas être commercialisées.
INNOVAIR NEXTHALER est un dispositif d’inhalation multidoses. Le dispositif est composé d’un boîtier constitué d’une coque inférieure munie d’une fenêtre affichant le nombre de doses restantes et d’un couvercle intégral. Après ouverture, le couvercle, qui contrôle également le mécanisme de décompte des doses, libère un embout buccal au travers duquel le médicament est inhalé. La coque inférieure et l’embout buccal sont constitués d’acrylonitrile butadiène styrène et le couvercle de polypropylène.
6.6. Précautions particulières d’élimination et de manipulation
Tout produit non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
17, AVENUE DE L’EUROPE
92270 BOIS-COLOMBES
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 302 062 3 2 : 3 inhalateur(s) multidose(s) acrylonitrile butadiène styrène de 120 dose(s).Chaque inhalateur est conditionné dans un sachet.
· 34009 302 062 4 9 : 2 inhalateur(s) multidose(s) acrylonitrile butadiène styrène de 180 dose(s).Chaque inhalateur est conditionné dans un sachet.
· 34009 302 062 5 6 : 3 inhalateur(s) multidose(s) acrylonitrile butadiène styrène de 180 dose(s).Chaque inhalateur est conditionné dans un sachet.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Liste I.
ANSM - Mis à jour le : 04/08/2021
INNOVAIR NEXTHALER 100 microgrammes/6 microgrammes par inhalation, poudre pour inhalation
Dipropionate de béclométasone anhydre/ fumarate de formotérol dihydraté
Réservé à l’adulte
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin, votre pharmacien ou votre infirmier/ère.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, votre pharmacien ou votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que INNOVAIR NEXTHALER 100 microgrammes/6 microgrammes par inhalation, poudre pour inhalation et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d'utiliser INNOVAIR NEXTHALER 100 microgrammes/6 microgrammes par inhalation, poudre pour inhalation ?
3. Comment utiliser INNOVAIR NEXTHALER 100 microgrammes/6 microgrammes par inhalation, poudre pour inhalation ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver INNOVAIR NEXTHALER 100 microgrammes/6 microgrammes par inhalation, poudre pour inhalation ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE INNOVAIR NEXTHALER 100 microgrammes/6 microgrammes par inhalation, poudre pour inhalation ET DANS QUELS CAS EST-IL UTILISE ?
Le dipropionate de béclométasone appartient à un groupe de médicaments dénommés corticosteroïdes qui ont une action anti-inflammatoire. Ils réduisent le gonflement et l’irritation dans vos poumons.
Le fumarate de formotérol dihydraté appartient à un groupe de médicaments appelés « bronchodilatateurs de longue durée d'action ». Les bronchodilatateurs provoquent un relâchement des muscles qui entourent les voies respiratoires et donc, un élargissement de leur calibre, ce qui facilite l'inspiration et l'expiration de l'air.
Ces deux substances actives facilitent la respiration en soulageant les symptômes tels que l'essoufflement, le sifflement respiratoire et la toux chez les patients asthmatiques ou présentant une bronchopneumopathie chronique obstructive (BPCO). Elles contribuent également à prévenir la survenue des symptômes de l’asthme.
Asthme
INNOVAIR NEXTHALER est utilisé pour traiter l’asthme chez l’adulte.
Si votre médecin vous a prescrit INNOVAIR NEXTHALER, vous êtes probablement dans l’une des deux situations suivantes :
· votre asthme n'est pas correctement contrôlé par des corticoïdes inhalés et des bronchodilatateurs de courte durée d'action utilisés «à la demande ».
ou
· votre asthme répond bien au traitement associant des corticoïdes et des bronchodilatateurs de longue durée d'action.
BPCO
INNOVAIR NEXTHALER est également préconisé pour le traitement symptomatique de la bronchopneumopathie chronique obstructive (BPCO) sévère chez l'adulte. La BPCO est une maladie chronique des poumons causée, le plus souvent, par le tabagisme.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER INNOVAIR NEXTHALER 100 microgrammes/6 microgrammes par inhalation, poudre pour inhalation ?
Avertissements et précautions
Adressez-vous à votre médecin ou pharmacien avant d’utiliser INNOVAIR NEXTHALER 100 microgrammes/6 microgrammes par inhalation, poudre pour inhalation.
Consultez votre médecin avant l’utilisation d’INNOVAIR NEXTHALER
· si vous avez :
o des troubles cardiaques ou de la fonction cardiaque
o des troubles du rythme cardiaque tels qu'accélération ou irrégularité des battements cardiaques, pouls rapide ou palpitations ou si vous savez que votre électrocardiogramme est anormal
o une hypertension artérielle
o un rétrécissement des artères (du fait d'une artériosclérose), ou si vous savez que vous avez un anévrisme (dilatation anormale de la paroi d'un vaisseau sanguin)
o une hyperactivité de votre glande thyroïde
o des taux sanguins de potassium faibles
o une maladie du foie ou des reins
o un diabète : si vous inhalez de fortes doses de formotérol votre taux sanguin de glucose risque d'augmenter et il peut donc être nécessaire de vérifier votre glycémie en début de traitement puis de façon rapprochée pendant le traitement
o un phéochromocytome (tumeur de la glande surrénale)
· si une anesthésie est prévue : suivant le type d'anesthésique, il peut être nécessaire d'arrêter l'utilisation de INNOVAIR NEXTHALER au moins 12 heures avant l'anesthésie.
· si vous êtes actuellement traité(e) ou avez déjà été traité(e) un jour pour une tuberculose ou si vous présentez une infection pulmonaire virale ou fongique connue.
Si vous êtes dans l'une des situations ci-dessus parlez-en à votre médecin avant d'utiliser INNOVAIR NEXTHALER.
Si vous n'êtes pas certain de savoir comment utiliser INNOVAIR NEXTHALER, consultez votre médecin, une infirmière connaissant l'asthme ou votre pharmacien, avant d'utiliser l'inhalateur.
Votre médecin pourra mesurer les concentrations de potassium dans le sang occasionnellement, en particulier si votre asthme est sévère. Comme de nombreux bronchodilatateurs, INNOVAIR NEXTHALER peut provoquer une diminution brutale de la concentration sanguine en potassium (hypokaliémie). Ce phénomène est dû au fait qu’un manque d’oxygène dans le sang associé à certains autres traitements que vous pourriez prendre simultanément à INNOVAIR NEXTHALER pourraient aggraver une diminution du taux de potassium.
Si vous utilisez des doses fortes de corticoïdes inhalés pendant une durée prolongée, il se peut que vous ayez besoin d'une plus grande quantité de corticoïdes en cas de stress. Les situations de stress consistent par exemple en une hospitalisation après un accident, un traumatisme grave ou intervention chirurgicale. Dans une telle situation, votre médecin traitant déterminera si vous avez besoin d'augmenter votre dose de corticoïdes et vous prescrira au besoin des comprimés ou des injections de corticoïdes.
Si vous devez aller à l'hôpital, n'oubliez pas d'emporter tous vos médicaments et inhalateurs, y compris INNOVAIR NEXTHALER et les médicaments ou comprimés achetés sans ordonnance, dans leur emballage d'origine, si possible.
Contactez votre médecin en cas de vision floue ou d’autres troubles visuels.
Enfants et adolescents
Ne pas administrer ce médicament aux enfants et aux adolescents âgés de moins de 18 ans.
Autres médicaments et INNOVAIR NEXTHALER 100 microgrammes/6 microgrammes par inhalation, poudre pour inhalation
Informez votre médecin ou pharmacien si vous utilisez, avez récemment utilisé ou pourriez utiliser tout autre médicament.
Cette précaution est prise, car INNOVAIR NEXTHALER peut affecter la manière dont réagissent certains autres médicaments. De même, certains médicaments peuvent affecter la manière dont INNOVAIR NEXTHALER agit.
Informez notamment votre médecin ou pharmacien si vous utilisez l’un des médicaments suivants :
· Certains médicaments peuvent augmenter les effets de INNOVAIR NEXTHALER et il est possible que votre médecin considère qu'une surveillance du traitement est nécessaire si vous prenez ces médicaments (incluant certains médicaments pour traiter l’infection à VIH : ritonavir, cobicistat).
· Les médicaments bêta-bloquants. Les bêta-bloquants sont des médicaments utilisés pour traiter de nombreuses affections, notamment les problèmes cardiaques, l’augmentation de la pression artérielle ou le glaucome (augmentation de la pression dans les yeux). Si vous avez besoin d'un traitement bêta-bloquant (y compris sous forme de collyre), l'effet du formotérol risque d'être affaibli, voire totalement neutralisé.
· Les médicaments bêta-adrénergiques (médicaments agissant de la même manière que le formotérol) peuvent augmenter les effets du formotérol.
· Les médicaments utilisés pour le traitement des anomalies du rythme cardiaque (quinidine, disopyramide, procaïnamide).
· Les médicaments utilisés pour le traitement des réactions allergiques (des antihistaminiques tels que la terfénadine).
· Les médicaments utilisés pour le traitement de la dépression ou des troubles psychiques tels que les inhibiteurs de la monoamine oxydase (par exemple phénelzine et isocarboxazide) ou les antidépresseurs tricycliques (par exemple amitryptiline et imipramine) ou les phénothiazines.
· Les médicaments utilisés pour le traitement de la maladie de Parkinson (L-dopa).
· Les médicaments utilisés pour le traitement de l’insuffisance thyroïdienne (L-thyroxine).
· Les médicaments contenant de l’ocytocine (laquelle provoque des contractions utérines).
· Les médicaments utilisés pour le traitement des troubles psychiques tels que les inhibiteurs de la monoamine-oxydase (IMAO), y compris les médicaments dotés de propriétés similaires comme la furazolidone et la procarbazine.
· Les médicaments utilisés pour le traitement des maladies cardiaques (digoxine).
· Autres médicaments utilisés pour le traitement de l'asthme (théophylline, aminophylline ou corticoïdes).
· Diurétiques (comprimés destinés à augmenter l'élimination d'eau).
Prévenez également votre médecin ou pharmacien si vous devez subir une anesthésie générale pour une opération ou des soins dentaires.
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou si vous envisagez une grossesse, demandez conseil à votre médecin avant de prendre ce médicament.
Il n’y a pas de données cliniques concernant l’utilisation d’INNOVAIR NEXTHALER pendant la grossesse.
Si vous pensez être enceinte ou si vous envisagez une grossesse, veuillez consulter votre médecin. Vous ne devez utiliser INNOVAIR NEXTHALER au cours de la grossesse que si ce traitement vous a été prescrit par votre médecin. Votre médecin décidera si vous devez interrompre votre traitement par INNOVAIR NEXTHALER au cours de l’allaitement ou si vous devez continuer à prendre INNOVAIR NEXTHALER mais ne pas allaiter.
Demandez conseil à votre médecin ou à votre pharmacien avant de prendre tout médicament.
Conduite de véhicules et utilisation de machines
Il est peu probable qu’INNOVAIR NEXTHALER perturbe votre aptitude à conduire et à utiliser des machines. Cependant, si vous présentez des effets indésirables, notamment vertiges et/ou tremblements, votre aptitude à conduire des véhicules ou à utiliser des machines peut en être affectée.
INNOVAIR NEXTHALER 100 microgrammes/6 microgrammes par inhalation, poudre pour inhalation contient du lactose.
Le lactose contient de petites quantités de protéines du lait, qui peuvent provoquer des réactions chez les patients allergiques. Si votre médecin vous a informé(e) d’une intolérance à certains sucres, contactez-le avant de prendre ce médicament.
3. COMMENT UTILISER INNOVAIR NEXTHALER 100 microgrammes/6 microgrammes par inhalation, poudre pour inhalation ?
INNOVAIR NEXTHALER délivre un aérosol extrafin qui permet d’administrer dans vos poumons un pourcentage supérieur de chaque dose. Votre médecin pourra par conséquent vous prescrire une dose de ce médicament inférieure par rapport à vos précédents traitements par inhalation.
Asthme
Votre médecin effectuera régulièrement un bilan pour vérifier que votre traitement avec INNOVAIR NEXTHALER correspond à la dose optimale. Lorsque votre asthme sera bien contrôlé, votre médecin pourra envisager le cas échéant de diminuer progressivement la dose d’INNOVAIR NEXTHALER. Vous ne devez en aucun cas modifier la dose sans prendre avis auprès de votre médecin.
INNOVAIR NEXTHALER peut être prescrit par votre médecin selon deux schémas posologiques :
a) INNOVAIR NEXTHALER peut vous être prescrit quotidiennement pour traiter votre asthme avec, si besoin, un inhalateur de secours séparé pour soulager l’aggravation soudaine des symptômes d’asthme tels que : essoufflements, sifflements et toux
b) INNOVAIR NEXTHALER peut vous être prescrit quotidiennement pour traiter votre asthme et aussi, si besoin, pour soulager l’aggravation soudaine des symptômes de votre asthme tels que : essoufflements, sifflements et toux.
a) Utilisation de INNOVAIR NEXTHALER avec un inhalateur de secours séparé :
Adultes et patients âgés :
La dose recommandée de ce médicament est de 1 ou 2 inhalations 2 fois par jour.
La dose quotidienne maximale est de 4 inhalations.
N'oubliez pas que vous devez toujours avoir sur vous votre inhalateur de secours contenant un bronchodilatateur à effet rapide pour traiter une éventuelle aggravation brutale des symptômes respiratoires ou une crise d'asthme.
b) Utilisation de INNOVAIR NEXTHALER comme inhalateur unique :
Adultes et patients âgés :
La dose recommandée est de 1 inhalation le matin et 1 inhalation le soir.
Vous pouvez également utiliser INNOVAIR NEXTHALER comme inhalateur de secours en cas d’apparition de symptômes aigus d’asthme.
En cas de symptômes d’asthme, prenez une inhalation et attendez quelques minutes.
Si vous ne sentez pas d’amélioration, prenez une autre inhalation.
Ne prenez pas plus de 6 inhalations de secours par jour.
La dose journalière maximale de INNOVAIR NEXTHALER est de 8 inhalations.
Si vous sentez que vous avez besoin de prendre plus d’inhalations chaque jour pour contrôler vos symptômes d’asthme, contactez votre médecin pour lui demander conseil. Il se peut qu’il soit amené à changer votre traitement.
N'augmentez pas la dose.
Si vous avez l'impression que le médicament n'est pas très efficace, parlez-en toujours à votre médecin avant d'augmenter la dose.
Bronchopneumopathie chronique obstructive (BPCO)
Adultes et patients âgés :
La dose recommandée est de 2 inhalations le matin et 2 inhalations le soir.
Comment utiliser INNOVAIR NEXTHALER :
INNOVAIR NEXTHALER 100 microgrammes/6 microgrammes par inhalation, poudre pour inhalation ne doit être administré que par inhalation.
Si cela est possible, maintenez-vous debout ou assis en position verticale pendant l’inhalation.
Si vous avez utilisé plus de INNOVAIR NEXTHALER 100 microgrammes/6 microgrammes par inhalation, poudre pour inhalation que vous n’auriez dû :
· Contactez votre médecin ou le service d’urgence le plus proche pour obtenir des conseils. Apportez votre médicament afin que les personnes sachent ce que vous avez pris ;
· Des effets indésirables peuvent survenir. Indiquez à votre médecin si vous présentez des symptômes inhabituels, car il pourra effectuer certains tests complémentaires ou décider si d’autres mesures thérapeutiques sont nécessaires.
Si vous oubliez d’utiliser INNOVAIR NEXTHALER 100 microgrammes/6 microgrammes par inhalation, poudre pour inhalation:
Utilisez le médicament dès que vous constatez cet oubli. Si l'heure de la prochaine prise est proche, vous pouvez attendre pour inhaler la dose suivante à l'heure prévue. Ne prenez pas de dose double pour compenser la dose que vous avez oublié de prendre.
Si vous arrêtez d’utiliser INNOVAIR NEXTHALER 100 microgrammes/6 microgrammes par inhalation, poudre pour inhalation :
Même si vous vous sentez mieux, ne réduisez pas la dose et n'arrêtez pas le traitement sans prendre l'avis de votre médecin.
Vous devez utiliser INNOVAIR NEXTHALER régulièrement comme vous l’a prescrit votre médecin, même quand vous n'avez pas de symptômes.
Si votre respiration n’évolue pas :
Si vos symptômes ne s’améliorent pas après l’inhalation de INNOVAIR NEXTHALER, il est possible que cela soit lié au fait que vous n’utilisiez pas votre inhalateur correctement. Par conséquent, vérifiez les instructions figurant ci-dessous pour une utilisation correcte et/ou contactez votre médecin pour qu’il vous indique comment utiliser correctement votre inhalateur.
Si votre asthme s’aggrave :
Si vos symptômes s’aggravent ou deviennent difficiles à contrôler (par exemple si vous êtes obligé(e) de recourir plus souvent que d’habitude à un inhalateur de secours séparé ou à INNOVAIR NEXTHALER utilisé en tant qu’inhalateur de secours) ou si votre inhalateur de secours ou INNOVAIR NEXTHALER n’améliore pas vos symptômes, vous devez continuer à utiliser INNOVAIR NEXTHALER, mais vous devez consulter votre médecin dès que possible. Votre médecin pourra changer la dose de INNOVAIR NEXTHALER ou vous prescrire un traitement supplémentaire ou un autre médicament.
Si vous avez d'autres questions sur l’utilisation de ce médicament, demandez plus d’informations à votre médecin ou pharmacien.
MODE D’EMPLOI DE L’INHALATEUR NEXTHALER
A. Ce conditionnement contient :
Pour des informations sur le contenu du conditionnement, voir rubrique 6.
Si le contenu du conditionnement ne correspond pas à celui décrit à la rubrique 6, retournez votre inhalateur à la personne qui vous l’a délivré, afin d’en obtenir un nouveau.
B. Mises en garde générales et précautions d’emploi
· Ne pas retirer l’inhalateur du sachet si vous n’avez pas l’intention de l’utiliser immédiatement.
· N’utilisez votre inhalateur que conformément à la prescription de votre médecin.
· Gardez le couvercle fermé jusqu’à ce que vous utilisiez votre inhalateur pour administrer une dose.
· Lorsque vous n’utilisez pas votre inhalateur, conservez-le dans un endroit propre et à l’abri de l’humidité.
· N’essayez pas de démonter votre inhalateur pour une raison quelconque.
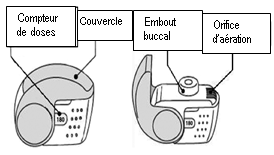
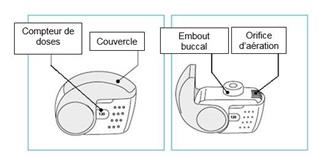 C. Principales caractéristiques de votre inhalateur NEXThaler
C. Principales caractéristiques de votre inhalateur NEXThaler
|
|
Administrer une dose avec votre inhalateur ne nécessite que trois étapes simples : Ouvrir, inhaler, fermer.
D. Avant d’utiliser un nouvel inhalateur
|
1. Ouvrez le sachet et sortez votre inhalateur |
· N’utilisez pas votre inhalateur si le sachet n’est pas scellé ou est endommagé – retournez-le à la personne qui vous l’a délivré afin d’en obtenir un nouveau.
· Utilisez l’étiquette sur la boite pour y inscrire la date à laquelle vous avez ouvert le sachet.
|
2. Inspectez votre inhalateur |
· Si votre inhalateur est cassé ou apparaît endommagé, retournez-le à la personne qui vous l’a délivré afin d’en obtenir un nouveau.
|
3. Vérifiez la fenêtre du compteur de doses. Si votre inhalateur est neuf, le nombre « 120 » ou « 180 » s’affichera dans la fenêtre du compteur de doses. |
· N’utilisez pas un nouvel inhalateur si le nombre affiché est inférieur à « 120 » ou «180 » – retournez-le à la personne qui vous l’a délivré afin d’en obtenir un nouveau.
|
|
E. Comment utiliser votre inhalateur NEXTHALER
· Si vous n’êtes pas sûr de prendre votre dose correctement, contactez votre pharmacien ou votre médecin.
· Si vous n’êtes pas sûr que le compteur de doses ait diminué après une inhalation, attendez la dose suivante et prenez-la conformément à votre prescription. Ne prenez pas de dose supplémentaire.
E.1. Ouvrir
1. Maintenez votre inhalateur fermement en position verticale.
2. Vérifier le nombre de doses restantes : tout chiffre compris entre « 1 » et « 120 » ou « 180 » montre que l’inhalateur contient des doses restantes.
· Si la fenêtre du compteur de doses affiche « 0 », il ne reste aucune dose - jetez votre inhalateur et obtenez-en un nouveau.
3. Ouvrez entièrement le couvercle.
|
|
4. Avant d’inhaler le médicament, expirez autant que vous le pouvez sans être gêné.
· N’expirez pas dans votre inhalateur.
E.2 Inhaler
Dans la mesure du possible, tenez-vous debout ou en position assise à la verticale lors de chaque inhalation.
1. Amenez votre inhalateur à votre bouche et placez vos lèvres autour de l’embout buccal.
· Ne recouvrez pas l’orifice d’aération en tenant votre inhalateur.
· N’inhalez pas le produit à travers l’orifice d’aération.
2. Inspirez rapidement et profondément par la bouche.
· Vous pourrez sentir un goût lorsque vous administrez votre dose.
· Vous pourrez entendre ou ressentir un déclic lorsque vous prenez votre dose.
o N’inhalez pas par le nez.
o Ne retirez pas votre inhalateur de vos lèvres au cours de l’inhalation.
|
|
3. Retirez votre inhalateur de votre bouche.
4. Retenez votre respiration pendant 5 à 10 secondes ou aussi longtemps que vous le pouvez sans être gêné.
5. Expirez lentement.
· N’expirez pas dans votre inhalateur.
E.3. Fermer
1. Replacez votre inhalateur en position verticale et fermez entièrement le couvercle.
2. Vérifiez que le compteur de doses a reculé d’une unité.
|
|
3. Si vous devez prendre une autre dose, répétez les étapes E.1 à E.3.
F. Nettoyage
· Normalement, il n’est pas nécessaire de nettoyer votre inhalateur.
· Le cas échéant, vous pouvez nettoyer votre inhalateur après utilisation avec un linge ou un tissu sec.
o Ne nettoyez pas votre inhalateur avec de l’eau ou d’autres liquides. Laissez-le sec.
G. Conservation
Pour des informations sur la conservation et l’élimination, voir rubrique 5.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Comme avec les autres traitements en inhalation, il y a un risque de survenue d'une aggravation de l'essoufflement, de la toux et des sifflements respiratoires immédiatement après l'emploi de INNOVAIR NEXTHALER. Ce phénomène est appelé « bronchospasme paradoxal ». S'il se produit, vous devez immédiatement ARRETER d'utiliser INNOVAIR NEXTHALER et utiliser aussitôt votre inhalateur de secours à effet rapide pour traiter les symptômes. Vous devez immédiatement consulter votre médecin afin qu’il réévalue avec vous la conduite à tenir.
Contactez immédiatement votre médecin si vous présentez des réactions allergiques, se manifestant notamment par des réactions cutanées, démangeaisons, éruption, rougeur de la peau, gonflement de la peau ou des muqueuses, en particulier des yeux, du visage, des lèvres et de la gorge.
D’autres effets indésirables possibles de INNOVAIR NEXTHALER sont énumérés ci-dessous en fonction de leur fréquence.
Fréquent (survenant chez moins d’un patient sur 10) :
· tremblements,
· pneumonie (infection pulmonaire) chez les patients atteints de bronchopneumopathie chronique obstructive (BPCO)
Si vous présentez l’un des effets indésirables suivants pendant la prise de INNOVAIR NEXTHALER, informez-en votre médecin, car ils pourraient être les symptômes d’une infection pulmonaire :
· fièvre ou frissons
· augmentation ou changement de coloration des expectorations (crachats)
· augmentation de la toux ou aggravation de l’essoufflement.
Peu fréquent (survenant chez moins d’un patient sur 100) :
· symptômes de type grippal, mal de gorge
· mycoses de la bouche et de la gorge. Rincer votre bouche ou effectuer un gargarisme à l’eau et brosser vos dents immédiatement après l’inhalation sont des mesures pouvant contribuer à prévenir ces effets indésirables.
· aggravation de vos symptômes d’asthme, difficultés respiratoires
· enrouement
· toux
· battements cardiaques inhabituellement rapides
· battements cardiaques inhabituellement lents
· sensation d'oppression thoracique
· maux de tête
· mal de cœur
· sensation de fatigue ou de nervosité
· modifications de l’électrocardiogramme (ECG)
· diminution de la concentration de cortisol dans l’urine ou dans le sang
· concentration élevée de potassium dans le sang
· concentration élevée de glucose dans le sang
· concentration élevée de graisses dans le sang.
Fréquence indéterminée (ne peut être estimée sur la base des données disponibles) :
· vision floue
Les effets indésirables qui ont été observés avec des médicaments inhalés similaires contenant du dipropionate de béclométasone et/ou du formotérol sont les suivants :
· palpitations
· irrégularité des battements cardiaques
· anomalie ou altération du goût
· douleurs et crampes musculaires
· agitation, vertiges
· sensation d’anxiété
· troubles du sommeil
· diminution de la concentration de potassium dans le sang
· augmentation ou diminution de la pression artérielle
L'inhalation de fortes doses de corticoïdes pendant une durée prolongée peut provoquer des effets généraux:
· anomalies du fonctionnement des glandes surrénales (inhibition de l’activité des glandes surrénales)
· diminution de la densité minérale osseuse (fragilisation des os)
· retard de croissance chez les enfants et adolescents
· glaucome (augmentation de la pression dans les yeux), cataracte
· prise rapide de poids, en particulier du visage et du thorax
· troubles du sommeil, dépression ou sentiment d’inquiétude, agitation, nervosité, surexcitation ou irritabilité. Ces effets sont susceptibles de se produire plus particulièrement chez l’enfant
· comportement anormal.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : www.signalement-sante.gouv.fr
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER INNOVAIR NEXTHALER 100 microgrammes/ 6 microgrammes par inhalation, poudre pour inhalation ?
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur la boite, le sachet ou l’étiquette après la mention EXP. La date de péremption fait référence au dernier jour de ce mois.
À conserver dans l’emballage extérieur d’origine, à l’abri de l’humidité. Ne retirer l’inhalateur de son sachet qu’immédiatement avant la première utilisation.
Avant première ouverture du sachet :
Pas de précautions particulières de conservation concernant la température.
Après première ouverture du sachet :
À conserver à une température ne dépassant pas 25 C.
Après la première ouverture du sachet, le médicament doit être utilisé dans un délai de 6 mois. Utilisez l’étiquette sur la boîte pour écrire la date à laquelle a été ouvert le sachet.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
· Les substances actives sont :
Dipropionate de béclométasone anhydre........................................................ 100 microgrammes
Fumarate de formotérol dihydraté...................................................................... 6 microgrammes
Pour une dose mesurée.
La dose délivrée au travers de l'embout buccal est de 81,9 microgrammes de dipropionate de béclométasone anhydre et 5 microgrammes de fumarate de formotérol dihydraté.
· Les autres composants sont :
Lactose monohydraté (qui contient de petites quantités de protéines du lait) et stéarate de magnésium.
Chaque boîte contient un, deux ou trois inhalateurs délivrant chacun 120 ou 180 inhalations.
Chaque inhalateur est conditionné dans un sachet protecteur scellé (sachet en feuille d’aluminium).
Toutes les présentations peuvent ne pas être commercialisées.
Titulaire de l’autorisation de mise sur le marché
17, AVENUE DE L’EUROPE
92270 BOIS-COLOMBES
Exploitant de l’autorisation de mise sur le marché
CHIESI SAS
17, AVENUE DE L’EUROPE
92270 BOIS-COLOMBES
VIA SAN LEONARDO 96
43122 PARMA
ITALIE
ou
CHIESI SAS
2 rue des Docteurs Alberto et Paolo Chiesi
41260 LA CHAUSSEE SAINT-VICTOR
ou
CHIESI PHARMACEUTICALS GMBH
GONZAGAGASSE 16/16
1010 VIENNE
AUTRICHE
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Ce médicament est autorisé dans les Etats membres de l'Espace Economique Européen sous les noms suivants : Conformément à la réglementation en vigueur.
[À compléter ultérieurement par le titulaire]
La dernière date à laquelle cette notice a été révisée est :
[À compléter ultérieurement par le titulaire]
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).
Des informations détaillées et actualisées sur ce médicament sont disponibles en scannant le QR code inclus dans la notice et sur l’emballage extérieur avec un smartphone/autre appareil.


(Conditionnement 120 inhalations) (Conditionnement 180 inhalations)
Les mêmes informations sont également disponibles à l’adresse suivante: https://qrco.de/Nexthaler100-6-120 ou https://qrco.de/Nexthaler100-6-180.