Dernière mise à jour le 08/01/2026
BECLOMETASONE/FORMOTEROL VIATRIS 100/6 microgrammes/dose, solution pour inhalation en flacon pressurisé
Indications thérapeutiques
Les deux substances actives sont le dipropionate de béclométasone et le fumarate de formotérol dihydraté. Le dipropionate de béclométasone appartient à un groupe de médicaments appelés corticostéroïdes (ou corticoïdes) qui exercent un effet anti‑inflammatoire et réduit l'inflammation et l'irritation dans vos poumons.
Le fumarate de formotérol dihydraté appartient à un groupe de médicaments appelés « bronchodilatateurs de longue durée d'action » qui provoquent un relâchement des muscles des voies respiratoires et vous aident à respirer plus facilement.
L'association de ces deux substances actives que ce soit pour les patients asthmatiques ou présentant une broncho‑pneumopathie chronique obstructive (BPCO) facilite la respiration en soulageant les symptômes tels que l'essoufflement, les sifflements respiratoires et la toux et aide également à éviter la survenue de ces symptômes.
Asthme
BECLOMETASONE/FORMOTEROL VIATRIS est destiné au traitement régulier de l'asthme chez l’adulte lorsque :
· l'asthme n'est pas correctement contrôlé par des corticoïdes inhalés et des bronchodilatateurs de courte durée d'action utilisés « à la demande ».
ou
· l'asthme répond bien au traitement associant des corticoïdes et des bronchodilatateurs de longue durée d'action.
Bronchopneumopathie chronique obstructive (BPCO)
BECLOMETASONE/FORMOTEROL VIATRIS est également préconisé pour le traitement de la broncho‑pneumopathie chronique obstructive (BPCO) sévère chez l’adulte. La BPCO est une maladie chronique des voies aériennes des poumons souvent causée par le tabagisme.
Présentations
> 1 flacon pressurisé aluminium avec valve doseuse placé dans un inhalateur avec compteur de doses en plastique de 120 doses
Code CIP : 34009 302 619 5 8
Déclaration de commercialisation : 07/03/2024
Cette présentation est agréée aux collectivités
- Prix hors honoraire de dispensation : 19,90 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 20,92 €
- Taux de remboursement :65 %
Service médical rendu (SMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Important | Avis du 21/06/2023 | Inscription (CT) | Le service médical rendu par BECLOMETASONE/FORMOTEROL VIATRIS 100/6 µg/dose (béclométasone/formotérol), solution en flacon pressurisé, est important dans l’indication de l’AMM dans l’asthme. |
| Modéré | Avis du 21/06/2023 | Inscription (CT) | Le service médical rendu par BECLOMETASONE/FORMOTEROL VIATRIS 100/6 µg/dose (béclométasone/formotérol), solution en flacon pressurisé, est modéré dans l’indication de l’AMM dans la BPCO. |
Amélioration du service médical rendu (ASMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprés de la HAS (plus d'informations dans l'aide). Les avis et synthéses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur de l'ASMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| V (Inexistant) | Avis du 21/06/2023 | Inscription (CT) | Cette spécialité est un hybride qui n’apporte pas d’amélioration du service médical rendu (ASMR V) par rapport à la spécialité de référence INNOVAIR 100/6 µg/dose (béclométasone/formotérol) solution en flacon pressurisé. |
ANSM - Mis à jour le : 19/08/2025
BECLOMETASONE/FORMOTEROL VIATRIS 100/6 microgrammes/dose, solution pour inhalation en flacon pressurisé
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Chaque dose mesurée (en sortie du flacon pressurisé) contient :
100 microgrammes de dipropionate de béclométasone et 6 microgrammes de fumarate de formotérol dihydraté.
Equivalant à une dose délivrée (au travers de l’embout buccal) de 84,6 microgrammes de dipropionate de béclométasone et 5,0 microgrammes de fumarate de formotérol dihydraté.
Excipient à effet notoire :
Ce médicament contient 6,9 mg d’alcool (éthanol anhydre) par pression en sortie du flacon pressurisé.
Pour la liste complète des excipients, voir rubrique 6.1.
Solution pour inhalation en flacon pressurisé.
Solution incolore à jaunâtre.
4.1. Indications thérapeutiques
BECLOMETASONE/FORMOTEROL VIATRIS 100/6 microgrammes/dose, solution pour inhalation en flacon pressurisé est indiqué en traitement continu de l'asthme, dans les situations où l'administration par voie inhalée d'un médicament associant un corticoïde et un bronchodilatateur bêta‑2 agoniste de longue durée d'action est justifiée :
· chez les patients insuffisamment contrôlés par une corticothérapie inhalée et la prise d'un bronchodilatateur bêta‑2 agoniste de courte durée d'action par voie inhalée « à la demande ».
ou
· chez les patients contrôlés par l'administration d'une corticothérapie inhalée associée à un bêta‑2 agoniste de longue durée d'action par voie inhalée.
Bronchopneumopathie chronique obstructive (BPCO)
Traitement symptomatique des patients présentant une BPCO sévère (VEMS < 50 % de la valeur théorique) et des antécédents d’exacerbations répétées, et chez qui des symptômes respiratoires significatifs persistent malgré un traitement régulier par bronchodilatateur à action prolongée
4.2. Posologie et mode d'administration
ASTHME
BECLOMETASONE/FORMOTEROL VIATRIS ne doit pas être utilisé en première intention pour l'initiation d'un traitement de l'asthme. La posologie des deux substances actives de BECLOMETASONE/FORMOTEROL VIATRIS est individuelle et doit être ajustée en fonction de la sévérité de la maladie. Que ce soit à l'initiation ou pendant les phases d'adaptation du traitement, si le dosage disponible de l'association fixe ne permet pas d'ajuster la posologie de chacun des principes actifs en fonction de l'état clinique du patient, bêta‑2 agonistes et corticostéroïdes devront être administrés individuellement.
Le dipropionate de béclométasone contenu dans BECLOMETASONE/FORMOTEROL VIATRIS se caractérise par une distribution de particules de taille extrafine ce qui conduit à une activité locale plus importante qu'avec une formulation de dipropionate de béclométasone « non-extrafine » (100 microgrammes de dipropionate de béclométasone en formulation « extrafine » contenus dans BECLOMETASONE/FORMOTEROL VIATRIS sont équivalents à 250 microgrammes de dipropionate de béclométasone dans une formulation non‑extrafine). Ainsi, la dose quotidienne totale de dipropionate de béclométasone administrée par BECLOMETASONE/FORMOTEROL VIATRIS devrait être inférieure à celle administrée avec une formulation non‑extrafine.
En cas de transfert d'un patient d'une formulation de dipropionate de béclométasone non‑extrafine à un traitement par BECLOMETASONE/FORMOTEROL VIATRIS, il convient d’en tenir compte et de réduire la dose de dipropionate de béclométasone pour l'ajuster en fonction de l'état clinique du patient.
Il existe deux modalités d’administration thérapeutiques :
A. BECLOMETASONE/FORMOTEROL VIATRIS est utilisé en traitement continu de fond et un bronchodilatateur d’action rapide est utilisé séparément pour soulager les symptômes d’asthme.
B. BECLOMETASONE/FORMOTEROL VIATRIS est utilisé à la fois en traitement continu de fond et, en cas de besoin, pour soulager les symptômes d’asthme.
A. Traitement continu de fond
Il convient d’informer les patients qu’ils doivent avoir en permanence à leur disposition un bronchodilatateur d’action rapide en traitement de secours pour traiter les symptômes aigus d’asthme.
Posologies recommandées chez l'adulte âgé de 18 ans et plus :
Une à deux inhalations deux fois par jour.
La dose journalière maximale est de 4 inhalations par jour.
B. Traitement continu de fond et, en cas de besoin, pour soulager les symptômes d’asthme
Les patients prennent quotidiennement BECLOMETASONE/FORMOTEROL VIATRIS en traitement continu de fond et utilisent aussi BECLOMETASONE/FORMOTEROL VIATRIS en cas de besoin en réponse à la survenue des symptômes d’asthme. Il convient d’informer les patients qu’ils doivent avoir en permanence BECLOMETASONE/FORMOTEROL VIATRIS à leur disposition en traitement de secours.
L’utilisation de BECLOMETASONE/FORMOTEROL VIATRIS en traitement continu de fond et pour soulager les symptômes d’asthme sera envisagée notamment chez des patients :
· Ayant un contrôle insuffisant de l’asthme avec recours fréquent au traitement de secours.
· Ayant eu des antécédents d’exacerbations d’asthme ayant nécessité une intervention médicalisée.
Une surveillance médicale attentive des effets indésirables dose‑dépendants est nécessaire chez les patients consommant de façon fréquente des doses journalières élevées de BECLOMETASONE/FORMOTEROL VIATRIS pour soulager leurs symptômes d’asthme.
Posologies recommandées pour les adultes de 18 ans et plus :
La dose recommandée en traitement continu de fond est d’une inhalation deux fois par jour (une inhalation le matin et une inhalation le soir).
En cas de besoin, pour soulager les symptômes, les patients prendront une inhalation supplémentaire. Si les symptômes persistent après quelques minutes, l’inhalation sera renouvelée.
La dose maximale journalière est de 8 inhalations.
Il est fortement recommandé aux patients utilisant fréquemment leur traitement de secours de prendre un avis médical. Ils devront être réévalués et leur traitement de fond reconsidéré.
Posologies recommandées chez l'enfant et l'adolescent de moins de 18 ans :
La sécurité et l’efficacité de BECLOMETASONE/FORMOTEROL VIATRIS chez l’enfant et l’adolescent de moins de 18 ans n’ont pas été établies. Les données disponibles sur l’utilisation de dipropionate de béclométasone et de formotérol fumarate chez l'enfant de 5 à 11 ans et l'adolescent de 12 à 17 ans sont décrites dans les rubriques 4.8, 5.1 et 5.2 mais aucune recommandation de posologie ne peut être faite.
Le médecin vérifiera régulièrement que le dosage prescrit de BECLOMETASONE/FORMOTEROL VIATRIS est adapté pour un traitement optimal du patient. Il convient de toujours rechercher la posologie minimale permettant d'obtenir le contrôle des symptômes. Lorsque celui-ci est obtenu avec la posologie minimale recommandée, l'administration d'un corticoïde seul pourra être envisagée comme étape suivante dans la recherche du traitement minimal efficace.
Les patients devront être informés de la nécessité de poursuivre le traitement par BECLOMETASONE/FORMOTEROL VIATRIS de façon quotidienne, même si la symptomatologie a régressé.
Bronchopneumopathie chronique obstructive (BPCO)
Posologie recommandée chez l’adulte à partir de 18 ans :
Deux inhalations deux fois par jour.
Populations particulières
Il n'y a pas lieu d'ajuster la posologie chez les sujets âgés. Il n'existe pas de donnée concernant l'emploi de BECLOMETASONE/FORMOTEROL VIATRIS en cas d'insuffisance hépatique ou rénale (voir rubrique 5.2).
Mode d’administration
Voie inhalée exclusivement.
Afin de s'assurer de l’administration correcte du médicament, il est utile que le médecin ou un autre professionnel de santé montre au patient comment utiliser l'inhalateur. L'utilisation adaptée du dispositif d'inhalation pressurisé est essentielle pour l'efficacité du traitement. Il convient d'informer le patient de la nécessité de lire attentivement la notice et de se conformer aux recommandations et modalités d'emploi qui y figurent.
Un compteur de doses sur le devant de l’inhalateur BECLOMETASONE/FORMOTEROL VIATRIS indique le nombre de doses restantes. A chaque utilisation du dispositif de 120 doses, une bouffée est libérée et le compteur décrémente une dose, mais la fenêtre du compteur de doses affiche le nombre de pulvérisations restantes dans l’inhalateur en unités de vingt (par ex., 120, 100, 80, etc.). Le patient doit être informé qu’en cas de chute de l’inhalateur, un décompte accidentel du compteur de doses peut survenir.
Tester l’inhalateur
Avant la première utilisation de l'inhalateur, le patient doit libérer préalablement trois bouffées dans le vide et, en cas de non-utilisation pendant 14 jours ou plus, le patient doit libérer préalablement une bouffée dans le vide afin de vérifier le bon fonctionnement du dispositif. Après avoir testé le dispositif pour la première fois, le patient doit s’assurer que le compteur de doses affiche 120 doses.
Dans la mesure du possible, les patients doivent se tenir debout ou en position assise à la verticale lors des inhalations.
Utilisation de l’inhalateur
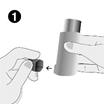
1. Le patient doit retirer le capuchon protecteur de l'embout buccal et vérifier que ce dernier est propre, non poussiéreux et dénué de saleté ou de tout autre corps étranger.
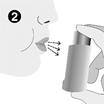
2. Le patient doit expirer aussi lentement et aussi profondément que possible.
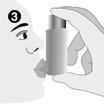
3. Le patient doit tenir la cartouche verticalement, orientée vers le haut, et serrer l'embout buccal entre les lèvres sans mordre l'embout buccal.
4. En même temps, le patient doit inspirer lentement et profondément par la bouche. Dès le début de l'inspiration, il doit appuyer sur le haut de l'inhalateur afin de libérer une bouffée.
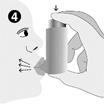
5. Le patient doit retenir sa respiration aussi longtemps que possible et ensuite retirer l'inhalateur de la bouche et expirer lentement. Le patient ne doit pas expirer dans l'inhalateur.
Pour inhaler une bouffée supplémentaire, le patient doit maintenir l'inhalateur en position verticale pendant environ 30 secondes et répéter les étapes 2 à 5.
IMPORTANT : Ne pas effectuer les étapes 2 à 5 trop rapidement.
Après l'emploi, le patient doit remettre le capuchon protecteur et vérifier le compteur de doses.
Il est conseillé aux patients de se procurer un nouvel inhalateur lorsque le compteur de doses n’affiche plus que 20 doses. L’inhalateur ne doit plus être utilisé lorsque le compteur affiche 0 car les bouffées restantes dans le dispositif peuvent ne pas délivrer la dose complète de traitement.
Si un nuage sort de l'inhalateur ou de chaque côté de la bouche au cours de l'administration du produit, l'inhalation devra être recommencée à partir de l'étape 2.
Chez les patients présentant une faiblesse de préhension, la manipulation de l'appareil peut être facilitée en tenant l'inhalateur à deux mains. Dans ce cas, il faut placer les index sur le haut de la cartouche de l'inhalateur et les deux pouces à la base de l'inhalateur.
Les patients doivent se rincer la bouche ou se gargariser à l'eau ou encore se brosser les dents après l'inhalation (voir rubrique 4.4).
Nettoyage
Se conformer aux instructions de nettoyage délivrées dans la notice. Pour le nettoyage régulier de l'inhalateur, le capuchon sera retiré de l'embout buccal et l'extérieur et l'intérieur de l'embout buccal seront essuyés avec un chiffon sec. Ne jamais enlever la cartouche de l’inhalateur et ne pas rincer à l'eau ou appliquer tout autre liquide pour nettoyer l'embout buccal.
Chez les patients ayant des difficultés à coordonner la pression sur le flacon avec l'inspiration de l'aérosol délivré, la chambre d'inhalation AeroChamber Plus peut être utilisée pour l'administration du produit. Les instructions pour l'utilisation adaptée et l'entretien de la chambre d'inhalation pourront être dispensées par le médecin, pharmacien, ou infirmière. Ils pourront ainsi s'assurer que le patient manipule convenablement le dispositif en exerçant une inspiration longue et profonde à travers la chambre d'inhalation dès le déclenchement du système pour une diffusion optimale du produit dans le poumon à l'aide de l'AeroChamber Plus.
Hypersensibilité aux substances actives ou à l’un des excipients mentionnés à la rubrique 6.1.
4.4. Mises en garde spéciales et précautions d'emploi
BECLOMETASONE/FORMOTEROL VIATRIS doit être administré avec précaution (éventuellement sous surveillance) chez les patients présentant les pathologies suivantes : arythmies cardiaques, en particulier bloc auriculo‑ventriculaire du troisième degré et tachyarythmies (rythme cardiaque accéléré et/ou irrégulier), sténose aortique sous‑valvulaire idiopathique, cardiomyopathie obstructive hypertrophique, cardiopathie sévère, en particulier infarctus du myocarde à la phase aiguë, cardiopathie ischémique, insuffisance cardiaque congestive, vasculopathie oblitérante, en particulier artériosclérose, hypertension artérielle et anévrisme.
La prudence est également requise chez les patients présentant un allongement de l'intervalle QTc, authentifié ou suspecté, qu'il soit congénital ou iatrogène (QTc > 0,44 seconde). Le formotérol lui‑même peut induire un allongement de l'intervalle QTc.
La prudence est également recommandée en cas d'utilisation de BECLOMETASONE/FORMOTEROL VIATRIS chez les patients présentant une thyréotoxicose, un diabète, un phéochromocytome et une hypokaliémie non traitée.
Une hypokaliémie pouvant entraîner des conséquences graves peut être observée lors d'un traitement par bêta‑2 agoniste. En cas d'asthme sévère la vigilance est requise car l’hypoxie peut potentialiser cet effet. L'administration concomitante de bêta‑2 agonistes avec des médicaments ayant un effet hypokaliémiant ou pouvant potentialiser cet effet comme les dérivés xanthiques, les corticoïdes ou les diurétiques peut induire une augmentation du risque d'hypokaliémie (voir rubrique 4.5). La prudence est particulièrement recommandée en cas d'asthme instable pour lequel la prise des médicaments bronchodilatateurs utilisés « à la demande » est importante et variable au cours de la journée. Il peut être recommandé de surveiller la kaliémie dans ces situations.
L'administration de formotérol peut provoquer une augmentation de la glycémie. Des contrôles supplémentaires de la glycémie peuvent donc être justifiés chez des patients diabétiques.
En cas d'anesthésie programmée avec des anesthésiques halogénés, l'administration de BECLOMETASONE/FORMOTEROL VIATRIS devra être interrompue au moins 12 heures avant le début de l'anesthésie, en raison du risque d'arythmies.
BECLOMETASONE/FORMOTEROL VIATRIS doit être utilisé avec prudence en cas de tuberculose pulmonaire évolutive ou quiescente et d'infection fongique ou virale des voies respiratoires.
Il est recommandé de ne pas arrêter brutalement un traitement par BECLOMETASONE/FORMOTEROL VIATRIS.
Si le contrôle des symptômes reste insuffisant à la suite du traitement il est nécessaire de solliciter l’attention d’un médecin. Une augmentation de la consommation de bronchodilatateurs utilisés pour soulager les symptômes aigus d’asthme indique une aggravation de l’asthme qui doit conduire à la réévaluation de la conduite thérapeutique. Une détérioration soudaine ou progressive du contrôle des symptômes d'asthme ou de BPCO nécessite un avis médical urgent car elle peut annoncer une évolution vers un état clinique grave engageant le pronostic vital. Il conviendra alors d'envisager une augmentation de la corticothérapie (avec par exemple une cure de corticoïdes par voie inhalée ou orale) ou une antibiothérapie en cas d'infection.
Le traitement par BECLOMETASONE/FORMOTEROL VIATRIS ne doit pas être instauré pendant une exacerbation ou pendant une aggravation significative ou une déstabilisation aiguë de l'asthme. Des événements indésirables graves liés à l'asthme ainsi que des exacerbations sont possibles pendant le traitement par BECLOMETASONE/FORMOTEROL VIATRIS. Le patient devra être informé que si les symptômes d'asthme restent insuffisamment contrôlés ou s'aggravent après la mise en route du traitement par BECLOMETASONE/FORMOTEROL VIATRIS, le traitement doit être poursuivi mais un avis médical est requis dès que possible.
Un bronchospasme paradoxal peut survenir, se manifestant par une augmentation immédiate du sifflement bronchique et de la respiration après l'inhalation de ce médicament. Cela doit être traité immédiatement à l’aide d’un bronchodilatateur d’action rapide. BECLOMETASONE/FORMOTEROL VIATRIS doit être arrêté immédiatement, le patient évalué et un autre traitement instauré si nécessaire.
BECLOMETASONE/FORMOTEROL VIATRIS ne doit pas être utilisé en traitement de première intention de l'asthme.
Pour le traitement de crises d’asthme aiguës, le patient doit disposer constamment d’un bronchodilatateur d’action rapide, c’est‑à‑dire soit BECLOMETASONE/FORMOTEROL VIATRIS pour les patients qui l’utilisent à la fois en traitement de fond et pour soulager les symptômes d’asthme, soit un bronchodilatateur d’action rapide distinct (pour les patients qui utilisent BECLOMETASONE/FORMOTEROL VIATRIS uniquement en traitement de fond).
Il convient de rappeler aux patients de prendre BECLOMETASONE/FORMOTEROL VIATRIS quotidiennement, conformément à la prescription médicale, même en l’absence de symptômes. La prise de BECLOMETASONE/FORMOTEROL VIATRIS « à la demande » ne doit s’envisager qu’en réponse à la survenue de symptômes d’asthme dans le but de les soulager, mais elle ne doit pas correspondre à une utilisation préventive systématique telle que pour la prévention de l’asthme d’effort. Pour une telle utilisation, il convient d’avoir recours à un bronchodilatateur d’action rapide seul.
Une fois les symptômes d'asthme contrôlés, les doses de BECLOMETASONE/FORMOTEROL VIATRIS seront progressivement diminuées sous surveillance régulière. La dose minimale efficace de BECLOMETASONE/FORMOTEROL VIATRIS devra être utilisée (voir aussi rubrique 4.2).
Les corticoïdes inhalés peuvent induire des effets systémiques, lorsqu'ils sont utilisés pendant longtemps à fortes doses. Ces effets sont beaucoup plus rares avec un traitement administré par voie inhalée que par voie orale. Les effets systémiques possibles sont les suivants : syndrome de Cushing, symptômes cushingoïdes, freination surrénalienne, diminution de la densité minérale osseuse, retard de croissance chez les enfants et adolescents, cataracte et glaucome et plus rarement des troubles psychologiques ou du comportement incluant hyperactivité psychomotrice, troubles du sommeil, anxiété, syndrome dépressif ou comportement agressif (notamment chez l’enfant).
Par conséquent, il est important d'examiner régulièrement le patient et de réduire la dose de corticoïde inhalé jusqu'à la dose minimale efficace pour le traitement de l'asthme.
Les données de pharmacocinétique en dose unique (voir rubrique 5.2) ont démontré que l’utilisation de dipropionate de béclométasone/formotérol fumarate avec la chambre d'inhalation AeroChamber Plus par rapport à l'inhalateur standard n’augmente pas l’exposition systémique totale au formotérol et réduit l’exposition systémique au 17‑monopropionate de béclométasone, tandis qu’il y a une augmentation du dipropionate de béclométasone sous sa forme inchangée qui atteint la circulation systémique à partir des poumons. Cependant, étant donné que l'exposition systémique totale du dipropionate de béclometasone et de son métabolite actif reste inchangée, il n'est pas attendu de risque accru d'effets systémiques avec l'utilisation de dipropionate de béclométasone/formotérol fumarate avec la chambre d'inhalation AeroChamber Plus.
L'administration au long cours de corticoïdes par voie inhalée à forte dose peut provoquer une freination surrénalienne, voire une insuffisance surrénalienne aiguë. Le risque est particulièrement élevé chez les enfants de moins de 16 ans recevant des doses de dipropionate de béclométasone supérieures aux doses préconisées. Les situations favorisant l'insuffisance surrénalienne aiguë sont notamment les suivantes : traumatisme, intervention chirurgicale, infection ou diminution trop rapide de la posologie. Les symptômes sont habituellement atypiques pouvant consister en une anorexie, des douleurs abdominales, une perte de poids, une fatigue, des céphalées, des nausées, des vomissements, une hypotension, des troubles de la conscience, une hypoglycémie et des convulsions. Il faut envisager une corticothérapie de supplémentations par voie systémique couvrant la durée de la période de stress ou en cas d'intervention programmée.
Il convient de rester prudent lors du remplacement d'un traitement préalable par BECLOMETASONE/FORMOTEROL VIATRIS, notamment si un risque de freination surrénalienne par le traitement précédent est pressenti.
La freination des fonctions surrénaliennes peut persister assez longtemps chez les patients passant d’une corticothérapie orale à une corticothérapie inhalée. Les patients ayant nécessité une corticothérapie à forte dose en urgence par le passé ou ayant reçu un traitement prolongé par des corticoïdes inhalés à forte dose sont également exposés à ce risque. Il conviendra donc d'évoquer le risque d'insuffisance surrénalienne persistante en cas de stress ou d'intervention programmée et envisager une corticothérapie de supplémentation dans ces situations. Un avis spécialisé peut être requis avant toute intervention en cas de freination majeure.
Pneumonie chez les patients présentant une bronchopneumopathie chronique obstructive (BPCO)
Une augmentation de l’incidence des cas de pneumonie, ayant ou non nécessité une hospitalisation, a été observée chez les patients présentant une BPCO et recevant une corticothérapie inhalée. Bien que cela ne soit pas formellement démontré dans toutes les études cliniques disponibles, ce risque semble augmenter avec la dose de corticoïde administré. Les données disponibles ne permettent pas de considérer que le niveau du risque de survenue de pneumonie varie en fonction du corticostéroïde inhalé utilisé. Il convient de rester vigilant chez les patients présentant une BPCO, les symptômes de pneumonie pouvant s'apparenter aux manifestations cliniques d'une exacerbation de BPCO. Le tabagisme, un âge avancé, un faible indice de masse corporelle (IMC) ainsi que la sévérité de la BPCO sont des facteurs de risques de survenue de pneumonie.
Les patients devront se rincer la bouche ou se gargariser avec de l'eau ou encore se brosser les dents après l'inhalation de la dose prescrite, afin de réduire le risque de candidose oropharyngée.
BECLOMETASONE/FORMOTEROL VIATRIS contient 7 mg d’alcool (éthanol) par bouffée (58,14 mg). La dose de 58,14 mg contenue dans ce médicament équivaut à moins de 174 mg (0,22 ml) de bière ou 58 mg (0,07 ml) de vin. Cette faible quantité d’alcool dans ce médicament ne porte pas à conséquence pour le patient.
Troubles visuels
Des troubles visuels peuvent apparaitre lors d'une corticothérapie par voie systémique ou locale. En cas de vision floue ou d'apparition de tout autre symptôme visuel apparaissant au cours d'une corticothérapie, un examen ophtalmologique est requis à la recherche notamment d'une cataracte, d'un glaucome, ou d'une lésion plus rare telle qu'une choriorétinopathie séreuse centrale, décrits avec l'administration de corticostéroïdes par voie systémique ou locale.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Interactions pharmacocinétiques
Le dipropionate de béclométasone est très rapidement métabolisé par des enzymes estérases.
Le métabolisme de la béclométasone est moins dépendant du CYP3A que celui de certains autres corticostéroïdes, et les interactions sont en général peu probables ; néanmoins, en cas d’utilisation concomitante d’inhibiteurs puissants du CYP3A (p. ex. ritonavir, cobicistat), la possibilité d’effets systémiques ne peut pas être exclue et il est donc conseillé d’être prudent et d’appliquer une surveillance adéquate en cas d’utilisation de ces agents.
Interactions pharmacodynamiques
L'usage des bêta‑bloquants (y compris sous forme de collyre) doit être évité chez les sujets asthmatiques. En cas d'utilisation impérative de bêta‑bloquants, l'effet du formotérol peut être diminué, voire inhibé.
A l'inverse, l'utilisation concomitante d'autres produits bêta‑adrénergiques peut entraîner un effet additif. Il convient donc de rester prudent lors de la prescription simultanée de formotérol et de théophylline ou d'autres médicaments bêta‑adrénergiques.
Un traitement concomitant par la quinidine, le disopyramide, le procaïnamide, les phénothiazines, les antihistaminiques, les inhibiteurs de la monoamine‑oxydase et les antidépresseurs tricycliques peut provoquer un allongement de l'intervalle QTc et augmenter le risque d'arythmie ventriculaire.
En outre, la L‑dopa, la L‑thyroxine, l'ocytocine et l'alcool peuvent perturber la tolérance cardiaque des bêta2‑sympathomimétiques.
Un traitement concomitant par des inhibiteurs de la monoamine‑oxydase ou par des médicaments dotés de propriétés similaires, tels que furazolidone et procarbazine, peut provoquer des réactions hypertensives.
Chez les patients recevant en même temps une anesthésie par des hydrocarbures halogénés, le risque d'arythmie est augmenté.
Un traitement concomitant par des dérivés de la xanthine, des corticoïdes ou des diurétiques risque de potentialiser l'effet hypokaliémiant des agonistes des récepteurs bêta2 (voir rubrique 4.4). Chez les patients traités par des glycosides digitaliques, l'hypokaliémie peut augmenter le risque d'arythmie.
BECLOMETASONE/FORMOTEROL VIATRIS contient une petite quantité d'éthanol. Il y a un risque théorique d'interaction chez les patients particulièrement sensibles recevant du disulfirame ou du métronidazole.
4.6. Fertilité, grossesse et allaitement
Il n'y a pas de données ou de démonstration de la sécurité du gaz propulseur HFA‑134a chez la femme enceinte ou qui allaite. Toutefois, les études animales concernant l'effet du HFA‑134a sur la reproduction et le développement embryofœtal n'ont révélé aucun effet indésirable cliniquement notable.
Fertilité
Il n'existe pas de données humaines concernant la fertilité. Au cours des études conduites chez le rat, une dose élevée de dipropionate de béclométasone dans l’association administrée a été associée à une réduction de la fertilité chez les femelles et à une embryotoxicité (voir rubrique 5.3).
Grossesse
Il n'existe pas de données cliniques pertinentes concernant l'emploi de BECLOMETASONE/FORMOTEROL VIATRIS chez la femme enceinte. Les études animales concernant l'association de dipropionate de béclométasone et de formotérol ont révélé une toxicité sur la reproduction après une exposition systémique élevée (voir rubrique 5.3 Données de sécurité préclinique) du fait de l'effet tocolytique des bêta2‑sympathomimétiques, la prudence est requise dans la période précédant l'accouchement. L'utilisation du formotérol est déconseillée pendant la grossesse et surtout en fin de grossesse ou pendant le travail, sauf en l'absence d'alternative dont la sécurité est bien établie.
BECLOMETASONE/FORMOTEROL VIATRIS ne doit être utilisé pendant la grossesse que si les bénéfices escomptés l'emportent sur les risques potentiels.
Allaitement
Il n'existe pas de données cliniques pertinentes concernant l'emploi de BECLOMETASONE/FORMOTEROL VIATRIS chez la femme qui allaite.
Bien qu'il n'y ait pas de données recueillies chez l'animal, il est probable que le dipropionate de béclométasone, comme les autres corticoïdes, soit sécrété dans le lait.
Le passage du formotérol dans le lait humain n'est pas connu, mais sa présence a été décelée chez l'animal pendant l'allaitement.
Il ne faut donc envisager l'administration de BECLOMETASONE/FORMOTEROL VIATRIS à des femmes qui allaitent que si les bénéfices escomptés l'emportent sur les risques potentiels.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
La présence du dipropionate de béclométasone et du fumarate de formotérol dihydraté dans BECLOMETASONE/FORMOTEROL VIATRIS peut entraîner des effets indésirables dont la nature et la sévérité sont identiques à celles des effets indésirables de chacun des deux principes actifs. L'administration concomitante des deux principes actifs n'entraîne pas la survenue d'événements indésirables spécifiques.
Les effets indésirables observés sous traitement par une association fixe de dipropionate de béclométasone et de formotérol et en monothérapie sont indiqués ci‑après. Ils sont classés par systèmes d’organes.
La définition des fréquences de survenue est la suivante : très fréquent (≥ 1/10), fréquent (≥ 1/100, < 1/10), peu fréquent (≥ 1/1 000, < 1/100), rare (≥ 1/10 000, < 1/1 000), très rare (≤ 1/10 000) et fréquence indéterminée (ne peut être estimée sur la base des données disponibles).
Les données obtenues concernant les réactions indésirables fréquentes et peu fréquentes sont issues des essais cliniques conduits chez des patients asthmatiques et chez des patients présentant une bronchopneumopathie chronique obstructive.
|
Classe de systèmes d'organes |
Réaction indésirable |
Fréquence |
|
Infections et infestations |
Pharyngite, candidose orale, pneumonie* (chez les patients atteints de BPCO) |
Fréquent |
|
Syndrome grippal, infection fongique buccale, candidose oropharyngée, candidose œsophagienne, candidose vulvovaginale, gastro‑entérite, sinusite, rhinite |
Peu fréquent |
|
|
Affections hématologiques et du système lymphatique |
Granulopénie |
Peu fréquent |
|
Thrombopénie |
Très rare |
|
|
Affections du système immunitaire |
Dermatite allergique |
Peu fréquent |
|
Réactions d'hypersensibilité, y compris érythème et œdème des lèvres, du visage, des yeux et du pharynx |
Très rare |
|
|
Affections endocriniennes |
Insuffisance surrénalienne |
Très rare |
|
Troubles du métabolisme et de la nutrition |
Hypokaliémie, hyperglycémie |
Peu fréquent |
|
Affections psychiatriques |
Agitation |
Peu fréquent |
|
Hyperactivité psychomotrice, troubles du sommeil, anxiété, syndrome dépressif, comportement agressif, trouble du comportement (notamment chez l’enfant) |
Fréquence indéterminée |
|
|
Affections du système nerveux |
Céphalées |
Fréquent |
|
Tremblement, sensations vertigineuses |
Peu fréquent |
|
|
Affections oculaires |
Glaucome, cataracte |
Très rare |
|
Vision floue (voir rubrique 4.4) |
Fréquence indéterminée |
|
|
Affections de l'oreille et du labyrinthe |
Inflammation des trompes d'Eustache |
Peu fréquent |
|
Affections cardiaques |
Palpitations ; allongement de l'intervalle QT corrigé à l’électrocardiogramme ; modifications de l'ECG, tachycardie, tachyarythmie, fibrillation auriculaire* |
Peu fréquent |
|
Extrasystoles ventriculaires, angine de poitrine |
Rare |
|
|
Affections vasculaires |
Bouffées vasomotrices, flush |
Peu fréquent |
|
Affections respiratoires, thoraciques et médiastinales |
Dysphonie |
Fréquent |
|
Toux productive ou non, irritation de la gorge, crise d’asthme |
Peu fréquent |
|
|
Bronchospasme paradoxal |
Rare |
|
|
Dyspnée, exacerbation de l’asthme |
Très rare |
|
|
Affections gastro‑intestinales |
Diarrhée, sécheresse de la bouche, dyspepsie, dysphagie, sensation de brûlure des lèvres, nausées, dysgueusie |
Peu fréquent |
|
Affections de la peau et du tissu sous‑cutané |
Prurit, rash, hyperhidrose, urticaire |
Peu fréquent |
|
Œdème de Quincke |
Rare |
|
|
Affections musculosquelettiques et du tissu conjonctif |
Contractures musculaires, myalgies |
Peu fréquent |
|
Retard de croissance chez l'enfant et l'adolescent |
Très rare |
|
|
Affections du rein et des voies urinaires |
Néphrite |
Rare |
|
Troubles généraux et anomalies au site d'administration |
Œdèmes périphériques |
Très rare |
|
Investigations |
Augmentation du taux de protéine C réactive, augmentation du taux de plaquettes, augmentation du taux d'acides gras libres, augmentation de l'insulinémie, augmentation du taux sanguin de corps cétoniques, diminution de la cortisolémie* |
Peu fréquent |
|
Augmentation de la pression artérielle, diminution de la pression artérielle |
Rare |
|
|
Diminution de la densité osseuse |
Très rare |
* Un cas non grave de pneumonie liée au traitement par dipropionate de béclométasone/de formotérol fumarate a été rapporté au cours d’un essai clinique pivot conduit chez des patients atteints de BPCO. D’autres effets indésirables observés avec dipropionate de béclométasone/formotérol fumarate lors des essais cliniques conduits dans la BPCO ont été : diminution de la cortisolémie et fibrillation auriculaire.
Comme avec les autres traitements utilisés en inhalation, un bronchospasme paradoxal est possible (voir rubrique 4.4).
Parmi les effets indésirables observés, ceux qui sont typiques du formotérol sont les suivants : hypokaliémie, céphalées, tremblement, palpitations, toux, contractures musculaires et allongement de l'intervalle QTc.
Les effets indésirables spécifiques du dipropionate de béclométasone sont les suivants : mycoses buccales, candidose buccale, dysphonie et irritation de la gorge.
Un gargarisme ou rinçage de la bouche à l'eau et éventuellement un brossage des dents après l'utilisation du médicament permettent de diminuer le risque de dysphonie et de candidoses. Une candidose symptomatique peut être traitée par un antifongique topique, le traitement par dipropionate de béclométasone/formotérol fumarate étant poursuivi en même temps.
Les corticoïdes par voie inhalée (par exemple le dipropionate de béclométasone) peuvent avoir des effets systémiques, surtout en cas d'utilisation prolongée de doses fortes. Il peut s'agir des phénomènes suivants : freination surrénalienne, diminution de la densité minérale osseuse, retard de croissance chez l'enfant et l'adolescent, cataracte et glaucome (voir aussi rubrique 4.4).
Des réactions d'hypersensibilité telles que rash, urticaire, prurit, érythème et œdème des yeux, du visage, des lèvres et de la gorge ont également été notées.
Dans une étude sur 12 semaines menée chez des patients adolescents asthmatiques, le profil de sécurité du dipropionate de béclométasone et du formotérol n'était pas différent de celui du dipropionate de béclometasone seul.
Le dipropionate de béclométasone et fumarate de formotérol 50/6 microgrammes par dose, formulation expérimentale pédiatrique de dipropionate de béclométasone et fumarate de formotérol, administré chez des enfants asthmatiques âgés de 5 à 11 ans pendant une période de traitement de 12 semaines, a montré un profil de sécurité similaire à l’association libre de formotérol et de dipropionate de béclométasone approuvés commercialisés.
Cependant, la même formulation pédiatrique de dipropionate de béclométasone et fumarate de formotérol 50/6 microgrammes administrée chez des enfants asthmatiques âgés de 5 à 11 ans pendant 2 semaines n'a pas démontré de non‑infériorité par apport à l'association libre de formotérol et diproponiate de béclométasone commercialisés administrés séparément, en termes de taux de croissance de la partie inférieure de la jambe.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr
Des doses cumulées allant jusqu'à 12 bouffées de dipropionate de béclométasone/formotérol fumarate par voie inhalée (soit au total 1 200 microgrammes de dipropionate de béclométasone et 72 microgrammes de formotérol) administrées lors d'études chez les asthmatiques n'ont pas révélé d'effets perturbant sur les fonctions vitales et n'ont pas entrainé d'effets indésirables ni sévères ni graves.
Un surdosage en formotérol peut engendrer les effets spécifiques des agonistes bêta2 adrénergiques : nausées, vomissements, céphalées, tremblement, somnolence, palpitations, tachycardie, arythmies ventriculaires, allongement de l'intervalle QTc, acidose métabolique, hypokaliémie, hyperglycémie.
En cas de surdosage en formotérol, des mesures thérapeutiques adaptées et un traitement symptomatique sont recommandés. Les cas présentant des signes de gravité devront être hospitalisés. Le recours à des bêta‑bloquants cardiosélectifs pourra être envisagé, mais avec une grande réserve compte tenu du risque de bronchospasme induit par les bêta‑bloquants. Une surveillance de la kaliémie est requise.
L'inhalation aiguë de doses de dipropionate de béclométasone supérieures aux doses recommandées peut provoquer une freination surrénalienne. Il n'y a pas lieu d'entreprendre un traitement spécifique, le retour à la normale de la fonction surrénalienne étant obtenu spontanément en quelques jours comme en témoignent les dosages plasmatiques du cortisol. Le traitement devra être poursuivi aux doses adaptées pour le contrôle de l'asthme.
Le surdosage chronique en dipropionate de béclométasone inhalé expose au risque de freination surrénalienne (voir rubrique 4.4). Une surveillance des fonctions surrénaliennes peut être nécessaire. Le traitement devra être poursuivi à la dose adaptée pour le contrôle de l'asthme.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Mécanisme d’action et effets pharmacodynamiques
BECLOMETASONE/FORMOTEROL VIATRIS contient du dipropionate de béclométasone et du formotérol, principes actifs dont les mécanismes d'action sont différents. Comme avec les autres médicaments par voie inhalée associant un corticoïde et un agoniste bêta2, les effets additifs des deux principes actifs sont observés sur la réduction des exacerbations d'asthme.
Dipropionate de béclométasone
Aux doses recommandées, le dipropionate de béclométasone inhalé exerce un effet anti‑inflammatoire glucocorticoïde au niveau pulmonaire, ayant pour effet la réduction des symptômes et exacerbations de l'asthme avec des effets indésirables moindres qu'avec les corticoïdes par voie systémique.
Formotérol
Le formotérol est un agoniste bêta2‑adrénergique sélectif qui induit une relaxation des muscles lisses bronchiques en cas de bronchoconstriction. L'effet bronchodilatateur apparaît rapidement, en l'espace de 1 à 3 minutes après l'inhalation, et il persiste 12 heures après l'inhalation d'une dose unique.
ASTHME
Efficacité clinique de dipropionate de béclométasone/formotérol fumarate en traitement continu de fond
Dans les essais cliniques menés chez des adultes, l'association de formotérol et de dipropionate de béclométasone a amélioré les symptômes d'asthme et la fonction respiratoire et a réduit les exacerbations.
Dans une étude menée pendant 24 semaines, l'effet de dipropionate de béclométasone/formotérol fumarate sur la fonction respiratoire a été au moins équivalent à celui de l'association de dipropionate de béclométasone et de formotérol administrés séparément et supérieur à celui du dipropionate de béclométasone utilisé seul.
Efficacité clinique de dipropionate de béclométasone/formotérol fumarate en traitement continu de fond et, en cas de besoin, pour soulager les symptômes d’asthme
Dans une étude de 48 semaines sur des groupes parallèles comportant 1 701 patients asthmatiques, l’efficacité de dipropionate de béclométasone/formotérol fumarate administré en traitement continu de fond (1 inhalation 2 fois par jour) et pour soulager les symptômes (jusqu’à 8 bouffées par jour au total) a été comparée à celle de dipropionate de béclométasone/formotérol fumarate en traitement continu de fond (1 inhalation 2 fois par jour) associé au salbutamol en traitement à la demande chez des patients adultes souffrant d’asthme non contrôlé modéré à sévère. Les résultats ont montré que dipropionate de béclométasone/formotérol fumarate en traitement de fond et pour soulager les symptômes prolongeait de manière significative la durée de temps écoulé jusqu’à la première exacerbation grave(*) par rapport au dipropionate de béclométasone/formotérol fumarate en traitement de fond associé au salbutamol à la demande (p< 0,001 pour les populations ITT et PP). Le taux d’exacerbations sévères d’asthme par patient et par an a été réduit de manière significative dans les groupes « traitement de fond et pour soulager les symptômes » comparé au groupe salbutamol : 0,1476 vs 0,2239 respectivement (réduction statistiquement significative : p < 0.001). Les patients du groupe dipropionate de béclométasone/formotérol fumarate « traitement de fond et pour soulager les symptômes » ont atteint une amélioration clinique significative dans le contrôle de l’asthme. Le nombre moyen d’inhalation / jour dans le traitement de secours et la proportion de patients ayant recours au traitement de secours ont diminué de manière similaire dans les deux groupes.
*NB Par exacerbations sévères on entend une détérioration de l’asthme nécessitant une hospitalisation ou un traitement aux urgences ou bien un recours aux corticoïdes par voie systémique pendant plus de 3 jours.
Dans une autre étude clinique, une dose unique de dipropionate de béclométasone/formotérol fumarate 100/6 microgrammes a exercé un effet bronchodilatateur rapide et a rapidement soulagé les symptômes de dyspnée, de manière similaire à celle du salbutamol 200 microgrammes/dose, lors d’une provocation par métacholine pour l’induction d’un bronchospasme chez des patients asthmatiques.
Population pédiatrique
Dans une étude sur 12 semaines menée chez des patients adolescents asthmatiques, l'association de dipropionate de béclométasone et de formotérol fumarate 100/6 microgrammes n'était pas supérieur au dipropionate de béclometasone seul, ni en termes de paramètres de la fonction pulmonaire (critère principal : variation du DEP matinal pré‑dose), de critères d'efficacité secondaires ou de mesures d’efficacité clinique.
L'effet bronchodilatateur d'une dose unique de dipropionate de béclométasone et de formotérol fumarate 50/6 microgrammes par dose, formulation expérimentale pédiatrique de dipropionate de béclométasone et fumarate de formotérol, administré avec la chambre d'inhalation AeroChamber Plus chez des enfants asthmatiques âgés de 5 à 11 ans, a été évalué comparativement à l'association libre de dipropionate de béclométasone et fumarate de formotérol commercialisés.
La non‑infériorité de dipropionate de béclométasone et de formotérol fumarate 50/6 par rapport à l'association libre a été démontrée en termes de VEMS moyen évalué pendant 12h après l'administration du matin, car la limite inférieure de l'intervalle de confiance à 95 % de la différence des moyennes ajustées était de ‑0,047 L, ce qui était supérieur à la limite de non‑infériorité prédéfinie de ‑0,1 L.
L’association de dipropionate de béclométasone et formotérol fumarate 50/6 microgrammes par dose formulation pédiatrique, administré avec l'AeroChamber Plus chez des enfants asthmatiques âgés de 5 à 11 ans pendant une période de traitement de 12 semaines, n'a pas démontré de supériorité en comparaison au dipropionate de béclométasone seul et a échoué à démontrer la non‑infériorité comparativement à l'association libre de dipropionate de béclométasone et fumarate de formotérol en termes de paramètres de la fonction pulmonaire (critère principal : variation du VEMS matinal pré‑dose).
BPCO
Deux essais de 48 semaines ont étudié les effets sur la fonction respiratoire et le taux des exacerbations (définies comme la mise en route d’une corticothérapie orale et/ou une d’une antibiothérapie et/ou une hospitalisation) chez des patients présentant une BPCO sévère (30 % < VEMS % < 50 %).
Une étude pivot a montré une amélioration significative de la fonction respiratoire (critère principal : VEMS pré‑dose) comparativement au formotérol seul après 12 semaines de traitement (différence moyenne ajustée entre dipropionate de béclométasone/formotérol fumarate et formotérol : 69 ml), ainsi qu’à chaque visite clinique durant la période totale de traitement (48 semaines). Cette étude a montré une diminution statistiquement significative du nombre moyen d’exacerbations par patient/année (taux d’exacerbation, autre critère principal) dans le groupe de patients traités par dipropionate de béclométasone/formotérol fumarate comparativement au formotérol (taux moyen ajusté de 0,80 comparativement à 1,12 dans le groupe formotérol, rapport ajusté 0,72, p < 0,001) sur 48 semaines de traitement sur un total de 1 199 patients présentant une BPCO sévère.
De plus, l’apparition de la première exacerbation était significativement retardée dans le groupe de patients traités par dipropionate de béclométasone/formotérol fumarate comparativement au formotérol. La supériorité du médicament princeps par rapport au formotérol en termes de taux d’exacerbations a également été mis en évidence dans les sous‑groupes de patients traités ou non par le bromure de tiotropium de façon concomitante (environ 50 % dans chaque bras).
L’autre étude pivot, une étude randomisée en 3 groupes parallèles incluant un total de 718 patients, a retrouvé une supériorité de dipropionate de béclométasone/formotérol fumarate par rapport au formotérol en termes de modification du VEMS mesuré avant administration de la dose à la fin du traitement (48 semaines), et a montré une non‑infériorité de dipropionate de béclométasone/formotérol fumarate par rapport à l’association fixe budésonide/formotérol sur le même paramètre.
5.2. Propriétés pharmacocinétiques
Dans une étude pharmacocinétique menée chez des sujets sains traités par une dose unique de l'association fixe dipropionate de béclométasone/formotérol fumarate (4 bouffées de 100/6 microgrammes) ou par une dose unique de dipropionate de béclométasone CFC (4 bouffées de 250 microgrammes) et de formotérol HFA (4 bouffées de 6 microgrammes), l'ASC du principal métabolite actif du dipropionate de béclométasone (17‑monopropionate de béclométasone) et sa concentration plasmatique maximale ont été réduites de 35 % et 19 % respectivement, avec l'association fixe, comparativement à la formulation non extrafine de dipropionate de béclométasone CFC ; par contre, la vitesse d'absorption était plus rapide (0,5 heure contre 2 heures) avec l'association fixe qu'avec la formulation non extrafine de dipropionate de béclométasone CFC seul.
Pour le formotérol, les concentrations plasmatiques maximales étaient similaires après l'administration de l'association fixe et de chacun des principes actifs administrés séparément et l'exposition systémique était légèrement plus élevée avec dipropionate de béclométasone/formotérol fumarate que lorsque les produits étaient administrés séparément.
Il n'y a pas d'élément évoquant l'existence d'interactions pharmacocinétiques ou pharmacodynamiques (systémiques) entre le dipropionate de béclométasone et le formotérol.
Dans une étude conduite chez le volontaire sain avec la chambre d'inhalation AeroChamber Plus, il a été observé une augmentation de la déposition pulmonaire du métabolite actif du dipropionate de béclométasone, le 17‑monopropionate de béclométasone, de 41 % et du formotérol de 45 %, par rapport à l'utilisation d'un inhalateur standard. L'exposition systémique totale était inchangée pour le formotérol, réduite de 10 % pour le 17‑monopropionate de béclométasone et augmentée pour le dipropionate de béclométasone sous sa forme inchangée.
Une étude a montré une déposition pulmonaire moyenne de 33 % de la dose nominale chez des patients atteints de BPCO comparativement à 34 % chez les sujets sains et 31 % chez les patients asthmatiques. Les expositions plasmatiques au 17‑monopropionate de béclométasone et au formotérol étaient comparables entre les trois groupes durant les 24 heures suivant l’inhalation. L’exposition totale au dipropionate de béclométasone était plus élevée chez les patients présentant une BPCO que chez les patients asthmatiques et les volontaires sains.
Population pédiatrique
Dipropionate de béclométasone/fumarate de formotérol n'était pas bioéquivalent à l'association libre de dipropionate de béclometasone extrafine et formotérol lorsqu'il était administré chez des adolescents asthmatiques âgés de 12 à 17 ans dans une étude pharmacocinétiques en dose unique (4 bouffées de 100/6 microgrammes). Ce résultat était indépendant de l'utilisation d'une chambre d'inhalation (AeroChamber Plus).
Quand la chambre d'inhalation n'était pas utilisée, les données disponibles tendaient vers une concentration plasmatique maximale plus faible du corticoïde inhalé composant de dipropionate de béclométasone/fumarate de formotérol comparativement à l'association libre (estimation ponctuelle des ratios des moyennes géométriques ajustées pour la Cmax du 17‑monopropionate de béclométasone [B17MP] 84,38 %, IC à 90 % 70,22 ; 101,38).
Quand l’association dipropionate de béclométasone/fumarate de formotérol était utilisée avec la chambre d'inhalation, la concentration plasmatique maximale de formotérol augmentait d'environ 68 % comparativement à l'association libre (estimation ponctuelle des ratios des moyennes géométriques ajustées pour la Cmax 168,41, IC à 90 % de 138,2 ; 205,2). La signification clinique de ces différences en cas d'utilisation chronique n'est pas connue.
L'exposition systémique totale au formotérol (ASC 0-t) était équivalente à celle de l'association libre, indépendamment de l'utilisation de la chambre d'inhalation. Pour le 17‑monopropionate de béclometasone, l'équivalence a été démontrée uniquement lorsque la chambre d'inhalation n'était pas utilisée, alors que l'IC à 90 % de l'ASC 0-t était légèrement en dehors de l'intervalle d'équivalence lorsque la chambre d'inhalation était utilisée (estimation ponctuelle des ratios des moyennes géométriques ajustées 89,63 %, IC 79,93 ; 100,50).
Dipropionate de béclométasone/fumarate de formotérol utilisé sans la chambre d'inhalation chez les adolescents entraînait une exposition systémique totale (ASC 0-t) plus faible du 17‑monopropionate de béclometasone et équivalente du formotérol comparativement à celles observées chez l'adulte. De plus, les concentrations plasmatiques maximales moyennes (Cmax) des deux substances étaient plus faibles chez les adolescents que chez les adultes.
Dans une étude pharmacocinétique en dose unique, dipropionate de béclométasone/fumarate de formotérol 50/6 microgrammes par dose, formulation expérimentale pédiatrique, administré avec l'AeroChamber Plus n'était pas bioéquivalent à l'association libre de diproprionate de béclométasone et formotérol administrés chez des enfants asthmatiques âgés de 5 à 11 ans. Les résultats de l'étude indiquaient une ASC 0-t et une concentration plasmatique maximale du corticoïde inhalé composant de dipropionate de béclométasone/fumarate de formotérol 50/6 plus basses comparativement à l'association libre (estimation ponctuelle des ratios des moyennes géométriques ajustées pour le 17‑monopropionate de béclométasone : ASC 0-t 81 %, IC à 90 % 69,7 ; 94,8 et Cmax : 82 %, IC à 90 % 70,1 ; 94,7). L'exposition systémique totale du formotérol (ASC 0-t) était équivalente à celle de l'association libre, alors que la Cmax était légèrement plus basse pour dipropionate de béclométasone/fumarate de formotérol 50/6 comparativement à l'association libre (estimation ponctuelle des ratios des moyennes géométriques ajustées 92 %, IC à 90 % 78 ; 108).
Dipropionate de béclométasone
Le dipropionate de béclométasone est une pro‑drogue dotée d'une faible affinité de fixation aux récepteurs des glucocorticoïdes et qui est hydrolysée par des enzymes (estérases), donnant naissance à un métabolite actif, le 17‑monopropionate de béclométasone, dont l'activité anti‑inflammatoire topique est plus intense que celle de la pro‑drogue dipropionate de béclométasone.
Absorption, distribution et métabolisme
Après inhalation, le dipropionate de béclométasone est rapidement absorbé par les poumons ; avant l'absorption, il est largement transformé en son métabolite actif, le 17‑monopropionate de béclométasone, sous l'effet d'enzymes estérases présentes dans la plupart des tissus. La disponibilité systémique du métabolite actif est liée à l'absorption pulmonaire (36 %) et à l'absorption gastro‑intestinale de la fraction déglutie. La biodisponibilité du dipropionate de béclométasone dégluti est négligeable, mais la transformation présystémique en 17‑monopropionate de béclométasone aboutit à une résorption de 41 % sous la forme du métabolite actif.
L'exposition systémique augmente de façon à peu près linéaire avec la dose inhalée.
Après inhalation, la biodisponibilité absolue est d'environ 2 % de la dose nominale pour le dipropionate de béclométasone inchangé et 62 % pour le 17‑monopropionate de béclométasone.
Après administration intraveineuse, la pharmacocinétique du dipropionate de béclométasone et de son métabolite actif se caractérise par une clairance plasmatique élevée (150 et 120 litres/heure respectivement), avec un volume de distribution à l'état d'équilibre faible pour le dipropionate de béclométasone (20 litres) et une distribution tissulaire plus importante pour son métabolite actif (424 litres).
Le taux de liaison aux protéines plasmatiques est modéré.
Élimination
Le dipropionate de béclométasone est essentiellement excrété par voie fécale, principalement sous la forme de métabolites polaires. L'excrétion rénale du dipropionate de béclométasone et de ses métabolites est négligeable. La demi‑vie d'élimination terminale est de 0,5 heure pour le dipropionate de béclométasone et de 2,7 heures pour le 17‑monopropionate de béclométasone.
Populations particulières
La pharmacocinétique du dipropionate de béclométasone n'a pas été étudiée chez des patients présentant une insuffisance rénale ou hépatique. Etant donné que le dipropionate de béclométasone est très rapidement métabolisé par les estérases présentes dans le liquide intestinal, le sérum, les poumons et le foie, donnant naissance à des produits plus polaires (21‑monopropionate de béclométasone, 17‑monopropionate de béclométasone et béclométasone), il n'y a pas lieu de penser qu'une insuffisance hépatique modifie la pharmacocinétique et le profil de sécurité du dipropionate de béclométasone.
Etant donné que ni le dipropionate de béclométasone ni ses métabolites n'ont été retrouvés dans les urines, il n'y pas lieu de considérer la possibilité d'une augmentation de l'exposition systémique en cas d'insuffisance rénale.
Formotérol
Absorption et distribution
Après inhalation, le formotérol est absorbé à la fois par les poumons et par le tractus gastro‑intestinal.
La fraction de la dose inhalée qui est déglutie après administration à l'aide d'un aérosol‑doseur est comprise entre 60 % et 90 %. Au moins 65 % de la fraction déglutie sont absorbés par le tractus gastro‑intestinal. Les concentrations plasmatiques maximales du principe actif inchangé sont atteintes en l'espace de 0,5 à 1 heure après administration orale. Le taux de liaison du formotérol aux protéines plasmatiques est de 61-64 %, avec 34 % de liaison à l'albumine. Dans la fourchette des concentrations atteintes aux doses thérapeutiques, on n'a pas observé de phénomène de saturation de la liaison. Après administration orale, la demi‑vie d'élimination est de 2‑3 heures. L'absorption du formotérol est linéaire après l'inhalation de 12 à 96 µg de fumarate de formotérol.
Biotransformation
Le formotérol est largement métabolisé et la voie de transformation métabolique consiste essentiellement en une conjugaison directe au niveau du groupe hydroxyle phénolique. Le conjugué d'acide glucuronique est inactif.
La deuxième voie métabolique essentielle consiste en une O‑déméthylation suivie d'une conjugaison au niveau du groupement phénolique 2'‑hydroxyle. Les iso‑enzymes CYP2D6, CYP2C19 et CYP2C9 du cytochrome P450 interviennent dans la O‑déméthylation du formotérol. La transformation métabolique semble se dérouler essentiellement dans le foie. Aux concentrations thérapeutiques, le formotérol n'induit pas d'inhibition des iso‑enzymes du CYP450.
Élimination
L'excrétion urinaire du formotérol après une inhalation unique à partir d'un inhalateur de poudre sèche augmente de façon linéaire dans la fourchette des doses allant de 12 à 96 µg. En moyenne, 8 % et 25 % de la dose sont excrétés respectivement sous forme inchangée et sous forme de formotérol total. Au vu des concentrations plasmatiques enregistrées après l'inhalation d'une dose unique de 120 µg chez 12 sujets sains, la demi‑vie d'élimination terminale est en moyenne de 10 heures. Les énantiomères (R, R) et (S, S) représentent respectivement environ 40 % et 60 % du médicament inchangé excrété dans les urines. La proportion relative des deux énantiomères reste constante dans toute la fourchette des doses étudiées et rien n'indique une accumulation de l'un des énantiomères après administration répétée.
Après administration orale (40 à 80 µg), 6 % à 10 % de la dose ont été retrouvés dans les urines sous forme intacte chez des sujets sains ; jusqu'à 8 % de la dose étaient retrouvés sous la forme du glucuronide.
En tout, 67 % d'une dose orale de formotérol sont excrétés dans les urines (essentiellement sous forme métabolisée) et le reste dans les selles. La clairance rénale du formotérol est de 150 mL/min.
Populations particulières
Insuffisance hépatique/rénale : la pharmacocinétique du formotérol n'a pas été étudiée chez des patients présentant une insuffisance hépatique ou rénale. Néanmoins, le formotérol étant principalement éliminé par métabolisation hépatique, une augmentation de l’exposition est attendue en cas de cirrhose hépatique sévère.
5.3. Données de sécurité préclinique
Les études menées chez le rat pour étudier la toxicité sur la reproduction ont montré des effets dose‑dépendants. L'association a provoqué une réduction de la fertilité des femelles et une toxicité embryofœtale. Il est bien connu que chez les animaux gravides, les doses fortes de corticoïdes provoquent des anomalies du développement fœtal, notamment des fentes palatines et un retard de croissance intra‑utérin et les effets constatés avec l'association dipropionate de béclométasone/formotérol étaient donc probablement imputables au dipropionate de béclométasone. Ces effets n'ont été observés qu'à de fortes expositions systémiques au métabolite actif, le 17‑monopropionate de béclométasone (200 fois les taux plasmatiques prévus en clinique). Les études animales ont en outre montré un allongement de la durée de la gestation et de la mise‑bas, ce qui s'explique par les effets tocolytiques bien connus des bêta2‑sympathomimétiques. Ces effets ont été constatés à des taux plasmatiques maternels de formotérol inférieurs aux taux prévus chez les patients traités par dipropionate de béclométasone/formotérol fumarate.
Les études de génotoxicité menées avec l'association dipropionate de béclométasone/formotérol n'indiquent pas de potentiel mutagène. Aucune étude de carcinogénicité n'a été menée avec l'association considérée. Cependant, les données obtenues chez l'animal avec chacun des principes actifs de l'association ne suggèrent aucun risque de carcinogénicité chez l'Homme.
Les données non cliniques concernant le gaz propulseur HFA‑134a sans CFC issues des études conventionnelles de pharmacologie de sécurité, toxicologie en administration répétée, génotoxicité, cancérogénèse, et des fonctions de reproduction, n’ont pas révélé de risque particulier pour l’homme.
Ethanol anhydre, eau pour préparations injectables, acide maléique, norflurane (HFA‑134a)
21 mois
Avant la délivrance au patient : 18 mois
Après la première ouverture : 3 mois
6.4. Précautions particulières de conservation
Boîte contenant un flacon de 120 doses
Avant la délivrance au patient :
A conserver au réfrigérateur en position verticale (entre 2 et 8 °C) pendant 18 mois au maximum.
Après la délivrance au patient :
A conserver à une température ne dépassant pas 25 °C pendant 3 mois au maximum.
Boîte contenant deux flacons de 120 doses chacun
Avant la délivrance au patient :
A conserver au réfrigérateur en position verticale (entre 2 et 8 °C).
Après la délivrance au patient :
Le patient doit être informé que les deux flacons doivent être conservés au réfrigérateur en position verticale (entre 2 et 8 °C) jusqu’à utilisation.
La cartouche contient un liquide pressurisé. Ne pas exposer à des températures supérieures à 50 °C. Ne pas percer la cartouche.
6.5. Nature et contenu de l'emballage extérieur
La solution pour inhalation est contenue dans un flacon pressurisé en aluminium doté d’une valve doseuse. Le flacon pressurisé est placé dans un inhalateur en plastique blanc doté d’un capuchon anti-poussière de couleur rose. L’inhalateur est équipé d’un compteur intégré de doses, comptabilisant chaque pulvérisation et affichant chaque 20ème pulvérisation.
Présentation :
1 flacon pressurisé délivrant 120 doses équivalent à 9,3 g de solution pour inhalation.
ou
2 flacons pressurisés délivrant 120 doses chacun équivalent à 9,3 g de solution pour inhalation.
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
Pour les pharmacies :
Inscrire sur la boîte la date de remise au patient.
Vérifier qu'il s'écoulera bien au moins 3 mois entre la date de remise du médicament au patient et la date de péremption imprimée sur l'emballage.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
1, RUE DE TURIN
69007 LYON
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 302 619 5 8 : 120 doses en flacon pressurisé (Aluminium) avec valve doseuse.
· 34009 302 756 4 1 : 120 doses en flacon pressurisé (Aluminium) avec valve doseuse. Boite de 2.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Liste I
ANSM - Mis à jour le : 19/08/2025
Dipropionate de béclométasone/Fumarate de formotérol dihydraté
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin, votre pharmacien ou votre infirmier/ère.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, votre pharmacien ou votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que BECLOMETASONE/FORMOTEROL VIATRIS 100/6 microgrammes/dose, solution pour inhalation en flacon pressurisé et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d’utiliser BECLOMETASONE/FORMOTEROL VIATRIS 100/6 microgrammes/dose, solution pour inhalation en flacon pressurisé ?
3. Comment utiliser BECLOMETASONE/FORMOTEROL VIATRIS 100/6 microgrammes/dose, solution pour inhalation en flacon pressurisé ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver BECLOMETASONE/FORMOTEROL VIATRIS 100/6 microgrammes/dose, solution pour inhalation en flacon pressurisé ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE BECLOMETASONE/FORMOTEROL VIATRIS 100/6 microgrammes/dose, solution pour inhalation en flacon pressurisé ET DANS QUELS CAS EST-IL UTILISE ?
Les deux substances actives sont le dipropionate de béclométasone et le fumarate de formotérol dihydraté. Le dipropionate de béclométasone appartient à un groupe de médicaments appelés corticostéroïdes (ou corticoïdes) qui exercent un effet anti‑inflammatoire et réduit l'inflammation et l'irritation dans vos poumons.
Le fumarate de formotérol dihydraté appartient à un groupe de médicaments appelés « bronchodilatateurs de longue durée d'action » qui provoquent un relâchement des muscles des voies respiratoires et vous aident à respirer plus facilement.
L'association de ces deux substances actives que ce soit pour les patients asthmatiques ou présentant une broncho‑pneumopathie chronique obstructive (BPCO) facilite la respiration en soulageant les symptômes tels que l'essoufflement, les sifflements respiratoires et la toux et aide également à éviter la survenue de ces symptômes.
Asthme
BECLOMETASONE/FORMOTEROL VIATRIS est destiné au traitement régulier de l'asthme chez l’adulte lorsque :
· l'asthme n'est pas correctement contrôlé par des corticoïdes inhalés et des bronchodilatateurs de courte durée d'action utilisés « à la demande ».
ou
· l'asthme répond bien au traitement associant des corticoïdes et des bronchodilatateurs de longue durée d'action.
Bronchopneumopathie chronique obstructive (BPCO)
BECLOMETASONE/FORMOTEROL VIATRIS est également préconisé pour le traitement de la broncho‑pneumopathie chronique obstructive (BPCO) sévère chez l’adulte. La BPCO est une maladie chronique des voies aériennes des poumons souvent causée par le tabagisme.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER BECLOMETASONE/FORMOTEROL VIATRIS 100/6 microgrammes/dose, solution pour inhalation en flacon pressurisé ?
· si vous êtes allergique ou pensez être allergique à l'un ou l'autre des principes actifs contenus dans BECLOMETASONE/FORMOTEROL VIATRIS, de même que si vous êtes allergique à d'autres médicaments ou médicaments pour inhalation utilisés pour le traitement de l'asthme ou à l'un des autres composants de BECLOMETASONE/FORMOTEROL VIATRIS (voir rubrique 6. Contenu de l’emballage et autres informations), demandez conseil à votre médecin.
Avertissements et précautions
Adressez-vous à votre médecin, pharmacien ou votre infirmier/ère avant d’utiliser BECLOMETASONE/FORMOTEROL VIATRIS 100/6 microgrammes/dose, solution pour inhalation en flacon pressurisé :
· si vous souffrez de troubles cardiaques tels qu'angine de poitrine (douleur cardiaque, douleur thoracique), si vous avez récemment eu une crise cardiaque (infarctus du myocarde), en cas d'insuffisance cardiaque, de rétrécissement des artères du cœur (cardiopathie coronarienne), de maladie des valves cardiaques ou d'autre anomalie cardiaque connue ou si vous souffrez d'une maladie appelée cardiomyopathie hypertrophique obstructive (également appelée CMHo, une anomalie du myocarde) ;
· si vous présentez un rétrécissement des artères (du fait d'une artériosclérose), si vous avez une hypertension artérielle ou si vous savez que vous avez un anévrisme (dilatation anormale de la paroi d'un vaisseau sanguin) ;
· si vous présentez des troubles du rythme cardiaque tels qu'accélération ou irrégularité des battements cardiaques, pouls rapide ou palpitations ou si vous savez que votre électrocardiogramme est anormal ;
· si vous avez une hyperactivité de votre glande thyroïde ;
· si votre taux sanguin de potassium est faible ;
· si vous avez une maladie quelconque du foie ou des reins ;
· si vous êtes diabétique (en effet, si vous inhalez de fortes doses de formotérol votre taux sanguin de glucose risque d'augmenter et il peut donc être nécessaire de vérifier votre glycémie en début de traitement puis de façon rapprochée pendant le traitement) ;
· si vous avez une tumeur de la glande surrénale (appelée phéochromocytome) ;
· si une anesthésie est prévue : suivant le type d'anesthésique, il peut être nécessaire d'arrêter l'utilisation de BECLOMETASONE/FORMOTEROL VIATRIS au moins 12 heures avant l’anesthésie ;
· si vous êtes actuellement traité(e) ou avez déjà été traité(e) un jour pour une tuberculose ou si vous présentez une infection pulmonaire virale ou fongique connue ;
· si vous devez éviter de consommer de l'alcool quelle qu'en soit la raison.
Si vous présentez l'une des caractéristiques mentionnées plus haut, prévenez toujours votre médecin avant d'utiliser BECLOMETASONE/FORMOTEROL VIATRIS 100/6 microgrammes/dose, solution pour inhalation en flacon pressurisé.
Si vous avez ou avez eu par le passé des problèmes de santé quels qu'ils soient ou des allergies ou si vous n'êtes pas certain de pouvoir utiliser BECLOMETASONE/FORMOTEROL VIATRIS, consultez votre médecin, une infirmière connaissant l'asthme ou votre pharmacien, avant d'utiliser l'inhalateur.
Un traitement par un agoniste bêta‑2 tel que le formotérol contenu dans BECLOMETASONE/FORMOTEROL VIATRIS peut rarement provoquer une diminution du taux sérique de potassium (hypokaliémie).
Si votre asthme est grave, vous devez être particulièrement prudent. En effet, la carence en oxygène dans le sang et certains autres traitements que vous utilisez en même temps que BECLOMETASONE/FORMOTEROL VIATRIS, par exemple des médicaments pour le traitement des maladies cardiaques ou de l'hypertension artérielle (« diurétiques ») ou d'autres médicaments utilisés pour le traitement de l'asthme, peuvent aggraver la diminution des taux de potassium. C'est pourquoi votre médecin décidera éventuellement de contrôler de temps à autre votre taux sanguin de potassium.
Si vous utilisez des doses fortes de corticoïdes inhalés pendant une durée prolongée, il se peut que vous ayez besoin de plus de corticoïdes en cas de stress. Les situations de stress consistent par exemple en une hospitalisation après un accident, un accident grave ou une intervention chirurgicale prévue. Dans une telle situation, votre médecin traitant déterminera si vous avez besoin d'augmenter votre dose de corticoïdes et vous prescrira au besoin des comprimés ou des injections de corticoïdes.
Si vous devez aller à l'hôpital, n'oubliez pas d'emporter tous vos médicaments et inhalateurs, y compris BECLOMETASONE/FORMOTEROL VIATRIS et les médicaments ou comprimés achetés sans ordonnance, dans leur emballage d'origine, si possible.
Consultez votre médecin en cas de vision floue ou d’autres troubles visuels.
Enfants et adolescents
Ne pas utiliser BECLOMETASONE/FORMOTEROL VIATRIS chez l’enfant et l’adolescent de moins de 18 ans tant que des données complémentaires ne sont pas disponibles.
Autres médicaments et BECLOMETASONE/FORMOTEROL VIATRIS 100/6 microgrammes/dose, solution pour inhalation en flacon pressurisé
Informez votre médecin si vous prenez ou avez récemment pris tout autre médicament, y compris des médicaments en vente libre.
Certains médicaments peuvent augmenter les effets de BECLOMETASONE/FORMOTEROL VIATRIS et il est possible que votre médecin souhaite vous surveiller attentivement si vous prenez ces médicaments (y compris certains médicaments pour traiter l’infection à VIH : ritonavir, cobicistat).
N'utilisez pas de bêta‑bloquants en même temps que ce médicament. Les bêta-bloquants tels que l’aténolol, le propranolol et le sotalol sont utilisés pour traiter un certain nombre d'affections, notamment l’hypertension artérielle et les affections cardiaques telles que les anomalies du rythme cardiaque et l’insuffisance cardiaque ; le timolol est utilisé pour traiter le glaucome. Si vous avez besoin d'un traitement bêta‑bloquant (y compris sous forme de collyre), l'effet du formotérol risque d'être affaibli, voire totalement neutralisé. A l'inverse, l'emploi d'autres médicaments bêta‑adrénergiques (médicaments qui agissent comme le formotérol) risque d'accentuer les effets du formotérol.
Utilisation de BECLOMETASONE/FORMOTEROL VIATRIS 100/6 microgrammes/dose, solution pour inhalation en flacon pressurisé en même temps que d'autres médicaments
· Certains médicaments destinés au traitement des anomalies du rythme cardiaque (quinidine, disopyramide, procaïnamide), des médicaments destinés au traitement des réactions allergiques (antihistaminiques), des médicaments destinés au traitement des symptômes de dépression ou des troubles psychiques, tels que les inhibiteurs de la monoamine oxydase (par exemple phénelzine et isocarboxazide), les antidépresseurs tricycliques (par exemple amitryptiline et imipramine) et les phénothiazines peuvent provoquer des modifications de l'électrocardiogramme (ECG, enregistrement de l'activité électrique du cœur). Ils peuvent aussi augmenter le risque de trouble du rythme cardiaque (arythmies ventriculaires).
· Certains médicaments destinés au traitement de la maladie de Parkinson (L‑dopa) ou de l'insuffisance thyroïdienne (L‑thyroxine), des médicaments contenant de l'ocytocine (laquelle provoque des contractions utérines) et l'alcool peuvent diminuer la tolérance cardiaque aux agonistes bêta‑2 tels que le formotérol.
· Les inhibiteurs de la monoamine‑oxydase (IMAO), de même que les médicaments dotés de propriétés similaires comme la furazolidone et la procarbazine, utilisés pour le traitement des troubles psychiques, peuvent provoquer une augmentation de la pression artérielle.
· Les médicaments destinés au traitement des maladies cardiaques (digoxine) peuvent provoquer une diminution du taux sanguin de potassium, ce qui peut augmenter le risque de troubles du rythme cardiaque.
· D'autres médicaments utilisés pour le traitement de l'asthme (théophylline, aminophylline ou corticoïdes) et certains diurétiques (comprimés destinés à augmenter l'élimination d'eau) peuvent provoquer une diminution du taux sanguin de potassium.
· Certains anesthésiques peuvent aggraver le risque de troubles du rythme cardiaque.
Grossesse, allaitement et fertilité
Il n'existe pas de données cliniques concernant l'utilisation de BECLOMETASONE/FORMOTEROL VIATRIS pendant la grossesse. Vous ne devez pas utiliser BECLOMETASONE/FORMOTEROL VIATRIS si vous êtes enceinte, si vous suspectez une grossesse ou si vous envisagez une grossesse, de même que si vous allaitez, sauf indication contraire de votre médecin.
Conduite de véhicules et utilisation de machines
Il est peu probable que BECLOMETASONE/FORMOTEROL VIATRIS perturbe votre aptitude à conduire et à utiliser des machines. Cependant, si vous présentez des effets indésirables, notamment vertiges et/ou tremblements, votre aptitude à conduire ou à utiliser des machines peut en être affectée.
BECLOMETASONE/FORMOTEROL VIATRIS 100/6 microgrammes/dose, solution pour inhalation en flacon pressurisé contient de l’alcool
BECLOMETASONE/FORMOTEROL VIATRIS 100/6 microgrammes/dose, solution pour inhalation en flacon pressurisé contient 7 mg d’alcool (éthanol) par bouffée. La quantité d’alcool dans ce médicament équivaut à moins de 1 ml de vin ou de bière.
La faible quantité d’alcool contenue dans ce médicament n’a aucun effet notable.
3. COMMENT UTILISER BECLOMETASONE/FORMOTEROL VIATRIS 100/6 microgrammes/dose, solution pour inhalation en flacon pressurisé ?
BECLOMETASONE/FORMOTEROL VIATRIS doit uniquement être utilisé en inhalation. BECLOMETASONE/FORMOTEROL VIATRIS doit être inhalé par la bouche vers vos poumons.
Veillez à toujours prendre ce médicament en suivant exactement les indications de votre médecin ou pharmacien. Vérifiez auprès de votre médecin ou pharmacien en cas de doute. Le pharmacien vous indiquera le nombre de bouffées que vous devez prendre et à quelle fréquence.
Posologie
Asthme
Votre médecin effectuera régulièrement un bilan pour vérifier que votre traitement avec BECLOMETASONE/FORMOTEROL VIATRIS 100/6 microgrammes/dose, solution pour inhalation en flacon pressurisé correspond à la dose optimale. Il vous prescrira la dose minimale qui contrôle efficacement vos symptômes.
BECLOMETASONE/FORMOTEROL VIATRIS peut être prescrit par votre médecin selon deux schémas posologiques :
a. BECLOMETASONE/FORMOTEROL VIATRIS peut vous être prescrit quotidiennement pour traiter votre asthme avec, si besoin, un inhalateur de secours séparé pour soulager l’aggravation soudaine des symptômes d’asthme tels qu’essoufflements, sifflements et toux.
Adultes et patients âgés
La dose recommandée de ce médicament est de 1 ou 2 bouffées deux fois par jour. La dose journalière maximale est de 4 bouffées.
N'oubliez pas que vous devez toujours avoir sur vous votre inhalateur de secours à effet rapide pour traiter l'aggravation aiguë des symptômes d'asthme ou une crise d'asthme survenant brutalement.
b. BECLOMETASONE/FORMOTEROL VIATRIS peut vous être prescrit quotidiennement pour traiter votre asthme et aussi, si besoin, pour soulager l’aggravation soudaine des symptômes de votre asthme tels que : essoufflement, sifflements et toux.
Adultes et patients âgés
La dose recommandée de ce médicament est d’une bouffée le matin et une bouffée le soir.
Vous pouvez également utiliser BECLOMETASONE/FORMOTEROL VIATRIS comme inhalateur de secours en cas d’apparition de symptômes aigus d’asthme.
En cas de symptômes d’asthme, prenez une bouffée et attendez quelques minutes
Si vous ne sentez pas d’amélioration, prenez une autre bouffée
Ne prenez pas plus de 6 bouffées de secours de BECLOMETASONE/FORMOTEROL VIATRIS par jour.
La dose journalière maximale de BECLOMETASONE/FORMOTEROL VIATRIS utilisé seul est de 8 bouffées.
Si vous sentez que vous avez besoin de prendre plus de bouffées chaque jour pour contrôler vos symptômes d’asthme, contactez votre médecin pour lui demander conseil. Il se peut qu’il soit amené à changer votre traitement.
Enfants et adolescents de moins de 18 ans
Ce médicament n'est pas destiné aux enfants ni aux adolescents de moins de 18 ans.
Broncho‑pneumopathie chronique obstructive (BPCO)
Adultes et patients âgés
La dose recommandée est deux bouffées le matin et deux bouffées le soir.
Patients exposés à des risques spécifiques
Il est inutile d'ajuster la dose chez les patients âgés. Il n'existe pas d'informations concernant l'emploi de BECLOMETASONE/FORMOTEROL VIATRIS en cas de maladie du foie ou des reins.
BECLOMETASONE/FORMOTEROL VIATRIS peut exercer un effet pour le traitement de l'asthme à une dose de dipropionate de béclométasone qui peut être inférieure à celle d'autres inhalateurs de dipropionate de béclométasone. Si vous utilisiez précédemment un inhalateur différent contenant du dipropionate de béclométasone, votre médecin vous indiquera précisément la dose de BECLOMETASONE/FORMOTEROL VIATRIS que vous devez employer pour traiter votre asthme.
N'augmentez pas la dose
Si vous avez l'impression que le médicament n'est pas très efficace, parlez‑en à votre médecin avant d'augmenter la dose.
Si vos troubles respiratoires s'aggravent
Si vous ressentez une aggravation de l'essoufflement ou si vous percevez des sifflements respiratoires qui surviennent immédiatement après l'inhalation de votre médicament, cessez immédiatement les prises de BECLOMETASONE/FORMOTEROL VIATRIS et utilisez votre inhalateur contenant un bronchodilatateur à effet rapide qui vous a été prescrit en traitement de secours en cas de symptômes aigus. Consultez rapidement votre médecin. Il évaluera la sévérité de vos symptômes et si nécessaire changera votre traitement en vous prescrivant un médicament différent.
Voir aussi rubrique 4. Quels sont les effets indésirables éventuels ?
Si votre asthme s'aggrave :
Si vos symptômes s'aggravent ou deviennent difficiles à maîtriser (par exemple, si vous êtes obligés de recourir plus souvent que d’habitude à un inhalateur de secours ou à BECLOMETASONE/FORMOTEROL VIATRIS en tant qu’inhalateur de secours) ; que ni l’un ni l’autre ne suffit à améliorer vos symptômes, consultez immédiatement votre médecin. Il se peut que votre asthme s'aggrave et votre médecin devra peut‑être modifier votre dose de BECLOMETASONE/FORMOTEROL VIATRIS ou vous prescrire un autre traitement.
Si vous avez d'autres questions concernant l'emploi de ce médicament, n'hésitez pas à interroger votre médecin ou pharmacien.
Mode d'emploi
Ce médicament est présenté sous forme d’une cartouche pressurisée introduite dans un inhalateur en plastique et d’un embout buccal. Un compteur de doses se trouve sur le devant de l’inhalateur, il vous indiquera le nombre de doses restantes. A chaque fois que vous appuyez sur la cartouche, une bouffée est libérée.
L’inhalateur est équipé d’un compteur intégré de doses, comptabilisant chaque pulvérisation et affichant chaque 20ème pulvérisation. Le compteur de doses va montrer approximativement le nombre de pulvérisations restantes dans la cartouche. La fenêtre du compteur de doses affiche le nombre moyen de pulvérisations restantes dans l’inhalateur en unités de 20 (par ex. 120, 100, 80 etc.). Quand 20 pulvérisations restent, le compteur affiche le nombre 20 sur un fond à moitié rouge et blanc, indiquant que l’inhalateur est presque vide.
Quand 120 pulvérisations ont été effectuées, l’affichage montre le chiffre 0 sur un fond rouge. L’indicateur de dose s’arrêtera de fonctionner à « 0 ».
Testez votre inhalateur
Avant d'utiliser l'inhalateur pour la première fois ou si vous ne l'avez pas employé pendant plus de 14 jours, vous devez tester votre inhalateur pour vérifier son bon fonctionnement.
1. Retirez le capuchon protecteur de l’embout buccal
2. Tenez l’inhalateur verticalement, l’embout buccal dirigé vers le bas.
3. Tenez l’embout buccal éloigné de vous
4.a. Si vous utilisez l’inhalateur pour la première fois, appuyez fermement sur la cartouche 3 fois pour libérer une bouffée à chaque pression.
4.b. Si vous n’avez pas utilisé l’inhalateur depuis 14 jours ou plus, appuyez fermement sur la cartouche pour libérer une bouffée.
5. Vérifiez le compteur de doses. Si vous testez votre inhalateur pour la première fois, le compteur de doses doit afficher 120.
|
|
Comment utiliser votre inhalateur
Dans la mesure du possible, pour l’administration du médicament vous devez vous tenir en position assise à la verticale ou debout. Avant l’inhalation, contrôler le compteur de doses :
Un nombre entre « 1 » et « 120 » indique qu’il reste des doses. Si le compteur indique « 0 » il n’y a plus de doses – jetez l’inhalateur et prenez en un nouveau.
|
|
|
|
|
|
1. Retirez le capuchon protecteur de l'embout buccal et vérifiez que ce dernier est bien propre, non poussiéreux et dénué de saleté ou de tout autre corps étranger.
2. Expirez aussi lentement et profondément que possible.
3. Tenez la cartouche verticalement la tête du dispositif dirigé vers le bas et enserrez l'embout buccal entre vos lèvres. Ne mordez pas l'embout buccal.
4. Inspirez lentement et profondément par la bouche et, juste après avoir commencé à inspirer, appuyez fermement sur le haut de l’inhalateur pour libérer une bouffée.
5. Retenez votre respiration aussi longtemps que possible et ensuite retirez l'inhalateur de votre bouche et expirez lentement. N'expirez pas dans l'inhalateur.
Si vous devez inhaler une autre bouffée, maintenez l'inhalateur en position verticale pendant environ 30 secondes puis répétez les étapes 2 à 5.
Important : N'allez pas trop vite pour les étapes 2 à 5.
Après l’emploi, fermez l’inhalateur en remettant le capuchon protecteur et vérifiez le compteur de doses.
Quand remplacer votre inhalateur
Pensez à vous procurer un nouvel inhalateur lorsque le compteur de doses affiche 20 doses et que la couleur du compteur de doses passe du blanc au rouge. Arrêtez d’utiliser l’inhalateur lorsque le compteur de doses affiche 0. En effet, les bouffées restantes dans le dispositif peuvent ne pas délivrer la dose complète de traitement.
Si vous voyez un « nuage » s'échapper du haut de l'inhalateur ou des côtés de votre bouche, cela signifie que BECLOMETASONE/FORMOTEROL VIATRIS n’atteint pas vos poumons comme il se doit. Prenez une autre bouffée, en suivant les instructions de l'étape 2.
Chez les patients présentant une faiblesse de préhension, la manipulation de l'appareil peut être facilitée en tenant l'inhalateur à deux mains. Dans ce cas, il faut placer les index sur le haut de la cartouche de l'inhalateur et les deux pouces à la base de l'inhalateur.
Pour réduire le risque d'infection fongique dans la bouche et la gorge, rincez‑vous la bouche ou faites des gargarismes avec de l'eau ou brossez‑vous les dents chaque fois que vous utilisez votre inhalateur.
Si vous avez l'impression que l'effet de BECLOMETASONE/FORMOTEROL VIATRIS est excessif ou au contraire trop faible, consultez votre médecin ou votre pharmacien.
S'il vous semble difficile de faire fonctionner l'inhalateur tout en inspirant, vous pouvez utiliser la chambre d'inhalation AeroChamber Plus. Demandez conseil à votre médecin, pharmacien ou à une infirmière. Il est important que vous lisiez la notice fournie avec votre chambre d'inhalation AeroChamber Plus et que vous suiviez avec attention les instructions d’utilisation et de nettoyage qui y figurent.
Nettoyage de l’inhalateur
Nettoyez l’inhalateur une fois par semaine. N’enlevez jamais la cartouche de l’inhalateur pendant le nettoyage et ne rincez pas à l'eau ou à tout autre liquide pour le nettoyer.
Pour nettoyer l’inhalateur :
1. Retirez le capuchon de protection de l’embout buccal.
2. Essuyez l’intérieur et l’extérieur de l’embout buccal de l’inhalateur à l’aide d’un chiffon propre et sec.
3. Replacez le capuchon sur l’embout buccal.
Si vous avez utilisé plus de BECLOMETASONE/FORMOTEROL VIATRIS 100/6 microgrammes/dose, solution pour inhalation en flacon pressurisé que vous n’auriez dû
· L'utilisation d'une dose excessive de formotérol peut induire les effets suivants : nausées, vomissements, accélération de la fréquence des battements cardiaques, palpitations, troubles du rythme des battements cardiaques, certaines formes de modifications de l'électrocardiogramme (enregistrement de l'activité électrique du cœur à l'aide d'un appareil électrocardiographe), maux de tête, tremblement, sensation de somnolence, excès d'acide dans le sang, diminution du taux sanguin de potassium et augmentation du taux sanguin de sucre. Votre médecin vous prescrira éventuellement des prises de sang pour contrôler vos taux sanguins de potassium et de glucose.
· L'utilisation de doses excessives de dipropionate de béclométasone peut provoquer des perturbations de la fonction des glandes surrénales à court terme. Cependant, ces anomalies s'amélioreront en l'espace de quelques jours. Au besoin, votre médecin contrôlera vos taux sanguins de cortisol.
Si vous présentez l'un quelconque de ces symptômes, prévenez votre médecin.
Si vous oubliez d’utiliser BECLOMETASONE/FORMOTEROL VIATRIS 100/6 microgrammes/dose, solution pour inhalation en flacon pressurisé
Utilisez le médicament dès que vous constatez cet oubli. Si l'heure de la prochaine prise est proche, vous pouvez attendre pour inhaler la dose suivante à l'heure prévue. Ne prenez pas de dose double.
Si vous arrêtez d’utiliser BECLOMETASONE/FORMOTEROL VIATRIS 100/6 microgrammes/dose, solution pour inhalation en flacon pressurisé
Ne réduisez pas la dose et n’arrêtez pas de prendre le médicament. Même si vous vous sentez mieux, ne réduisez pas la dose et n'arrêtez pas le traitement sans prendre l'avis de votre médecin. Si vous souhaitez réduire la dose ou arrêter de prendre le médicament, consultez votre médecin. Vous devez utiliser BECLOMETASONE/FORMOTEROL VIATRIS régulièrement, même quand vous n'avez pas de symptômes.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Effets indésirables graves
Comme avec les autres traitements en inhalation, il y a un risque de survenue d'une aggravation de l'essoufflement et des sifflements respiratoires immédiatement après l'emploi de BECLOMETASONE/FORMOTEROL VIATRIS. Ce phénomène est appelé « bronchospasme paradoxal ». S'il se produit, vous devez immédiatement ARRETER d'utiliser BECLOMETASONE/FORMOTEROL VIATRIS et utiliser aussitôt votre inhalateur de secours à effet rapide pour traiter les symptômes (essoufflement et sifflements respiratoires). Vous devez immédiatement consulter votre médecin.
Informez immédiatement votre médecin en cas d’apparition de réactions d'hypersensibilité telles qu'allergies cutanées, démangeaisons, éruption, rougeur de la peau, gonflement de la peau ou des muqueuses, en particulier des yeux, du visage, des lèvres et de la gorge.
Autres effets indésirables
Les autres effets indésirables possibles sont énumérés ci‑dessous en fonction de leur fréquence.
Fréquents (survenant chez moins d'un patient sur 10) :
· Infections fongiques (de la bouche et de la gorge),
· Maux de tête,
· Enrouement,
· Mal de gorge.
· Pneumonie (infection pulmonaire) chez les patients atteints de bronchopneumopathie chronique obstructive (BPCO) : informez votre médecin si vous présentez l’un des symptômes suivants pendant votre traitement par BECLOMETASONE/FORMOTEROL VIATRIS, car cela pourrait indiquer une infection pulmonaire :
o fièvre ou frissons
o augmentation ou changement de coloration des expectorations (crachats)
o augmentation de la toux ou aggravation de l'essoufflement
Peu fréquents (survenant chez moins d'un patient sur 100) :
· Accélération anormale de la fréquence cardiaque et trouble du rythme cardiaque
· Modifications de l'électrocardiogramme (ECG)
· Crise d'asthme
· Tremblement
· Agitation
· Etourdissement
· Palpitations
· Symptômes de type grippal
· Infections fongiques du vagin
· Inflammation des sinus
· Inflammation de l'oreille
· Irritation de la gorge
· Toux et toux productive
· Nausées
· Anomalie ou perturbation du goût
· Sensation de brûlure des lèvres
· Sécheresse de la bouche
· Difficultés de déglutition
· Indigestion
· Problèmes d'estomac
· Diarrhée
· Douleurs et crampes musculaires
· Rougeur du visage
· Transpiration excessive
· Augmentation du débit sanguin dans certains tissus du corps
· Rhinite
· Altération de certaines composantes du sang
· Diminution du nombre de globules blancs
· Augmentation du nombre de plaquettes
· Diminution du taux sanguin de potassium
· Augmentation de la glycémie
· Augmentation du taux sanguin d'insuline, d'acides gras libres et de cétones
· Urticaire ou éruption cutanées
Les effets indésirables suivants ont également été rapportés chez les patients présentant une broncho‑pneumopathie chronique obstructive avec une fréquence classée comme peu fréquente :
· Réduction du taux de cortisol dans le sang : ceci est dû à l’effet des corticoïdes sur votre glande surrénale
· Battements de cœur irréguliers
Rares (survenant chez moins d'un patient sur 1 000) :
· Sensation d'oppression thoracique
· Omission d'un battement cardiaque
· Augmentation ou diminution de la pression artérielle
· Inflammation des reins
· Gonflement de la peau et des muqueuses persistant pendant plusieurs jours.
Très rares (survenant chez moins d'un patient sur 10 000) :
· Aggravation de l'asthme
· Essoufflement
· Diminution du nombre de plaquettes sanguines
· Œdème des mains et des pieds.
Dans de très rares cas, l'inhalation de fortes doses de corticoïdes pendant une durée prolongée peut provoquer des effets généraux :
· Anomalies du fonctionnement des glandes surrénales (blocage surrénalien)
· Augmentation de la pression dans les yeux (glaucome)
· Cataracte
· Retard de croissance chez les enfants et adolescents
· Diminution de la densité minérale osseuse (fragilisation des os)
Fréquence indéterminée (ne peut être estimé sur la base des données disponibles)
· Troubles du sommeil, dépression ou anxiété, agitation, nervosité, surexcitation ou irritabilité sont des effets plus susceptibles de survenir notamment chez l’enfant.
· Vision floue
Les effets suivants sont plus susceptibles de survenir chez l’enfant
· Troubles du sommeil
· Dépression ou anxiété
· Agitation
· Nervosité
· Surexcitation
· Irritabilité
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez‑en à votre médecin, votre pharmacien ou à votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER BECLOMETASONE/FORMOTEROL VIATRIS 100/6 microgrammes/dose, solution pour inhalation en flacon pressurisé ?
Tenir ce médicament hors de la vue et de la portée des enfants.
Boîte contenant un flacon de 120 doses
N'utilisez pas ce médicament au-delà de 3 mois après son achat chez votre pharmacien et ne l'utilisez jamais après la date de péremption qui est mentionnée sur la boîte en carton et sur l'étiquette après EXP. La date de péremption fait référence au dernier jour de ce mois.
Boîte contenant deux flacons de 120 doses chacun
Conservez les deux flacons au réfrigérateur en position verticale (entre 2 et 8 °C) jusqu’à utilisation.
Une fois qu’un flacon est sorti du réfrigérateur et ouvert pour le traitement, il peut être conservé à température ambiante (ne dépassant pas 25 °C). Utilisez-le pendant 3 mois maximum, mais jamais au‑delà de la date d’expiration mentionnée sur la boîte et l’étiquette après EXP. La date de péremption fait référence au dernier jour de ce mois.
Si l'inhalateur a été exposé à un froid intense, réchauffez‑le pendant quelques minutes entre vos mains avant de l'utiliser. Ne le réchauffez jamais par une autre source artificielle de chaleur.
Mise en garde : La cartouche contient un liquide pressurisé. Ne pas exposer à des températures supérieures à 50 °C. Ne pas percer la cartouche.
Ne jetez aucun médicament au tout‑à‑l’égout ou avec les ordures ménagères. Retournez tous les inhalateurs utilisés, partiellement utilisés et inutilisés à votre pharmacien, qui les éliminera. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
· Les substances actives sont : dipropionate de béclométasone, fumarate de formotérol dihydraté.
Chaque pulvérisation/dose mesurée contient 100 microgrammes de dipropionate de béclométasone et 6 microgrammes de fumarate de formotérol dihydraté. Equivalent à une dose délivrée (ex-actuator) de 84,6 microgrammes de dipropionate de béclométasone et 5 microgrammes de fumarate de formotérol dihydraté.
· Les autres composants sont :
norflurane (HFA‑134a), éthanol anhydre, acide maléique et eau pour injections.
Ce médicament contient des gaz à effet de serre fluorés.
Chaque inhalateur contient 8,12 g de norflurane (HFA‑134a) correspondant à 0,012 tonne équivalent CO2 (potentiel de réchauffement global (PRG) = 1 430).
Chaque boîte contient :
· un flacon délivrant 120 doses (bouffées) ;
· deux flacons délivrant 120 doses (bouffées) chacun.
Toutes les présentations peuvent ne pas être commercialisées.
BECLOMETASONE/FORMOTEROL VIATRIS est une solution pressurisée contenue dans un flacon pressurisé en aluminium doté d’une valve doseuse. Le flacon pressurisé est placé dans un inhalateur en plastique blanc doté d’un capuchon anti-poussière de couleur rose. L’inhalateur est équipé d’un compteur intégré de doses, comptabilisant chaque pulvérisation et affichant chaque 20ème pulvérisation.
Titulaire de l’autorisation de mise sur le marché
1 RUE DE TURIN
69007 LYON
Exploitant de l’autorisation de mise sur le marché
VIATRIS SANTE
1 RUE DE TURIN
69007 LYON
EUROFINS BIOPHARMA PRODUCT TESTING FINLAND OY
VOLTTIKATU 5 JA 8
KUOPIO 70700
FINLANDE
OU
McDERMOTT LABORATORIES Ltd
25 BALDOYLE INDUSTRIAL ESTATE
GRANGE ROAD
DUBLIN 13, D13N5X2
IRLANDE
OU
MYLAN GERMANY GmbH
BENZSTRASSE 1
61352 BAD HOMBURG
ALLEMAGNE
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Ce médicament est autorisé dans les Etats membres de l'Espace Economique Européen sous les noms suivants : Conformément à la réglementation en vigueur.
[À compléter ultérieurement par le titulaire]
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
{mois AAAA}.
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).