Dernière mise à jour le 08/01/2026
VENTOLINE 100 microgrammes/dose, suspension pour inhalation en flacon pressurisé
Indications thérapeutiques
Ce médicament contient un bêta-2 mimétique : le salbutamol.
C’est un bronchodilatateur (il augmente le calibre des bronches) à action rapide (il agit en quelques minutes) et de courte durée (4 à 6 heures) qui s’administre par voie inhalée (en l’inspirant par l'embout buccal de l'inhalateur).
Il est indiqué en cas de crise d’asthme ou pour soulager une gêne respiratoire au cours de la maladie asthmatique ou de certaines maladies des bronches.
Il peut également vous être prescrit en traitement préventif de l’asthme déclenché par l’effort.
Si vous avez de l'asthme, en fonction de sa sévérité, votre médecin peut prescrire VENTOLINE 100 microgrammes/dose, suspension pour inhalation en flacon pressurisé seul ou en complément d’un traitement de fond continu par un ou plusieurs autres médicaments, comme les corticoïdes par voie inhalée.
Ce médicament peut également vous être prescrit à l’occasion de certains tests respiratoires (explorations fonctionnelles respiratoires).
Présentations
> 1 flacon(s) pressurisé(s) de 200 dose(s) aluminium avec valve doseuse avec embout buccal
Code CIP : 344 387-3 ou 34009 344 387 3 8
Déclaration de commercialisation : 29/05/1998
Cette présentation est agréée aux collectivités
- Prix hors honoraire de dispensation : 3,58 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 4,60 €
- Taux de remboursement :65%
Service médical rendu (SMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Important | Avis du 09/11/2016 | Renouvellement d'inscription (CT) | Le service médical rendu par les spécialités VENTOLINE reste important dans les indications respectives de leur AMM. |
Amélioration du service médical rendu (ASMR)
Pas d'ASMR disponible pour ce médicament (plus d'informations dans l'aide )
ANSM - Mis à jour le : 06/11/2025
VENTOLINE 100 microgrammes/dose, suspension pour inhalation en flacon pressurisé
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Sulfate de salbutamol 120,50 microgrammes
Quantité correspondant à salbutamol .. 100,00 microgrammes
Pour une dose.
Pour la liste complète des excipients, voir rubrique 6.1.
Suspension pour inhalation
4.1. Indications thérapeutiques
· Traitement symptomatique de la crise d’asthme.
· Traitement symptomatique des exacerbations d'asthme ou bronchite chronique obstructive.
· Prévention de l’asthme d’effort.
· Test de réversibilité de l’obstruction bronchique lors des explorations fonctionnelles respiratoires.
4.2. Posologie et mode d'administration
Posologie
Quel que soit l’âge :
· Traitement de la crise d’asthme et des exacerbations : dès les premiers symptômes, inhaler 1 à 2 bouffées.
· Prévention de l’asthme d’effort : inhalation de 1 à 2 bouffées, 15 à 30 minutes avant l’exercice.
La dose de 1 à 2 bouffées est généralement suffisante pour traiter une gêne respiratoire.
En cas de persistance des symptômes, elle peut être renouvelée quelques minutes plus tard.
La durée d'action bronchodilatatrice du salbutamol par voie inhalée est de 4 à 6 heures.
En cas de réapparition des symptômes, les prises peuvent être renouvelées.
La dose quotidienne ne doit habituellement pas dépasser 8 bouffées par 24 heures. Au-delà de cette dose, le patient doit être informé qu’une consultation médicale est nécessaire afin de réévaluer la conduite thérapeutique (voir rubrique 4.4).
En cas de crise d’asthme aiguë grave ou d’exacerbation aiguë sévère de bronchopneumopathie chronique obstructive, il convient d’administrer 2 à 6 bouffées à renouveler toutes les 5 à 10 minutes en attendant la prise en charge par une structure d’urgence pré-hospitalière. Dans ces situations, l’utilisation d’une chambre d’inhalation est recommandée car elle contribue à améliorer la diffusion pulmonaire du salbutamol administré par voie inhalée. Néanmoins, le déclenchement de l’aérosol-doseur à plusieurs reprises dans la chambre d’inhalation pouvant diminuer la dose totale inhalée, le patient devra inhaler le produit immédiatement après chaque déclenchement (ou éventuellement chaque série de deux déclenchements successifs) de l’aérosol doseur dans la chambre d’inhalation. L’administration sera ensuite répétée par cycles successifs. L’asthme aigu grave nécessite une hospitalisation. Une oxygénothérapie et la mise en route d’une corticothérapie par voie systémique doivent être envisagées.
Mode d’administration
Voie inhalée par un dispositif en flacon pressurisé muni d’un embout buccal.
Pour une utilisation correcte, il est souhaitable que le médecin s’assure du bon usage de l’appareil par le patient.
En cas de mise en évidence chez le patient d’une mauvaise synchronisation main/poumon empêchant la coordination des mouvements inspiration/déclenchement de l’appareil, l’utilisation d’une chambre d’inhalation est indiquée. D’autres spécialités à base de salbutamol mieux adaptées à ces patients sont également disponibles.
Les nourrissons et les jeunes enfants nécessitant un traitement par VENTOLINE en suspension pour inhalation en flacon pressurisé peuvent bénéficier de l’utilisation d’une chambre d’inhalation munie d’un masque facial.
Utilisation du dispositif d'inhalation :
Lorsque l’inhalateur est utilisé pour la première fois ou s’il n’a pas été utilisé depuis plus de 5 jours, il convient de s'assurer de son bon fonctionnement. Pour cela, retirer le capuchon de l’embout buccal en pressant doucement de chaque côté, bien agiter l’inhalateur, et appuyer sur la cartouche pour libérer deux bouffées de produit dans l’air ambiant.
Pour l'utilisation courante, après avoir enlevé le capuchon de l’embout buccal en exerçant une pression de chaque côté de celui-ci, le patient devra :
· vérifier l’absence de corps étrangers à l’intérieur de l’inhalateur notamment au niveau de l’embout buccal,
· bien agiter l'inhalateur afin de s’assurer que les composants de la solution contenue dans la cartouche ont été correctement mélangés,
· expirer profondément en dehors de l'inhalateur,
· présenter l’embout buccal entre les lèvres à l’entrée de la bouche, le fond de la cartouche métallique dirigé vers le haut,
· commencer à inspirer en pressant sur la cartouche métallique tout en continuant à inspirer lentement et profondément,
· retirer l’embout buccal et retenir sa respiration pendant au moins 10 secondes,
· renouveler l'inhalation si besoin,
· repositionner le capuchon sur l’embout buccal et appuyer fermement pour le remettre en position,
· l’embout buccal de l’inhalateur doit, par mesure d’hygiène, être nettoyé après emploi.
L'inhalateur n'est pas muni d'un compteur de doses.
· Allergie à l’un des constituants.
· Intolérance à ce médicament (survenue de toux ou de bronchospasme survenant immédiatement après inhalation du produit). Dans ce cas, il conviendra d’interrompre ce traitement et de prescrire d’autres thérapeutiques ou d’autres formes d’administration.
4.4. Mises en garde spéciales et précautions d'emploi
Informer le patient qu’une consultation médicale immédiate est nécessaire si, en cas de crise d’asthme, le soulagement habituellement obtenu n’est pas rapidement observé.
Dans le cas où une dose habituellement efficace de VENTOLINE 100 microgrammes/dose ne procure plus un soulagement rapide pendant au moins trois heures après son administration, il convient de conseiller au patient de consulter rapidement un médecin afin que les dispositions supplémentaires nécessaires puissent être prises. L'absence de réponse au traitement par VENTOLINE 100 microgrammes/dose peut indiquer la nécessité d'un traitement alternatif urgent.
L'inhalateur contient suffisamment de salbutamol pour seulement 200 doses (bouffées). Après 200 doses (bouffées), l'inhalateur peut continuer à pulvériser, mais sans la dose prévue de salbutamol. Des méthodes telles que secouer, peser ou immerger les inhalateurs ne sont pas précises pour déterminer si un inhalateur ne contient pas la dose prévue de salbutamol et elles ne sont pas recommandées. Des cas d’exacerbations d’asthme sévère ont été rapportées.
Il peut être envisagé de tenir un registre du nombre de doses (bouffées) administrées au patient. Il est recommandé d’avoir un inhalateur de secours à disposition. Si le patient utilise plusieurs inhalateurs, il est recommandé de tenir un registre séparé pour chaque inhalateur.
Si un patient développe en quelques jours une augmentation rapide de sa consommation en bronchodilatateurs bêta-2 mimétiques d’action rapide et de courte durée par voie inhalée, on doit craindre (surtout si les valeurs du débit-mètre de pointe s’abaissent et/ou deviennent irrégulières) une décompensation de l'atteinte respiratoire et chez les asthmatiques, la possibilité d’une évolution vers un état de mal asthmatique. Les patients doivent être avertis qu’ils doivent dans ce cas consulter un médecin dès que possible. La conduite thérapeutique devra alors être réévaluée.
La surutilisation de bronchodilatateurs bêta agonistes de courte durée d’action peut masquer la progression de la pathologie sous-jacente et contribuer à la détérioration du contrôle de l’asthme, entrainant une augmentation du risque d’exacerbations graves d’asthme et de la mortalité.
Les patients qui prennent du salbutamol « à la demande » plus de deux fois par semaine (en plus des administrations en traitement préventif de l’asthme induit par l’effort) sont à risque de surutilisation de salbutamol et doivent donc être réexaminés (symptômes diurnes, réveils nocturnes, limitation des activités due à l’asthme) afin de réajuster leur traitement.
Une détérioration soudaine et progressive du contrôle de l’asthme peut mettre en jeu le pronostic vital. L'instauration d'une corticothérapie ou l'augmentation d'une corticothérapie déjà en cours, doivent être envisagées. Chez l'adulte asthmatique, une corticothérapie inhalée doit être envisagée dès qu’il est nécessaire de recourir plus de 1 fois par semaine aux bêta-2 mimétiques par voie inhalée. Le patient doit dans ce cas être averti que l’amélioration de son état clinique ne doit pas conduire à une modification de son traitement, en particulier à l’arrêt de la corticothérapie par voie inhalée sans avis médical.
Comme avec les autres traitements administrés par voie inhalée, un bronchospasme paradoxal peut survenir, se manifestant par une augmentation de la dyspnée et des sifflements bronchiques immédiatement après l'inhalation du produit. Le bronchospasme sera traité par une autre présentation ou un autre bronchodilatateur à action rapide par voie inhalée (si disponible). Le traitement par VENTOLINE 100 microgrammes/dose, suspension pour inhalation en flacon pressurisé doit être interrompu et, si nécessaire, être remplacé par un autre médicament bronchodilatateur à action rapide.
Les médicaments ayant une activité sympathomimétique, dont fait partie le salbutamol, peuvent entraîner des effets cardiovasculaires. Des cas d'ischémies myocardiques associées au salbutamol ont été rapportés lors de notifications spontanées depuis la commercialisation ainsi que dans la littérature. Les patients présentant une cardiopathie sévère sous-jacente (par exemple, cardiopathie ischémique, troubles du rythme ou insuffisance cardiaque sévère) devront être informés de la nécessité de consulter leur médecin en cas de douleur thoracique ou autres symptômes évocateurs d’une aggravation de leur cardiopathie. L'origine cardiaque de symptômes respiratoires telle qu'une dyspnée doit également être évoquée.
Précautions d’emploi
En cas d’infection bronchique ou de bronchorrhée abondante, un traitement approprié est nécessaire afin de favoriser la diffusion optimale du produit dans les voies respiratoires.
Le salbutamol doit être utilisé avec précaution chez les patients ayant reçu des doses importantes d’autres médicaments sympathomimétiques.
Le salbutamol administré par voie inhalée avec ce dispositif en flacon pressurisé, peut-être, aux doses usuelles, normalement utilisé chez les malades atteints d’hyperthyroïdie, de troubles coronariens, de cardiomyopathie obstructive, de troubles du rythme ventriculaire, d’hypertension artérielle, de diabète sucré, contrairement au salbutamol administré en nébulisation ou par voie orale ou injectable qui ne doit être prescrit qu’avec prudence dans ces situations.
Les bêta-2 mimétiques à forte dose (en particulier par voie parentérale ou par nébulisation), peuvent être à l’origine d’une hypokaliémie potentiellement grave, pouvant favoriser la survenue de troubles du rythme cardiaque. Une surveillance de la kaliémie est recommandée dans la mesure du possible, en particulier lors de l’administration simultanée de thérapeutiques hypokaliémiantes, en cas d’hypoxie ou chez les sujets chez qui le risque de survenue de torsades de pointes est majoré (QT long ou traitements susceptibles d’augmenter le QTc).
Comme d'autres agonistes des récepteurs bêta adrénergiques, le salbutamol peut induire une augmentation de la glycémie. Des cas d’acidocétose ont été rapportés chez les patients diabétiques. L’administration concomitante de corticoïdes peut majorer ces effets.
Des cas d'acidose lactique ont été très rarement rapportés en association à de fortes doses de bêta-2 agonistes de courte durée d’action par voie intraveineuse ou par voie inhalée par nébulisation, principalement chez des patients traités pour une exacerbation aiguë de leur asthme (voir 4.8 Effets indésirables). Une augmentation du taux d’acide lactique peut entraîner une dyspnée et une hyperventilation compensatoire, qui peut être interprétée à tort comme un signe d’échec au traitement de l’asthme conduisant à l'augmentation inapproprié du traitement par bêta-agoniste de courte durée d’action. Par conséquent, le risque d'acidose lactique doit faire l'objet d'une surveillance attentive en particulier dans les situations sévères.
Sportifs :
L’attention des sportifs sera attirée sur le fait que cette spécialité contient un principe actif pouvant induire une réaction positive des tests pratiqués lors des contrôles antidopage.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
+ Bêta-bloquants non sélectifs
Le salbutamol et les bêta-bloquants non sélectifs, tel que le propranolol, ne doivent généralement pas être prescrits de façon concomitante.
+ Anesthésiques halogénés (halothane)
En cas d’intervention obstétricale, majoration de l’inertie utérine avec risque hémorragique ; par ailleurs, risque de survenue de troubles du rythme ventriculaire graves, par augmentation de la réactivité cardiaque.
Associations faisant l'objet de précautions d’emploi
+ Antidiabétiques
L'administration de bêta-2 mimétiques est associée à une augmentation de la glycémie, ce qui peut être interprété comme une diminution de l'effet du traitement antidiabétique, par conséquent, il peut être nécessaire de réajuster le traitement antidiabétique (voir rubrique 4.4). Renforcer la surveillance sanguine et urinaire.
4.6. Fertilité, grossesse et allaitement
Salbutamol
En clinique, il existe un recul important, avec un nombre suffisant de grossesses documentées, pour que l’on puisse conclure à l’innocuité du salbutamol pendant la grossesse.
En conséquence, le salbutamol par voie inhalée peut être administré en cas de grossesse.
Lors de l’administration pendant la grossesse :
Une accélération du rythme cardiaque fœtal peut être observée parallèlement à la tachycardie maternelle. Il est exceptionnel de la voir persister à la naissance.
De même, les valeurs de la glycémie post-natale ne sont qu’exceptionnellement perturbées.
En cas d’administration avant l’accouchement, tenir compte de l’effet vasodilatateur périphérique des bêta-2 mimétiques.
Norflurane (Tétrafluoroéthane ou HFA 134a) : gaz propulseur
L’étude des fonctions de reproduction menée chez l’animal n’a pas mis en évidence d’effet néfaste de l’administration de HFA 134a ou tétrafluoroéthane contenu dans ce médicament.
Néanmoins chez la femme enceinte le retentissement de l’administration de HFA 134a en cours de grossesse n’est pas connu.
Les bêta-2 mimétiques passent dans le lait maternel.
Le passage du gaz propulseur le Norflurane (Tétrafluoroéthane ou HFA 134a) et de ses métabolites dans le lait n’est pas connu.
Fertilité
Il n'existe aucune information sur les effets du salbutamol sur la fertilité humaine. Il n'a pas été mis en évidence d'effet indésirable sur la fertilité chez l’animal (voir rubrique 5.3).
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Sans objet.
Les effets secondaires sont cités ci-dessous, listés par classe organe et par fréquence. Les fréquences sont définies en très fréquent (≥1/10), fréquent (³1/100 et <1/10), peu fréquent (³1/1000 et <1/100), rare (≥1/10000 et <1/1000) et très rare (<1/10000) y compris les cas isolés. Les effets très fréquents et fréquents ont généralement été décrits dans les essais cliniques. Les effets indésirables rares et très rares sont généralement issus des notifications spontanées depuis la commercialisation.
|
Classe organe
|
Effets indésirables
|
Fréquence
|
|
Affections du système immunitaire |
Réactions d’hypersensibilité incluant : œdème angioneurotique, urticaire, prurit, bronchospasme, hypotension, collapsus. |
Très rare |
|
Troubles du métabolisme et de la nutrition |
Hypokaliémie.*
|
Très rare |
|
Affections du système nerveux |
Céphalées, tremblements. |
Fréquent |
|
Affections psychiatriques |
Troubles du comportement : nervosité, agitation. |
Très rare |
|
Affections cardiaques
|
Tachycardie. |
Fréquent |
|
Palpitations. |
Peu fréquent |
|
|
Arythmies cardiaques (incluant fibrillation auriculaire, tachycardie supraventriculaire et extrasystoles). |
Très rare |
|
|
Ischémies myocardiques (voir rubrique 4.4). |
Indéterminée** |
|
|
Affections vasculaires |
Vasodilatation périphérique. |
Très rare |
|
Affections respiratoires, thoraciques et médiastinales |
Bronchospasme paradoxal.*** |
Très rare |
|
Affections gastro-intestinales |
Irritation de la bouche et de la gorge. |
Peu fréquent |
|
Affections musculo-squelettiques et systémiques |
Crampes musculaires. |
Peu fréquent |
* Les bêta-2 mimétiques à fortes doses peuvent entraîner des hyperglycémies des hypokaliémies réversibles à l’arrêt du traitement.
** La fréquence de survenue des ischémies myocardiques ne peut être déterminée car les cas rapportés sont issus de notifications spontanées depuis la commercialisation.
*** Comme avec d’autres produits inhalés, possibilité de survenue de toux et rarement de bronchospasme paradoxal à la suite de l’inhalation. Ne pas renouveler l’administration de ce médicament et utiliser un autre médicament bronchodilatateur à action rapide pour soulager le bronchospasme. Le traitement devra alors être réévalué pour envisager, le cas échéant, la prescription d’une alternative thérapeutique.
Des cas d'acidose lactique ont été très rarement rapportés chez des patients recevant du salbutamol par voie intraveineuse ou par voie inhalée par nébulisation pour le traitement d’exacerbations aiguës d'asthme.
Peuvent également être observés des troubles digestifs (nausées, vomissements).
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - site internet : https://signalement.social-sante.gouv.fr
Une hypokaliémie peut survenir suite à un surdosage en salbutamol. La kaliémie doit donc être surveillée en cas de surdosage.
Des nausées, vomissements et hyperglycémie ont été rapportées, en particulier chez les enfants et lorsque le surdosage est dû à une prise de salbutamol par voie orale.
Des cas d’acidose lactique ont été rapportés avec des doses élevées de bêta-2 agonistes d’action rapide. En cas de surdosage, il convient donc de surveiller les taux sériques de lactate et le risque d’acidose lactique, en particulier en cas de persistance ou aggravation de la tachypnée malgré la disparition des symptômes de bronchospasme tels que les sibilants, qui peut être lié à l'acidose métabolique.
Conduite à tenir : surveillance et traitement symptomatique.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : Bronchodilatateur Bêta-2 mimétique à action rapide et de courte durée par voie inhalée (R : Système Respiratoire), code ATC : R03AC02
Le salbutamol est un agoniste sélectif des récepteurs bêta-2 adrénergiques.
Après inhalation, le salbutamol exerce une action stimulante sur les récepteurs bêta-2 du muscle lisse bronchique assurant ainsi une bronchodilatation rapide, significative en quelques minutes, et persistant pendant 4 à 6 heures.
5.2. Propriétés pharmacocinétiques
Après inhalation avec VENTOLINE 100 microgrammes/dose, suspension pour inhalation en flacon pressurisé, les concentrations plasmatiques observées aux doses usuelles sont négligeables (10 à 50 fois inférieures à celles observées après administration per os ou en injection).
Il n’y a pas de corrélation entre les taux sanguins et l’efficacité.
Après résorption pulmonaire l’élimination essentiellement urinaire se fait en partie sous forme active (mois de 2%) et en partie sous forme de métabolites inactifs (sulfoconjugués).
Norflurane (ou tétrafluoroéthane ou HFA 134a) : gaz propulseur
Après inhalation d’une bouffée, l’absorption de HFA 134a est très faible et rapide, la concentration maximale est atteinte en moins de 6 minutes.
Un très faible métabolisme hépatique avec formation d’acide trifluoroacétique et trifluorocétaldéhyde a été mis en évidence chez l’animal (souris et rats).
Néanmoins, les études cinétiques réalisées chez des patients après administration de HFA 134a en situation en pathologie, n’ont pas mis en évidence la formation d’acide trifluoroacétique.
5.3. Données de sécurité préclinique
Dans une étude sur la reproduction et sur la fertilité conduite chez le rat avec des doses orales de 2 et 50 mg/kg/jour, aucun effet indésirable n’a été mis en évidence sur la fertilité, le développement embryonnaire, la taille, le poids de naissance ou la croissance de la progéniture, à l’exception d’une réduction du nombre de ratons survivant jusqu’au jour 21 après la naissance à la dose de 50 mg/kg/jour.
Norflurane (tétrafluoroéthane ou HFA 134a)
Sans objet.
2 ans.
6.4. Précautions particulières de conservation
Repositionner le capuchon sur l’embout buccal et appuyer fermement pour le remettre en position.
Récipient sous pression :
· ne pas exposer à une chaleur supérieure à 30°C, ni au soleil
· ne pas percer,
· ne pas jeter au feu même vide.
Ne pas congeler.
6.5. Nature et contenu de l'emballage extérieur
6.6. Précautions particulières d’élimination et de manipulation
Le médecin devra informer le patient qu’il doit nettoyer son inhalateur au moins une fois par semaine.
Les instructions de nettoyage sont :
1. Séparer la cartouche de l’applicateur en plastique et retirer le capuchon.
2. Rincer soigneusement l’applicateur en plastique sous l’eau tiède.
3. Sécher soigneusement l’applicateur à l'aide d'un tissu sec aussi bien à l’intérieur qu’à l’extérieur.
4. Une fois ces opérations effectuées, remettre en place la cartouche métallique et le capuchon.
Ne pas plonger la cartouche métallique dans l’eau.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
23 RUE FRANCOIS JACOB
92500 RUEIL-MALMAISON
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 344 387 3 8 : 200 doses en flacon pressurisé (Aluminium) avec valve doseuse et embout buccal
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
<{JJ mois AAAA}>
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Sans objet.
Liste I.
A.1. Nom et adresse du (des) fabricant(s) de la (des) substances(s) active(s) d'origine biologique
Sans objet.
A.2. Nom et adresse du (des) fabricant(s) responsable(s) de la libération des lots
ZONE INDUSTRIELLE N° 2
23 RUE LAVOISIER
27000 EVREUX
ou
GLAXO WELLCOME, S.A.
AVENIDA DE EXTREMADURA 3
09400 ARANDA DE DUERO (BURGOS)
ESPAGNE
B. CONDITIONS OU RESTRICTIONS DE DELIVRANCE ET D’UTILISATION
C. AUTRES CONDITIONS ET OBLIGATIONS DE L’AUTORISATION DE MISE SUR LE MARCHE
· Rapports périodiques actualisés de sécurité (PSUR)
Les exigences relatives à la soumission des rapports périodiques actualisés de sécurité pour ce médicament sont définies dans la liste des dates de référence pour l’Union (liste EURD) prévue à l’article 107 quater, paragraphe 7, de la directive 2001/83/CE et ses actualisations publiées sur le portail web européen des médicaments.
D. CONDITIONS OU RESTRICTIONS EN VUE D’UNE UTILISATION SURE ET EFFICACE DU MEDICAMENT
Sans objet.
E. OBLIGATION SPECIFIQUE RELATIVE AUX MESURES POST-AUTORISATION CONCERNANT L’AUTORISATION DE MISE SUR LE MARCHE « SOUS CIRCONSTANCES EXCEPTIONNELLES »
Sans objet.
F. COMPOSITION QUALITATIVE ET QUANTITATIVE EN EXCIPIENTS
Gaz propulseur :
Norflurane (ou tétrafluoroéthane ou HFA 134a).................................................................... 75,00 mg
Pour une dose.
ANSM - Mis à jour le : 06/11/2025
VENTOLINE 100 microgrammes/dose, suspension pour inhalation en flacon pressurisé
Sulfate de salbutamol
· Gardez cette notice, vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin ou votre pharmacien.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, qu'il soit mentionné ou non dans cette notice, parlez-en à votre médecin ou votre pharmacien. Voir rubrique 4.
1. Qu'est-ce que VENTOLINE 100 microgrammes/dose, suspension pour inhalation en flacon pressurisé et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d'utiliser VENTOLINE 100 microgrammes/dose, suspension pour inhalation en flacon pressurisé ?
3. Comment utiliser VENTOLINE 100 microgrammes/dose, suspension pour inhalation en flacon pressurisé ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver VENTOLINE 100 microgrammes/dose, suspension pour inhalation en flacon pressurisé ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE VENTOLINE 100 microgrammes/dose, suspension pour inhalation en flacon pressurisé ET DANS QUELS CAS EST-IL UTILISE ?
Ce médicament contient un bêta-2 mimétique : le salbutamol.
C’est un bronchodilatateur (il augmente le calibre des bronches) à action rapide (il agit en quelques minutes) et de courte durée (4 à 6 heures) qui s’administre par voie inhalée (en l’inspirant par l'embout buccal de l'inhalateur).
Il est indiqué en cas de crise d’asthme ou pour soulager une gêne respiratoire au cours de la maladie asthmatique ou de certaines maladies des bronches.
Il peut également vous être prescrit en traitement préventif de l’asthme déclenché par l’effort.
Si vous avez de l'asthme, en fonction de sa sévérité, votre médecin peut prescrire VENTOLINE 100 microgrammes/dose, suspension pour inhalation en flacon pressurisé seul ou en complément d’un traitement de fond continu par un ou plusieurs autres médicaments, comme les corticoïdes par voie inhalée.
Ce médicament peut également vous être prescrit à l’occasion de certains tests respiratoires (explorations fonctionnelles respiratoires).
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER VENTOLINE 100 microgrammes/dose, suspension pour inhalation en flacon pressurisé ?
N’utilisez jamais VENTOLINE 100 microgrammes/dose, suspension pour inhalation en flacon pressurisé :
· Si vous êtes allergique au salbutamol (la substance active) ou à l’un des autres composants contenus dans ce médicament, mentionnés dans la rubrique 6.
Si vous ressentez une augmentation de la gêne respiratoire ou de la toux immédiatement après l’inhalation de ce produit, ne renouvelez pas la prise de ce médicament et contactez votre médecin.
En cas de doute, demandez l’avis de votre médecin ou de votre pharmacien.
Avertissements et précautions
Adressez-vous à votre médecin ou pharmacien avant d’utiliser VENTOLINE 100 microgrammes/dose, suspension pour inhalation en flacon pressurisé. Faites attention avec ce médicament :
En cas de survenue de crises d’asthme, ou de gêne respiratoire, le soulagement habituellement obtenu doit être observé rapidement et doit durer pendant au moins trois heures après l’utilisation de ce médicament. En cas d’échec, consultez immédiatement un médecin.
Si la dose habituellement efficace devient insuffisante, si les crises d'asthme ou les épisodes de gêne respiratoire deviennent plus fréquents, il faut craindre une aggravation de la maladie : consultez rapidement votre médecin qui réévaluera votre traitement. (Voir rubrique 3)
Ce produit actif en inhalation, doit atteindre l’extrémité des petites bronches. En cas d’encombrement des voies respiratoires par des mucosités abondantes, notamment lors d’infection, son efficacité peut être diminuée. Consultez rapidement votre médecin afin qu’il mette en place un traitement adapté.
Prévenez votre médecin :
- si vous avez des problèmes en lien avec votre glande thyroïde,
- si vous avez des problèmes cardio-vasculaires, notamment certains troubles du rythme cardiaque, une angine de poitrine (sensation d'oppression thoracique et douleurs violentes localisées au niveau de la poitrine et pouvant s’étendre dans le bras gauche), ou une hypertension artérielle (augmentation de la pression du sang dans les artères),
- si vous avez un diabète
afin qu'il détermine les modalités de traitement les mieux adaptées à votre cas.
Autres médicaments et VENTOLINE 100 microgrammes/dose, suspension pour inhalation en flacon pressurisé
Informez votre médecin ou pharmacien si vous prenez, avez pris récemment ou pourriez prendre tout autre médicament (en particulier des médicaments bêta-bloquants ou antidiabétiques), y compris un médicament obtenu sans ordonnance.
VENTOLINE 100 microgrammes/dose, suspension pour inhalation en flacon pressurisé avec des aliments et boissons
Sans objet.
D'une façon générale, demandez conseil à votre médecin ou à votre pharmacien avant de prendre tout médicament.
Ce médicament dans les conditions normales d'utilisation peut être utilisé pendant la grossesse.
Le salbutamol passe dans le lait maternel.
Sportifs :
Attention, ce médicament contient un principe actif pouvant rendre positifs les tests pratiqués lors de contrôles antidopage.
Conduite de véhicules et utilisation de machines
Sans objet.
VENTOLINE 100 microgrammes/dose, suspension pour inhalation en flacon pressurisé contient :
Sans objet.
3. COMMENT UTILISER VENTOLINE 100 microgrammes/dose, suspension pour inhalation en flacon pressurisé ?
Instructions pour un bon usage
L'inhalateur n'est pas muni d'un compteur de doses. Vous ne pouvez donc pas savoir combien de doses restent disponibles dans l’inhalateur. Aussi, il est recommandé de garder un 2ème inhalateur de VENTOLINE 100 microgrammes/dose, suspension pour inhalation en flacon pressurisé non entamé à disposition pour prendre le relais en cas de survenue imprévisible d'une crise d'asthme ou d'une gêne respiratoire alors que votre premier inhalateur serait vide.
VENTOLINE 100 microgrammes/dose, suspension pour inhalation en flacon pressurisé doit être utilisé en fonction des besoins, plutôt qu’en prises régulières.
Respectez toujours la posologie prescrite par votre médecin. En cas de doute, consultez votre médecin ou votre pharmacien.
La dose recommandée est :
· en cas de crise d’asthme ou d'épisode aigu de gêne respiratoire : dès les premiers symptômes, inhalez 1 à 2 bouffées (voir ci-dessous « Mode d’emploi »).
Cette dose peut éventuellement être répétée quelques minutes plus tard si nécessaire
Si les troubles ne régressent pas rapidement, consultez immédiatement un médecin.
· En cas de crise d'asthme sévère, les inhalations peuvent être renouvelées à raison de 2 à 6 bouffées toutes les 5 à 10 minutes jusqu'à une prise en charge éventuelle hospitalière. Dans ces situations, l'utilisation d'une chambre d’inhalation est recommandée pour faciliter l'administration.
· prévention de l’asthme d’effort : inhalez 1 à 2 bouffées (voir ci-dessous « Mode d’emploi »), 15 à 30 minutes avant l’exercice.
La dose quotidienne ne doit habituellement pas dépasser 8 bouffées (voir ci-dessous). Si vous avez besoin de prendre plus de 8 bouffées par jour de ce médicament pour soulagez vos symptômes respiratoires, vous devez consulter votre médecin afin qu'il réévalue votre traitement.
Si votre asthme est instable (par exemple si vos symptômes ou vos exacerbations d’asthme sont fréquents, comme un souffle court qui rend la parole, l’alimentation ou le sommeil difficile, une toux, des sifflements lorsque vous respirez, si vous ressentez un serrement dans la poitrine ou si vos capacités physiques sont limitées par un essoufflement), vous devez avertir immédiatement votre médecin qui débutera ou augmentera les doses d’un traitement pour contrôler votre asthme, comme les corticostéroïdes par voie inhalée.
Si votre inhalateur ne procure pas un soulagement rapide d'une durée d'au moins 3 heures, vous devez demander l’avis d’un médecin sans tarder.
Informez rapidement votre médecin si votre asthme s'aggrave ou si ce médicament ne soulage plus autant votre asthme qu'auparavant (par exemple si vous avez besoin de doses plus importantes pour soulager vos difficultés respiratoires), vous pourriez avoir besoin d’un médicament différent.
Si vous utilisez VENTOLINE 100 microgrammes/dose, suspension pour inhalation en flacon pressurisé plus de deux fois par semaine pour traiter vos symptômes d’asthme (en plus des utilisations en prévention avant un exercice physique) cela indique que votre asthme est mal contrôlé, ce qui pourrait augmenter le risque de crise d’asthme sévère (aggravation de l’asthme), entrainer des complications graves et pourrait menacer votre pronostic vital, voire être fatale. Vous devez alors contacter votre médecin au plus vite pour modifier votre traitement pour l’asthme.
Si vous utilisez quotidiennement un médicament destiné à traiter l’inflammation des bronches (par exemple des « corticostéroïdes inhalés ») il est important de continuer à prendre ce médicament anti-inflammatoire régulièrement, même si vous vous sentez mieux.
Mode d’administration :
Voie inhalée (exclusivement par l'intermédiaire de l'embout buccal de l'inhalateur).
Lisez attentivement le mode d’emploi de l’inhalateur :
L’efficacité de ce médicament dépend en partie d’une utilisation correcte de l’appareil. Au besoin, n’hésitez pas à demander à votre médecin de vous fournir des explications détaillées.
Mode d’emploi :
Lorsque vous utilisez votre inhalateur pour la première fois ou si vous ne l’avez pas utilisé depuis plus de 5 jours, vous devez vous assurer de son bon fonctionnement. Pour cela, retirez le capuchon de l’embout buccal en pressant doucement de chaque côté, agitez bien l’inhalateur, et appuyez sur la cartouche pour libérer deux bouffées de produit dans l’air.
Pour l'utilisation courante de votre inhalateur, après avoir enlevé le capuchon de l’embout buccal en exerçant une pression de chaque côté de celui-ci :
· vérifiez l’absence de corps étrangers à l’intérieur de l’inhalateur y compris dans l’embout buccal,
|
|
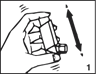
· agitez bien l’inhalateur afin de mélanger les composants de la solution contenue dans la cartouche (fig.1),
|
|
|
· videz vos poumons en expirant profondément en dehors de l'inhalateur (fig. 2), |
|
|
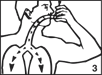
· placez l’embout buccal entre les lèvres à l’entrée de la bouche, le fond de la cartouche métallique dirigé vers le haut (fig. 3), · commencez à inspirer et pressez sur la cartouche métallique tout en continuant à inspirer lentement et profondément (fig. 3), |
|
|
· retirez l’embout buccal de la bouche et retenez votre respiration pendant au moins 10 secondes (fig. 4),
|
· si vous avez besoin d'une 2ème bouffée, renouveler la manipulation (schémas 2, 3, 4),
· puis, repositionnez le capuchon sur l’embout buccal et appuyez fermement pour le remettre en position,
· par mesure d’hygiène, l’embout buccal doit être nettoyé après emploi.
Contrôlez votre technique d’inhalation devant une glace :
Si une quantité importante de produit s’échappe par le nez ou la bouche, les points suivants sont à surveiller : soit la pression de la cartouche métallique a eu lieu avant le début ou après la fin de l’inspiration, soit l’inspiration n’a pas été suffisamment profonde.
Nettoyage :
Nettoyez votre aérosol-doseur au moins une fois par semaine.
· Séparez la cartouche de l’applicateur en plastique et retirez le capuchon,
· Rincez soigneusement l’applicateur en plastique sous l’eau tiède, mais ne plongez pas la cartouche métallique dans l’eau.
· Séchez soigneusement l’applicateur à l'aide d'un tissu sec aussi bien à l’intérieur qu’à l’extérieur,
· Une fois ces opérations effectuées, remettez en place la cartouche métallique et le capuchon.
Utilisation d’une chambre d’inhalation :
En cas de difficulté à utiliser l’inhalateur ou si le médicament est destiné à de jeunes enfants, votre médecin peut conseiller l’utilisation d’une chambre d’inhalation. Une chambre d'inhalation est un dispositif servant de réservoir sur lequel est l’embout buccal de l'inhalateur et permettant d’inhaler plus facilement le médicament sans synchronisation main-poumon nécessaire pour que l'inspiration puisse être réalisée en même temps que le déclenchement du dispositif.
Dans ce cas, vous devez inhaler immédiatement le médicament par l'embout buccal de la chambre d'inhalation après chaque déclenchement de l'inhalateur (ou éventuellement après chaque série de deux déclenchements successifs) en pressant la cartouche afin de libérer l'aérosol à l'intérieur de la chambre d’inhalation.
Si vous avez utilisé plus de VENTOLINE 100 microgrammes/dose, suspension pour inhalation en flacon pressurisé que vous n’auriez dû
Si vous prenez une dose supérieure à la dose recommandée, vous pouvez présenter des effets indésirables tels que tachycardie (accélération du rythme cardiaque), maux de tête, tremblements des mains ou nervosité/agitation (voir la rubrique 4 : « Quels sont les effets indésirables éventuels ? »).
Consultez votre médecin et emportez avec vous cette notice ou votre médicament afin que votre médecin sache de quel médicament il s'agit.
Si vous oubliez d’utiliser VENTOLINE 100 microgrammes/dose, suspension pour inhalation en flacon pressurisé
Ne prenez pas de dose double pour compenser la dose que vous avez oublié de prendre.
Si vous arrêtez d’utiliser VENTOLINE 100 microgrammes/dose, suspension pour inhalation en flacon pressurisé
Sans objet.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Lors d'un traitement avec le salbutamol, certaines personnes peuvent parfois (fréquence de survenue non connue) ressentir une douleur dans le thorax (sensation d'oppression) qui peut être due à des problèmes cardiaques tels qu’une angine de poitrine. Prévenez rapidement votre médecin si vous ressentez de tels symptômes.
En cas d'aggravation de votre gêne respiratoire (respiration sifflante) juste après la prise de ce médicament, cessez immédiatement de l'utiliser, et contactez votre médecin dès que possible.
Si disponible, utilisez dès que possible un autre médicament bronchodilatateur d’action rapide pour traiter votre asthme.
Peuvent également être observés :
Aux doses habituellement prescrites :
· Fréquemment :
o tremblements des extrémités (pieds et mains),
o accélération du rythme cardiaque,
o maux de tête.
· Peu fréquemment :
o palpitations,
o irritations de la bouche ou de la gorge,
o crampes musculaires.
· Rarement :
o comme avec d’autres produits administrés par voie inhalée, une toux ou une augmentation de la gêne respiratoire (respiration sifflante) pourrait survenir immédiatement après l’inhalation du produit. Dans ce cas, arrêtez le traitement et contactez votre médecin afin qu’il envisage un autre traitement.
· Très rarement :
o bouffées de chaleur, rougeurs sur la peau,
o anomalie du rythme cardiaque,
o nervosité, agitation,
o réactions allergiques pouvant se manifester par une sensation d’oppression dans la poitrine, des démangeaisons, un sifflement respiratoire, un gonflement des paupières, du visage et/ou des lèvres et éruption cutanée, une baisse de la tension artérielle pouvant aller jusqu’au malaise.
A des doses très élevées :
o augmentation de la quantité de sucre dans le sang, régressant à l’arrêt du traitement,
o diminution du taux de potassium dans le sang (très rarement).
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER VENTOLINE 100 microgrammes/dose, suspension pour inhalation en flacon pressurisé ?
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur la boîte. La date de péremption fait référence au dernier jour de ce mois.
Le récipient est sous pression : ne l’exposez pas à une chaleur supérieure à 30°C, ni au soleil. Ne le percez pas, ne le jetez pas au feu même vide. Ne pas congeler.
Immédiatement après utilisation, repositionnez le capuchon sur l’embout buccal et appuyez fermement pour le remettre en position. Ne forcez pas sur le capuchon.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient VENTOLINE 100 microgrammes/dose, suspension pour inhalation en flacon pressurisé
· La substance active est :
Sulfate de Salbutamol :................................................................................... 120,50 microgrammes
Correspondant à 100,00 microgrammes de salbutamol.
Pour une dose.
· L’autre composant est :
Gaz propulseur : le norflurane (tétrafluoroéthane ou HFA 134a).
Ce médicament contient des gaz à effet de serre fluorés.
Chaque inhalateur contient 18 g de HFC-134a (aussi appelé norflurane ou tétrafluoroéthane ou HFA 134a) correspondant à 0,0257 tonne équivalent CO2 (potentiel de réchauffement global (PRG) = 1 430).
Ce médicament se présente sous forme de suspension pour inhalation en flacon de 200 doses.
Titulaire de l’autorisation de mise sur le marché
23 RUE FRANCOIS JACOB
92500 RUEIL-MALMAISON
Exploitant de l’autorisation de mise sur le marché
23 RUE FRANCOIS JACOB
92500 RUEIL-MALMAISON
ZONE INDUSTRIELLE N° 2
23 RUE LAVOISIER
27000 EVREUX
ou
GLAXO WELLCOME, S.A.
AVENIDA DE EXTREMADURA 3
09400 ARANDA DE DUERO (BURGOS)
ESPAGNE
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Sans objet.
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).