Dernière mise à jour le 01/12/2025
MINIDRIL, comprimé enrobé
Indications thérapeutiques
Classe pharmacothérapeutique : PROGESTATIFS ET ESTROGENES EN ASSOCIATION FIXE – code ATC : G03AA07.
MINIDRIL est un contraceptif hormonal oral utilisé afin d’éviter une grossesse.
Chaque comprimé de MINIDRIL contient deux hormones féminines différentes en petite quantité : le lévonorgestrel et l’éthinylestradiol.
Les contraceptifs oraux contenant deux hormones sont appelés contraceptifs oraux « combinés ».
Présentations
> 1 plaquette(s) PVC aluminium de 21 comprimé(s)
Code CIP : 318 239-0 ou 34009 318 239 0 2
Déclaration de commercialisation : 19/01/1976
Cette présentation est agréée aux collectivités
- Prix hors honoraire de dispensation : 1,59 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 2,61 €
- Taux de remboursement :65%
> 3 plaquette(s) PVC aluminium de 21 comprimé(s)
Code CIP : 318 240-9 ou 34009 318 240 9 1
Déclaration de commercialisation : 19/01/1976
Cette présentation est agréée aux collectivités
- Prix hors honoraire de dispensation : 3,76 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 4,78 €
- Taux de remboursement :65%
Documents de bon usage du médicament
- Contraception chez la femme en post-partum
Auteur : Haute autorité de santé
Type : Fiche mémo
Date de mise à jour :Septembre 2019
- Contraception d’urgence
Auteur : Haute autorité de santé
Type : Fiche mémo
Date de mise à jour :Septembre 2019
- Contraception chez l’homme
Auteur : Haute autorité de santé
Type : Fiche mémo
Date de mise à jour :Septembre 2019
- Stérilisation à visée contraceptive chez l’homme et chez la femme
Auteur : Haute autorité de santé
Type : Fiche mémo
Date de mise à jour :Septembre 2019
- Contraception chez la femme adulte et de l'adolescente en âge de procréer (hors post-partum et post-IVG)
Auteur : Haute autorité de santé
Type : Fiche mémo
Date de mise à jour :Septembre 2019
- Contraception chez la femme à risque cardio-vasculaire
Auteur : Haute autorité de santé
Type : Fiche mémo
Date de mise à jour :Septembre 2019
- Contraception : prescriptions et conseils aux femmes
Auteur : Haute autorité de santé
Type : Fiche mémo
Date de mise à jour :Septembre 2019
- Contraception hormonale orale : dispensation en officine
Auteur : Haute autorité de santé
Type : Fiche mémo
Date de mise à jour :Septembre 2019
- Contraception d’urgence : dispensation en officine
Auteur : Haute autorité de santé
Type : Fiche mémo
Date de mise à jour :Septembre 2019
- Contraception estroprogestative transdermique ou vaginale : dispensation en officine
Auteur : Haute autorité de santé
Type : Fiche mémo
Date de mise à jour :Septembre 2019
- Contraception chez la femme après une interruption volontaire de grossesse (IVG)
Auteur : Haute autorité de santé
Type : Fiche mémo
Date de mise à jour :Septembre 2019
- Méthodes contraceptives : Focus sur les méthodes les plus efficaces disponibles
Auteur : Haute autorité de santé
Type : Evaluation des technologies de santé
Date de mise à jour :Novembre 2017
- Contraceptifs oraux estroprogestatifs : préférez les «pilules» de 1re ou 2e génération
Auteur : Haute autorité de santé
Type : Fiche Bon Usage du Médicament
Date de mise à jour :Janvier 2013
Service médical rendu (SMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Important | Avis du 26/06/2019 | Renouvellement d'inscription (CT) | Le service médical rendu par ADEPAL MINIDRIL et TRINORDIOL reste important dans l’indication de l’AMM. |
Amélioration du service médical rendu (ASMR)
Pas d'ASMR disponible pour ce médicament (plus d'informations dans l\'aide)
ANSM - Mis à jour le : 31/03/2025
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Ethinylestradiol................................................................................................................. 0,030 mg
Pour un comprimé enrobé
Excipients à effet notoire : lactose, saccharose.
Pour la liste complète des excipients, voir rubrique 6.1.
4.1. Indications thérapeutiques
Contraception hormonale orale.
La décision de prescrire MINIDRIL doit être prise en tenant compte des facteurs de risque de la patiente, notamment ses facteurs de risque de thrombo-embolie veineuse (TEV), ainsi que du risque de TEV associé à MINIDRIL en comparaison aux autres CHC (Contraceptifs Hormonaux Combinés) (voir rubriques 4.3 et 4.4).
4.2. Posologie et mode d'administration
Prendre régulièrement et sans oubli 1 comprimé par jour au même moment de la journée, pendant 21 jours consécutifs avec un arrêt de 7 jours entre chaque plaquette.
Une hémorragie de privation débute habituellement 2 à 3 jours après la prise du dernier comprimé et peut se poursuivre après le début de la plaquette suivante.
Population pédiatrique
Sans objet.
Mode d’administration
Début de traitement par MINIDRIL, comprimé enrobé
· Absence de contraception hormonale le mois précédent :
Prendre le 1er comprimé le 1er jour des règles.
· Relais d'un autre contraceptif hormonal estroprogestatif (contraceptif hormonal combiné (CHC), anneau vaginal ou dispositif transdermique (patch)) : Prendre le 1er comprimé le jour suivant la prise du dernier comprimé actif du contraceptif précédent ou au plus tard le jour qui suit la période habituelle d'arrêt des comprimés.
Dans le cas de l’anneau vaginal ou du dispositif transdermique, prendre le 1er comprimé le jour de retrait ou au plus tard le jour prévu pour l’application du nouveau dispositif ou du nouvel anneau.
· Relais d'une contraception progestative (pilule microdosée, injectable, implant, dispositif intra-utérin [DIU] contenant un progestatif) :
Le relais d'une contraception microdosée peut se faire à tout moment du cycle et MINIDRIL, comprimé enrobé devra être débuté le lendemain de l'arrêt.
Le relais d'un implant ou d’un DIU se fait le jour du retrait, et le relais d'un contraceptif injectable se fait le jour prévu pour la nouvelle injection. Dans tous les cas, il est recommandé d'utiliser une méthode complémentaire de contraception pendant les 7 premiers jours de traitement.
· Après une interruption de grossesse du premier trimestre :
Il est possible de débuter MINIDRIL, comprimé enrobé immédiatement. Il n'est pas nécessaire d'utiliser une méthode complémentaire de contraception.
· Après un accouchement ou une interruption de grossesse du deuxième trimestre :
Le post-partum immédiat étant associé à une augmentation du risque thrombo-embolique, les contraceptifs oraux estroprogestatifs ne doivent pas être débutés moins de 21 à 28 jours après un accouchement ou une interruption de grossesse du deuxième trimestre. Si le traitement est commencé plus de 28 jours après un accouchement ou une interruption de grossesse du deuxième trimestre, il est recommandé d'utiliser une méthode complémentaire de contraception de type mécanique pendant les 7 premiers jours de traitement. Cependant, si des relations sexuelles ont déjà eu lieu, il convient de s'assurer de l'absence de grossesse avant le début de prise de contraceptif oral estroprogestatif ou d'attendre les premières règles.
· En cas d'allaitement : voir rubrique 4.6.
Conduite à tenir en cas d’oubli d’un ou plusieurs comprimés
La sécurité contraceptive peut être diminuée en cas d'oubli particulièrement si cet oubli augmente l'intervalle de temps entre le dernier comprimé de la plaquette en cours et le 1er comprimé de la plaquette suivante.
· Si l'oubli d'un comprimé est constaté dans les 12 heures qui suivent l'heure habituelle de la prise, prendre immédiatement le comprimé oublié, et poursuivre le traitement normalement en prenant le comprimé suivant à l'heure habituelle.
· Si l'oubli d'un comprimé est constaté plus de 12 heures après l'heure normale de la prise, la sécurité contraceptive n'est plus assurée.
Les deux règles de base suivantes s’appliquent en cas d’oubli de prendre des comprimés :
1. La prise des comprimés ne doit jamais être interrompue pendant plus de 7 jours.
2. La prise ininterrompue de comprimés pendant 7 jours est requise pour obtenir une inhibition correcte de l'axe hypothalamo-hypophyso-ovarien.
Les conseils suivants seront donc donnés en pratique :
Semaine 1
La femme prendra le dernier comprimé oublié dès qu’elle y pense, même si cela veut dire qu’elle doit prendre 2 comprimés en même temps. Elle continuera ensuite à prendre les comprimés suivants à l'heure habituelle.
Elle devra aussi utiliser simultanément une contraception mécanique complémentaire (exemple, un préservatif) pendant les 7 jours suivants. En cas de rapports sexuels au cours des 7 jours qui précédent, la possibilité d’une grossesse doit être envisagée. Le risque de grossesse est d'autant plus élevé que le nombre de comprimés oubliés est important ou que la date de l'oubli est proche du début de la plaquette.
Semaine 2
La femme prendra le dernier comprimé oublié dès qu’elle y pense, même si cela veut dire qu’elle doit prendre 2 comprimés en même temps. Elle continuera ensuite à prendre les comprimés à l'heure habituelle.
Si les comprimés ont été pris correctement les 7 jours qui précédent le comprimé oublié, il ne sera pas nécessaire de prendre des mesures contraceptives complémentaires. Toutefois, si plusieurs comprimés ont été oubliés, il sera recommandé à la femme d’utiliser une autre méthode de contraception pendant 7 jours.
Semaine 3
Le risque de diminution de l'efficacité contraceptive est maximal compte tenu de l’approche de la période de 7 jours sans comprimés. Toutefois, il est possible d’empêcher la réduction de l’efficacité contraceptive en modulant la prise de comprimés. Il ne sera donc pas nécessaire de prendre des mesures contraceptives complémentaires si l’on suit l’une des alternatives ci-dessous, à condition que tous les comprimés aient été pris correctement pendant les 7 jours qui précèdent le comprimé oublié. Toutefois, si cela n’est pas le cas, il sera recommandé à la femme de suivre la première des deux alternatives et d’utiliser simultanément une autre méthode de contraception pendant les 7 jours suivants.
1. La femme prendra le dernier comprimé oublié dès qu’elle y pense, même si cela veut dire qu’elle doit prendre 2 comprimés en même temps. Elle continuera ensuite à prendre les comprimés à l'heure habituelle.
Elle commencera la plaquette suivante immédiatement après avoir pris le dernier comprimé de la plaquette courante, c'est-à-dire qu’il n’y aura pas d’interruption entre les plaquettes. L’apparition d’une hémorragie de privation avant la fin de la deuxième plaquette est peu probable mais des spottings (gouttes ou taches de sang) ou des métrorragies sont possibles les jours de prise des comprimés.
2. Il pourra aussi être conseillé à la femme d’arrêter de prendre les comprimés de la plaquette courante. Dans ce cas, elle devra observer une période sans comprimés de 7 jours maximum, y compris les jours où elle a oublié de prendre les comprimés, et continuer ensuite avec la plaquette suivante.
Si la femme a oublié des comprimés et n’a pas d'hémorragie de privation pendant la première période normale sans comprimé, la possibilité d’une grossesse devra être envisagée.
En cas de troubles gastro-intestinaux :
En cas de troubles gastro-intestinaux sévères (par exemple des vomissements ou une diarrhée), l'absorption d'un comprimé peut ne pas être complète ; des mesures contraceptives complémentaires doivent donc être prises.
· Si des vomissements se produisent dans les 3-4 heures suivant la prise du comprimé, un nouveau comprimé doit être pris en remplacement dès que possible. Le nouveau comprimé doit être pris si possible dans les 12 heures qui suivent l'heure habituelle de prise.
· Si plus de 12 heures se sont écoulées, les mêmes consignes que celles données pour les oublis de comprimés doivent s'appliquer (voir rubrique 4.2. « Conduite à tenir en cas d'oubli d'un ou plusieurs comprimés »).
Si la femme ne veut pas modifier le calendrier normal de prise des comprimés, elle doit prendre le(s) comprimé(s) supplémentaire(s) à partir d'une autre plaquette.
· Présence ou risque de thrombo-embolie veineuse (TEV) :
o Thrombo-embolie veineuse – présence de TEV (patiente traitée par des anticoagulants) ou antécédents de TEV (p. ex. thrombose veineuse profonde [TVP] ou embolie pulmonaire [EP]) ;
o Prédisposition connue, héréditaire ou acquise, à la thrombo-embolie veineuse, telle qu’une résistance à la protéine C activée (PCa) (y compris une mutation du facteur V de Leiden), un déficit en antithrombine III, un déficit en protéine C, un déficit en protéine S ;
o Intervention chirurgicale majeure avec immobilisation prolongée (voir rubrique 4.4) ;
o Risque élevé de thrombo-embolie veineuse dû à la présence de multiples facteurs de risque (voir rubrique 4.4) ;
· Présence ou risque de thrombo-embolie artérielle (TEA) :
o Thrombo-embolie artérielle – présence ou antécédents de thrombo-embolie artérielle (p. ex. infarctus du myocarde [IM]) ou de prodromes (p. ex. angine de poitrine) ;
o Affection cérébrovasculaire – présence ou antécédents d’accident vasculaire cérébral (AVC) ou de prodromes (p. ex. accident ischémique transitoire [AIT]) ;
o Prédisposition connue, héréditaire ou acquise, à la thrombo-embolie artérielle, telle qu’une hyperhomocystéinémie ou la présence d’anticorps anti-phospholipides (anticorps anti-cardiolipine, anticoagulant lupique) ;
o Antécédents de migraine avec signes neurologiques focaux ;
o Risque élevé de thrombo-embolie artérielle dû à la présence de multiples facteurs de risque (voir rubrique 4.4) ou d’un facteur de risque sévère tel que :
§ diabète avec symptômes vasculaires,
§ hypertension artérielle sévère,
§ dyslipoprotéinémie sévère.
· Pancréatite ou antécédents de pancréatite associée à une hypertriglycéridémie sévère ;
· Affection hépatique sévère ou antécédent d'affection hépatique sévère, en l'absence de normalisation des tests fonctionnels hépatiques ;
· Tumeur hépatique (bénigne ou maligne) évolutive ou ancienne ;
· Tumeur maligne hormono-dépendante connue ou suspectée (par exemple, tumeurs des organes génitaux ou du sein) ;
· Saignements vaginaux non diagnostiqués ;
· Hypersensibilité aux substances actives ou à l'un des excipients mentionnés à la rubrique 6.1.
MINIDRIL est contre-indiqué en association avec le millepertuis.
MINIDRIL est contre-indiqué en administration concomitante avec des médicaments antiviraux contre le virus de l’hépatite C (VHC) contenant l’association ombitasvir/paritaprévir/ritonavir, le dasabuvir, le glécaprévir/pibrentasvir et le sofosbuvir/velpatasvir/voxilaprévir (voir rubrique 4.5).
4.4. Mises en garde spéciales et précautions d'emploi
Si la patiente présente l’un des troubles ou l’un des facteurs de risque mentionnés ci-dessous, la pertinence du traitement par MINIDRIL doit être discutée avec elle.
En cas d’aggravation ou de survenue de l’un de ces troubles ou facteurs de risque, la nécessité d’interrompre l’utilisation de MINIDRIL doit être discutée entre le médecin et la patiente.
MINIDRIL et Thrombose
Risque de thrombo-embolie veineuse (TEV)
Le risque de TEV est augmenté chez les femmes qui utilisent un contraceptif hormonal combiné (CHC) en comparaison aux femmes qui n’en utilisent pas. Les CHC contenant du lévonorgestrel, du norgestimate ou de la noréthistérone sont associés au risque de TEV le plus faible. La décision d’utiliser MINIDRIL doit être prise uniquement après concertation avec la patiente afin de s’assurer qu’elle comprend le risque de TEV associé à MINIDRIL, l’influence de ses facteurs de risque actuels sur ce risque et le fait que le risque de TEV est maximal pendant la première année d’utilisation. Certaines données indiquent également une augmentation du risque lors de la reprise d’un CHC après une interruption de 4 semaines ou plus.
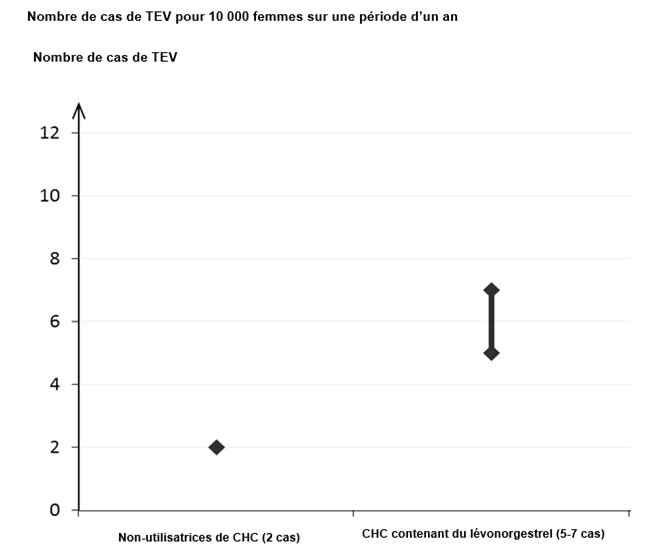
Parmi les femmes qui n’utilisent pas de CHC et qui ne sont pas enceintes, environ 2 sur 10 000 développeront une TEV sur une période d’un an. Cependant, chez une femme donnée, le risque peut être considérablement plus élevé, selon les facteurs de risque qu’elle présente (voir ci-dessous).
On estime que sur 10 000 femmes qui utilisent un CHC contenant du lévonorgestrel, 61 développeront une TEV sur une période d’un an.
[1] Point central de l’intervalle de 5-7 pour 10 000 années-femmes sur la base d’un risque relatif, pour les CHC contenant du lévonorgestrel par rapport à la non-utilisation d’un CHC, d’environ 2,3 à 3,6.
Ce nombre de TEV par année est inférieur à celui attendu pendant la grossesse ou en période post-partum.
La TEV peut être fatale dans 1 à 2 % des cas.
De façon extrêmement rare, des cas de thrombose ont été signalés chez des utilisatrices de CHC dans d’autres vaisseaux sanguins, p. ex. les veines et artères hépatiques, mésentériques, rénales ou rétiniennes.
Facteurs de risque de TEV
Le risque de complications thrombo-emboliques veineuses chez les utilisatrices de CHC peut être considérablement accru si d’autres facteurs de risque sont présents, en particulier si ceux-ci sont multiples (voir le tableau ci-dessous).
MINIDRIL est contre-indiqué chez les femmes présentant de multiples facteurs de risque, ceux-ci les exposant à un risque élevé de thrombose veineuse (voir rubrique 4.3). Lorsqu’une femme présente plus d’un facteur de risque, il est possible que l’augmentation du risque soit supérieure à la somme des risques associés à chaque facteur pris individuellement – dans ce cas, le risque global de TEV doit être pris en compte. Si le rapport bénéfice/risque est jugé défavorable, le CHC ne doit pas être prescrit (voir rubrique 4.3).
Tableau : Facteurs de risque de TEV
|
Facteur de risque |
Commentaire |
|
Obésité (indice de masse corporelle supérieur à 30 kg/m²) |
L’élévation de l’IMC augmente considérablement le risque. Ceci est particulièrement important à prendre en compte si d’autres facteurs de risque sont présents. |
|
Immobilisation prolongée, intervention chirurgicale majeure, toute intervention chirurgicale sur les jambes ou le bassin, neurochirurgie ou traumatisme majeur Remarque : l’immobilisation temporaire, y compris les trajets aériens > 4 heures, peut également constituer un facteur de risque de TEV, en particulier chez les femmes présentant d’autres facteurs de risque |
Dans ces situations, il est conseillé de suspendre l’utilisation de la pilule (au moins quatre semaines à l’avance en cas de chirurgie programmée) et de ne reprendre le CHC que deux semaines au moins après la complète remobilisation. Une autre méthode de contraception doit être utilisée afin d’éviter une grossesse non désirée. Un traitement anti-thrombotique devra être envisagé si MINIDRIL n’a pas été interrompu à l’avance.
|
|
Antécédents familiaux (thrombo-embolie veineuse survenue dans la fratrie ou chez un parent, en particulier à un âge relativement jeune, c.-à-d. avant 50 ans) |
En cas de prédisposition héréditaire suspectée, la femme devra être adressée à un spécialiste pour avis avant toute décision concernant l’utilisation de CHC. |
|
Autres affections médicales associées à la TEV |
Cancer, lupus érythémateux disséminé, syndrome hémolytique et urémique, maladies inflammatoires chroniques intestinales (maladie de Crohn ou rectocolite hémorragique) et drépanocytose. |
|
Âge |
En particulier au-delà de 35 ans. |
Il n’existe aucun consensus quant au rôle éventuel joué par les varices et les thrombophlébites superficielles dans l’apparition ou la progression d’une thrombose veineuse.
L’augmentation du risque de thrombo-embolie pendant la grossesse, et en particulier pendant les 6 semaines de la période puerpérale, doit être prise en compte (pour des informations concernant « Grossesse et allaitement », voir rubrique 4.6).
Symptômes de TEV (thrombose veineuse profonde et embolie pulmonaire)
Les femmes doivent être informées qu’en cas d’apparition de ces symptômes, elles doivent consulter un médecin en urgence et lui indiquer qu’elles utilisent un CHC.
Les symptômes de la thrombose veineuse profonde (TVP) peuvent inclure :
· gonflement unilatéral d’une jambe et/ou d’un pied ou le long d’une veine de la jambe ;
· douleur ou sensibilité dans une jambe, pouvant n’être ressentie qu’en position debout ou lors de la marche ;
· sensation de chaleur, rougeur ou changement de la coloration cutanée de la jambe affectée.
Les symptômes de l’embolie pulmonaire (EP) peuvent inclure :
· apparition soudaine et inexpliquée d’un essoufflement ou d’une accélération de la respiration ;
· toux soudaine, pouvant être associée à une hémoptysie ;
· douleur thoracique aiguë ;
· étourdissements ou sensations vertigineuses sévères ;
· battements cardiaques rapides ou irréguliers.
Certains de ces symptômes (p. ex. « essoufflement », « toux ») ne sont pas spécifiques et peuvent être interprétés à tort comme des signes d’événements plus fréquents ou moins sévères (infections respiratoires, p. ex.).
Les autres signes d’une occlusion vasculaire peuvent inclure : douleur soudaine, gonflement et coloration légèrement bleutée d’une extrémité.
Si l’occlusion se produit dans l’œil, les symptômes peuvent débuter sous la forme d’une vision trouble indolore pouvant évoluer vers une perte de la vision. Dans certains cas, la perte de la vision peut survenir presque immédiatement.
Risque de thrombo-embolie artérielle (TEA)
Des études épidémiologiques ont montré une association entre l’utilisation de CHC et l’augmentation du risque de thrombo-embolie artérielle (infarctus du myocarde) ou d’accident cérébrovasculaire (p. ex. accident ischémique transitoire, AVC). Les événements thrombo-emboliques artériels peuvent être fatals.
Facteurs de risque de TEA
Le risque de complications thrombo-emboliques artérielles ou d’accident cérébrovasculaire chez les utilisatrices de CHC augmente avec la présence de facteurs de risque (voir le tableau). MINIDRIL est contre-indiqué chez les femmes présentant un facteur de risque sévère ou de multiples facteurs de risque de TEA qui les exposent à un risque élevé de thrombose artérielle (voir rubrique 4.3).
Lorsqu’une femme présente plus d’un facteur de risque, il est possible que l’augmentation du risque soit supérieure à la somme des risques associés à chaque facteur pris individuellement – dans ce cas, le risque global doit être pris en compte. Si le rapport bénéfice/risque est jugé défavorable, le CHC ne doit pas être prescrit (voir rubrique 4.3).
Tableau : Facteurs de risque de TEA
|
Facteur de risque |
Commentaire |
|
Âge |
En particulier au-delà de 35 ans. |
|
Tabagisme |
Il doit être conseillé aux femmes de ne pas fumer si elles souhaitent utiliser un CHC. Il doit être fortement conseillé aux femmes de plus de 35 ans qui continuent de fumer d’utiliser une méthode de contraception différente. |
|
Hypertension artérielle |
|
|
Obésité (indice de masse corporelle supérieur à 30 kg/m2) |
L’élévation de l’IMC augmente considérablement le risque. Ceci est particulièrement important à prendre en compte chez les femmes présentant d’autres facteurs de risque. |
|
Antécédents familiaux (thrombo-embolie artérielle survenue dans la fratrie ou chez un parent, en particulier à un âge relativement jeune, c.-à-d. avant 50 ans) |
En cas de prédisposition héréditaire suspectée, la femme devra être adressée à un spécialiste pour avis avant toute décision concernant l’utilisation de CHC. |
|
Migraine |
L’accroissement de la fréquence ou de la sévérité des migraines lors de l’utilisation d’un CHC (qui peut être le prodrome d’un événement cérébrovasculaire) peut constituer un motif d’arrêt immédiat du CHC. |
|
Autres affections médicales associées à des événements indésirables vasculaires |
Diabète, hyperhomocystéinémie, valvulopathie cardiaque et fibrillation auriculaire, dyslipoprotéinémie et lupus érythémateux disséminé. |
Symptômes de TEA
Les femmes doivent être informées qu’en cas d’apparition de ces symptômes, elles doivent consulter un médecin en urgence et lui indiquer qu’elles utilisent un CHC.
Les symptômes d’un accident cérébrovasculaire peuvent inclure :
· apparition soudaine d’un engourdissement ou d’une faiblesse du visage, d’un bras ou d’une jambe, en particulier d’un côté du corps ;
· apparition soudaine de difficultés à marcher, de sensations vertigineuses, d’une perte d’équilibre ou de coordination ;
· apparition soudaine d’une confusion, de difficultés à parler ou à comprendre ;
· apparition soudaine de difficultés à voir d’un œil ou des deux yeux ;
· céphalée soudaine, sévère ou prolongée, sans cause connue ;
· perte de conscience ou évanouissement avec ou sans crise convulsive.
Des symptômes temporaires suggèrent qu’il s’agit d’un accident ischémique transitoire (AIT).
Les symptômes de l’infarctus du myocarde (IM) peuvent inclure :
· douleur, gêne, pression, lourdeur, sensation d’oppression ou d’encombrement dans la poitrine, le bras ou sous le sternum ;
· sensation de gêne irradiant vers le dos, la mâchoire, la gorge, le bras, l’estomac ;
· sensation d’encombrement, d’indigestion ou de suffocation ;
· transpiration, nausées, vomissements ou sensations vertigineuses ;
· faiblesse, anxiété ou essoufflement extrêmes ;
· battements cardiaques rapides ou irréguliers.
MINIDRIL et Tumeurs
Certaines études épidémiologiques suggèrent que les CHC pourraient être associés à une augmentation du risque de cancer du col de l'utérus chez les utilisatrices de CHC au long cours (> 5 ans). Il n'est cependant pas établi si ces pathologies sont dues à d'autres facteurs comme le comportement sexuel et le papillomavirus virus humain (HPV).
Une méta-analyse de 54 études épidémiologiques a conclu qu'il existe une légère augmentation du risque relatif (RR = 1,24) de cancer du sein chez les femmes sous contraception orale. Cette majoration du risque disparaît progressivement au cours des 10 ans qui suivent l'arrêt du CHC.
Le cancer du sein étant rare chez les femmes de moins de 40 ans, le nombre plus élevé de cancers diagnostiqués chez les utilisatrices habituelles ou nouvelles utilisatrices de CHC reste faible par rapport au risque global de cancer du sein.
Ces études ne permettent pas d'établir une relation de causalité. Il est possible que, chez les utilisatrices de CHC, cette augmentation du risque soit due à un diagnostic plus précoce du cancer du sein, aux effets biologiques de cette contraception ou à l'association des deux. Les cancers du sein diagnostiqués chez les utilisatrices ont tendance à être moins évolués cliniquement par rapport à ceux diagnostiqués chez des femmes n'en ayant jamais utilisé.
Dans de rares cas, des tumeurs bénignes du foie (par exemple : adénome hépatique, hyperplasie nodulaire focale), et dans de plus rares cas encore, des tumeurs malignes du foie ont été rapportées chez des utilisatrices de CHC.
Dans des cas isolés, ces tumeurs ont conduit à des hémorragies intra-abdominales mettant en jeu le pronostic vital. Chez les femmes sous CHC, la survenue de douleurs de la partie supérieure de l'abdomen, d'augmentation du volume du foie ou de signes d'hémorragie intra-abdominale doit faire évoquer une tumeur hépatique.
L'utilisation de CHC plus fortement dosés (50 µg d’éthinylestradiol) diminue le risque de cancer de l'endomètre et de l'ovaire. Ceci demande à être confirmé avec les CHC plus faiblement dosés.
Autres pathologies
Hypertriglycéridémie
Chez les femmes atteintes d'hypertriglycéridémie ou ayant des antécédents familiaux d'hypertriglycéridémie, un risque accru de pancréatite peut survenir en cas d'utilisation d'un CHC.
Hypertension artérielle
Une augmentation modérée de la pression artérielle a été observée chez de nombreuses femmes sous CHC mais elle était rarement cliniquement significative. Une interruption immédiate du CHC n'est justifiée que dans ces rares cas.
La persistance de chiffres tensionnels élevés ou le non-contrôle des chiffres tensionnels par un traitement antihypertenseur chez une femme hypertendue prenant un CHC doit faire interrompre celle-ci.
Le CHC pourra éventuellement être repris après normalisation des chiffres tensionnels par un traitement antihypertenseur.
Affections hépatiques
La survenue d’anomalies hépatiques aigues ou chroniques peut nécessiter l’arrêt du CHC jusqu’à la normalisation des paramètres hépatiques.
Angio-œdème
Les œstrogènes exogènes peuvent déclencher ou aggraver les symptômes d'un angio-œdème héréditaire ou acquis.
Intolérance au glucose/Diabète
Les CHC peuvent avoir un effet sur la résistance périphérique à l'insuline et la tolérance au glucose ; il n'est cependant pas obligatoire de modifier le traitement chez des diabétiques utilisant un CHC faiblement dosé (contenant moins de 0,05 mg d'éthinylestradiol). Les femmes diabétiques doivent cependant être étroitement surveillées, en particulier lors de l'instauration d'un CHC.
Autres
La récidive d'un ictère cholestatique et/ou d'un prurit liés à une cholestase survenue au cours d'une grossesse précédente ou de la prise antérieure d'hormones stéroïdiennes doit faire arrêter le CHC.
La survenue ou l’aggravation des pathologies suivantes a été observée au cours de la grossesse ou chez des femmes prenant des CHC, bien que la responsabilité des CHC n’ait pu être établie : ictère et/ou prurit dû à une cholestase, lithiase biliaire, porphyrie, lupus érythémateux disséminé, syndrome hémolytico-urémique, chorée de Sydenham, herpès gravidique, hypoacousie par otosclérose.
Des cas d’aggravations de dépression endogène, d'épilepsie, de maladie de Crohn et de rectocolite hémorragique ont été observés sous CHC.
L’état dépressif et la dépression sont des effets indésirables bien connus liés à l’utilisation de contraceptifs hormonaux (voir rubrique 4.8). La dépression peut être grave et constitue un facteur de risque bien connu de comportement suicidaire et de suicide. Il convient de conseiller aux femmes de contacter leur médecin en cas de changements d’humeur et de symptômes dépressifs, y compris peu de temps après le début du traitement.
Un chloasma peut survenir, en particulier chez les femmes ayant des antécédents de chloasma gravidique. Les femmes ayant une prédisposition au chloasma sous CHC doivent éviter de s'exposer au soleil ou aux rayons ultra-violets.
Une attention particulière devra être portée aux patientes ayant une hyperprolactinémie.
Excipients à effet notoire
Ce médicament contient du lactose. Les patients présentant une intolérance au galactose, un déficit total en lactase ou un syndrome de malabsorption du glucose et du galactose (maladies héréditaires rares) ne doivent pas prendre ce médicament.
Ce médicament contient du saccharose. Les patients présentant une intolérance au fructose, un syndrome de malabsorption du glucose et du galactose ou un déficit en sucrase/isomaltase (maladies héréditaires rares) ne doivent pas prendre ce médicament.
Consultation/examen médical
Avant l’instauration ou la reprise d’un traitement par MINIDRIL, une recherche complète des antécédents médicaux (y compris les antécédents familiaux) doit être effectuée et la présence d’une grossesse doit être exclue. La pression artérielle doit être mesurée et un examen physique doit être réalisé, en ayant à l’esprit les contre-indications (voir rubrique 4.3) et les mises en garde (voir rubrique 4.4). Il est important d’attirer l’attention des patientes sur les informations relatives à la thrombose veineuse et artérielle, y compris le risque associé à MINIDRIL comparé à celui associé aux autres CHC, les symptômes de la TEV et de la TEA, les facteurs de risque connus et la conduite à tenir en cas de suspicion de thrombose.
Il doit également être indiqué aux patientes de lire attentivement la notice et de suivre les conseils fournis. La fréquence et la nature des examens doivent être définies sur la base des recommandations en vigueur et adaptées à chaque patiente.
Les patientes doivent être averties que les contraceptifs hormonaux ne protègent pas contre l’infection par le VIH (SIDA) et les autres maladies sexuellement transmissibles.
Examens biologiques
L’utilisation de contraceptifs hormonaux peut modifier les résultats de certains examens biologiques tels que : les tests fonctionnels hépatiques, thyroïdiens, surrénaliens et rénaux, le taux plasmatique des protéines (porteuses) comme la corticosteroid-binding globulin (CBG) et des fractions lipidiques/lipoprotéiniques, les paramètres du métabolisme glucidique, les paramètres de la coagulation et de la fibrinolyse. Les modifications restent en général dans les limites de la normale.
Diminution de l'efficacité
L'efficacité des CHC peut être réduite en cas d'oubli de comprimés actifs (voir rubrique 4.2), de troubles gastro-intestinaux (voir rubrique 4.2) ou de prise concomitante d’autres médicaments (voir rubrique 4.5).
Troubles du cycle
Des saignements irréguliers (« spottings » ou métrorragies) peuvent survenir sous contraceptifs oraux, en particulier au cours des premiers mois. Ces saignements irréguliers seront considérés comme significatifs s'ils persistent après environ 3 cycles.
Si les saignements irréguliers persistent ou surviennent après des cycles réguliers, une recherche étiologique non hormonale doit alors être effectuée ; des examens diagnostiques appropriés doivent être pratiqués afin d'exclure une tumeur maligne ou une grossesse. Ces examens peuvent comporter un curetage.
Chez certaines femmes, les hémorragies de privation peuvent ne pas survenir au cours de l'intervalle libre. Si la contraception orale a été suivie telle que décrite dans la rubrique 4.2, il est peu probable que la femme soit enceinte. Cependant, si la contraception orale n'a pas été suivie correctement avant l'absence de la première hémorragie de privation ou si deux hémorragies de privation successives ne se produisent pas, il convient de s'assurer de l'absence de grossesse avant de poursuivre cette contraception.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Les interactions entre les contraceptifs estroprogestatifs et d'autres substances peuvent conduire à une augmentation ou une diminution des concentrations plasmatiques d’estroprogestatifs.
La diminution des concentrations plasmatiques d’estroprogestatifs peut provoquer une augmentation de l'incidence des saignements intermenstruels et éventuellement réduire l'efficacité du contraceptif estroprogestatif.
Associations contre-indiquées
+ Millepertuis
Diminution des concentrations plasmatiques du contraceptif hormonal, en raison de l'effet inducteur enzymatique du millepertuis, avec risque de baisse d'efficacité voire d'annulation de l'effet dont les conséquences peuvent être éventuellement graves (survenue d'une grossesse).
+ Ombitasvir/paritaprévir/ritonavir, dasabuvir (avec ou sans ribavirine), glécaprévir/pibrentasvir et sofosbuvir/velpatasvir/voxilaprévir
Augmentation de l’hépatotoxicité.
Interactions pharmacodynamiques
Au cours des essais cliniques menés chez des patients traités pour une infection par le virus de l'hépatite C (VHC) et recevant des médicaments contenant de l’ombitasvir/paritaprévir/ritonavir, du dasabuvir avec ou sans ribavirine, il a été observé des augmentations de transaminase (ALAT) supérieures à 5 fois la limite supérieure de la normale (LSN), significativement plus fréquentes chez les femmes utilisant des médicaments contenant de l'éthinylestradiol, tels que les contraceptifs hormonaux combinés (CHC). De plus, chez des patients traités par le glécaprevir/pibrentasvir ou le sofosbuvir/velpatasvir/voxilaprévir, des augmentations des ALAT ont été observées chez les femmes utilisant des médicaments contenant de l'éthinylestradiol tels que les CHC (voir la rubrique 4.3).
Par conséquent, les utilisatrices de MINIDRIL doivent changer de méthode de contraception (par exemple contraceptif à base de progestatif seul ou méthodes non hormonales) avant de débuter un traitement avec ces associations de médicaments. MINIDRIL peut être réinstauré 2 semaines après la fin du traitement avec ces associations de médicaments.
+ Inducteurs enzymatiques
(Par exemple apalutamide, carbamazépine, dabrafénib, éfavirenz, enzalutamide, eslicarbazépine, fosphénytoïne, létermovir, lorlatinib, lumacaftor, névirapine, oxcarbazépine, phénobarbital, phénytoïne, pitolisant, primidone, rifabutine, rifampicine)
Diminution de l'efficacité contraceptive, par augmentation du métabolisme hépatique du contraceptif hormonal par l’inducteur.
Utiliser une méthode additionnelle de type mécanique (préservatif) pendant la durée de l'association, et un cycle suivant l’arrêt de l’inducteur.
+ Inhibiteurs de protéases boostés par ritonavir
(Par exemple atazanavir, darunavir, fosamprénavir, lopinavir, ritonavir, saquinavir, tipranavir)
Risque de diminution de l'efficacité contraceptive par diminution des concentrations en contraceptif hormonal due à l’augmentation de son métabolisme hépatique par le ritonavir.
Utiliser une méthode additionnelle de type mécanique (préservatif) pendant la durée de l'association, et un cycle suivant l’arrêt du ritonavir.
+ Lamotrigine (voir aussi ci-dessous Associations nécessitant des précautions d’emploi)
Diminution des concentrations et de l’efficacité de la lamotrigine par augmentation de son métabolisme hépatique.
Eviter de mettre en route une contraception orale pendant la période d’ajustement posologique de la lamotrigine.
+ Modafinil
Risque de diminution de l'efficacité contraceptive, pendant le traitement et un cycle après l'arrêt du traitement par le modafinil, en raison de son potentiel inducteur enzymatique.
Utiliser une méthode additionnelle de type mécanique (préservatif) pendant la durée de l’association, et un cycle suivant l’arrêt du modafinil.
+ Pérampanel
Pour des doses de pérampanel ≥ 12 mg/j : risque de diminution de l’efficacité contraceptive.
Utiliser de préférence une autre méthode contraceptive, en particulier de type mécanique.
+ Topiramate
Pour des doses de topiramate ≥ 200 mg/jour : risque de diminution de l’efficacité contraceptive par diminution des concentrations en estrogène.
Si l’association s’avère nécessaire, utiliser une méthode additionnelle de type mécanique pendant la durée de l’association, et un cycle suivant l’arrêt du topiramate.
+ Ulipristal
Dans l’indication contraception d’urgence :
Antagonisme des effets de l’ulipristal en cas de reprise d’un contraceptif hormonal moins de 5 jours après la prise de la contraception d’urgence.
Dans le cas où la (re)prise d’une contraception hormonale est envisagée, utiliser une contraception additionnelle de type mécanique pendant les 12 jours qui suivent la (dernière) prise de l’ulipristal (au cas où il y en aurait eu plus d’une).
Dans l’indication fibrome :
Antagonisme réciproque des effets de l’ulipristal et du progestatif, avec risque d’inefficacité.
Dans le cas où la (re)prise d’une contraception hormonale est envisagée, utiliser une contraception de type mécanique pendant les 7 premiers jours de la contraception hormonale.
+ Vémurafénib
Risque de diminution des concentrations des estroprogestatifs, avec pour conséquence un risque d’inefficacité.
Associations faisant l’objet de précautions d’emploi
+ Aprépitant
Diminution de l’efficacité contraceptive par augmentation du métabolisme hépatique du contraceptif hormonal par l’aprépitant.
Utiliser une méthode additionnelle de type mécanique (préservatif) pendant la durée de l'association, et un cycle suivant l’arrêt de l’aprépitant.
+ Bosentan
Diminution de l'efficacité contraceptive par augmentation du métabolisme hépatique du contraceptif hormonal par le bosentan.
Utiliser une méthode additionnelle de type mécanique (préservatif) pendant la durée de l'association, et un cycle suivant l’arrêt du bosentan.
+ Elvitégravir
Diminution de l’efficacité contraceptive par augmentation du métabolisme hépatique du contraceptif hormonal par l’elvitégravir.
Utiliser une méthode additionnelle de type mécanique (préservatif) pendant la durée de l’association, et un cycle suivant l’arrêt de l’elvitégravir.
+ Felbamate
Risque de diminution de l’efficacité contraceptive, pendant le traitement et un cycle après l’arrêt du traitement par le felbamate, en raison de son potentiel inducteur enzymatique.
Utiliser une méthode additionnelle de type mécanique (préservatif) pendant la durée de l’association, et un cycle suivant l’arrêt du felbamate.
+ Griséofulvine
Diminution de l'efficacité contraceptive par augmentation du métabolisme hépatique du contraceptif hormonal par la griséofulvine.
Utiliser une méthode additionnelle de type mécanique (préservatif) pendant la durée de l'association, et un cycle suivant l’arrêt de la griséofulvine.
+ Lamotrigine
Diminution des concentrations et de l’efficacité de la lamotrigine par augmentation de son métabolisme hépatique.
Surveillance clinique et adaptation de la posologie de la lamotrigine lors de la mise en route d’une contraception orale et après son arrêt.
+ Rufinamide
Diminution de l’efficacité contraceptive par augmentation du métabolisme hépatique du contraceptif hormonal par le rufinamide.
Utiliser une méthode additionnelle de type mécanique (préservatif) pendant la durée de l’association, et un cycle suivant l’arrêt du rufinamide.
4.6. Fertilité, grossesse et allaitement
Grossesse
MINIDRIL n'est pas indiqué pendant la grossesse. En cas de découverte d’une grossesse sous ce médicament, son utilisation doit immédiatement être interrompue.
De nombreuses études épidémiologiques n’ont pas révélé d’augmentation du risque d’anomalies congénitales chez les enfants nés de femmes ayant utilisé un contraceptif oral avant la grossesse.
Aucun effet tératogène n’a été observé lorsqu’un contraceptif oral combiné a été pris par erreur en début de grossesse.
L’augmentation du risque de TEV en période post-partum doit être prise en compte lors de la reprise de MINIDRIL (voir rubriques 4.2 et 4.4).
En cas d'allaitement, l'utilisation de ce médicament est déconseillée en raison du passage des estroprogestatifs dans le lait maternel.
Si la femme désire allaiter, un autre moyen de contraception doit être proposé.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Pour les effets indésirables graves, tels que les accidents thromboemboliques veineux et artériels, les cancers du col de l’utérus, les cancers du sein et les tumeurs hépatiques malignes, voir rubrique 4.4.
Une augmentation du risque d'événement thrombotique et thrombo-embolique artériel et veineux, incluant l’infarctus du myocarde, l’AVC, les accidents ischémiques transitoires, la thrombose veineuse et l’embolie pulmonaire, a été observée chez les femmes utilisant des CHC ; ceci est abordé plus en détails en rubrique 4.4.
|
|
Fréquent |
Peu fréquent |
Rare |
Très rare |
Fréquence indéterminée |
|
Tumeurs bénignes, malignes et non précisées (incl kystes et polypes) |
|
|
|
Carcinome hépatocellulaire, tumeurs hépatiques bénignes (par exemple : hyperplasie nodulaire focale, adénome hépatique) |
|
|
Infections et infestations |
Vaginite incluant candidose vaginale |
|
|
|
|
|
Affections du système immunitaire |
|
|
Réactions anaphylactiques avec de très rares cas d'urticaire, angio-œdème, troubles circulatoire et respiratoire sévères |
Exacerbation d'un lupus érythémateux disséminé |
Aggravation des symptômes d’un angio-œdème héréditaire ou acquis |
|
Troubles du métabolisme et de la nutrition |
|
Modification de l'appétit (augmentation ou diminution) |
Intolérance au glucose |
Exacerbation d'une porphyrie |
|
|
Affections psychiatriques |
Modification de l'humeur incluant la dépression, modification de la libido. |
|
|
|
|
|
Affections du système nerveux |
Nervosité, étourdissement |
|
|
Exacerbation d'une chorée |
|
|
Affections oculaires |
|
|
Irritation par les lentilles de contact |
Névrite optique |
|
|
Affections vasculaires |
|
Hypertension artérielle |
Thrombo-embolie veineuse et thrombo-embolie artérielle |
Aggravation des varices |
|
|
Affections gastro-intestinales |
Nausée, vomissement, douleur abdominale |
Crampes abdominales, ballonnement |
|
Colite ischémique |
Maladie inflammatoire du colon (maladie de Crohn, colite ulcéreuse) |
|
Affections hépatobiliaires |
|
|
Ictère cholestatique |
Pancréatite, lithiase biliaire, cholestase |
Atteinte hépatocellulaire (par exemple : hépatite, fonction hépatique anormale) |
|
Affections de la peau et des tissus sous-cutanés |
Acné |
Rashs, chloasma (melasme) avec risque de persistance, hirsutisme, alopécie |
Erythème noueux |
Erythème polymorphe |
|
|
Affections du rein et des voies urinaires |
|
|
|
Syndrome hémolytique urémique |
|
|
Affections des organes de reproduction et sein |
Douleur, tension, gonflement et sécrétions mammaires, dysménorrhée, modification des règles, modification d’un ectropion et des sécrétions vaginales, aménorrhée |
|
|
|
|
|
Troubles généraux et anomalies au site d'administration |
Rétention hydrique/œdème Modification du poids (augmentation ou diminution) |
|
|
|
|
|
Investigations |
|
Modification des lipides plasmatiques, incluant une hypertriglycéridémie, augmentation de la pression artérielle |
|
Diminution du taux de folates sériques |
|
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : Progestatifs et estrogènes en association fixe, code ATC : G03AA07 (Système génito-urinaire et hormones sexuelles)
Estroprogestatif combiné minidosé, monophasique.
Indice de Pearl : 0,1 pour cent années femmes.
MINIDRIL est un contraceptif oral combiné (COC) contenant de l’éthinylestradiol (EE) et du lévonorgestrel. Il a été démontré que les COC exercent leur effet en diminuant la sécrétion de gonadotrophine afin de supprimer l’activité ovarienne. L'effet contraceptif qui en résulte repose sur divers mécanismes, dont le plus important est l'inhibition de l'ovulation.
5.2. Propriétés pharmacocinétiques
L'éthinylestradiol est rapidement et presque complètement absorbé par le tractus gastro-intestinal. Il subit un important effet de premier passage hépatique. Par voie orale, sa biodisponibilité moyenne est de 40 à 45 %.
Au niveau plasmatique, l'éthinylestradiol se lie exclusivement à l'albumine.
Après administration orale, le pic plasmatique d'éthinylestradiol est atteint en 60 à 180 minutes.
La demi-vie de l'éthinylestradiol est comprise entre 6 et 31 heures.
L'éthinylestradiol subit principalement une hydroxylation aromatique, mais une grande variété de métabolites hydroxylés et méthylés sont formés, que l'on retrouve sous forme libre ou conjuguée. L'éthinylestradiol conjugué est excrété par la bile et subit un cycle entérohépatique. 40 % du produit sont éliminés dans les urines et 60 % dans les selles.
Lévonorgestrel
Le lévonorgestrel est rapidement et presque complètement absorbé par le tractus gastro-intestinal. Il est totalement biodisponible.
Au niveau plasmatique, le lévonorgestrel se lie à la SHBG (sex hormone binding globulin) et à l'albumine.
Après administration orale, le pic plasmatique du lévonorgestrel est atteint en 30 à 120 minutes. La demi-vie d'élimination est d'environ 24 à 55 heures. Il est principalement métabolisé par réduction du cycle A suivi d'une glucuronidation. Environ 60 % du lévonorgestrel sont excrétés dans les urines, contre 40 % dans les selles.
5.3. Données de sécurité préclinique
Povidone K25, stéarate de magnésium, lactose monohydraté, amidon de maïs, talc.
Enrobage : saccharose, macrogol 6000, carbonate de calcium, povidone K90, cire d'abeille blanche, cire de carnauba.
6.4. Précautions particulières de conservation
Pas de précautions particulières de conservation.
6.5. Nature et contenu de l'emballage extérieur
Plaquette (PVC/Aluminium) de 21 comprimés. Boîte de 1 ou 3.
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
Pas d'exigences particulières.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
23-25, avenue du Docteur Lannelongue
75014 PARIS
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 318 239 0 2 : 21 comprimés sous plaquette (PVC/Aluminium).
· 34009 318 240 9 1 : 63 comprimés sous plaquettes (PVC/Aluminium).
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Liste I.
ANSM - Mis à jour le : 31/03/2025
Lévonorgestrel/Ethinylestradiol
Points importants à connaître concernant les contraceptifs hormonaux combinés (CHC) :
· Ils comptent parmi les méthodes de contraception réversibles les plus fiables lorsqu’ils sont utilisés correctement.
· Ils augmentent légèrement le risque de formation d’un caillot sanguin dans les veines et les artères, en particulier pendant la première année de leur utilisation ou lorsque le contraceptif hormonal combiné est repris après une interruption de 4 semaines ou plus.
· Soyez vigilante et consultez votre médecin si vous pensez présenter les symptômes évocateurs d’un caillot sanguin (voir rubrique 2 « Caillots sanguins »).
Veuillez lire attentivement cette notice avant de prendre ce médicament car elle contient des informations importantes pour vous.
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin ou votre pharmacien.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que MINIDRIL, comprimé enrobé et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant de prendre MINIDRIL, comprimé enrobé ?
3. Comment prendre MINIDRIL, comprimé enrobé ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver MINIDRIL, comprimé enrobé ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE MINIDRIL, comprimé enrobé ET DANS QUELS CAS EST-IL UTILISE ?
Classe pharmacothérapeutique : PROGESTATIFS ET ESTROGENES EN ASSOCIATION FIXE – code ATC : G03AA07.
MINIDRIL est un contraceptif hormonal oral utilisé afin d’éviter une grossesse.
Chaque comprimé de MINIDRIL contient deux hormones féminines différentes en petite quantité : le lévonorgestrel et l’éthinylestradiol.
Les contraceptifs oraux contenant deux hormones sont appelés contraceptifs oraux « combinés ».
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT DE PRENDRE MINIDRIL, comprimé enrobé ?
Avant de commencer un traitement par MINIDRIL, un interrogatoire sur vos antécédents médicaux et ceux de vos proches sera effectué par votre médecin. Votre pression artérielle sera mesurée et, si nécessaire, selon votre situation personnelle, d'autres examens pourront être demandés.
Avant de commencer à prendre MINIDRIL vous devez lire les informations concernant les caillots sanguins (thrombose) en rubrique 2. Il est particulièrement important de lire la description des symptômes d’un caillot sanguin – voir rubrique 2, « Caillots sanguins »).
Cette notice indique les situations dans lesquelles vous devez arrêter de prendre MINIDRIL ou les circonstances dans lesquelles l'efficacité contraceptive peut être diminuée. Dans ces cas, vous ne devez pas avoir de rapports sexuels ou alors, vous devez utiliser d'autres méthodes contraceptives non hormonales comme le préservatif ou toute autre barrière mécanique. N'utilisez pas de méthodes naturelles de contraception (mesure de la température, aspect de la glaire cervicale). En effet, ces méthodes peuvent ne pas être fiables car MINIDRIL a un effet sur la température corporelle et sur la glaire cervicale.
Comme les autres contraceptifs oraux, MINIDRIL ne protège pas contre l’infection par le VIH (SIDA) ni contre les autres maladies sexuellement transmissibles (MST).
Si votre médecin vous a informée d'une intolérance à certains sucres, contactez-le avant de prendre ce médicament.
Ne prenez jamais MINIDRIL, comprimé enrobé :
Vous ne devez pas utiliser MINIDRIL si vous êtes dans l’une des situations listées ci-dessous. Si tel est le cas, vous devez en informer votre médecin. Votre médecin discutera avec vous d’autres méthodes de contraception qui seraient plus adaptées.
· si vous avez (ou avez déjà eu) un caillot dans un vaisseau sanguin d’une jambe (thrombose veineuse profonde [TVP]), d’un poumon (embolie pulmonaire [EP]) ou d’autres organes ;
· si vous vous savez atteinte d’un trouble affectant la coagulation sanguine – par exemple, un déficit en protéine C, un déficit en protéine S, un déficit en antithrombine III, une mutation du facteur V de Leiden ou la présence d’anticorps anti-phospholipides ;
· si vous devez être opérée ou si vous êtes alitée pendant une durée prolongée (voir rubrique « Caillots sanguins ») ;
· si vous avez déjà eu une crise cardiaque ou un accident vasculaire cérébral (AVC) ;
· si vous avez (ou avez déjà eu) une angine de poitrine (une maladie provoquant des douleurs intenses dans la poitrine et pouvant être le signe précurseur d’une crise cardiaque) ou un accident ischémique transitoire (AIT - symptômes temporaires d’AVC) ;
· si vous avez l’une des maladies suivantes pouvant augmenter le risque de caillot dans les artères :
o diabète sévère avec atteinte des vaisseaux sanguins,
o pression artérielle très élevée,
o taux très élevé de graisses dans le sang (cholestérol ou triglycérides),
o maladie appelée hyperhomocystéinémie.
· si vous avez (ou avez déjà eu) un type de migraine appelé « migraine avec aura » ;
· si vous avez (ou avez eu) une inflammation du pancréas (pancréatite) ;
· si vous avez (ou avez eu) une affection du foie avec absence de normalisation de votre fonction hépatique ;
· si vous avez (ou avez eu) une tumeur du foie ;
· si vous avez des antécédents ou une suspicion de cancer du sein ou des organes génitaux ;
· si vous avez des saignements vaginaux inexpliqués ;
· si vous êtes allergique à l'éthinylestradiol ou au lévonorgestrel, ou à l'un des autres composants contenus dans ce médicament, mentionnés dans la rubrique 6. Ceci peut se manifester par des démangeaisons, une éruption cutanée ou un gonflement ;
· en association avec du millepertuis (voir rubrique « Autres médicaments et MINIDRIL, comprimé enrobé ») ;
· si vous avez une hépatite C et prenez des médicaments antiviraux contenant l’association ombitasvir/paritaprévir/ritonavir, le dasabuvir, le glécaprévir/pibrentasvir et le sofosbuvir/velpatasvir/voxilaprévir (voir aussi rubrique « Autres médicaments et MINIDRIL, comprimé enrobé »).
Avertissements et précautions
Adressez-vous à votre médecin ou pharmacien avant de prendre MINIDRIL, comprimé enrobé.
Dans quels cas devez-vous contacter votre médecin ?
Consultez un médecin de toute urgence
- si vous remarquez de possibles signes d’un caillot sanguin, qui pourraient indiquer que vous avez un caillot sanguin dans une jambe (thrombose veineuse profonde), que vous avez un caillot sanguin dans un poumon (embolie pulmonaire) ou que vous faites une crise cardiaque ou un AVC (voir rubrique « Caillots sanguins » ci-dessous).
Pour la description des symptômes de ces effets indésirables graves, reportez-vous à la rubrique « Comment reconnaître un caillot sanguin ».
Si vous êtes dans l’une des situations suivantes, informez-en votre médecin.
Si le problème apparaît ou s’aggrave pendant l’utilisation de MINIDRIL vous devez également en informer votre médecin.
· en cas de survenue ou antécédent de cancer du sein chez un parent proche ;
· si vous avez une affection du foie ou de la vésicule biliaire ;
· si vous êtes diabétique ;
· en cas de dépression ;
· si vous êtes atteinte de la maladie de Crohn ou de rectocolite hémorragique (maladies inflammatoires chroniques des intestins) ;
· si vous avez un lupus érythémateux disséminé (LED) (une maladie qui affecte votre système de défenses naturelles) ;
· si vous avez un syndrome hémolytique et urémique (SHU) (un trouble de la coagulation sanguine qui entraîne une défaillance des reins) ;
· si vous avez une drépanocytose (une maladie héréditaire touchant les globules rouges) ;
· si vous avez des taux élevés de graisses dans le sang (hypertriglycéridémie) ou des antécédents familiaux de ce trouble. L’hypertriglycéridémie a été associée à une augmentation du risque de pancréatite (inflammation du pancréas) ;
· si vous devez être opérée ou si vous êtes alitée pendant une durée prolongée (reportez-vous à la rubrique 2, « Caillots sanguins ») ;
· si vous venez juste d’accoucher, vous êtes exposée à un risque augmenté de caillots sanguins. Vous devez demander à votre médecin combien de temps après l’accouchement vous pouvez commencer à prendre MINIDRIL ;
· si vous avez une inflammation des veines situées sous la peau (thrombophlébite superficielle) ;
· si vous avez des varices ;
· si vous êtes épileptique (voir « Autres médicaments et MINIDRIL, comprimé enrobé ») ;
· si vous avez une augmentation de la prolactine ;
· si vous avez présenté l'une des pathologies suivantes lors d'une grossesse ou la prise antérieure d'un traitement hormonal : perte auditive, maladie du sang appelée porphyrie, herpès gestationnel (éruption de vésicules sur la peau pendant la grossesse), chorée de Sydenham (maladie des nerfs avec survenue de mouvements corporels brusques non contrôlés) ;
· en cas d’antécédents ou de survenue de chloasma (taches brun doré en particulier sur le visage, appelées « masque de grossesse »). Dans ce cas, évitez toute exposition directe au soleil ou aux rayons ultraviolets ;
· si vous développez des symptômes d’angio-œdème, tels qu’un gonflement du visage, de la langue et/ou de la gorge et/ou des difficultés à avaler ou une urticaire avec éventuellement des difficultés à respirer, consultez immédiatement votre médecin. Les produits contenant des œstrogènes peuvent déclencher ou aggraver les symptômes d’un angio-œdème héréditaire ou acquis.
Troubles psychiatriques
Certaines femmes qui utilisent des contraceptifs hormonaux dont MINIDRIL ont fait état d’une dépression ou d’un état dépressif. La dépression peut être grave et peut parfois donner lieu à des idées suicidaires. Si vous présentez des changements d’humeur et des symptômes dépressifs, sollicitez les conseils de votre médecin dès que possible.
CAILLOTS SANGUINS
L’utilisation d’un contraceptif hormonal combiné tel que MINIDRIL augmente le risque d’apparition d’un caillot sanguin en comparaison à une non-utilisation. Dans de rares cas, un caillot sanguin peut bloquer des vaisseaux sanguins et provoquer de graves problèmes.
Les caillots sanguins peuvent se former :
· dans les veines (on parle alors de « thrombose veineuse » ou de « thrombo-embolie veineuse » [TEV]) ;
· dans les artères (on parle alors de « thrombose artérielle » ou de « thrombo-embolie artérielle » [TEA]).
Le rétablissement, suite à des caillots sanguins, n’est pas toujours complet. Dans de rares cas, ils peuvent entraîner des séquelles graves et durables et, dans de très rares cas, ils peuvent être fatals.
Il est important de garder à l’esprit que le risque global de caillot sanguin dû à MINIDRIL est faible.
COMMENT RECONNAÎTRE UN CAILLOT SANGUIN
Consultez un médecin de toute urgence si vous remarquez l’un des signes ou symptômes suivants.
|
Présentez-vous l’un de ces signes ? |
Il peut éventuellement s’agir de : |
|
· Gonflement d’une jambe ou le long d’une veine de la jambe ou du pied, en particulier s’il s’accompagne de : o douleur ou sensibilité dans la jambe, pouvant n’être ressentie qu’en position debout ou lors de la marche ; o chaleur dans la jambe affectée ; o changement de couleur de la peau de la jambe, devenant p. ex. pâle, rouge ou bleue.
|
Thrombose veineuse profonde |
|
· Apparition soudaine et inexpliquée d’un essoufflement ou d’une respiration rapide ; · toux soudaine sans cause apparente, avec parfois des crachats de sang ; · douleur aiguë dans la poitrine, qui peut s’accentuer en cas de respiration profonde ; · étourdissements ou sensations vertigineuses sévères ; · battements de cœur rapides ou irréguliers ; · douleur intense dans l’estomac. En cas de doute, consultez un médecin car certains de ces symptômes, comme la toux ou l’essoufflement, peuvent être pris à tort pour les signes d’une maladie moins sévère telle qu’une infection respiratoire (p.ex. un simple rhume). |
Embolie pulmonaire |
|
Symptômes apparaissant le plus souvent dans un seul œil : · perte immédiate de la vision ou vision trouble sans douleur pouvant évoluer vers une perte de la vision.
|
Thrombose veineuse rétinienne (caillot sanguin dans l’œil) |
|
· Douleur, gêne, pression, lourdeur dans la poitrine ; · sensation d’oppression ou d’encombrement dans la poitrine, le bras ou sous le sternum ; · sensation d’encombrement, d’indigestion ou de suffocation ; · sensation de gêne dans le haut du corps irradiant vers le dos, la mâchoire, la gorge, le bras et l’estomac ; · transpiration, nausées, vomissements ou sensations vertigineuses ; · faiblesse, anxiété ou essoufflement extrêmes ; · battements de cœur rapides ou irréguliers. |
Crise cardiaque |
|
· Apparition soudaine d’une faiblesse ou d’un engourdissement au niveau du visage, d’un bras ou d’une jambe, en particulier d’un côté du corps ; · apparition soudaine d’une confusion, de difficultés à parler ou à comprendre ; · apparition soudaine de difficultés à voir d’un œil ou des deux yeux ; · apparition soudaine de difficultés à marcher, de sensations vertigineuses, d’une perte d’équilibre ou de coordination ; · maux de tête soudains, sévères ou prolongés, sans cause connue ; · perte de conscience ou évanouissement avec ou sans crise convulsive. Parfois, les symptômes de l’AVC peuvent être de courte durée, avec un rétablissement presque immédiat et complet, mais vous devez tout de même consulter un médecin de toute urgence car vous pourriez être exposée au risque d’un nouvel AVC. |
Accident vasculaire cérébral (AVC) |
|
· Gonflement et coloration légèrement bleutée d’une extrémité ; · douleur intense dans l’estomac (« abdomen aigu »). |
Caillots sanguins bloquant d’autres vaisseaux sanguins |
CAILLOTS SANGUINS DANS UNE VEINE
Que peut-il se passer si un caillot sanguin se forme dans une veine ?
· Un lien a été établi entre l’utilisation de contraceptifs hormonaux combinés et l’augmentation du risque de caillots sanguins dans les veines (thrombose veineuse). Cependant, ces effets indésirables sont rares. Le plus souvent, ils surviennent pendant la première année d’utilisation d’un contraceptif hormonal combiné.
· Lorsqu’un caillot sanguin se forme dans une veine d’une jambe ou d’un pied, il peut provoquer une thrombose veineuse profonde (TVP).
· Si le caillot sanguin migre de la jambe vers le poumon, il peut provoquer une embolie pulmonaire.
· Dans de très rares cas, un caillot peut se former dans une veine d’un autre organe, comme l’œil (thrombose veineuse rétinienne).
À quel moment le risque d’apparition d’un caillot sanguin dans une veine est-il le plus élevé ?
Le risque d’apparition d’un caillot sanguin dans une veine est maximal pendant la première année d’utilisation d’un contraceptif hormonal combiné pris pour la première fois. Le risque peut également être augmenté lorsque vous recommencez à prendre un contraceptif hormonal combiné (le même produit ou un produit différent) après une interruption de 4 semaines ou plus.
Après la première année, le risque diminue mais reste toujours légèrement plus élevé que si vous n’utilisiez pas de contraceptif hormonal combiné.
Lorsque vous arrêtez de prendre MINIDRIL, le risque d’apparition de caillot sanguin revient à la normale en quelques semaines.
Quel est le risque d’apparition d’un caillot sanguin ?
Le risque dépend de votre risque de base de TEV et du type de contraceptif hormonal combiné que vous prenez.
Le risque global de caillot sanguin dans une jambe ou un poumon (TVP ou EP) associé à MINIDRIL, est faible.
· Sur 10 000 femmes qui n’utilisent aucun contraceptif hormonal combiné et qui ne sont pas enceintes, environ 2 développeront un caillot sanguin sur une période d’un an.
· Sur 10 000 femmes qui utilisent un contraceptif hormonal combiné contenant du lévonorgestrel, de la noréthistérone ou du norgestimate, environ 5 à 7 développeront un caillot sanguin sur une période d’un an.
· Le risque d’apparition d’un caillot sanguin variera selon vos antécédents médicaux personnels (voir « Facteurs augmentant le risque de caillot sanguin » ci-dessous).
|
|
Risque d’apparition d’un caillot sanguin sur une période d’un an |
|
Femmes qui n’utilisent pas de contraceptif hormonal combiné (pilule/patch/anneau) et qui ne sont pas enceintes |
Environ 2 femmes sur 10 000 |
|
Femmes qui utilisent une pilule contraceptive hormonale combinée contenant du lévonorgestrel, comme MINIDRIL, de la noréthistérone ou du norgestimate |
Environ 5 à 7 femmes sur 10 000 |
Facteurs augmentant le risque de caillot sanguin dans une veine
Le risque de caillot sanguin associé à MINIDRIL est faible mais certaines situations peuvent augmenter ce risque. Le risque sera plus élevé :
· si vous avez un surpoids important (indice de masse corporelle [IMC] supérieur à 30 kg/m2) ;
· si l’un des membres de votre famille proche a eu un caillot sanguin dans une jambe, un poumon ou un autre organe à un âge relativement jeune (p. ex. avant l’âge de 50 ans). Si tel est le cas, vous pourriez être atteinte d’un trouble héréditaire de la coagulation sanguine ;
· si vous devez être opérée ou si vous êtes alitée pendant une période prolongée en raison d’une blessure ou d’une maladie, ou si votre jambe est immobilisée (p. ex. plâtre). Il pourra être nécessaire d’interrompre l’utilisation de MINIDRIL plusieurs semaines avant l’opération chirurgicale et/ou tant que votre mobilité est réduite. Si vous devez arrêter d’utiliser MINIDRIL, demandez à votre médecin à quel moment vous pourrez recommencer à l’utiliser ;
· avec l’âge (en particulier au-delà de 35 ans) ;
· si vous avez accouché dans les semaines précédentes.
Plus vous cumulez ces situations, plus le risque d’apparition d’un caillot sanguin augmente.
Les voyages en avion (de plus de 4 heures) peuvent augmenter temporairement le risque de caillot sanguin, en particulier si vous présentez déjà certains des autres facteurs listés.
Il est important de prévenir votre médecin si vous êtes concernée par l’une de ces situations, même si vous n’en êtes pas certaine. Votre médecin pourra décider qu’il est nécessaire d’arrêter le traitement par MINIDRIL.
Si l’une des situations ci-dessus évolue pendant la période où vous utilisez MINIDRIL, par exemple si un membre de votre famille proche développe une thrombose sans raison connue ou si vous prenez beaucoup de poids, parlez-en à votre médecin.
CAILLOTS SANGUINS DANS UNE ARTÈRE
Que peut-il se passer si un caillot sanguin se forme dans une artère ?
Comme un caillot sanguin dans une veine, un caillot dans une artère peut provoquer de graves problèmes. Par exemple, il peut provoquer une crise cardiaque ou un accident vasculaire cérébral (AVC).
Facteurs augmentant le risque de caillot sanguin dans une artère
Il est important de noter que le risque de crise cardiaque ou d’AVC lié à l’utilisation de MINIDRIL est très faible mais peut augmenter :
· avec l’âge (au-delà de 35 ans) ;
· si vous fumez. Lors de l’utilisation d’un contraceptif hormonal combiné tel que MINIDRIL, il est conseillé d’arrêter de fumer. Si vous ne parvenez pas à arrêter de fumer et si vous êtes âgée de plus de 35 ans, votre médecin pourra vous conseiller d’utiliser une méthode de contraception différente ;
· si vous êtes en surpoids ;
· si vous avez une pression artérielle élevée ;
· si un membre de votre famille proche a déjà eu une crise cardiaque ou un AVC à un âge relativement jeune (avant l’âge de 50 ans). Si tel est le cas, le risque que vous ayez une crise cardiaque ou un AVC pourrait également être plus élevé ;
· si vous, ou un membre de votre famille proche, avez un taux de graisses élevé dans le sang (cholestérol ou triglycérides) ;
· si vous avez des migraines, en particulier des migraines avec aura ;
· si vous avez des problèmes cardiaques (maladie de la valve cardiaque, trouble du rythme appelé fibrillation auriculaire) ;
· si vous êtes diabétique.
Si vous cumulez plusieurs de ces situations ou si l’une d’entre elles est particulièrement sévère, le risque d’apparition d’un caillot sanguin peut être encore plus élevé.
Si l’une des situations ci-dessus évolue pendant la période où vous utilisez MINIDRIL, par exemple si vous commencez à fumer, si un membre de votre famille proche développe une thrombose sans raison connue ou si vous prenez beaucoup de poids, parlez-en à votre médecin.
MINIDRIL et Cancer
Le cancer du sein est plus fréquent chez les femmes qui prennent un contraceptif oral sans que l’on sache si ce traitement en est la cause. En effet, il est possible que les femmes prenant un contraceptif oral soient examinées plus souvent par leur médecin attentivement. Cette différence disparaît progressivement après l'arrêt du contraceptif oral.
Il est important d'examiner régulièrement vos seins. En cas de survenue d'une grosseur suspecte, contactez votre médecin.
Dans de rares cas, des tumeurs bénignes du foie, et plus rarement encore des tumeurs malignes du foie ont été observées chez des femmes prenant un contraceptif oral. Consultez votre médecin si vous présentez subitement des maux de ventre intenses.
Saignements entre les règles
Des saignements entre les règles, en dehors de la semaine d'interruption, peuvent survenir dans les premiers mois d'un traitement par MINIDRIL. Si ces saignements persistent plusieurs mois ou s'ils apparaissent au bout de plusieurs mois d'utilisation, votre médecin doit en rechercher la cause.
Que devez-vous faire si vos règles ne surviennent pas pendant la période d’arrêt entre deux plaquettes ?
Si vous avez pris correctement tous les comprimés, si vous n'avez pas eu de vomissements ou de diarrhées sévères et si vous n'avez pas pris d'autres médicaments, il est peu probable que vous soyez enceinte.
Si vous n'avez pas vos règles deux fois de suite, il se peut que vous soyez enceinte. Consultez immédiatement votre médecin. Ne commencez pas la plaquette suivante tant que vous n'êtes pas certaine de ne pas être enceinte.
Enfants
Sans objet.
Autres médicaments et MINIDRIL, comprimé enrobé
|
Indiquez toujours au professionnel de santé qui vous prescrit MINIDRIL les autres médicaments ou préparations à base de plantes que vous prenez déjà. Indiquez également à tout autre professionnel de santé qui vous prescrira un autre médicament (ou à votre pharmacien) que vous prenez MINIDRIL. Ils vous indiqueront si vous devez prendre des mesures contraceptives complémentaires (par exemple, préservatifs) et si nécessaire, pendant quelle durée. |
Certains médicaments peuvent diminuer la capacité de MINIDRIL à prévenir une grossesse ou peuvent entraîner des saignements inattendus.
Informez votre médecin ou pharmacien si vous prenez, avez récemment pris ou pourriez prendre tout autre médicament.
Ce médicament NE DOIT PAS ETRE UTILISE (voir rubrique « Ne prenez jamais MINIDRIL, comprimé enrobé ») :
· en association avec le millepertuis ;
· si vous avez une hépatite C et prenez des médicaments contre l’hépatite C tels que ceux contenant l’association ombitasvir/paritaprévir/ritonavir, le dasabuvir, le glécaprévir/pibrentasvir et le sofosbuvir/velpatasvir/voxilaprévir, car ces produits pourraient entraîner des élévations aux tests sanguins de la fonction hépatique (élévation de l’enzyme hépatique ALAT).
Votre médecin vous prescrira un autre type de contraception avant de démarrer le traitement par ces médicaments.
MINIDRIL peut être repris 2 semaines environ après la fin de ce traitement. Voir rubrique « Ne prenez jamais MINIDRIL, comprimé enrobé ».
Ce médicament DOIT ETRE EVITE en association avec certains médicaments utilisés dans le traitement de :
· l'épilepsie (ex : primidone, phénytoïne, fosphénytoïne, phénobarbital, carbamazépine, oxcarbazépine, topiramate, rufinamide, pérampanel, eslicarbazépine, felbamate) ;
· la tuberculose (ex : rifampicine, rifabutine) ;
· les infections par le VIH (ex : ritonavir, névirapine, éfavirenz, elvitégravir, darunavir, lopinavir, saquinavir, tipranavir, fosamprénavir, atazanavir) ou autres infections (griséofulvine) ;
· l'hypertension artérielle pulmonaire (bosentan) ;
· la narcolepsie (modafinil, pitolisant) ;
· les nausées et vomissements causés par la chimiothérapie (aprépitant) ;
· d’un certain type de cancer de la peau (vémurafénib, dabrafénib) ;
· de certains types de cancers (apalutamide, enzalutamide, lorlatinib) ;
· les infections à cytomégalovirus en cas de greffe (létermovir) ;
· la mucoviscidose (lumacaftor) ;
· le fibrome et l’indication de la contraception d’urgence (ulipristal).
MINIDRIL peut agir aussi sur l'efficacité d'autres médicaments :
· un anti-épileptique : la lamotrigine (cela peut augmenter la fréquence des crises d'épilepsie).
Examens biologiques
Si vous devez effectuer un examen sanguin, informez votre médecin ou l'équipe du laboratoire que vous prenez une contraception orale, ces produits pouvant modifier les résultats de certains examens.
MINIDRIL avec des aliments et boissons
Sans objet.
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin ou pharmacien avant de prendre ce médicament.
En cas de grossesse, ce médicament n'a pas lieu de vous être prescrit. Dans ce cas, arrêtez le traitement, prévenez et consultez votre médecin afin de vous conformer à ses recommandations.
En cas d'allaitement, l'utilisation de MINIDRIL est en général déconseillée. Consultez votre médecin si vous désirez prendre un contraceptif oral pendant l’allaitement.
Conduite de véhicules et utilisation de machines
Il n’y a pas de données suggérant que MINIDRIL affecte la conduite ou l’utilisation des machines.
MINIDRIL, comprimé enrobé contient du lactose et du saccharose.
Ce médicament contient du lactose. Si votre médecin vous a informée d’une intolérance à certains sucres, contactez-le avant de prendre ce médicament.
Ce médicament contient du saccharose. Si votre médecin vous a informée que vous avez une intolérance à certains sucres, contactez votre médecin avant de prendre ce médicament.
3. COMMENT PRENDRE MINIDRIL, comprimé enrobé ?
Prenez un comprimé de MINIDRIL, comprimé enrobé tous les jours, si nécessaire avec un peu d'eau. Vous pouvez prendre les comprimés avec ou sans nourriture, mais prenez toujours les comprimés à la même heure de la journée.
La plaquette contient 21 comprimés. Prenez les 21 comprimés. Ensuite, vous ne prendrez plus de comprimés pendant 7 jours.
Une hémorragie de privation doit apparaitre pendant l’intervalle sans comprimés (cette période est également appelée semaine d’arrêt ou d’interruption), généralement le 2ème ou le 3ème jour après la prise du dernier comprimé.
Commencez la plaquette suivante dès le 8ème jour après le jour de prise du dernier comprimé (c'est-à-dire après l’arrêt pendant les 7 jours), même si l’hémorragie de privation persiste.
Ceci signifie que vous devez toujours commencer la plaquette suivante le même jour de la semaine et avoir une hémorragie de privation les mêmes jours tous les mois.
Si vous utilisez MINIDRIL, comprimé enrobé de cette façon, vous êtes protégée d’une grossesse même pendant les 7 jours sans prise de comprimés.
Quand commencer la première plaquette ?
· Si vous n'avez pas pris de contraception hormonale au cours du mois précédent :
Commencez MINIDRIL, comprimé enrobé le premier jour du cycle (c'est-à-dire, le premier jour de vos règles). En commençant MINIDRIL, comprimé enrobé le premier jour de vos règles, vous êtes immédiatement protégée d’une grossesse.
· Si vous preniez un autre contraceptif hormonal combiné (contraceptif oral combiné, anneau vaginal, dispositif transdermique) :
Commencez MINIDRIL, comprimé enrobé de préférence le jour suivant la prise du dernier comprimé actif (le dernier comprimé contenant les substances actives) du contraceptif oral combiné précédent ou au plus tard le jour suivant la période habituelle d’arrêt des comprimés (ou après la prise du dernier comprimé inactif du contraceptif oral combiné précédent). Pour prendre le relais d’un anneau vaginal ou d’un dispositif transdermique, suivez l’avis de votre médecin.
Si vous utilisiez une méthode contraceptive contenant un progestatif seul (pilule microdosée, forme injectable, implant ou un dispositif intra-utérin (DIU) délivrant un progestatif) :
o en relais d’une pilule progestative : vous pouvez commencer MINIDRIL, comprimé enrobé à tout moment du cycle, le lendemain de l’arrêt de la pilule ;
o en relais d’un implant ou d’un système intra-utérin : débutez MINIDRIL, comprimé enrobé le jour du retrait ;
o en relais d’un contraceptif injectable : débutez MINIDRIL, comprimé enrobé le jour prévu pour la nouvelle injection.
Dans tous les cas, quelle que soit la méthode précédente, vous devez utiliser des précautions complémentaires (par exemple un préservatif) pendant les 7 premiers jours de prise de MINIDRIL, comprimé enrobé.
· Si vous débutez MINIDRIL, comprimé enrobé après une interruption de grossesse du premier trimestre, vous pouvez débuter immédiatement.
· Après un accouchement ou une interruption de grossesse du deuxième trimestre :
Commencez à prendre MINIDRIL, comprimé enrobé au moins 21 à 28 jours après un accouchement. Si vous commencez après le 28ème jour, vous devez utiliser une méthode dite de type barrière (par exemple, un préservatif) pendant les sept premiers jours d'utilisation de MINIDRIL, comprimé enrobé. Toutefois, si vous avez déjà eu des rapports sexuels, vous devez vous assurer que vous n'êtes pas enceinte ou attendre vos premières règles avant de commencer à utiliser MINIDRIL, comprimé enrobé.
Demandez conseil à votre médecin si vous ne savez pas exactement quand démarrer votre contraception.
Si vous allaitez et que vous voulez (re)commencer MINIDRIL, comprimé enrobé après un accouchement, veuillez lire la rubrique « Grossesse et allaitement ».
Si vous avez pris plus de MINIDRIL, comprimé enrobé que vous n’auriez dû
Consultez immédiatement votre médecin ou votre pharmacien.
Aucune conséquence grave n'a été rapportée après la prise d'un trop grand nombre de comprimés de MINIDRIL, comprimé enrobé.
Le surdosage peut se manifester par des signes digestifs (nausées ou des vomissements), une douleur abdominale, une tension mammaire, des étourdissements, de la somnolence/fatigue et, chez les jeunes filles, par de petits saignements vaginaux.
Si vous avez pris plus de comprimés de MINIDRIL, comprimé enrobé que vous n'auriez dû ou si vous découvrez qu'un enfant a pris des comprimés, consultez votre médecin ou votre pharmacien.
Si vous oubliez de prendre MINIDRIL, comprimé enrobé
Si l'oubli du comprimé remonte à moins de 12 heures, l'efficacité contraceptive n'est pas réduite. Prenez immédiatement le comprimé oublié et continuez à prendre les comprimés suivants à l'heure habituelle.
Si l'oubli du comprimé remonte à plus de 12 heures, l'efficacité contraceptive peut être réduite. Plus le nombre de comprimés oubliés est élevé, plus le risque de diminution de l'efficacité contraceptive est important. Le risque d'une protection contraceptive incomplète est maximal si vous oubliez un comprimé au début ou à la fin de la plaquette. Vous devez par conséquent respecter les règles contraceptives suivantes (reportez-vous également au schéma ci-dessous) :
Oubli de plus d'un comprimé de la plaquette en cours :
Contactez votre médecin.
Oubli d'un comprimé en semaine 1 :
Prenez immédiatement le comprimé oublié, même si cela implique la prise de deux comprimés en même temps. Continuez ensuite à prendre les comprimés à l'heure habituelle et utilisez des mesures contraceptives supplémentaires, par exemple un préservatif, pendant les 7 jours suivants. Si vous avez eu des rapports sexuels dans la semaine qui a précédé l'oubli ou si vous avez oublié de commencer une nouvelle plaquette après la période sans prise de comprimés, vous devez être consciente qu'il existe un risque de grossesse. Dans ce cas, consultez votre médecin.
Oubli d'un comprimé en semaine 2 :
Prenez immédiatement le comprimé oublié, même si cela implique la prise de deux comprimés en même temps. Continuez ensuite à prendre les comprimés à l'heure habituelle. L'efficacité contraceptive n'est pas réduite et vous n'avez pas besoin de prendre de précautions supplémentaires.
Oubli d'un comprimé en semaine 3 :
Vous pouvez choisir l'une des deux possibilités suivantes :
· Prenez immédiatement le comprimé oublié, même si cela implique la prise de deux comprimés en même temps. Continuez ensuite à prendre les comprimés à l'heure habituelle. Au lieu de respecter un intervalle sans prise de comprimés, commencez directement la plaquette suivante.
Il est fort probable que vous ayez vos règles (hémorragie de privation) à la fin de la deuxième plaquette mais vous pouvez aussi avoir des spottings ou des saignements entre les règles pendant la prise des comprimés de la deuxième plaquette.
· Vous pouvez aussi arrêter de prendre les comprimés de la plaquette et passer directement à la période d'arrêt de 7 jours (notez le jour de votre oubli). Si vous voulez commencer une nouvelle plaquette le jour habituel, raccourcissez la période sans prise de comprimés à moins de 7 jours.
Si vous suivez correctement l'une de ces deux recommandations, vous resterez protégée d'une grossesse.
Si vous avez oublié un comprimé d'une plaquette et que vous n'avez pas eu d'hémorragie de privation (règles) au cours de la période sans prise de comprimés, cela peut signifier que vous êtes enceinte. Vous devez consulter votre médecin avant de commencer la plaquette suivante.
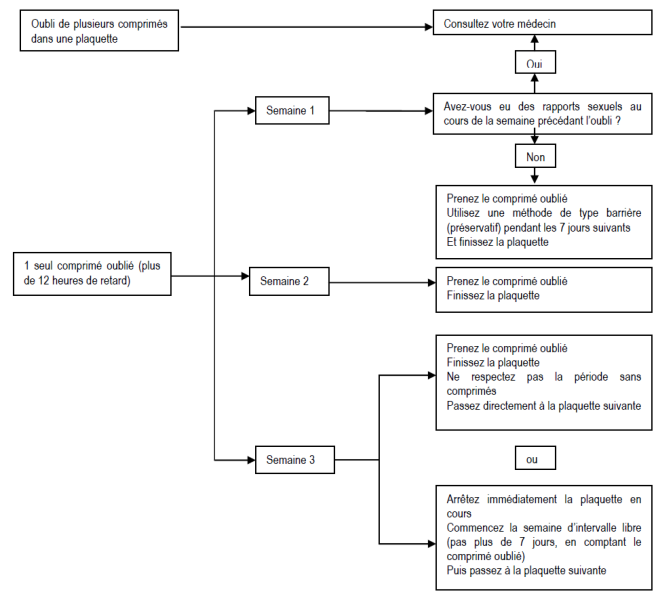
Que faire en cas de vomissements ou de diarrhées sévères
Si vous vomissez dans les 3 à 4 heures qui suivent la prise d'un comprimé ou si vous avez une diarrhée sévère, il est possible que les substances actives de la pilule ne soient pas complètement absorbées dans votre corps. La situation est similaire à celle d'un oubli de comprimé. Après des vomissements ou une diarrhée, vous devez prendre un autre comprimé d'une plaquette de réserve dès que possible et si possible dans les 12 heures qui suivent l'heure habituelle à laquelle vous prenez votre pilule. Si ce n'est pas possible ou si plus de 12 heures se sont écoulées, vous devez suivre les conseils donnés au paragraphe « Si vous oubliez de prendre MINIDRIL, comprimé enrobé ».
Si vous arrêtez de prendre MINIDRIL, comprimé enrobé
Vous pouvez arrêter de prendre MINIDRIL, comprimé enrobé quand vous le souhaitez. Si vous ne souhaitez pas être enceinte, demandez à votre médecin de vous conseiller d'autres méthodes contraceptives fiables.
Si vous avez d'autres questions sur l'utilisation de ce médicament, demandez plus d’informations à votre médecin ou à votre pharmacien.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Si vous ressentez un quelconque effet indésirable, en particulier si l’effet est sévère et persistant, ou si vous remarquez une modification de votre état de santé qui pourrait selon vous être due à MINIDRIL, informez-en votre médecin.
Il existe une augmentation du risque de caillots sanguins dans les veines (thrombo-embolie veineuse [TEV]) ou dans les artères (thrombo-embolie artérielle [TEA]) chez toutes les femmes qui prennent des contraceptifs hormonaux combinés. Pour plus de précisions sur les différents risques associés à la prise de contraceptifs hormonaux combinés, reportez-vous à la rubrique 2, « Quelles sont les informations à connaître avant de prendre MINIDRIL, comprimé enrobé ? ».
Consultez immédiatement un médecin si vous ressentez un des effets indésirables graves indiqués ci-dessous :
· Une réaction allergique grave
o Les symptômes sont les suivants : respiration sifflante soudaine, difficulté respiratoire ou sensations vertigineuses, gonflement des paupières, du visage, des lèvres ou de la gorge, éruption cutanée, urticaire.
· Angio-œdème
o Les symptômes sont les suivants : gonflement du visage, de la langue et/ou de la gorge et/ou des difficultés à avaler ou une urticaire avec éventuellement des difficultés à respirer (voir aussi « Avertissements et précautions »).
· Thrombose de la veine rétinienne
o Les symptômes surviennent le plus souvent dans un seul œil.
o Vision brouillée non douloureuse pouvant évoluer en perte de la vue.
o Perte soudaine de la vue.
· Syndrome hémolytique et urémique (affection du sang et des reins)
o Les symptômes sont les suivants : vomissements, diarrhée (qui peut être sanguinolente), fièvre, sensation de faiblesse, diminution de la production d'urine.
· Pancréatite
o Les symptômes sont une douleur grave dans le haut du ventre, pouvant s'étendre dans le dos.
· Erythème polymorphe
o Les symptômes sont une éruption cutanée avec des taches roses ou rouges, particulièrement sur la paume des mains et la plante des pieds, avec éventuellement formation de cloques. Cela peut s'accompagner d'ulcères au niveau de la bouche, des yeux ou des organes génitaux, et de fièvre.
L'évaluation de ces effets indésirables repose sur les informations suivantes relatives à leur fréquence d'apparition :
· très fréquent : affecte plus d'une utilisatrice sur 10,
· fréquent : affecte 1 à 10 utilisatrices sur 100,
· peu fréquent : affecte 1 à 10 utilisatrices sur 1 000,
· rare : affecte 1 à 10 utilisatrices sur 10 000,
· très rare : affecte moins d'une utilisatrice sur 10 000,
· non connu : la fréquence ne peut être estimée sur la base des données disponibles.
Les effets indésirables les plus souvent rapportés (touchant plus de 10 utilisatrices sur 100) durant les essais cliniques et durant le suivi après commercialisation ont été des maux de tête, dont des migraines, et des saignements irréguliers (entre les règles).
Les effets indésirables fréquemment rapportés (touchant entre 1 et 10 utilisatrices sur 100) sont : vaginite, incluant candidose vaginale, modification de l'humeur incluant la dépression, modification de la libido (désir sexuel), nervosité, étourdissements, nausée, vomissement, douleur abdominale, acné, douleur, tension ou écoulement des seins, douleur des règles, modification des sécrétions vaginales et des règles, absence de règles, rétention d'eau, gonflement, augmentation ou diminution du poids.
Les effets indésirables peu fréquemment rapportés (touchant entre 1 et 10 utilisatrices sur 1 000) sont : augmentation ou diminution de l'appétit, crampes abdominales, ballonnement, éruption cutanée, taches brunes sur le visage (chloasma), augmentation de la pilosité, chute de cheveux, hypertension artérielle, modification des graisses dans le sang dont une augmentation des triglycérides.
Les effets indésirables rarement rapportés (touchant entre 1 et 10 utilisatrices sur 10 000) sont : réactions allergiques sévères pouvant s'accompagner d'urticaire, de gonflements, de troubles circulatoires et de difficultés respiratoires, augmentation du taux de sucre dans le sang (hyperglycémie), irritation par les lentilles de contact, jaunisse, nodules sous la peau (érythème noueux), caillots sanguins dans une veine ou une artère, par exemple :
· dans une jambe ou un pied (thrombose veineuse profonde, TVP),
· dans un poumon (embolie pulmonaire, EP),
· crise cardiaque,
· accident vasculaire cérébral (AVC),
· mini-AVC ou symptômes temporaires de type AVC, connus sous le nom d’accident ischémique transitoire (AIT),
· caillots sanguins dans le foie, l’estomac/l’intestin, les reins ou un œil.
Le risque d’apparition d’un caillot sanguin peut être plus élevé si vous présentez certains autres facteurs qui augmentent ce risque (voir rubrique 2 pour plus d’informations sur les facteurs augmentant le risque de caillots sanguins et les symptômes d’un caillot sanguin).
Les effets indésirables très rarement rapportés (touchant moins de 1 utilisatrice sur 10 000) sont :
· Aggravation d'une maladie du système immunitaire (lupus), d'une maladie du foie (la porphyrie), des varices ou d’une maladie appelée chorée caractérisée par la survenue de mouvements incontrôlables, brusques et irréguliers,
· Survenue de certains troubles au niveau des yeux tel qu'une inflammation du nerf optique qui peut conduire à une perte partielle ou totale de la vision, d'affections du foie ou du pancréas, d'une réaction cutanée particulière appelée érythème polymorphe, d'une maladie entrainant des troubles sanguins et urinaires (syndrome hémolytique urémique) ou d’une colite ischémique (flux sanguin insuffisant dans le côlon),
· Augmentation du risque de calculs biliaires ou obstruction du flux biliaire,
· Diminution des folates dans le sang.
D'autres effets indésirables dont la fréquence n'a pas été déterminée ont été rapportés : tels qu’hépatite ou trouble de la fonction du foie ou des maladies inflammatoires du côlon (maladie de Crohn, colite ulcéreuse).
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER MINIDRIL, comprimé enrobé ?
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur la boîte. La date de péremption fait référence au dernier jour de ce mois.
Pas de précautions particulières de conservation.
Ne jetez aucun médicament au tout-à-l’égout ni avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient MINIDRIL, comprimé enrobé
· Les substances actives sont :
Lévonorgestrel........................................................................................................... . 0,150 mg
Ethinylestradiol.......................................................................................................... . 0,030 mg
Pour un comprimé enrobé.
· Les autres composants sont :
Povidone K25, stéarate de magnésium, lactose monohydraté, amidon de maïs, talc.
Enrobage : saccharose, macrogol 6000, carbonate de calcium, povidone K90, cire d'abeille blanche, cire de carnauba.
Qu'est-ce que MINIDRIL, comprimé enrobé et contenu de l'emballage extérieur
Ce médicament se présente sous forme de comprimé enrobé.
Boîte de 1 plaquette de 21 comprimés.
Boîte de 3 plaquettes de 21 comprimés.
Toutes les présentations peuvent ne pas être commercialisées.
Titulaire de l’autorisation de mise sur le marché
23-25, AVENUE DU DOCTEUR LANNELONGUE
75014 PARIS
Exploitant de l’autorisation de mise sur le marché
23-25, AVENUE DU DOCTEUR LANNELONGUE
75014 PARIS
PFIZER IRELAND PHARMACEUTICALS UNLIMITED COMPANY
LITTLE CONNELL
NEWBRIDGE
CO. KILDARE
W12 HX57
IRLANDE
ou
HAUPT PHARMA MUNSTER GMBH
SCHLEEBRUGGENKAMP 15
D-48159 MUNSTER
ALLEMAGNE
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Sans objet.
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).