Dernière mise à jour le 01/12/2025
SARGENOR 1 g/5 ml, solution buvable
Ce médicament n'est ou ne sera bientôt plus disponible sur le marché.
Si vous prenez actuellement ce médicament, il vous est recommandé d'en parler avec votre médecin
ou avec votre pharmacien qui pourra vous orienter vers un autre traitement.
Présentations
> 20 ampoule(s) en verre brun de 5 ml
Code CIP : 328 928-3 ou 34009 328 928 3 9
Déclaration d'arrêt de commercialisation : 01/02/2024
Cette présentation n'est pas agréée aux collectivités
Service médical rendu (SMR)
Pas de SMR disponible pour ce médicament ( plus d'informations dans l'aide )
Amélioration du service médical rendu (ASMR)
Pas d'ASMR disponible pour ce médicament (plus d'informations dans l'aide )
ANSM - Mis à jour le : 26/09/2025
SARGENOR 1 g/5 ml, solution buvable
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Aspartate d’arginine ............................................................................................................ 1,000 g
Excipients à effet notoire : saccharose, parahydroxybenzoate de propyle, parahydroxybenzoate de méthyle, éthanol.
Pour la liste complète des excipients, voir rubrique 6.1.
Solution buvable.
4.1. Indications thérapeutiques
Traitement d’appoint de l’asthénie fonctionnelle.
4.2. Posologie et mode d'administration
Posologie
Adulte : 2 à 3 ampoules par jour.
Enfant de plus de 12 ans : 1 à 2 ampoules par jour.
Mode d’administration
Les ampoules sont à prendre diluées dans un peu d’eau, de préférence avant les repas.
Le traitement est limité à 15 jours.
Hypersensibilité à la substance active ou à l’un des excipients mentionnés à la rubrique 6.1, notamment le parahydroxybenzoate de méthyle ou de propyle.
4.4. Mises en garde spéciales et précautions d'emploi
En cas de persistance des troubles au-delà de 15 jours de traitement ou d’aggravation des troubles, la situation doit être réévaluée.
Le traitement d’une asthénie chez l’enfant de moins de 12 ans nécessite un avis médical.
Chez les patients ayant récemment subi un infarctus du myocarde, ce médicament ne doit être pris que sous surveillance médicale.
Ce médicament contient du parahydroxybenzoate et peut provoquer des réactions allergiques (éventuellement retardées).
Ce médicament contient du saccharose. Les patients présentant une intolérance au fructose, un syndrome de malabsorption du glucose et du galactose ou un déficit en sucrase/isomaltase (maladies héréditaires rares) ne doivent pas prendre ce médicament.
Ce médicament contient 5,571 mg d'alcool (éthanol) par ampoule. La quantité en éthanol par ampoule équivaut à moins de 1 ml de bière ou 1 ml de vin. La faible quantité d'alcool contenue dans ce médicament n'est pas susceptible d'entraîner d'effet notable ;
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Les données disponibles à ce jour ne laissent pas supposer l’existence d’interactions cliniquement significatives.
4.6. Fertilité, grossesse et allaitement
Grossesse
Il n'y a pas ou peu de données sur l'utilisation de SARGENOR 1 g/5 ml, solution buvable chez les femmes enceintes. Par mesure de précaution, il est préférable d'éviter l'utilisation de SARGENOR 1 g/5 ml, solution buvable pendant la grossesse.
Allaitement
L’excrétion de l'aspartate d’arginine dans le lait maternel n’est pas connue. Un risque pour les nouveau-nés et les nourrissons ne peut être exclu. Par conséquent, l'utilisation de SARGENOR 1 g/5 ml, solution buvable est à éviter pendant l'allaitement.
Fertilité
Il n’existe pas de données animales ou cliniques sur l’effet de SARGENOR 1 g/5 ml, solution buvable sur la fertilité.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Sans objet.
Les effets indésirables mentionnés ci-dessous, pouvant survenir avec SARGENOR 1 g/5 ml, solution buvable sont listés par classe de systèmes d’organes et par fréquence selon la convention suivante : très fréquent (≥ 1/10) ; fréquent (≥1/100, <1/10) ; peu fréquent (≥ 1/1000, <1/100) ; rare (≥ 1/10 000, <1/1000) ; très rare (<1/10 000) ; et fréquence indéterminée (ne peut être estimée sur la base des données disponibles).
|
Système de classes d’organes (SOC) |
Fréquence |
Terme préférentiel MedDRA (PT) |
|
Affection du système immunitaire |
Fréquence indéterminée |
Hypersensibilité |
|
Affections gastro-intestinales |
Fréquence indéterminée |
Troubles gastro-intestinaux, diarrhée, nausée, vomissements (à forte dose) |
|
Affections de la peau et du tissu sous-cutané |
Fréquence indéterminée |
Dermatite allergique (réactions cutanées notamment dues à la présence des parahydroxybenzoates) |
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr.
L'ingestion de fortes doses d’arginine ou un traitement prolongé peut provoquer des troubles gastro-intestinaux tels que diarrhées, nausées, douleurs abdominales, ballonnements et vomissements.
En cas de surdosage, le traitement par l'aspartate d'arginine doit être interrompu et un traitement symptomatique doit être administré.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : TONIQUES, code ATC : A13A.
5.2. Propriétés pharmacocinétiques
Absorption
L’arginine et l’acide aspartique sont bien absorbés par voie orale.
Distribution
Les deux amino-acides présentent une forte diffusion tissulaire.
Elimination
Leur élimination s’effectue par voie rénale.
5.3. Données de sécurité préclinique
Non renseigné.
Saccharose, parahydroxybenzoate de propyle (E 216), parahydroxybenzoate de méthyle (E 218), arôme abricot*, caramel (E 150), eau purifiée.
*Composition de l'arôme abricot : vanilline, aldéhyde benzoïque, acétate d'amyle, diacétyle, ionone, caproate d'allyle, gamma undécalactone, gamma nonalactone, teinture de levisticum, huiles essentielles de citron, d'orange, de bergamote, de coriandre, de néroli, de camomille, de cannelle, de noix de muscade, éthanol, eau purifiée.
Sans objet.
4 ans
6.4. Précautions particulières de conservation
Pas de précautions particulières de conservation.
6.5. Nature et contenu de l'emballage extérieur
Ampoule à deux pointes autocassables en verre brun de type II de 5 ml.
6.6. Précautions particulières d’élimination et de manipulation
Pas d’exigences particulières.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
COOPERATION PHARMACEUTIQUE FRANCAISE
PLACE LUCIEN AUVERT
77020 MELUN CEDEX
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 341 548 6 7 : 5 ml en ampoule (verre brun), boîte de 10.
· 34009 328 928 3 9 : 5 ml en ampoule (verre brun), boîte de 20.
· 34009 332 981 2 8 : 5 ml en ampoule (verre brun), boîte de 40.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Sans objet.
Médicament non soumis à prescription médicale.
ANSM - Mis à jour le : 26/09/2025
SARGENOR 1 g/5 ml, solution buvable
Aspartate d’arginine
Veuillez lire attentivement cette notice avant de prendre ce médicament car elle contient des informations importantes pour vous.
Vous devez toujours prendre ce médicament en suivant scrupuleusement les informations fournies dans cette notice ou par votre médecin ou votre pharmacien.
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Adressez-vous à votre pharmacien pour tout conseil ou information.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
· Vous devez vous adresser à votre médecin si vous ne ressentez aucune amélioration ou si vous vous sentez moins bien après 15 jours.
1. Qu'est-ce que SARGENOR 1 g/5 ml, solution buvable et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant de prendre SARGENOR 1 g/5 ml, solution buvable?
3. Comment prendre SARGENOR 1 g/5ml, solution buvable ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver SARGENOR 1 g/5 ml, solution buvable ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE SARGENOR 1 g/5 ml, solution buvable, ET DANS QUELS CAS EST-IL UTILISE ?
Classe pharmacothérapeutique : TONIQUES - code ATC : A13A
Ce médicament est indiqué dans les états de fatigue passagers.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT DE PRENDRE SARGENOR 1 g/5 ml, solution buvable ?
Si votre médecin vous a informé(e) que vous avez une intolérance à certains sucres, contactez le avant de prendre ce médicament.
Ne prenez jamais SARGENOR 1 g/5 ml, solution buvable :
· si vous êtes allergique à l’aspartate d’arginine ou à l’un des autres composants contenus dans ce médicament, mentionnés dans la rubrique 6.
· Ce médicament contient du parahydroxybenzoate et peut provoquer des réactions allergiques (éventuellement retardées).
Ce médicament contient 5,571 mg d'alcool (éthanol) par ampoule. La quantité en éthanol par ampoule équivaut à moins de 1 ml de bière ou 1 ml de vin. La faible quantité d'alcool contenue dans ce médicament n'est pas susceptible d'entraîner d'effet notable.
Avertissements et précautions
Adressez-vous à votre médecin ou pharmacien avant de prendre SARGENOR 1 g/5 ml, solution buvable.
Si vous avez récemment subi un infarctus du myocarde, ce médicament ne doit être pris que sous surveillance médicale.
L’apparition d’une fatigue chez l’enfant de moins de 12 ans, même si elle semble passagère, nécessite une consultation médicale auprès de votre médecin.
La prise de ce médicament ne dispense pas de respecter les principales règles d’hygiène telles que : activité physique régulière, alimentation équilibrée (notamment éviter la prise d’alcool, de tabac et/ou d’excitants), heures régulières de sommeil, repos.
La durée de traitement est limitée à 15 jours.
En cas de persistance de la fatigue après 15 jours ou si la fatigue s’accompagne de manifestations inhabituelles, prenez l’avis de votre médecin ou de votre pharmacien.
Enfants et adolescents
Sans objet.
Autres médicaments et SARGENOR 1 g/5 ml, solution buvable
 Informez votre médecin ou pharmacien si vous prenez, avez récemment pris ou pourriez prendre tout autre médicament.
Informez votre médecin ou pharmacien si vous prenez, avez récemment pris ou pourriez prendre tout autre médicament.
Ce médicament contient de l’aspartate d’arginine. D’autres médicaments en contiennent. Ne les associez pas, afin de ne pas dépasser les doses maximales conseillées (voir rubrique 3 « Posologie »).
SARGENOR 1 g/5 ml, solution buvable avec des aliments et boissons
Sans objet.
Grossesse et allaitement
Si vous allaitez, vous devez éviter de prendre ce médicament.
Conduite de véhicules et utilisation de machines
Sans objet.
SARGENOR 1 g/5 ml, solution buvable contient du saccharose, du parahydroxybenzoate de propyle (E 216), du parahydroxybenzoate de méthyle (E 218) et de l’éthanol.
3. COMMENT PRENDRE SARGENOR 1 g/5 ml, solution buvable ?
Veillez à toujours prendre ce médicament en suivant exactement les instructions de cette notice ou les indications de votre médecin ou pharmacien. Vérifiez auprès de votre médecin ou pharmacien en cas de doute.
Posologie
Adulte : 2 à 3 ampoules par jour.
Enfant de plus de 12 ans : 1 à 2 ampoule(s) par jour.
Durée du traitement
La durée d’utilisation est limitée à 15 jours.
Mode et voie d’administration
Voie orale.
Les ampoules sont à prendre diluées dans un peu d’eau, de préférence avant les repas.
Les ampoules sont munies de traits circulaires, un ou plusieurs, aux deux extrémités, où se trouve un point de rupture prédéterminé.

Les extrémités de l’ampoule doivent être cassées au niveau de ces points prédéterminés. La solution ne s'écoule que lorsque les deux extrémités sont cassées.
Les ampoules peuvent être ouvertes manuellement, en suivant les étapes ci-dessous :
1. Tenez l'ampoule en position oblique À CÔTÉ du verre à boire que vous allez utiliser (et non pas au-dessus du verre).
2. Cassez l'extrémité supérieure en la pliant avec une légère pression entre le pouce et l’index. Utilisez un tissu en papier propre pour protéger vos doigts et exercer une pression plus forte.
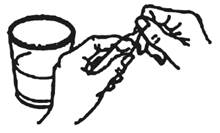
3. Retourner l'ampoule (la solution ne s'écoule pas encore).
4. Tenez l'ampoule en position oblique à côté du verre. Seule l'extrémité cassée est au-dessus du verre.
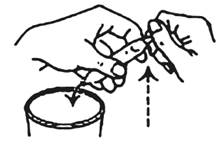
5. Cassez l'autre extrémité. La solution s'écoule maintenant.
6. Assurez-vous que la solution dans le verre ne contient pas de débris de verre.
Si vous avez pris plus de SARGENOR 1 g/5 ml, solution buvable que vous n’auriez dû
En cas de surdosage, arrêtez le traitement et consultez immédiatement votre médecin ou votre pharmacien.
Si vous oubliez de prendre SARGENOR 1 g/5 ml, solution buvable
Ne prenez pas de dose double pour compenser la dose que vous avez oublié de prendre.
Si vous arrêtez de prendre SARGENOR 1 g/5 ml, solution buvable
Sans objet.
Si vous avez d’autres questions sur l’utilisation de ce médicament, demandez plus d’informations à votre médecin ou à votre pharmacien.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Comme tous les médicaments, ce médicament peut provoquer des effets indésirables, mais ils ne surviennent pas systématiquement chez tout le monde.
La fréquence de ces effets indésirables est indéterminée (ne peut être estimée sur la base des données disponibles).
· Réactions allergiques (hypersensibilité)
· Troubles gastro-intestinaux tels que diarrhée, nausée, vomissements (à forte dose)
· Réactions cutanées notamment dues à la présence des parahydroxybenzoates
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr.
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER SARGENOR 1 g/5 ml, solution buvable ?
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur la boîte. La date de péremption fait référence au dernier jour de ce mois.
Pas de condition particulière de conservation.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient SARGENOR 1 g/5 ml, solution buvable
· La substance active est :
Aspartate d’arginine ............................................................................................................ 1 g
Pour une ampoule de 5 ml.
· Les autres composants sont : saccharose, parahydroxybenzoate de propyle (E 216), parahydroxybenzoate de méthyle (E 218), arôme abricot, caramel (E 150), eau purifiée.
Qu’est-ce que SARGENOR 1 g/5 ml, solution buvable et contenu de l’emballage extérieur
Ce médicament se présente sous forme de solution buvable en ampoules de 5 ml. Boîte de 10, 20 ou 40 ampoules.
Toutes les présentations peuvent ne pas être commercialisées.
Titulaire de l’autorisation de mise sur le marché
COOPERATION PHARMACEUTIQUE FRANCAISE
PLACE LUCIEN AUVERT
77020 MELUN CEDEX
Exploitant de l’autorisation de mise sur le marché
COOPERATION PHARMACEUTIQUE FRANCAISE
PLACE LUCIEN AUVERT
77020 MELUN CEDEX
MEDA MANUFACTURING
AVENUE J.F. KENNEDY
33700 MERIGNAC
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Sans objet.
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).