Dernière mise à jour le 01/12/2025
MINOXIDIL SANDOZ CONSEIL 5 %, solution pour application cutanée
Indications thérapeutiques
Classe pharmacothérapeutique : MINOXIDIL A USAGE LOCAL (D : médicaments dermatologiques). Code ATC : D11AX01.
Ce médicament est indiqué en cas de chute de cheveux modérée (alopécie androgénétique) chez le sujet de sexe masculin.
Présentations
> 3 flacons polyéthylène de 60 ml surmontés d'une pompe polyéthylène avec embout applicateur coudé et articulé polypropylène
Code CIP : 367 563-2 ou 34009 367 563 2 8
Déclaration de commercialisation : 29/04/2005
Cette présentation n'est pas agréée aux collectivités
Service médical rendu (SMR)
Amélioration du service médical rendu (ASMR)
Ce médicament étant un générique, l'ASMR n'a pas été évalué par la commission de la transparence (CT), il est possible de se référer à la /aux spécialité(s) de référence du groupe générique auquel appartient ce médicament (cliquez ici pour aller à la rubrique des groupes génériques)
ANSM - Mis à jour le : 20/11/2025
MINOXIDIL SANDOZ CONSEIL 5 %, solution pour application cutanée
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Minoxidil.................................................................................................................................... 5 g
Pour 100 mL de solution pour application cutanée.
Excipients à effet notoire : propylèneglycol et éthanol.
Pour la liste complète des excipients, voir rubrique 6.1.
Solution pour application cutanée.
4.1. Indications thérapeutiques
Ce médicament est indiqué en cas de chute de cheveux modérée (alopécie androgénétique) chez le sujet de sexe masculin.
4.2. Posologie et mode d'administration
Réservé à l'adulte de sexe masculin.
Posologie
Appliquer 2 fois par jour (une fois le matin et une fois le soir) une dose de 1 mL sur la zone de calvitie du cuir chevelu en prenant pour point de départ le centre de la zone à traiter. Cette dose doit être respectée quelle que soit l'étendue de la zone concernée.
La dose journalière totale ne doit pas dépasser 2 mL.
Mode d’administration
Voie cutanée.
Etendre le produit avec le bout des doigts de façon à couvrir l'ensemble de la zone à traiter.
Après application de la solution, se laver soigneusement les mains.
Ne pas appliquer le produit sur une autre partie du corps.
Appliquer sur des cheveux et un cuir chevelu parfaitement secs.
Le mode d'application varie en fonction du système de délivrance utilisé avec le flacon.
Pulvérisateur : ce système est adapté à l'application sur des surfaces étendues.
1. Retirer le capot du flacon.
2. Diriger la pompe vers le centre de la surface à traiter, l'actionner une fois et étendre le produit avec le bout des doigts de façon à couvrir l'ensemble de la zone à traiter. Répéter l'opération 6 fois pour appliquer une dose de 1 mL (soit 7 pulvérisations au total).
Eviter d'inhaler le produit.
3. Replacer le capot sur le flacon après utilisation.
Pulvérisateur muni d'un applicateur : ce système est adapté à l'application sur de faibles surfaces ou sous les cheveux.
1. Retirer le capot du flacon.
2. Retirer l'élément supérieur de la pompe. Adapter l'applicateur et appuyer fermement.
3. Diriger la pompe vers le centre de la surface à traiter, l’actionner une fois et étendre le produit avec le bout des doigts de façon à couvrir l’ensemble de la zone à traiter.
Répéter l’opération 6 fois pour appliquer une dose de 1 mL (soit 7 pulvérisations au total).
Eviter d'inhaler le produit.
4. Replacer le capot sur le flacon après utilisation.
Durée d’utilisation
Les résultats peuvent ne pas être visibles avant au moins 2 à 4 mois de traitement appliqué deux fois par jour. Le début et le degré de la réponse varient en fonction des sujets.
Ne pas arrêter les applications au risque de revenir à l'état antérieur après un délai de 3 ou 4 mois.
Ne plus utiliser MINOXIDIL SANDOZ en l’absence d’amélioration après 4 mois d’application.
· Hypersensibilité à la substance active ou à l’un des excipients mentionnés à la rubrique 6.
· Mauvaise tolérance à la forme 2 % quelle que soit la symptomatologie.
· Ce médicament est contre-indiqué chez la femme.
· Chez les sujets âgés de moins de 18 ans ou de plus de 65 ans.
4.4. Mises en garde spéciales et précautions d'emploi
Une absorption percutanée accrue du minoxidil, pouvant provoquer des effets systémiques, est possible en cas de :
· dermatose ou lésion du cuir chevelu,
· d’application concomitante d’acide rétinoïque, d’anthraline ou de tout autre topique irritant,
· d’augmentation de la dose appliquée et/ou augmentation de la fréquence des applications : il est impératif de respecter la posologie et le mode d’administration.
De même, bien que l’utilisation extensive du minoxidil solution n’ait pas révélé d’effets systémiques, on ne peut exclure qu’une absorption plus importante liée à une variabilité individuelle ou une sensibilité inhabituelle puisse provoquer des effets systémiques. Les patients devront en être avertis.
Il convient, par mesure de prudence, de surveiller régulièrement l'apparition éventuelle de symptômes évocateurs d'effets systémiques, tels que diminution de la pression artérielle, tachycardie, douleur thoracique, perte de connaissance, vertiges, prise de poids inexpliquée ou signes de rétention hydrosodée (gonflement des mains ou des pieds).
La surveillance doit se faire en début de traitement puis de façon régulière. En cas d'apparition d'effets systémiques ou de réactions dermatologiques sévères ou de tout autre symptôme inattendu (voir rubrique 4.8), le traitement devra être interrompu et le patient doit consulter un médecin.
Les patients atteints de maladie cardiovasculaire ou d’arythmie cardiaque doivent consulter un médecin avant d’utiliser le minoxidil par voie topique. Chez ces sujets, le bénéfice du traitement doit être pesé. Ils devront être plus particulièrement avertis des effets indésirables potentiels afin d’interrompre le traitement dès l’apparition de l’un d’eux et d’avertir un médecin.
Si les symptômes persistent ou s’aggravent, ou si de nouveaux symptômes apparaissent, les patients doivent interrompre le traitement et consulter un médecin.
Ne pas appliquer de minoxidil :
o en cas de chute des cheveux s’effectuant en plaques et/ou de façon brutale, de chute des cheveux consécutive à une maladie ou à un traitement médicamenteux, ou si la raison de l’alopécie est inconnue,
o sur une autre partie du corps,
o en même temps que d’autres médicaments sur le cuir chevelu.
En cas de contact accidentel avec l’œil, une peau irritée, une muqueuse, la solution peut provoquer une sensation de brûlure et/ou une irritation. En cas de contact avec les surfaces sensibles (œil, peau irritée, muqueuses), rincer abondamment à l'eau courante froide.
L'ingestion accidentelle est susceptible d'entraîner des effets indésirables sévères, notamment cardiaques (voir rubrique 4.8).
Ce produit doit donc être tenu hors de la portée des enfants.
L’exposition solaire est déconseillée en cas d’application de minoxidil.
Quelques patients ont constaté une modification de la couleur et/ou de la texture de leurs cheveux.
Ne pas inhaler.
L’utilisation d’une posologie ou d’une fréquence supérieures n’entraînera pas d’amélioration des résultats.
La poursuite du traitement est nécessaire pour augmenter et maintenir la repousse des cheveux. Dans le cas contraire, la chute des cheveux reprendra.
Une augmentation temporaire de la chute des cheveux peut se produire pendant les 2 à 6 premières semaines de traitement. Si la chute de cheveux persiste, le patient devra arrêter d’utiliser MINOXIDIL SANDOZ CONSEIL et consulter son médecin.
Une pilosité indésirable peut se produire en raison du transfert du produit sur d’autres zones que le cuir chevelu.
Hypertrichose chez l’enfant suite à une exposition topique involontaire au minoxidil :
Des cas d’hypertrichose ont été rapportés chez des nourrissons après contact cutané au niveau des sites d’application du minoxidil de patients (soignants) utilisant du minoxidil topique. L'hypertrichose était réversible, en quelques mois, lorsque les nourrissons n'étaient plus exposés au minoxidil. Le contact entre les enfants et les sites d’application du minoxidil doit donc être évité.
Excipients
Ce médicament contient 550 mg de propylèneglycol par dose (1 mL).
Ce médicament contient 250,7 mg d'alcool (éthanol) par dose (1mL). Cela peut provoquer une sensation de brûlure sur une peau endommagée. À tenir à l'écart de toute flamme, cigarette allumée ou source de chaleur intense.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Le minoxidil topique ne doit pas être utilisé en même temps que d’autres médicaments (notamment, corticostéroïdes, trétinoïne, anthraline) sur le cuir chevelu, car ces médicaments topiques peuvent modifier la perméabilité de la peau et entraîner une modification de l'absorption de minoxidil.
Une interaction avec les antihypertenseurs vasodilatateurs tels que la guanethidine a été rapportée avec des formulations orales de minoxidil conduisant à une baisse rapide et prononcée de la pression artérielle.
4.6. Fertilité, grossesse et allaitement
Grossesse
Ce médicament est contre-indiqué chez la femme.
Administré par voie générale, le minoxidil passe dans le lait maternel.
Ce médicament est contre-indiqué chez la femme.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
La sécurité du minoxidil topique est basée sur 7 études cliniques randomisées et contrôlées versus placebo chez l’adulte évaluant le minoxidil en solution à 2 % ou 5 %, et deux études cliniques randomisées et contrôlées versus placebo chez l’adulte évaluant la formulation en mousse à 5 %.
Les effets indésirables identifiés au cours des études cliniques et après l’obtention de l’autorisation de mise sur le marché sont présentés dans le tableau ci-dessous. Dans ce tableau, les fréquences sont présentées selon la convention suivante :
Très fréquent ≥ 1/10
Fréquent ≥ 1/100 et < 1/10
Peu fréquent ≥ 1/1 000 et < 1/100
Rare ≥ 1/10 000 et < 1/1 000
Très rare < 1/10 000
Fréquence indéterminée (ne peut être estimée sur la base des données disponibles)
Les effets indésirables sont présentés par catégorie de fréquence basée sur 1) l'incidence dans les essais cliniques ou les études épidémiologiques, si disponible, ou 2) lorsque l'incidence ne peut être estimée, la catégorie de fréquence est répertoriée comme « indéterminée ».
|
Classe de systèmes d’organes |
|
|
Catégorie de fréquence |
Terme recommandé pour l’effet indésirable |
|
Infections et Infestations |
|
|
Fréquence indéterminée |
Otite externe |
|
Affections du système immunitaire |
|
|
Fréquence indéterminée |
Dermatite de contact allergique |
|
Réactions allergiques, y compris angio-oedème (les manifestations de l’angio-oedème peuvent comprendre les termes recommandés suivants : œdème des lèvres, gonflement des lèvres, œdème de la bouche, gonflement bucco-pharyngé, œdème pharyngé, gonflement de la langue et œdème de la langue) |
|
|
Hypersensibilité (les manifestations des réactions d’hypersensibilité peuvent comprendre les termes recommandés suivants du dictionnaire MedDRA : œdème du visage, érythème généralisé, prurit généralisé, sensibilité, rhinite, picotements, gonflement du visage et constriction de la gorge) |
|
|
Affections du système nerveux |
|
|
Peu fréquent |
Sensations vertigineuses |
|
Très fréquent |
Céphalées |
|
Fréquence indéterminée |
Dysgueusie |
|
Névrite |
|
|
Paresthésie |
|
|
Affections oculaires |
|
|
Fréquence indéterminée |
Irritation oculaire |
|
Troubles visuels |
|
|
Affections cardiaques |
|
|
Rare |
Douleur thoracique |
|
Accélération du rythme cardiaque (tachycardie) |
|
|
Palpitations |
|
|
Affections vasculaires |
|
|
Fréquence indéterminée |
Hypotension |
|
Affections respiratoires, thoraciques et médiastinales |
|
|
Fréquent |
Dyspnée |
|
Affections gastro-intestinales |
|
|
Peu fréquent |
Nausées |
|
Fréquence indéterminée |
Vomissements |
|
Affections hépatobiliaires |
|
|
Fréquence indéterminée |
Hépatite |
|
Affections de la peau et du tissu sous-cutané |
|
|
Fréquent |
Dermatite, dermatite acnéiforme |
|
Hypertrichose (affectant d’autres parties que le cuir chevelu) |
|
|
Prurit |
|
|
Rash |
|
|
Fréquence indéterminée |
Alopécie |
|
Changement de la couleur des cheveux, pousse anormale des cheveux, texture anormale des cheveux |
|
|
Affections du rein et des voies urinaires |
|
|
Fréquence indéterminée |
Lithiase rénale |
|
Troubles généraux et anomalies au site d’administration |
|
|
Fréquent |
Œdème périphérique |
|
Fréquence indéterminée |
Réactions au site d’administration : (celles-ci touchent parfois les structures environnantes, notamment les oreilles et le visage et se manifestent généralement par : prurit, irritation, douleur, sensation de brûlure, éruption cutanée, acné, œdème, sécheresse cutanée et érythème, mais peuvent parfois être plus sévères et comprendre : exfoliation, dermatite, vésiculation, saignements et ulcération) |
|
Asthénie |
|
|
Investigations |
|
|
Fréquent |
Gain de poids* |
* Cet événement indésirable a été observé au cours des études cliniques sur la mousse de minoxidil.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/.
Une augmentation de l’absorption systémique du minoxidil pouvant entraîner des événements indésirables peut se produire si des doses supérieures à la posologie recommandée sont appliquées sur des zones corporelles plus larges ou des zones autres que le cuir chevelu.
L'ingestion accidentelle peut provoquer les effets systémiques dus à l'action vasodilatatrice du minoxidil. Les signes et symptômes d'un surdosage éventuel seraient d'ordre cardio-vasculaire, avec hypotension, tachycardie, léthargie et rétention hydrosodée.
Une rétention hydrosodée peut être traitée par une thérapeutique diurétique appropriée, une tachycardie et un angor par un agent bêta-bloqueur ou un autre inhibiteur du système nerveux sympathique. Une hypotension symptomatique pourrait être traitée par administration intraveineuse de solution isotonique de chlorure de sodium. Il convient d'éviter l'utilisation de sympathomimétiques, telles la noradrénaline et l'adrénaline en raison d'une trop grande stimulation cardiaque.
Tenir hors de la portée des enfants. En cas d’ingestion, contacter immédiatement un médecin ou un service d’urgence.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Mécanisme d’action
Le mécanisme précis d'action n'est pas connu, mais certains effets de minoxidil incluent une stimulation et une prolongation de la croissance anagène, et la stimulation de la transition des follicules pileux de la phase de repos (télogène) à la phase de croissance (anagène).
Efficacité et sécurité préclinique
Appliqué par voie topique, le minoxidil stimule la croissance des kératinocytes in vitro et in vivo et la pousse des cheveux chez certains sujets présentant une alopécie androgénétique. L'apparition de ce phénomène a lieu après environ 2 à 4 mois d'utilisation du produit et varie en fonction des sujets.
A l'arrêt du traitement, la repousse cesse et un retour à l'état initial est prévisible sous 3 ou 4 mois.
L'application topique de minoxidil au cours des essais cliniques contrôlés chez des patients normotendus ou hypertendus non traités n'a pas donné lieu à l'observation de manifestations systémiques liées à une absorption du minoxidil.
5.2. Propriétés pharmacocinétiques
Le minoxidil, lorsqu'il est appliqué par voie topique, n'est que faiblement absorbé : une quantité moyenne de 1,7% (pour des valeurs allant de 0,3 à 4,5%) de la dose appliquée parvient à la circulation générale.
A titre de comparaison, lorsqu'il est administré par voie orale sous forme de comprimés (dans le traitement de certaines hypertensions), le minoxidil est pratiquement complètement résorbé à partir du tractus gastro-intestinal. Une dose de 1 mL de solution correspondant à une application sur la peau de 50 mg de minoxidil, résulterait donc en une absorption d'environ 0,85 mg de minoxidil.
Au cours d’une étude, l’aire sous la courbe (ASC) du minoxidil sous forme de solution à 2 % était en moyenne de 7,54 ng·h/ml, comparativement à une ASC moyenne de 35,1 ng·h/ml pour la formulation orale à 2,5 mg. La concentration sérique maximale moyenne (Cmax) pour la solution topique était de 1,25 ng/ml, comparé à 18,5 ng/ml suite à l’administration d’une dose orale de 2,5 mg.
Dans une autre étude, l'absorption systémique d'une formulation de mousse à 5% était d’environ la moitié de celle d'une solution topique à 5 %. L'ASC moyenne (0-12 h) et la Cmax pour la mousse à 5 %, étaient de 8,81 ng·h/ml et 1,11 ng/ml, respectivement, correspondant à environ 50 % de l'ASC (0-12 h) et de la Cmax de la solution à 5 % (18,71 ngh/ml et 2,13 ng/ml, respectivement).
L'ASC du minoxidil 5 % mousse utilisé une fois par jour a été similaire à celle d'une solution de minoxidil à 2 % utilisée deux fois par jour chez des sujets de sexe féminin.
Le Tmax pour la mousse à 5 % (5,42 h), était similaire au Tmax pour la solution à 5 % (5,79 h). Les effets hémodynamiques du minoxidil ne sont pas visibles jusqu'à ce que les concentrations moyennes sériques de minoxidil atteignent 21,7 ng/ml.
Distribution
Le volume de distribution du minoxidil après administration intraveineuse a été estimé à 70 litres.
Biotransformation
La biotransformation du minoxidil absorbé après application topique n'est pas entièrement connue.
Environ 60 % du minoxidil absorbé après application topique est métabolisé en glucuronide minoxidil, principalement dans le foie.
Élimination
La demi-vie moyenne du minoxidil topique atteint en moyenne 22 heures. Le minoxidil et ses métabolites sont excrétés à 97 % dans les urines et 3 % dans les fèces.
Après arrêt de l'application topique, environ 95 % du minoxidil absorbé est éliminé en 4 jours.
5.3. Données de sécurité préclinique
Des effets cardiaques spécifiques chez le chien ont été observés à faible dose conduisant à des effets hémodynamiques importants associés à des modifications cardiaques lors d’études de toxicité en administration répétée. Les données disponibles n’ont pas montré d’effets semblables chez l’Homme traité par le minoxidil, par voie orale ou cutanée.
Pouvoir mutagène
Le minoxidil n’a montré aucun signe de pouvoir mutagène ou génotoxique dans un certain nombre d’essais in vitro et in vivo.
Cancérogénicité
Une forte incidence de tumeurs hormono-dépendantes a été observée chez la souris et chez le rat. Ces tumeurs sont dues aux effets hormonaux secondaires (hyperprolactinémie) observés uniquement chez les rongeurs à des doses extrêmement élevées, survenant par un mécanisme similaire à celui observé avec la réserpine.
L’application topique de minoxidil n’a pas entraîné d’effets sur le statut hormonal chez la femme. Par conséquent, la tendance du minoxidil à favoriser des tumeurs à médiation hormonale ne constitue pas un risque cancérogène chez l’homme.
Tératogénicité
Les études de toxicité sur la reproduction chez l’animal (rat et lapin) ont montré des signes de toxicité maternelle et un risque pour le fœtus à des niveaux d’exposition très élevés par rapport à ceux prévus chez l’homme.
Fertilité
Des doses de minoxidil supérieures à 9 mg/kg (au moins 25 fois l’exposition chez l’homme) administrées par voie sous-cutanée chez des rats ont été associées à une réduction des taux de fécondation et d’implantation, ainsi qu’à une réduction du nombre de descendants vivants.
Propylèneglycol, éthanol à 96 %, eau purifiée.
3 ans.
6.4. Précautions particulières de conservation
A conserver à une température ne dépassant pas 25°C.
Produit inflammable.
6.5. Nature et contenu de l'emballage extérieur
Flacon blanc (PE) de 60 mL surmonté d'une pompe composée d'une bague (PEBD), d'un joint (PE), d'un tube plongeur (PEBD/PP) et un capot protecteur (Polystyrène), muni d'un embout coudé et articulé (Polypropylène) avec poussoir (PE) livré dans un sachet (PE).
Boîte de 1 ou 3 flacons.
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
Pas d’exigences particulières pour l’élimination.
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
9 PLACE MARIE-JEANNE BASSOT
92300 Levallois-Perret
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 367 562 6 7 : 60 mL en flacon (PE) avec pompe (PE). Boîte de 1 flacon.
· 34009 367 563 2 8 : 60 mL en flacon (PE) avec pompe (PE). Boîte de 3 flacons.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Médicament non soumis à prescription médicale.
ANSM - Mis à jour le : 20/11/2025
MINOXIDIL SANDOZ CONSEIL 5 %, solution pour application cutanée
Minoxidil
Vous devez toujours utiliser ce médicament en suivant scrupuleusement les informations fournies dans cette notice ou par votre médecin ou votre pharmacien.
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Adressez-vous à votre pharmacien pour tout conseil ou information.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
· Vous devez vous adresser à votre médecin si vous ne ressentez aucune amélioration ou si vous vous sentez moins bien après 3 mois.
1. Qu'est-ce que MINOXIDIL SANDOZ CONSEIL 5 %, solution pour application cutanée et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d'utiliser MINOXIDIL SANDOZ CONSEIL 5 %, solution pour application cutanée ?
3. Comment utiliser MINOXIDIL SANDOZ CONSEIL 5 %, solution pour application cutanée ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver MINOXIDIL SANDOZ CONSEIL 5 %, solution pour application cutanée ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE MINOXIDIL SANDOZ CONSEIL 5 %, solution pour application cutanée ET DANS QUELS CAS EST-IL UTILISE ?
Classe pharmacothérapeutique : MINOXIDIL A USAGE LOCAL (D : médicaments dermatologiques). Code ATC : D11AX01.
Ce médicament est indiqué en cas de chute de cheveux modérée (alopécie androgénétique) chez le sujet de sexe masculin.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER MINOXIDIL SANDOZ CONSEIL 5 %, solution pour application cutanée ?
N’utilisez jamais MINOXIDIL SANDOZ CONSEIL 5 %, solution pour application cutanée :
· si vous êtes allergique au minoxidil ou à l’un des autres composants contenus dans ce médicament, mentionnés dans la rubrique 6,
· si vous avez des lésions du cuir chevelu,
· si vous êtes intolérant à la forme à 2 %,
· si vous avez moins de 18 ans ou plus de 65 ans,
· en cas de toute alopécie (chute de cheveux) de la femme.
Avertissements et précautions
Adressez-vous à votre médecin ou pharmacien avant d’utiliser MINOXIDIL SANDOZ CONSEIL 5 %, solution pour application cutanée. En cas de maladies cardiaques mêmes anciennes, il est nécessaire de consulter un médecin avant la première utilisation de minoxidil.
Ne pas appliquer de minoxidil :
· en cas de chute de cheveux s’effectuant en plaque et/ou de façon brutale, de chute des cheveux consécutive à une maladie, à un traitement médicamenteux ou si la raison de la chute de cheveux n’est pas connue. N’UTILISEZ PAS CE MEDICAMENT ET PRENEZ L’AVIS DE VOTRE MEDECIN. En effet, le minoxidil ne serait pas efficace sur ce type de chute de cheveux (voir Conseils d’éducation sanitaire),
· sur une autre partie du corps.
Il est important de respecter la posologie et le mode d'administration préconisés :
· n'augmentez pas la dose par application, n'augmentez pas la fréquence des applications,
· n'appliquez le minoxidil que sur un cuir chevelu sain. Evitez cette application en cas d'irritation, de rougeur persistante, d'inflammation, de sensation douloureuse du cuir chevelu,
· n'appliquez pas de minoxidil en même temps que de l'acide rétinoïque ou que de l'anthraline (médicaments parfois utilisés en dermatologie) ou que de tout autre médicament de dermatologie irritant.
Chez les sujets présentant des lésions du cuir chevelu, une augmentation du passage dans le sang du principe actif est possible (voir N'utilisez jamais MINOXIDIL SANDOZ CONSEIL 5%, solution pour application cutanée).
En cas de non-respect de la posologie et/ou du mode d’administration préconisés, le passage dans la circulation générale du minoxidil pourrait être augmenté et entraîner des effets indésirables tels que douleur thoracique, baisse de la pression artérielle, tachycardie (accélération du rythme cardiaque), étourdissements ou sensation de vertiges, prise de poids soudaine et inexpliquée, gonflement des mains et des pieds. En cas d’apparition de ces symptômes, s’ils s’aggravent ou si de nouveaux symptômes apparaissent : arrêtez le traitement et consultez votre médecin.
· Arrêtez le traitement et consultez votre médecin en cas de rougeur ou d'irritation persistante du cuir chevelu.
· Ne pas avaler. Ne pas inhaler.
· Ne laisser pas ce médicament à la portée des enfants.
· Prévenir votre médecin en cas de troubles cardiaques.
· En cas de contact accidentel avec l’œil, une plaie, une muqueuse, la solution (contenant de l’éthanol) peut provoquer une sensation de brûlure et une irritation : rincer abondamment avec de l’eau courante.
· Une modification de la couleur et /ou la texture des cheveux a été constatée chez quelques patients.
· L’exposition solaire est déconseillée en cas d’application de minoxidil : une protection est nécessaire (chapeau).
Des cas de pilosité excessive sur le corps de nourrissons ont été rapportés après contact cutané au niveau des sites d’application du minoxidil de patients (soignants) utilisant du minoxidil topique. La croissance des poils est revenue à la normale en quelques mois lorsque les nourrissons n'étaient plus exposés au minoxidil. Veiller à ce que les enfants n’entrent pas en contact avec des zones de votre corps où vous avez appliqué le minoxidil par voie topique.
Consultez un médecin si vous remarquez une pilosité excessive sur le corps de votre enfant pendant la période où vous utilisez des produits topiques contenant du minoxidil.
En cas de doute ne pas hésiter à demander l'avis de votre médecin ou de votre pharmacien.
Enfants et adolescents
Sans objet.
Autres médicaments et MINOXIDIL SANDOZ CONSEIL 5 %, solution pour application cutanée
Informez votre médecin ou pharmacien si vous prenez, avez récemment pris ou pourriez prendre tout autre médicament.
Le minoxidil ne doit pas être utilisé en même temps que d'autres médicaments (notamment, corticostéroïdes, trétinoïne, anthraline) sur le cuir chevelu.
MINOXIDIL SANDOZ CONSEIL 5 %, solution pour application cutanée avec des aliments et boissons
Sans objet.
Ce médicament est contre-indiqué chez la femme.
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin ou à votre pharmacien avant de prendre ce médicament.
Conduite de véhicules et utilisation de machines
Le minoxidil peut provoquer des vertiges ou une hypotension (voir rubrique 4 « QUELS SONT LES EFFETS INDÉSIRABLES ÉVENTUELS ? »). Soyez prudent si vous conduisez un véhicule ou utilisez des machines.
MINOXIDIL SANDOZ CONSEIL 5 %, solution pour application cutanée contient du propylèneglycol et de l’éthanol.
Ce médicament contient 550 mg de propylèneglycol par dose (1 mL).
Ce médicament contient 250.7 mg d'alcool (éthanol) par dose (1mL). Cela peut provoquer une sensation de brûlure sur une peau endommagée. À tenir à l'écart de toute flamme, cigarette allumée ou source de chaleur intense.
3. COMMENT UTILISER MINOXIDIL SANDOZ CONSEIL 5 %, solution pour application cutanée ?
Veillez à toujours utiliser ce médicament en suivant exactement les indications de cette notice ou les indications de votre médecin ou pharmacien. Vérifiez auprès de votre médecin ou pharmacien en cas de doute.
RESERVE A L’ADULTE.
Posologie
Appliquer 2 fois par jour (une fois le matin et une fois le soir) une dose de 1 mL sur la zone de calvitie du cuir chevelu en prenant pour point de départ le centre de la zone à traiter.
Cette dose doit être respectée quelle que soit l'étendue de la zone concernée.
La dose journalière totale ne doit pas dépasser 2 mL.
Etendre le produit avec le bout des doigts de façon à couvrir l'ensemble de la zone à traiter.
Se laver soigneusement les mains après utilisation.
Ne pas appliquer le produit sur une autre partie du corps.
Mode d'administration
Voie cutanée.
Appliquer sur des cheveux et un cuir chevelu parfaitement secs.
Le mode d’application varie en fonction du système de délivrance utilisé avec le flacon.
Pulvérisateur : ce système est adapté à l'application sur des surfaces étendues du cuir chevelu.
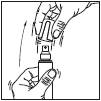

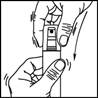
1. Retirer le capot du flacon.
2. Diriger la pompe vers le centre de la surface à traiter, l'actionner une fois et étendre le produit avec le bout des doigts de façon à couvrir l'ensemble de la zone à traiter. Répéter l'opération 6 fois pour appliquer une dose de 1 mL (soit 7 pulvérisations au total).
Eviter d'inhaler le produit.
3. Replacer le capot sur le flacon après utilisation.
Pulvérisateur muni d'un applicateur : ce système est adapté à l'application sur de petites surfaces ou sous les cheveux.
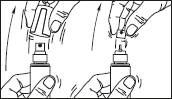
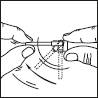
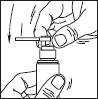
1. Retirer le capot du flacon. Retirer l'élément supérieur de la pompe
2. Relever l'embout coudé de l'applicateur. Adapter l'applicateur et appuyer fermement.
Opérer ensuite selon le procédé décrit pour le pulvérisateur :

3. Diriger la tige vers le centre de la surface à traiter, l'actionner une fois et étendre le produit avec le bout des doigts de façon à couvrir l'ensemble de la zone à traiter. Répéter l'opération 6 fois pour appliquer une dose de 1 mL (soit 7 pulvérisations au total).
Eviter d'inhaler le produit.
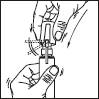
4. Rabaisser l'embout de l'applicateur. Replacer le capot sur le flacon après utilisation.
Fréquence d’administration
1 application deux fois par jour, matin et soir.
Durée du traitement
Un traitement d'une durée de 2 mois à raison de 2 applications par jour peut être nécessaire avant que soit mise en évidence une stimulation de la pousse des cheveux.
Le début et le degré de la réponse varient en fonction des sujets.
Ne pas arrêter les applications au risque de revenir à l'état antérieur après un délai de 3 ou 4 mois. Ne plus utiliser MINOXIDIL SANDOZ CONSEIL en l’absence d’amélioration après 4 mois d’utilisation.
L’augmentation de la dose ou de la fréquence d’application n’entrainera pas d’amélioration des résultats.
Si vous avez utilisé plus de MINOXIDIL SANDOZ CONSEIL 5 %, solution pour application cutanée que vous n’auriez dû :
Consultez immédiatement votre médecin ou votre pharmacien.
L’ingestion accidentelle peut provoquer des effets dus à l’action cardio-vasculaire du minoxidil.
Tenir hors de la portée des enfants. En cas d’ingestion, contactez immédiatement un médecin ou un service médical d’urgence.
Si vous oubliez d’utiliser MINOXIDIL SANDOZ CONSEIL 5 %, solution pour application cutanée :
Ne prenez pas de dose double pour compenser la dose que vous avez oubliée de prendre.
Reprendre à la fréquence habituelle : 1 application le matin, et 1 application le soir.
Si vous arrêtez d’utiliser MINOXIDIL SANDOZ CONSEIL 5 %, solution pour application cutanée :
A l’arrêt du traitement, la repousse cesse et un retour à l’état initial est prévisible sous 3 ou 4 mois.
Si vous avez d’autres questions sur l’utilisation de ce médicament, demandez plus d’informations à votre médecin ou à votre pharmacien.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Comme tous les médicaments, ce médicament peut provoquer des effets indésirables, mais ils ne surviennent pas systématiquement chez tout le monde.
Informez immédiatement votre médecin si vous remarquez l’un des symptômes suivants, car vous pourriez avoir besoin d’un traitement médical en urgence :
· Gonflement du visage, des lèvres ou de la gorge entraînant des difficultés à avaler ou à respirer. Ces symptômes pourraient être le signe d’une réaction allergique grave (fréquence indéterminée, impossible à estimer à partir des données disponibles).
Autres effets indésirables possibles :
· Il est possible que surviennent une irritation locale avec desquamation (élimination des cellules mortes de la peau), démangeaisons, érythème (rougeur de la peau), peau sèche, acné, formation de vésicules, saignements, ulcération, sensation de brûlure, douleur et hypertrichose (développement anormal du système pileux à distance du point d’application) ou plus rarement des réactions allergiques. Des difficultés respiratoires ont également été rapportées. Il faut avertir votre médecin.
· Dans quelques cas rares, il est possible que surviennent une baisse de la tension artérielle, une accélération du pouls, des palpitations, une chute des cheveux, des cheveux irréguliers, un changement de la couleur et/ou de la texture des cheveux, une douleur thoracique, une hépatite ou des calculs rénaux : il faut immédiatement arrêter le traitement et avertir votre médecin.
· Plus rarement d'autres réactions ont pu être décrites, à type d'allergie (rhinite, éruptions cutanées, rougeur généralisée), de vertiges, de picotement, de maux de tête, de faiblesse, d’œdèmes (infiltration de liquide dans les tissus), d’altération du goût, d’infection de l'oreille, de troubles de la vision, d’irritation oculaire, de névrite (atteinte d'un nerf), de nausées, de vomissements, de dépression.
Il faut cependant noter que ces effets, en particulier ceux qui ont été le plus rarement rapportés, l'ont été sans que l'on puisse formellement établir qu'ils aient été provoqués par le traitement.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/.
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER MINOXIDIL SANDOZ CONSEIL 5 %, solution pour application cutanée ?
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur l’étiquette et l’emballage après EXP. La date de péremption fait référence au dernier jour de ce mois.
Ce médicament doit être conservé à une température inférieure à 25°C.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient MINOXIDIL SANDOZ CONSEIL 5 %, solution pour application cutanée
· La substance active est :
Minoxidil.................................................................................................................................... 5 g
Pour 100 mL de solution pour application cutanée.
· Les autres composants sont : propylèneglycol, éthanol à 96 %, eau purifiée.
Ce médicament se présente sous forme de solution pour application cutanée en flacon.
Boîte de 1 ou 3 flacons.
Toutes les présentations peuvent ne pas être commercialisées.
Titulaire de l’autorisation de mise sur le marché
9, PLACE MARIE-JEANNE BASSOT
92300 Levallois-Perret
Exploitant de l’autorisation de mise sur le marché
SANDOZ
9, PLACE MARIE-JEANNE BASSOT
92300 Levallois-Perret
9, PLACE MARIE-JEANNE BASSOT
92300 Levallois-Perret
OU
NOVARTIS PHARMA GMBH
ROONSTRASSE 25 UND OBERE TURNSTRASSE 8-10
90429 NUERNBERG, BAYERN
ALLEMAGNE
OU
NOVARTIS FARMACEUTICA S.A.
GRAN VIA DE LES CORTS CATALANES 764
08013 BARCELONE
ESPAGNE
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Sans objet.
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).
Conseil d’éducation sanitaire :
a) Qu'appelle-t-on alopécie androgénétique ?
Normalement les cheveux ont une durée de vie de 3 à 6 ans et il tombe 50 à 100 cheveux par jour.
Une chute de cheveux plus importante peut survenir de façon saisonnière (à l'automne) ou après un accouchement : cette chute est normale, transitoire et il n'y a pas lieu de débuter un traitement.
L'alopécie se définit par une chute de cheveux supérieure à 100 cheveux par jour.
On distingue deux types d'alopécies :
· les alopécies aiguës,
· les alopécies chroniques.
ð Les alopécies aiguës (chute des cheveux soudaine sur une courte période) peuvent être diffuses ou par plaques (pelades) et sont le plus souvent de cause connue (soins capillaires agressifs, mauvais état général, cure d'amaigrissement mal équilibrée, certains médicaments, choc psychique, stress...). Ces alopécies aiguës ne doivent pas être traitées par ce médicament.
ð Les alopécies chroniques (au long cours) sont presque toujours diffuses. Elles sont parfois dues à une maladie précise (thyroïde, métabolique...) et elles ne doivent pas être traitées par ce médicament. Dans la grande majorité, ces alopécies chroniques sont d'origine mal connue, le plus souvent à caractère héréditaire : il s'agit de l'alopécie androgénétique. Seul ce type d'alopécie peut être traité par le minoxidil.
b) Comment reconnaître une alopécie androgénétique chez le sujet de sexe masculin ?

L'alopécie androgénétique débute par un dégarnissement des golfes temporaux.
Puis une légère tonsure apparaît au sommet du crâne.
Ces deux zones dépourvues de cheveux vont progressivement s'agrandir : l'alopécie androgénétique évolue progressivement vers la calvitie.
c) Quelques conseils d'utilisation
Utiliser un shampooing peu agressif (de préférence sans silicone).
Si vous faites votre shampooing après l'application du minoxidil, respecter une période de 4 heures après celle-ci.
Si vous appliquez le minoxidil après le shampooing, il est recommandé de le faire sur un cuir chevelu sec.
Vous pouvez utiliser un sèche-cheveux de préférence en position tiède après l'application de minoxidil.
Vous pouvez utiliser des mousses, gels ou sprays coiffants en respectant un délai minimum de 1 heure entre les applications.
Il n'y a pas d'interaction entre votre traitement par le minoxidil et vos permanentes ou soins colorants mais il est préférable de les limiter du fait de leur agressivité sur les cheveux.
Si vous envisagez de vous exposer au soleil après une application de minoxidil, il est recommandé de couvrir vos cheveux.
d) Quelques informations complémentaires
En début de traitement, sur une courte période, il est possible que se produise une augmentation de la chute des cheveux. Ces cheveux étaient destinés à tomber et le font plus rapidement. C'est un phénomène normal, continuez le traitement.
Les premiers cheveux qui pousseront seront doux, duveteux et peu visibles. Au fur et à mesure, en poursuivant votre traitement, ils pourront changer et s'épaissir.
[SA1]Mention déjà présente en rubrique 7 ci-dessous.