
DOGMATIL 0,5 g/100 ml SANS SUCRE, solution buvable édulcorée au cyclamate de sodium - Résumé des caractéristiques du produit |
 |
|
ANSM - Mis à jour le : 21/08/2024
DOGMATIL 0,5 g/100 ml SANS SUCRE, solution buvable édulcorée au cyclamate de sodium
2. COMPOSITION QUALITATIVE ET QUANTITATIVE 
Sulpiride base.......................................................................................................................... 0,5 g
Pour 100 ml
Excipients à effet notoire : sodium 2,855 mg par ml, parahydroxybenzoate et éthanol 47,85 mg par dose de 25 mg.
Pour la liste complète des excipients, voir rubrique 6.1.
4.1. Indications thérapeutiques 
Traitement symptomatique de courte durée de l'anxiété en cas d'échec des thérapeutiques habituelles.
Chez l'enfant :
Troubles graves du comportement (agitation, automutilations, stéréotypies) notamment dans le cadre des syndromes autistiques.
4.2. Posologie et mode d'administration 
La posologie minimale efficace sera toujours recherchée. Si l'état clinique du patient le permet, le traitement sera instauré à dose faible, puis augmenté progressivement par paliers.
Chez l'adulte :
Traitement symptomatique de courte durée de l'anxiété de l'adulte en cas d'échec des thérapeutiques habituelles :
La posologie journalière est de 50 à 150 mg pendant 4 semaines au maximum.
Population pédiatrique
Troubles graves du comportement (agitation, automutilations, stéréotypies) notamment dans le cadre des syndromes autistiques :
La posologie journalière est de 5 à 10 mg/kg.
Mode d’administration
Voie orale.
Ce médicament s’administre uniquement à l’aide du godet fourni avec le flacon dans la boîte.
La dose par prise se lit directement sur le godet gradué de 25 mg à 75 mg, par intervalles de 5 mg
Pour la population pédiatrique, la dose doit être calculée. Si la dose calculée correspond à une dose intermédiaire entre 2 graduations, la dose à administrer sera celle correspondant à la graduation inférieure la plus proche sur le godet (voir rubrique 6.6).
Ce médicament ne doit jamais être utilisé dans les situations suivantes :
· hypersensibilité à la substance active ou à l’un des excipients mentionnés à la rubrique 6.1,
· tumeurs prolactino dépendantes (par exemple adénome hypophysaire à prolactine et cancer du sein),
· phéochromocytome, connu ou suspecté,
· en association avec :
o les dopaminergiques hors parkinson (cabergoline, quinagolide),
o le citalopram, l’escitalopram, l’hydroxyzine, la dompéridone et la pipéraquine (voir rubrique 4.5),
· porphyrie aiguë.
4.4. Mises en garde spéciales et précautions d'emploi 
· Un syndrome malin des neuroleptiques potentiellement fatal, signalé en rapport avec les antipsychotiques est caractérisé par une hyperthermie, pâleur, troubles végétatifs, altération de la conscience, une rigidité musculaire, une rhabdomyolyse, des taux sériques élevés de créatine phosphokinase et une dysautonomie, Des cas avec des caractéristiques atypiques telles que l'hyperthermie sans la rigidité musculaire ou hypertonie, ont été observés. Dans le cas d'hyperthermie d'origine non diagnostiquée, qui peut être considéré comme un signe/symptôme précurseur du syndrome malin des neuroleptiques ou comme un syndrome malin des neuroleptiques atypique, tout traitement par sulpiride et tous les autres médicaments antipsychotiques doit être interrompu rapidement sous surveillance médicale.
Les signes de dysfonctionnement végétatif, tels que sudation et instabilité artérielle, peuvent précéder l'apparition de l'hyperthermie et constituer, par conséquent, des signes d'appel précoces.
Bien que cet effet des neuroleptiques puisse avoir une origine idiosyncrasique, certains facteurs de risque semblent y prédisposer, tels que la déshydratation ou des atteintes organiques cérébrales.
· Allongement de l'intervalle QT : le sulpiride prolonge de façon dose-dépendante l'intervalle QT. Cet effet, connu pour potentialiser le risque de survenue de troubles du rythme ventriculaire grave notamment à type de torsades de pointe, est majoré par l'existence d'une bradycardie, d'une hypokaliémie, d'un QT long congénital ou acquis (association à un médicament augmentant l'intervalle QT) (voir rubrique 4.8)
Il convient donc, lorsque la situation clinique le permet, de s'assurer avant toute administration de l'absence de facteurs pouvant favoriser la survenue de ce trouble du rythme :
· bradycardie inférieure à 55 battements par minute,
· hypokaliémie,
· allongement congénital de l'intervalle QT,
· traitement en cours par un médicament susceptible d'entraîner une bradycardie marquée (< 55 battements par minute), une hypokaliémie, un ralentissement de la conduction intracardiaque, un allongement de l'intervalle QT (voir rubriques 4.3 et 4.5).
Hormis les situations d'urgence, il est recommandé d'effectuer un électrocardiogramme (ECG) dans le bilan initial des patients devant être traités par un neuroleptique.
Accident vasculaire cérébral
Dans des études cliniques randomisées versus placebo réalisées chez des patients âgés atteints de démence et traités avec certains antipsychotiques atypiques, il a été observé un risque plus élevé d'accident vasculaire cérébral comparé au placebo. Le mécanisme d'une telle augmentation de risque n'est pas connu. Une élévation du risque avec d'autres antipsychotiques ou chez d'autres populations de patients ne peut être exclue. Ce médicament doit être utilisé avec prudence chez les patients présentant des facteurs de risque d'accident vasculaire cérébral.
Patients âgés déments
Le risque de mortalité est augmenté chez les patients âgés atteints de psychose associée à une démence et traités par antipsychotiques.
Les analyses de 17 études contrôlées versus placebo (durée moyenne de 10 semaines), réalisées chez des patients prenant majoritairement des antipsychotiques atypiques, ont mis en évidence un risque de mortalité 1,6 à 1,7 fois plus élevé chez les patients traités par ces médicaments comparativement au placebo.
A la fin du traitement d'une durée moyenne de 10 semaines, le risque de mortalité a été de 4,5% dans le groupe de patients traités comparé à 2,6% dans le groupe placebo.
Bien que les causes de décès dans les essais cliniques avec les antipsychotiques atypiques aient été variées, la plupart de ces décès semblait être soit d'origine cardiovasculaire (par exemple insuffisance cardiaque, mort subite) soit d'origine infectieuse (par exemple pneumonie).
Des études épidémiologiques suggèrent que, comme avec les antipsychotiques atypiques, le traitement avec les antipsychotiques classiques peut augmenter la mortalité.
La part respective de l'antipsychotique et des caractéristiques des patients dans l'augmentation de la mortalité dans les études épidémiologiques n'est pas claire.
Thromboembolie veineuse
Des cas de thromboembolies veineuses (TEV) ont été rapportés avec les antipsychotiques. Les patients traités par des antipsychotiques présentant souvent des facteurs de risque acquis de TEV, tout facteur de risque potentiel de TEV doit être identifié avant et pendant le traitement par DOGMATIL et des mesures préventives doivent être mises en œuvre (voir rubrique 4.8).
Cancer du sein
Le sulpiride peut augmenter les taux de prolactine. Il doit donc être utilisé avec précaution. Quel que soit leur sexe, les patients ayant des antécédents personnels ou familiaux de cancer du sein doivent être étroitement surveillés pendant le traitement par sulpiride.
Diminution du péristaltisme intestinal
Des cas d’obstruction intestinale ont été rapportés chez des patients traités par des antipsychotiques. De rares cas de colite ischémique et de nécrose intestinale, d’évolution parfois fatale, ont également été rapportés. La majorité de ces patients étaient traités de façon concomitante avec un ou plusieurs médicaments induisant une diminution de la motilité intestinale (en particulier les médicaments ayant des propriétés anticholinergiques). L’apparition de douleurs abdominales avec vomissements et/ou diarrhée doit attirer l’attention. Il est impératif que la constipation soit reconnue et traitée activement. La survenue d’un iléus/ une obstruction intestinale doit nécessiter une prise en charge en urgence.
La prise de ce médicament est déconseillée en association avec l'alcool, la lévodopa, les antiparkinsoniens dopaminergiques, les antiparasitaires susceptibles de donner des torsades de pointe, la méthadone, d'autres neuroleptiques et médicaments susceptibles de donner des torsades de pointe (voir rubrique 4.5).
Il est nécessaire de tenir compte du risque d'apparition de dyskinésies tardives, même avec de faibles doses, notamment chez le sujet âgé.
Chez l'enfant, l'efficacité et la tolérance n'ayant pas été complètement étudiées, des précautions devront être prises lors de l'utilisation du sulpiride (voir rubrique 4.2). Du fait du retentissement cognitif, un examen clinique annuel évaluant les capacités d'apprentissage est recommandé. La posologie sera régulièrement adaptée en fonction de l'état clinique de l'enfant.
L'utilisation chez l'enfant de moins de 6 ans sera réservée à des situations exceptionnelles, en milieu spécialisé.
Excipients à effet notoire
Ce médicament contient du parahydroxybenzoate et peut provoquer des réactions allergiques (éventuellement retardées).
Ce médicament contient 2,855 mg de sodium par ml (correspondant à 5 mg de sulpiride base) de solution buvable, ce qui équivaut à 0,143% de l’apport alimentaire quotidien maximal recommandé par l’OMS de 2 g de sodium par adulte.
Ce médicament contient 47,85 mg d'éthanol par dose de 25 mg (5 ml de solution buvable) équivalent à 9,57 mg par ml (0,957 % p/v). La quantité d’éthanol dans 5 ml de ce médicament est équivalente à 1,196 ml de bière ou 0,478 ml de vin.
La quantité d'éthanol contenue dans ce médicament n'est pas susceptible d'avoir un effet chez les adultes et les adolescents, et est peu susceptible d'avoir un effet notable chez les enfants. Chez les jeunes enfants, certains effets peuvent survenir comme par exemple la somnolence.
L'éthanol contenu dans ce médicament peut modifier les effets d'autres médicaments (voir rubrique 4.5).
Il doit être pris en compte chez les personnes souffrant d’alcoolisme, chez les femmes enceintes ou qui allaitent et chez les enfants.
Précautions d'emploi
Les patients diabétiques et les patients ayant des facteurs de risque de diabète, et qui débutent un traitement par sulpiride, doivent faire l'objet d'une surveillance glycémique appropriée.
En dehors de situations exceptionnelles, ce médicament ne doit pas être utilisé en cas de maladie de Parkinson.
En cas d'insuffisance rénale, réduire la posologie et renforcer la surveillance, en cas d'insuffisance rénale grave, il est recommandé de prescrire des cures discontinues.
La surveillance du traitement par sulpiride doit être renforcée :
· chez les sujets épileptiques en raison de la possibilité d'abaissement du seuil épileptogène, des cas de convulsions ont été rapportés chez des patients traités par sulpiride (voir rubrique 4.8),
· chez le sujet âgé présentant une plus grande sensibilité à l'hypotension orthostatique, à la sédation, et aux effets extrapyramidaux.
Des cas de leucopénie, neutropénie et agranulocytose ont été rapportés avec les antipsychotiques dont DOGMATIL. Des infections inexpliquées ou de la fièvre inexpliquée peuvent être révélateurs d'une leucopénie (voir rubrique 4.8) et nécessiter la réalisation de bilans sanguins immédiats.
DOGMATIL doit être utilisé avec prudence chez les patients ayant un antécédent de glaucome, d’iléus, de sténose digestive congénitale, de rétention urinaire ou d’hyperplasie de la prostate.
DOGMATIL doit être utilisé avec prudence chez les patients hypertendus, et plus particulièrement chez le sujet âgé, en raison du risque de crise hypertensive. Une surveillance adéquate doit être mise en place chez ces patients.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions 
+ Interaction liée à la présence d’éthanol
La co-administration de médicaments contenant par exemple du propylène glycol ou de l’éthanol peut entraîner une accumulation d’éthanol et induire des effets indésirables, en particulier chez les jeunes enfants ayant une capacité métabolique faible ou immature.
+ Médicaments sédatifs
Il faut prendre en compte le fait que de nombreux médicaments ou substances peuvent additionner leurs effets dépresseurs du système nerveux central et contribuer à diminuer la vigilance. Il s'agit des dérivés morphiniques (analgésiques, antitussifs et traitements de substitution), des neuroleptiques, des barbituriques, des benzodiazépines, des anxiolytiques autres que les benzodiazépines (par exemple, le méprobamate), des hypnotiques, des antidépresseurs sédatifs (amitriptyline, doxépine, miansérine, mirtazapine, trimipramine), des antihistaminiques H1 sédatifs, des antihypertenseurs centraux, du baclofène et de la thalidomide.
+ Médicaments susceptibles de donner des torsades de pointe
Ce trouble du rythme cardiaque grave peut être provoqué par un certain nombre de médicaments, antiarythmiques ou non. L'hypokaliémie (voir Hypokaliémiants) est un facteur favorisant, de même que la bradycardie (voir Bradycardisants) ou un allongement préexistant de l'intervalle QT, congénital ou acquis.
Les médicaments à l’origine de cet effet indésirable sont notamment les antiarythmiques de classe Ia et III, et certains neuroleptiques. D'autres molécules n’appartenant pas à ces classes sont également en cause.
Pour le dolasétron, l'érythromycine, la spiramycine et la vincamine, seules les formes administrées par voie intraveineuse sont concernées par cette interaction.
L'utilisation d'un médicament torsadogène avec un autre médicament torsadogène est contre-indiquée en règle générale.
Toutefois certains d’entre eux, en raison de leur caractère incontournable, font exception à la règle, en étant seulement déconseillés avec les autres torsadogènes. Il s’agit de la méthadone, des antiparasitaires (chloroquine, halofantrine, luméfantrine, pentamidine) et des neuroleptiques.
Cependant, le citalopram, la dompéridone et l’escitalopram ne suivent pas cet assouplissement, et sont contre-indiqués avec tous les torsadogènes.
Associations contre-indiquées
+ Citalopram, escitalopram
Risque majoré de troubles du rythme ventriculaire, notamment de torsades de pointe.
+ Dopaminergiques hors parkinson (cabergoline, quinagolide)
Antagonisme réciproque de l'agoniste dopaminergique et des neuroleptiques.
+ Dompéridone
Risque majoré de troubles du rythme ventriculaire, notamment de torsades de pointe.
+ Hydroxyzine
Risque majoré de troubles du rythme ventriculaire, notamment de torsades de pointe.
+ Pipéraquine
Risque majoré de troubles du rythme ventriculaire, notamment de torsades de pointe.
+ Antiparasitaires susceptibles de donner des torsades de pointe (chloroquine, halofantrine, luméfantrine, pentamidine)
Risque majoré de troubles du rythme ventriculaire, notamment de torsades de pointe.
Si cela est possible, interrompre l’un des deux traitements.
Si l'association ne peut être évitée, contrôle préalable du QT et surveillance ECG monitoré.
+ Antiparkinsoniens dopaminergiques (amantadine, apomorphine, bromocriptine, entacapone, lisuride, pergolide, piribédil, pramiprexole, rasagiline, ropinirole, rotigotine, sélégiline)
Antagonisme réciproque du dopaminergique et des neuroleptiques.
Le dopaminergique peut provoquer ou aggraver les troubles psychotiques. En cas de nécessité d'un traitement par neuroleptiques chez le patient parkinsonien traité par dopaminergiques, ces derniers doivent être diminués progressivement jusqu'à l'arrêt (leur arrêt brutal expose à un risque de « syndrome malin des neuroleptiques »).
+ Autres médicaments susceptibles de donner des torsades de pointe : antiarythmiques de classe Ia (quinidine, hydroquinidine, disopyramide) et de classe III (amiodarone, dronédarone, sotalol, dofétilide, ibutilide), et autres médicaments tels que arsénieux, diphémanil, dolasétron IV, dompéridone, érythromycine IV, hydroxychloroquine, lévofloxacine, méquitazine, mizolastine, prucalopride, vincamine IV, moxifloxacine, spiramycine IV, torémifène, vandétanib
Risque majoré de troubles du rythme ventriculaire, notamment de torsades de pointe.
+ Autres neuroleptiques susceptibles de donner des torsades de pointe (amisulpride, chlorpromazine, cyamémazine, dropéridol, flupenthixol, fluphénazine, halopéridol, lévomépromazine, pimozide, pipampérone, pipotiazine, sultopride, tiapride, zuclopenthicol)
Risque majoré de troubles du rythme ventriculaire, notamment de torsades de pointe.
+ Alcool (boisson ou excipient)
Majoration par l'alcool de l'effet sédatif de ces substances.
L'altération de la vigilance peut rendre dangereuses la conduite de véhicules et l'utilisation de machines.
Eviter la prise de boissons alcoolisées et de médicaments contenant de l'alcool.
+ Lévodopa
Antagonisme réciproque de la lévodopa et des neuroleptiques.
Chez le patient parkinsonien, utiliser les doses minimales efficaces de chacun des deux médicaments.
+ Méthadone
Risque majoré de troubles du rythme ventriculaire, notamment de torsades de pointe.
Associations faisant l'objet de précautions d’emploi
+ Anagrelide
Risque majoré de troubles du rythme ventriculaire, notamment de torsades de pointe.
Surveillance clinique et électrocardiographique pendant l’association.
+ Azithromycine
Risque majoré de troubles du rythme ventriculaire, notamment de torsades de pointe.
Surveillance clinique et électrocardiographique pendant l'association.
+ Bêta-bloquants dans l'insuffisance cardiaque (bisoprolol, carvédilol, métoprolol, nébivolol)
Risque majoré de troubles du rythme ventriculaire, notamment de torsades de pointe.
Surveillance clinique et ECG.
+ Bradycardisants (notamment antiarythmiques de classe Ia, bêta-bloquants, certains antiarythmiques de classe III, certains antagonistes du calcium, crizotinib, digitaliques, pasiréotide, pilocarpine, anticholinestérasiques)
Risque majoré de troubles du rythme ventriculaire, notamment de torsades de pointe.
Surveillance clinique et ECG.
+ Ciprofloxacine, lévofloxacine, norfloxacine
Risque majoré de troubles du rythme ventriculaire, notamment de torsades de pointe.
Surveillance clinique et électrocardiographique pendant l’association.
+ Clarithromycine
Risque majoré de troubles du rythme ventriculaire, notamment de torsades de pointe. Surveillance clinique et électrocardiographique pendant l'association.
+ Hypokaliémiants (diurétiques hypokaliémiants, seuls ou associés, laxatifs stimulants, glucocorticoïdes, tétracosactide et amphotéricine B par voie IV)
Risque majoré de troubles du rythme ventriculaire, notamment de torsades de pointe.
Corriger toute hypokaliémie avant d'administrer le produit et réaliser une surveillance clinique, électrolytique et ECG.
+ Lithium
Risque d’apparition de signes neuropsychiques évocateurs d’un syndrome malin des neuroleptiques ou d’une intoxication au lithium.
Surveillance clinique et biologique régulière, notamment en début d’association.
Arrêt d’un des deux traitements aux premiers signes de neurotoxicité.
+ Ondansétron
Risque majoré de troubles du rythme ventriculaire, notamment de torsades de pointe.
Surveillance clinique et électrocardiographique pendant l’association.
+ Roxithromycine
Risque majoré de troubles du rythme ventriculaire, notamment de torsades de pointe.
Surveillance clinique et électrocardiographique pendant l'association.
+ Sucralfate
Diminution de l'absorption digestive du sulpiride.
Prendre le sucralfate à distance du sulpiride (plus de 2 heures, si possible).
+ Topiques gastro-intestinaux, anti-acides et charbon
Diminution de l’absorption digestive du sulpiride.
Prendre les topiques gastro-intestinaux et antiacides à distance du sulpiride (plus de 2 heures, si possible).
Associations à prendre en compte
+ Autres médicaments sédatifs
Majoration de la dépression centrale.
L’altération de la vigilance peut rendre dangereuses la conduite de véhicules et l’utilisation de machines.
+ Bêta-bloquants dans l’insuffisance cardiaque (bisoprolol, carvédilol, métoprolol, nébivolol)
(Pour les bêta-bloquants utilisés dans l'insuffisance cardiaque, voir aussi « Associations faisant l’objet de précaution d’emploi »)
Effet vasodilatateur et risques d'hypotension, notamment orthostatique (effet additif).
+ Dapoxétine
Risque de majoration des effets indésirables, notamment à type de vertiges ou de syncopes.
+ Orlistat
Risque d’échec thérapeutique en cas de traitement concomitant par orlistat.
+ Médicaments abaissant la tension artérielle
Risque de majoration du risque d’hypotension, notamment orthostatique.
4.6. Fertilité, grossesse et allaitement 
Grossesse
Les données sur l’utilisation du sulpiride chez la femme enceinte sont très limitées. La sécurité d'emploi de sulpiride au cours de la grossesse n’a pas été établie. Le sulpiride traverse le placenta. Les études chez l’animal ont montré une toxicité sur la fonction de reproduction.
L'utilisation de sulpiride n’est pas recommandée pendant la grossesse et chez les femmes en âge de procréer n'utilisant pas de contraception efficace, sauf si les bénéfices attendus justifient les risques potentiels encourus.
Les nouveau-nés exposés aux antipsychotiques (dont DOGMATIL) au cours du troisième trimestre de la grossesse, présentent un risque d’événements indésirables incluant des symptômes extrapyramidaux et/ou des symptômes de sevrage, pouvant varier en termes de sévérité et de durée après la naissance (voir rubrique 4.8). Les réactions suivantes ont été rapportées : agitation, hypertonie, hypotonie, tremblements, somnolence, détresse respiratoire, troubles de l’alimentation. En conséquence, les nouveau-nés doivent être étroitement surveillés.
Le sulpiride est excrété dans le lait maternel en quantité assez importantes, dépassant dans certains cas la valeur acceptée de 10 % de la posologie ajustée en fonction du poids de la mère, mais les concentrations dans le sang chez les nourrissons nourris au sein n'ont pas été évaluées. Les informations sur les effets de sulpiride chez les nouveau-nés / nourrissons sont insuffisantes.
Il faut décider d'interrompre l'allaitement ou de ne pas prendre de sulpiride en tenant compte du bénéfice de l'allaitement pour l'enfant et du bénéfice du traitement pour la femme.
Fertilité
Une diminution de la fertilité liée aux effets pharmacologiques du médicament (effet dépendant de la prolactine) a été observée chez les animaux traités.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines 
Affections hématologiques et du système lymphatique (voir rubrique 4.4)
Peu fréquent : leucopénie.
Fréquence indéterminée : neutropénie et agranulocytose.
Affections du système immunitaire
Fréquence indéterminée : réaction anaphylactique : urticaire, choc anaphylactique.
Affections endocriniennes
Fréquent : hyperprolactinémie.
Affections du métabolisme et de la nutrition
Fréquence indéterminée : hyponatrémie, syndrome de sécrétion inappropriée de l’hormone antidiurétique.
Affections psychiatriques
Fréquent : insomnie.
Fréquence indéterminée : confusion.
Affections du système nerveux
Fréquent :
· sédation ou somnolence,
· syndrome extrapyramidal cédant partiellement aux antiparkinsoniens anticholinergiques,
· parkinsonisme,
· tremblements,
· akathisie.
Peu fréquent : hypertonie, dyskinésie, dystonie.
Rare : crises oculogyres.
Fréquence indéterminée :
· syndrome malin des neuroleptiques potentiellement fatal (voir rubrique 4.4),
· hypokinésie,
· des dyskinésies tardives ont été observées comme avec tous les neuroleptiques au cours de cures prolongées : les antiparkinsoniens anticholinergiques sont sans action ou peuvent provoquer une aggravation,
· convulsions (voir rubrique 4.4).
Affections cardiaques
Rare : arythmies ventriculaires telles que torsades de pointe, tachycardie ventriculaire, pouvant entraîner une fibrillation ventriculaire ou un arrêt cardiaque.
Fréquence indéterminée : allongement de l'intervalle QT, mort subite (voir rubrique 4.4).
Affections vasculaires
Peu fréquent : hypotension orthostatique ;
Fréquence indéterminée : embolies veineuses, embolies pulmonaires, thromboses veineuses profondes (voir rubrique 4.4), augmentation de la pression artérielle (voir rubrique 4.4).
Troubles respiratoires, thoraciques et médiastinaux
Fréquence indéterminée : pneumonie d’inhalation (principalement en association avec d’autres médicaments dépresseurs du SNC).
Affections gastro-intestinales
Fréquent : constipation.
Peu fréquent : hyper-sécrétion salivaire.
Affections hépatobiliaires :
Fréquent : augmentation des enzymes hépatiques.
Fréquence indéterminée : atteintes hépatocellulaires, cholestatiques ou mixtes.
Affections musculosquelettiques et du tissu conjonctif
Fréquence indéterminée : rhabdomyolyse.
Affections de la peau ou du tissu sous-cutané
Fréquent : éruption maculo-papuleuse.
Affections gravidiques, puerpérales et périnatales
Fréquence indéterminée : syndrome de sevrage néonatal (voir rubrique 4.6).
Affections des organes de reproduction et du sein
Fréquent : galactorrhée.
Peu fréquent : aménorrhée, impuissance ou frigidité.
Fréquence indéterminée : gynécomastie.
Troubles généraux et anomalies au site d’administration
Fréquent : prise de poids.
Fréquence indéterminée : hyperthermie (voir rubrique 4.4).
Investigations
Fréquence indéterminée : augmentation du taux de la créatine phosphokinase dans le sang.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/.
L'expérience avec le sulpiride en cas de surdosage est limitée. Des dyskinésies avec torticolis spasmodique, protrusion de la langue et trismus peuvent apparaître. Certains patients peuvent développer un syndrome parkinsonien pouvant mettre en jeu le pronostic vital, voire un coma.
Des cas d’issue fatale ont été rapportés principalement en cas d’association avec d’autres substances psychotropes.
Le sulpiride est partiellement éliminé par hémodialyse.
Il n'existe pas d'antidote spécifique au sulpiride.
Traitement symptomatique, réanimation sous étroite surveillance respiratoire et cardiaque continue (risque d'allongement de l'intervalle QT et d'arythmie ventriculaire) qui sera poursuivie jusqu'à rétablissement du patient.
Si un syndrome extrapyramidal sévère apparaît, administrer un anticholinergique.
5. PROPRIETES PHARMACOLOGIQUES 
5.1. Propriétés pharmacodynamiques 
Classe pharmacothérapeutique : ANTIPSYCHOTIQUE NEUROLEPTIQUE BENZAMIDE, code ATC : N05AL01.
Le sulpiride interfère dans les transmissions nerveuses dopaminergiques cérébrales et exerce, aux faibles posologies, une action activante simulant un effet dopaminomimétique. Aux doses plus élevées, le sulpiride a également une action antiproductive.
5.2. Propriétés pharmacocinétiques 
Absorption
Administré par voie orale, de sulpiride est obtenu en 4,5 heures ; il est de 0,28 mg/l après une prise de 50 mg de solution buvable.
La biodisponibilité des formes orales est de 25 à 35 %, avec une forte variabilité inter-individuelle.
La cinétique du sulpiride reste linéaire après administration à des doses variant de 50 à 300 mg.
Distribution
Le sulpiride diffuse rapidement dans les tissus : le volume apparent de distribution à l'équilibre est de 0,94 l/kg.
Le taux de fixation protéique est d'environ 40 %.
Le sulpiride diffuse faiblement dans le lait maternel et passe la barrière placentaire.
Biotransformation
Le sulpiride est faiblement métabolisé chez l'homme.
Elimination
L'excrétion du sulpiride est essentiellement rénale, par filtration glomérulaire. La clairance totale est de 126 ml/mn. La demi-vie d'élimination plasmatique est de 7 heures.
5.3. Données de sécurité préclinique 
3 ans
6.4. Précautions particulières de conservation 
A conserver à une température ne dépassant pas 25 °C.
6.5. Nature et contenu de l'emballage extérieur 
200 ml en flacon (verre brun) avec godet (polypropylène).
6.6. Précautions particulières d’élimination et de manipulation 
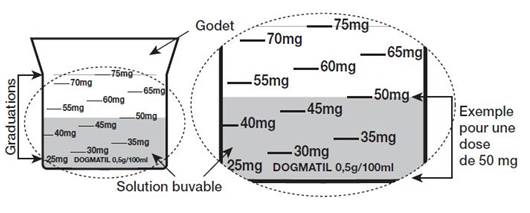
Ce médicament s’administre par voie orale uniquement à l’aide du godet fourni avec le flacon dans la boîte.
La mention « DOGMATIL 0,5 g/100 ml » est apposée sur le bas du godet.
Le godet est transparent et gradué de 25 mg à 75 mg, tous les 5 mg. Les graduations sont visibles sur son pourtour.
1 ml de solution correspond à 5 mg de sulpiride base.
Ouvrir le flacon de DOGMATIL 0,5 g/100 ml SANS SUCRE.
La dose à administrer pour une prise est obtenue en versant dans le godet la quantité de solution buvable requise jusqu’à atteindre la graduation de la dose prescrite.
Par exemple : pour obtenir une dose à administrer de 50 mg, verser le contenu du flacon dans le godet jusqu’à la graduation 50 mg.
Après utilisation, refermer le flacon, bien rincer le godet avec de l'eau et le sécher. Puis ranger immédiatement le godet dans la boîte dans un endroit inaccessible aux enfants. Ne jamais séparer le godet des autres éléments de conditionnement du médicament (flacon, notice, boîte). L’usage du godet est exclusivement réservé à l’administration de DOGMATIL 0,5 g/100 ml SANS SUCRE.
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE 
44 RUE CAMBRONNE
75015 PARIS
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE 
· 34009 303 290 5 4 : 200 ml en flacon (verre brun) avec godet (polypropylène).
· 34009 550 314 8 2 : 200 ml en flacon (verre brun) avec godet (polypropylène).
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION 
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE 
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES 
Liste I
|
| Plan du site | Accessibilité | Contact | Téléchargement | Declaration de confidentialité | Service-Public.fr | Legifrance | Gouvernement.fr |