Dernière mise à jour le 02/02/2026
GRAZAX 75 000 SQ-T, lyophilisat sublingual
Indications thérapeutiques
Classe pharmacothérapeutique - code ATC : extrait allergénique, pollen de graminée - V01AA02.
GRAZAX contient un extrait allergénique de pollen de graminée de phléole des prés (Phleum pratense). GRAZAX est utilisé chez l’adulte et l’enfant (à partir de 5 ans) pour le traitement de la rhinite et de la conjonctivite allergiques provoquées par les pollens de graminées. Ce traitement modifie l’évolution de l’allergie en améliorant votre tolérance immunitaire envers les pollens de graminées.
Chez l’enfant, l’indication du traitement doit être posée par un médecin expérimenté dans le traitement des maladies allergiques de l’enfant.
Lors de l’examen médical, le médecin évaluera vos symptômes allergiques et réalisera un test cutané (prick test) ou un prélèvement sanguin afin de confirmer le bien fondé d’un traitement par GRAZAX.
Il est recommandé de prendre le premier lyophilisat sublingual sous surveillance médicale. Votre médecin pourra ainsi évaluer avec vous votre tolérance au traitement et la survenue éventuelle d’effets secondaires.
GRAZAX doit être prescrit par des médecins expérimentés dans le traitement des allergies.
Présentations
> 3 plaquette(s) aluminium de 10 lyophilisat(s)
Code CIP : 378 011-6 ou 34009 378 011 6 4
Déclaration de commercialisation : 03/01/2011
Cette présentation est agréée aux collectivités
- Prix hors honoraire de dispensation : 59,33 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 60,35 €
- Taux de remboursement :15%
Documents de bon usage du médicament
- Quelle place pour Grazax® (allergène standardisé de fléole des prés par voie orale) dans les rhinites et conjonctivites allergiques aux graminées?
Auteur : Haute autorité de santé
Type : Fiche Bon Usage du Médicament
Date de mise à jour :Février 2013
Service médical rendu (SMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Faible | Avis du 20/01/2016 | Renouvellement d'inscription (CT) | Le service médical rendu par GRAZAX reste faible dans l’indication de l’AMM. |
Amélioration du service médical rendu (ASMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprés de la HAS (plus d'informations dans l'aide). Les avis et synthéses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur de l'ASMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| IV (Mineur) | Avis du 16/02/2011 | Réévaluation SMR | La Commission considère que GRAZAX apporte une amélioration du service médical rendu mineure (ASMR IV) dans la prise en charge de la rhinite et de la conjonctivite allergiques, déclenchées par les pollens de graminées, chez des patients ayant une allergie exclusivement liée aux pollens de graminées et ayant une réponse insuffisante aux traitements symptomatiques, à savoir antihistaminiques et/ou corticoïdes, quelle que soit leur forme d'administration. |
| IV (Mineur) | Avis du 21/07/2010 | Extension d'indication | La Commission de la Transparence a pris en compte la faible quantité d'effet de GRAZAX démontrée sur le traitement des rhinites et conjonctivites déclenchées par les pollens de graminées. Les APSI, utilisés dans ce traitement, n'étant pas des spécialités pharmaceutiques, n'ont fait l'objet ni d'une évaluation, ni d'une AMM. Il n'y a donc pas de donnée comparative ou d'évaluation de l'efficacité des APSI. En conséquence, la Commission considère que GRAZAX apporte une amélioration du service médical rendu mineure (ASMR IV) dans la prise en charge de la rhinite et de la conjonctivite allergiques, déclenchées par les pollens de graminées, chez les enfants à partir de 5 ans ayant une allergie exclusivement liée aux pollens de graminées et une réponse insuffisante aux traitements symptomatiques, à savoir antihistaminiques et/ou corticoïdes, quelle que soit leur forme d'administration. |
| IV (Mineur) | Avis du 22/07/2009 | Réévaluation ASMR | La Commission considère que GRAZAX apporte une amélioration du service médical rendu mineure (ASMR IV) dans la prise en charge de la rhinite et de la conjonctivite allergiques, déclenchées par les pollens de graminées, chez des patients n'ayant pas d'allergie liée à des allergènes multiples et ayant une réponse insuffisante aux traitements symptomatiques, à savoir antihistaminiques et/ou corticoïdes, quelle que soit leur forme d'administration. |
| V (Inexistant) | Avis du 07/11/2007 | Inscription (CT) | Au regard de la quantité d'effet observée dans l'étude présentée et en l'absence de données comparatives fiables, la Commission de la Transparence considère que GRAZAX n'apporte pas d'amélioration du service médical rendu (ASMR V) dans la stratégie thérapeutique actuelle de prise en charge. |
ANSM - Mis à jour le : 28/01/2026
GRAZAX 75 000 SQ-T, lyophilisat sublingual
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Extrait allergénique standardisé de pollen de graminée de phléole des prés (Phleum pratense) 75 000 SQ-T* par lyophilisat sublingual.
*Comprimé à unités de qualité standardisée (SQ-T).
La teneur en allergène majeur Phl p 5 est déterminée à 6 microgrammes par lyophilisat sublingual, en moyenne, selon la méthode Ph.Eur. L’efficacité clinique et la tolérance des produits d’immunothérapie allergénique (ITA) dépendent également d’autres facteurs tels que le procédé de fabrication, la formulation, la composition du produit et son administration.
Pour la liste complète des excipients, voir rubrique 6.1.
Lyophilisat sublingual rond blanc à blanc cassé avec image imprimée en creux sur un côté.
4.1. Indications thérapeutiques
4.2. Posologie et mode d'administration
La posologie recommandée chez l'adulte et l’enfant (à partir de 5 ans) est d’un lyophilisat sublingual (75 000 SQ-T) par jour.
Le traitement par GRAZAX doit être initié uniquement par des médecins expérimentés dans le traitement des pathologies allergiques et en mesure de traiter les réactions allergiques.
Patients âgés
Aucune donnée clinique relative à une immunothérapie par GRAZAX n’est disponible chez le sujet âgé (de plus de 65 ans).
Population pédiatrique
Le traitement chez l’enfant devra être conduit par un médecin expérimenté dans le traitement des maladies allergiques chez l’enfant.
Aucune donnée clinique relative à une immunothérapie par GRAZAX n’est disponible chez l’enfant de moins de 5 ans.
Mode d’administration
La première prise de lyophilisat sublingual devra être réalisée sous surveillance médicale pendant environ 20 à 30 minutes afin d’évaluer et traiter les éventuels effets indésirables d’apparition immédiate.
Pour obtenir l'effet recherché dans le traitement de la rhinite et de la conjonctivite allergiques aux pollens de graminées, au cours de la saison des pollens de graminées, il est recommandé de débuter le traitement au moins 4 mois avant la date prévue du début de la saison des pollens de graminées et de le poursuivre toute la saison. Si le traitement n’est débuté que 2 à 3 mois avant cette saison, il est néanmoins possible d’observer une certaine efficacité. S’il n’est pas observé d’amélioration significative des symptômes pendant la première saison des pollens, la poursuite du traitement n’est pas justifiée.
Pour observer une efficacité sur le long terme et une modification de l’évolution de la maladie allergique, il est recommandé de poursuivre le traitement quotidien pendant 3 années consécutives.
GRAZAX est un lyophilisat sublingual. Le comprimé de lyophilisat sublingual doit être libéré de la plaquette avec des doigts secs et déposé immédiatement sous la langue où il se dissout instantanément.
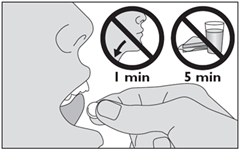
Ne pas déglutir pendant au moins 1 minute. Ne pas absorber d'aliment ni de boisson dans les 5 minutes qui suivent la prise du médicament.
Le lyophilisat sublingual doit être administré immédiatement après l'ouverture de la plaquette.
· Hypersensibilité à l'un des excipients mentionnés à la rubrique 6.1.
· Affections malignes ou maladies systémiques affectant le système immunitaire telles que maladies auto-immunes, maladies à complexes immuns ou déficits immunitaires.
· Etats inflammatoires de la cavité buccale associés à des symptômes sévères tels que lichen plan buccal avec ulcérations ou mycose buccale sévère.
· Asthme non contrôlé ou sévère (défini chez l'adulte par un VEMS < 70 % de la valeur théorique après traitement médicamenteux adapté, chez l’enfant par un VEMS < 80 % de la valeur théorique après traitement médicamenteux adapté).
4.4. Mises en garde spéciales et précautions d'emploi
Réactions allergiques systémiques sévères
Des cas de réactions anaphylactiques graves ont été rapportés depuis la commercialisation soulignant l’importance de débuter le traitement sous surveillance médicale. Dans certains cas, la réaction anaphylactique grave s’est produite à des prises ultérieures à la première prise.
Les réactions systémiques pouvant survenir incluent : flushs (bouffées vasomotrices), prurit intense de la paume des mains, de la plante des pieds et des autres régions du corps (de type urticarien). Une sensation de chaleur, de malaise général, une agitation/anxiété peuvent également apparaître. En cas d’apparition de réactions systémiques sévères, d'angio-œdème, de trouble de la déglutition, de dyspnée, de modification de la voix, d’hypotension ou de gêne laryngée, un médecin devra être immédiatement contacté. Le traitement par GRAZAX devra alors être interrompu définitivement ou jusqu'à avis contraire du médecin. En cas d’association à un asthme, l’apparition de symptômes ou de signes révélant une aggravation de l'asthme doit conduire à l’interruption du traitement et à la consultation immédiate du médecin qui réévaluera la conduite à tenir et le bien-fondé ou non de la poursuite du traitement.
Chez les patients ayant déjà présenté une réaction systémique au cours d’une immunothérapie aux graminées par voie sous-cutanée, le risque de réaction sévère avec GRAZAX peut être plus important. Le traitement par GRAZAX sera initié avec précaution et en ayant notamment à disposition les traitements nécessaires en cas de survenue de réactions indésirables.
L’utilisation d’adrénaline peut être nécessaire pour traiter des réactions anaphylactiques graves. Dans le rare cas d’une réaction allergique systémique sévère, il faut tenir compte de la capacité du patient à tolérer l’injection d’adrénaline (par exemple, en cas de traitement concomitant avec des anti-dépresseurs tricycliques, des inhibiteurs de la monoamine oxydase (IMAO), des inhibiteurs de la catéchol-O-méthyltransférase (COMT) et/ou des bêta-bloquants).
Les patients présentant une cardiopathie peuvent être exposés à un risque plus important en cas de réactions allergiques systémiques sévères. L’expérience clinique du traitement par GRAZAX chez les patients présentant une cardiopathie est limitée.
Réactions allergiques locales
Un traitement par GRAZAX expose le patient aux allergènes auxquels il est allergique. De ce fait, la survenue de réactions allergiques locales, en général légères à modérées, sont attendues au cours du traitement. Si le patient présente des réactions indésirables locales significatives induites par le traitement, le recours à un médicament symptomatique de l’allergie (exemple : anti-histaminique) doit être envisagé.
Affections buccales
En cas de chirurgie bucco-dentaire, y compris l’extraction dentaire ou de perte des dents de lait chez l’enfant, le traitement par GRAZAX doit être interrompu pendant au moins 7 jours afin de permettre la cicatrisation de la cavité buccale.
Asthme
L’asthme est un facteur de risque connu dans la survenue de réactions allergiques systémiques sévères.
GRAZAX n’a pas été étudié chez les patients présentant un asthme sévère non contrôlé.
Les patients asthmatiques doivent être informés de la nécessité de consulter immédiatement un médecin en cas d’aggravation soudaine de leur asthme.
Chez les patients asthmatiques présentant une infection aiguë du tractus respiratoire, l’initiation du traitement par GRAZAX doit être différée jusqu’à la guérison de l’infection.
Œsophagite à éosinophiles
Des cas isolés d'œsophagite à éosinophiles ont été rapportés avec GRAZAX depuis la commercialisation. Chez les patients présentant des symptômes gastro-œsophagiens sévères ou persistants, tels que dysphagie ou dyspepsie, l'arrêt du traitement par GRAZAX doit être envisagé.
Vaccination simultanée
Il n’y a pas d’expérience clinique concernant la vaccination pendant un traitement par GRAZAX. La vaccination pourra être envisagée sans interrompre le traitement par GRAZAX seulement après un examen médical évaluant l'état général du patient.
Allergie alimentaire
GRAZAX contient de la gélatine dérivée de poisson. Les données disponibles n'ont pas mis en évidence de risque accru de réactions allergiques chez les patients souffrant d'une allergie sévère au poisson. Toutefois, il convient de garder en mémoire cette information lorsqu'un traitement par GRAZAX est initié chez des patients allergiques au poisson.
Ce médicament contient moins de 1 mmol (23 mg) de sodium par lyophilisat sublingual, c’est-à-dire qu’il est essentiellement « sans sodium ».
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Aucune étude d’interaction n’a été réalisée chez l’homme.
L’administration concomitante de médicaments symptomatiques de l’allergie (par exemple anti-histaminiques, corticostéroïdes et agents inhibant la dégranulation des mastocytes) peut augmenter la tolérance clinique de l'immunothérapie.
Les données disponibles sur les risques éventuels d'une immunothérapie simultanée avec d'autres allergènes pendant le traitement par GRAZAX sont limitées.
4.6. Fertilité, grossesse et allaitement
Grossesse
Allaitement
Aucune donnée clinique n’est disponible concernant l’utilisation de GRAZAX au cours de l’allaitement. Il n’est pas attendu d’effets spécifiques chez les enfants allaités.
Fertilité
Aucune donnée clinique relative à l’effet de GRAZAX sur la fertilité n’est disponible. Chez la souris, il n’y a eu aucun effet sur l’accouplement ou la fertilité avec le traitement par GRAZAX (voir rubrique 5.3)
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Le traitement par GRAZAX n’a aucun effet ou un effet négligeable sur l’aptitude à conduire des véhicules et à utiliser des machines.
Résumé du profil de tolérance
Les effets indésirables attendus au cours du traitement par GRAZAX sont des réactions allergiques locales légères à modérées, survenant lors des premiers jours de traitement et tendant à disparaître spontanément entre 1 à 7 jours. Les effets indésirables les plus fréquemment rapportés sont un prurit oral, une irritation de la gorge et un œdème de la bouche. Dans la majorité des cas, les réactions apparaissent dans les 5 minutes suivant la prise quotidienne de GRAZAX et diminuent au bout de quelques minutes ou quelques heures. Des réactions allergiques locales plus sévères ou des réactions allergiques systémiques peuvent apparaître (voir rubrique 4.4).
Tableau des effets indésirables
Le tableau 1, listant les effets indésirables, est établi à partir des données issues d'essais cliniques contrôlés versus placebo réalisés chez des adultes et des enfants atteints de rhinoconjonctivite saisonnière au pollen de graminées, certains d’entre eux présentant également un asthme léger à modéré et à partir de déclarations spontanées.
Les réactions indésirables sont regroupées selon leur fréquence de survenue et conformément à la classification MedDRA : très fréquent (≥ 1/10), fréquent (≥ 1/100 à < 1/10), peu fréquent (≥ 1/1 000 à < 1/100), rare (≥ 1/10 000 à < 1/1 000), très rare (< 1/10 000).
Tableau 1 - Effets indésirables
|
Classes organiques |
Fréquence |
Effets indésirables |
|
Affections du système immunitaire |
Peu fréquent |
Réaction anaphylactique, réaction allergique systémique |
|
Affections du système nerveux |
Peu fréquent |
Dysgueusie, paresthésie |
|
Affections oculaires |
Fréquent |
Prurit oculaire, conjonctivite, gonflement oculaire |
|
Peu fréquent |
Hyperémie oculaire, irritation oculaire, augmentation du larmoiement |
|
|
Affections de l’oreille et du labyrinthe |
Très fréquent |
Prurit auriculaire |
|
Peu fréquent |
Gêne auriculaire, douleur auriculaire |
|
|
Rare |
Gonflement auriculaire |
|
|
Affections cardiaques |
Peu fréquent |
Palpitations |
|
Affections respiratoires, thoraciques et médiastinales |
Très fréquent |
Irritation de la gorge |
|
Fréquent |
Eternuements, toux, sécheresse de la gorge, dyspnée, douleur oropharyngée, œdème pharyngé, rhinorrhée, sensation de constriction pharyngée, prurit nasal |
|
|
Peu fréquent |
Hypoesthésie pharyngée, hypertrophie des amygdales, œdème laryngé, dysphonie, érythème pharyngé |
|
|
Rare |
Bronchospasme |
|
|
Affections gastro-intestinales |
Très fréquent |
Prurit buccal, œdème buccal |
|
Fréquent |
Gonflement des lèvres, gêne au niveau buccal, paresthésie buccale, stomatite, dysphagie, douleur abdominale, diarrhées, dyspepsie, nausées, vomissements, érythème de la muqueuse buccale, ulcération buccale, douleur buccale, prurit labial |
|
|
Peu fréquent |
Sécheresse buccale, vésicules labiales, chéilite, odynophagie, hypertrophie des glandes salivaires, hypersialorrhée, inconfort au niveau de la langue, glossite, gastrite, reflux gastro-œsophagien, gêne abdominale, ulcération labiale, vésicules de la muqueuse buccale |
|
|
Rare |
Œsophagite à éosinophiles |
|
|
Affections de la peau et du tissu sous-cutané |
Fréquent |
Prurit, urticaire, rash |
|
Peu fréquent |
Angio-œdème, érythème |
|
|
Troubles généraux et anomalies au site d’administration |
Fréquent |
Fatigue, gêne thoracique |
|
Peu fréquent |
Sensation de corps étranger |
Description d’une sélection de réactions indésirables
Si le patient présente des effets indésirables significatifs liés au traitement, le recours à un médicament symptomatique de l’allergie doit être envisagé.
Des cas de réactions anaphylactiques graves, incluant le choc anaphylactique, ont été rapportés depuis la commercialisation. Il est donc important de débuter le traitement sous surveillance médicale. Dans certains cas, la réaction anaphylactique grave s’est produite à des prises ultérieures à la première prise (voir rubriques 4.2 et 4.4).
En cas de réactions systémiques sévères, d'angio-œdème, de trouble de la déglutition, de dyspnée, de modification de la voix, d’hypotension ou de gêne laryngée, un médecin devra être immédiatement contacté. Le traitement doit être interrompu définitivement ou jusqu'à avis contraire du médecin.
Population pédiatrique
Les effets indésirables observés chez la population pédiatrique traitée par GRAZAX ont été similaires à ceux observés chez les adultes. La majorité des effets ont été observés à une fréquence similaire à celle observée chez les adultes.
Les effets indésirables suivants ont été rapportés plus fréquemment dans la population pédiatrique que dans la population générale (tableau 1) :
· irritation oculaire, douleur auriculaire, érythème pharyngé et vésicules de la muqueuse buccale (fréquent)
· gonflement auriculaire (peu fréquent).
Les effets étaient principalement de sévérité légère à modérée.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr.
Dans des études de phase I, les adultes allergiques aux pollens de graminées ont été exposés à des doses allant jusqu'à 1 000 000 SQ-T. Chez l’enfant, il n’y a pas de donnée relative à une exposition à des doses supérieures à la dose journalière recommandée de 75 000 SQ-T.
Si des doses supérieures à la dose quotidienne recommandée sont absorbées, le risque d'effets secondaires peut augmenter, avec possibilité de réactions allergiques systémiques ou de réactions allergiques locales sévères. En cas de réactions systémiques sévères, d’angio-œdème, de trouble de la déglutition, de dyspnée, de modification de la voix ou de gêne laryngée, un médecin devra être immédiatement contacté. Ces réactions devront être traitées par un médicament anti-allergique adapté. Le traitement par GRAZAX devra être interrompu définitivement ou jusqu'à avis contraire du médecin.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : extrait allergénique, pollen de graminée, code ATC : V01AA02.
Mécanisme d’action
GRAZAX est un traitement d’immunothérapie allergénique. L’immunothérapie allergénique consiste en l’administration répétée d’allergènes à un individu allergique dans le but de modifier la réponse immunitaire à l’allergène, permettant ainsi une diminution durable des symptômes, un moindre recours aux médicaments symptomatiques et une amélioration de la qualité de vie en cas d’exposition à l’allergène dans la vie courante.
GRAZAX est un traitement modificateur de la maladie chez les patients présentant des symptômes cliniquement significatifs de rhinite et/ou de conjonctivite allergiques aux pollens de graminées. La modification de l’évolution de la rhino-conjonctivite chez les adultes et les enfants est démontrée par l’observation d’un effet rémanent 2 ans après 3 années de traitement par GRAZAX.
L’activité pharmacodynamique a pour cible le système immunitaire. L'objectif du traitement est d’induire une réponse immunitaire contre l'allergène qui est administré au patient. Le mécanisme d'action complet et exact à l’origine de l'effet clinique de l'immunothérapie spécifique n'est pas totalement compris ni documenté. Il a été montré que le traitement par GRAZAX induit la production d’anticorps bloquants dirigés contre les allergènes de graminées. Il induit également une augmentation des IgG4 spécifiques sur une période d’observation de 3 ans de traitement. Deux ans après la fin du traitement par GRAZAX, l’augmentation des IgG4 spécifiques était toujours présente. La signification clinique de ces résultats n'a pas été établie.
Efficacité clinique et tolérance chez l’adulte
L'efficacité de GRAZAX sur la rhino-conjonctivite en une prise quotidienne a été évaluée dans une étude multinationale randomisée, en double-aveugle, contrôlée contre placebo (GT-08), incluant 634 patients adultes souffrant de rhino-conjonctivite induite par les pollens de graminées. 72 % des patients présentaient une réponse positive au test cutané à un ou plusieurs allergènes autres que les pollens de graminées. L'efficacité a été évaluée sur le score quotidien moyen des symptômes de rhino-conjonctivite et le score médicamenteux mesurés sur une saison de pollens de graminées. Le traitement était débuté au moins 16 semaines avant le début prévu de la première saison des pollens de graminées et était poursuivi toute l’année.
Le traitement quotidien par GRAZAX administré pendant 3 ans chez l’adulte a entraîné une modification de la pathologie se traduisant par un effet rémanent à l’arrêt du traitement (effet démontré 1 et 2 ans après l’arrêt du traitement). L’effet a varié au cours des cinq saisons successives avec un pic lors de la deuxième saison et une tendance apparente vers une diminution progressive de l’effet de la troisième à la cinquième saison pollinique (3ème saison de traitement suivie de 2 saisons sans traitement). La variabilité de l’effet du traitement est corrélée à la variabilité de l’exposition pollinique. Cependant, la diminution de l’exposition pollinique ne peut expliquer à elle seule la tendance vers une diminution progressive de l’effet du traitement observée au cours des saisons 3 à 5.
L'efficacité et la sécurité du GRAZAX n'ont pas été établies chez les patients dont les symptômes allergiques pendant la saison pollinique sont dus à d'autres allergènes que les pollens de graminées.
Les résultats après 3 ans de traitement quotidien par GRAZAX (3 premières années) et 2 ans de suivi après arrêt du traitement (années 4 à 5) chez l’adulte sont présentés dans le tableau 2 et le tableau 3.
Tableau 2 - Critères primaires d’efficacité chez l’adulte - Années 1 à 5
|
Traitement |
Traitement |
Traitement |
Suivi |
Suivi |
|
|
Année 1 |
Année 2 |
Année 3 |
Année 4 |
Année 5 |
|
Nombre de patients inclus dans l’analyse A |
|
|
|
|
|
|
GRAZAX |
282 |
172 |
160 |
142 |
137 |
|
Placebo |
286 |
144 |
127 |
115 |
104 |
|
Score des symptômes de rhino-conjonctiviteB |
|||||
|
GRAZAX : moyenne (médiane) |
2,85 (2,6) |
2,40 (1,94) |
2,56 (2,04) |
2,68 (2,27) |
2,56 (2,18) |
|
Placebo : moyenne (médiane) |
4,14 (3,8) |
3,76 (3,45) |
3,59 (3,23) |
3,63 (3,27) |
3,40 (3,15) |
|
Différence des moyennes |
|
|
|
|
|
|
Valeur absolue |
1,29 |
1,36 |
1,04 |
0,95 |
0,84 |
|
[IC 95%] |
[0,90 ; 1,68] |
[0,86 ; 1,86] |
[0,52 ; 1,56] |
[0,40 ; 1,50] |
[0,28 ; 1,41] |
|
Relative au placebo (%) |
31% |
36% |
29% |
26% |
25% |
|
[IC 95%] |
[22% ; 41%] |
[23% ; 49%] |
[14% ; 43%] |
[11% ; 41%] |
[9% ; 37%] |
|
Valeur de p ANOVA |
< 0,0001 |
< 0,0001 |
0,0001 |
0,0007 |
0,0037 |
|
Différence des médianes |
|
|
|
|
|
|
Valeur absolue |
1,2 |
1,51 |
1,19 |
1,00 |
0,97 |
|
Relative au placebo (%) |
32% |
44% |
37% |
31% |
31% |
|
Score médicamenteux de la rhino-conjonctivite C |
|||||
|
GRAZAX : moyenne (médiane) |
1,65 (1,0) |
1,74 (0,46) |
1,82 (0,82) |
2,32 (1,23) |
2,42 (1,62) |
|
Placebo : moyenne (médiane) |
2,68 (2,2) |
3,19 (1,71) |
3,04 (2,07) |
3,25 (2,58) |
3,04 (2,06) |
|
Différence des moyennes |
|
|
|
|
|
|
Valeur absolue |
1,03 |
1,45 |
1,22 |
0,93 |
0,62 |
|
[IC 95%] |
[0,63 ; 1,44] |
[0,75 ; 2,16] |
[0,52 ; 1,92] |
[0,14 ; 1,72] |
[-0,15 ; 1,38] |
|
Relative au placebo (%) |
39% |
46% |
40% |
29% |
20% |
|
[IC 95%] |
[24% ; 54%] |
[24% ; 68%] |
[17% ; 63%] |
[4% ; 53%] |
[-8% ; 40%] |
|
Valeur de p ANOVA |
< 0,0001 |
< 0,0001 |
0,0007 |
0,0215 |
0,1136 |
|
Différence des médianes |
|
|
|
|
|
|
Valeur absolue |
1,2 |
1,25 |
1,25 |
1,35 |
0,44 |
|
Relative au placebo (%) |
55% |
73% |
60% |
52% |
21% |
|
A L’étude clinique était initialement planifiée sur 1 année. 546 patients des 634 initialement inclus ont poursuivi le traitement jusqu’à la fin de la première année. L’étude a été poursuivie pendant 2 années supplémentaires de traitement et 2 années de suivi. 351 patients ont été inclus dans la période d’extension de l’étude (74 n’ont pas été inclus en raison de fermeture des sites d’investigations). Les 351 patients inclus constituaient un sous-groupe représentatif des 634 patients initiaux. Le nombre de patients inclus dans l’analyse correspond aux patients ayant complété le carnet de suivi au cours des saisons des pollens de graminées. |
|||||
|
B Score des symptômes : score moyen quotidien des symptômes de rhino-conjonctivite pour chaque sujet évalué pendant la saison des pollens de graminées. Les symptômes de rhino-conjonctivite mesurés étaient rhinorrhée, obstruction nasale, éternuements, prurit nasal, sensation de picotements/rougeur/prurit oculaires et larmoiement. Le score des symptômes de rhino-conjonctivite allait de 0 à 18 ; la valeur supérieure correspond à des symptômes durables et très sévères dans toutes les catégories susmentionnées. Dans l’étude, 95% des scores enregistrés étaient inférieurs ou égaux à 9. C Score médicamenteux : score moyen quotidien de traitement médicamenteux de la rhino-conjonctivite pour chaque sujet évalué pendant la saison des pollens de graminées. Les médicaments pouvant être utilisés étaient la loratadine (6 points par comprimé), l’olopatadine en collyre (1,5 points par goutte) (années 2 à 5 seulement), le budésonide en spray nasal (1 point par pulvérisation) et la prednisone 5 mg (1,6 point par comprimé). Le score de traitement médicamenteux de la rhino-conjonctivite allait de 0 à 36 ; la valeur supérieure correspond à un besoin durable de doses élevées des médicaments susmentionnés. Dans l’étude, 95% des scores enregistrés étaient inférieurs ou égaux à 11. |
|||||
Tableau 3 - Critères secondaires d’efficacité chez l’adulte – Années 1 à 5
|
|
GRAZAX |
Placebo |
Diff. absolue |
Diff. |
Valeur de p |
|
|
Moyenne |
Moyenne |
moyenne |
Relative* |
ANOVA |
|
|
(Médiane) |
(Médiane) |
[IC 95%] |
[IC 95%] |
|
|
1ère année de traitement |
|||||
|
Nombre de patients A |
282 |
286 |
|
|
|
|
Score de Qualité de vie B |
1,03 |
1,40 |
0,37 |
26% |
< 0,0001 |
|
(0,9) |
(1,4) |
[0,23 ; 0,50] |
[16% ; 36%] |
|
|
|
Evaluation globale C |
82% |
55% |
27% |
49% |
< 0,0001 |
|
|
|
[20% ; 34%] |
[36% ; 63%] |
|
|
|
Jours satisfaisants D |
45% |
33% |
12% |
38% |
< 0,0001 |
|
(40%) |
(22%) |
[8% ; 17%] |
[23% ; 53%] |
|
|
|
Pourcentage de patients ayant plus de 50% de jours satisfaisants D |
40% |
24% |
16% |
66% |
< 0,0001 |
|
|
|
[8% ; 24%] |
[34% ; 98%] |
|
|
|
2ème année de traitement |
|||||
|
Nombre de patients A |
172 |
144 |
|
|
|
|
Score de Qualité de vie B |
0,85 |
1,26 |
0,41 |
33% |
< 0,0001 |
|
(0,63) |
(1,05) |
[0,23 ; 0,59] |
[18% ; 49%] |
|
|
|
Jours satisfaisants D |
49,6% |
33,4% |
16,2% |
48% |
< 0,0001 |
|
(47,5%) |
(26,5%) |
[9,4% ; 22,9%] |
[28% ; 69%] |
|
|
|
Pourcentage de patients ayant plus de 50% de jours satisfaisants D |
47,1% |
28,5% |
18,6% |
65% |
0,0008 |
|
|
|
[7,5 ; 29,7] |
[26% ; 104%] |
|
|
|
Jours sans symptômes et sans médicaments F |
45,8% |
31,7% |
14,2% |
45% |
< 0,0001 |
|
(42,6%) |
(24,1%) |
[6,0% ; 20,5%] |
[19% ; 65%] |
|
|
|
3ème année de traitement |
|||||
|
Nombre de patients A |
160 |
127 |
|
|
|
|
Score de Qualité de vie B |
0,78 |
1,01 |
0,23 |
23% |
0,0058 |
|
(0,60) |
(0,92) |
[0,07 ; 0,40] |
[7% ; 40%] |
|
|
|
Jours satisfaisants D |
43,0% |
30,4% |
12,6% |
41% |
0,0004 |
|
(41,0%) |
(22,0%) |
[5,6% ; 19,7%] |
[18 % ; 65%] |
|
|
|
Pourcentage de patients ayant plus de 50% de jours satisfaisants DE |
43% |
24% |
19% |
79% |
0,0011# |
|
|
|
(odds ratio¤ 2,4 [1,4 ; 4,0]) |
|
|
|
|
Jours sans symptômes et sans médicaments F |
34,1% |
24,1% |
10,0% |
41,7% |
0,0035 |
|
(26,6%) |
(14,8%) |
[3,3% ; 16,7%] |
[14% ; 69%] |
|
|
|
Suivi, 4ème année |
|||||
|
Nombre de patients A |
142 |
115 |
|
|
|
|
Score de Qualité de vie B |
0,82 |
1,07 |
0,25 |
23% |
0,0041 |
|
(0,64) |
(0,97) |
[0,08 ; 0,41] |
[7% ; 38%] |
|
|
|
Jours satisfaisants D |
50,0% |
38,1% |
11,9% |
31% |
0,0020 |
|
(51,9%) |
(31,6%) |
[4,4% ; 19,4%] |
[12% ; 50%] |
|
|
|
Pourcentage de patients ayant plus de 50% de jours satisfaisants DE |
53,1% |
34,0% |
19,1% |
56% |
0,0031# |
|
|
|
(odds ratio¤ 2,2 [1,3 ; 3,7]) |
|
|
|
|
Jours sans symptômes et sans médicaments F |
35,2% |
27,6% |
7,6% |
27% |
0,0384 |
|
(25,7%) |
(17,2%) |
[0,41% ; 14,8%] |
[1% ; 54%] |
|
|
|
Suivi, 5ème année |
|||||
|
Nombre de patients A |
137 |
104 |
|
|
|
|
Score de Qualité de vie B |
0,69 |
0,85 |
0,16 |
19% |
0,0587 |
|
(0,56) |
(0,85) |
[-0,01 ; 0,33] |
[-2% ; 38%] |
||
|
Jours satisfaisants D |
49,7% |
40,0% |
9,74% |
24% |
0,0203 |
|
(51,1%) |
(32,9%) |
[1,5% ; 17,9%] |
[3% ; 52%] |
||
|
Pourcentage de patients ayant plus de 50% de jours satisfaisants DE |
49,5% |
35,0% |
14,5% |
41% |
0,0280# |
|
(odds ratio¤ 1,8 [1,1 ; 3,1]) |
|||||
|
Jours sans symptômes et sans médicaments F |
33,5% |
28,0% |
5,5% |
20% |
0,1737 |
|
(25,9%) |
(18,2%) |
[-2,4% ; 13,4%] |
[-8% ; 57%] |
||
|
* Différence relative = |différence absolue|/placebo ; ¤ odds ratio pour un excellent contrôle ; # valeur de p pour les odds ratio |
|||||
|
A L’étude clinique était initialement planifiée sur 1 année. 546 patients des 634 initialement inclus ont poursuivi le traitement jusqu’à la fin de la première année. L’étude a été étendue sur 2 années supplémentaires de traitement et 2 années de suivi. A l’inclusion de la période d’extension de l’étude, 351 patients ont été inclus (74 n’ont pas été inclus en raison de fermeture des sites d’investigations). Les 351 patients inclus constituaient un sous-groupe représentatif des 634 patients initiaux. Le nombre de patients inclus dans l’analyse correspond aux patients ayant complété le carnet de suivi au cours des saisons des pollens de graminées. |
|||||
|
B La qualité de vie a été évaluée à l’aide du questionnaire de qualité de vie relatif à la rhino-conjonctivite, comportant 28 questions dans les domaines suivants : diminution de l’activité, troubles du sommeil, symptômes nasaux et oculaires, symptômes non nasaux et non oculaires, troubles émotionnels et pratiques. Un score élevé indique une détérioration de la qualité de vie. Le score du questionnaire de qualité de vie relatif à la rhino-conjonctivite allait de 0 à 6 ; la valeur supérieure correspond à un impact durable et très sévère pour toutes les questions posées. Dans l’étude, 95% des scores enregistrés étaient inférieurs ou égaux à 4. C Evaluation globale : pourcentage de sujets ayant remarqué une amélioration des symptômes de la rhino-conjonctivite au cours de la saison de traitement par rapport à leurs souvenirs des saisons précédentes. D Jours satisfaisants : pourcentage de jours pendant lesquels les sujets n'ont pas pris de médicaments symptomatiques et présentaient un score de symptômes ne dépassant pas 2. E Pour la 3ème année de traitement et les 2 années de suivi : le pourcentage de patients ayant plus de 50% de jours satisfaisants pendant la saison des pollens de graminées concernée a été analysé selon les moyennes des odds ratio. F Jours sans symptômes et sans médicaments : pourcentage de jours pendant lesquels les sujets n’ont pas pris de médicaments symptomatiques et n’ont présenté aucun symptôme. |
|||||
Un effet statistiquement significatif a été démontré sur chacun des symptômes de rhino-conjonctivite évalués (rhinorrhée, obstruction nasale, éternuements, prurit nasal, sensation de picotements/rougeur/prurit oculaires et larmoiement).
Dans un essai où le traitement pré-saisonnier était de plus courte durée, une moindre diminution du score des symptômes et du score médicamenteux était retrouvée. La diminution du score de symptômes était de 16% (p = 0,071) et celle du score médicamenteux était de 28% (p = 0,0047) (analyse complète finale) pour un traitement par GRAZAX débuté environ 2 mois avant le début de la saison des pollens de graminées et poursuivi pendant cette saison.
Population pédiatrique
L’efficacité à court terme de GRAZAX sur la rhino-conjonctivite a été évaluée au cours d’une étude randomisée, en double aveugle, contrôlée contre placebo (GT-12) incluant 238 enfants (5-16 ans) ayant une rhino-conjonctivite induite par les pollens de graminées associée ou non à un asthme. Le traitement était débuté avant la saison des pollens de graminées et était poursuivi pendant toute la saison (tableau 4).
L’efficacité à long terme de GRAZAX a été évaluée dans le cadre d’une étude multinationale randomisée, en double aveugle, contrôlée contre placebo (GT-21) incluant 812 enfants (5-12 ans) présentant une histoire cliniquement pertinente de rhino-conjonctivite allergique aux pollens de graminées et sans histoire clinique d’asthme.
Le traitement quotidien par GRAZAX pendant 3 ans a entraîné un effet rémanent sur les symptômes de la rhino-conjonctivite. Cet effet sur les symptômes de la rhino-conjonctivite a été observé lors des évaluations réalisées tout au long des 5 années d’étude, pendant la période de suivi de 2 ans après la fin du traitement et à la fin de l’étude. Les données relatives à l’efficacité clinique sont présentées dans le tableau 4.
Tableau 4 - Données d’efficacité sur la rhino-conjonctivite chez l’enfant
|
|
GRAZAX
|
Placebo
|
Diff. absolue [IC 95%] |
Diff. relative* (%) [IC 95%] |
Valeur de p
|
|
GT-12 |
|||||
|
Nombre de patients inclus dans l’analyse |
117 |
121 |
|
|
|
|
Critères principaux : |
|
|
|
|
|
|
Score des symptômes de rhino-conjonctivite A |
2,18 |
2,80 |
0,62 |
22 % |
0,0215 |
|
[0,10 ; 1,15] |
[4 % ; 38 %] |
||||
|
Score médicamenteux de la rhino-conjonctivite B |
0,78 |
1,19 |
0,41 |
34 % |
0,0156 |
|
Critères secondaires majeurs : |
|
|
|
|
|
|
Score des symptômes de rhino-conjonctivite A au cours du pic de la saison des pollens de graminées |
2,84 |
3,91 |
1,07 |
27 % |
0,0059 |
|
[0,32 ; 1,81] |
[9 % ; 43 %] |
||||
|
Score médicamenteux de la rhino-conjonctivite B au cours du pic de la saison des pollens de graminées |
0,87 |
2,40 |
1,53 |
64 % |
0,0013 |
|
Jours sans symptômes C |
52 % |
42 % |
9 % |
22 % |
0,0225 |
|
[1 % ; 17 %] |
[3 % ; 45 %] |
||||
|
GT-21 |
|||||
|
Nombre de patients inclus dans l’analyse complète |
398 |
414 |
|
|
|
|
Critère secondaire : Symptômes annuels de rhino-conjonctiviteD durant la saison des pollens de graminées |
|||||
|
Traitement – Année 1 |
19,4 |
25,5 |
6,1 |
24% |
< 0,001 |
|
[2,7 ; 9,4] |
|||||
|
Traitement – Année 2 |
20,3 |
28,8 |
8,4 |
29% |
< 0,001 |
|
[5,0 ; 11,9] |
|||||
|
Traitement – Année 3 |
21,9 |
31,1 |
9,23 |
30% |
< 0,001 |
|
[5,7 ; 12,8] |
|||||
|
Suivi – Année 4 |
23,5 |
30,3 |
6,7 |
22% |
< 0,001 |
|
[3,1 ; 10,3] |
|||||
|
Suivi – Année 5 |
19,6 |
25,5 |
5,8 |
23% |
0,002 |
|
[2,2 ; 9,4] |
|||||
|
Critère secondaire : Symptômes quotidiens de rhino-conjonctiviteE durant la saison des pollens de graminées |
|||||
|
Suivi – Année 5 |
15,2 |
19,5 |
4,4 |
22% |
0,005 |
|
[1,35 ; 7,40] |
|||||
|
Critère secondaire : Score médicamenteux quotidien de la rhino-conjonctivite F durant la saison des pollens de graminées |
|||||
|
Suivi – Année 5 |
4,9 |
6,7 |
1,8 |
27% |
< 0,001 |
|
[0,9 ; 2,7] |
|||||
|
* Différence relative = |différence absolue|/placebo A Score des symptômes : score moyen quotidien des symptômes de rhino-conjonctivite pour chaque sujet évalué pendant la saison des pollens de graminées. Les symptômes de rhino-conjonctivite mesurés étaient rhinorrhée, obstruction nasale, éternuements, prurit nasal, sensation de picotements/rougeur/prurit oculaires et larmoiement. Analyse paramétrique (données transformées par calcul - racine carrée), différence relative des moyennes ajustées après calcul. B Score médicamenteux : score médian quotidien du recours aux médicaments de la rhino-conjonctivite pour chaque sujet évalué pendant la saison des pollens de graminées. Les médicaments utilisés étaient la loratadine en comprimé, la lévocabastine en collyre, le budésonide en spray nasal et la prednisolone en comprimé. Analyse non paramétrique, différence relative des médianes. C Jours sans symptômes : pourcentage de jours pendant lesquels les sujets n'ont pas pris de médicaments symptomatiques et présentaient un score de symptômes ne dépassant pas 2. Analyse paramétrique (données non transformées), différence relative des moyennes ajustées. D Symptômes mesurés par un score EVA annuel : score à la question : « Quelle était l’intensité du rhume des foins au cours de la semaine dernière ? », sur une échelle visuelle analogique de 100 mm allant de « pas de symptômes » à « symptômes sévères », évalué une seule fois. Analyse paramétrique, différence relative des moyennes ajustées. E Symptômes mesurés par un score EVA quotidien : score moyen quotidien à la question « Quelle était l’intensité du rhume des foins aujourd’hui ? », sur une échelle visuelle analogique de 100 mm allant de « pas de symptômes » à « symptômes sévères », pendant une période de 14 jours. Analyse paramétrique (données transformées par calcul - racine carrée), différence relative des moyennes ajustées après calcul. F Score médicamenteux : score moyen quotidien du recours aux médicaments de la rhino-conjonctivite pendant une période de 14 jours. Analyse paramétrique (données transformées par calcul - racine carrée), différence relative des moyennes ajustées après calcul. |
|||||
5.2. Propriétés pharmacocinétiques
5.3. Données de sécurité préclinique
Les études conventionnelles de toxicité systémique menées chez la souris n'ont pas mis en évidence de risque particulier pour l'être humain. Dans des études toxicologiques réalisées chez le chien, la posologie quotidienne pendant 52 semaines a été associée à des lésions de type vascularite/périvascularite chez les mâles mais pas chez les femelles. Le risque de lésions vascularite/périvascularite n'est pas attendu chez l’homme. Dans une étude combinée sur la fertilité et le développement embryo-fœtal chez la souris, les performances d’accouplement et la fertilité n’ont pas été affectées et il n’y a pas eu d’effets néfastes pour le fœtus. Dans une étude de développement pré/post-natal, le développement de la souris était normal.
Mannitol
Hydroxyde de sodium (pour ajustement du pH)
5 ans
6.4. Précautions particulières de conservation
Pas de précautions particulières de conservation.
6.5. Nature et contenu de l'emballage extérieur
Plaquettes (aluminium) avec pellicule amovible (aluminium), dans un emballage extérieur. Chaque plaquette contient 10 lyophilisats sublinguaux.
Boîtes de 10 (1x10), 30 (3x10), 90 (9x10) ou 100 (10x10) lyophilisats sublinguaux.
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
BØGE ALLE 6-8
2970 HØRSHOLM
DANEMARK
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 303 346 5 2 : 10 lyophilisats sublinguaux dans une plaquette (aluminium) avec pellicule amovible (aluminium) ; boîte de 10 lyophilisats.
· 34009 378 011 6 4 : 10 lyophilisats sublinguaux dans une plaquette (aluminium) avec pellicule amovible (aluminium) ; boîte de 30 lyophilisats.
· 34009 381 472 0 9 : 10 lyophilisats sublinguaux dans une plaquette (aluminium) avec pellicule amovible (aluminium) ; boîte de 90 lyophilisats.
· 34009 378 012 2 5 : 10 lyophilisats sublinguaux dans une plaquette (aluminium) avec pellicule amovible (aluminium) ; boîte de 100 lyophilisats.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Liste I
ANSM - Mis à jour le : 28/01/2026
GRAZAX 75 000 SQ-T, lyophilisat sublingual
Extrait allergénique standardisé de pollen de graminée de phléole des prés (Phleum pratense)
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin ou votre pharmacien.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que GRAZAX 75 000 SQ-T, lyophilisat sublingual et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant de prendre GRAZAX 75 000 SQ-T, lyophilisat sublingual ?
3. Comment prendre GRAZAX 75 000 SQ-T, lyophilisat sublingual ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver GRAZAX 75 000 SQ-T, lyophilisat sublingual ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE GRAZAX 75 000 SQ-T, lyophilisat sublingual ET DANS QUELS CAS EST-IL UTILISE ?
Classe pharmacothérapeutique - code ATC : extrait allergénique, pollen de graminée - V01AA02.
GRAZAX contient un extrait allergénique de pollen de graminée de phléole des prés (Phleum pratense). GRAZAX est utilisé chez l’adulte et l’enfant (à partir de 5 ans) pour le traitement de la rhinite et de la conjonctivite allergiques provoquées par les pollens de graminées. Ce traitement modifie l’évolution de l’allergie en améliorant votre tolérance immunitaire envers les pollens de graminées.
Chez l’enfant, l’indication du traitement doit être posée par un médecin expérimenté dans le traitement des maladies allergiques de l’enfant.
Lors de l’examen médical, le médecin évaluera vos symptômes allergiques et réalisera un test cutané (prick test) ou un prélèvement sanguin afin de confirmer le bien fondé d’un traitement par GRAZAX.
Il est recommandé de prendre le premier lyophilisat sublingual sous surveillance médicale. Votre médecin pourra ainsi évaluer avec vous votre tolérance au traitement et la survenue éventuelle d’effets secondaires.
GRAZAX doit être prescrit par des médecins expérimentés dans le traitement des allergies.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT DE PRENDRE GRAZAX 75 000 SQ-T, lyophilisat sublingual ?
Ne prenez jamais GRAZAX 75 000 SQ-T, lyophilisat sublingual :
· si vous êtes allergique à l’un des autres composants contenus dans ce médicament mentionnés dans la rubrique 6,
· si vous souffrez d’une maladie du système immunitaire,
· si vous souffrez d’asthme sévère (à déterminer avec votre médecin),
· si vous êtes atteint d’un cancer,
· si vous présentez des états inflammatoires sévères au niveau de la bouche.
Avertissements et précautions
Adressez-vous à votre médecin avant de prendre GRAZAX 75 000 SQ-T, lyophilisat sublingual :
· si vous avez récemment subi une extraction dentaire ou tout autre acte de chirurgie buccale. Dans ce cas, le traitement par GRAZAX doit être interrompu pendant au moins 7 jours pour permettre la cicatrisation dans la bouche,
· si vous êtes allergique au poisson (ce médicament contient de la gélatine dont la fabrication est dérivée d’extraits de poissons),
· si vous avez déjà eu une réaction allergique à la suite d’une injection par voie sous cutanée d’un extrait allergénique de pollen de graminées,
· si vous êtes asthmatique et souffrez d’une infection aiguë des voies respiratoires supérieures. Dans ce cas, le traitement par GRAZAX doit être temporairement interrompu jusqu’à guérison de l’infection.
Certains effets indésirables peuvent être sévères et nécessiter une prise en charge médicale immédiate. Merci de vous reporter à la rubrique 4 pour les symptômes.
Enfants
En cas de perte d’une dent de lait, le traitement par GRAZAX doit être interrompu pendant au moins 7 jours pour permettre la cicatrisation dans la bouche.
Si vous êtes concernés par l’une des situations ci-dessus, parlez-en à votre médecin avant de prendre GRAZAX.
Aucune donnée concernant l’utilisation de GRAZAX chez le sujet âgé (de plus de 65 ans) n’est disponible.
Autres médicaments et GRAZAX 75 000 SQ-T, lyophilisat sublingual
Informez votre médecin ou pharmacien si vous prenez ou avez récemment pris tout autre médicament, y compris un médicament obtenu sans ordonnance.
Si vous prenez d’autres médicaments pour traiter les symptômes de votre allergie tels que des anti-histaminiques ou des corticostéroïdes, informez-en votre médecin.
GRAZAX 75 000 SQ-T, lyophilisat sublingual avec des aliments et boissons
Ne pas absorber d’aliments ni de boissons dans les 5 minutes suivant la prise de ce médicament.
Grossesse, allaitement et fertilité
A l’heure actuelle, aucune donnée concernant l’utilisation de GRAZAX pendant la grossesse n’est disponible. Le traitement par GRAZAX ne devra pas être débuté pendant la grossesse. Si vous devenez enceinte pendant le traitement, parlez-en à votre médecin pour qu’il évalue s’il est adapté ou non de poursuivre le traitement.
A l’heure actuelle, aucune donnée concernant l’utilisation de GRAZAX pendant l’allaitement n’est disponible. Il n’est cependant pas attendu d’effets chez les enfants allaités.
Conduite de véhicules et utilisation de machines
Vous êtes seul apte à évaluer votre aptitude à conduire des véhicules et à utiliser des machines. Par les effets induits, la prise de médicaments peut interférer sur cette aptitude. Une description des effets de GRAZAX est disponible dans d’autres rubriques de cette notice. Veuillez donc lire la totalité des informations figurant sur cette notice, à titre informatif.
En cas de doute, demandez conseil à votre médecin ou votre pharmacien.
Le traitement par GRAZAX n’a pas d’effet ou a un effet négligeable sur la capacité à conduire un véhicule ou à utiliser des machines.
GRAZAX 75 000 SQ-T, lyophilisat sublingual contient du sodium
3. COMMENT PRENDRE GRAZAX 75 000 SQ-T, lyophilisat sublingual ?
Combien de lyophilisat de GRAZAX devez-vous prendre ?
La posologie recommandée est d’un lyophilisat sublingual par jour.
Comment prendre GRAZAX ?
Afin d’obtenir la meilleure efficacité, il est préférable de commencer à prendre ce médicament au moins 4 mois avant le début présumé de la saison des pollens de graminées. La durée de traitement préconisée avec GRAZAX est de 3 ans.
La première dose de GRAZAX doit être prise au cabinet du médecin :
· Car vous devez rester sous surveillance médicale pendant environ une demi-heure après avoir pris la première dose.
· Ceci est une précaution pour vérifier votre sensibilité au médicament.
· Cela vous donnera également la possibilité de discuter avec votre médecin des éventuels effets indésirables que vous pourriez ressentir.
Continuez à prendre GRAZAX tous les jours même s’il faut un certain temps avant que votre allergie ne s’améliore.
Si vos symptômes allergiques ne s’améliorent pas pendant la première saison des pollens de graminées, consultez votre médecin pour discuter de la poursuite du traitement.
Assurez-vous que vos mains soient sèches avant de prendre ce médicament.
Prenez le lyophilisat sublingual de la façon suivante :
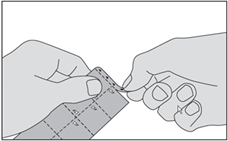
|
1. Détachez la bande marquée de triangles en haut de la plaquette. |
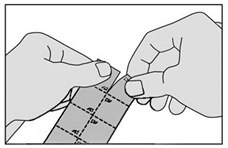
|
2. Détachez un carré de la plaquette le long des lignes en pointillés. |
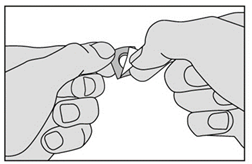
|
3. Retirez la pellicule en la tirant à partir du coin marqué. Ne faites pas sortir le médicament en le poussant au travers de la pellicule car cela pourrait l’endommager. |
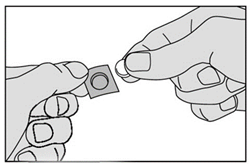
|
4. Retirez délicatement le médicament de la pellicule et placez-le immédiatement sous votre langue. |
|
5. Laissez le médicament sous votre langue jusqu’à ce qu’il soit dissous. · Ne pas avaler pendant 1 minute. · Ne pas manger ni boire pendant au moins 5 minutes après avoir pris le médicament. |
Si vous avez pris plus de GRAZAX 75 000 SQ-T, lyophilisat sublingual que vous n’auriez dû
Si vous avez pris trop de lyophilisats sublinguaux de GRAZAX, vous pouvez ressentir des symptômes allergiques y compris des symptômes locaux au niveau de la bouche et de la gorge. Si les symptômes qui apparaissent sont de forte intensité ou vous paraissent inquiétants, contactez immédiatement un médecin ou un hôpital.
Si vous oubliez de prendre GRAZAX 75 000 SQ-T, lyophilisat sublingual
Si vous avez oublié de prendre un lyophilisat sublingual, prenez-le plus tard dans la journée. Ne prenez pas de dose double pour compenser la dose de lyophilisat sublingual que vous avez oublié de prendre.
Si vous arrêtez de prendre GRAZAX 75 000 SQ-T, lyophilisat sublingual
Si vous ne prenez pas ce médicament selon les prescriptions, l’effet du traitement peut ne pas se faire sentir. Si vous avez d’autres questions sur l’utilisation de ce médicament, demandez plus d’informations à votre médecin ou à votre pharmacien.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Les effets secondaires peuvent être une réponse allergique à l’allergène avec lequel vous êtes traité.
En général, les effets secondaires durent de quelques minutes à plusieurs heures après la prise du lyophilisat sublingual et diminuent en une semaine après le début du traitement.
Effets indésirables graves :
Arrêtez de prendre GRAZAX 75 000 SQ-T, lyophilisat sublingual et contactez immédiatement votre médecin ou un hôpital si vous présentez l’un des symptômes suivants :
· Gonflement rapide du visage, de la bouche ou de la gorge
· Difficultés à avaler
· Difficultés à respirer
· Urticaire
· Modifications de la voix
· Aggravation des symptômes d’asthme existants
· Gêne importante
Si vous ressentez des brûlures d'estomac persistantes, contactez votre médecin.
Autres effets indésirables possibles :
Très fréquents (pouvant concerner plus d’1 personne sur 10) :
· Gonflement de la bouche
· Démangeaison de la bouche ou de l’oreille
· Sensation d’irritation dans la gorge
Fréquents (pouvant concerner jusqu’à 1 personne sur 10) :
· Sensation de fourmillements ou engourdissement de la bouche
· Démangeaison des yeux, des lèvres ou du nez
· Inflammation des yeux ou de la bouche
· Essoufflement, toux ou éternuements
· Sécheresse de la gorge
· Ecoulement nasal
· Gonflement des yeux ou des lèvres
· Aphtes
· Douleur au niveau des vésicules buccales ou inconfort au niveau de la bouche ou de la gorge
· Douleur à l’estomac, diarrhées, nausées, vomissements
· Brûlures d’estomac
· Démangeaison, éruption cutanée ou urticaire
· Fatigue
· Gêne thoracique
· Sensation de gorge serrée
· Rougeur dans la bouche
· Difficultés à avaler
Peu fréquents (pouvant concerner jusqu’à 1 personne sur 100) :
· Sensation de battements cardiaques rapides, intenses ou irréguliers
· Altération du goût
· Rougeur ou irritation des yeux
· Douleur ou inconfort au niveau des oreilles
· Engourdissement dans la gorge, déglutition douloureuse
· Hypertrophie des amygdales
· Réaction allergique grave
· Bouche sèche
· Vésicules au niveau des lèvres, inflammation des lèvres, ulcère des lèvres
· Hypertrophie ou hypersécrétion des glandes salivaires
· Inflammation de l’estomac, régurgitation
· Sensation de corps étranger dans la gorge
· Rougeur de la peau
· Gonflement du visage
· Inflammation de la langue
· Réaction allergique
· Sensation de fourmillements sur la peau
· Gêne au niveau de l’estomac
· Gonflement de la gorge
· Larmoiement
· Enrouement
· Rougeur de la gorge
· Formation de cloques dans la bouche
Rares (pouvant concerner jusqu’à 1 personne sur 1 000) :
· Bronchospasme
· Gonflement des oreilles
Les effets indésirables suivants sont rapportés plus fréquemment chez les enfants que chez les adultes : irritation des yeux, rougeur de la gorge, formation de cloques dans la bouche, douleur des oreilles et gonflement des oreilles.
Si vous présentez des effets secondaires préoccupants, contactez votre médecin qui déterminera les médicaments anti-allergiques dont vous pourriez avoir besoin tels que les anti-histaminiques.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr.
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER GRAZAX 75 000 SQ-T, lyophilisat sublingual ?
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur la plaquette et l’emballage extérieur après EXP. La date de péremption fait référence au dernier jour de ce mois.
Pas de précautions particulières de conservation.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient GRAZAX 75 000 SQ-T, lyophilisat sublingual
· La substance active est : un extrait allergénique de pollen de graminée de phléole des prés (Phleum pratense). L’activité par lyophilisat sublingual est exprimée en unité SQ-T*. L’activité d’un lyophilisat sublingual est de 75 000 SQ-T. La teneur en allergène Phl p 5 est de 6 microgrammes par lyophilisat sublingual.
* Comprimés à unités de qualité standardisée (SQ-T).
· Les autres composants sont : la gélatine (à base de poisson), le mannitol, l’hydroxyde de sodium.
Qu’est-ce que GRAZAX 75 000 SQ-T, lyophilisat sublingual et contenu de l’emballage extérieur
Lyophilisat sublingual rond blanc à blanc cassé avec image imprimée en creux sur un côté.
Plaquettes (aluminium) avec pellicule amovible (aluminium), dans un emballage extérieur. Chaque plaquette contient 10 lyophilisats sublinguaux.
Boîtes de 10 (1x10), 30 (3x10), 90 (9x10) ou 100 (10x10) lyophilisats sublinguaux.
Toutes les présentations peuvent ne pas être commercialisées.
Titulaire de l’autorisation de mise sur le marché
BØGE ALLE 6-8
2970 HØRSHOLM
DANEMARK
Exploitant de l’autorisation de mise sur le marché
ALK
TOUR W
102 TERRASSE BOIELDIEU
92800 PUTEAUX
MIGUEL FLETA 19
28037 MADRID
ESPAGNE
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Ce médicament est autorisé dans les Etats membres de l'Espace Economique Européen sous les noms suivants : Conformément à la réglementation en vigueur.
[à compléter ultérieurement par le titulaire]
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
< {MM/AAAA}>< {mois AAAA}.>
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).