Dernière mise à jour le 01/12/2025
QUINIMAX 250 mg/2 ml, solution injectable
Ce médicament n'est ou ne sera bientôt plus disponible sur le marché.
Si vous prenez actuellement ce médicament, il vous est recommandé d'en parler avec votre médecin
ou avec votre pharmacien qui pourra vous orienter vers un autre traitement.
Indications thérapeutiques
Classe pharmacothérapeutique – Antipaludique, code ATC : P01BC01 - (P : Parasitologie)
Ce médicament est un antipaludique. Il contient de la quinine et des extraits alcaloïdes de quinquina.
Il est préconisé dans le traitement des crises de paludisme grave ou lorsqu'il est impossible d'administrer un traitement par la voie orale.
Le paludisme est une maladie causée par un parasite microscopique (Plasmodium), il est transmis par les piqûres de moustiques et il sévit dans les pays tropicaux. Cette maladie peut être grave. Elle doit être dépistée et traitée rapidement.
La quinine reste active sur des parasites devenus résistants à certains autres médicaments antipaludiques (en particulier dans les régions de chloroquinorésistance).
Composition en substances actives
-
Solution ( Composition pour une ampoule de 2 ml )
- quinine240,000 mg
- sous forme de : gluconate de quinine385,125 mg
- quinine240,000 mg
- quinidine6,600 mg
- sous forme de : gluconate de quinidine10,590 mg
- sous forme de : chlorhydrate de cinchonine2,120 mg
- sous forme de : chlorhydrate de cinchonidine2,015 mg
Présentations
> 3 ampoule(s) en verre jaune(brun) de 2 ml
Code CIP : 342 724-2 ou 34009 342 724 2 4
Déclaration d'arrêt de commercialisation : 31/01/2024
Cette présentation n'est pas agréée aux collectivités
- Prix hors honoraire de dispensation : 97,90 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 98,92 €
- Taux de remboursement :65%
Service médical rendu (SMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Important | Avis du 24/01/2018 | Renouvellement d'inscription (CT) | Le service médical rendu par QUINIMAX reste important dans les indications de l’AMM. |
Amélioration du service médical rendu (ASMR)
Pas d'ASMR disponible pour ce médicament (plus d'informations dans l'aide )
ANSM - Mis à jour le : 05/06/2024
QUINIMAX 250 mg/2 ml, solution injectable
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
gluconate de quinine...................................................................................................... 385,125 mg
(quantité correspondante en QUININE........................................................................... 240,000 mg*)
gluconate de quinidine..................................................................................................... 10,590 mg
(quantité correspondante en QUINIDINE............................................................................ 6,600 mg*)
chlorhydrate de cinchonine................................................................................................. 2,120 mg
(quantité correspondante en CINCHONINE........................................................................ 1,700 mg*)
chlorhydrate de cinchonidine.............................................................................................. 2,015 mg
(Quantité correspondante en CINCHONIDINE.................................................................... 1,700 mg*)
pour une ampoule de 2 ml.
*Soit une quantité totale d’alcaloïdes base de 250 mg.
Pour la liste complète des excipients, voir rubrique 6.1.
4.1. Indications thérapeutiques
· accès pernicieux,
· accès palustre en particulier en cas de résistance aux amino-4-quinoléines avec impossibilité d'utiliser la voie orale.
Il convient de tenir compte des recommandations officielles concernant l’utilisation appropriée des médicaments antipaludiques.
4.2. Posologie et mode d'administration
1 ampoule contient 250 mg d'alcaloïdes base.
Ce dosage n'est pas adapté à l'enfant de moins de 30 kg.
· Voie intraveineuse : 25 mg/kg/jour d'alcaloïdes base répartis en 3 injections de 8 mg/kg d'alcaloïdes base, en perfusion intraveineuse lente de 4 heures chacune à répéter toutes les 8 heures (ou éventuellement en continu à la seringue électrique).
Soit chez l'adulte de 60 kg : 2 ampoules à 250 mg par prise,
Chez l'enfant de 30 à 50 kg (soit environ 10 à 15 ans) : 1 ampoule à 250 mg par prise.
Le produit sera dilué préférentiellement dans une solution glucosée à 5 % ou 10 % ou bien dans un soluté physiologique.
· Voie intramusculaire : 2 à 3 injections lentes et profondes par jour de 8 mg/kg d'alcaloïdes base.
Soit chez l'adulte de 60 kg : 2 ampoules à 250 mg par prise,
Chez l'enfant de 30 à 50 kg (soit environ 10 à 15 ans) : 1 ampoule à 250 mg par prise.
En raison d'un risque de nécrose induit par la quinine, cette voie d'administration doit être limitée aux situations où il est impossible de mettre en place une perfusion intraveineuse.
· Chez l'insuffisant rénal : la posologie sera diminuée de 30 à 50 %.
La durée du traitement d'un accès palustre par la quinine est de 5 à 7 jours.
Le relais par la voie orale sera envisagé dès que possible.
Mode d’administration
Voie intraveineuse.
Voie intramusculaire.
Ce médicament est contre indiqué dans les situations suivantes :
· en dehors du contexte de l'urgence de l'accès grave ou pernicieux, la quinine est contre-indiquée en cas de troubles de la conduction intra-ventriculaire,
· en cas d’antécédent de fièvre bilieuse hémoglobinurique,
· hypersensibilité aux substances actives ou à l’un des excipients mentionnés à la rubrique 6.1,
· en cas d’association avec d’autres antiarythmiques (amiodarone, dronédarone, hydroquinidine, disopyramide, sotalol), cobicistat, ombitasvir + paritaprévir, inhibiteurs de protéases boostés par ritonavir, tétrabénazine et voriconazole, pipéraquine, hydroxyzine, dompéridone, citalopram, escitalopram, spiramycine, érythromycine IV, vincamine IV, vandétanib, torémifène, méquitazine, moxifloxacine.
Ce médicament est généralement déconseillé en association avec la méfloquine (voir rubrique 4.5).
4.4. Mises en garde spéciales et précautions d'emploi
La survenue d'une hémolyse importante sous traitement doit faire évoquer une fièvre bilieuse hémoglobinurique devant conduire à l'arrêt du traitement par la quinine.
Ce médicament est déconseillé avec le crizotinib, l’idélalisib, la rifampicine, la codéine, le tamoxifène, le tramadol, le vérapamil, le fingolimod, l’ozanimod, la délamanid, certains antiparasitaires susceptibles de donner des torsades de pointes (la chloroquine, l’halofantrine, la luméfantrine, la pentamidine), la méthadone, le cotrimoxazole, certains neuroleptiques, les arsénieux, l’hydroxychloroquine (voir rubrique 4.5).
Pendant l'injection, une surveillance de la fréquence cardiaque et de la pression artérielle sont recommandée. La survenue d'une arythmie nécessite le ralentissement de la vitesse de perfusion.
Affections cardiaques
La quinine possède des effets dose-dépendants d’allongement de l’intervalle QT. La prudence est recommandée chez les patients atteints d’affections qui les prédisposent à un allongement de l’intervalle QT et chez les patients présentant un bloc auriculo-ventriculaire. L’allongement de l’intervalle QT peut mener à un risque de torsades de pointes et/ou de tachycardie ventriculaire. Du fait du potentiel allongement de l’intervalle QT, une surveillance par électrocardiogramme (ECG) est recommandée chez les patients présentant une cardiopathie, un syndrome du QT long, des antécédents d’arythmies ventriculaires, une hypokaliémie et/ou une hypomagnésémie, non corrigées, une bradycardie (< 50 bpm) et en cas de traitement concomitant par des médicaments qui allongent l’intervalle QT et/ou susceptibles de donner des torsades de pointes (voir les rubriques 4.5, 4.8 et 4. 9).
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Associations déconseillées (voir rubrique 4.4)
+ Rifampicine
Risque de perte de l’efficacité de la quinine par augmentation de son métabolisme hépatique par l’inducteur.
+ Crizotinib
Risque de majoration de la toxicité de la quinine par diminution de son métabolisme et/ou augmentation de sa biodisponibilité par le crizotinib.
+ Idélalisib
Augmentation des concentrations plasmatiques du substrat par diminution de son métabolisme hépatique par l’idélalisib.
Risque majoré de survenue de crises épileptiques par addition des effets convulsivants.
Respecter un délai minimal de 12 heures entre la fin de l'administration IV de quinine et le début de l'administration de la méfloquine.
Association faisant l’objet d’une précaution d’emploi
Risque de perte de l’efficacité de la quinine par augmentation de son métabolisme hépatique par l’inducteur.
Surveillance clinique et adaptation de la posologie de la quinine pendant le traitement par apalutamide ou enzalutamide, et après son arrêt.
+Médicaments susceptibles d’allonger l’intervalle QT et/ou induisant des torsades de pointes
Le QUINIMAX 250 mg/2 ml, solution injectable doit être utilisé avec prudence chez les patients traités avec des médicaments connus pour allonger l’intervalle QT.
+ Anticonvulsivants inducteurs enzymatiques sauf carbamazépine et phénobarbital (fosphénytoïne, phénytoïne, primidone)
Risque de perte de l’efficacité de la quinine par augmentation de son métabolisme hépatique par l’inducteur.
Surveillance clinique et adaptation de la posologie de la quinine pendant le traitement par l’inducteur et après son arrêt.
+ Carbamazépine, Phénobarbital
La quinine peut augmenter les concentrations en carbamazépine et phénobarbital. Une surveillance étroite est recommandée en cas de traitement concomitant avec la quinine
La quinine inhibe la glycoprotéine P (P-gp) in vitro à des concentrations élevées. Par conséquent, il existe un potentiel d'augmentation des concentrations de substrat de la P-gp lorsque la quinine est administrée de façon concomitante.
La prudence est conseillée (par exemple, par la surveillance des effets indésirables ou des concentrations plasmatiques, selon le cas) lorsque des substrats à index thérapeutique étroit de la P-gp sont administrés de façon concomitante.
Risque d’augmentation des concentrations plasmatiques du dabigatran par augmentation de son absorption intestinale par la quinine.
Surveillance clinique et biologique étroite pendant l’association.
La quinine inhibe la glycoprotéine P (P-gp) in vitro à des concentrations élevées. Par conséquent, il existe un potentiel d'augmentation des concentrations de substrat de la P-gp lorsque la quinine est administrée de façon concomitante.
La prudence est conseillée (par exemple, par la surveillance des effets indésirables ou des concentrations plasmatiques, selon le cas) lorsque des substrats à index thérapeutique étroit de la P-gp sont administrés de façon concomitante.
Augmentation modérée de la digoxinémie.Surveillance clinique et ECG, si besoin, avec adaptation éventuelle des doses de digoxine.
+ Macrolides inhibiteurs puissants du CYP3A4 (clarithromycine, télithromycine, érythromycine administrée par voie orale)
Risque de majoration des effets indésirables de la quinine, notamment troubles du rythme ventriculaire et troubles neurosensoriels (cinchonisme). Surveillance clinique et ECG. Adaptation éventuelle de la posologie de la quinine pendant le traitement par l’inhibiteur enzymatique et après son arrêt.
+ Antifongiques azolés inhibiteurs puissants du CYP3A4 (itraconazole, kétoconazole, posaconazole) (avec voriconazole voir en association déconseillée avec quinidine)
Risque de majoration des effets indésirables de la quinine, notamment troubles du rythme ventriculaire et troubles neurosensoriels (cinchonisme). Surveillance clinique et ECG. Adaptation éventuelle de la posologie de la quinine pendant le traitement par l’inhibiteur enzymatique et après son arrêt.
QUINIDINE
Il faut prendre en compte le fait que les substances atropiniques peuvent additionner leurs effets indésirables et entraîner plus facilement une rétention urinaire, une poussée aiguë de glaucome, une constipation, une sécheresse de la bouche, etc
Les divers médicaments atropiniques sont représentés par les antidépresseurs imipraminiques, la plupart des antihistaminiques H1 atropiniques, les antiparkinsoniens anticholinergiques, les antispasmodiques atropiniques, le disopyramide, les neuroleptiques phénothiaziniques ainsi que la clozapine.
Médicaments bradycardisants
De nombreux médicaments peuvent entraîner une bradycardie. C'est le cas notamment des antiarythmiques de classe Ia, des bêta-bloquants, de certains antiarythmiques de classe III, de certains antagonistes du calcium, de la digoxine, de la pilocarpine, des anticholinestérasiques, etc.
Substances susceptibles de donner des torsades de pointes
Ce trouble du rythme cardiaque grave peut être provoqué par un certain nombre de médicaments, antiarythmiques ou non. L'hypokaliémie (cf. médicaments hypokaliémiants) est un facteur favorisant, de même que la bradycardie (cf. médicaments bradycardisants) ou un allongement préexistant de l'intervalle QT, congénital ou acquis.
Les médicaments à l’origine de cet effet indésirable sont notamment les antiarythmiques de classe Ia et III, et certains neuroleptiques. D'autres molécules n’appartenant pas à ces classes sont également en cause.
Pour l’érythromycine et la vincamine, seules les formes administrées par voie intraveineuse sont concernées par cette interaction. L'utilisation d'un médicament torsadogène avec un autre médicament torsadogène est contre-indiquée en règle générale.
Certains d’entre eux, en raison de leur caractère incontournable, font exception à la règle, en étant seulement déconseillés avec les autres torsadogènes. Il s’agit des antiparasitaires (chloroquine, halofantrine, luméfantrine, pentamidine), des arsénieux, de l'hydroxychloroquine, de la méthadone, du crizotinib, du cotrimoxazole et des neuroleptiques.
A noter que le citalopram, l’escitalopram, la dompéridone, l'hydroxyzine et la pipéraquine ne suivent pas cet assouplissement, et sont contre-indiqués avec tous les torsadogènes, à la suite d’un arbitrage européen.
Associations contre-indiquées (voir rubrique 4.3)
+ Autres antiarythmiques (amiodarone, dronédarone, hydroquinidine, disopyramide, sotalol)
L’association de deux antiarythmiques est très délicate. Elle est dans la majorité des cas contre-indiquée ou déconseillée.
+ Citalopram, escitalopram
Risque majoré de troubles du rythme ventriculaire, notamment de torsades de pointes.
Risque de majoration des effets indésirables de la quinidine par diminution de son métabolisme par le cobicistat.
+ Dompéridone
Risque majoré de troubles du rythme ventriculaire, notamment de torsades de pointes.
+ Érythromycine administrée par voie IV
Risque majoré de troubles du rythme ventriculaire, notamment de torsades de pointes.
Risque majoré de troubles du rythme ventriculaire, notamment de torsades de pointes.
+ Inhibiteurs de protéases boostés par ritonavir (atazanavir, darunavir, fosamprénavir, indinavir, lopinavir, nirmatrévir, saquinavir, tipranavir)
Risque majoré de troubles du rythme ventriculaire, notamment de torsades de pointes.
+ Méquitazine
Risque majoré de troubles du rythme ventriculaire, notamment de torsades de pointes.
+ Moxifloxacine
Risque majoré de troubles du rythme ventriculaire, notamment de torsades de pointes.
Augmentation des concentrations plasmatiques de la quinidine par diminution de son métabolisme hépatique par la bithérapie.
+ Pipéraquine
Risque majoré de troubles du rythme ventriculaire, notamment de torsades de pointes.
+ Spiramycine
Risque majoré de troubles du rythme ventriculaire, notamment de torsades de pointes.
+ Tétrabénazine
Augmentation possiblement très importante de l’exposition des métabolites actifs de la tétrabénazine.
+ Torémifène
Risque majoré de troubles du rythme ventriculaire, notamment de torsades de pointes.
+ Vandétanib
Risque majoré de troubles du rythme ventriculaire, notamment de torsades de pointes.
+ Vincamine administrée par voie IV
Risque majoré de troubles du rythme ventriculaire, notamment de torsades de pointes.
+ Voriconazole
Risque majoré de troubles du rythme ventriculaire, notamment de torsades de pointes.
Associations déconseillées (voir rubrique 4.4)
Risque majoré de troubles du rythme ventriculaire, notamment de torsades de pointes. Si cela est possible, interrompre l'un des deux traitements. Si l'association ne peut être évitée, contrôle préalable du QT et surveillance ECG monitorée.
+ Arsénieux
Risque majoré de troubles du rythme ventriculaires, notamment de torsades de pointes. Si l’association ne peut être évitée, contrôle clinique et électrocardiographique régulier.
Diminution de l’efficacité de l’opiacé par inhibition de son métabolisme par l’inhibiteur.
+ Crizotinib
Risque majoré de troubles du rythme ventriculaire, notamment de torsades de pointes. Si l’association ne peut être évitée, contrôle clinique et électrocardiographique régulier.
+ Délamanid
Risque majoré de troubles du rythme ventriculaire, notamment de torsades de pointes. Si l’association ne peut être évitée, contrôle clinique et électrocardiographique régulier.
+ Fingolimod, Ozanimod, Ponésimod
Potentialisation des effets bradycardisants pouvant entraîner des conséquences fatales. Les bêta-bloquants sont d’autant plus à risque qu’ils empêchent les mécanismes de compensation adrénergique.
Surveillance clinique et ECG continu pendant les 24 heures suivant la première dose.
+ Hydroxychloroquine
Risque majoré de troubles du rythme ventriculaire, notamment de torsades de pointes. Si l’association ne peut être évitée, contrôle clinique et électrocardiographique régulier.
+ Méthadone
Risque majoré de troubles du rythme ventriculaire, notamment de torsades de pointes. Si l’association ne peut être évitée, contrôle clinique et électrocardiographique régulier.
+ Neuroleptiques susceptibles de donner des torsades de pointes (amisulpride, chlorpromazine, cyamémazine, dropéridol, flupentixol, fluphénazine, halopéridol, lévomépromazine, pimozide, pipampérone, pipéraquine, pipotiazine, sulpiride, tiapride, zuclopenthixol)
Risque majoré de troubles du rythme ventriculaire, notamment de torsades de pointes. Si l’association ne peut être évitée, contrôle clinique et électrocardiographique régulier.
Risque de baisse de l'efficacité du tamoxifène, par inhibition de la formation de son métabolite actif par la quinidine.
+ Tramadol
Diminution de l’efficacité de l’opiacé par inhibition de son métabolisme par l’inhibiteur.
+ Vérapamil
Risque de majoration importante des effets hémodynamiques du vérapamil, avec hypotension et bradycardie sévères.
+ Sulfaméthoxazole + Triméthoprime (cotrimoxazole)
Risque majoré de troubles du rythme ventriculaire, notamment de torsades de pointes. Si l’association ne peut être évitée, contrôle clinique et électrocardiographique régulier.
Association faisant l’objet d’une précaution d’emploi
+ Alcalinisants urinaires (acétazolamide, bicarbonate de sodium, troméetamol)
Augmentation des concentrations plasmatiques de la quinidine et risque de surdosage (diminution de l'excrétion rénale de la quinidine par alcalinisation des urines).
Surveillance clinique, ECG et éventuellement contrôle de la quinidinémie ; si besoin, adaptation de la posologie pendant le traitement alcalinisant et après son arrêt.
Risque de bradycardie excessive (addition des effets).
+ Azithromycine, clarithromycine, roxithromycine
Risque majoré de troubles du rythme ventriculaire, notamment de torsades de pointes.
Surveillance clinique et électrocardiographique pendant l'association.
+ Bêta-bloquants dans l’insuffisance cardiaque (bisoprolol, carvedilol, metoprolol, nebivolol) (incluant l’esmolol)
Risque majoré de troubles du rythme ventriculaire, notamment de torsades de pointes.
L’association avec l’esmolol peut conduire à des troubles de la contractilité, de l'automatisme et de la conduction (suppression des mécanismes sympathiques compensateurs).
Surveillance clinique et électrocardiographique.
+ Ciprofloxacine, lévofloxacine, norfloxacine
Risque majoré de troubles du rythme ventriculaire, notamment de torsades de pointes.
Surveillance clinique et électrocardiographique pendant l'association.
+ Dabigatran
Augmentation des concentrations plasmatiques de dabigatran, avec majoration du risque de saignement.
Dans l'indication post-chirurgicale : surveillance clinique et adaptation de la posologie du dabigatran à 150 mg/j en une prise.
+ Digoxine
Augmentation de la digoxinémie par diminution de la clairance rénale de la digoxine. De plus, troubles de l'automatisme (bradycardie excessive et troubles de la conduction auriculoventriculaire).
Surveillance clinique et ECG. En cas de réponse inattendue, contrôler la digoxinémie et adapter la posologie.
+ Dronédarone
Risque de bradycardie ou de bloc auriculo-ventriculaire, notamment chez le sujet âgé. Par ailleurs, légère augmentation des concentrations de dronédarone par diminution de son métabolisme par la quinidine.
Débuter le traitement par la quinidine aux posologies minimales recommandées, et ajuster les doses en fonction de l’ECG.
+ Glasdégib
Risque majoré de troubles du rythme ventriculaire, notamment de torsades de pointes.
Surveillance clinique et électrocardiographique pendant l'association.
+ Hypokaliémiants
Risque majoré de troubles du rythme ventriculaire, notamment de torsades de pointes.
Corriger toute hypokaliémie avant d’administrer le produit et réaliser une surveillance clinique, électrolytique et électrocardiographique.
Risque majoré de troubles du rythme ventriculaire, notamment de torsades de pointes, ainsi que d'acouphènes et/ou de diminution de l'acuité auditive (cinchonisme), par diminution du métabolisme hépatique de la quinidine.
Surveillance clinique.
+ Médicaments à l’origine d’un hypogonadisme masculin
Risque majoré de troubles du rythme ventriculaire, notamment de torsades de pointes.
Surveillance clinique et électrocardiographique pendant l'association.
+ Ondansetron
Risque majoré de troubles du rythme ventriculaire, notamment de torsades de pointes.
Surveillance clinique et électrocardiographique pendant l'association.
Risque majoré de troubles du rythme ventriculaire, notamment de torsades de pointes.
Surveillance clinique.
+ Talazoparib
Augmentation des concentrations de talazoparib avec risque de majoration de la toxicité.
Réduire la dose de talazoparib.
+ Triclabendazole
Risque majoré de troubles du rythme ventriculaire, notamment de torsades de pointes (inhibition du métabolisme hépatique du médicament torsadogène).
Surveillance clinique.
Association à prendre en compte
+ Autres médicaments atropiniques
Addition des effets indésirables atropiniques à type de rétention urinaire, constipation, sécheresse de la bouche...
+ Autres médicaments bradycardisants
Risque de bradycardie excessive (addition des effets).
+ Anticholinestérasiques (ambénonium, donépézil, galantamine, néostigmine, pyridostigmine, rivastigmine)
Addition des effets indésirables atropiniques à type de rétention urinaire, constipation, sécheresse de la bouche...
+ Morphiniques
Risque important d'akinésie colique, avec constipation sévère.
+ Curares (atracurium, cisatracurium, mivacurium, rocuronium, suxamethonium, vecuronium)
Modification de l'intensité et/ou la durée de l'effet des curares non dépolarisants.
4.6. Fertilité, grossesse et allaitement
Grossesse
Quelques cas d'anomalies oculaires et d'atteintes auditives ont été rapportés lors de la prise de fortes doses de quinine pendant la grossesse. Aux doses thérapeutiques, aucun incident n'a été signalé. La quinine dans les conditions normales d'utilisation, peut être prescrite pendant la grossesse.
Le passage dans le lait étant très faible, l'allaitement est possible pendant un traitement par la quinine.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
· risque de survenue d'hypoglycémie,
· possibilité de survenue de signe de cinchonisme (acouphènes, vertiges, céphalées, troubles de la vision, baisse de l'acuité auditive, nausées et diarrhées) régressant à la diminution des doses ou l'arrêt du traitement et nécessitant rarement l'arrêt du traitement,
· photosensibilité,
· manifestations allergiques : prurit, urticaire, éruption cutanée généralisée, choc anaphylactique,
· anémie hémolytique aiguë parfois grave et compliquée d'insuffisance rénale aigue (fièvre bilieuse hémoglobinurique),
· thrombopénie, purpura thrombocytopénique,
· allongement de l’intervalle QT,
· à forte dose des cas de convulsions ont été décrits,
· effets indésirables locaux :
o Des nécroses suppuratives, des algodystrophies sciatiques, des indurations fibreuses au point d'injection ont été décrites à la suite d'injection intramusculaire de quinine. Cette voie d'administration doit être réservée aux situations où il est impossible d'utiliser la voie intraveineuse.
o En cas d'extravasation ou de perfusion de produit trop concentré, risque de survenue d'endophlébite et de sclérose de la veine.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/
Les signes de surdosage les plus fréquents sont :
· Acouphènes, baisse de l'acuité auditive et vertiges. Une surdité permanente s'observe parfois après administration de doses toxiques.
· Amblyopie, rétrécissement du champ visuel, diplopie et héméralopie. Le rétablissement est lent mais généralement complet. Des spasmes de l'artère centrale de la rétine ont été décrits lors de surdosages.
· Effet quinidine-like aboutissant à une hypotension, des troubles de la conduction, des symptômes angineux et une tachycardie ventriculaire. Une arythmie, et un arrêt cardiaque peuvent survenir.
L'administration par voie orale de plus de 3 g, en une seule prise, peut déterminer chez l'adulte une intoxication grave voire fatale, précédée d'une dépression centrale et de crises convulsives. Des doses plus faibles peuvent être fatales chez l'enfant.
Une arythmie, une hypotension et un arrêt cardiaque peuvent découler de l'effet cardiotoxique de la quinine tandis que la toxicité oculaire peut entraîner la cécité.
Conduite à tenir
Traitement symptomatique des anomalies en milieu hospitalier.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : Antipaludique, code ATC : P01BC01 (P : Parasitologie)
La quinine, antipaludique naturel, exerce une action schizonticide sanguine rapide sur les différentes espèces plasmodiales. Elle n'a aucune activité sur les formes intrahépatiques.
La quinidine, la cinchonine, la cinchonidine sont des alcaloïdes de quinquina. Ces principes actifs exercent également une activité pouvant contribuer à l'action schizonticide.
5.2. Propriétés pharmacocinétiques
La demi-vie de la quinine est de 10 heures chez le sujet sain et peut augmenter jusque 18 heures chez le sujet impaludé. Le passage transplacentaire et les taux dans le lait sont faibles. De petites quantités pénètrent dans le liquide céphalo-rachidien. La quinine est en majorité métabolisée en métabolite inactif par le foie. L'excrétion est biliaire à 80 % et urinaire à environ 20 % sous forme inchangée.
5.3. Données de sécurité préclinique
Glycérol, acide chlorhydrique concentré, eau pour préparations injectables.
Avant ouverture : 18 mois.
Après ouverture et dilution : le produit doit être utilisé immédiatement.
6.4. Précautions particulières de conservation
Avant ouverture : A conserver à une température ne dépassant pas 25°C.
6.5. Nature et contenu de l'emballage extérieur
2 ml en ampoule bouteille en verre jaune de type I.
Boîte de 3 ou 25.
6.6. Précautions particulières d’élimination et de manipulation
Pas d’exigences particulières.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
82 AVENUE RASPAIL
94250 GENTILLY
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 342 724 2 4 : 2 ml en ampoule (verre jaune). Boîte de 3.
· 34009 342 725 9 2 : 2 ml en ampoule (verre jaune). Boîte de 25.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
A compléter ultérieurement par le titulaire.
10. DATE DE MISE A JOUR DU TEXTE
A compléter ultérieurement par le titulaire.
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Liste I
ANSM - Mis à jour le : 05/06/2024
QUINIMAX 250 mg/2 ml, solution injectable
Gluconate de quinine, gluconate de quinidine, chlorhydrate de cinchonidine, chlorhydrate de cinchonine
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin ou votre pharmacien.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que QUINIMAX 250 mg/2 ml, solution injectable et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d'utiliser QUINIMAX 250 mg/2 ml, solution injectable ?
3. Comment utiliser QUINIMAX 250 mg/2 ml, solution injectable ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver QUINIMAX 250 mg/2 ml, solution injectable ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE QUINIMAX 250 mg/2 ml, solution injectable ET DANS QUELS CAS EST-IL UTILISE ?
Classe pharmacothérapeutique – Antipaludique, code ATC : P01BC01 - (P : Parasitologie)
Ce médicament est un antipaludique. Il contient de la quinine et des extraits alcaloïdes de quinquina.
Il est préconisé dans le traitement des crises de paludisme grave ou lorsqu'il est impossible d'administrer un traitement par la voie orale.
Le paludisme est une maladie causée par un parasite microscopique (Plasmodium), il est transmis par les piqûres de moustiques et il sévit dans les pays tropicaux. Cette maladie peut être grave. Elle doit être dépistée et traitée rapidement.
La quinine reste active sur des parasites devenus résistants à certains autres médicaments antipaludiques (en particulier dans les régions de chloroquinorésistance).
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER QUINIMAX 250 mg/2 ml, solution injectable ?
N’utilisez jamais QUINIMAX 250 mg/2 ml, solution injectable dans les cas suivants :
· en dehors du contexte de l'urgence, si vous souffrez de certains troubles du rythme cardiaque (trouble préexistant de la conduction intra-ventriculaire),
· si vous avez un antécédent de fièvre bilieuse hémoglobinurique,
· si vous prenez ce médicament en association avec d’autres antiarythmiques (amiodarone, dronédarone, hydroquinidine, disopyramide, sotalol), le voriconazole, le cobicistat, l’association ombitasvir + paritaprévir, les inhibiteurs de protéases boostés par ritonavir (atazanavir, darunavir, fosamprénavir, indinavir, lopinavir, nirmatrévir, saquinavir, tipranavir), la tétrabénazine, la pipéraquine, l’hydroxyzine, la dompéridone, le citalopram, l’escitalopram, la spiramycine, l’érythromycine administrée par voie intraveineuse (IV), la moxifloxacine, la vincamine administrée par voie intraveineuse (IV), le vandétanib, le torémifène, la méquitazine.
Ce médicament NE DOIT GENERALEMENT PAS ETRE UTILISE, sauf avis contraire de votre médecin, dans les cas suivants :
· en cas de traitement par la méfloquine (autre antipaludique).
EN CAS DE DOUTE, IL EST INDISPENSABLE DE DEMANDER L'AVIS DE VOTRE MEDECIN OU DE VOTRE PHARMACIEN.
Avertissements et précautions
Adressez-vous à votre médecin ou pharmacien avant d’utiliser QUINIMAX 250 mg/2 ml, solution injectable.
Avertissez votre médecin si vous avez des troubles du rythme cardiaque (bloc auriculo-ventriculaire, syndrome du QT long, arythmies ventriculaires), une maladie du cœur (cardiopathie), un rythme cardiaque très lent (< 50 battements par minute) ou un déséquilibre des électrolytes dans le sang (en particulier un taux faible de potassium ou de magnésium, voir rubrique «Autres médicaments et QUINIMAX 250 mg/2 ml, solution injectable».
Attention, en cas d'émission d'urine rouge après la prise de ce médicament interrompre le traitement et demander conseil à un médecin AVANT LA PRISE SUIVANTE DU MEDICAMENT.
Si l'exposition au risque de paludisme persiste après le traitement d'une crise de paludisme par la quinine, un traitement préventif adapté peut être envisagé. Demandez l'avis de votre médecin.
En cours de traitement, une surveillance du rythme cardiaque (mesure du pouls) et de la tension artérielle sont nécessaires.
En cas de maladie rénale, réduire la dose.
EN CAS DE DOUTE, NE PAS HESITER A DEMANDER L'AVIS DE VOTRE MEDECIN OU DE VOTRE PHARMACIEN.
Autres médicaments et QUINIMAX 250 mg/2 ml, solution injectable
AFIN D'EVITER D'EVENTUELLES INTERACTIONS ENTRE PLUSIEURS MEDICAMENTS, notamment avec la méfloquine (autre antipaludique), POUVANT ENTRAINER EN PARTICULIER DES TROUBLES DU RYTHME CARDIAQUE (ALLONGEMENT DE L’INTERVALLE QT) OU UNE AGGRAVATION DE TROUBLES CARDIAQUES PREEXISTANTS, IL FAUT SIGNALER SYSTEMATIQUEMENT TOUT AUTRE TRAITEMENT EN COURS A VOTRE MEDECIN OU A VOTRE PHARMACIEN.
· des médicaments utilisés pour traiter les rythmes cardiaques anormaux, tels que, mais non limité à la digoxine et le vérapamil. Votre médecin pourra vous prescrire une surveillance cardiaque pendant le traitement,
· des médicaments utilisés pour traiter les troubles cardio-vasculaires, de la classe des béta-bloquants tels que le bisoprolol, le carvedilol, le metoprolol, le nebivolol (incluant l’esmolol),
· certains neuroleptiques (amisulpride, chlorpromazine, cyamémazine, le dropéridol, le flupentixol, le fluphénazine, l’halopéridol, le lévomépromazine, la pimozide, la pipampérone, la pipéraquine, la pipotiazine, le sulpiride, le tiapride, le zuclopenthixol),
· des médicaments utilisés dans le traitement de certaines infections causées par des bactéries : antibiotiques de la famille des macrolides (l’érythromycine, la clarithromycine, la télithromycine, la roxithromycine et l’azithromycine), de la famille des rifamycines (la rifampicine), de la famille des fluoroquinolones (la moxifloxacine, la ciprofloxacine), de la famille des quinolones (la lévofloxacine, la norfloxacine) ou l’association d’antibiotiques sulfaméthoxazole + triméthoprime,
· du délamanid (médicament antituberculeux),
· des médicaments utilisés dans le traitement de certaines infections virales (ritonavir),
· des médicaments utilisés dans le traitement de certaines infections causées par des champignons (itraconazole, posaconazole),
· des médicaments utilisés dans le traitement de certaines infections parasitaires (notamment l’halofantrine, le luméfantrine, le triclabendazole, la méfloquine, la chloroquine, l’hydroxychloroquine), ou d’autres infections (pentamidine, cotrimoxazole),
· des médicaments utilisés pour traiter les troubles de la coagulation tels que le dabigatran,
· des médicaments anticancéreux tels que le tamoxifène, le talazoparib, le crizotinib, l’idélalisib, le glasdégib, l’apalutamide ou l’enzalutamide,
· des médicaments immunosuppresseurs tels que le fingolimod, l’ozanimod ou le ponésimod,
· certains médicaments utilisés dans l'épilepsie comme la primidone, la fosphénytoïne, la phénytoïne ou le stiripentol,
· de la carbamazépine ou du phénobarbital (médicaments utilisés pour traiter l’épilepsie),
· certains médicaments utilisés dans le traitement de la douleur comme la codéine, le tramadol, et les médicaments morphiniques,
· certains médicaments utilisés contre la nausée comme l’ondansétron,
· de la méthadone (médicament utilisé contre la dépendance aux opiacés),
· des médicaments à base d’arsenic,
· des médicaments diminuant les taux de potassium sanguins (hypokaliémiants),
· des médicaments à l’origine d’un déficit de sécrétion de testostérone,
· des médicaments utilisés en anesthésie à base de curares comme l’atracurium, le cisatracurium, le mivacurium, le rocuronium, le suxaméthonium, le vécuronium,
· un médicament utilisé dans le traitement du syndrome de Cushing : le kétoconazole (administré par voie orale),
· des médicaments à base de pilocarpine pour traiter le glaucome,
· des médicaments alcalinisants urinaires (acétazolamide, bicarbonate de sodium, trométamol) utilisés pour traiter des maladies urinaires,
· des médicaments utilisés pour traiter la myasthénie tels que l’ambénonium, la néostigmine, la pyridostigmine,
· des médicaments utilisés pour traiter l’atonie intestinale tels que la pyridostigmine,
QUINIMAX 250 mg/2 ml, solution injectable avec des aliments et boissons
Sans objet.
En cas de paludisme, votre médecin peut être amené à vous prescrire ce médicament pendant la grossesse. Respectez soigneusement les doses prescrites.
En cas de traitement avec ce médicament, l'allaitement est possible.
Demandez conseil à votre médecin ou à votre pharmacien avant de prendre tout médicament.
Conduite de véhicules et utilisation de machines
L'attention sera attirée notamment chez les conducteurs de véhicules et les utilisateurs de machines sur les risques de vertiges et les troubles de la vision attachés à l'emploi de ce produit.
QUINIMAX 250 mg/2 ml, solution injectable contient
Sans objet.
3. COMMENT UTILISER QUINIMAX 250 mg/2 ml, solution injectable ?
Ce dosage n'est pas adapté à l'enfant de moins de 30 kg.
Se conformer à la prescription médicale.
CE MEDICAMENT VOUS A ETE PERSONNELLEMENT DELIVRE DANS UNE SITUATION PRECISE :
IL PEUT NE PAS ETRE ADAPTE A UN AUTRE CAS.
NE PAS LE CONSEILLER A UNE AUTRE PERSONNE.
Mode d'administration
Perfusion intra-veineuse lente ou en injection intra-musculaire profonde.
Respecter les conditions strictes d'asepsie lors de l'injection.
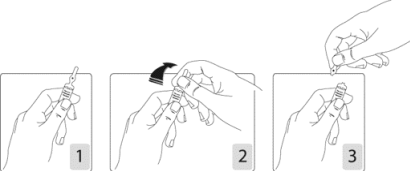
Pour ouvrir l’ampoule :
Tenir fermement l’ampoule, le point coloré face à vous (schéma 1). Saisir la tête de l’ampoule entre le pouce et l’index (le pouce sur le point coloré), puis exercer une pression vers l’arrière (schémas 2 et 3).
Durée du traitement
La durée du traitement d'un accès palustre par la quinine est de 5 à 7 jours.
Le relais par un traitement par voie orale doit être envisagé dès que possible.
Si vous avez utilisé plus de QUINIMAX 250 mg/2 ml, solution injectable que vous n’auriez dû
Consultez immédiatement votre médecin ou votre pharmacien.
· En cas de troubles auditifs, de troubles visuels, d'anomalies du rythme cardiaque, de troubles digestifs : ils peuvent traduire un surdosage de la quinine.
· En cas d'intoxication accidentelle (notamment fréquente chez les jeunes enfants).
Si vous oubliez d’utiliser QUINIMAX 250 mg/2 ml, solution injectable
Si vous arrêtez d’utiliser QUINIMAX 250 mg/2 ml, solution injectable
Sans objet.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
· Troubles du rythme du cœur (allongement de l’intervalle QT),
· Hypoglycémie (quantité insuffisante de sucre dans le sang) pouvant entraîner un malaise,
· Bourdonnements d'oreilles, baisse brutale de l'audition, vertiges, maux de tête, troubles de la vision, nausées peuvent survenir après 3 jours de traitement,
· Convulsions à forte dose,
· Manifestations allergiques : démangeaison, urticaire, éruption généralisée, choc anaphylactique,
· Anomalies sanguines (diminution des plaquettes sanguines),
· Apparition rare d'urine rouge au cours du traitement par quinine (fièvre bilieuse hémoglobinurique) (voir rubrique 2 paragraphe « Avertissements et précautions »),
· Manifestations locales :
o voie intra-musculaire : possibilité de douleur voire nécrose au point d'injection,
o voie intra-veineuse : en particulier en cas d'extravasation : possibilité de phlébite (inflammation de la veine avec formation d'un caillot entraînant son oblitération), éventuellement suivie d'une sclérose de la veine.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER QUINIMAX 250 mg/2 ml, solution injectable ?
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur l’emballage. La date de péremption fait référence au dernier jour de ce mois.
Après ouverture et dilution : le produit doit être utilisé immédiatement.
Avant ouverture : à conserver à une température ne dépassant pas 25 °C.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient QUINIMAX 250 mg/2 ml, solution injectable
· Les substances actives sont :
gluconate de quinine................................................................................................ 385,125 mg
(quantité correspondante en QUININE..................................................................... 240,000 mg*)
gluconate de quinidine............................................................................................... 10,590 mg
(quantité correspondante en QUINIDINE...................................................................... 6,600 mg*)
chlorhydrate de cinchonine........................................................................................... 2,120 mg
(quantité correspondante en CINCHONINE.................................................................. 1,700 mg*)
chlorhydrate de cinchonidine........................................................................................ 2,015 mg
(quantité correspondante en CINCHONIDINE............................................................... 1,700 mg*)
pour une ampoule de 2 ml.
*Soit une quantité totale d’alcaloïdes base de 250 mg.
· Les autres composants sont :
Excipients : glycérol, acide chlorhydrique concentré, eau pour préparations injectables.
Gaz d'inertage : azote.
Qu’est-ce que QUINIMAX 250 mg/2 ml, solution injectable et contenu de l’emballage extérieur
Ce médicament se présente sous forme de solution injectable en ampoule de 2 ml.
Boîte de 3 ou 25 ampoules.
Toutes les présentations peuvent ne pas être commercialisées.
Titulaire de l’autorisation de mise sur le marché
82 AVENUE RASPAIL
94250 GENTILLY
Exploitant de l’autorisation de mise sur le marché
SANOFI WINTHROP INDUSTRIE
82 AVENUE RASPAIL
94250 GENTILLY
1, RUE DE LA VIERGE
33440 AMBARES
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Sans objet.
La dernière date à laquelle cette notice a été révisée est :
A compléter ultérieurement par le titulaire
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).