
ANSM - Mis à jour le : 16/01/2025
FENTANYL SANDOZ 800 microgrammes, comprimé sublingual
2. COMPOSITION QUALITATIVE ET QUANTITATIVE 
Chaque comprimé sublingual contient 800 microgrammes de fentanyl (sous forme de citrate).
Pour la liste complète des excipients, voir rubrique 6.1.
Comprimé blanc, oblong de 10 mm de longueur et 6 mm de largeur.
4.1. Indications thérapeutiques 
4.2. Posologie et mode d'administration 
Mode d’administration
Les comprimés sublinguaux de FENTANYL SANDOZ doivent être placés directement sous la langue, le plus loin possible. Les comprimés sublinguaux de FENTANYL SANDOZ ne doivent pas être avalés, mais fondre complètement sous la langue, sans être mâchés ni sucés. Les patients doivent être informés qu’ils ne doivent pas manger ni boire avant dissolution complète du comprimé sublingual.
Les patients souffrant de sècheresse buccale peuvent utiliser de l’eau pour humidifier la muqueuse buccale avant la prise de FENTANYL SANDOZ.
Posologie
Titration de la dose
L’objectif de la titration de la dose est d’identifier une dose d’entretien optimale pour le traitement des accès douloureux paroxystiques. Cette dose optimale doit permettre une analgésie adéquate avec un taux acceptable d’effets indésirables.
La dose optimale de FENTANYL SANDOZ doit être déterminée pour chaque patient par titration progressive. Plusieurs dosages sont disponibles et peuvent être utilisés pendant la phase de titration. La dose initiale de FENTANYL SANDOZ utilisée doit être de 100 µg, avec augmentation de la posologie si nécessaire, dans la gamme des dosages disponibles.
Les patients doivent être surveillés attentivement jusqu’à ce qu’une dose optimale ait été atteinte.
La substitution de FENTANYL SANDOZ à d’autres produits contenant du fentanyl ne doit pas être effectuée dans un rapport de 1/1 dans la mesure où les différents produits ont des profils d’absorption différents. Tout remplacement d’un autre produit contenant du fentanyl par FENTANYL SANDOZ doit donner lieu à une nouvelle titration.
Le schéma posologique suivant est recommandé pour la titration. Le médecin doit toutefois toujours prendre en compte les besoins cliniques du patient, son âge et ses maladies concomitantes.
Tous les patients doivent commencer le traitement avec un seul comprimé sublingual de 100 microgrammes. Si une analgésie adéquate n’est pas obtenue dans les 15 à 30 minutes qui suivent l’administration d’un comprimé sublingual unique, un second comprimé sublingual de 100 microgrammes peut être administré. Si une analgésie adéquate n’est pas obtenue dans les 15 à 30 minutes suivant la première dose, il faut envisager une augmentation de la dose jusqu'au dosage immédiatement supérieur pour le prochain accès douloureux paroxystique (voir figure ci-dessous).
L’augmentation posologique doit se poursuivre par étape jusqu’à obtention d’une analgésie adéquate avec des effets indésirables tolérables. Pour des doses initiales de 400 µg et plus, le dosage du comprimé sublingual supplémentaire doit être de 200 µg. Cela est illustré par le tableau ci-dessous.
Pendant la phase de titration, le patient ne peut pas recevoir plus de deux prises pour un seul accès douloureux paroxystique.
PROCEDE DE TITRATION DE FENTANYL SANDOZ

|
Dosage (en µg) du premier comprimé sublingual par accès douloureux paroxystique |
Dosage (en µg) du second comprimé sublingual, à administrer au besoin 15 à 30 minutes après le premier comprimé |
|
100 |
100 |
|
200 |
100 |
|
300 |
100 |
|
400 |
200 |
|
600 |
200 |
|
800 |
- |
Si la plus forte dose permettant d’obtenir une analgésie efficace provoque des effets indésirables considérés comme inacceptables, une dose intermédiaire peut être administrée (en utilisant selon le cas le comprimé de 100 µg).
Pendant la phase de titration, les patients doivent être informés de la possibilité d’utiliser plusieurs comprimés de 100 µg et/ou de 200 µg comme dose unique. Le nombre de comprimés administrés pour le traitement d’un seul accès douloureux paroxystique ne doit pas être supérieur à quatre (4).
L’efficacité et la sécurité de doses supérieures à 800 µg n’ont pas été évaluées au cours des études cliniques menées chez des patients.
Afin de minimiser le risque d’effet indésirable lié aux morphiniques et de déterminer la dose appropriée, les patients doivent être placés sous surveillance médicale stricte pendant le processus de titration.
Pendant la phase de titration, les patients doivent attendre au moins 2 heures avant de traiter un autre accès de douleur paroxystique avec FENTANYL SANDOZ.
Traitement d’entretien
Lorsque la dose appropriée, qui peut être supérieure à un comprimé, a été déterminée, elle doit continuer à être utilisée. La consommation doit être limitée à quatre doses de FENTANYL SANDOZ par jour.
Pendant la période d’entretien, les patients doivent attendre au moins 2 heures avant de traiter un autre accès de douleur paroxystique avec FENTANYL SANDOZ.
Réajustement de la dose
En cas d’observation d’une modification marquée de la réponse (analgésie ou effets indésirables), une nouvelle adaptation de la dose peut être nécessaire pour assurer le maintien d’une dose optimale.
Si le patient présente plus de quatre accès douloureux paroxystiques par jour pendant plus de quatre jours consécutifs, la dose du morphinique à longue durée d’action utilisée pour traiter la douleur chronique doit être réévaluée. En cas de modification de ce morphinique ou de sa posologie, la dose de FENTANYL SANDOZ doit être réévaluée et éventuellement réadaptée pour garantir l’utilisation d’une dose optimale.
Toute nouvelle adaptation de la dose d’un analgésique, quel qu’il soit, doit être impérativement effectuée sous surveillance médicale.
En l’absence de contrôle adéquat de la douleur, la possibilité d’une hyperalgie, d’une tolérance au traitement ou de la progression d’une maladie sous-jacente doit être considérée (voir rubrique 4.4).
Durée et objectifs du traitement
Avant l’instauration du traitement par FENTANYL SANDOZ, une stratégie thérapeutique comprenant la durée et les objectifs du traitement doivent être convenus avec le patient, conformément aux lignes directrices relatives à la prise en charge de la douleur. Pendant le traitement, des contacts fréquents doivent avoir lieu entre le médecin et le patient afin d’évaluer la nécessité de poursuivre le traitement, d’envisager l’arrêt du traitement et d’ajuster les doses si nécessaire. En l’absence d’un contrôle adéquat de la douleur, la possibilité d’hyperalgésie, de tolérance et de progression de la maladie sous-jacente doit être envisagée (voir rubrique 4.4).
FENTANYL SANDOZ ne doit pas être utilisé plus longtemps que nécessaire.
Arrêt du traitement
Le traitement par FENTANYL SANDOZ doit être immédiatement arrêté dès que le patient ne présente plus d’accès douloureux paroxystiques. Le traitement de la douleur chronique de fond doit être maintenu comme prescrit.
Si l’arrêt de tous les traitements opioïdes est nécessaire, le patient doit être étroitement surveillé par le médecin afin d’éviter le risque d’apparition de symptômes liés à un sevrage brutal.
Population pédiatrique
Compte tenu de l’absence de données de sécurité et d’efficacité pour cette population, FENTANYL SANDOZ ne doit pas être utilisé chez les patients de moins de 18 ans.
Personnes âgées
La titration de la dose doit être particulièrement prudente et l’apparition éventuelle de signes de toxicité du fentanyl doit faire l’objet d’une surveillance stricte (voir rubrique 4.4).
Patients insuffisants hépatiques ou rénaux
L’apparition éventuelle de signes de toxicité du fentanyl doit faire l’objet d’une surveillance stricte chez les patients atteints de troubles hépatiques ou rénaux (voir rubrique 4.4).
· Hypersensibilité à la substance active ou à l’un des excipients mentionnés à la rubrique 6.1.
· Patients non traités par un traitement de fond morphinique, en raison d’un risque accru de dépression respiratoire.
· Dépression respiratoire sévère ou pathologies pulmonaires obstructives sévères.
· Patients traités par des médicaments contenant de l'oxybate de sodium,
· Traitement de la douleur aiguë autre que les accès douloureux paroxystiques.
4.4. Mises en garde spéciales et précautions d'emploi 
En raison des effets indésirables potentiellement graves des traitements morphiniques comme FENTANYL SANDOZ, les patients et le personnel soignant doivent être informés de l’importance de la prise correcte de FENTANYL SANDOZ et informés des mesures à prendre en présence de symptômes de surdosage.
Avant l’instauration de FENTANYL SANDOZ, le traitement morphinique à longue durée d’action utilisé pour contrôler la douleur chronique doit avoir été stabilisé.
Comme tous les morphiniques, FENTANYL SANDOZ est associé à un risque de dépression respiratoire cliniquement significative. La phase de titration doit être réalisée avec une prudence particulière chez les patients atteints de broncho-pneumopathie chronique obstructive ou d’une autre pathologie (par ex. : myasthénie grave) les prédisposant à une dépression respiratoire, en raison de la majoration du risque de dépression respiratoire pouvant entraîner un arrêt respiratoire.
FENTANYL SANDOZ ne doit être administré qu’avec une extrême prudence aux patients susceptibles de présenter une sensibilité particulière aux effets cérébraux de l’hypercapnie, comme les patients présentant des signes d’hypertension intracrânienne, des troubles de la conscience, un coma ou des tumeurs cérébrales. Les morphiniques pouvant masquer l’évolution clinique chez les patients atteints de traumatismes crâniens, ils ne doivent être utilisés dans ce cadre qu’en cas d’absolue nécessité.
Hyperalgésie
Comme avec les autres morphiniques, en cas de contrôle insuffisant de la douleur en réponse à une augmentation de dose en fentanyl, la possibilité d'une hyperalgésie induite par les morphiniques est à envisager. Une diminution de la dose en fentanyl, une suspension du traitement ou une réévaluation du traitement est recommandée.
Tolérance et troubles liés à l’usage d’opioïdes (abus et dépendance)
Une accoutumance et une dépendance physique et/ou psychologique sont susceptibles d’apparaître lors de l’administration répétée d’opioïdes tels que le fentanyl.
Avant l’instauration du traitement par FENTANYL SANDOZ et pendant le traitement, les objectifs du traitement et un plan d’arrêt doivent être convenus en accord avec le patient (voir rubrique 4.2). Avant et pendant le traitement, le patient doit également être informé des risques et des signes de TUO. En cas d’apparition de ces signes, les patients doivent être invités à contacter leur médecin.
Les patients devront être surveillés pour détecter tout signe d’abus ou d’addiction (par exemple une demande de renouvellement prématurée). Cela inclut la revue de la prise concomitante d’opioïdes et de psychotropes (comme les benzodiazépines). Pour les patients présentant des signes et des symptômes de TUO, il convient d’envisager une consultation chez un spécialiste en toxicomanie.
Pathologie cardiaque
Le fentanyl peut provoquer une bradycardie. Il doit être utilisé avec prudence chez les patients présentant des antécédents de bradyarythmie ou une bradyarythmie préexistante.
Les données obtenues à la suite de l’administration intraveineuse de fentanyl suggèrent la possibilité d’une réduction de sa clairance et d’une augmentation de sa demi-vie chez les patients âgés, qui pourraient être plus sensibles à la substance active que les patients plus jeunes. Les patients âgés, cachectiques ou affaiblis doivent faire l’objet d’une surveillance attentive en cas d’apparition de signes de toxicité du fentanyl, entraînant si nécessaire une réduction de la dose.
FENTANYL SANDOZ doit être administré avec prudence chez les patients présentant des troubles hépatiques ou rénaux, en particulier pendant la phase de titration. L’utilisation de FENTANYL SANDOZ chez des patients insuffisants hépatiques ou rénaux pourrait augmenter la biodisponibilité du fentanyl et réduire sa clairance systémique, ce qui pourrait entraîner une augmentation et une prolongation des effets morphiniques.
Une prudence particulière doit être apportée au traitement des patients hypovolémiques ou hypotendus.
FENTANYL SANDOZ n’a pas été étudié chez les patients présentant des lésions buccales ou une mucite. Un risque d’augmentation de l’exposition systémique au médicament peut exister chez ces patients et une prudence particulière est donc recommandée pendant la titration.
La suspension du traitement par FENTANYL SANDOZ ne devrait pas entraîner d’effet notable, mais les symptômes possibles de sevrage incluent : anxiété, tremblements, sueurs, pâleur, nausées et vomissements.
Troubles respiratoires liés au sommeil
Les opioïdes peuvent provoquer des troubles respiratoires liés au sommeil, notamment une apnée centrale du sommeil (ACS) et une hypoxémie liée au sommeil. L’utilisation d’opioïdes majore le risque d’ACS de façon dose-dépendante. Chez les patients souffrant d’ACS, une réduction de la dose totale d’opioïdes doit être envisagée.
Syndrome sérotoninergique
· Il est conseillé de faire preuve de prudence lorsque FENTANYL SANDOZ est administré en association avec des médicaments qui affectent les systèmes de neurotransmission sérotoninergique.
Un syndrome sérotoninergique, susceptible de mettre en jeu le pronostic vital, peut se développer lors de l'utilisation concomitante de médicaments sérotoninergiques tels que des inhibiteurs sélectifs de la recapture de la sérotonine (ISRS) et des inhibiteurs de la recapture de la sérotonine et de la noradrénaline (IRSN), ainsi qu’avec des médicaments qui altèrent le métabolisme de la sérotonine (y compris les inhibiteurs de la monoamine oxydase [IMAO]). Cela peut se produire aux doses recommandées.
Le syndrome sérotoninergique peut s’accompagner d’altérations de l'état mental (p. ex. agitation, hallucinations, coma), d’une instabilité du système nerveux autonome (p. ex. tachycardie, pression artérielle labile, hyperthermie), de troubles neuromusculaires (p. ex. hyperréflexie, incoordination, rigidité) et/ou de symptômes gastro-intestinaux (p. ex. nausées, vomissements, diarrhée).
En cas de suspicion de syndrome sérotoninergique, il convient d’arrêter le traitement par FENTANYL SANDOZ.
Risques en cas d’administration concomitante de benzodiazépines ou de médicaments apparentés
L’utilisation concomitante de FENTANYL SANDOZ et de sédatifs, tels que des benzodiazépines ou des médicaments apparentés, peut entraîner une sédation profonde, une dépression respiratoire, un coma et le décès. Compte tenu de ces risques, l’utilisation concomitante ne doit être envisagée que lorsque les autres options de traitement ne sont pas possibles. Toutefois, si votre médecin vous prescrit FENTANYL SANDOZ avec des sédatifs, il devra limiter la dose et la durée du traitement concomitant.
Les patients doivent être étroitement surveillés pour déceler tout signe et symptôme éventuel de dépression respiratoire et de sédation. Il est fortement recommandé d'informer les patients et le personnel soignant de la nécessité d’être attentifs aux signes et symptômes décrits ci-dessus (voir rubrique 4.5).
FENTANYL SANDOZ contient du sodium
Ce médicament contient moins de 1 mmol (23 mg) de sodium par comprimé sublingual, c’est-à-dire qu’il est essentiellement « sans sodium ».
4.5. Interactions avec d'autres médicaments et autres formes d'interactions 
Le fentanyl est métabolisé par le CYP3A4. Les médicaments qui inhibent l’activité du CYP3A4 tels que les macrolides (par ex. : érythromycine), les antifongiques imidazolés (par ex. kétoconazole, itraconazole) et certains inhibiteurs de la protéase (par ex. : ritonavir) sont susceptibles d’augmenter la biodisponibilité du fentanyl en diminuant sa clairance systémique, ce qui pourrait accroître ou prolonger les effets des morphiniques. Le jus de pamplemousse est également un inhibiteur du CYP3A4.
L’efficacité du fentanyl peut être diminuée en cas d’administration concomitante avec des médicaments qui induisent l’activité du CYP3A4 tels que les antimycobactériens (par exemple rifampicine, rifabutine), les antiépileptiques (par exemple carbamazépine, phénytoïne et phénobarbital), les produits à base de plantes (par exemple millepertuis, Hypericum perforatum). Les inducteurs du CYP3A4 exercent leur effet de façon temps-dépendante et le délai pour atteindre l’effet maximal peut être d’au moins deux semaines après l’introduction du médicament. A l’inverse, après l’arrêt du traitement, le temps nécessaire pour la diminution de l’induction du CYP3A4 peut être d’au moins deux semaines. Les patients recevant du fentanyl chez lesquels le traitement par des inducteurs du CYP3A4 est arrêté ou chez lesquels la dose de ces médicaments est diminuée peuvent présenter un risque d’efficacité ou de toxicité accrue du fentanyl. Le fentanyl doit donc être administré avec prudence lorsque des inhibiteurs et/ou des inducteurs du CYP3A4 sont administrés de façon concomitante.
L’administration concomitante d’autres dépresseurs du SNC tels que : autres dérivés morphiniques (analgésiques ou antitussifs), anesthésiques généraux, myorelaxants, antidépresseurs sédatifs, antihistaminiques H1 sédatifs, barbituriques, anxiolytiques (benzodiazépines), gabapentinoïdes (gabapentine et prégabaline), hypnotiques, neuroleptiques, clonidine et substances apparentées peuvent augmenter les effets dépresseurs du SNC. Une dépression respiratoire, une hypotension et une sédation profonde peuvent apparaître.
L’alcool potentialise les effets sédatifs des analgésiques morphiniques. L’administration concomitante de boissons alcoolisées ou de médicaments contenant de l'alcool et de FENTANYL SANDOZ n’est donc pas recommandée.
L’utilisation de FENTANYL SANDOZ n’est pas recommandée chez les patients ayant reçu des inhibiteurs de la monoamine- oxydase (IMAO) dans les 14 jours précédant la prise, en raison de la potentialisation sévère et imprévisible des analgésiques morphiniques par les IMAO.
L’utilisation concomitante d’agonistes-antagonistes partiels morphiniques (par ex : buprénorphine, nalbuphine, pentazocine) n’est pas recommandée. En effet, ceux-ci possèdent une forte affinité pour les récepteurs morphiniques, avec une activité intrinsèque relativement faible ; ils antagonisent donc partiellement l’effet analgésique du fentanyl et peuvent entraîner des symptômes de sevrage chez les patients morphinodépendants.
Médicaments sérotoninergiques
L'administration concomitante de fentanyl et d’un agent sérotoninergique, tel qu’un inhibiteur sélectif de la recapture de la sérotonine (ISRS), un inhibiteur de la recapture de la sérotonine et de la noradrénaline (IRSN) ou un inhibiteur de la monoamine oxydase (IMAO), peut augmenter le risque de syndrome sérotoninergique, une pathologie pouvant mettre en jeu le pronostic vital.
Médicaments sédatifs tels que les benzodiazépines et les molécules apparentées
L’utilisation concomitante des opioïdes avec les médicaments sédatifs tels que les benzodiazépines et les molécules apparentées augmente le risque de sédation, dépression respiratoire, coma et décès compte tenu de l’accumulation des effets dépresseurs sur le Système Nerveux Central (SNC). La posologie et la durée du traitement concomitant doivent être limitées (voir rubrique 4.4).
4.6. Fertilité, grossesse et allaitement 
Grossesse
L’innocuité du fentanyl durant la grossesse n’a pas été démontrée. Le fentanyl doit être utilisé au cours de la grossesse uniquement en cas de nécessité absolue.
Un traitement prolongé au cours de la grossesse est associé à un risque de symptômes de sevrage chez le nouveau-né.
Il est recommandé de ne pas utiliser le fentanyl pendant le travail et l’accouchement (y compris en cas de césarienne), car il franchit la barrière placentaire et peut entraîner une dépression respiratoire chez le fœtus ou le nouveau-né.
Le fentanyl est excrété dans le lait maternel et peut entraîner une sédation et une dépression respiratoire chez le nourrisson. Le fentanyl ne doit pas être utilisé pendant l’allaitement et celui-ci ne doit pas reprendre moins de 5 jours après la dernière administration du fentanyl.
Fertilité
Des études effectuées chez l’animal ont mis en évidence une toxicité sur la reproduction, avec une diminution de la fertilité chez le rat (voir rubrique 5.3). Le risque potentiel en clinique n’est pas connu.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines 
Cependant, il est connu que les analgésiques opioïdes altèrent les capacités mentales ou physiques nécessaires à l’exécution de tâches potentiellement dangereuses telles que la conduite d’un véhicule ou l’utilisation de machines. Il doit être conseillé aux patients de ne pas conduire de véhicule ni utiliser de machine s’ils éprouvent une somnolence, des étourdissements ou des troubles visuels (vision floue ou double) pendant le traitement par FENTANYL SANDOZ.
Les effets indésirables attendus avec FENTANYL SANDOZ sont les effets indésirables typiques des morphiniques qui diminueront d’intensité avec la poursuite du traitement. Les réactions indésirables potentielles les plus graves associées aux morphiniques sont la dépression respiratoire (qui peut entraîner un arrêt respiratoire), l’hypotension et l’état de choc.
Les études cliniques de fentanyl visaient à évaluer la sécurité et l’efficacité dans le traitement des accès douloureux paroxystiques d’origine cancéreuse ; tous les patients recevaient en même temps des opioïdes tels que la morphine à libération prolongée, l’oxycodone à libération prolongée ou le fentanyl par voie transdermique pour leur douleur chronique. Il n’est donc pas possible de distinguer de façon certaine les effets de FENTANYL SANDOZ seul.
Les effets indésirables les plus fréquemment rapportés avec FENTANYL SANDOZ sont les effets indésirables typiques des opioïdes tels que nausées, constipation, somnolence et céphalées.
Résumé tabulé des effets indésirables de FENTANYL SANDOZ et/ou d’autres médicaments contenant du fentanyl :
Les effets indésirables suivants ont été rapportés avec le fentanyl et/ou d’autres médicaments contenant du fentanyl durant les essais cliniques ou après la commercialisation. Ils sont énumérés ci-dessous par classe de système d’organes et fréquence (très fréquent ≥ 1/10 ; fréquent ≥ 1/100, < 1/10 ; peu fréquent ≥ 1/1 000, < 1/100 ; fréquence indéterminée (ne peut être estimée sur la base des données disponibles). Au sein de chaque groupe de fréquence, les effets indésirables sont présentés suivant un ordre décroissant de gravité.
|
Système Organe Classe MedDRA |
Très fréquent ≥ 1/10 |
Fréquent ≥ 1/100, < 1/10 |
Peu fréquent ≥ 1/1 000 , < 1/100 |
Fréquence indéterminée |
|
Affections du système immunitaire |
|
|
Hypersensibilité |
|
|
Troubles du métabolisme et de la nutrition |
|
|
Anorexie, diminution de l’appétit |
|
|
Affections psychiatriques |
|
|
Dépression, paranoïa, état confusionnel, désorientation, modifications de l’état mental, anxiété, euphorie, dysphorie, labilité émotionnelle, troubles de l’attention, insomnie |
Hallucinations, pharmaco- dépendance (addiction)**, abus, délire |
|
Affections du système nerveux |
|
Vertiges, céphalées, somnolence |
Amnésie, parosmie, dysgueusie, tremblement, léthargie, hypoesthésie, troubles du sommeil |
Convulsions, diminution du niveau de conscience, perte de conscience |
|
Affections oculaires |
|
|
Vision floue |
|
|
Affections cardiaques |
|
|
Tachycardie, bradycardie |
|
|
Affections vasculaires |
|
|
Hypotension |
|
|
Affections respiratoires, thoraciques et médiastinales |
|
Dyspnée |
Douleur oro- pharyngée, sensation de constriction de la gorge |
Dépression respiratoire |
|
Affections gastro- intestinales |
Nausées |
Stomatite, vomissements, constipation, sécheresse buccale |
Ulcération buccale, ulcération gingivale, ulcération labiale, vidange gastrique retardée, douleur abdominale, dyspepsie, gêne gastrique, affection de la langue, stomatite aphteuse |
Œdème de la langue, diarrhée |
|
Affections de la peau et du tissu sous-cutané |
|
Hyperhidrose |
Lésion cutanée, rash, prurit allergique, prurit, sueurs nocturnes, tendance accrue aux ecchymoses |
Urticaire |
|
Affections musculo- squelettiques et systémiques |
|
|
Arthralgies, raideur musculo- squelettiques, raideur articulaire |
|
|
Affections des organes de reproduction et du sein |
|
|
Dysfonction érectile |
|
|
Troubles généraux et anomalies au site d’administration |
|
Fatigue |
Syndrome de sevrage*, asthénie, malaise |
Bouffée vasomotrice et bouffée de chaleur, œdème périphérique, fièvre, syndrome de sevrage néonatal, tolérance au médicament** |
|
Lésions, intoxications et complications liées aux procédures |
|
|
Surdosage accidentel |
Chutes |
*Des symptômes de sevrage des opioïdes tels que nausées, vomissements, diarrhée, anxiété, frissons, tremblements et sudation ont été observés avec le fentanyl administré par voie transmuqueuse.
**Voir la rubrique « Description de certains effets indésirables ».
Description de certains effets indésirables
Tolérance
La tolérance peut se développer lors d’une utilisation répétée.
Pharmacodépendance
L’utilisation répétée de FENTANYL SANDOZ peut entraîner une dépendance aux médicaments (pharmacodépendance), même à des doses thérapeutiques. Le risque de pharmacodépendance peut varier selon les facteurs de risque propres au patient, de la posologie et de la durée du traitement par opioïdes (voir rubrique 4.4).
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/.
Les symptômes attendus en cas de surdosage par fentanyl sont de même nature que son action pharmacologique. L’effet indésirable le plus grave est la dépression respiratoire qui peut entraîner un arrêt respiratoire. Un coma peut également être observé. Des cas de respiration de Cheynes-Stokes ont été constatés en cas de surdosage en fentanyl, en particulier chez les patients ayant des antécédents d’insuffisance cardiaque. Une leucoencéphalopathie toxique a également été observée lors d’un surdosage en fentanyl.
Mesures à prendre
Les mesures à prendre immédiatement en présence d’un surdosage morphinique consistent à retirer immédiatement le comprimé sublingual de FENTANYL SANDOZ de la bouche du patient s’il s’y trouve encore, effectuer des stimulations physiques et verbales du patient, déterminer son niveau de conscience. La perméabilité des voies respiratoires doit être assurée et maintenue.
Une canule oropharyngée ou un tube endotrachéal doit être inséré et administré et la ventilation mécanique initiée si nécessaire. Une température corporelle adéquate doit être maintenue et un apport liquidien par voie parentérale doit être instauré.
Pour le traitement du surdosage accidentel chez une personne qui n’a jamais reçu de traitement morphinique, administrer de la naloxone ou d’autres antagonistes morphiniques en se référant aux indications cliniques et aux Résumés des Caractéristiques des produits en question. En cas de dépression respiratoire prolongée, il peut être nécessaire de répéter l’administration de l’antagoniste morphinique.
La naloxone et les autres antagonistes morphiniques doivent être utilisés avec prudence dans le traitement du surdosage chez les patients sous morphiniques en raison du risque de déclenchement d’un syndrome de sevrage aigu.
Une hypotension sévère ou persistante, si elle a lieu, doit évoquer une hypovolémie, à prendre en charge par un apport liquidien approprié par voie parentérale.
Le fentanyl et d’autres morphiniques ont été associés à une rigidité musculaire inhibant la respiration. Dans ce cas, une intubation endotrachéale, l’instauration d’une ventilation assistée et l’administration d’un antagoniste morphinique ainsi que, d’un myorelaxant, peuvent être nécessaires.
5. PROPRIETES PHARMACOLOGIQUES 
5.1. Propriétés pharmacodynamiques 
Mécanisme d’action et effets pharmacodynamiques
Le fentanyl est un puissant analgésique agissant sur le récepteur morphinique µ et présente un effet analgésique rapide et une courte durée d’action. Le fentanyl présente un effet analgésique environ 100 fois plus puissant que celui de la morphine. Les effets secondaires du fentanyl sur le système nerveux central (SNC) et les fonctions respiratoire et gastro-intestinale sont ceux des analgésiques morphiniques et sont considérés comme des effets de classe. Ceux-ci peuvent inclure dépression respiratoire, bradycardie, hypothermie, constipation, myosis, dépendance physique et euphorie.
Les effets analgésiques du fentanyl sont liés aux concentrations plasmatiques en substance active. Chez les sujets n’ayant jamais reçu de traitement morphinique, les concentrations sanguines minimales de fentanyl produisant un effet analgésique efficace sont comprises entre 0,3 et 1,2 ng/ml. Les concentrations comprises entre 10 et 20 ng/ml produisent un effet anesthésique chirurgical et une profonde dépression respiratoire.
Efficacité et sécurité clinique
Chez des patients cancéreux dont les douleurs chroniques étaient contrôlées par des administrations régulières de doses stables de morphiniques, une amélioration statistiquement significative a été observée sur la différence d’intensité de la douleur avec du fentanyl comparativement au placebo, dès 10 minutes après l’administration (voir figure 1 ci-dessous). La nécessité de recourir à un traitement analgésique de secours a été significativement réduite.
Figure 1. Différence moyenne d’intensité de la douleur par rapport à la situation initiale (± ET) pour du fentanyl comparée à un placebo (mesurée sur une échelle de Likert de 0 à 10)
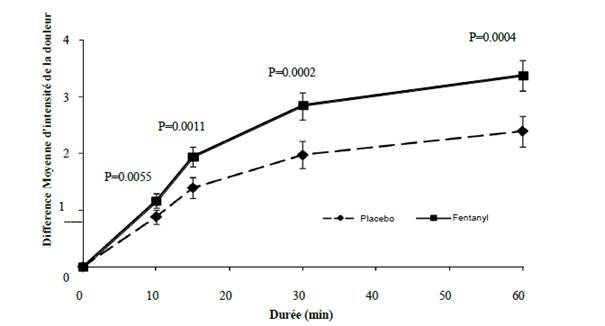
L’innocuité et l’efficacité du fentanyl ont été évaluées chez des patients prenant le médicament dès l’apparition de l’accès douloureux paroxystique. L’utilisation préventive du fentanyl dans les épisodes douloureux prévisibles n’a pas été étudiée dans les essais cliniques.
Comme tous les agonistes des récepteurs morphiniques µ, le fentanyl provoque une dépression respiratoire dose-dépendante. Le risque est plus élevé chez les sujets n’ayant jamais reçu de traitement morphinique que chez les patients souffrant de douleurs sévères ou recevant un traitement morphinique de fond. Le traitement prolongé par morphiniques entraîne généralement le développement d’une accoutumance à leurs effets secondaires.
Bien que les morphiniques augmentent en général la tonicité du muscle lisse urétral, l’effet global est variable, entraînant dans certains cas des urgences mictionnelles et dans d’autres cas une dysurie.
Les morphiniques augmentent la tonicité et réduisent les contractions péristaltiques du muscle lisse intestinal, prolongeant la durée du transit intestinal, pouvant ainsi être à l’origine de l’effet constipant du fentanyl.
Les morphiniques peuvent avoir une influence sur les axes hypothalamo-hypophyso-surrénalien ou -gonadique et être à l’origine de modifications telles qu’une augmentation de la prolactine sérique et une diminution du cortisol plasmatique et de la testostérone. Des signes et des symptômes cliniques peuvent découler de ces troubles hormonaux.
5.2. Propriétés pharmacocinétiques 
Absorption
FENTANYL SANDOZ se présente sous la forme de comprimé sublingual à dissolution rapide. Le fentanyl est absorbé rapidement, au cours des 30 minutes suivant l’administration de FENTANYL SANDOZ. La biodisponibilité absolue de FENTANYL SANDOZ est de 54 %. Les concentrations plasmatiques maximales moyennes de fentanyl sont comprises entre 0,2 et 1,3 ng/ml (après administration de 100 à 800 µg de FENTANYL SANDOZ). Elles sont obtenues respectivement en 22,5 et 240 minutes.
Distribution
Environ 80 à 85 % du fentanyl se lie aux protéines plasmatiques, essentiellement à l’α-1 glycoprotéine et dans une moindre mesure à l’albumine et aux lipoprotéines. Le volume de distribution du fentanyl à l’état d’équilibre est d’environ 3 à 6 l/kg.
Biotransformation
Le fentanyl est métabolisé en plusieurs métabolites pharmacologiquement inactifs, notamment en norfentanyl essentiellement sous l’effet du CYP3A4. Après administration intraveineuse de fentanyl, environ 75 % de la dose administrée est excrétée dans les urines dans les 72 heures, essentiellement sous forme de métabolites, moins de 10 % de la dose administrée reste sous forme inchangée. Environ 9 % de la dose prise est éliminée dans les fèces sous forme de métabolites.
Elimination
La clairance plasmatique totale du fentanyl est d’environ 0,5 l/h/kg.
Après administration de FENTANYL SANDOZ, la demi-vie d’élimination principale du fentanyl est d’environ 7 heures (3 à 12,5 heures) et sa demi-vie d’élimination terminale d’environ 20 heures (11,5 à 25 heures).
Linéarité/ non linéarité
Les paramètres pharmacocinétiques de FENTANYL SANDOZ sont dose-proportionnels pour la gamme de dosages disponibles (100 à 800 µg). Les études pharmacocinétiques ont montré qu’une dose composée de plusieurs comprimés est bioéquivalente à un comprimé unique de la dose équivalente.
Insuffisance hépatique ou insuffisance rénale
L’insuffisance hépatique ou rénale risque d’entraîner une augmentation des concentrations sériques. La clairance du fentanyl pourrait être réduite chez les patients âgés, cachectiques ou affaiblis, ce qui pourrait entraîner la prolongation de la demi-vie terminale du produit (voir rubriques 4.2 et 4.4).
5.3. Données de sécurité préclinique 
Des tests de mutagénicité bactérienne et chez le rongeur ont abouti à des résultats négatifs. Comme d'autres morphiniques, le fentanyl a fait preuve d’effets mutagènes in vitro sur des cellules de mammifères. Il semble improbable que l’utilisation thérapeutique entraîne un risque mutagène puisque les effets ont été induits uniquement à des concentrations très élevées.
Les études de carcinogénicité (test biologique alternatif par voie cutanée chez la souris transgéniques Tg.AC durant 26 semaines, étude de carcinogénicité par voie sous-cutanée chez le rat durant deux ans) avec le fentanyl n’ont pas révélé de résultats suggérant un potentiel oncogène.
L’analyse de coupes de cerveau provenant de l’étude de carcinogénicité réalisée chez le rat a montré des lésions cérébrales chez les animaux ayant reçu des doses élevées de citrate de fentanyl. La pertinence clinique de ces résultats chez l’Homme n’est pas connue.
3 ans.
6.4. Précautions particulières de conservation 
A conserver à une température ne dépassant pas 25°C.
A conserver dans l’emballage d'origine, à l’abri de l’humidité.
6.5. Nature et contenu de l'emballage extérieur 
Les comprimés sublinguaux sont conditionnés sous plaquettes unitaires prédécoupées avec sécurité enfant (PA/Aluminium/PVC//Aluminium/PET) insérées dans un étui en carton.
Boîte de 10 x 1 ou 30 x 1 comprimés.
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation 
Les déchets doivent être éliminés en toute sécurité.
Les patients et le personnel soignant doivent être incités à retourner tous les produits non utilisés à la pharmacie.
Tout produit non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE 
49, AVENUE GEORGES POMPIDOU
92300 LEVALLOIS-PERRET
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE 
· XXXX : 10 x 1 comprimés sous plaquettes unitaires prédécoupées avec sécurité enfant (PA/Aluminium/PVC//Aluminium/PET).
· 34009 302 059 9 0 : 30 x 1 comprimés sous plaquettes unitaires prédécoupées avec sécurité enfant (PA/Aluminium/PVC//Aluminium/PET).
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION 
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE 
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES 
Stupéfiant.
Prescription limitée à 28 jours.
Délivrance fractionnée de 7 jours maximum, sauf mention expresse « délivrance en une seule fois ».
Prescription sur ordonnance répondant aux spécifications fixées par l’arrêté du 31 mars 1999.
|
| Plan du site | Accessibilité | Contact | Téléchargement | Declaration de confidentialité | Service-Public.fr | Legifrance | Gouvernement.fr |