Dernière mise à jour le 08/01/2026
PHOXILIUM 1,2 mmol/L PHOSPHATE, solution pour hémodialyse et hémofiltration
Indications thérapeutiques
SOLUTIONS POUR HEMODIALYSE ET HEMOFILTRATION - code ATC : B05ZB
Phoxilium 1,2 mmol/l phosphate, solution pour hémodialyse et hémofiltration appartient au groupe des solutions pour hémofiltration et contient du chlorure de calcium dihydraté, du chlorure de magnésium hexahydraté, du chlorure de sodium, du bicarbonate de sodium, du chlorure de potassium, du phosphate disodique dihydraté.
Phoxilium 1,2 mmol/l phosphate, solution pour hémodialyse et hémofiltration est utilisé en traitements de soins intensifs dans les hôpitaux afin de corriger les déséquilibres chimiques du sang provoqués par une insuffisance rénale.
Les traitements, utilisés au cours de l'épuration extra-rénale continue, sont conçus pour éliminer les déchets accumulés dans le sang lorsque les reins ne fonctionnent plus.
La solution Phoxilium 1,2 mmol/l PHOSPHATE, solution pour hémodialyse et hémofiltration est utilisée pour traiter, plus particulièrement les patients gravement atteints d’insuffisance rénale aiguë et ayant :
· un taux normal de potassium dans le sang (kaliémie normale) ou
· un taux normal ou faible de phosphate dans le sang (phosphatémie normale ou hypophosphatémie).
Ce médicament peut également être utilisé dans les cas de d'empoisonnement ou d’intoxication par des substances dialysables ou filtrables.
Composition en substances actives
-
Petit compartiment (A) ( Composition pour 1000 ml de solution )
- > chlorure de calcium dihydraté 3,68 g
- > chlorure de magnésium hexahydraté 2,44 g
-
Grand compartiment (B) ( Composition pour 1000 ml de solution )
- > chlorure de sodium 6,44 g
- > bicarbonate de sodium 2,92 g
- > chlorure de potassium 0,314 g
- > phosphate disodique dihydraté 0,225 g
Présentations
> 2 poche(s) polyoléfine bicompartimenté(e)(s)/à 2 compartiments suremballée(s)/surpochée(s) de 250 ml (petit compartiment A) + 4750 ml (grand compartiment B)
Code CIP : 394 497-7 ou 34009 394 497 7 7
Déclaration de commercialisation : 25/06/2010
Cette présentation est agréée aux collectivités
Service médical rendu (SMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Important | Avis du 04/11/2009 | Inscription (CT) | Le service médical rendu par cette spécialité est important. |
Amélioration du service médical rendu (ASMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprés de la HAS (plus d'informations dans l'aide). Les avis et synthéses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur de l'ASMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| V (Inexistant) | Avis du 04/11/2009 | Inscription (CT) | Absence d'amélioration du service médical rendu (ASMR V). |
Autres informations
- Titulaire de l'autorisation : VANTIVE BELGIUM S.R.L.
- Conditions de prescription et de délivrance :
- liste I
- prescription hospitalière
- Statut de l'autorisation : Valide
- Type de procédure : Procédure décentralisée
- Code CIS : 6 411 905 6
ANSM - Mis à jour le : 07/08/2024
PHOXILIUM 1,2 mmol/L PHOSPHATE, solution pour hémodialyse et hémofiltration
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Phoxilium est présenté sous forme d’une poche à deux compartiments. La solution reconstituée prête à l’emploi est obtenue en cassant le cône sécable ou en ouvrant la soudure pelable, et en mélangeant les deux solutions.
AVANT RECONSTITUTION
1000 ml de solution du petit compartiment (A) contiennent:
Chlorure de calcium, 2 H2O.................................................................................................... 3,68 g
Chlorure de magnésium, 6 H2O................................................................................................ 2,44 g
1000 ml de solution du grand compartiment (B) contiennent:
Chlorure de sodium................................................................................................................ 6,44 g
Bicarbonate de sodium........................................................................................................... 2,92 g
Chlorure de potassium.......................................................................................................... 0,314 g
Phosphate disodique, 2 H2O................................................................................................. 0,225 g
APRÈS RECONSTITUTION
1000 ml de solution reconstituée contiennent :
|
Principes actifs |
mmol/l |
mEq/l |
|
Calcium Ca2+ |
1,25 |
2,50 |
|
Magnésium Mg2+ |
0,600 |
1,20 |
|
Sodium Na+ |
140,0 |
140,0 |
|
Chlorure Cl- |
115,9 |
115,9 |
|
Phosphate d’hydrogène HPO42- |
1,20 |
2,40 |
|
Bicarbonate HCO3- |
30,0 |
30,0 |
|
Potassium K+ |
4,00 |
4,00 |
La solution finale reconstituée de 1000 ml correspond à 50 ml de solution A et 950 ml de solution B.
Pour la liste complète des excipients, voir rubrique 6.1.
Solution pour hémodialyse et hémofiltration.
Solutions limpides et incolores.
Osmolarité théorique : 293 mOsm/l
pH de solution reconstituée : 7 - 8,5
4.1. Indications thérapeutiques
Phoxilium 1,2 mmol/l PHOSPHATE, solution pour hémodialyse et hémofiltration est utilisé au cours de l'épuration extra-rénale continue (EERC) chez les patients gravement atteints d'insuffisance rénale aiguë (IRA) dont le pH et la kaliémie sont redevenus normaux et qui ont besoin d’un apport complémentaire en phosphate pour compenser la perte de phosphate dans l’ultrafiltrat ou dans le dialysat au cours de l’EERC.
PHOXILIUM 1,2 mmol/l PHOSPHATE, solution pour hémodialyse et hémofiltration peut également être utilisé dans les cas de d'empoisonnement ou d’intoxication par des substances dialysables ou filtrables.
PHOXILIUM 1,2 mmol/l PHOSPHATE, solution pour hémodialyse et hémofiltration est indiquée chez les patients normakaliémiques et ayant une phosphatémie normale ou une hypophosphatémie.
4.2. Posologie et mode d'administration
Le volume et le débit d'administration de PHOXILIUM 1,2 mmol/l PHOSPHATE, solution pour hémodialyse et hémofiltration dépendent de la concentration en phosphate et autres électrolytes dans le sang, de l'équilibre acido-basique, de l’équilibre hydrique et de l’état clinique général du patient. De plus, le volume de la solution de substitution et/ou celui du dialysat à administrer dépendent de l’intensité (dose) du traitement souhaitée. L'administration de PHOXILIUM 1,2 mmol/l PHOSPHATE, solution pour hémodialyse et hémofiltration (dose, débit de perfusion et volume cumulatif) doit être définie uniquement par un médecin expérimenté dans les soins intensifs et les traitements d’épuration extra-rénale continue (EERC).
Par conséquent, le volume à administrer est à l’appréciation du médecin traitant.
Les débits de la solution de substitution pour l’hémofiltration et l’hémodiafiltration sont :
Adultes : 500 - 3000 ml/heure
Les débits de dialysat pour l’hémodialyse continue et l’hémodiafiltration continue sont:
Adultes : 500 - 2500 ml/heure
Les débits totaux combinés usuels utilisés chez l’adulte pour les traitements d’EERC (solution de substitution et dialysat) sont environ de 2000 à 2500 ml/h, ce qui correspond à un volume quotidien de solution d'approximativement 48 à 60 litres.
Population pédiatrique
Chez les enfants (nouveau-nés jusqu’aux enfants de moins de 18 ans), le débit de la solution de substitution pour une hémofiltration et une hémodiafiltration et le débit de la solution de dialyse (dialysat) pour une hémodialyse continue et hémodiafiltration continue doivent être compris entre 1000 et 4000 ml/h/1,73 m2.
Chez les adolescents âgés de 12 à 18 ans, la recommandation posologique des adultes doit être appliquée lorsque la dose pédiatrique calculée dépasse la dose maximale recommandée pour les adultes.
Mode d’administration
Voie intraveineuse et pour hémodialyse.
PHOXILIUM 1,2 mmol/l PHOSPHATE, solution pour hémodialyse et hémofiltration, lorsqu’il est utilisé en tant que solution de substitution, est administré dans le circuit extracorporel en amont (pré-dilution) ou en aval (post-dilution) de l’hémofiltre ou l’hémodiafiltre.
PHOXILIUM 1,2 mmol/l PHOSPHATE, solution pour hémodialyse et hémofiltration, lorsqu'il est utilisé en tant que dialysat, est administré dans le compartiment dialysat du filtre extracorporel séparé du flux sanguin par une membrane semi-perméable.
Pour les instructions concernant la reconstitution du médicament avant administration, voir la rubrique 6.6.
Contre-indications liées à la solution :
· Hyperkaliémie
· Alcalose métabolique
· Hyperphosphatémie
Contre-indications liées à la technique d’hémofiltration/dialyse :
· Insuffisance rénale associée à un état d'hypercatabolisme prononcé, si les symptômes urémiques ne peuvent pas être corrigés par hémofiltration ou hémodiafiltration.
· Pression artérielle insuffisante au niveau des accès vasculaires,
· Anticoagulation systémique si le risque hémorragique est élevé.
4.4. Mises en garde spéciales et précautions d'emploi
La solution doit seulement être utilisée par ou sous la responsabilité d’un médecin qualifié dans les traitements EERC utilisant les techniques d’hémofiltration, d'hémodiafiltration et d’hémodialyse.
Attention :
La solution Phoxilium ne doit pas être utilisée chez les patients présentant une hyperkaliémie (voir rubrique 4.3). La concentration sérique en potassium doit être surveillée avant et pendant l’hémofiltration et/ou l’hémodialyse.
La solution Phoxilium contenant du potassium, une hyperkaliémie transitoire peut survenir après le début du traitement. Réduire le débit de perfusion et vérifier l'obtention de la concentration de potassium désirée. Si l'hyperkaliémie persiste, interrompre rapidement l'administration.
En cas d’apparition d’une hyperkaliémie pendant l’utilisation de Phoxilium comme dialysat, l’administration d’un dialysat sans potassium pourra être nécessaire pour accroître l’élimination du potassium.
La solution Phoxilium contenant du phosphate, une hyperphosphatémie transitoire peut survenir après le début du traitement. Réduire le débit de perfusion et vérifier l'obtention de la concentration de phosphate désirée. Si l'hyperphosphatémie persiste, interrompre rapidement l'administration (voir rubrique 4.3 Contre-indications).
Les paramètres électrolytiques et acido-basiques du sang doivent être contrôlés régulièrement chez les patients traités par Phoxilium. Phoxilium contient du phosphate d'hydrogène, un acide faible qui peut influencer l'équilibre acido-basique du patient. Si une acidose métabolique se développe ou s'aggrave pendant le traitement par Phoxilium, il est possible que le débit de perfusion doive être réduit ou que son administration doive être interrompue.
Étant donné que la solution Phoxilium ne contient pas de glucose, l’administration peut causer une hypoglycémie. La glycémie doit être régulièrement surveillée chez les patients diabétiques (en particulier chez ceux recevant de l’insuline ou d’autres médicaments hypoglycémiants), mais également chez les patients non diabétiques, notamment en raison du risque d’hypoglycémie silencieuse pendant la procédure. En cas d’hypoglycémie, l’utilisation d’une solution contenant du glucose doit être considérée. D’autres mesures correctives pourront être nécessaires pour maintenir la glycémie au niveau souhaité.
Le mode d'emploi (voir rubrique 6.6) doit être suivi scrupuleusement.
Les solutions des deux compartiments doivent être mélangées avant l'utilisation.
L'utilisation d'une solution contaminée peut entraîner une septicémie et un choc.
Ne pas utiliser la solution si le mélange n’est pas limpide. La connexion/ déconnexion de la ligne à la poche PHOXILIUM 1,2 mmol/l PHOSPHATE, solution pour hémodialyse et hémofiltration doit être effectuée de manière aseptique.
Seul un équipement approprié pour les techniques d’épuration extra-rénale extracorporelle doit être utilisé.
Précautions spéciales d’emploi
PHOXILIUM 1,2 mmol/l PHOSPHATE, solution pour hémodialyse et hémofiltration peut être réchauffée à 37°C pour le confort du patient. Le réchauffement de la solution avant l’utilisation doit être effectué avant la reconstitution, exclusivement avec une chaleur sèche. Les solutions ne doivent pas être réchauffées au bain-marie ni au four à micro-ondes. PHOXILIUM 1,2 mmol/l PHOSPHATE, solution pour hémodialyse et hémofiltration doit être inspectée visuellement afin de détecter toute présence de particules ou de décoloration avant l'administration, si la solution et le conteneur le permettent. N'administrer que si la solution est limpide et la soudure intacte.
Pendant toute la durée du traitement, l'hémodynamique, l’état hydrique, l’équilibre électrolytique et l'équilibre acido-basique du patient doivent être surveillés attentivement, y compris toutes les entrées et sorties de liquide, même si elles ne sont pas directement liées à l'EERC.
En cas d’hypervolémie, le débit net d’ultrafiltration prescrit pour l’équipement d’EERC peut être augmenté et/ou le débit d’administration des solutions autres que la solution de substitution et/ou le dialysat peut être diminué.
En cas d’hypovolémie, le débit net d’ultrafiltration prescrit pour l’équipement d’EERC peut être réduit et/ou le débit d’administration des solutions autres que la solution de substitution et/ou le dialysat peut être augmenté.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Des interactions avec d’autres médicaments peuvent être évitées par un dosage approprié de la solution pour l’hémofiltration et l’hémodialyse.
Cependant les interactions médicamenteuses suivantes peuvent se produire avec PHOXILIUM 1,2 mmol/l PHOSPHATE, solution pour hémodialyse et hémofiltration :
· Sources supplémentaires de phosphate (p. ex. liquides d'hyperalimentation), car elles peuvent influencer la concentration sérique de phosphate et augmenter le risque d'hyperphosphatémie.
· La vitamine D et ses analogues, ainsi que les médicaments contenant du calcium (par exemple, le chlorure de calcium ou le gluconate de calcium utilisé pour le maintien de l'homéostasie calcique chez les patients sous EERC et anticoagulation au citrate), car ils peuvent augmenter le risque d’hypercalcémie.
· Tout ajout de bicarbonate de sodium (ou source de tampon) dans les liquides d'EERC ou d'autres liquides peut augmenter le risque d’alcalose métabolique.
· Lorsque du citrate est utilisé comme anticoagulant, il est inclus dans le volume total de tampon et peut réduire les concentrations plasmatiques de calcium.
4.6. Fertilité, grossesse et allaitement
Fertilité
Aucun effet sur la fertilité n’est attendu dans la mesure où le calcium, le sodium, le potassium, le magnésium, le chlorure, le phosphate d'hydrogène et le bicarbonate sont des constituants normaux de l'organisme.
Grossesse et allaitement
Il n’existe pas de donnée clinique documentée concernant l’utilisation de PHOXILIUM 1,2 mmol/l PHOSPHATE, solution pour hémodialyse et hémofiltration pendant la grossesse et l’allaitement. PHOXILIUM 1,2 mmol/l PHOSPHATE, solution pour hémodialyse et hémofiltration ne doit être administrée à la femme enceinte ou qui allaite que si c’est absolument nécessaire.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Certains effets indésirables peuvent avoir pour origine la solution utilisée ou le traitement.
Les solutions d’hémofiltration et d’hémodialyse avec tampon bicarbonate sont généralement bien tolérées.
Les effets indésirables suivants ont été rapportés après la commercialisation. Le tableau suivant présente les effets indésirables selon les classes de systèmes d'organes MedDRA (CSO et terme préféré). Les fréquences ne peuvent être estimées sur la base des données disponibles.
|
Classe de systèmes d'organes MedDRA |
Terme préféré |
Fréquence |
|
Troubles du métabolisme et de la nutrition |
Déséquilibres électrolytiques, p. ex. hyperphosphatémie |
fréquence indéterminée |
|
Déséquilibre liquidien, p. ex. hypervolémie, hypovolémie |
fréquence indéterminée |
|
|
|
Troubles de l'équilibre acido-basique, p. ex. acidose métabolique, alcalose métabolique |
fréquence indéterminée |
|
Affections vasculaires |
Hypotension* |
fréquence indéterminée |
|
Affections gastro-intestinales |
Nausées* |
fréquence indéterminée |
|
|
Vomissements* |
fréquence indéterminée |
|
Affections musculo-squelettiques et systémiques |
Crampes musculaires* |
fréquence indéterminée |
*Effets indésirables généralement liés aux traitements par dialyse.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/.
Un surdosage avec PHOXILIUM 1,2 mmol/l PHOSPHATE, solution pour hémodialyse et hémofiltration ne peut pas survenir si la procédure est conduite correctement et si la balance hydro-électrolytique et l'équilibre acido-basique du patient sont surveillés attentivement par du personnel médical qualifié.
Un surdosage en PHOXILIUM 1,2 mmol/l PHOSPHATE, solution pour hémodialyse et hémofiltration peut toutefois provoquer une affection clinique sévère, comme une insuffisance cardiaque congestive, des troubles liés aux électrolytes ou à l’équilibre acido-basique.
En cas d'hypervolémie ou d'hypovolémie, les instructions de prise en charge de l'hypervolémie ou de l'hypovolémie à la rubrique 4.4 doivent être scrupuleusement suivies.
En cas d'acidose métabolique et/ou d'hyperphosphatémie, interrompre rapidement l'administration. Il n'existe aucun antidote spécifique au surdosage. Le risque peut être limité par une surveillance étroite pendant le traitement (voir rubriques 4.3 et 4.4).
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : SOLUTIONS POUR HEMODIALYSE ET HEMOFILTRATION
Code ATC : B05ZB
PHOXILIUM 1,2 mmol/l PHOSPHATE, solution pour hémodialyse et hémofiltration, est inactive sur le plan pharmacologique. Les ions sodium, calcium, magnésium, potassium, phosphate et chlorure sont présents à des concentrations similaires aux concentrations physiologiques du plasma.
PHOXILIUM 1,2 mmol/l PHOSPHATE, solution pour hémodialyse et hémofiltration est utilisé pour remplacer l’eau et les électrolytes éliminés lors de l’hémofiltration et de l’hémodiafiltration ou pour servir de dialysat approprié pendant l’hémodiafiltration continue ou l’hémodialyse continue.
Le bicarbonate est utilisé comme tampon alcalinisant.
5.2. Propriétés pharmacocinétiques
Non concerné. Les principes actifs de PHOXILIUM 1,2 mmol/l PHOSPHATE, solution pour hémodialyse et hémofiltration sont inactifs sur le plan pharmacologique et sont présents à des concentrations similaires aux concentrations physiologiques du plasma.
5.3. Données de sécurité préclinique
Aucune donnée pertinente à signaler d’après les conclusions précliniques. Les principes actifs sont inactifs sur le plan pharmacologique et sont présents à des concentrations similaires aux niveaux physiologiques du plasma.
Eau pour préparations injectables
Acide chlorhydrique (pour l’ajustement du pH)
Grand compartiment B :
Eau pour préparations injectables
Dioxyde de carbone (pour l’ajustement du pH)
En l’absence d’étude de compatibilité, ce médicament ne doit pas être mélangé avec d’autres médicaments.
18 mois
Après reconstitution :
La stabilité physico-chimique de la solution reconstituée a été démontrée pendant 24 heures à 22°C. Si la solution n’est pas utilisée immédiatement, les durées et conditions de conservation avant utilisation relèvent de la seule responsabilité de l’utilisateur et ne devraient pas dépasser 24 heures, incluant la durée du traitement.
6.4. Précautions particulières de conservation
A conserver entre + 4°C et + 30°C. Ne pas mettre au réfrigérateur. Ne pas congeler.
Pour les conditions de conservation du médicament après reconstitution, voir la rubrique 6.3.
6.5. Nature et contenu de l'emballage extérieur
L’emballage en polychlorure de vinyle (PVC) ou en polyoléfine se présente sous la forme d’une poche à deux compartiments. La poche de 5000 ml se compose d’un petit compartiment (250 ml) et d’un grand compartiment (4750 ml). Les deux compartiments sont séparés par un cône sécable ou une soudure pelable.
Le grand compartiment B comporte un connecteur d'injection (ou site d’injection trocardable) en polycarbonate (PC), avec une gomme en caoutchouc recouverte d'un bouchon, ainsi que d’un connecteur luer (PC) muni d’un cône sécable (PC) ou d'une valve en caoutchouc de silicone permettant de connecter la poche à la ligne de solution de réinjection ou de dialyse adaptée.
La poche est suremballée dans un emballage transparent en copolymère multicouches.
Chaque poche à deux compartiments contient 5000 mL.
Conditionnement : 2 poches de 5000 ml dans un carton.
6.6. Précautions particulières d’élimination et de manipulation
La solution du petit compartiment A est ajoutée à la solution du grand compartiment B après rupture du cône sécable ou ouverture de la soudure pelable, immédiatement avant utilisation. La solution reconstituée doit être limpide et incolore.
Une notice comportant les instructions détaillées d’utilisation est jointe dans le carton.
Une technique aseptique rigoureuse doit être respectée tout au long de la manipulation et de l’administration de la solution au patient.
A n’utiliser que si le suremballage est intact. Toutes les soudures doivent être intactes, le cône sécable ou la soudure pelable ne doit pas être brisée et la solution doit être limpide. Appuyer fermement sur la poche pour vérifier l'absence de fuite. En cas de fuite, jetez immédiatement la solution, car la stérilité ne peut plus être garantie.
Le grand compartiment B comporte un site d’injection pour l’ajout éventuel d’autres médicaments nécessaires après la reconstitution de la solution. Il est de la responsabilité de l’utilisateur de juger de la compatibilité d’un médicament à ajouter avec PHOXILIUM en vérifiant l’apparition d’éventuel changement de couleur et/ou de précipités, de complexes insolubles ou de cristaux. Avant d’ajouter un médicament, vérifiez sa solubilité et sa stabilité dans PHOXILIUM, et s’assurer de l’adéquation du pH de PHOXILIUM (le pH de la solution reconstituée est de 7,0– 8,5). Il est possible que les additifs soient incompatibles. La notice d’utilisation relative au médicament à ajouter doit être consultée.
Retirez tout liquide du site d’injection, tenez la poche à l'envers, injectez le médicament par le site d’injection et mélangez soigneusement. L’introduction et le mélange d’additifs doit toujours être effectué avant de connecter la poche de solution au circuit extracorporel. La solution doit être administrée immédiatement.
Si les deux compartiments de la poche sont séparés par un cône sécable et qu’un cône sécable est situé dans le connecteur luer, suivre les instructions suivantes :
I Retirer l’emballage de protection de la poche immédiatement avant usage et jeter tout autre emballage. Casser le cône sécable séparant les deux compartiments de la poche. Le cône sécable reste dans la poche.
II Vérifier que toute la solution du petit compartiment A s'écoule correctement dans le grand compartiment B.
III Rincer le petit compartiment A à deux reprises en refoulant par pression la solution mélangée dans le petit compartiment A, puis à nouveau dans le grand compartiment B.
IV Lorsque le petit compartiment A est vide, agiter le grand compartiment B afin de parfaire le mélange. La solution est alors prête à l'emploi et la poche peut être suspendue à l’équipement.
V La ligne de dialyse ou de réinjection peut être connectée à l’un des deux connecteurs de la poche
Va Si le connecteur luer de la poche est utilisé, employer une méthode aseptique pour retirer le bouchon du luer et visser le connecteur luer lock mâle de la ligne de dialyse ou de solution de réinjection sur le connecteur luer femelle de la poche : serrer. À l’aide des deux mains, casser le cône sécable bleu à sa base avec un mouvement de va-et-vient. N’utiliser aucun instrument. Vérifier que le cône est complètement détaché et que la solution s’écoule librement. Le cône reste dans le site luer en cours de traitement.
Vb Si le port d’injection est utilisé, ôter d’abord la capsule le protégeant. Le port d’injection est désinfectable. Introduire ensuite le perforateur à travers la gomme en caoutchouc. Vérifier que la solution s’écoule librement.
Si les deux compartiments de la poche sont séparés par un cône sécable et qu'une valve est située dans le connecteur luer, suivre les instructions suivantes:
I Retirer l’emballage de protection de la poche immédiatement avant usage et jeter tout autre emballage. Casser le cône sécable séparant les deux compartiments de la poche. Le cône sécable reste dans la poche.
II Vérifier que toute la solution du petit compartiment A s'écoule correctement dans le grand compartiment B.
III Rincer le petit compartiment A à deux reprises en refoulant par pression la solution mélangée dans le petit compartiment A, puis à nouveau dans le grand compartiment B.
IV Lorsque le petit compartiment A est vide, agiter le grand compartiment B afin de parfaire le mélange. La solution est alors prête à l'emploi et la poche peut être suspendue à l’équipement.
V La ligne de dialyse ou de réinjection peut être connectée à l’un des deux connecteurs de la poche.
Va Si le connecteur luer de la poche est utilisé, ôter le bouchon du luer en le tournant et en le tirant et visser le connecteur luer lock mâle de la ligne de dialyse ou de réinjection sur le connecteur luer femelle de la poche en le poussant et en le tournant. Vérifier que la connexion est sûre et serrer. Le connecteur est désormais ouvert. Vérifier que la solution s’écoule librement.
Lorsque la ligne de dialysat ou de réinjection est déconnectée du connecteur luer, ce dernier se ferme et l’écoulement de la solution s'arrête. Le connecteur luer ne nécessite pas d’aiguille et est désinfectable.
Vb Si le port d’injection est utilisé, ôter d’abord la capsule le protégeant. Le port d’injection est désinfectable. Introduire ensuite le perforateur à travers la gomme en caoutchouc. Vérifier que la solution s’écoule librement.
Si les deux compartiments de la poche sont séparés par une soudure pelable et qu'une valve est située dans le connecteur luer, suivre les instructions suivantes:
I Retirer l’emballage de protection de la poche immédiatement avant usage et jeter tout autre emballage. Ouvrir la soudure en tenant le petit compartiment des deux mains et en le pressant jusqu'à ce qu'une ouverture se crée dans la soudure pelable située entre les deux compartiments.
II Appuyer à l’aide des deux mains sur le grand compartiment jusqu’à ce que la soudure pelable située entre les deux compartiments soit complètement ouverte.
III Agiter délicatement la poche pour parfaire le mélange de la solution. La solution est alors prête à l'emploi et la poche peut être suspendue à l’équipement.
IV La ligne de dialyse ou de réinjection peut être connectée à l’un des deux connecteurs de la poche.
IVa Si le connecteur luer de la poche est utilisé, ôter le bouchon du luer en le tournant et en le tirant et visser le connecteur luer lock mâle de la ligne de dialyse ou de réinjection sur le connecteur luer femelle de la poche en le poussant et en le tournant. Vérifier que la connexion est sûre et serrer. Le connecteur est désormais ouvert. Vérifier que la solution s’écoule librement.
Lorsque la ligne de dialyse ou de réinjection est déconnectée du connecteur luer, ce dernier se ferme et l’écoulement de la solution s'arrête. Le connecteur luer ne nécessite pas d’aiguille et est désinfectable.
IVb Si le port d’injection est utilisé, ôter d’abord la capsule le protégeant. Le port d’injection est désinfectable. Introduire ensuite le perforateur à travers la gomme en caoutchouc. Vérifier que la solution s’écoule librement.
La solution reconstituée doit être administrée immédiatement. Si elle n’est pas utilisée immédiatement, elle doit l’être sous les 24 heures, durée du traitement comprise, après l'ajout de la solution A à la solution B.
La solution reconstituée est à usage unique.
Les quantités de solution non utilisées doivent être jetées immédiatement après emploi.
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
BOULEVARD D'ANGLETERRE 2
1420 BRAINE-L'ALLEUD
BELGIQUE
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 394 496 0 9 : 250 ml (Petit compartiment A) (poche PVC) + 4750 ml (Grand compartiment B) (poche PVC) ; boîte de 2
· 34009 394 497 7 7 : 250 ml (Petit compartiment A) (poche Polyoléfine) + 4750 ml (Grande compartiment B) (poche Polyoléfine) ; boîte de 2.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Liste I.
Médicament soumis à prescription hospitalière.
ANSM - Mis à jour le : 07/08/2024
PHOXILIUM 1,2 mmol/L PHOSPHATE, solution pour hémodialyse et hémofiltration
Chlorure de calcium dihydraté, chlorure de magnésium hexahydraté, chlorure de sodium, bicarbonate de sodium, chlorure de potassium, phosphate disodique dihydraté
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin, votre pharmacien ou votre infirmier/ère.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, votre pharmacien ou votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu’est-ce que PHOXILIUM 1,2 mmol/l PHOSPHATE, solution pour hémodialyse et hémofiltration et dans quel cas est-il utilisé ?
2. Quelles sont les informations à connaître avant de recevoir PHOXILIUM 1,2 mmol/l PHOSPHATE, solution pour hémodialyse et hémofiltration ?
3. Comment utiliser PHOXILIUM 1,2 mmol/l PHOSPHATE, solution pour hémodialyse et hémofiltration ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver PHOXILIUM 1,2 mmol/l PHOSPHATE, solution pour hémodialyse et hémofiltration ?
6. Contenu de l'emballage et autres informations
1. QU’EST-CE QUE PHOXILIUM 1,2 mmol/L PHOSPHATE, solution pour hémodialyse et hémofiltration ET DANS QUELS CAS EST-IL UTILISE ?
SOLUTIONS POUR HEMODIALYSE ET HEMOFILTRATION - code ATC : B05ZB
Phoxilium 1,2 mmol/l phosphate, solution pour hémodialyse et hémofiltration appartient au groupe des solutions pour hémofiltration et contient du chlorure de calcium dihydraté, du chlorure de magnésium hexahydraté, du chlorure de sodium, du bicarbonate de sodium, du chlorure de potassium, du phosphate disodique dihydraté.
Phoxilium 1,2 mmol/l phosphate, solution pour hémodialyse et hémofiltration est utilisé en traitements de soins intensifs dans les hôpitaux afin de corriger les déséquilibres chimiques du sang provoqués par une insuffisance rénale.
Les traitements, utilisés au cours de l'épuration extra-rénale continue, sont conçus pour éliminer les déchets accumulés dans le sang lorsque les reins ne fonctionnent plus.
La solution Phoxilium 1,2 mmol/l PHOSPHATE, solution pour hémodialyse et hémofiltration est utilisée pour traiter, plus particulièrement les patients gravement atteints d’insuffisance rénale aiguë et ayant :
· un taux normal de potassium dans le sang (kaliémie normale) ou
· un taux normal ou faible de phosphate dans le sang (phosphatémie normale ou hypophosphatémie).
Ce médicament peut également être utilisé dans les cas de d'empoisonnement ou d’intoxication par des substances dialysables ou filtrables.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER PHOXILIUM 1,2 mmol/L PHOSPHATE, solution pour hémodialyse et hémofiltration ?
N’utilisez pas PHOXILIUM 1,2 mmol/l PHOSPHATE, solution pour hémodialyse et hémofiltration dans l’un des trois cas suivants :
· une concentration élevée de potassium dans le sang (hyperkaliémie)
· une concentration élevée de bicarbonate dans le sang (alcalose métabolique)
· une concentration élevée de phosphate dans le sang (hyperphosphatémie)
N’utilisez pas le traitement par hémodialyse ou hémofiltration dans les trois cas suivants :
· lorsque l’hémofiltration ne peut corriger les symptômes entrainés par un taux d’urée élevé dans le sang (symptômes urémiques) provoqué par une insuffisance rénale associée à un état d'hypercatabolisme prononcé (augmentation anormale de la dégradation des substances).
· en cas de pression artérielle insuffisante au niveau des accès vasculaires,
· en cas de coagulation sanguine réduite (anticoagulation systémique), si le risque d’hémorragie est élevé.
Avertissements et précautions
Adressez-vous à votre médecin, pharmacien ou infirmier/ère avant d’utiliser PHOXILIUM 1,2 mmol/L PHOSPHATE, solution pour hémodialyse et hémofiltration
Avant et pendant le traitement, la composition de votre sang sera contrôlée dont notamment l’équilibre acido-basique et les concentrations des sels dans le sang (électrolytes), y compris toutes les entrées (perfusion intraveineuse) et sorties (urine) de liquide, même celles qui ne sont pas directement liées au traitement.
Autres médicaments et PHOXILIUM 1,2 mmol/l PHOSPHATE, solution pour hémodialyse et hémofiltration
Informez votre médecin ou pharmacien si vous prenez, avez récemment pris ou pourriez prendre tout autre médicament. En effet, la concentration sanguine de certains de vos médicaments peut influencer le traitement avec PHOXILIUM 1,2 mmol/L PHOSPHATE, solution pour hémodialyse et hémofiltration Votre médecin décidera s'il convient de modifier votre prescription.
En particulier, informez votre médecin si vous utilisez l’une des substances suivantes :
· Sources supplémentaires de phosphate (p. ex. liquides nutritionnels), car elles peuvent augmenter le risque d'une concentration élevée de phosphate dans le sang (hyperphosphatémie) ;
· Vitamine D et les médicaments contenant du chlorure de calcium ou du gluconate de calcium, car ils peuvent augmenter le risque d’une concentration élevée de calcium dans le sang (hypercalcémie).
· Bicarbonate de sodium car il peut augmenter le risque d’une concentration excessive de bicarbonate dans votre sang (alcalose métabolique).
· Du citrate utilisé comme anticoagulant, car il peut réduire les concentrations plasmatiques de calcium.
Grossesse, allaitement et fertilité
Grossesse et allaitement :
Il n’existe pas d’information clinique documentée concernant l’utilisation de ce médicament pendant la grossesse et la lactation. Ce médicament ne doit être administré à la femme enceinte ou qui allaite que si c’est absolument nécessaire.
Fertilité :
Aucun effet sur la fertilité n’est attendu dans la mesure où le calcium, le sodium, le potassium, le magnésium, le chlorure, le phosphate d’hydrogène et le bicarbonate sont des constituants normaux de l’organisme.
Conduite de véhicules et utilisation de machines
PHOXILIUM 1,2 mmol/l PHOSPHATE, solution pour hémodialyse et hémofiltration n’a aucun effet sur la capacité à conduire un véhicule ou à utiliser des machines.
3. COMMENT UTILISER PHOXILIUM 1,2 mmol/l PHOSPHATE, solution pour hémodialyse et hémofiltration ?
PHOXILIUM 1,2 mmol/l PHOSPHATE, solution pour hémodialyse et hémofiltration peut être administré directement dans le circuit sanguin (voie intraveineuse) à l’aide d’un appareil d’EERC ou utilisé en hémodialyse, où la solution circule d’un côté d’une membrane de dialyse tandis que le sang circule de l’autre côté.
Veillez à toujours utiliser ce médicament en suivant exactement les indications de votre médecin, pharmacien ou infirmier/ère. Vérifiez auprès de votre médecin, pharmacien ou infirmier/ère en cas de doute.
Pour le mode d’emploi, veuillez-vous reporter à la rubrique « Les informations suivantes sont destinées exclusivement aux professionnels de la santé ».
Si vous avez utilisé plus de PHOXILIUM 1,2 mmol/l PHOSPHATE, solution pour hémodialyse et hémofiltration que vous n'auriez dû
PHOXILIUM 1,2 mmol/l PHOSPHATE, solution pour hémodialyse et hémofiltration est un médicament réservé à l’usage hospitalier et devant être administré uniquement par des professionnels de la santé surveillant attentivement votre balance hydrique et votre bilan sanguin.
Il est donc peu probable d’utiliser plus de Phoxilium 1,2 mmol/l phosphate, solution pour hémodialyse et hémofiltration que vous n'auriez dû.
Toutefois dans le cas peu probable d’un surdosage, votre médecin prendra les mesures qui s’imposent et ajustera votre traitement.
Un surdosage peut provoquer une surcharge hydrique, une réduction de la concentration plasmatique de bicarbonate (acidose métabolique) et/ou une concentration élevée de phosphate (hyperphosphatémie) si vous souffrez d’insuffisance rénale.
Il peut avoir des conséquences graves, comme une insuffisance cardiaque congestive ou des troubles de votre bilan sanguin.
Si vous avez d’autres questions sur l’utilisation de ce médicament, demandez plus d’informations à votre médecin ou à votre pharmacien.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Les trois effets indésirables suivants peuvent être associés à l’utilisation de Phoxilium 1,2 mmol/l phosphate, solution pour hémodialyse et hémofiltration :
· volume d’eau dans le corps anormalement élevé ou faible (hyper ou hypovolémie),
· modification des concentrations de sels dans le sang (déséquilibre électrolytique tel que l'hyperphosphatémie),
· élévation de la concentration plasmatique de bicarbonate dans le sang (alcalose métabolique) ou réduction de la concentration plasmatique de bicarbonate (acidose métabolique)
D’autres effets indésirables peuvent être liés aux traitements par dialyse, par exemple :
· nausées, vomissements, crampes musculaires et tension artérielle basse (hypotension).
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien ou à votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER phoxilium 1,2 mmol/l phosphate, solution pour hémodialyse et hémofiltration ?
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur la poche et sur l’emballage. La date de péremption fait référence au dernier jour de ce mois.
A conserver entre + 4°C et + 30°C. Ne pas mettre au réfrigérateur. Ne pas congeler.
La stabilité physico-chimique de la solution reconstituée a été démontrée pendant 24 heures à 22°C. Si la solution n’est pas utilisée immédiatement, les durées et conditions de conservation avant utilisation relèvent de la seule responsabilité de l’utilisateur et ne devraient pas dépasser 24 heures, incluant la durée du traitement.
N’utilisez pas ce médicament si la solution est trouble ou si le suremballage est endommagé. Toutes les soudures doivent être intactes.
Ne jetez aucun médicament au tout-à-l’égout ni avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient PHOXILIUM 1,2 mmol/l PHOSPHATE, solution pour hémodialyse et hémofiltration
· Les substances actives avant et après mélange (reconstitution) sont :
AVANT RECONSTITUTION
1000 ml de solution du petit compartiment (A) contiennent:
Chlorure de calcium, 2 H2O.............................................................................................. 3,68 g
Chlorure de magnésium, 6 H2O......................................................................................... 2,44 g
1000 ml de solution du grand compartiment (B) contiennent:
Chlorure de sodium.......................................................................................................... 6,44 g
Bicarbonate de sodium..................................................................................................... 2,92 g
Chlorure de potassium.................................................................................................... 0,314 g
Phosphate disodique, 2 H2O.......................................................................................... 0,225 g
APRES RECONSTITUTION (A+B)
Les solutions des compartiments A (250 ml) et B (4750 ml) sont mélanges afin d’obtenir une solution reconstituée (5000ml) dont la composition est la suivante :
Calcium, Ca2+....................................................................................................................................................................................................................... 1,25 mmol/l
Magnesium, Mg2+............................................................................................................................................................................................................... 0,6 mmol/l
Sodium, Na+............................................................................................................................................................................................................................ 140 mmol/l
Chloride, Cl-........................................................................................................................................................................................................................ 115,9 mmol/l
Bicarbonate, HCO3-............................................................................................................................................................................................................ 30 mmol/l
Potassium, K+.............................................................................................................................................................................................................................. 4 mmol/l
Phosphate d’hydrogène, HPO42-.................................................................................................................................................................... 1,2 mmol/l
Osmolarité théorique: 293 mOsm/l
· Les autres composants sont :
Dioxyde de carbone (pour ajustement du pH) E290
Acide chlorhydrique (pour ajustement du pH) E507
Eau pour préparations injectables.
PHOXILIUM 1,2 mmol/l PHOSPHATE, solution pour hémodialyse et hémofiltration est une solution pour hémodialyse et hémofiltration présentée dans une poche à deux compartiments. La solution reconstituée prête à l’emploi est obtenue en cassant le cône sécable ou la soudure pelable et en mélangeant les deux solutions. La solution reconstituée est limpide et incolore. Chaque poche (A+B) contient 5 000 ml de solution pour hémodialyse et hémofiltration. Cette poche est suremballée dans un emballage transparent.
Chaque boîte contient deux poches et une notice.
Titulaire de l’autorisation de mise sur le marché
vantive belgium srl
BOULEVARD D'ANGLETERRE 2
1420 BRAINE-L'ALLEUD
BELGIQUE
Exploitant de l’autorisation de mise sur le marché
VANTIVE SAS
IMMEUBLE BERLIOZ
4 BIS RUE DE LA REDOUTE
78280 GUYANCOURT
BIEFFE MEDITAL SpA
VIA STELVIO 94
IT-23035 SONDALO (SO)
ITALIE
Ou
VANTIVE MANUFACTURING LIMITED
Moneen Road,
Castlebar
County Mayo
F23 XR63
IrlandE
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Ce médicament est autorisé dans les Etats membres de l'Espace Economique Européen et au Royaume-Uni (Irlande du Nord) sous les noms suivants : Conformément à la réglementation en vigueur.
[À compléter ultérieurement par le titulaire]
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
Informations réservées aux professionnels de santé :
Les informations suivantes sont destinées exclusivement aux professionnels de la santé :
Phoxilium 1,2 mmol/l phosphate, solution pour hémodialyse et hémofiltration
Précautions
Les instructions d'utilisation/de manipulation de PHOXILIUM 1,2 mmol/l PHOSPHATE, solution pour hémodialyse et hémofiltration doivent être suivies scrupuleusement.
La solution contenue dans les deux compartiments doit être mélangée avant utilisation. L'utilisation d'une solution contaminée peut entraîner une septicémie avec état de choc.
PHOXILIUM 1,2 mmol/l PHOSPHATE, solution pour hémodialyse et hémofiltration peut être réchauffée à 37°C pour améliorer le confort du patient. Le réchauffement de la solution avant son utilisation doit être effectué avant la reconstitution, exclusivement avec une chaleur sèche. Les solutions ne doivent pas être réchauffées au bain-marie ni au four à micro-ondes. PHOXILIUM 1,2 mmol/l PHOSPHATE, solution pour hémodialyse et hémofiltration doit être inspectée visuellement afin de détecter toute présence de particules ou de décoloration avant l'administration. N'administrer que si la solution est limpide et la soudure intacte.
La concentration en phosphate inorganique doit être mesurée régulièrement. En cas d'hypophosphatémie (faible taux de phosphate dans le sang), une supplémentation en phosphate inorganique doit être apportée.
Tout ajout de bicarbonate de sodium peut augmenter le risque d’alcalose métabolique.
En cas de déséquilibre hydrique, l’état clinique doit être surveillé attentivement et la balance hydrique doit être restaurée.
· En cas d’hypervolémie, le débit d’ultrafiltration net prescrit pour l'appareil d'EERC peut être augmenté et/ou le débit d’administration de solutions autres que la solution de substitution et/ou le dialysat peut être réduit.
· En cas d'hypovolémie, le débit d’ultrafiltration net prescrit pour l'appareil d'EERC peut être réduit et/ou le débit d’administration de solutions autres que la solution de substitution et/ou le dialysat peut être augmenté.
Avertissements
La solution Phoxilium ne doit pas être utilisée chez les patients présentant une hyperkaliémie. La concentration sanguine en potassium doit être régulièrement surveillée avant et pendant l’hémofiltration et/ou l’hémodialyse.
La solution Phoxilium contenant du potassium, une hyperkaliémie transitoire peut survenir après le début du traitement. Réduire le débit de perfusion et vérifier l'obtention de la concentration de potassium désirée. Si l'hyperkaliémie persiste, interrompre rapidement l'administration.
En cas d’apparition d’une hyperkaliémie pendant l’utilisation de Phoxilium comme dialysat, l’administration d’un dialysat sans potassium pourra être nécessaire pour accroître l’élimination du potassium.
La solution Phoxilium contenant du phosphate, une hyperphosphatémie transitoire peut survenir après le début du traitement. Le débit de perfusion sera réduit jusqu'à l'obtention de la concentration de phosphate désirée. Si l'hyperphosphatémie persiste, l'administration doit être interrompue rapidement.
Les paramètres électrolytiques et acido-basiques du sang doivent être contrôlés régulièrement chez les patients traités par Phoxilium. Phoxilium contient du phosphate d'hydrogène, un acide faible qui peut influencer l'équilibre acido-basique du patient. Si une acidose métabolique se développe ou s'aggrave pendant le traitement par Phoxilium, il est possible que le débit de perfusion doive être réduit ou que son administration doive être interrompue.
Étant donné que la solution Phoxilium ne contient pas de glucose, son administration peut causer une hypoglycémie. La glycémie doit être régulièrement surveillée chez les patients diabétiques (en particulier chez ceux recevant de l’insuline ou d’autres médicaments hypoglycémiants), mais également chez les patients non diabétiques, notamment en raison du risque d’hypoglycémie silencieuse pendant la procédure. En cas d’hypoglycémie, l’utilisation d’une solution contenant du glucose doit être considérée. D’autres mesures correctives pourront être nécessaires pour maintenir le niveau de glycémie souhaité.
Posologie
Le volume et le débit d’administration de la solution Phoxilium dépendent de la concentration en phosphate et autres électrolytes dans le sang, de l’équilibre acido-basique, de l’équilibre hydrique et de l’état clinique général du patient. De plus, le volume de la solution de substitution et/ou celui du dialysat à administrer dépendent de l’intensité (dose) du traitement souhaitée.
L’administration de la solution Phoxilium (dose, débit de perfusion et volume cumulatif) doit être définie uniquement par un médecin expérimenté dans les soins intensifs et les traitements d’épuration extra-rénale continue (EERC).
Par conséquent, le volume à administrer est à l’appréciation du médecin traitant.
La plage de débit de la solution de substitution pour l’hémofiltration et l’hémodiafiltration est :
Adultes : 500 - 3 000 ml/h
La plage de débit de dialysat pour l’hémodialyse continue et l’hémodiafiltration continue est :
Adultes : 500 - 2 500 ml/h
Les débits totaux combinés usuels utilisés chez l’adulte pour les traitements d’EERC (dialysat et solution de substitution) sont environ de 2000 à 2500 ml/h, ce qui correspond à un volume quotidien de solution d’approximativement 48 à 60 litres.
Population pédiatrique
Chez les enfants (de nouveaux-nés jusqu’aux enfants de moins de 18 ans), le débit de la solution de substitution pour une hémofiltration et une hémodiafiltration et le débit de la solution de dialyse (dialysat) pour une hémodialyse continue et hémodiafiltration continue doivent être compris entre 1000 et 4000 ml/h/1,73 m2.
Chez les adolescents âgés de 12 à 18 ans, la recommandation posologique des adultes doit être appliquée lorsque la dose pédiatrique calculée dépasse la dose maximale recommandée pour les adultes.
Instructions d'utilisation / de manipulation
La solution qui se trouve dans le petit compartiment A est ajoutée à celle du grand compartiment B en brisant le cône sécable ou la soudure pelable juste avant l'utilisation. La solution reconstituée doit être limpide et incolore.
Une technique aseptique rigoureuse doit être respectée tout au long de la manipulation et de l’administration de la solution au patient.
A n’utiliser que si le suremballage est intact. Toutes les soudures doivent être intactes, la soudure pelable ne doit pas être brisée et la solution doit être limpide. Appuyer fermement sur la poche pour vérifier l'absence de fuite. En cas de fuite, jetez immédiatement la solution, car la stérilité ne peut plus être garantie.
Le grand compartiment B comporte un site d’injection pour l’ajout éventuel d’autres médicaments à la solution après sa reconstitution. Il est de la responsabilité de l’utilisateur de juger de la compatibilité d’un médicament à ajouter avec PHOXILIUM en vérifiant l’apparition d’éventuel changement de couleur et/ou de précipités, de complexes insolubles ou de cristaux.
Avant d’ajouter une substance ou un médicament, vérifiez sa solubilité et sa stabilité dans PHOXILIUM et s’assurer de l’adéquation du pH de PHOXILIUM (le pH de la solution reconstituée est de 7,0– 8,5). Il est possible que les additifs soient incompatibles. La notice d’utilisation relative au médicament à ajouter doit être consultée.
Retirez tout liquide du site d’injection, tenez la poche à l'envers, injectez le médicament par le site d’injection et mélangez soigneusement. L’introduction et le mélange des additifs doit toujours être effectué avant de connecter la poche de solution au circuit extracorporel. La solution doit être administrée immédiatement.
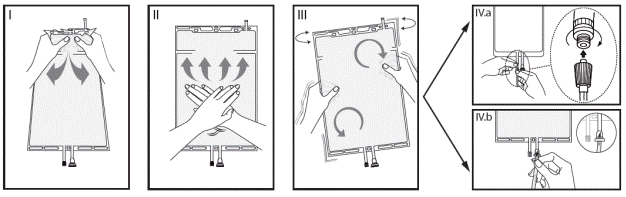
Si les deux compartiments de la poche sont séparés par une soudure pelable, suivre les instructions suivantes :
I Retirez l’emballage de la poche immédiatement avant usage et jetez tout autre emballage. Ouvrez la soudure en tenant le petit compartiment des deux mains et en le pressant jusqu’à ce qu’une ouverture se crée dans la soudure pelable située entre les deux compartiments (Voir l’illustration I ci-dessous)
II Appuyez à l’aide de vos deux mains sur le grand compartiment jusqu’à ce que la soudure pelable située entre les deux compartiments soit complètement ouverte (Voir l’illustration II ci-dessous)
III Agitez délicatement la poche pour parfaire le mélange de la solution. La solution est alors prête à l’emploi et la poche peut être suspendue à l’équipement. (Voir figure III ci-dessous)
IV La ligne de dialyse ou de solution de réinjection peut être connectée à l’un des deux connecteurs de la poche
IV.a Si le connecteur luer de la poche est utilisé, retirez le bouchon du luer en le tournant et en le tirant et vissez le connecteur luer lock mâle de la ligne de dialyse ou de solution de réinjection sur le luer femelle de la poche en poussant et en tournant. Vérifiez que la connexion est solide et serrez. Le connecteur est désormais ouvert. Vérifiez que la solution s’écoule librement. (Voir l’illustration IV.a ci-dessous).
Lorsque la ligne de dialyse ou de solution de réinjection est déconnectée du connecteur luer, ce dernier se ferme et le flux de solution s’arrête. Le port luer est un port sans aiguille et désinfectable.
IV.b Si le port d’injection est utilisé, ôtez d’abord la capsule le protégeant. Le port d’injection est désinfectable. Introduisez ensuite le perforateur à travers la gomme en caoutchouc. Vérifiez que la solution s’écoule librement (Voir l’illustration IV.b ci-dessous).
La solution reconstituée doit être administrée immédiatement. Si elle n’est pas utilisée immédiatement, elle doit l’être sous les 24 heures, durée du traitement comprise, après l'ajout de la solution A à la solution B.
La solution reconstituée est à usage unique. Les quantités de solution non utilisées doivent être jetées immédiatement après emploi.
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
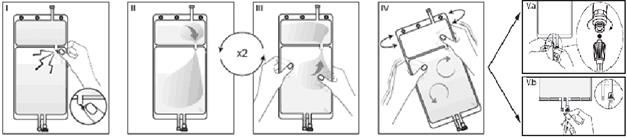
Si les deux compartiments de la poche sont séparés par un cône sécable et qu’un cône sécable est situé dans le connecteur luer, suivre les instructions suivantes :
I Retirez l’emballage de la poche immédiatement avant usage et jetez tout autre emballage. Ouvrez la soudure en brisant le cône sécable séparant les deux compartiments de la poche. Le cône sécable reste dans la poche. (Voir l’illustration I ci-dessous)
II Vérifiez que toute la solution du petit compartiment A s'écoule correctement dans le grand compartiment B. (Voir l’illustration II ci-dessous)
III Rincez le petit compartiment A à deux reprises en refoulant par pression la solution mélangée dans le petit compartiment A, puis à nouveau dans le grand compartiment B. (Voir l’illustration III ci-dessous)
IV Lorsque le petit compartiment A est vide : agitez le grand compartiment B afin de parfaire le mélange. La solution est alors prête à l'emploi et la poche peut être suspendue à l’équipement. (Voir l’illustration IV ci-dessous)
V La ligne de dialyse ou de solution de réinjection peut être connectée à l’un des deux connecteurs de la poche.
V.a Si le connecteur luer de la poche est utilisé, employez une méthode aseptique pour retirer le bouchon du luer et visser le connecteur luer lock mâle de la ligne de dialyse ou de solution de réinjection sur le luer femelle de la poche : serrez. À l’aide de vos deux mains, cassez le cône sécable bleu à sa base avec un mouvement de va-et-vient. N’utilisez aucun instrument. Vérifiez que le cône est complètement détaché et que la solution s’écoule librement. Le cône reste dans le site luer en cours de traitement. (Voir l’illustration V.a ci-dessous)
V.b Si le port d’injection est utilisé, ôtez d’abord la capsule le protégeant. Le port d’injection est désinfectable. Introduisez ensuite le perforateur à travers la gomme en caoutchouc. Vérifiez que la solution s’écoule librement. (Voir l’illustration V.b ci-dessous).
La solution reconstituée doit être administrée immédiatement. Si elle n’est pas utilisée immédiatement, elle doit l’être sous les 24 heures, durée du traitement comprise, après l'ajout de la solution A à la solution B.
La solution reconstituée est à usage unique. Les quantités de solution non utilisées doivent être jetées immédiatement après emploi.
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
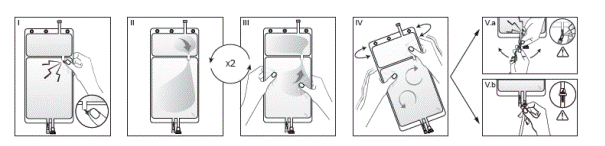
Si les deux compartiments de la poche sont séparés par un cône sécable et qu'une valve est située dans le connecteur luer, suivre les instructions suivantes:
I Retirez l’emballage de protection de la poche immédiatement avant usage et jetez tout autre emballage. Ouvrez la soudure en brisant le cône sécable séparant les deux compartiments de la poche. Le cône sécable reste dans la poche. (Voir l’illustration I ci-dessous)
II Vérifiez que toute la solution du petit compartiment A s'écoule correctement dans le grand compartiment B. (Voir l’illustration II ci-dessous)
III Rincez le petit compartiment A à deux reprises en refoulant par pression la solution mélangée dans le petit compartiment A, puis à nouveau dans le grand compartiment B. (Voir l’illustration III ci-dessous)
IV Lorsque le petit compartiment A est vide : agitez le grand compartiment B afin de parfaire le mélange. La solution est alors prête à l'emploi et la poche peut être suspendue à l’équipement. (Voir l’illustration IV ci-dessous)
V La ligne de dialyse ou de solution de réinjection peut être connectée à l’un des deux connecteurs de la poche.
V.a Si le connecteur luer de la poche est utilisé, ôtez le bouchon du luer en en le tournant et en le tirant et vissez le connecteur luer lock mâle de la ligne de dialyse ou de solution de réinjection sur le luer femelle de la poche en le poussant et en le tournant. Vérifiez que la connexion est sûre et serrez. Le connecteur est désormais ouvert. Vérifiez que la solution s’écoule librement. (Voir l’illustration V.a ci-dessous)
Lorsque la ligne de dialyse ou de solution de réinjection est déconnectée du connecteur luer, ce dernier se ferme et l’écoulement de la solution s'arrête. Le connecteur luer ne nécessite pas d’aiguille et est désinfectable.
V.b Si le port d’injection est utilisé, ôtez d’abord la capsule le protégeant. Le port d’injection est désinfectable. Introduisez ensuite le perforateur à travers la gomme en caoutchouc. Vérifiez que la solution s’écoule librement. (Voir l’illustration V.b ci-dessous).
La solution reconstituée doit être administrée immédiatement. Si elle n’est pas utilisée immédiatement, elle doit l’être sous les 24 heures, durée du traitement comprise, après l'ajout de la solution A à la solution B.
La solution reconstituée est à usage unique. Les quantités de solution non utilisées doivent être jetées immédiatement après emploi.
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
|
|