Dernière mise à jour le 08/01/2026
LIDOCAÏNE/PRILOCAÏNE BIOGARAN 5 %, crème
Indications thérapeutiques
Classe pharmacothérapeutique - code ATC : N01B B20
LIDOCAÏNE/PRILOCAÏNE BIOGARAN 5 %, crème contient deux substances actives appelées la lidocaïne et la prilocaïne. Ces dernières appartiennent à un groupe de médicaments appelés anesthésiques locaux.
LIDOCAÏNE/PRILOCAÏNE BIOGARAN 5 %, crème fonctionne en provoquant une anesthésie de la surface de la peau pendant une courte durée. Ce médicament est appliqué sur la peau avant certains actes médicaux. Cela permet d’arrêter la douleur au niveau de la peau ; cependant, vous pouvez encore avoir les sensations de pression et de toucher.
Adultes, adolescents et enfants
Il peut être utilisé pour anesthésier la peau avant :
· l’insertion d’aiguilles (par exemple, si vous devez avoir une injection ou faire une prise de sang) ;
· des opérations mineures de la peau.
Adultes et adolescents
Il peut aussi être utilisé :
· pour anesthésier les parties génitales avant :
o de recevoir une injection ;
o certains actes médicaux tels que le retrait de verrues.
Un médecin ou un(e) infirmier/ère doit superviser l’utilisation de LIDOCAÏNE/PRILOCAÏNE BIOGARAN sur les parties génitales.
Adultes
Il peut aussi être utilisé pour anesthésier la peau avant :
· le nettoyage ou le retrait de la peau endommagée en cas d’ulcères de jambe.
Présentations
> 1 tube(s) aluminium verni de 5 g avec 2 pansement(s)
Code CIP : 377 134-7 ou 34009 377 134 7 4
Déclaration de commercialisation : 07/02/2007
Cette présentation est agréée aux collectivités
- Prix hors honoraire de dispensation : 3,09 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 4,11 €
- Taux de remboursement :65%
Service médical rendu (SMR)
Amélioration du service médical rendu (ASMR)
Ce médicament étant un générique, l'ASMR n'a pas été évalué par la commission de la transparence (CT), il est possible de se référer à la /aux spécialité(s) de référence du groupe générique auquel appartient ce médicament (cliquez ici pour aller à la rubrique des groupes génériques)
ANSM - Mis à jour le : 05/02/2025
LIDOCAÏNE/PRILOCAÏNE BIOGARAN 5 %, crème
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Prilocaïne................................................................................................................................ 2,5 g
Pour 100 g de crème
Excipient à effet notoire : Hydroxystéarate de macrogolglycérol (huile de ricin).
Pour la liste complète des excipients, voir rubrique 6.1.
4.1. Indications thérapeutiques
LIDOCAÏNE/PRILOCAÏNE BIOGARAN crème est indiquée pour :
· l’anesthésie topique de la peau lors de :
o l’insertion d’aiguilles, par exemple insertion de cathéters intraveineux ou prélèvements sanguins ;
o procédures chirurgicales superficielles ;
chez les adultes et dans la population pédiatrique
· l’anesthésie topique des muqueuses génitales, par exemple avant des procédures chirurgicales superficielles ou une anesthésie par infiltration ; chez les adultes et les adolescents ≥ 12 ans ;
· l’anesthésie topique des ulcères de jambe afin de faciliter le nettoyage mécanique/débridement chez les adultes uniquement.
4.2. Posologie et mode d'administration
Adultes et adolescents
Les détails des indications ou des procédures d’utilisation, ainsi que la dose et la durée d’application sont fournis dans les Tableaux 1 et 2.
Pour plus de renseignements sur l’utilisation appropriée du produit selon de telles procédures, veuillez vous référer au Mode d’administration.
Tableau 1 Adultes et adolescents de 12 ans et plus
|
Indication/Procédure |
Dose et durée d’application |
|
Peau |
|
|
Petites interventions, par exemple insertion d’aiguilles et traitement chirurgical de lésions localisées. |
2 g (approximativement un demi tube de 5 g) ou approximativement 1,5 g/10 cm2 pendant 1 à 5 heures1). |
|
Interventions dermatologiques sur peau récemment rasée sur de larges parties du corps, par exemple l’épilation au laser (auto-application par le patient). |
Dose maximale recommandée : 60 g. Surface traitée maximale recommandée : 600 cm2 pendant au moins 1 heure, maximum 5 heures1). |
|
Interventions chirurgicales dermatologiques sur de plus grandes surfaces, par exemple greffe de peau mince en milieu hospitalier. |
Approximativement 1,5-2 g/10 cm2 pendant 2 à 5 heures1). |
|
Peau des organes génitaux chez l’homme, avant injection d'anesthésiques locaux Peau des organes génitaux chez la femme, avant injection d'anesthésiques locaux2). |
1 g/10 cm2 pendant 15 minutes. 1-2 g/10 cm2 pendant 60 minutes. |
|
Muqueuses génitales |
|
|
Traitement chirurgical de lésions localisées, par exemple ablation de verrues génitales (condylomes acuminés) et avant injection d’anesthésiques locaux. |
Approximativement 5-10 g de crème pendant 5-10 minutes1) 3) 4). |
|
Avant curetage cervical. |
10 g de crème doivent être administrés au niveau du cul-de-sac vaginal latéral pendant 10 minutes. |
|
Ulcère(s) de jambe |
|
|
Adultes uniquement Nettoyage mécanique/débridement. |
Approximativement 1-2 g/10 cm2 jusqu’à un total de 10 g sur le ou les ulcère(s) de jambe3) 5). Temps d’application : 30-60 minutes. |
1) Après une période d’application plus longue, l’anesthésie diminue.
2) Sur la peau des organes génitaux chez la femme, l'application seule de LIDOCAÏNE/PRILOCAÏNE BIOGARAN pendant 60 ou 90 minutes ne permet pas une anesthésie suffisante pour le traitement de verrues génitales par thermocautérisation ou diathermie.
3) Les concentrations plasmatiques n’ont pas été déterminées chez les patients traités avec des doses > à 10 g (voir aussi rubrique 5.2).
4) Chez les adolescents pesant moins de 20 kg, la dose maximale de LIDOCAÏNE/PRILOCAÏNE BIOGARAN à appliquer sur les muqueuses génitales doit être proportionnellement réduite.
5) LIDOCAÏNE/PRILOCAÏNE BIOGARAN a été utilisé pour le traitement des ulcères de jambe jusqu’à 15 reprises sur une période de 1 à 2 mois sans perte d’efficacité ni augmentation du nombre ou de la sévérité des événements indésirables.
Population pédiatrique
Tableau 2 Patients pédiatriques âgés de 0 à 11 ans
|
Groupe d’âge |
Procédure |
Dosage et temps d’application |
|
|
Petites interventions, par exemple insertion d’aiguilles et traitement chirurgical de lésions localisées |
Approximativement 1 g/10 cm2 pendant une heure (voir détails ci-dessous) |
|
Nouveau-nés et nourrissons 0 - 2 mois 1) 2) 3) |
|
Jusqu’à 1 g et 10 cm2 pendant une heure4) |
|
Nourrissons 3 - 11 mois 1) 2) |
|
Jusqu’à 2 g et 20 cm2 pendant une heure5) |
|
Jeunes enfants et enfants 1-5 ans |
|
Jusqu’à 10 g et 100 cm2 pendant 1 - 5 heures6) |
|
Enfants 6 - 11 ans |
|
Jusqu’à 20 g et 200 cm2 pendant 1 - 5 heures6) |
|
Patients pédiatriques avec dermatite atopique |
Avant curetage de molluscum |
Temps d’application : 30 minutes |
1) Chez les nouveau-nés nés à terme et les nourrissons de moins de 3 mois, une unique dose devra seulement être appliquée sur une période de 24 heures. Pour les enfants âgés de 3 mois et plus, un maximum de 2 doses, séparées d’au moins 12 heures, peut être donnée sur une période de 24 heures, voir rubriques 4.4 et 4.8.
2) LIDOCAÏNE/PRILOCAÏNE BIOGARAN ne doit pas être utilisé chez les enfants de moins de 12 mois qui sont traités par des médicaments inducteurs de méthémoglobine, pour des raisons de sécurité, voir rubriques 4.4 et 4.8.
3) LIDOCAÏNE/PRILOCAÏNE BIOGARAN ne doit pas être utilisé chez les prématurés de moins de 37 semaines d’âge gestationnel, pour des raisons de sécurité voir rubrique 4.4.
4) Un temps d’application > 1 heure n’a pas été étudié.
5) Aucune augmentation cliniquement significative des taux de méthémoglobine après application de LIDOCAÏNE/PRILOCAÏNE BIOGARAN pendant maximum 4 heures sur 16 cm2 n’a été observée.
6) Après une période d’application plus longue, l’anesthésie diminue.
L’efficacité et la sécurité de l’utilisation de LIDOCAÏNE/PRILOCAÏNE BIOGARAN sur la peau des organes génitaux et les muqueuses génitales n’ont pas été établies chez les enfants de moins de 12 ans.
Les données pédiatriques disponibles ne démontrent pas d’efficacité adéquate pour la circoncision.
Patients âgés
Aucune réduction de dose n’est nécessaire chez les patients âgés (voir rubriques 5.1 et 5.2)
Atteinte de la fonction hépatique
Une réduction de dose unique n’est pas nécessaire chez les patients présentant une atteinte de la fonction hépatique (voir rubrique 5.2)
Atteinte de la fonction rénale
Une réduction de dose n’est pas nécessaire chez les patients présentant une fonction rénale diminuée.
Mode d’administration
Voie cutanée.
La membrane de protection du tube est perforée à l’aide du bouchon.
Un gramme de LIDOCAÏNE/PRILOCAÏNE BIOGARAN correspond approximativement à 3,5 cm de longueur de crème prélevée dans un tube de 30 g. Si le dosage requiert un niveau de précision élevé pour éviter un surdosage (par exemple à des doses proches de la limite maximale chez le nouveau-né ou si deux applications peuvent être requises sur une durée de 24 heures), il est possible d’utiliser une seringue, sachant que 1 ml = 1 g.
Une couche épaisse de LIDOCAÏNE/PRILOCAÏNE BIOGARAN doit être appliquée sur la peau, incluant la peau des organes génitaux, sous un pansement occlusif. Pour l’application sur des zones plus étendues, telle que pour la greffe de peau mince, un bandage élastique doit être appliqué au-dessus du pansement occlusif pour assurer une distribution uniforme de la crème et protéger la zone. En présence d’une dermatite atopique, la durée d’application doit être réduite.
Pour les interventions concernant les muqueuses génitales, il n’est pas nécessaire d’utiliser un pansement occlusif. L’intervention doit commencer immédiatement après le retrait de la crème.
Pour les interventions concernant les ulcères de jambe, LIDOCAÏNE/PRILOCAÏNE BIOGARAN doit être appliqué en couche épaisse sous un pansement occlusif. Le nettoyage doit débuter sans délai après le retrait de la crème.
Le tube de LIDOCAÏNE/PRILOCAÏNE BIOGARAN est destiné à un usage unique lorsqu’il est utilisé pour traiter les ulcères de jambe : le tube ainsi que le contenu restant doivent être jetés à chaque fois qu’un patient a été traité.
4.4. Mises en garde spéciales et précautions d'emploi
En raison de données insuffisantes sur son absorption, LIDOCAÏNE/PRILOCAÏNE BIOGARAN ne doit pas être appliqué sur les blessures ouvertes (excepté les ulcères de jambe).
En raison de l’absorption potentiellement plus importante sur la peau récemment rasée, il est important de respecter la posologie, la zone et le temps d’application recommandés (voir rubrique 4.2).
Il faut faire attention lors de l’application de LIDOCAÏNE/PRILOCAÏNE BIOGARAN chez les patients atteints de dermatite atopique. Un temps d'application réduit à 15-30 minutes peut être suffisant (voir rubrique 5.1). Des temps d’application supérieurs à 30 minutes chez des patients atteints de dermatite atopique peuvent conduire à une augmentation de l’incidence des réactions vasculaires locales, en particulier rougeur au site d’application et dans certains cas pétéchies et purpura (voir rubrique 4.8). Avant le curetage de molluscum chez les enfants atteints de dermatite atopique, un temps d’application de 30 minutes est recommandé.
Lors de son application à proximité des yeux, LIDOCAÏNE/PRILOCAÏNE BIOGARAN doit être utilisé avec précaution car cela peut provoquer des irritations et des brûlures chimiques au niveau des yeux. La perte des réflexes de protection des yeux peut également conduire à une irritation de la cornée et à une potentielle abrasion. En cas de contact oculaire, les yeux doivent être immédiatement rincés avec de l’eau ou une solution saline et protégés jusqu’au retour de la sensibilité.
Lorsque LIDOCAÏNE/PRILOCAÏNE BIOGARAN est utilisé chez l’enfant, quel que soit le site d’application, il convient de surveiller attentivement l’enfant afin d’éviter qu’il ne s’auto-administre LIDOCAÏNE/PRILOCAÏNE BIOGARAN dans les yeux.
LIDOCAÏNE/PRILOCAÏNE BIOGARAN ne doit pas être utilisé sur une membrane tympanique endommagée. Des tests effectués sur des animaux de laboratoire ont révélé une ototoxicité de LIDOCAÏNE/PRILOCAÏNE BIOGARAN lors de son instillation dans l'oreille moyenne. Cependant, chez les animaux avec une membrane tympanique intacte, aucune anomalie n’a été montrée lors de l’application de LIDOCAÏNE/PRILOCAÏNE BIOGARAN au niveau du canal auditif externe.
Les patients traités avec des médicaments anti-arythmiques de classe III (par exemple, l’amiodarone) doivent être étroitement surveillés et une surveillance ECG doit être envisagée car les effets cardiaques peuvent être additifs.
La lidocaïne et la prilocaïne ont des propriétés bactéricides et antivirales à des concentrations supérieures à 0,5 – 2 %. C’est pourquoi, bien que les résultats d’une étude clinique suggèrent que l’utilisation de LIDOCAÏNE/PRILOCAÏNE BIOGARAN avant une vaccination contre la tuberculose (BCG) n’influence pas la réponse immunitaire, évaluée par la formation d’une papule locale, il est nécessaire de suivre le résultat d’injections intradermiques de vaccins vivants.
LIDOCAÏNE/PRILOCAÏNE BIOGARAN contient de l’hydroxystéarate de macrogol glycérol (huile de ricin), qui peut causer des réactions cutanées.
Population pédiatrique
Lors d’études, l’efficacité de LIDOCAÏNE/PRILOCAÏNE BIOGARAN lors des prélèvements capillaires au talon chez les nouveau-nés n’a pas été démontrée.
Chez les nouveau-nés et les nourrissons de moins de 3 mois, une augmentation transitoire dépourvue de signification clinique des taux de méthémoglobine est couramment observée, jusqu’à 12 heures après application de la dose recommandée de LIDOCAÏNE/PRILOCAÏNE BIOGARAN.
Si la dose recommandée est dépassée, le patient doit être surveillé en cas de survenue d’effets indésirables systémiques secondaires à une méthémoglobinémie (voir rubriques 4.2, 4.8 et 4.9).
LIDOCAÏNE/PRILOCAÏNE BIOGARAN ne doit pas être utilisé
· chez les nouveau-nés/nourrissons de 0 à 12 mois traités par des médicaments inducteurs de méthémoglobine ;
· chez les nouveau-nés prématurés de moins de 37 semaines d’âge gestationnel car ils risquent de développer des taux élevés de méthémoglobine.
La sécurité et l’efficacité de l’application de LIDOCAÏNE/PRILOCAÏNE BIOGARAN sur la peau des organes génitaux et sur les muqueuses génitales n’ont pas été établies chez les enfants de moins de 12 ans.
Les données pédiatriques disponibles ne démontrent pas d’efficacité adéquate pour la circoncision.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Avec des doses élevées de LIDOCAÏNE/PRILOCAÏNE BIOGARAN, le risque de toxicité systémique supplémentaire doit être envisagé chez les patients recevant d'autres anesthésiques locaux ou des médicaments de structure apparentée aux anesthésiques locaux, puisque les effets toxiques sont additifs.
Des études d’interaction spécifique avec la lidocaïne/prilocaïne et des anti-arythmiques de classe III (par exemple l’amiodarone) n’ont pas été réalisées mais une précaution particulière est conseillée (voir aussi rubrique 4.4).
Les médicaments qui réduisent la clairance de la lidocaïne (par exemple la cimétidine ou les béta-bloquants) peuvent causer des concentrations plasmatiques potentiellement toxiques lorsque la lidocaïne est donnée à fortes doses répétées sur une longue période.
Population pédiatrique
Des études d’interaction spécifiques chez les enfants n’ont pas été réalisées. Les interactions sont probablement similaires à celles de la population adulte.
4.6. Fertilité, grossesse et allaitement
Grossesse
Bien qu’une application topique soit uniquement associée à un faible taux d’absorption systémique, l’utilisation de LIDOCAÏNE/PRILOCAÏNE BIOGARAN chez les femmes enceintes doit être considérée avec précaution car les données disponibles concernant l’utilisation de LIDOCAÏNE/PRILOCAÏNE
BIOGARAN chez les femmes enceintes sont insuffisantes. Cependant, des études chez l’animal n’ont pas montré d’effets nocifs directs ou indirects sur la grossesse, le développement embryonnaire/foetal, l’accouchement ou le développement postnatal. Une toxicité de reproduction a été montrée lors d’une administration sous-cutanée/intramusculaire de fortes doses de lidocaïne ou de prilocaïne excédant considérablement l’exposition lors d’une application topique (voir rubrique 5.3).
La lidocaïne et la prilocaïne traversent la barrière placentaire, et peuvent être absorbées par les tissus foetaux. Il est raisonnable de penser que la lidocaïne et la prilocaïne ont été utilisées chez de nombreuses femmes enceintes ou en âge de procréer. Jusqu’à présent, aucun trouble spécifique de la fonction reproductrice n’a été rapporté par exemple une incidence accrue de malformations ou autres effets directement ou indirectement nocifs pour le foetus.
La lidocaïne et, en toute probabilité, la prilocaïne sont excrétées dans le lait maternel mais en quantités si faibles qu’il n’y a généralement pas de risque que l’enfant soit affecté à des doses thérapeutiques. LIDOCAÏNE/PRILOCAÏNE BIOGARAN peut être utilisé pendant l’allaitement en cas de nécessité clinique.
Fertilité
Des études chez l’animal n’ont montré aucune altération de la fertilité des rats mâles ou femelles (voir rubrique 5.3).
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
LIDOCAÏNE/PRILOCAÏNE BIOGARAN n’a pas d’effet ou un effet négligeable sur l’aptitude à conduire des véhicules et à utiliser des machines quand il est utilisé aux doses recommandées.
Résumé du profil de sécurité
Les effets indésirables les plus fréquemment observés sont liés au site d’administration (réactions locales transitoires au site d’application) et sont rapportés comme fréquents.
Liste des réactions indésirables sous forme de tableau
Les incidences des effets indésirables (EIs) associés à un traitement par LIDOCAÏNE/PRILOCAÏNE BIOGARAN sont présentées dans le tableau ci-dessous. Le tableau est basé sur les évènements indésirables rapportés pendant les essais cliniques et/ou l’utilisation post-commercialisation. Les effets indésirables sont listés par ordre de fréquence, selon la terminologie MedDRA par Classe de Système d’Organe (SOC), au niveau des termes préférés.
Dans chaque Classe de Système d’Organe, les fréquences des effets indésirables sont répertoriées comme suit : très fréquent (≥ 1/10), fréquent (≥ 1/100 à < 1/10), peu fréquent (≥ 1/1 000 à < 1/100), rare (≥ 1/10 000 à < 1/1 000) et très rare (< 1/10 000). Dans chaque groupe de fréquence, les effets indésirables sont présentés dans un ordre de sévérité décroissante.
Tableau 3 Effets indésirables
|
Classe de Système d’Organe |
Fréquent |
Peu fréquent |
Rare |
Fréquence indéterminée |
|
Affections hématologiques et du système lymphatique |
|
|
Méthémoglobinémie1 |
|
|
Affections du système immunitaire |
|
|
Hypersensibilité1, 2, 3 |
|
|
Blessures, empoisonnements et complications procédurales |
|
|
|
Brûlures chimiques des yeux (voir rubrique 4.4) |
|
Affections oculaires |
|
|
Irritation de la cornée1 |
|
|
Affections de la peau et du tissu sous-cutané |
|
|
Purpura1, pétéchies1 (en particulier après des durées d’application plus longues chez les enfants souffrant de dermatite atopique ou de molluscum contagiosum) |
|
|
Troubles généraux et anomalies au site d’administration |
Sensation de brûlure2, 3 Prurit au site d’application 2, 3 Erythème au site d’application 1, 2 ,3 Oedème au site d’application 1, 2, 3 Chaleur au site d’application 2, 3 Pâleur au site d’application 1, 2, 3 |
Sensation de brûlure1 Irritation au site d’application3 Prurit au site d’application 1 Paresthésie au site d’application2 telle que fourmillements Chaleur au site d’application1
|
|
|
1Peau
2Muqueuses génitales
3Ulcère de jambe
Population pédiatrique
La fréquence, le type et la sévérité des effets indésirables sont similaires dans les groupes d’âges pédiatriques et adultes, excepté en ce qui concerne la méthémoglobinémie qui est observée plus fréquemment, souvent en relation avec un surdosage (voir la rubrique 4.9), chez les nouveau-nés et les nourrissons âgés de 0 à 12 mois.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/.
Une méthémoglobinémie cliniquement significative devra être traitée par une injection intraveineuse lente de bleu de méthylène (voir également rubrique 4.4).
Si d’autres symptômes de toxicité systémique survenaient, les signes devraient être similaires à ceux qui se produiraient suite à l’administration d’anesthésiques locaux par d’autres voies d’administration.
La toxicité d’un anesthésique local se manifeste par des symptômes d’excitation du système nerveux central et, dans les cas sévères, dépression du système nerveux central et dépression cardiovasculaire.
Des symptômes neurologiques graves (convulsions, dépression du système nerveux central) doivent être traités symptomatiquement par assistance respiratoire et par administration de médicaments anticonvulsivants ; les signes circulatoires sont traités suivant les recommandations de réanimation.
Le taux d’absorption du produit sur peau intacte étant lent, un patient montrant des signes de toxicité doit être maintenu sous observation pendant plusieurs heures après le traitement d’urgence.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : anesthésiques, local ; amides, code ATC : N01B B20.
Mécanisme d’action
LIDOCAÏNE/PRILOCAÏNE BIOGARAN produit une anesthésie de la peau par libération de lidocaïne et de prilocaïne à partir de la crème dans les couches épidermique et dermique de la peau et à proximité des récepteurs dermiques de la douleur et des terminaisons nerveuses.
La lidocaïne et la prilocaïne sont des anesthésiques locaux de type amide. Ces deux composants stabilisent les membranes neuronales en inhibant les flux ioniques nécessaires à l’initiation et à la conduction des influx, produisant ainsi une anesthésie locale. La qualité de l’anesthésie dépend du temps d’application et de la dose utilisée.
Peau
LIDOCAÏNE/PRILOCAÏNE BIOGARAN est appliqué sur la peau intacte sous un pansement occlusif. Le temps nécessaire pour réaliser une anesthésie fiable de la peau intacte est de 1 à 2 heures, en fonction du type d’intervention. L’effet anesthésique local est renforcé avec des durées d’application plus longues de 1 à 2 heures sur la plupart des parties du corps, à l’exception de la peau du visage et des parties génitales masculines. Compte tenu de la finesse de la peau du visage et d’une irrigation sanguine élevée des tissus, un effet anesthésique local maximal est obtenu après 30 à 60 minutes sur le front et les joues. De même, une anesthésie locale des parties génitales masculines est obtenue en 15 minutes. La durée de l’anesthésie après l’application de LIDOCAÏNE/PRILOCAÏNE BIOGARAN pendant 1 à 2 heures est d’au moins 2 heures après le retrait du pansement, excepté sur le visage où ce délai est plus court. LIDOCAÏNE/PRILOCAÏNE BIOGARAN est tout aussi efficace et a le même temps de déclenchement de l’effet anesthésiant quel que soit le niveau de pigmentation de la peau de claire à foncée (types de peau de I à VI).
Au cours des études cliniques avec application de LIDOCAÏNE/PRILOCAÏNE BIOGARAN sur la peau intacte, aucune différence de sécurité ou d’efficacité (y compris le délai avant le début de l’anesthésie) n’a été observée entre les patients gériatriques (de 65 à 96 ans) et les patients plus jeunes.
LIDOCAÏNE/PRILOCAÏNE BIOGARAN produit une réponse vasculaire biphasique impliquant une vasoconstriction initiale suivie d’une vasodilatation au site d’application (voir rubrique 4.8). Indépendamment de la réponse vasculaire, LIDOCAÏNE/PRILOCAÏNE BIOGARAN facilite l’insertion de l’aiguille par rapport à une crème placebo. Chez les patients atteints de dermatite atopique, une réaction vasculaire similaire mais plus courte a été observée, avec apparition d’un érythème après 30-60 minutes, indiquant une absorption plus rapide à travers la peau (voir rubrique 4.4).LIDOCAÏNE/PRILOCAÏNE BIOGARAN peut causer une augmentation transitoire de l’épaisseur cutanée, provoquée en partie par l’hydratation de la peau sous le pansement occlusif. L’épaisseur de la peau se réduit au cours des 15 minutes suivant l’exposition à l’air.
La profondeur de l'anesthésie cutanée augmente avec le temps d'application. Chez 90 % des patients, l'anesthésie est suffisante pour l'insertion d'un poinçon de biopsie (de 4 mm de diamètre) à une profondeur de 2 mm après 60 minutes et 3 mm après 120 minutes de traitement par LIDOCAÏNE/PRILOCAÏNE BIOGARAN.
L’utilisation de LIDOCAÏNE/PRILOCAÏNE BIOGARAN, avant une vaccination rougeole-oreillons-rubéole ou avant l’administration intramusculaire d’un vaccin inactivé diphtérie-coqueluche-tétanos-poliovirus -Haemophilus influenzae b ou un vaccin contre l’hépatite B, n’a pas affecté la moyenne des titres en anticorps, le taux de séroconversion ou la proportion de patients obtenant des titres d’anticorps protecteurs ou positifs après immunisation, par rapport aux patients traités par un placebo.
Muqueuses génitales
L’absorption sur les muqueuses génitales est plus rapide, et le délai de survenue de l’anesthésie est plus court qu’après application sur la peau.
Après une application de 5-10 minutes de LIDOCAÏNE/PRILOCAÏNE BIOGARAN sur la muqueuse génitale de la femme, la durée moyenne de l’analgésie efficace à un stimulus au laser à argon qui produit une douleur vive avec sensation de piqûre était de 15 à 20 minutes (variations individuelles dans l’intervalle 5-45 minutes).
Ulcères de jambe
Une anesthésie fiable dans le cas du nettoyage des ulcères de jambe est obtenue après un temps d’application de 30 minutes chez la plupart des patients. Une application d’une durée de 60 minutes peut améliorer davantage l’anesthésie. Le nettoyage doit commencer dans les 10 minutes qui suivent le retrait de la crème. Des données cliniques relatives à des temps d’attente plus longs ne sont pas disponibles. LIDOCAÏNE/PRILOCAÏNE BIOGARAN réduit la douleur postopératoire jusqu’à 4 heures après débridement. LIDOCAÏNE/PRILOCAÏNE BIOGARAN réduit le nombre de séances de nettoyage nécessaires pour obtenir un ulcère propre par comparaison au débridement obtenu avec une crème placebo. On n’a observé aucun effet négatif sur la guérison de l’ulcère ou sur la flore bactérienne.
Population pédiatrique
Des études cliniques impliquant plus de 2300 patients pédiatriques de tout âge ont démontré une efficacité pour la douleur liée à l’aiguille (prélèvement sanguin veineux, cathétérisme, vaccination sous-cutanée et intramusculaire, ponction lombaire), pour le traitement des lésions vasculaires au laser, et le curetage des molluscum contagiosum. LIDOCAÏNE/PRILOCAÏNE BIOGARAN a diminué la douleur lors de l’insertion d’aiguilles et lors de l’injection de vaccins. L’efficacité analgésique a augmenté d’une application de 15 minutes à une application de 90 minutes sur une peau normale ; mais sur des lésions vasculaires, une application de 90 minutes n’a pas fourni de bénéfice supérieur à une application de 60 minutes. LIDOCAÏNE/PRILOCAÏNE BIOGARAN ne montre pas de bénéfice versus placebo concernant la cryothérapie à l’azote liquide des verrues communes. Aucune efficacité suffisante pour la circoncision n’a pu être démontrée.
Onze études cliniques réalisées chez des nouveau-nés et des nourrissons ont montré que les pics de concentrations de méthémoglobine qui survenaient environ 8 heures après l’administration épicutanée de LIDOCAÏNE/PRILOCAÏNE BIOGARAN, étaient cliniquement non significatifs au dosage recommandé et revenaient à des valeurs normales après environ 12-13 heures. La formation de méthémoglobine est associée à la quantité cumulée de prilocaïne absorbée par voie percutanée et peut donc augmenter en fonction de l’allongement de la durée d’application de LIDOCAÏNE/PRILOCAÏNE BIOGARAN.
L’utilisation de LIDOCAÏNE/PRILOCAÏNE BIOGARAN, avant une vaccination rougeole-oreillons-rubéole ou avant l’administration intramusculaire d’un vaccin inactivé diphtérie-coqueluche-tétanos-poliovirus -Haemophilus influenzae b ou un vaccin contre l’hépatite B, n’a pas affecté la moyenne des titres en anticorps, le taux de séroconversion ou la proportion de patients obtenant des titres d’anticorps protecteurs ou positifs après immunisation, par rapport aux patients traités par un placebo.
5.2. Propriétés pharmacocinétiques
Absorption, distribution, biotransformation et élimination
L’absorption systémique de la lidocaïne et de la prilocaïne à partir de LIDOCAÏNE/PRILOCAÏNE BIOGARAN est fonction de la dose, de la surface d’application et du temps d’application. Des facteurs additionnels incluent l’épaisseur de la peau (qui varie selon les parties du corps) ainsi que d’autres facteurs tels que les maladies de la peau, et le rasage. Après application sur des ulcères de jambe, les caractéristiques des ulcères peuvent également affecter l’absorption. Les concentrations plasmatiques après traitement par LIDOCAÏNE/PRILOCAÏNE BIOGARAN sont de 20 à 60 % inférieures pour la prilocaïne par rapport à la lidocaïne en raison d’un volume de distribution supérieur et d’une clairance plus rapide. La voie d’élimination principale de la lidocaïne et de la prilocaïne est le métabolisme hépatique et les métabolites sont éliminés par voie rénale. Toutefois, les taux de métabolisation et d’élimination des anesthésiques locaux après une application topique de LIDOCAÏNE/PRILOCAÏNE BIOGARAN dépendent de la vitesse d’absorption. Par conséquent, une réduction de la clairance, notamment chez les patients présentant une atteinte grave de la fonction hépatique, a des effets limités sur les concentrations plasmatiques systémiques après administration d’une dose unique de LIDOCAÏNE/PRILOCAÏNE BIOGARAN et après administrations réitérées une fois par jour de doses uniques à court terme (jusqu’à 10 jours).
Les symptômes de toxicité anesthésique locale deviennent de plus en plus marqués lorsque la concentration plasmatique augmente de 5 à 10 μg/ml de l’une ou l’autre des substances actives. Il convient de considérer que la toxicité de la lidocaïne et celle de la prilocaïne sont additives.
Peau intacte
Après application sur la cuisse chez l’adulte (60 g de crème/400 cm² pendant 3 heures), le degré d’absorption de la lidocaïne et de la prilocaïne était d’environ 5 %. Les concentrations plasmatiques maximales (en moyenne 0,12 et 0,07 μg/ml) ont été atteintes en approximativement 2-6 heures après l’application.
Le degré d’absorption systémique était d’environ 10 % après application sur le visage (10 g/100 cm² pendant 2 heures). Les concentrations plasmatiques maximales (en moyenne 0,16 et 0,06 μg/ml) ont été atteintes après environ 1,5-3 heures.
Dans des études de greffe de peau mince chez les adultes une application de 7 heures 40 minutes au niveau de la cuisse ou de l’avant-bras jusqu’à une surface de 1 500 cm² a conduit des concentrations plasmatiques maximales ne dépassant pas 1,1 μg/ml de lidocaïne et 0,2 μg/ml de prilocaïne.
Muqueuses génitales
Après application de 10 g de LIDOCAÏNE/PRILOCAÏNE BIOGARAN pendant 10 minutes sur la muqueuse vaginale, les concentrations plasmatiques maximales de lidocaïne et de prilocaïne (en moyenne respectivement 0,18 μg/ml et 0,15 μg/ml) ont été atteintes après 20-45 minutes.
Ulcère de jambe
Suite à une application unique de 5 à 10 g de LIDOCAÏNE/PRILOCAÏNE BIOGARAN sur des ulcères de jambe d’une surface s’étendant jusqu’à 64 cm² pendant 30 minutes, les concentrations plasmatiques maximales de lidocaïne (intervalle de 0,05 à 0,25 μg/ml avec une valeur individuelle de 0,84 μg/ml) et de prilocaïne (0,02-0,08 μg/ml) ont été atteintes en 1 à 2,5 heures.
Après un temps d’application de 24 heures sur les ulcères de jambe sur une zone s’étendant jusqu’à 50 à 100 cm², les concentrations plasmatiques maximales pour la lidocaïne (0,19-0,71 μg/ml) et pour la prilocaïne (0,06-0,28 μg/ml) ont été généralement atteintes en 2 à 4 heures.
Des applications répétées de 2-10 g de LIDOCAÏNE/PRILOCAÏNE BIOGARAN sur des ulcères de jambe sur une surface s’étendant jusqu'à 62 cm² pendant 30-60 minutes 3-7 fois par semaine jusqu’à 15 doses sur une période d’un mois, n’ont pas montré d’accumulation plasmatique apparente de lidocaïne ni de ses métabolites monoglycinexylidide et 2,6-xylidine ou de prilocaïne ni de son métabolite l’ortho-toluidine. Les concentrations plasmatiques maximales observées de lidocaïne, de monoglycinexylidide et de 2,6-xylidine étaient respectivement de 0,41 μg/ml, de 0,03 μg/ml et de 0,01 μg/ml. Les concentrations plasmatiques maximales observées de prilocaïne et d’ortho-toluidine étaient respectivement de 0,08 μg/ml et de 0,01 μg/ml.
Après une application répétée de 10 g de LIDOCAÏNE/PRILOCAÏNE BIOGARAN sur des ulcères de jambe chroniques sur une surface comprise entre 62 et 160 cm² pendant 60 minutes une fois par jour pendant 10 jours consécutifs, la concentration plasmatique maximale moyenne résultant de la somme des concentrations de lidocaïne et de prilocaïne était de 0,6 μg/ml. La concentration maximale ne dépend pas de l’âge du patient mais est significativement (p < 0,01) associée à la taille de la surface de l’ulcère. L’augmentation de la surface de l’ulcère de 1 cm² entraîne une augmentation de la valeur Cmax de la somme des concentrations de lidocaïne et de prilocaïne de 7,2 ng/ml. La somme des concentrations plasmatiques maximales de lidocaïne et de prilocaïne est inférieure d’un tiers à celle associée aux réactions toxiques et aucune accumulation n’est apparemment observée sur 10 jours.
Populations spéciales
Patients âgés
Après application de LIDOCAÏNE/PRILOCAÏNE BIOGARAN sur la peau intacte de patients gériatriques ou sur d’autres patients non gériatriques, les concentrations plasmatiques de lidocaïne et de prilocaïne sont très basses et nettement inférieures aux niveaux toxiques potentiels.
Population pédiatrique
Les concentrations plasmatiques maximales de lidocaïne et de prilocaïne après application de LIDOCAÏNE/PRILOCAÏNE BIOGARAN chez les patients pédiatriques de différents âges étaient également en dessous des niveaux potentiellement toxiques. Voir tableau 4.
Tableau 4. Concentrations plasmatiques de lidocaïne et de prilocaïne dans les groupes pédiatriques âgés de 0 mois à 8 ans
|
Age |
Quantité de crème appliquée |
Temps d’application de la crème sur la peau |
Concentration plasmatique [ng/ml] |
|
|
Lidocaïne |
Prilocaïne |
|||
|
0 - 3 mois |
1 g/10 cm² |
1 heure |
135 |
107 |
|
3 - 12 mois |
2 g/16 cm² |
4 heures |
155 |
131 |
|
2 - 3 ans |
10 g/100 cm² |
2 heures |
315 |
215 |
|
6 - 8 ans |
10 – 16 g/100-160 cm² (1 g/10 cm²) |
2 heures |
299 |
110 |
5.3. Données de sécurité préclinique
Aucun des deux anesthésiques locaux n’a présenté de potentiel génotoxique lors des tests de génotoxicité in vitro ou in vivo. Etant donné l’indication et la durée d’utilisation thérapeutique de ces substances actives, aucune étude de cancérogénicité n’a été réalisée avec la lidocaïne ou la prilocaïne, seules ou en association.
Un métabolite de la lidocaïne, le 2,6-diméthylaniline, et un métabolite de la prilocaïne, l’o-toluidine, ont fait preuve d’une activité génotoxique. Au cours d’études précliniques toxicologiques évaluant l’exposition chronique, ces métabolites ont montré un potentiel cancérogène. Les évaluations du risque comparant l’exposition humaine maximale calculée lors de l’utilisation intermittente de lidocaïne et de prilocaïne à l’exposition au cours des études précliniques, indiquent une grande marge de sécurité lors de l’utilisation clinique.
Des études de tolérance locale avec des mélanges de lidocaïne et de prilocaïne 1:1 (m/m) sous forme d’émulsion, de crème ou de gel ont montré que ces formulations sont bien tolérées par la peau intacte et lésée et par les muqueuses.
Lors d’une étude chez l’animal, une réaction irritative prononcée a été observée après application unique dans l’oeil d’une émulsion contenant 50 mg/g de lidocaïne + prilocaïne 1:1 (m/m). La concentration en anesthésiques locaux était identique et la formulation similaire à celles de LIDOCAÏNE/PRILOCAÏNE BIOGARAN. Cette réaction oculaire peut avoir été influencée par le pH élevé de la formulation de l’émulsion (environ 9) mais il est probable qu’elle soit due en partie au pouvoir irritant propre des anesthésiques locaux.
Après ouverture: le produit se conserve au maximum 6 mois
6.4. Précautions particulières de conservation
A conserver à une température ne dépassant pas + 25°C.
6.5. Nature et contenu de l'emballage extérieur
5 g en tube (Aluminium) verni (résine époxyphénolique) fermé par un bouchon (Polypropylène) + pansements adhésifs. Boîte de 1 tube et 2 pansements ou boîte de 5 tubes et 10 pansements.
30 g en tube (Aluminium) verni (résine époxyphénolique) fermé par un bouchon (Polypropylène).
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
Précautions à prendre avant de manipuler ou d’administrer le médicament
Les personnes qui appliquent ou enlèvent fréquemment la crème doivent veiller à ce que le contact soit évité afin de prévenir le développement d’hypersensibilité.
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
TOUR HEKLA
52 AVENUE DU GENERAL DE GAULLE
92800 PUTEAUX
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 567 513 9 6 : 5 g en tube (Aluminium) verni (résine époxyphénolique) + pansements adhésifs. Boîte de 5 tubes et 10 pansements.
· 34009 567 514 5 7 : 30 g en tube (Aluminium) verni (résine époxyphénolique).
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Liste II
ANSM - Mis à jour le : 05/02/2025
LIDOCAÏNE/PRILOCAÏNE BIOGARAN 5 %, crème
Lidocaïne/Prilocaïne
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin ou votre pharmacien.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que LIDOCAÏNE/PRILOCAÏNE BIOGARAN 5 %, crème et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d'utiliser LIDOCAÏNE/PRILOCAÏNE BIOGARAN 5 %, crème ?
3. Comment utiliser LIDOCAÏNE/PRILOCAÏNE BIOGARAN 5 %, crème ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver LIDOCAÏNE/PRILOCAÏNE BIOGARAN 5 %, crème ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE LIDOCAÏNE/PRILOCAÏNE BIOGARAN 5 %, crème ET DANS QUELS CAS EST-IL UTILISE ?
Classe pharmacothérapeutique - code ATC : N01B B20
LIDOCAÏNE/PRILOCAÏNE BIOGARAN 5 %, crème contient deux substances actives appelées la lidocaïne et la prilocaïne. Ces dernières appartiennent à un groupe de médicaments appelés anesthésiques locaux.
LIDOCAÏNE/PRILOCAÏNE BIOGARAN 5 %, crème fonctionne en provoquant une anesthésie de la surface de la peau pendant une courte durée. Ce médicament est appliqué sur la peau avant certains actes médicaux. Cela permet d’arrêter la douleur au niveau de la peau ; cependant, vous pouvez encore avoir les sensations de pression et de toucher.
Adultes, adolescents et enfants
Il peut être utilisé pour anesthésier la peau avant :
· l’insertion d’aiguilles (par exemple, si vous devez avoir une injection ou faire une prise de sang) ;
· des opérations mineures de la peau.
Adultes et adolescents
Il peut aussi être utilisé :
· pour anesthésier les parties génitales avant :
o de recevoir une injection ;
o certains actes médicaux tels que le retrait de verrues.
Un médecin ou un(e) infirmier/ère doit superviser l’utilisation de LIDOCAÏNE/PRILOCAÏNE BIOGARAN sur les parties génitales.
Adultes
Il peut aussi être utilisé pour anesthésier la peau avant :
· le nettoyage ou le retrait de la peau endommagée en cas d’ulcères de jambe.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER LIDOCAÏNE/PRILOCAÏNE BIOGARAN 5 %, crème ?
N’utilisez jamais LIDOCAÏNE/PRILOCAÏNE BIOGARAN 5 %, crème:
· Si vous êtes allergique (hypersensible) aux substances actives ou à l’un des autres composants contenus dans ce médicament, mentionnés dans la rubrique 6.
Avertissements et précautions
Adressez-vous à votre médecin ou votre pharmacien avant d’utiliser LIDOCAÏNE/PRILOCAÏNE BIOGARAN
· si vous ou votre enfant avez une maladie héréditaire rare qui affecte le sang, appelée « déficit en glucose-6-phosphate-déshydrogénase » ;
· si vous ou votre enfant avez un problème au niveau de la quantité de pigments sanguins appelé « méthémoglobinémie » ;
· n’utilisez pas LIDOCAÏNE/PRILOCAÏNE BIOGARAN sur les zones présentant des éruptions cutanées, des coupures, des écorchures ou d’autres plaies ouvertes, à l’exception des ulcères de jambe. Si l’un de ces problèmes est présent, vérifiez avec votre médecin ou pharmacien avant d’utiliser la crème ;
· si vous ou votre enfant souffrez d’une affection cutanée appelée « dermatite atopique », un temps d’application réduit peut être suffisant. Un temps d’application de plus de 30 minutes peut conduire à une augmentation de l’incidence des réactions cutanées locales (voir aussi rubrique 4 « Effets indésirables éventuels ») ;
· si vous prenez des médicaments spécifiques pour traiter les troubles du rythme cardiaque (anti-arythmiques de classe III tels que l’amiodarone). Dans ce cas, le médecin doit surveiller votre fonction cardiaque.
En raison de l’absorption potentiellement renforcée sur une peau récemment rasée, il est important de suivre la posologie recommandée, le site d’application et le temps d’application.
Evitez le contact de LIDOCAÏNE/PRILOCAÏNE BIOGARAN avec les yeux car il peut provoquer une irritation ou des brûlures chimique au niveau des yeux. Si vous recevez accidentellement LIDOCAINE/PRILOCAÏNE BIOGARAN dans votre œil, vous devez le rincer immédiatement à l’eau tiède ou avec une solution saline (chlorure de sodium). Veillez à ne rien recevoir d’autre dans les yeux jusqu’au retour de la sensibilité.
Les enfants doivent être surveillés lorsqu’ils utilisent LIDOCAÏNE/PRILOCAÏNE BIOGARAN sur une partie de leur corps, afin d’éviter le contact avec les yeux.
LIDOCAÏNE/PRILOCAÏNE BIOGARAN ne doit pas être appliqué à un tympan altéré.
Si vous utilisez LIDOCAÏNE/PRILOCAÏNE BIOGARAN avant d’être vacciné par des vaccins vivants (par exemple le vaccin contre la tuberculose), vous devez consulter à nouveau votre médecin ou votre infirmier/ère après la période de délai demandée dans le cadre du suivi de la vaccination.
Enfants et adolescents
Chez les nourrissons et les nouveau-nés âgés de moins de 3 mois, une augmentation transitoire, cliniquement non significative, de la quantité de pigments sanguins appelés « méthémoglobinémie » est fréquemment observée jusqu’à 12 heures après l’application de LIDOCAÏNE/PRILOCAÏNE BIOGARAN.
L’efficacité de LIDOCAÏNE/PRILOCAÏNE BIOGARAN lors du prélèvement sanguin au talon chez les nouveau-nés ou afin d’assurer une analgésie adéquate lors de la circoncision n’a pas pu être confirmée dans les études cliniques.
LIDOCAÏNE/PRILOCAÏNE BIOGARAN ne doit pas être appliqué sur les muqueuses génitales (par exemple dans le vagin) chez les enfants (âgés de moins de 12 ans) en raison de données insuffisantes sur l’absorption des substances actives.
LIDOCAÏNE/PRILOCAÏNE BIOGARAN ne doit pas être utilisé chez les enfants âgés de moins de 12 mois qui reçoivent simultanément d’autres traitements affectant la quantité de pigments sanguins « méthémoglobinémie » (par exemple les sulfamides, voir aussi rubrique 2 « Autres médicaments et LIDOCAÏNE/PRILOCAÏNE BIOGARAN»).
LIDOCAÏNE/PRILOCAÏNE BIOGARAN ne doit pas être utilisé chez les nourrissons prématurés.
Autres médicaments et LIDOCAÏNE/PRILOCAÏNE BIOGARAN 5 %, crème
Informez votre médecin ou pharmacien si vous utilisez/prenez, avez récemment utilisé/pris ou pourriez utiliser/prendre tout autre médicament. Ceci inclut les médicaments que vous achetez sans prescription et les médicaments à base de plantes. LIDOCAÏNE/PRILOCAÏNE BIOGARAN peut avoir un effet sur le mode d’action de certains médicaments et certains médicaments peuvent avoir un effet sur LIDOCAÏNE/PRILOCAÏNE BIOGARAN.
Informez en particulier votre médecin ou votre pharmacien, si vous ou votre enfant avez récemment utilisé ou reçu l’un des médicaments suivants :
· des médicaments utilisés pour traiter les infections appelés « sulfamides » et du nitrofurantoïne;
· des médicaments utilisés pour traiter l’épilepsie, appelés phénytoïne et phénobarbital ;
· d’autres anesthésiques locaux ;
· des médicaments pour traiter un rythme cardiaque irrégulier tels que l’amiodarone ;
· la cimétidine ou les béta-bloquants qui peuvent augmenter les concentrations de lidocaïne dans le sang. Cette interaction n’a pas d’impact clinique si LIDOCAÏNE/PRILOCAÏNE BIOGARAN est utilisé aux doses recommandées pour une courte durée de traitement.
LIDOCAÏNE/PRILOCAÏNE BIOGARAN 5 %, crème avec des aliments, boissons et de l’alcool
Sans objet.
Grossesse, allaitement et fertilité
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin ou pharmacien avant de prendre ce médicament.
Il est peu probable que LIDOCAÏNE/PRILOCAÏNE BIOGARAN, utilisé occasionnellement pendant la grossesse, provoque des effets indésirables sur le fœtus.
Les substances actives contenues dans LIDOCAÏNE/PRILOCAÏNE BIOGARAN (lidocaïne et prilocaïne) sont excrétées dans le lait maternel. Cependant, les quantités sont si faibles qu’il n’y a généralement pas de risque pour l’enfant.
Des études chez l’animal ont montré une absence d’altération de la fertilité chez le mâle ou la femelle.
Conduite de véhicules et utilisation de machines
LIDOCAÏNE/PRILOCAÏNE BIOGARAN n’a aucune ou qu’une influence négligeable sur l’aptitude à conduire et à utiliser des machines quand il est utilisé aux doses recommandées.
LIDOCAÏNE/PRILOCAÏNE BIOGARAN 5 %, crème contient de l’hydroxystéarate de macrogolglycérol. L’hydroxystéarate de macrogolglycérol (huile de ricin) peut provoquer des réactions cutanées.
3. COMMENT UTILISER LIDOCAÏNE/PRILOCAÏNE BIOGARAN 5 %, crème ?
Utilisation de LIDOCAÏNE/PRILOCAÏNE BIOGARAN
· le site d’application, la quantité à utiliser ainsi que le temps d’application dépendront de la raison pour laquelle LIDOCAÏNE/PRILOCAÏNE BIOGARAN est utilisé ;
· votre médecin, pharmacien ou infirmier/ère vous appliqueront la crème ou vous montreront comment le faire vous-même ;
· si LIDOCAÏNE/PRILOCAÏNE BIOGARAN est utilisé sur les parties génitales, l’application doit être supervisée par un médecin ou un(e) infirmier/ère ;
Ne pas utiliser LIDOCAÏNE/PRILOCAÏNE BIOGARAN 5 %, crème sur les zones suivantes :
· coupures, écorchures ou plaies, excepté les ulcères de jambe ;
· zone avec éruptions cutanées ou eczéma ;
· dans les yeux ou près des yeux ;
· à l’intérieur du nez, de l’oreille ou de la bouche ;
· au niveau de l’anus ;
· sur les parties génitales des enfants.
Les personnes qui appliquent ou enlèvent régulièrement la crème doivent s’assurer que tout contact est évité afin de prévenir le développement d’une hypersensibilité.
La membrane de protection du tube est perforée à l’aide du capuchon.
Utilisation sur la peau avant de petits actes médicaux (comme l’insertion d’aiguille ou des opérations mineures de la peau) :
· la crème est appliquée sur la peau en couche épaisse. Votre médecin, pharmacien ou votre infirmier/ère vous diront où vous devrez l’appliquer ;
· la crème est ensuite recouverte par un pansement [ruban adhésif]. Ce dernier sera enlevé juste avant le début de l’intervention. Si vous appliquez vous-même la crème, assurez-vous d’avoir reçu des pansements de la part de votre médecin, pharmacien ou infirmier/ère ;
· la dose usuelle chez les adultes et les adolescents âgés de plus de 12 ans est de 2 g (grammes) ;
· chez les adultes et adolescents âgés de plus de 12 ans, la crème doit être appliquée au moins 60 minutes avant le début de l’intervention (excepté si la crème est utilisée au niveau des parties génitales). Cependant, ne pas appliquer la crème plus de 5 heures avant le début de l’intervention ;
· chez les enfants, la quantité de LIDOCAINE/PRILOCAÏNE BIOGARAN utilisée et le temps d’application dépendent de leur âge. Votre médecin, infirmier/ère ou pharmacien vous diront la quantité à utiliser et à quel moment l’appliquer.
Lorsque vous appliquez la crème, il est très important de suivre exactement les instructions suivantes :
1. Appliquer la quantité de crème prescrite en couche épaisse sans la masser, sur la zone à anesthésier.
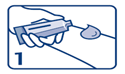


2. Retirer la partie cartonnée du pansement adhésif (face non imprimée).
3. Placer la face adhésive du pansement de façon à couvrir la crème (bien faire adhérer les bords du pansement pour assurer l’étanchéité).
4. Puis retirer la feuille imprimée.

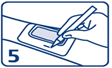
5. Indiquer l’heure d’application sur le bord du pansement.
Laisser la crème et le pansement en place pendant le temps recommandé par votre médecin, au minimum 60 minutes.
Utilisation sur des zones de peau plus larges nouvellement rasées avant une intervention médicale ambulatoire (comme certaines techniques d’épilation) :
La dose usuelle est de 1 g de crème pour 10 cm² (10 centimètres carrés) de peau appliquée pendant 1 à 5 heures sous un pansement. LIDOCAÏNE/PRILOCAÏNE BIOGARAN ne doit pas être utilisé sur une surface de peau nouvellement rasée dont la superficie dépasse les 600 cm² (600 centimètres carrés, par exemple 30 cm sur 20 cm). La dose maximale est de 60 g.
Utilisation sur la peau avant une intervention chirurgicale (comme une greffe de peau mince) nécessitant une anesthésie plus profonde de la peau :
· LIDOCAÏNE/PRILOCAÏNE BIOGARAN peut être utilisé à cette fin chez les adultes et les adolescents âgés de plus de 12 ans ;
· la dose usuelle est de 1,5 à 2 g de crème pour 10 cm² (10 centimètres carrés) de peau ;
· la crème est appliquée sous un pansement pendant 2 à 5 heures.
Utilisation sur la peau avant l’enlèvement de taches ressemblant à des verrues appelées « molluscum »
· LIDOCAÏNE/PRILOCAÏNE BIOGARAN peut être utilisé chez les enfants et adolescents présentant une maladie de peau appelée « dermatite atopique » ;
· la dose usuelle dépend de l’âge de l’enfant et est appliquée pendant 30 à 60 minutes (30 minutes si le patient a une dermatite atopique). Votre médecin, infirmier/ère ou pharmacien vous diront la quantité de crème à appliquer.
Utilisation sur la peau des parties génitales avant l’injection d’anesthésiques locaux
· LIDOCAÏNE/PRILOCAÏNE BIOGARAN peut être utilisé à cette fin uniquement chez les adultes et les adolescents âgés de plus de 12 ans ;
· la dose usuelle est de 1 g de crème (1 à 2 g pour la peau des organes génitaux féminins) pour 10 cm² (10 centimètres carrés) de peau ;
· la crème doit être recouverte par un pansement. Elle doit être appliquée pendant 15 minutes sur la peau des organes génitaux masculins et pendant 60 minutes sur la peau des organes génitaux féminins.
Utilisation sur les parties génitales avant des chirurgies mineures de la peau (comme le retrait de verrues)
· LIDOCAÏNE/PRILOCAÏNE BIOGARAN peut être utilisé à cette fin uniquement chez les adultes et adolescents âgés de plus de 12 ans ;
· la dose usuelle est de 5 à 10 g de crème pendant 10 minutes. Un pansement n’est pas utilisé. L’intervention médicale doit débuter aussitôt après.
Utilisation sur les ulcères de jambe avant le nettoyage ou le retrait de la peau endommagée
· la dose usuelle est de 1 à 2 g de crème pour 10 cm² de peau jusqu’à un total de 10 g ;
· la crème est recouverte par un pansement hermétique tel qu’un ruban adhésif. Elle doit être appliquée 30 à 60 minutes avant que l’ulcère ne soit nettoyé. Retirer la crème avec une compresse et commencer le nettoyage sans délai ;
· LIDOCAÏNE/PRILOCAÏNE BIOGARAN peut être utilisé avant le nettoyage des ulcères de jambe jusqu’à 15 fois sur une période de 1 à 2 mois ;
· le tube LIDOCAÏNE/PRILOCAÏNE BIOGARAN est destiné à l’usage unique lorsqu’il est utilisé sur les ulcères de jambe : le tube ainsi que le contenu restant doivent être jetés après chaque traitement.
Si vous avez utilisé plus de LIDOCAÏNE/PRILOCAÏNE BIOGARAN 5 %, crème que vous n’auriez dû
Consultez immédiatement votre médecin ou votre pharmacien.
Si vous avez utilisé plus de LIDOCAINE PRILOCAINE BIOGARAN que votre médecin, pharmacien ou infirmier/ère vous a prescrit, informez-les aussitôt, même si vous ne ressentez aucun symptôme.
Les symptômes d’un surdosage de LIDOCAÏNE/PRILOCAÏNE BIOGARAN sont listés ci-dessous. Il est peu probable que de tels symptômes surviennent si LIDOCAÏNE/PRILOCAÏNE BIOGARAN est utilisé aux doses recommandées.
· Sensation d’étourdissement ou sensation vertigineuse.
· Picotements de la peau autour de la bouche et engourdissement de la langue.
· Goût anormal.
· Vision floue.
· Bourdonnement dans les oreilles.
· Un risque de « méthémoglobinémie aiguë » existe aussi (un problème avec les quantités de pigments sanguins). Ceci est plus probable quand certains médicaments ont été pris simultanément. Si cela se produit, la peau prend une coloration bleu gris en raison d’un manque d’oxygène.
Dans les cas graves de surdosage, les symptômes peuvent inclure des convulsions, une baisse de la pression artérielle, un ralentissement de la respiration, un arrêt respiratoire et une altération du rythme cardiaque. Ces effets peuvent engager le pronostic vital.
Si vous oubliez d’utiliser LIDOCAÏNE/PRILOCAÏNE BIOGARAN 5 %, crème
Si vous arrêtez d’utiliser LIDOCAÏNE/PRILOCAÏNE BIOGARAN 5 %, crème
Sans objet.
Si vous avez d’autres questions sur l’utilisation de ce médicament, demandez plus d’informations à votre médecin, à votre pharmacien ou à votre infirmier/ère.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Une légère réaction (pâleur ou rougeur de la peau, légère enflure, brûlure initiale ou démangeaisons) peut survenir au niveau de la zone sur laquelle LIDOCAÏNE PRILOCAÏNE BIOGARAN a été appliqué. Ce sont des réactions normales liées à la crème et à la présence des anesthésiques et elles disparaîtront rapidement sans que des mesures spécifiques ne soient nécessaires.
Si vous ressentez des effets gênants ou inhabituels pendant que vous utilisez LIDOCAÏNE/PRILOCAÏNE BIOGARAN, cessez son utilisation et consultez votre médecin, ou votre pharmacien aussi vite que possible.
Fréquent (peut affecter jusqu’à 1 personne sur 10)
· Réactions locales transitoires de la peau (pâleur, rougeur, gonflement) au site d’application pendant le traitement de la peau, des muqueuses génitales ou des ulcères de jambes.
· Sensation initiale légère de brûlure, de démangeaison ou de chaleur au site d’application pendant le traitement des muqueuses génitales ou des ulcères de jambes.
Peu fréquent (peut affecter jusqu’à 1 personne sur 100)
· Sensation initiale légère de brûlure, de démangeaison ou de chaleur au site d’application pendant le traitement de la peau.
· Engourdissement (picotement) au site d’application pendant le traitement des muqueuses génitales.
· Irritation de la peau au site d’application pendant le traitement des ulcères de jambe.
Rare (peut affecter jusqu’à 1 personne sur 1 000)
· Réactions allergiques, qui dans de rares cas peuvent conduire à un choc anaphylactique (éruption cutanée, gonflement, fièvre, difficultés respiratoires et évanouissement) pendant le traitement de la peau, des muqueuses génitales ou des ulcères de jambes.
· Méthémoglobinémie (trouble sanguin) pendant le traitement de la peau.
· Petits saignements en forme de points au site d’application (particulièrement chez les enfants présentant de l’eczéma en cas d’application prolongée) pendant le traitement de la peau.
· Irritations des yeux lorsque LIDOCAÏNE/PRILOCAÏNE BIOGARAN a été accidentellement en contact avec les yeux pendant le traitement de la peau.
Fréquence inconnue (dont la fréquence ne peut être estimée sur la base des données disponibles)
· Brûlures chimiques des yeux si LIDOCAÏNE/PRILOCAÏNE BIOGARAN a été accidentellement en contact avec les yeux pendant le traitement.
Effets indésirables supplémentaires chez les enfants
Méthémoglobinémie, une maladie du sang, qui est plus souvent observée, dans le cas de surdosage chez les nouveau-nés et les nourrissons âgés de 0 à 12 mois.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou, votre pharmacien ou à votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet: https://signalement.social-sante.gouv.fr/
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER LIDOCAÏNE/PRILOCAÏNE BIOGARAN 5 %, crème ?
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur l’emballage et le tube après EXP. La date de péremption fait référence au dernier jour de ce mois.
Avant ouverture : A conserver à une température ne dépassant pas +25°C.
Après ouverture : le produit se conserve au maximum 6 mois.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient LIDOCAÏNE/PRILOCAÏNE BIOGARAN 5%, crème
· Les substances actives sont :
Lidocaïne .......................................................................................................................... 2,5 g
Prilocaïne ......................................................................................................................... 2,5 g
Pour 100 g de crème.
· Les autres composants sont :
Carbomère (carbopol 980NF), hydroxystéarate de macrogolglycérol 25 (huile de ricin hydrogénée polyoxyéthylénée), hydroxyde de sodium, eau purifiée.
Qu’est-ce que LIDOCAÏNE/PRILOCAÏNE BIOGARAN 5%, crème et contenu de l’emballage extérieur
Ce médicament se présente sous forme de crème. Tube de 5 g (boîte de 1 tube avec 2 pansements adhésifs ou 5 tubes avec 10 pansements adhésifs) ou tube de 30 g.
Toutes les présentations peuvent ne pas être commercialisées.
Titulaire de l’autorisation de mise sur le marché
TOUR HEKLA
52 AVENUE DU GENERAL DE GAULLE
92800 PUTEAUX
Exploitant de l’autorisation de mise sur le marché
15 BOULEVARD CHARLES DE GAULLE
92700 COLOMBES
93 ROUTE DE LA MONNAIE
37210 VOUVRAY
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Sans objet.
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).