Dernière mise à jour le 01/12/2025
FERTISTARTKIT 75 UI, poudre et solvant pour solution injectable
Indications thérapeutiques
Classe pharmacothérapeutique : Gonadotrophines - code ATC : G03GA02
Indications thérapeutiques :
· FERTISTARTKIT est utilisé pour provoquer l'ovulation chez des femmes qui n'ovulent pas et qui n'ont pas répondu au traitement par le citrate de clomifène.
· FERTISTARTKIT est utilisé pour stimuler la croissance de plusieurs follicules (et par conséquent plusieurs oeufs) chez les femmes ayant recours à un traitement pour la fertilité.
FERTISTARTKIT est une hormone post-ménopausique humaine, hautement purifiée, appartenant au groupe pharmacothérapeutique des gonadotrophines.
Un flacon contient de la poudre lyophilisée avec 75 UI d’activité d’hormone folliculo-stimulante (FSH) et 75 UI d’activité d’hormone lutéinisante (LH) humaine.
La gonadotrophine ménopausique humaine (HMG) est extraite de l'urine des femmes ménopausées. De la gonadotrophine chorionique humaine (hCG), extraite de l’urine des femmes enceintes, est ajoutée pour contribuer à l’activité LH totale.
Ce médicament doit être utilisé sous surveillance médicale.
Présentations
> 5 flacon(s) en verre de 75 UI - 5 seringue(s) préremplie(s) en verre de 1 ml avec aiguille(s)
Code CIP : 34009 300 210 9 5
Déclaration de commercialisation : 11/03/2016
Cette présentation est agréée aux collectivités
- Prix hors honoraire de dispensation : 87,93 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 88,95 €
- Taux de remboursement :100%
> 10 flacon(s) en verre de 75 UI - 10 seringue(s) préremplie(s) en verre de 1 ml avec aiguille(s)
Code CIP : 34009 300 211 0 1
Déclaration d'arrêt de commercialisation : 31/12/2024
Cette présentation n'est pas agréée aux collectivités
- Prix hors honoraire de dispensation : 166,44 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 167,46 €
- Taux de remboursement :100%
Service médical rendu (SMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Important | Avis du 02/12/2015 | Inscription (CT) | Le service médical rendu par MENOTROPHINE LG est important dans : • l’induction de l’ovulation dans un contexte d’aménorrhée ou d’anovulation chez les femmes qui n’ont pas répondu au traitement par citrate de clomiphène, • l’hyperstimulation ovarienne contrôlée pour induire le développement de follicules multiples dans le cadre des techniques d’assistance médicale à la procréation telles que la fécondation in vitro. |
Amélioration du service médical rendu (ASMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprés de la HAS (plus d'informations dans l'aide). Les avis et synthéses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur de l'ASMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| V (Inexistant) | Avis du 02/12/2015 | Inscription (CT) | Les données d’efficacité n’étant pas en faveur d’une supériorité cliniquement pertinente de MENOTROPHINE LG, ces spécialités n’apportent pas d’amélioration du service médical rendu (ASMR V) par rapport à MENOPUR dans les indications de l’AMM. |
Autres informations
- Titulaire de l'autorisation : IBSA PHARMA SAS
- Conditions de prescription et de délivrance :
- liste I
- médicament nécessitant une surveillance particulière pendant le traitement
- prescription réservée aux spécialistes et services ENDOCRINOLOGIE
- prescription réservée aux spécialistes et services GYNECOLOGIE
- prescription réservée aux spécialistes et services MALADIES METABOLIQUES
- prescription réservée aux spécialistes et services OBSTETRIQUE
- Statut de l'autorisation : Valide
- Type de procédure : Procédure décentralisée
- Code CIS : 6 405 281 4
ANSM - Mis à jour le : 26/06/2024
FERTISTARTKIT 75 UI, poudre et solvant pour solution injectable
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Un flacon contient de la poudre lyophilisée avec 75 UI d’activité d’hormone folliculo-stimulante (FSH) et 75 UI d’activité d’hormone lutéinisante (LH) humaine.
La gonadotrophine ménopausique humaine (HMG) est extraite de l'urine des femmes ménopausées. De la gonadotrophine chorionique humaine (hCG), extraite de l’urine des femmes enceintes, est ajoutée pour contribuer à l’activité LH totale.
Pour la liste complète des excipients, voir rubrique 6.1
Poudre et solvant pour solution injectable.
Poudre en flacon : Bouchon ou poudre lyophilisée blanche.
Solvant en seringue pré-remplie : solution claire et incolore
4.1. Indications thérapeutiques
Hyperstimulation ovarienne contrôlée (HOC) pour induire le développement de follicules multiples dans le cadre des techniques d'assistance médicale à la procréation (AMP) telles que la fécondation in vitro (FIV).
4.2. Posologie et mode d'administration
Le traitement par FERTISTARTKIT doit être instauré sous la surveillance d’un médecin ayant l’expérience du traitement de stérilité.
Il existe de grandes variations inter- et intra-individuelles dans la réponse ovarienne aux gonadotrophines exogènes. De ce fait, il est impossible de définir un schéma posologique unique. La posologie doit donc être ajustée individuellement en fonction de la réponse ovarienne. Ceci nécessite la mise en œuvre d'examens échographiques et d'une surveillance des taux d'œstradiol.
· Anovulation:
L'objectif du traitement par FERTISTARTKIT est de développer un seul follicule de De Graaf mature, à partir duquel l'ovule sera libéré après l'administration d'hCG.
FERTISTARTKIT peut être administré en injection quotidienne. Chez les patientes réglées, le traitement devra commencer au cours des 7 premiers jours du cycle menstruel.
Un traitement standard commence avec 75 à 150 UI de FSH par jour et est augmenté, si nécessaire, de 37,5 UI (jusqu'à 75 UI), à 7 jours ou de préférence à 14 jours d'intervalle, afin d'obtenir une réponse adéquate, mais non excessive.
La dose quotidienne maximale de FERTISTARTKIT ne doit, en général, pas dépasser 225 UI.
Le traitement devra être adapté à la réponse individuelle de chaque patiente déterminée en mesurant la taille du follicule dominant par échographie et/ou les taux d'estrogènes.
La dose quotidienne est ensuite maintenue jusqu’à l’obtention de conditions préovulatoires. 7 à 14 jours de traitement suffisent habituellement à créer ces conditions.
L'administration de FERTISTARTKIT est alors interrompue et l'ovulation peut être induite par administration de gonadotrophine chorionique humaine (hCG).
Si le nombre de follicules répondeurs est trop élevé ou si les concentrations d'estradiol augmentent trop rapidement, plus d'un doublement par jour pendant deux ou trois jours consécutifs, la dose quotidienne devra être réduite. Etant donné que les follicules de plus de 14 mm peuvent conduire à une grossesse, la présence de multiples follicules préovulatoires de plus de 14 mm fait courir le risque de grossesses multiples. Dans ce cas, l'hCG ne sera pas administrée et la grossesse devra être évitée afin de prévenir une grossesse multiple. La patiente devra utiliser un moyen de contraception mécanique ou s'abstenir d'avoir des rapports sexuels jusqu'au début du cycle menstruel suivant (voir rubrique 4.4). Le traitement devra reprendre lors du cycle suivant à une posologie inférieure à celle du cycle abandonné.
En l'absence de réponse adéquate, après 4 semaines de traitement, ce cycle devra être abandonné et la patiente recommencera un traitement avec une dose de départ plus élevée que dans le cycle abandonné.
Quand une réponse optimale est obtenue, une injection unique de 5000 UI à 10000 UI d'hCG, devra être administrée 24 à 48 heures après la dernière injection de FERTISTARTKIT. On recommandera alors à la patiente d'avoir un rapport sexuel le jour même et le jour suivant l'administration d'hCG.
Sinon, une insémination artificielle peut être réalisée.
· Hyperstimulation ovarienne contrôlée pour induire le développement de follicules multiples dans le cadre des techniques d'AMP:
La désensibilisation avec un agoniste de la Gonadotrophin-Releasing Hormone (GnRH) ou un antagoniste de l’hormone gonadotrope (antagoniste GnRH) est maintenant fréquemment utilisée pour supprimer le pic de LH endogène et contrôler la sécrétion basale de LH.
Dans un schéma thérapeutique courant, on commence l'administration de FERTISTARTKIT environ 2 semaines après le début du traitement par l'agoniste, les deux traitements étant poursuivis jusqu'à l'obtention d'une croissance folliculaire adéquate. Par exemple, on administrera, après les 2 semaines de traitement par agoniste, 150 à 225 UI de FSH durant les 5 à 7 premiers jours. La dose sera ensuite adaptée en fonction de la réponse ovarienne.
Un autre schéma thérapeutique destiné à provoquer une superovulation comprend l'administration de 150 à 225 UI de FSH par jour, en commençant le 2ème ou le 3ème jour du cycle. Le traitement sera poursuivi jusqu'à l'obtention d'une croissance folliculaire adéquate (déterminée par le contrôle des taux sériques d'œstrogènes et/ou un examen échographique) en ajustant la posologie en fonction de la réponse de la patiente (habituellement pas au-delà de 450 UI/jour). En général, un développement folliculaire adéquat est obtenu, en moyenne, vers le 10ème jour de traitement (5 à 20 jours).
Lorsqu'une réponse optimale est obtenue, une injection unique de 5000 à 10000 UI d'hCG est administrée 24 à 48 heures après la dernière injection de FERTISTARTKIT, pour induire la maturation folliculaire finale.
La ponction folliculaire destinée à recueillir les ovocytes est réalisée 34 à 35 heures plus tard.
Population pédiatrique
Le médicament n’est pas destiné à un usage pédiatrique.
Mode d’administration
FERTISTARTKIT est destiné à une administration par voie sous-cutanée ou intramusculaire.
La poudre doit être reconstituée immédiatement avant l’utilisation, avec le solvant joint.
Pour éviter les injections douloureuses et pour limiter les fuites au point d'injection, FERTISTARTKIT doit être administré lentement par voie sous-cutanée. On changera les points d'injection sous-cutanée afin d'éviter l'apparition de lipo-atrophie. Toute solution non utilisée doit être jetée.
L'injection sous-cutanée pourra être réalisée par la patiente elle-même, si les instructions et les recommandations du médecin ont été données et suivies strictement.
Pour les instructions concernant la reconstitution du médicament avant administration, voir la rubrique 6.6.
· Hypersensibilité à la ménotropine ou à l’un des excipients mentionnés à la rubrique 6.1 ;
· Ovaires hypertrophiés ou kystes non imputables à un syndrome des ovaires polykystiques;
· Saignements gynécologiques d'étiologie inconnue;
· Carcinomes ovariens, utérins ou mammaires;
· Tumeurs hypothalamiques ou hypophysaires.
FERTISTARTKIT est contre-indiqué lorsqu’une réponse efficace ne pourra pas être obtenue, par exemple :
· Insuffisance ovarienne primaire;
· Malformations des organes génitaux incompatibles avec une grossesse;
· Fibrome utérin incompatible avec une grossesse.
4.4. Mises en garde spéciales et précautions d'emploi
La première injection de FERTISTARTKIT doit être réalisée sous contrôle médical strict.
L'auto-injection de FERTISTARTKIT ne devra être réalisée que par des patientes motivées, entraînées et pouvant disposer de conseils avisés. Au préalable, il faudra lui montrer la technique d'injection sous -cutanée, indiquer les zones d'injection possibles, montrer comment on prépare la solution à injecter.
Avant de commencer le traitement, les couples infertiles devront subir des examens et les éventuelles contre-indications d'une grossesse devront être recherchées. Les examens porteront tout particulièrement sur l'hypothyroïdie et l'insuffisance corticosurrénalienne, l'hyperprolactinémie et les tumeurs hypothalamiques ou hypophysaires pour lesquelles des traitements spécifiques seront prescrits.
Hyperstimulation ovarienne non souhaitée
Un suivi échographique du développement folliculaire et une détermination des taux d’oestradiol doivent être réalisés avant le traitement et surveillés à intervalles réguliers pendant le traitement. Ceci est particulièrement important au début de la stimulation (voir ci-dessous).
Hormis le développement d'un nombre élevé de follicules, les concentrations d'estradiol peuvent augmenter très rapidement, par exemple plus d'un doublement par jour pendant deux ou trois jours consécutifs, et éventuellement atteindre des valeurs excessives. Le diagnostic d'hyperstimulation ovarienne peut être confirmé par échographie. Si cette hyperstimulation ovarienne non souhaitée se produit (c'est-à-dire n'entrant pas dans le cadre d'une hyperstimulation ovarienne contrôlée dans un programme de procréation médicalement assistée), l'administration de FERTISTARTKIT devra être interrompue. Dans ce cas, on évitera toute possibilité de grossesse et l'hCG ne sera pas administrée parce qu'elle pourrait induire, en plus d'une ovulation multiple, un syndrome d'hyperstimulation ovarienne (SHO). Les signes et symptômes cliniques d'un syndrome d'hyperstimulation ovarienne d'intensité légère sont des douleurs abdominales, des nausées, de la diarrhée et une augmentation de volume discrète à modérée des ovaires ainsi que des kystes ovariens. Dans de rares cas, un syndrome d'hyperstimulation ovarienne sévère, susceptible de menacer le pronostic vital, peut apparaître. Il se caractérise par de gros kystes ovariens (ayant tendance à se rompre), une ascite, souvent un hydrothorax et une prise de poids. Dans de rares cas, une thromboembolie veineuse ou artérielle peut survenir en association avec un SHO (voir rubrique 4.8.).
Grossesses multiples
L'incidence des grossesses multiples après assistance médicale à la procréation est corrélée au nombre d'ovocytes/embryons transférés. Chez les patientes recevant un traitement d'induction de l'ovulation, l'incidence des grossesses et des naissances multiples est accrue, comparée au mode de conception naturel. La majorité des grossesses multiples sont gémellaires. Afin de limiter les risques de grossesses multiples, une surveillance attentive de la réponse ovarienne est recommandée.
Fausses couches
Les taux de fausse couche spontanée sont plus élevés chez les patientes recevant de la HMG que ceux rencontrés dans la population générale, mais comparables à ceux retrouvés chez des femmes présentant d'autres problèmes de fertilité.
Grossesses ectopiques
Etant donné que les femmes infertiles suivant des traitements de procréation médicalement assistée, notamment des FIV, présentent souvent des anomalies tubaires, l'incidence de grossesses extra-utérines peut être augmentée. Il est important de confirmer par une échographie précoce si la grossesse est intra-utérine.
Tumeurs des organes de la reproduction
Des tumeurs bénignes et malignes de l'ovaire et des autres organes de la reproduction ont été rapportées chez les femmes ayant eu recours à plusieurs traitements médicaux pour traiter l'infertilité. Il n'a pas encore été établi si un traitement par gonadotrophines augmente ou non le risque de ces tumeurs chez les femmes infertiles.
Malformations congénitales
Après utilisation des techniques de reproduction assistée, l'incidence des malformations congénitales peut être légèrement plus élevée qu'après conceptions naturelles. Ceci peut être dû à des différences dans les caractéristiques des parents (ex.: âge de la mère, caractéristiques du sperme) et aux grossesses multiples
Evénements thromboemboliques
Les femmes présentant des facteurs de risque généralement reconnus de thrombose, tels qu'un antécédent personnel ou familial, une obésité sévère (indice de masse corporel > 30 kg/m2) ou une thrombophilie connue, peuvent présenter un risque augmenté d'évènements thromboemboliques veineux ou artériel, au cours ou après traitement par gonadotrophines. Chez ces femmes, les bénéfices d'un traitement par FIV doivent être comparés avec les risques (voir rubrique 4.8).
Informations Complémentaires
Ce médicament contient moins de 1 mmol de sodium (23 mg) par solution reconstituée, c'est-à-dire qu'il est essentiellement « sans sodium ».
Afin d'améliorer la traçabilité de ce médicament biologique, il convient d’enregistrer avec précision le nom et le numéro de lot du produit administré.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
4.6. Fertilité, grossesse et allaitement
Grossesse
FERTISTARTKIT ne doit pas être utilisé pendant la grossesse.
Aucun risque tératogène n'a été rapporté suite à une hyperstimulation ovarienne contrôlée lors de l'utilisation clinique de gonadotrophines urinaires. A ce jour, aucune autre donnée épidémiologique n'est disponible.
Aucun effet tératogène n'a été observé au cours d'études chez l'animal.
FERTISTARTKIT ne doit pas être utilisé pendant l’allaitement.
La sécrétion de prolactine pendant l'allaitement peut entraîner une faible réponse à la stimulation ovarienne.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
L’effet indésirable le plus couramment observé dans les essais cliniques menés avec FERTISTARTKIT est l’hyperstimulation ovarienne (SHO) (liée à la dose), généralement légère et accompagnée d’une légère augmentation du volume des ovaires, d’un inconfort ou d’une douleur abdominale. Seul un cas de SHO s’est avéré grave.
Les effets indésirables les plus fréquents avec FERTISTARTKIT étaient les céphalées et la distension abdominale, ainsi que les nausées, la fatigue, le vertige et la douleur au site d’injection.
Le tableau ci-dessous présente les principales réactions indésirables (> 1 %) chez les femmes traitées par FERTISTARTKIT dans les essais cliniques, par système corporel et fréquence. Dans chaque groupe de fréquence, les effets indésirables sont présentés par ordre décroissant de gravité.
Dans chaque classe de système d’organes, les effets indésirables sont classés par fréquence, avec les réactions les plus fréquentes en premier, à l’aide de la convention suivante :
Très fréquent (≥1/10) ; fréquent (≥1/100, ≤1/10) ; peu fréquent (≥1/1 000, ≤1/100) ; rare (≥1/10 000, ≤1/1 000) ; très rare (≥1/10 000), fréquence indéterminée (ne peut être estimée sur la base des données disponibles).
|
Système corporel* |
Fréquence |
Réaction indésirable à un médicament |
|
Affections du système nerveux |
Très fréquent |
Céphalées |
|
Fréquent |
Vertige |
|
|
Affections gastro-intestinales |
Très fréquent |
Distension abdominale |
|
Fréquent |
Inconfort abdominal, douleur abdominale, nausées |
|
|
Affections musculo-squelettiques et systémiques |
Fréquent |
Dorsalgie, sensation de lourdeur |
|
Affections des organes de reproduction et du sein |
Fréquent |
Syndrome d’hyperstimulation ovarienne, douleur pelvienne, hypersensibilité mammaire |
|
Troubles généraux et anomalies au site d’administration |
Fréquent |
Douleur au site d’injection, réaction au site d’injection, fatigue, malaise, soif |
|
Affections vasculaires |
Fréquent |
Bouffées de chaleur |
|
Rare |
Accidents thromboemboliques |
*Le terme MedDRA le plus approprié est mentionné pour décrire une certaine réaction ; les synonymes ou affections apparentées ne sont pas mentionnés mais doivent être pris en compte également.
D’après les études publiées, les effets indésirables suivants ont été observés chez des patientes traitées par gonadotrophines post-ménopausiques humaines :
· Hyperstimulation ovarienne (SHO) sévère accompagnée d’une hypertrophie ovarienne et de la formation de kystes, douleur abdominale aiguë, ascites, épanchement pleural, hypovolémie, choc et troubles thrombo-emboliques. (Voir aussi rubrique 4.4)
· Torsion de l'ovaire, généralement associée aux formes sévères de SHO
· Rupture de kystes ovariens accompagnée d’une hémorragie intra-péritonéale ; quelques cas de rupture de kyste se sont révélés fatales.
· Des réactions allergiques également accompagnées de symptômes généralisés ont aussi été rapportées après le traitement avec des produits à base de gonadotrophine. (Voir aussi rubrique 4.4)
Les réactions locales au site d’injection, telles que douleur, rougeur, hématome, gonflement et/ou irritation, font partie des effets indésirables attendus après l’administration de gonadotrophines.
La fréquence de ces événements serait supérieure en cas d’administration intramusculaire, par rapport à l’injection sous-cutanée.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr.
On ne dispose d’aucune donnée sur la toxicité aiguë de la ménotropine chez l’homme, mais la toxicité aiguë des préparations de gonadotrophines urinaires s’est avérée très faible dans les études réalisées chez l’animal. L’administration de ménotropine à une posologie trop élevée peut conduire à une hyperstimulation ovarienne (voir rubrique 4.4).
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : gonadotrophines, code ATC : G03GA02.
La substance active contenue dans FERTISTARTKIT est l’hormone gonadotrophine post-ménopausique humaine hautement purifiée (ménotropine).
L’activité FSH de FERTISTARTKIT est obtenue à partir des urines de femmes ménopausées ; l’activité LH est obtenue à partir des urines de femmes ménopausées et de femmes enceintes. La préparation est normalisée de façon à avoir un rapport d’activité FSH/LH d’environ 1.
Dans les ovaires, la FSH induit une augmentation du nombre de follicules en formation et stimule leur développement. La FSH augmente la production d’oestradiol dans la granulosa en induisant l’aromatisation des androgènes produits dans la thèque sous l’influence de la LH.
5.2. Propriétés pharmacocinétiques
L’efficacité biologique de la ménotropine est principalement due à son constituant FSH. La pharmacocinétique de la ménotropine après une administration intramusculaire ou sous-cutanée affiche une forte variabilité interindividuelle. D’après les données issues des études réalisées avec la ménotropine, après une injection unique de 300 UI, le taux sérique maximal de FSH (Cmax) est atteint environ 19 heures après l’injection intramusculaire et 22 heures après l’injection sous-cutanée. Les pics de FSH ont atteint 6,5 ± 2,1 UI/l avec une AUC0-t de 438,0 ± 124,0 UIxh/l après l’administration intramusculaire. Après l’administration sous-cutanée, les pics de FSH ont atteint 7,5 ± 2,8 UI/l avec une AUC0-t de 485,0 ± 93,5 UIxh/l.
L’AUC et la Cmax de LH se sont révélées significativement plus basses dans le groupe sous-cutané par rapport au groupe intramusculaire. Ceci peut être dû aux très faibles taux détectés (proches ou en dessous des limites de détection) dans les deux groupes et à la forte variabilité intra- et interindividuelle.
La demi-vie d’élimination est d’environ 45 heures après l’administration intramusculaire et de 40 heures après l’administration sous-cutanée.
Après l’administration, l’excrétion de la ménotropine est essentiellement rénale.
La pharmacocinétique chez des patients présentant une atteinte hépatique ou rénale n’a pas été étudiée.
5.3. Données de sécurité préclinique
Aucune étude non clinique n’a été menée avec FERTISTARTKIT.
Solvant : chlorure de sodium et eau pour préparation injectable
2 ans.
Après reconstitution, une utilisation immédiate est recommandée.
6.4. Précautions particulières de conservation
6.5. Nature et contenu de l'emballage extérieur
Poudre en flacon (verre de type I), muni d’un bouchon en caoutchouc bromobutyle siliconé serti d’un opercule (aluminium et plastique coloré : 75 UI vert clair, 150 UI vert foncé) + 1 ml de solvant dans une seringue préremplie (verre de type I) fermée par un capuchon (isoprène et bromobutyle) et munie d’un bouchon piston (chlorobutyl et silicone) + 1 aiguille pour la reconstitution et l’injection intramusculaire et 1 aiguille pour l’injection sous-cutanée. Ces 4 éléments sont conditionnés en blister (PVC) ; packs de 1, 5 et 10 étuis.
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
La solution doit être préparée juste avant l’injection.
Chaque flacon est à usage unique. Le médicament doit être reconstitué dans des conditions aseptiques.
FERTISTARTKIT ne doit être reconstitué qu’avec le solvant fourni dans l’emballage.
Une surface de travail propre doit être préparée et les mains doivent être préalablement lavées avant la reconstitution de la solution.
Placer sur la surface propre tous les accessoires suivants :
· deux cotons imbibés d'alcool (non fournis),
· un flacon contenant la poudre de FERTISTARTKIT
· une seringue préremplie de solvant
· une aiguille pour la reconstitution de la solution à injecter et pour l’injection intramusculaire
· une aiguille fine pour l’injection sous-cutanée
RAPPEL : Ne retirez pas le bouchon protecteur (col blanc) de la seringue préremplie, car il empêche le retrait accidentel du bouchon et facilite la manipulation de la seringue pendant l'injection.
Reconstitution de la poudre pour solution injectable
Préparez la solution injectable :
Décapuchonnez la seringue préremplie, introduisez l’aiguille de reconstitution (aiguille longue) dans la seringue.
1. Retirez le capuchon en plastique coloré du flacon contenant la poudre de FERTISTARTKIT et désinfectez la surface du bouchon en caoutchouc en l’essuyant avec un coton imbibé d’alcool.
2. Prenez la seringue et injectez lentement le solvant dans le flacon de poudre à travers le bouchon en caoutchouc.
3. Faites doucement rouler le flacon entre vos mains jusqu’à dissolution complète de la poudre, en prenant soin d’éviter la formation de mousse.
4. Une fois la poudre dissoute (ce qui, en général, se produit immédiatement), aspirez doucement la solution dans la seringue.
Si vous reconstituez plusieurs flacons de FERTISTARTKIT, prélevez le contenu reconstitué du premier flacon dans la seringue et injectez-le lentement dans un deuxième flacon après avoir répété les étapes 1 à 4.
En cas d’utilisation de plusieurs flacons de poudre, la quantité de ménotropine contenue dans 1 ml de solution reconstituée sera comme suit :
|
FERTISTARTKIT 75 UI poudre et solvant pour solution injectable |
||||||||||||||
|
La solution doit être claire et incolore.
Jetez tous les éléments usagés :
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur (à l’issue de l’injection, toutes les aiguilles et seringues vides doivent être immédiatement jetées dans un récipient approprié).
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
PARC DE SOPHIA ANTIPOLIS
LES TROIS MOULINS
280, RUE DE GOA
06600 ANTIBES
FRANCE
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 300 210 9 5 : étui contenant la poudre en flacon (75 UI), le solvant en seringue préremplie (1ml), une aiguille pour la reconstitution et l’injection intramusculaire et une aiguille pour l’injection sous-cutanée. Boite de 5 étuis.
· 34009 300 211 0 1 : étui contenant la poudre en flacon (75 UI), le solvant en seringue préremplie (1ml), une aiguille pour la reconstitution et l’injection intramusculaire et une aiguille pour l’injection sous-cutanée. Boite de 10 étuis.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Liste I
Médicament nécessitant une surveillance particulière pendant le traitement : prescription réservée aux spécialistes en gynécologie et/ou gynécologie-obstétrique et/ou endocrinologie et métabolisme.
ANSM - Mis à jour le : 26/06/2024
FERTISTARTKIT 75 UI poudre et solvant pour solution injectable
ménotropine
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin ou votre pharmacien.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
· Dans cette notice, FERTISTARTKIT désigne à la fois FERTISTARTKIT 75 UI poudre et solvant pour solution injectable et FERTISTARTKIT 150 UI poudre et solvant pour solution injectable.
1. Qu'est-ce que FERTISTARTKIT 75 UI, poudre et solvant pour solution injectable et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d'utiliser FERTISTARTKIT 75 UI, poudre et solvant pour solution injectable ?
3. Comment utiliser FERTISTARTKIT 75 UI, poudre et solvant pour solution injectable ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver FERTISTARTKIT 75 UI, poudre et solvant pour solution injectable ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE FERTISTARTKIT 75 UI, poudre et solvant pour solution injectable ET DANS QUELS CAS EST-IL UTILISE ?
Classe pharmacothérapeutique : Gonadotrophines - code ATC : G03GA02
Indications thérapeutiques :
· FERTISTARTKIT est utilisé pour provoquer l'ovulation chez des femmes qui n'ovulent pas et qui n'ont pas répondu au traitement par le citrate de clomifène.
· FERTISTARTKIT est utilisé pour stimuler la croissance de plusieurs follicules (et par conséquent plusieurs oeufs) chez les femmes ayant recours à un traitement pour la fertilité.
FERTISTARTKIT est une hormone post-ménopausique humaine, hautement purifiée, appartenant au groupe pharmacothérapeutique des gonadotrophines.
Un flacon contient de la poudre lyophilisée avec 75 UI d’activité d’hormone folliculo-stimulante (FSH) et 75 UI d’activité d’hormone lutéinisante (LH) humaine.
La gonadotrophine ménopausique humaine (HMG) est extraite de l'urine des femmes ménopausées. De la gonadotrophine chorionique humaine (hCG), extraite de l’urine des femmes enceintes, est ajoutée pour contribuer à l’activité LH totale.
Ce médicament doit être utilisé sous surveillance médicale.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER FERTISTARTKIT 75 UI, poudre et solvant pour solution injectable ?
Votre fertilité et celle de votre partenaire sera évaluée avant l’initiation de votre traitement.
N’utilisez jamais FERTISTARTKIT 75 UI, poudre et solvant pour solution injectable :
· Ovaires hypertrophiés ou kystes non imputables à un syndrome des ovaires polykystiques.
· Saignements dont la cause est inconnue.
· Cancer de l'ovaire, de l'utérus ou du sein.
· Tumeur de l'hypophyse ou de l'hypothalamus.
· Hypersensibilité (allergie) à la ménotropine ou à l’un des composants de FERTISTARTKIT.
Ce médicament ne doit pas être administré dans les cas où une grossesse est impossible tels que ménopause précoce, malformations des organes génitaux ou tumeurs spécifiques de l'utérus.
Avertissements et précautions
Même si aucune réaction allergique n’a été rapportée sous FERTISTARTKIT, veuillez informer votre médecin de toute réaction allergique survenue avec un médicament similaire.
Ce traitement accroît le risque de développer un syndrome d'hyperstimulation ovarienne (SHO) (se reporter au paragraphe 4). Si un syndrome d’hyperstimulation ovarienne survenait, votre traitement serait interrompu et toute grossesse devrait être évitée. Les premiers signes d’une hyperstimulation ovarienne sont une douleur dans la région abdominale basse ainsi que des nausées, vomissements et prise de poids. Si ces symptômes apparaissent vous devez consulter votre médecin dès que possible. Dans certains cas, rares mais graves, une hypertrophie des ovaires et des épanchements de liquide dans l’abdomen ou la cage thoracique peut survenir.
Le médicament utilisé pour la maturation folliculaire finale et l’ovulation (contenant de la gonadotrophine chorionique humaine - hCG) peut augmenter le risque de développer un SHO. Il est donc déconseillé d’utiliser de la hCG lors de la survenue d’un SHO, et vous ne devez pas avoir de rapports sexuels, même si un moyen de contraception mécanique (préservatif) est utilisé, pendant au minimum 4 jours.
Les taux de fausse couche spontanée sont plus élevés chez les femmes présentant des problèmes de fertilité que dans la population générale.
Chez les patientes recevant un traitement induisant l’ovulation, l’incidence des grossesses et des naissances multiples est accrue, comparée à la conception naturelle. Toutefois, ce risque peut être réduit en utilisant des doses et le schéma d’administration recommandés.
Chez les femmes présentant une anomalie des trompes de Fallope, il y a une augmentation du risque de grossesse extra-utérine.
Les grossesses multiples et les caractéristiques des parents suivant un traitement pour la fertilité (ex : âge de la mère, caractéristiques du sperme) peuvent être associées à un risque accru d’anomalies congénitales.
Le traitement avec FERTISTARTKIT, tout comme la grossesse en soi, peut augmenter le risque de thrombose. La thrombose est la formation de caillots sanguins dans un vaisseau, la plupart du temps dans une veine de la jambe ou des poumons. En particulier, vous devez en discuter avec votre médecin dans les cas suivants :
· Si vous êtes au courant d’une prédisposition aux thromboses
· Si vous, ou un membre de votre famille, a déjà eu une thrombose
· Si vous êtes en surpoids important.
Ce médicament est préparé à partir d’urine humaine. Le risque de transmission d’agents qui pourraient causer une infection ou une maladie ne peut pas être définitivement exclu. Ce risque est cependant limité par les étapes de fabrication permettant d’éliminer les virus, notamment pour le VIH, les Herpès virus et les Papillomavirus.
Aucun cas de contamination virale associée à l’administration de gonadotrophine extraite de l’urine humaine n’a jamais été rapporté.
Enfants et adolescents
Le médicament n'est pas destiné à un usage chez l’enfant.
Autres médicaments et FERTISTARTKIT 75 UI, poudre et solvant pour solution injectable
Informez votre médecin ou pharmacien si vous utilisez, avez récemment utilisé ou pourriez utiliser tout autre médicament.
Interactions avec des aliments et des boissons
Sans objet.
Grossesse, allaitement et fertilité
FERTISTARTKIT ne doit pas être utilisé si vous êtes enceinte ou si vous allaitez.
Demandez conseil à votre médecin ou à votre pharmacien avant de prendre tout médicament.
Conduite de véhicules et utilisation de machines
FERTISTARTKIT n’a aucun effet ou qu’un effet négligeable sur l’aptitude à conduire des véhicules et à utiliser des machines.
FERTISTARTKIT contient du sodium
Ce médicament contient moins de 1 mmol de sodium (23 mg) par solution reconstituée, c'est-à-dire essentiellement « sans sodium ».
3. COMMENT UTILISER FERTISTARTKIT 75 UI, poudre et solvant pour solution injectable?
Dosage et durée de traitement :
Respectez toujours la posologie indiquée par votre médecin. En cas de doute, consultez votre médecin.
Femmes qui n’ovulent pas et qui ont des règles irrégulières ou qui n’ont pas de règles :
En règle générale, la première injection d’un flacon de FERTISTARTKIT 75 UI est administrée la première semaine du cycle après les règles, spontanées ou induites.
Ensuite, FERTISTARTKIT est injecté quotidiennement à la dose prescrite par le médecin et le traitement est poursuivi jusqu’au développement d’au moins un follicule mature dans l’ovaire. Votre médecin adaptera la dose de FERTISTARTKIT en fonction de la réponse ovarienne, qui est déterminée à l’aide d’examens cliniques.
Dès qu’un follicule atteint le stade de développement requis, le traitement par FERTISTARTKIT est suspendu et l’ovulation est déclenchée avec une autre hormone (gonadotrophine chorionique, hCG).
L’ovulation a généralement lieu 32 à 48 heures plus tard.
Durant cette phase du traitement, la fécondation est possible. Vous devrez avoir des relations sexuelles tous les jours à partir de la veille de l’administration de l’hCG. En l’absence de grossesse malgré l’ovulation, le traitement peut être renouvelé.
Femmes sous stimulation ovarienne en vue du développement de plusieurs follicules avant une fécondation in vitro ou autres techniques de procréation assistée :
Le but de cette méthode est d’induire le développement de plusieurs follicules. Le traitement débutera le 2e ou 3e jour du cycle avec des injections de 150-300 UI de FERTISTARTKIT (1-2 flacons de FERTISTARTKIT 150 UI). Votre médecin pourra décider d’administrer des doses plus élevées si nécessaire. La dose injectée de FERTISTARTKIT est supérieure à celle employée pour la fécondation naturelle. La poursuite du traitement est adaptée individuellement par le médecin.
Dès qu’un nombre suffisant de follicules s’est développé, le traitement par FERTISTARTKIT est suspendu et l’ovulation est déclenchée en injectant une autre hormone (gonadotrophine chorionique, hCG).
Mode d’administration
Comment administrer FERTISTARTKIT ?
FERTISTARTKIT est injecté lentement sous la peau (par voie sous-cutanée) ou dans le muscle (injection intramusculaire).
Chaque flacon est à usage unique et doit être administré immédiatement après reconstitution.
Après vous avoir dispensé les conseils et la formation nécessaires, votre médecin peut vous demander de vous injecter FERTISTARTKIT vous-même.
Pour la première fois, votre médecin doit :
· vous avoir fait pratiquer une injection sous-cutanée,
· vous avoir indiqué les zones d’injection possibles,
· vous avoir montré comment préparer la solution à injecter,
· vous avoir indiqué précisément comment préparer la bonne dose à injecter.
Avant de vous injecter vous-même FERTISTARTKIT, lisez attentivement les instructions suivantes :
Comment préparer et injecter FERTISTARTKIT, en utilisant 1 flacon de poudre :
La solution à injecter doit être préparée juste avant que vous soyez prêt à l’utiliser, à l’aide de la seringue préremplie de solvant (une solution de chlorure de sodium à 9 mg/ml dans de l’eau pour préparations injectables) fournie dans chaque boîte de FERTISTARTKIT.
Préparez une surface de travail propre et lavez-vous les mains. Il est important que vos mains et tous les accessoires que vous utilisez soient aussi propres que possible.
Placez sur la surface propre tous les accessoires suivants :
· deux cotons imbibés d’alcool (non fournis),
· un flacon contenant la poudre de FERTISTARTKIT,
· une seringue préremplie de solvant,
· une aiguille pour préparer l’injection,
une aiguille fine pour l’injection sous-cutanée.
Reconstitution de la solution à injecter, en utilisant 1 flacon de poudre :
Préparation de la solution pour injection :
|
|
1. Retirez le capuchon de la seringue pré-remplie, monter l’aiguille pour reconstitution (aiguille longue) sur la seringue. Posez précautionneusement la seringue sur la surface de travail propre. Evitez de toucher l’aiguille. |
Préparation de la solution injectable :
|
|
2. Retirez le bouchon de plastique coloré (75 UI vert clair, 150 UI vert foncé) du flacon contenant la poudre en le soulevant doucement. Désinfectez la surface du bouchon en caoutchouc avec un coton imbibé d’alcool et laissez sécher.
|
|
|
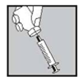
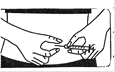
3. Prenez votre seringue, retirez le capuchon protecteur de l’aiguille et injectez doucement le solvant dans le flacon de poudre à travers le milieu du dessus du capuchon en caoutchouc. Appuyez fermement sur le piston pour faire descendre toute la solution dans la poudre. NE PAS SECOUER mais faire doucement rouler le flacon entre vos doigts jusqu’à dissolution complète de la poudre, en prenant soin d’éviter la formation de mousse.
|
|
|
4. Une fois la poudre dissoute (ce qui habituellement se produit immédiatement), aspirer doucement la solution dans la seringue : Avec la seringue toujours en place, retourner le flacon tête en bas Assurez-vous que l’extrémité de l’aiguille est bien recouverte par le liquide. Tirer doucement sur le piston afin d’aspirer toute la solution de FERTISTARTKIT dans la seringue. Vérifiez que la solution reconstituée est claire et incolore. |
Préparation de doses plus élevées en utilisant plus d’un flacon de poudre :
Si vous reconstituez plusieurs flacons de FERTISTARTKIT, prélevez le contenu reconstitué du premier flacon dans la seringue et injectez-le lentement dans un deuxième flacon après avoir répété les étapes 2 à 4.
Injection de la solution en sous-cutanée :
|
|
· Lorsque la seringue contient la dose prescrite, remettez le capuchon protecteur sur l’aiguille. Remplacez l'aiguille utilisée pour la préparation par l’aiguille fine pour injection sous-cutanée avec son capuchon protecteur. · Poussez fermement l’aiguille fine contre le réservoir de la seringue, puis tournez-le légèrement pour s’assurer qu’il est bien vissé et pour créer un joint. |
|
|
· Retirez le capuchon protecteur de l’aiguille. Diriger l'aiguille vers le haut puis tapotez légèrement la seringue de façon à ce que les bulles remontent. · Appuyez doucement sur le piston jusqu'à ce qu’un peu de liquide apparaisse en haut de l’aiguille. · Ne pas utiliser si le liquide est trouble ou contient des particules.
|
Site d’injection :
Votre médecin ou votre infirmière vous aura déjà indiqué où injecter FERTISTARTKIT sur votre corps. Généralement les endroits sont la cuisse ou le ventre en-dessous du nombril. Désinfectez la zone où l'injection va être faite avec un coton imbibé d’alcool.
Insertion de l’aiguille :
|
|
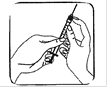
Pincez fermement la peau entre vos doigts. De l’autre main enfoncez l'aiguille d'un coup sec avec un angle de 45 ou 90 degrés.
|
Injection de la solution :
Injectez sous la peau comme on vous l'a indiqué. N'injectez pas directement dans une veine. Appuyez doucement et fermement sur le piston afin d’injecter correctement la solution et pour éviter d’abîmer les tissus.
Prenez tout le temps nécessaire pour injecter le volume de solution prescrite. Comme décrit dans la préparation de la solution, en fonction de la dose prescrite par votre médecin vous pouvez ne pas utiliser toute la solution.
Retrait de l’aiguille :
· Retirez immédiatement l'aiguille et appuyez avec un coton imbibé d'alcool au point d'injection. Un massage doux - en maintenant la pression - aide à disperser la solution de FERTISTARTKIT et à soulager tout inconfort.
Injection intramusculaire du médicament :
Pour les injections intramusculaires, votre médecin préparera et injectera FERTISTARTKIT sur le côté de votre cuisse ou sur la fesse.
Jetez tous les accessoires utilisés :
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur (une fois l’injection terminée, toutes les aiguilles et seringues vides doivent être immédiatement jetées dans un récipient approprié).
Si vous avez utilisé plus de FERTISTARTKIT 75 UI, poudre et solvant pour solution injectable que vous n’auriez dû
Les effets d’un surdosage de FERTISTARTKIT ne sont pas connus ; néanmoins, un syndrome d’hyperstimulation ovarienne n’est pas exclu (voir la rubrique 4. Quels sont les effets indésirables éventuels). Si vous avez utilisé plus de FERTISTARTKIT que vous n’auriez dû, consultez immédiatement votre médecin ou votre infirmière.
Si vous oubliez d’utiliser FERTISTARTKIT 75 UI, poudre et solvant pour solution injectable :
Prenez-le comme prévu au moment de l’injection suivante. Ne prenez pas de dose double pour compenser la dose simple que vous avez oublié de prendre.
Si vous arrêtez d’utiliser FERTISTARTKIT 75 UI, poudre et solvant pour solution injectable :
N’arrêtez jamais de votre propre initiative. Si vous souhaitez arrêter le traitement, il faut toujours consulter votre médecin.
Si vous avez d’autres questions sur l’utilisation de ce médicament, demandez plus d’informations à votre médecin ou à votre pharmacien.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
L’effet indésirable suivant est important et son apparition exige une action immédiate si vous le ressentez. Vous devez cesser la prise de FERTISTARTKIT et consulter votre médecin immédiatement si les effets suivants surviennent :
Fréquent : peut affecter jusqu'à 1 personne sur 10 :
· syndrome d’hyperstimulation ovarienne (les symptômes incluent la formation de kystes ovariens ou l’augmentation du volume de kystes existants, une douleur dans la région abdominale basse, une sensation de soif ainsi que des nausées, parfois accompagnées de vomissements, des volumes bas d’urines concentrées et une prise de poids) (voir rubrique 2 pour plus d’informations).
Les effets indésirables suivants ont aussi été rapportés :
Très fréquent : peut affecter plus de 1 personne sur 10 :
· maux de tête
· ballonnements
Fréquent : peut affecter jusqu'à 1 personne sur 10:
· douleur ou gêne abdominale
· douleur pelvienne
· maux de dos
· sensation de lourdeur
· inconfort au niveau des seins
· étourdissements
· bouffées de chaleur
· sensation de soif
· nausées
· fatigue
· sensation générale d’inconfort
· réaction au site d’injection comme une douleur ou une inflammation (fréquence supérieure avec l’injection intramusculaire par rapport à l’injection sous-cutanée)
Rare : peut affecter jusqu'à 1 personne sur 1000 :
· torsion ovarienne (torsion de l’ovaire qui peut provoquer une douleur extrême dans l’abdomen)
· thrombo-embolisme (formation d’un caillot dans un vaisseau sanguin qui migre dans la circulation et bloque un autre vaisseau).
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou, votre pharmacien ou à votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER FERTISTARTKIT 75 IU, poudre et solvant pour solution injectable ?
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur l’emballage extérieur, le flacon et la seringue préremplie de solvant. Si la date de péremption est indiquée sous la forme mois/année, la date de péremption fait référence au dernier jour de ce mois.
A conserver à une température ne dépassant pas 25°C. Conserver le flacon et la seringue préremplie dans l’emballage extérieur, à l’abri de la lumière.
A utiliser immédiatement après reconstitution.
N’utilisez pas ce médicament si vous remarquez que la solution n’est pas claire. Après reconstitution, la solution doit être claire et incolore.
Ne jetez aucun médicament au tout-à-l’égout. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient FERTISTARTKIT 75 IU, poudre et solvant pour solution injectable
· La substance active est : La ménotropine
Un flacon contient de la poudre lyophilisée avec 75 UI d’activité d’hormone folliculo-stimulante (FSH) et 75 UI d’activité d’hormone lutéinisante (LH) humaine.
La gonadotrophine ménopausique humaine (HMG) est extraite de l'urine des femmes ménopausées.
En cas d’utilisation de plusieurs flacons de poudre, la quantité de ménotropine contenue dans 1 ml de solution reconstituée sera comme suit :
|
FERTISTARTKIT 75 UI poudre et solvant pour solution injectable |
|
|
Nombre de flacons utilisés |
Quantité totale de ménotropine dans 1 ml de solution |
|
1 |
75 UI |
|
2 |
150 UI |
|
3 |
225 UI |
|
4 |
300 UI |
|
5 |
375 UI |
|
6 |
450 UI |
· Les autres excipients sont :
Pour la poudre : lactose monohydraté.
Pour le solvant : solution de chlorure de sodium 9 mg/ml.
Poudre : bouchon ou poudre lyophilisée blanche.
Solvant : solution claire et incolore
FERTISTARTKIT se présente sous la forme d’une poudre et d’un solvant pour solution injectable.
1 set contient ce qui suit :
· Un flacon contenant un bouchon ou une poudre lyophilisée blanche
· Une seringue préremplie (1 ml) contenant une solution claire et incolore
· Une aiguille pour la reconstitution et l’injection intramusculaire (aiguille longue)
· Une aiguille pour l’injection sous-cutanée (aiguille courte)
Disponibles en boîtes de 1, 5 ou 10 étuis.
Toutes les présentations peuvent ne pas être commercialisées.
Titulaire de l’autorisation de mise sur le marché
PARC DE SOPHIA ANTIPOLIS
LES TROIS MOULINS
280, RUE DE GOA
06600 ANTIBES
FRANCE
Exploitant de l’autorisation de mise sur le marché
Parc de Sophia Antipolis
Les 3 Moulins
280 rue de Goa
06600 ANTIBES
VIA MARTIRI DI CEFALONIA, 2
26900 LODI
ITALIE
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Ce médicament est autorisé dans les Etats membres de l'Espace Economique Européen sous les noms suivants : Conformément à la réglementation en vigueur
[à compléter ultérieurement par le titulaire]
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
Sans objet.