Dernière mise à jour le 02/02/2026
SUXAMETHONIUM AGUETTANT 10 mg/mL, solution injectable en seringue préremplie
Indications thérapeutiques
SUXAMETHONIUM AGUETTANT 10 mg/mL, solution injectable en seringue préremplie appartient à une famille de médicaments appelés relaxants musculaires.
Leur effet est de bloquer la connexion entre les nerfs et certains muscles, ce qui relâche ces muscles en les paralysant de façon temporaire. Ce médicament est utilisé comme myorelaxant pour faciliter l’intubation endotrachéale lors d’une anesthésie générale ou dans les situations d’urgence, chez l’adulte et chez l’enfant de plus de 12 ans.
SUXAMETHONIUM AGUETTANT 10 mg/mL, solution injectable en seringue préremplie est administré lors de l’insertion d’un tube dans la trachée (intubation endotrachéale) lorsqu’il faut aider une personne à respirer. Au cours de cette intervention, il est nécessaire de paralyser les muscles utilisés dans la respiration.
Présentations
> 10 seringue(s) préremplie(s) polypropylène de 10 ml
Code CIP : 34009 301 880 4 0
Déclaration de commercialisation : 28/10/2020
Cette présentation est agréée aux collectivités
Service médical rendu (SMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Important | Avis du 22/04/2020 | Inscription (CT) | Le service médical rendu par SUXAMETHONIUM AGUETTANT 10 mg/ml, solution injectable en seringue préremplie est important dans l’indication de l’AMM. |
Amélioration du service médical rendu (ASMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprés de la HAS (plus d'informations dans l'aide). Les avis et synthéses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur de l'ASMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| V (Inexistant) | Avis du 22/04/2020 | Inscription (CT) | La spécialité SUXAMETHONIUM AGUETTANT 10 mg/ml, solution injectable en seringue préremplie n’apporte pas d’amélioration du service médical rendu (ASMR V) par rapport aux autres spécialités injectables à base de chlorure de suxaméthonium disponibles. |
Autres informations
- Titulaire de l'autorisation : Laboratoire AGUETTANT
- Conditions de prescription et de délivrance :
- administration par tout médecin spécialiste en ANESTHESIE-REANIMATION ou en MEDECINE D'URGENCE
- liste I
- réservé à l'usage en situation d'urgence selon l'article R5121-96 du code de la santé publique
- réservé à l'usage HOSPITALIER
- réservé à une structure d'assistance médicale mobile ou de rapatriement sanitaire
- Statut de l'autorisation : Valide
- Type de procédure : Procédure décentralisée
- Code CIS : 6 404 171 8
ANSM - Mis à jour le : 05/03/2025
SUXAMETHONIUM AGUETTANT 10 mg/mL, solution injectable en seringue préremplie
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Chaque mL de solution injectable contient 10 mg de chlorure de suxaméthonium anhydre (équivalent à 11 mg de chlorure de suxaméthonium dihydraté).
Chaque seringue préremplie de 10 mL contient 100 mg de chlorure de suxaméthonium anhydre (équivalent à 110 mg de chlorure de suxaméthonium dihydraté).
Excipient à effet notoire :
Chaque mL de solution injectable contient 2,79 mg de sodium, équivalent à 0,12 mmol.
Chaque seringue préremplie de 10 mL contient 27,9 mg de sodium, équivalent à 1,2 mmol.
Pour la liste complète des excipients, voir rubrique 6.1.
Solution injectable (injection).
Solution limpide et incolore.
pH : 3,0 – 4,5
Osmolalité : 250 - 350 mOsm/Kg
4.1. Indications thérapeutiques
4.2. Posologie et mode d'administration
Posologie
Adultes
Pour réaliser une intubation endotrachéale, le chlorure de suxaméthonium est habituellement administré en bolus intraveineux à une dose de 1 mg/kg de poids corporel. Cette dose provoquera habituellement une relaxation musculaire dans un délai de 30 à 60 secondes environ et d’une durée approximative de 2 à 6 minutes. De plus fortes doses entraîneront une relaxation musculaire plus long mais le doublement de la dose ne doublera pas nécessairement la durée de la relaxation.
SUXAMETHONIUM AGUETTANT est réservé à l’administration d’une dose unique.
L’utilisation de faibles doses de myorelaxants non dépolarisants quelques minutes avant l’administration du suxaméthonium a été préconisée pour réduire l’incidence et la sévérité des douleurs musculaires liées au suxaméthonium. Cette technique peut nécessiter l’utilisation de doses de chlorure de suxaméthonium dépassant 1 mg/kg pour obtenir les conditions satisfaisantes à une intubation endothrachéale (voir rubrique 4.4).
Populations particulières
Patients âgés
Les doses de suxaméthonium nécessaires chez les patients âgés sont comparables à celles des sujets adultes.
Insuffisance rénale
Une dose unique de suxaméthonium peut être administrée aux patients présentant une insuffisance rénale en l’absence d’une hyperkaliémie. Des doses multiples ou plus élevées peuvent entraîner des élévations cliniquement significatives de la kaliémie et par conséquent, ne doivent pas être utilisées.
Insuffisance hépatique
Aucun ajustement posologique n’est nécessaire chez les patients présentant une insuffisance hépatique. La fin de l’action du suxaméthonium dépend de la cholinestérase plasmatique qui est synthétisée dans le foie. Bien que les taux plasmatiques de cholinestérase diminuent souvent chez les patients présentant une atteinte hépatique, ces taux sont rarement assez bas pour prolonger de manière significative l’apnée induite par le suxaméthonium (voir rubrique 4.4).
Population pédiatrique
Adolescents de plus de 12 ans : la posologie est similaire à celle des adultes.
SUXAMETHONIUM AGUETTANT ne doit pas être administré chez des enfants de moins de 12 ans. Les graduations de la seringue pré-remplie ne permettent pas une adminitration précise du SUXAMETHONIUM AGUETTANT dans cette population.
Mode d’administration
SUXAMETHONIUM AGUETTANT doit être administré par voie intraveineuse. La seringue préremplie ne convient pas à une utilisation d’un pousse-seringue.
· Hypersensibilité à la substance active ou à l’un des excipients mentionnés à la rubrique 6.1.
· Le suxaméthonium n’a aucun effet sur le niveau de conscience et ne doit pas être administré à des patients qui ne sont pas sous anesthésie générale (voir rubrique 4.2).
· Antécédents personnels ou familiaux d’hyperthermie maligne. Le suxaméthonium peut stimuler des contractions myofibrillaires prolongées chez les sujets prédisposés (voir rubrique 4.4).
· Patients connus pour avoir une activité atypique héréditaire de la cholinestérase plasmatique (butyrylcholinestérase) (antécédents de réponse prolongée et/ou renforcée - voir rubrique 4.4)
· Patients présentant une hyperkaliémie ou prédisposés à développer une hyperkaliémie (voir rubrique 4.4).
· Le suxaméthonium est contre-indiqué dans les cas suivants :
o patients ayant une hyperkaliémie pré-existante. En l’absence d’hyperkaliémie et de neuropathie, une insuffisance rénale ne constitue pas une contre-indication à l’administration d’une dose habituelle unique de suxaméthonium, mais des doses multiples ou élevées peuvent entraîner des élévations cliniquement significatives de la kaliémie et par conséquent, ne doivent pas être utilisées.
o patients en phase de rétablissement après un traumatisme majeur ou suite à des brûlures sévères. La période comportant le plus grand risque d’hyperkaliémie peut être prolongée s’il existe une infection persistante avec un retard de guérison.
o patients présentant des déficits neurologiques et une fonte musculaire majeure aiguë (par ex. lésions des motoneurones supérieurs et/ou inférieurs) ; la libération éventuelle de potassium apparaît au cours des 6 premiers mois qui suivent le déficit neurologique et est corrélée au degré et à l’étendue de la paralysie musculaire. Les patients qui ont été immobilisés pendant de longues périodes peuvent présenter un risque similaire.
· Patients atteints de myopathies des muscles squelettiques (par ex. dystrophie musculaire de Duchenne) car l’administration de suxaméthonium peut s’accompagner d’une hyperthermie maligne, de troubles du rythme ventriculaire et d’un arrêt cardiaque secondaire à une rhabdomyolyse aiguë avec hyperkaliémie.
· Antécédents personnels ou familiaux de maladies myotoniques congénitales telles que la myotonie congénitale et la dystrophie myotonique (risque de spasmes myotoniques sévères et de rigidité).
· Le suxaméthonium entraîne une élévation transitoire importante de la pression intraoculaire et par conséquent, ne doit pas être utilisé en présence de lésions oculaires ouvertes ou dans les cas où une augmentation de la pression intraoculaire n’est pas pas souhaitable sauf si le bénéfice potentiel de son utilisation est supérieur au risque potentiel pour l’œil.
4.4. Mises en garde spéciales et précautions d'emploi
Le suxaméthonium paralyse les muscles respiratoires ainsi que les autres muscles squelettiques mais n’a aucun effet sur la conscience.
L’utilisation d’une technique de monitoring neuromusculaire appropriée est recommandée pour l’évaluation du blocage neuromusculaire et de la récupération.
Réaction anaphylactique
Des réactions anaphylactiques allergiques ou non-allergiques sont rapportées pendant l’induction de l’anesthésie, parfois chez des patients n’ayant jamais été exposés au curare. Les manifestations les plus fréquentes sont une éruption cutanée (de type érythémateuse) ou un érythème généralisé ou limité au site d’injection, qui peut éventuellement évoluer en un choc anaphylactique et/ou un bronchospasme. Dans certains cas, le bronchospasme et/ou le choc anaphylactique ne sont pas associés à des manifestations cutanées. Un œdème de Quincke a également été rapporté.
L’apparition des premiers signes impose un arrêt définitif de l’administration de SUXAMETHONIUM AGUETTANT même si l’administration n’a pas été entièrement réalisée. Un traitement symptomatique doit alors être administré.
En cas de réaction allergique, il est nécessaire d’administrer un traitement symptomatique. Des tests d’allergologie doivent également être réalisés (prélèvement immédiat, puis test cutané) (voir rubrique 4.8).
Sensibilité croisée
Il a été rapporté des pourcentages élevés de sensibilité croisée (supérieurs à 50 %) entre médicaments entraînant un blocage neuromusculaire. Par conséquent, avant d’administrer du suxaméthonium, il convient si possible d’exclure une hypersensibilité à d’autres médicaments entraînant un blocage neuromusculaire. Le suxaméthonium ne doit être utilisé chez des patients sensibles que lorsqu’il est absolument indispensable. Les patients qui présentent une réaction d’hypersensibilité sous anesthésie générale doivent ultérieurement faire l’objet d’une recherche d’hypersensibilité à d’autres bloquants neuromusculaires.
Déficit ou réduction d’activité de la cholinestérase plasmatique
Le suxaméthonium est rapidement hydrolysé par la cholinestérase plasmatique, ce qui limite l’intensité et la durée du blocage neuromusculaire. Les sujets présentant une diminution de l’activité de la cholinestérase plasmatique présentent une réponse prolongée au suxaméthonium. Environ 0,05 % de la population ont une réduction de l’activité de la cholinestérase d’origine héréditaire qui est responsable d’un allongement de la durée d’action du suxaméthonium de plus d’1 heure. En cas de curarisation prolongée, il est nécessaire de poursuivre la ventilation contrôlée jusqu’au retour d’une respiration spontanée et d’une normalisation de la fonction musculaire.
Un allongement et une intensification du blocage neuromusculaire peuvent apparaître après une injection de suxaméthonium par suite d’une réduction de l’activité de la cholinestérase plasmatique dans les affections pathologiques et les cas suivants :
· variation physiologique pendant la grossesse ou en période postnatale (voir rubrique 4.6) ;
· anomalie génétiquement déterminée de la cholinestérase plasmatique (voir rubrique 4.3) ;
· tétanos généralisé sévère, tuberculose, autres infections chroniques ou sévères ;
· brûlures sévères (voir rubrique 4.3) ;
· maladie invalidante chronique, affection maligne, anémie chronique et malnutrition ;
· insuffisance hépatique stade terminal, insuffisance rénale aiguë ou chronique (voir rubrique 4.2) ;
· maladies auto-immunes : myxœdème ;
· collagénoses ;
· causes iatrogènes : après un échange plasmatique, une plasmaphérèse, une circulation extracorporelle et par suite d’un traitement médicamenteux concomitant (voir rubrique 4.5).
Hyperthermie maligne
Comme le suxaméthonium peut être utilisé avec d’autres médicaments anesthésiques (halogénés) et qu’une hyperthermie maligne peut apparaître pendant l’anesthésie même en l’absence de facteurs déclenchants connus, les médecins doivent être familiarisés avec les signes précoces, le diagnostic et le traitement de l’hyperthermie maligne. Un spasme isolé des masséters peut apparaître et empêcher une intubation alors que les autres muscles sont relâchés, mais il peut aussi s’agir d’un signe précoce d’hyperthermie maligne. Les autres signes d’hyperthermie maligne doivent alors être rechercher.
S’il apparaît une hyperthermie maligne, l’administration de tous les médicaments anesthésiques connus pour être associés à un tel cas (y compris le suxaméthonium) doit être arrêtée et toutes les mesures de soin doivent immédiatement être mises en œuvre. Le dantrolène sodique intraveineux est le traitement médicamenteux spécifique de première intention et doit être administré dès le diagnostic posé.
Douleurs musculaires
Des douleurs musculaires sont fréquemment observées après l’administration de suxaméthonium et le plus communément chez des patients en ambulatoire subissant une intervention chirurgicale mineure sous anesthésie générale (voir rubrique 4.8). La relation directe entre le degré de fasciculation musculaire visible après l’administration de suxaméthonium et l’incidence ou la sévérité de la douleur n’a pas été établi. Le suxaméthonium doit être utilisé avec prudence chez les patients présentant des fractures ou des spasmes musculaires car les fasciculations musculaires initiales peuvent entraîner un traumatisme supplémentaire.
Hyperkaliémie
Une élévation aiguë transitoire de la kaliémie apparaît souvent après l’administration de suxaméthonium chez des sujets normaux ; l’ampleur de cette élévation est de l’ordre de 0,5 mmol/litre. Dans certaines affections et certains états pathologiques, cette augmentation de la kaliémie après l’administration de suxaméthonium peut être excessive et entraîner des arythmies cardiaques graves et un arrêt cardiaque. Chez les patients présentant une septicémie sévère, le risque d’hyperkaliémie semble être lié à la sévérité et à la durée de l’infection.
Myasthénie grave et autres syndromes myasthéniques
Il est déconseillé d’administrer du suxaméthonium aux patients présentant une myasthénie grave avancée. Même si ces patients sont résistants au suxaméthonium, ils développent un état de bloc de Phase II qui peut être responsable d’un retard de guérison. Les patients atteints d’un syndrome myasthénique d’Eaton-Lambert sont plus sensibles que la normale au suxaméthonium, ce qui implique une réduction posologique.
Bradycardie et autres troubles du rythme cardiaque
Le suxaméthonium n’a aucun effet direct sur le myocarde, mais par suite d’une stimulation des ganglions autonomes et des récepteurs muscariniques, le suxaméthonium peut entraîner des modifications du rythme cardiaque, y compris un arrêt cardiaque.
Chez des adultes sains, le suxaméthonium provoque parfois un léger ralentissement transitoire de la fréquence cardiaque lors de l’administration initiale. Des bradycardies sont plus fréquemment observées chez les enfants et en cas d’administrations répétées de suxaméthonium chez les enfants et les adultes. Le suxaméthonium peut également potentialiser la bradycardie due à l’halothane ou à d’autres médicaments. Rester vigilant lorsque les deux médicaments sont utilisés lors de l’anesthésie. Un traitement préliminaire par atropine ou glycopyrrolate intraveineux réduit de manière significative l’incidence et la sévérité de la bradycardie liée au suxaméthonium.
En l’absence d’hyperkaliémie préexistante ou provoquée, des arythmies ventriculaires sont rarement observées après une administration de suxaméthonium. Les patients prenant des médicaments de type digitalique sont néanmoins plus prédisposés à de telles arythmies.
Effets muscariniques
Les effets muscariniques du suxaméthonium, par ex. augmentation des sécrétions bronchiques ou salivaires, peuvent être évités par l’administration prophylactique d’atropine.
Augmentation de la pression intraoculaire
L’administration du suxaméthonium n’est pas recommandée chez les patients subissant une chirurgie ouverte du globe oculaire.
Sodium
Ce médicament contient 27,9 mg de sodium pour 10 mL, soit 1,4 % de la consommation quotidienne maximale recommandée par l’OMS qui est de 2 g de sodium pour un adulte.
Le SUXAMETHONIUM AGUETTANT n’est pas recommandé chez des enfants de moins de 12 ans. En cas d’utilisation chez des enfants de plus de 12 ans, la prudence est de rigueur car une myopathie non diagnostiquée ou une prédisposition non connue à une hyperthermie maligne et à une rhabdomyolyse est plus probable chez les patients pédiatriques, ce qui les expose à un risque accru d’effets indésirables graves après administration de suxaméthonium (voir rubriques 4.3 et 4.8).
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
· Antipsychotiques : phénelzine, promazine
· Cytotoxiques : cyclophosphamide, thiotépa, irinotécan
· Anesthésiques généraux : kétamine
· Antihistaminiques : des concentrations élevées de cimétidine peuvent inhiber la pseudocholinestérase
· Anesthésiques locaux et/ou antiarythmiques : procaïne, chloroprocaïne, lidocaïne et procaïnamide
· Métoclopramide
· Parasympathiques : donépézil, galantamine, néostigmine, pyridostigmine, rivastigmine, édrophonium, chlorhydrate de tacrine
· Sympathomimétiques (bêta agonistes) : bambutérol et terbutaline
· Substances oganophosphorées : diazinon, malathion, chlorpyrifos, dichlorvos, propétamphos, dimpylate
· Écothiopate en collyre
· Inhibiteurs sélectifs de la recapture de la sérotonine (ISRS)
· Autres médicaments ayant un effet délétère potentiel sur l’activité de la cholinestérase plasmatique : aprotinine, chlorpromazine, estrogènes et contraceptifs oraux contenant des estrogènes, ocytocine, corticoïdes à doses élevées.
Certains médicaments ou substances peuvent renforcer ou prolonger les effets de blocage neuromusculaire du suxaméthonium par des mécanismes non liés à l’activité de la cholinestérase plasmatique :
· Antiarythmiques : quinidine, vérapamil
· Antibactériens (renforcement des effets du suxaméthonium) : aminoglycosides, lincosamides (tels que clindamycine et lincomycine), polymyxines (telles que colistine et polymyxine B) et vancomycine
· Anticonvulsivants : carbamazépine, phénytoïne
· Bêta-bloquants (renforcement/prolongement du blocage neuromusculaire) : esmolol
· Immunomodulateurs (prolongement du blocage neuromusculaire) : azathioprine
· Carbonate de lithium
· Quinine et chloroquine
· Magnésium : magnésium par voie parentérale (renforcement du blocage neuromusculaire)
· Médicaments volatils administrés par inhalation : l’halothane, l’enflurane, le desflurane, l’isoflurane, le diéthyléther et le méthoxyflurane ont un léger effet sur le bloc de Phase I d’une injection de suxaméthonium mais accéléreront l’apparition et renforceront l’intensité du bloc de Phase II induit par le suxaméthonium.
Certains médicaments ou substances peuvent exacerber certains effets indésirables du suxaméthonium:
· Glucosides cardiotoniques : Les patients recevant des médicaments de type digitalique sont plus susceptibles de présenter des effets d’hyperkaliémie exacerbés par le suxaméthonium.
· Anesthésiques généraux : propofol (augmentation du risque de dépression myocardique et de bradycardie).
Autres interactions
· Bloquants neuromusculaires compétitifs : L’association de bloquants neuromusculaires compétitifs peut entraîner des effets additifs ou synergiques. Néanmoins, la séquence d’administration peut également affecter l’interaction. L’utilisation préalable d’une faible dose d’un bloquant neuromusculaire compétitif (par ex. vécuronium) réduit en général les effets du suxaméthonium, mais si le suxaméthonium est administré pendant la récupération d’un blocage provoqué par un bloquant neuromusculaire compétitif, il peut apparaître un antagonisme, un renforcement ou une association de l’activité des deux bloquants. Les effets d’un bloquant neuromusculaire compétitif peuvent être augmentés si ce dernier est administré après le suxaméthonium.
4.6. Fertilité, grossesse et allaitement
Grossesse
Le suxaméthonium n’a aucune action directe sur l’utérus ou d’autres structures musculaires lisses. Aux doses thérapeutiques normales, il ne traverse pas la barrière placentaire en quantités suffisantes pour affecter les mouvements respiratoires du fœtus.
Les bénéfices de l’utilisation du suxaméthonium dans le cadre de l’induction en séquence rapide pour une anesthésie générale sont normalement supérieurs au risque éventuel pour le fœtus.
Les taux de cholinestérase plasmatique chutent au cours du premier trimestre de grossesse pour atteindre environ 70 à 80 % des taux existant avant la grossesse ; une baisse supplémentaire à un niveau correspondant à 60 à 70 % des taux avant la grossesse apparaît 2 à 4 jours après l’accouchement. Les taux de cholinestérase plasmatique augmentent ensuite pour retrouver leurs valeurs normales au cours des 6 semaines suivantes.
Par conséquent, pendant la grossesse ou en période postnatale, une proportion élevée de patientes peut présenter un léger allongement du blocage neuromusculaire après l’injection de suxaméthonium (voir rubrique 4.4). Chez deux espèces animales, le suxaméthonium ne s’est pas révélé embryotoxique ou tératogène. L’utilisation du suxaméthonium peut être envisagée pendant la grossesse, si nécessaire. Néanmoins, la prudence est de rigueur après l’administration du suxaméthonium chez des patientes enceintes et en période post-natale.
On ne sait pas si le suxaméthonium ou ses métabolites sont excrétés dans le lait maternel. Néanmoins, comme le suxaméthonium est rapidement hydrolysé par la cholinestérase plasmatique (pseudocholinestérase) en un métabolite inactif, aucun effet n’est attendu chez les nouveau-nés/nourrissons allaités.
Fertilité
Il n’existe pas de données concernant l’effet du suxaméthonium sur la fertilité. Néanmoins, comme le suxaméthonium est rapidement hydrolysé par la cholinestérase plasmatique (pseudocholinestérase) en un métabolite inactif, aucun effet n’est attendu sur la fertilité une fois que l’effet pharmacologique est passé.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
SUXAMETHONIUM AGUETTANT a une influence importante sur l’aptitude à conduire des véhicules et à utiliser des machines.
Le suxaméthonium sera toujours utilisé en association avec un anesthésique général et par conséquent, on appliquera les précautions habituelles concernant la réalisation de tâches après une anesthésie générale.
Les effets indésirables sont énumérés ci-dessous par classe de systèmes d’organe et par fréquence. Les fréquences estimées ont été déterminées d’après les données publiées. Les fréquences sont définies de la manière suivante : très fréquent (≥ 1/10) ; fréquent (≥ 1/100 et < 1/10), peu fréquent (≥ 1/1 000 et < 1/100) ; rare (≥ 1/10 000 et < 1/1 000) ; très rare (< 1/10 000).
|
Fréquent |
Réactions anaphylactiques allergiques ou non allergiques (histaminolibération non spécifique), prurit, troubles cardiovasculaires, bronchospasme, choc anaphylactique sévère (pouvant avoir une évolution fatale) (voir rubrique 4.4). |
|
Fréquence indéterminée |
Œdème de Quincke |
|
Affections du système nerveux |
|
|
Fréquent |
Augmentation transitoire de la pression intracrânienne* |
|
Affections oculaires |
|
|
Fréquent |
Augmentation de la pression intra-oculaire* |
|
Affections cardiaques |
|
|
Fréquent |
Arythmies (y compris arythmies ventriculaires), bradycardie, tachycardie. |
|
Fréquence indéterminée |
Arrêt cardiaque. |
|
Affections vasculaires |
|
|
Fréquent |
Bouffées vasomotrices, hypotension |
|
Fréquence indéterminée |
Hypertension |
|
Affections respiratoires, thoraciques et médiastinales |
|
|
Rare |
Bronchospasme, dépression respiratoire prolongée |
|
Fréquence indéterminée |
Sécrétion bronchique excessive, apnée |
|
Affections gastrointestinales |
|
|
Fréquent Fréquence indéterminée |
Augmentation de la pression intragastrique* Sécrétion gastrique excessive Hypertrophie de la glande salivaire |
|
Une hypersalivation a également été rapportée |
|
|
Affections de la peau et du tissu sous-cutané |
|
|
Fréquent |
Rash |
|
Affections musculosquelettiques et systémiques |
|
|
Très fréquent |
Fasciculation musculaire, douleurs musculaires post-opératoires (voir rubrique 4.4) |
|
Fréquent |
Myoglobinémie, myoglobinurie |
|
Rare |
Trismus |
|
Fréquence indéterminée |
Rhabdomyolyse (voir rubriques 4.3 et 4.4) |
|
Troubles généraux et anomalies au site d'administration |
|
|
Fréquent |
Érythème au site d’injection |
|
Rare |
Hyperthermie maligne (voir rubrique 4.4) |
|
Investigations |
|
|
Fréquent |
Augmentation transitoire de la kaliémie |
* L’augmentation initiale de la pression intracrânienne, intraoculaire et intragastrique se normalise en quelques minutes.
Description d’effets indésirables particuliers
Des cas d’arrêt cardiaque liés à une hyperkaliémie ont été rapportés après l’administration de suxaméthonium chez des patients présentant une infirmité motrice cérébrale congénitale, un tétanos, une lésion de la moelle épinière, une dystrophie musculaire et un traumatisme crânien fermé. De tels événements ont également été rapportés dans de rares cas chez des enfants présentant des troubles musculaires antérieurement non diagnostiqués.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : www.signalement-sante.gouv.fr.
Une apnée et une paralysie musculaire prolongée représentent les principaux effets graves d’un surdosage. Par conséquent, il est essentiel de maintenir une ventilation appropriée des voies aériennes jusqu’à l’apparition d’une respiration spontanée.
La néostigmine et d’autres médicaments anticholinestérasiques ne sont pas des antidotes au suxaméthonium mais intensifieraient l’effet de dépolarisation. Néanmoins, dans certains cas, lorsque l’action du suxaméthonium est prolongée, le bloc dépolarisant caractéristique (Phase I) peut se transformer en ayant les caractéristiques d’un bloc non-dépolarisant (Phase II). La décision d’utiliser de la néostigmine pour inverser le bloc de Phase II induit par le suxaméthonium repose sur l’avis du clinicien dans chaque cas individuel. Des informations valables en rapport avec cette décision seront obtenues en surveillant la fonction neuromusculaire. Si l’on utilise de la néostigmine, son administration doit s’accompagner de doses appropriées d’un anticholinergique tel que l’atropine.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Mécanisme d’action
Le suxaméthonium est un bloquant neuromusculaire à action dépolarisante ultra-courte.
Effets pharmacodynamiques
Le suxaméthonium a une structure très proche de l’acétylcholine. Tout comme l’acétylcholine, le suxaméthonium agit sur la plaque motrice terminale des muscles squelettiques pour provoquer une paralysie flasque (bloc de Phase I). Le suxaméthonium diffuse lentement vers la plaque motrice où sa concentration persiste assez longtemps pour provoquer une perte d’excitabilité électrique. La dépolarisation de la plaque motrice établit un gradient électrique ce qui provoque l’ouverture des canaux ioniques voltage-dépendants du muscle et entraîne ainsi une contraction musculaire temporaire. Bien que la plaque motrice reste dépolarisée, la membrane musculaire tient compte de cette dépolarisation et reste flasque.
Si le suxaméthonium est perfusé en continu, la membrane jonctionnelle récupère lentement son potentiel de repos avec un retour de la transmission neuromusculaire (tachyphylaxie) ; ainsi pour maintenir l’effet, il faudra une plus grande vitesse de perfusion. Avec une perfusion continue, la transmission neuromusculaire sera de nouveau inhibée (bloc de Phase II) même si le potentiel membranaire de la plaque motrice reste relativement inchangé. Un bloc de Phase II a les caractéristiques cliniques d’un bloc non-dépolarisant. Un bloc de Phase II peut s’accompagner d’un blocage neuromusculaire prolongé et d’une apnée. Le mécanisme de ce bloc n’est pas connu mais un blocage des canaux par pénétration du suxaméthonium dans le cytoplasme sous-synaptique, une accumulation intracellulaire de calcium et de sodium, la perte de potassium intracellulaire et l’activation de Na, K-ATP-ase sont tous des phénomènes qui y contribuent. On considère que la courte durée d’action du suxaméthonium est due à son métabolisme rapide dans le sang. Le suxaméthonium est rapidement hydrolysé par la cholinestérase plasmatique en succinylmonocholine qui possède des propriétés myorelaxantes dépolarisantes cliniquement non significatives.
5.2. Propriétés pharmacocinétiques
Le gène contrôlant l’expression de la cholinestérase plasmatique présente un polymorphisme et l’activité enzymatique varie entre les sujets. Une apnée prolongée a parfois été rapportée chez des patients après administration du suxaméthonium. La plupart de ces patients présentaient une cholinestérase plasmatique atypique ou un déficit en cholinestérase par suite de variations alléliques, d’une affection hépatique ou rénale, ou de troubles nutritionnels modifiant la clairance de la substance active. Certains médicaments peuvent inhiber la synthèse enzymatique ou modifier son activité (voir rubrique 4.5).
5.3. Données de sécurité préclinique
Acide succinique,
Hydroxyde de sodium ou acide chlorhydrique (pour ajustement du pH),
Eau pour préparations injectables.
Après ouverture de l’emballage, le médicament doit être utilisé immédiatement.
Ce médicament peut être conservé pendant une courte période à des températures ne dépassant pas 25°C. Dans tous les cas, une fois retiré du stockage réfrigéré, le médicament doit être jeté après 30 jours.
6.4. Précautions particulières de conservation
À conserver au réfrigérateur (entre 2°C et 8°C). Ne pas congeler.
Conserver la seringue préremplie dans sa plaquette non ouverte jusqu’à son utilisation.
Pour les conditions de conservation du médicament après première ouverture, voir la rubrique 6.3.
6.5. Nature et contenu de l'emballage extérieur
10 mL de solution injectable en seringue préremplie (polypropylène), sans aiguille, munie d’un bouchon de piston (chlorobutyl) et graduée (par graduations de 0,5 mL de 0 à 10 mL) à l’aide d’une étiquette transparente auto-adhésive. Un embout de fermeture (polypropylène) protège la pointe de la seringue.
La seringue préremplie est conditionnée individuellement dans une plaquette thermoformée transparente.
Disponible en boîtes de 1 ou 10 seringue(s) préremplie(s).
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
Instructions d’utilisation :
Respecter scrupuleusement le protocole ci-dessous lors de la préparation de la seringue :
· La seringue préremplie est à utiliser chez un seul patient. Jetez la seringue après utilisation. Ne pas réutiliser.
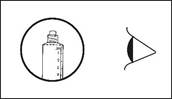
· Le médicament doit être inspecté visuellement avant l’administration afin de déceler la présence de particules ou une coloration anormale. Seule une solution limpide et incolore dépourvue de particules ou de précipités doit être utilisée.
· Le médicament ne doit pas être utilisé si le dispositif d’inviolabilité sur la seringue est rompu.
· La surface externe de la seringue préremplie est stérile jusqu’à l’ouverture de la plaquette. La plaquette ne doit pas être ouverte avant l’utilisation.
· Lorsqu’il est manipulé en conditions d’asepsie, le médicament, une fois retiré de la plaquette, peut être placé sur un champ stérile.
|
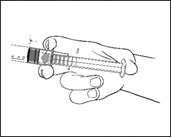
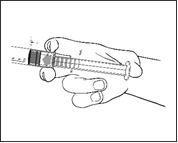
1) Retirez la seringue préremplie stérile de la plaquette thermoformée. |
|
|
|
2) Enfoncez le piston pour libérer le bouchon. Le procédé de stérilisation peut avoir fait adhérer le bouchon au corps de la seringue. |
|
|
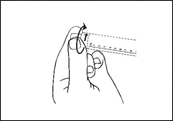
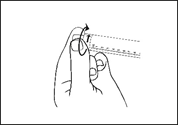
3) Enlevez le capuchon en le dévissant de manière à rompre la bande d’inviolabilité. Ne pas toucher le raccord Luer exposé afin d’éviter toute contamination. |
|
|
4) Vérifiez que la bande d’inviolabilité à la pointe de la seringue a été complètement retirée. Si ce n’est pas le cas, remettez le capuchon en place et dévissez à nouveau. |
|
|
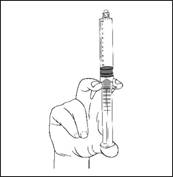
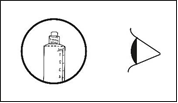
5) Chassez l’air en enfonçant doucement le piston. |
|
6) Raccordez la seringue à l’abord ou à une aiguille. Enfoncez lentement le piston pour injecter le volume requis. |
|
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
69007 LYON
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 301 880 4 0 : 10 mL de solution en seringue préremplie. Boîte de 10.
· 34009 550 682 1 1 : 10 mL de solution en seringue préremplie. Boîte de 1.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Médicament réservé à l’usage hospitalier.
Médicament pouvant être administré par tout médecin spécialisé en anesthésie-réanimation ou en médecine d'urgence dans les cas où il intervient en situation d'urgence ou dans le cadre d'une structure d'assistance médicale mobile ou de rapatriement sanitaire (article R. 5121-96 du code de la santé publique).
ANSM - Mis à jour le : 05/03/2025
SUXAMETHONIUM AGUETTANT 10 mg/mL, solution injectable en seringue préremplie
Chlorure de suxaméthonium anhydre
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin, votre pharmacien ou votre infirmier/ère.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, votre pharmacien ou votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que SUXAMETHONIUM AGUETTANT 10 mg/mL, solution injectable en seringue préremplie et dans quels cas est-il utilisé ?
3. Comment utiliser SUXAMETHONIUM AGUETTANT 10 mg/mL, solution injectable en seringue préremplie ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver SUXAMETHONIUM AGUETTANT 10 mg/mL, solution injectable en seringue préremplie ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE SUXAMETHONIUM AGUETTANT 10 mg/mL, solution injectable en seringue préremplie ET DANS QUELS CAS EST-IL UTILISE ?
SUXAMETHONIUM AGUETTANT 10 mg/mL, solution injectable en seringue préremplie appartient à une famille de médicaments appelés relaxants musculaires.
Leur effet est de bloquer la connexion entre les nerfs et certains muscles, ce qui relâche ces muscles en les paralysant de façon temporaire. Ce médicament est utilisé comme myorelaxant pour faciliter l’intubation endotrachéale lors d’une anesthésie générale ou dans les situations d’urgence, chez l’adulte et chez l’enfant de plus de 12 ans.
SUXAMETHONIUM AGUETTANT 10 mg/mL, solution injectable en seringue préremplie est administré lors de l’insertion d’un tube dans la trachée (intubation endotrachéale) lorsqu’il faut aider une personne à respirer. Au cours de cette intervention, il est nécessaire de paralyser les muscles utilisés dans la respiration.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER SUXAMETHONIUM AGUETTANT 10 mg/mL, solution injectable en seringue préremplie?
SUXAMETHONIUM AGUETTANT 10 mg/mL, solution injectable en seringue préremplie ne doit jamais vous être administré :
· si vous êtes allergique au suxaméthonium ou à l’un des autres composants contenus dans ce médicament, mentionnés dans la rubrique 6 ;
· si vous êtes conscient ;
· en cas d’antécédent personnel ou familial de réactions indésirables à un anesthésique telle qu’apparition d’une température corporelle très élevée (hyperthermie maligne) ;
· si vous présentez un déficit d’une enzyme appelée pseudocholinestérase qui décompose le suxaméthonium dans l’organisme ;
· si vous présentez des taux élevés de potassium dans le sang (hyperkaliémie) ;
· si vous avez eu un accident grave, une intervention chirurgicale majeure ou des brûlures sévères ;
· si vous avez souffert d’une lésions au niveau de la moelle épinière ou d’un nerf ou d’une fonte brutale de la masse musculaire ;
· si vous n’avez pas été en mesure de bouger pendant une longue période comme par exemple pour permettre à un os fracturé de se réparer ou en cas de longue période de repos au lit ;
· si vous avez une faiblesse musculaire ou une perte de masse musculaire (par exemple dystrophie musculaire de Duchenne) ;
· si vous-même ou quelqu’un de votre famille a une maladie entraînant une faiblesse des muscles (myotonie congénitale, dystrophie myotonique) ;
· si vous avez récemment eu une lésion au niveau des yeux ;
· si vous souffrez d’un problème dû à une trop forte pression dans l’oeil (glaucome), sauf si le bénéfice potentiel de l’utilisation de ce médicament est supérieur au risque potentiel pour l’oeil.
Avertissements et précautions
Adressez-vous à votre médecin, pharmacien ou votre infirmier/ère avant d’administrer SUXAMETHONIUM AGUETTANT 10 mg/mL, solution injectable en seringue préremplie :
· si vous avez déjà eu une réaction allergique à un relaxant musculaire administré dans le cadre d’une opération ;
· si vous souffrez de myasthénie grave, une maladie qui entraîne une faiblesse sévère des muscles, ou de toute autre maladie des nerfs ou des muscles ;
· si vous êtes enceinte ou si vous avez accouché au cours des six dernières semaines ;
· si vous avez le tétanos, une infection qui apparaît par contamination d’une plaie ;
· si vous avez la tuberculose ou une autre infection bactérienne sévère ou de longue durée ;
· si vous avez une maladie depuis longtemps qui vous a laissé dans un état de faiblesse.
· si vous souffrez d’une maladie du sang connue pour être une anémie.
· si vous êtes sous-alimenté ou incapable d’absorber les nutriments provenant des aliments (malnutrition).
· si vous souffrez de problèmes au niveau du foie ou des reins ;
· si vous souffrez d’une maladie dans laquelle l’organisme s’attaque à lui-même (maladie auto-immune) telle qu’une maladie de la glande thyroïde (myxoedème) ;
· si vous souffrez de maladies entraînant des problèmes articulaires (collagènoses).
· si vous avez ou avez eu un traitement de votre sang appelé plasmaphérèse.
· si vous avez récemment subi une circulation extracorporelle.
Enfants
Ce médicament n’est pas recommandé chez des enfants de moins de 12 ans. Les graduations de la seringue préremplie ne permettent pas une administration précise dans cette population.
En cas d’utilisation chez des enfants de plus de 12 ans, la prudence est de rigueur.
Autres médicaments et SUXAMETHONIUM AGUETTANT 10 mg/mL, solution injectable en seringue préremplie
Informez votre médecin, pharmacien ou votre infirmier/ère si vous utilisez, avez récemment utilisé ou pourriez utiliser tout autre médicament.
En particulier, informez votre médecin, pharmacien ou votre infirmier/ère si vous utilisez, avez récemment utilisé ou pourriez utiliser un des médicaments suivants :
· médicaments psychiatriques (par ex. phénelzine, promazine) ;
· médicaments anticancéreux (par ex. cyclophosphamide, thiotépa, irinotécan) ;
· médicaments anesthésiques (par ex. kétamine, halothane, enflurane, desflurane, propofol) ;
· anesthésiques locaux (par ex. lidocaïne, procaïne, procaïnamide) ;
· un médicament utilisé pour traiter et prévenir les nausées et les vomissements (métoclopramide) ;
· médicaments utilisés en cas de maladie d’Alzheimer ou de myasthénie grave (anticholinestérase telle que donézépil, édrophonium, galantamine, néostigmine, pyridostigmine, rivastigmine et tacrine);
· médicaments pour traiter l’asthme ou d’autres affections respiratoires (par ex. bambutérol, terbutaline) ;
· substances organiques contenant du phosphore ;
· un médicament utilisé pour réduire le saignement (aprotinine) ;
· estrogènes et contraceptifs oraux contenant de l’estrogène ;
· un médicament pour contracter l’utérus (ocytocine) ;
· médicaments utilisés dans des affections inflammatoires (comme les corticoïdes utilisés en cas de rhumatismes etc.) ;
· médicaments utilisés pour traiter des troubles du rythme cardiaque (antiarythmiques comme par ex. quinidine, vérapamil) ;
· certains antibiotiques utilisés pour traiter des infections bactériennes (par ex. lincosamides, polymyxines et aminoglycosides) ;
· médicaments antiépileptiques utilisés pour arrêter les convulsions (par ex. carbamazépine et phénytoïne) ;
· un médicament bêta-bloquant utilisé pour ralentir les battements du cœur (esmolol) ;
· un médicament utilisé pour supprimer la réaction immunitaire (azathioprine) ;
· un médicament utilisé pour contrôler la surexcitation et/ou la dépression (lithium) ;
· sels de magnésium ;
· médicaments qui augmentent la contraction du muscle cardiaque (glucosides cardiotoniques comme la digoxine) ;
· un médicament utilisé pour traiter une pression élevée dans les yeux, c’est-à-dire le glaucome (écothiopate).
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin avant d’administrer ce médicament.
SUXAMETHONIUM AGUETTANT 10 mg/mL, solution injectable en seringue préremplie ne doit être utilisé pendant la grossesse que si votre médecin décide que les bénéfices pour vous sont supérieurs à tout risque éventuel pour l’enfant à venir.
La prudence est de mise après l’administration de suxaméthonium aux patientes enceintes ou venant d’accoucher.
On ignore si le suxaméthonium passe dans le lait maternel. Néanmoins, comme le suxaméthonium est rapidement métabolisé en un métabolite inactif, aucun effet chez les nouveau-nés/nourrissons allaités n’est attendu.
Conduite de véhicules et utilisation de machines
Il peut être dangereux de conduire des véhicules ou d’utiliser des machines tout juste après avoir reçu ce médicament. Votre médecin vous indiquera combien de temps il faut attendre avant de pouvoir conduire ou utiliser des machines.
SUXAMETHONIUM AGUETTANT 10 mg/mL, solution injectable en seringue préremplie contient du sodium.
Ce médicament contient 27,9 mg de sodium (principal composant du sel de cuisine/de table). Cela correspond à 1,4 % de l’apport alimentaire maximal quotidien recommandé pour un adulte.
3. COMMENT UTILISER SUXAMETHONIUM AGUETTANT 10 mg/mL, solution injectable en seringue préremplie?
Vous ne devrez jamais vous administrer vous-même ce médicament. Il vous sera toujours administré par un professionnel de santé qualifié pour le faire.
Votre médecin déterminera la dose que vous recevrez. Celle-ci dépendra de vos besoins individuels, de votre poids corporel, de l’importance du relâchement musculaire nécessaire.
SUXAMETHONIUM AGUETTANT 10 mg/mL, solution injectable en seringue préremplie vous sera administré par injection dans une veine (utilisation par voie intraveineuse). La seringue préremplie ne convient pas à une utilisation dans un pousse-seringue.
Si vous avez reçu plus de SUXAMETHONIUM AGUETTANT 10 mg/mL, solution injectable en seringue préremplie que vous n’auriez dû
Comme ce médicament sera toujours administré sous conditions strictement contrôlées, il est peu probable que vous en administriez plus que nécessaire. Dans le cas d’un surdosage, le muscle restera relâché plus longtemps que nécessaire.
Pour toute autre question sur l’utilisation de ce médicament, adressez-vous à votre médecin, pharmacien ou votre infirmier/ère.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Effets indésirables très fréquents (pouvant affecter plus d’1 personne sur 10) :
· spasmes musculaires visibles sous la peau
· douleur musculaire après une opération – votre médecin vous placera sous surveillance pour cela.
Effets indésirables fréquents (pouvant affecter jusqu’à 1 personne sur 10)
· réactions allergiques : démangeaisons, urticaire, collapsus
· augmentation de la pression de liquide dans l’œil, ce qui peut provoquer des maux de tête ou une vision trouble
· augmentation de la pression dans l’estomac
· accélération ou ralentissement de votre rythme cardiaque
· faible tension artérielle
· présence de protéines dans le sang ou les urines en raison d’une lésion musculaire
· taux élevé de potassium dans le sang
· bouffées de chaleur
· éruption cutanée.
Effets indésirables rares (pouvant affecter jusqu’à 1 personne sur 1 000)
· difficulté à respirer
· température corporelle élevée
· difficulté à ouvrir la bouche.
Effets indésirables de fréquence indéterminée (ne peut être estimée sur la base des données disponibles)
· gonflement (œdème de Quincke)
· arrêt cardiaque
· tension artérielle élevée ou basse
· production excessive de salive
· production excessive d’expectoration
· apnée passagère
· lésion musculaire
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, votre pharmacien ou à votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : www.signalement-sante.gouv.fr
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER SUXAMETHONIUM AGUETTANT 10 mg/mL, solution injectable en seringue préremplie ?
Tenir ce médicament hors de la vue et de la portée des enfants.
N’administrez pas ce médicament après la date de péremption indiquée sur l’étiquette de la seringue préremplie, la plaquette thermoformée et la boîte carton. La date de péremption fait référence au dernier jour de ce mois.
À conserver au réfrigérateur (entre 2°C et 8°C).
Conserver la seringue préremplie dans sa plaquette non ouverte jusqu’à son utilisation.
Après ouverture de l’emballage, le médicament doit être utilisé immédiatement.
N’utilisez pas ce médicament si vous remarquez des signes visibles de dégradation.
Toute seringue préremplie, même partiellement utilisée, doit être jetée de manière appropriée après utilisation. Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient SUXAMETHONIUM AGUETTANT 10 mg/mL, solution injectable en seringue préremplie
· La substance active est du chlorure de suxaméthonium.
Chaque mL de solution injectable contient 10 mg de chlorure de suxaméthonium anhydre (équivalent à 11 mg de chlorure de suxaméthonium dihydraté).
Chaque seringue préremplie de 10 mL contient 100 mg de chlorure de suxaméthonium anhydre (équivalent à 110 mg de chlorure de suxaméthonium dihydraté).
· Les autres composants sont : chlorure de sodium, acide succinique, hydroxyde de sodium ou acide chlorhydrique (pour ajustement du pH), eau pour préparations injectables.
SUXAMETHONIUM AGUETTANT 10 mg/mL, solution injectable en seringue préremplie se présente sous forme d’une solution injectable contenue dans une seringue préremplie (polypropylène) de 10 mL, conditionnée individuellement sous une plaquette thermoformée transparente.
Boîtes de 1 ou 10 seringue(s) préremplie(s).
Toutes les présentations peuvent ne pas être commercialisées.
Titulaire de l’autorisation de mise sur le marché
1, RUE ALEXANDER FLEMING
69007 LYON
Exploitant de l’autorisation de mise sur le marché
1, RUE ALEXANDER FLEMING
69007 LYON
1, RUE ALEXANDER FLEMING
69007 LYON
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Ce médicament est autorisé dans les Etats membres de l'Espace Economique Européen sous les noms suivants : Conformément à la réglementation en vigueur.
[À compléter ultérieurement par le titulaire]
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
{MM/AAAA}>< {mois AAAA}.
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).
Les informations suivantes sont destinées exclusivement aux professionnels de la santé :
La seringue préremplie ne convient pas pour une utilisation avec un pousse-seringue.
Respecter scrupuleusement le protocole ci-dessous lors de la préparation de la seringue :
La seringue préremplie est à utiliser chez un seul patient. Jetez la seringue après utilisation. Ne pas réutiliser.
Le médicament ne doit pas être utilisé si le dispositif d’inviolabilité sur la seringue est rompu.
|
1) Retirez la seringue préremplie stérile de la plaquette thermoformée. |
|
|
|
2) Enfoncez le piston pour libérer le bouchon. Le procédé de stérilisation peut avoir fait adhérer le bouchon au corps de la seringue. |
|
|
3) Enlevez le capuchon en le dévissant de manière à rompre la bande d’inviolabilité. Ne pas toucher le raccord Luer exposé afin d’éviter toute contamination. |
|
|
4) Vérifiez que la bande d’inviolabilité à la pointe de la seringue a été complètement retirée. Si ce n’est pas le cas, remettez le capuchon en place et dévissez à nouveau. |
|
|
5) Chassez l’air en enfonçant doucement le piston. |
|
6) Raccordez la seringue à l’abord ou à une aiguille. Enfoncez lentement le piston pour injecter le volume requis. |
|