Dernière mise à jour le 01/12/2025
SYNAREL 0,2 mg/dose, solution pour pulvérisation nasale
Indications thérapeutiques
Ce médicament est un produit comparable à une hormone naturelle.
Ce médicament est préconisé dans les situations suivantes :
· dans le traitement de l'endométriose. La durée du traitement est au maximum de 6 mois,
· dans le traitement de certaines stérilités. Ce traitement est généralement associé avec d'autres hormones (appelées gonadotrophines) au cours des traitements de procréation médicalement assistée (fécondation in vitro).
Présentations
> 1 flacon(s) en verre de 8 ml avec embout nasal polypropylène
Code CIP : 353 521-0 ou 34009 353 521 0 1
Déclaration de commercialisation : 16/11/2000
Cette présentation est agréée aux collectivités
- Prix hors honoraire de dispensation : 109,87 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 110,89 €
- Taux de remboursement :65%
Service médical rendu (SMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Important | Avis du 18/02/2015 | Renouvellement d'inscription (CT) | Le service médical rendu par SYNAREL reste important dans les indications de l’AMM. |
Amélioration du service médical rendu (ASMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprés de la HAS (plus d'informations dans l'aide). Les avis et synthéses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur de l'ASMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| V (Inexistant) | Avis du 22/09/2010 | Renouvellement d'inscription (CT) | Synarel n'apporte pas d'amélioration du service médical rendu (ASMR V) par rapport aux autres agonistes de la GnRH à administration quotidienne dans le traitement de l'endométriose. Synarel n'apporte pas d'amélioration du service médical rendu (ASMR V) dans la dans la stratégie thérapeutique de la désensibilisation hypophysaire au cours de l'induction de l'ovulation. |
ANSM - Mis à jour le : 10/11/2025
SYNAREL 0,2 mg/dose, solution pour pulvérisation nasale
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Acétate de nafaréline
Quantité correspondant à nafaréline base ...................................................................0,20* mg
Pour une dose*.
*Une dose correspond à 0,100 ml ± 0,02 ml contenant 0,160 mg à 0,240 mg de nafaréline base.
Excipient à effet notoire : SYNAREL contient 0,01 mg de chlorure de benzalkonium dans chaque spray.
Pour la liste complète des excipients, voir rubrique 6.1.
Solution pour pulvérisation nasale.
4.1. Indications thérapeutiques
1) Endométriose à localisation génitale et extragénitale (du stade I au stade IV).
L'expérience clinique relative au traitement de l'endométriose est limitée aux femmes âgées de 18 ans et plus.
2) Désensibilisation hypophysaire au cours de l'induction de l'ovulation en vue d'une fécondation in vitro suivie d'un transfert d'embryons.
4.2. Posologie et mode d'administration
Endométriose
Le traitement doit être débuté dans les 5 premiers jours du cycle.
La posologie recommandée est de 400 microgrammes par 24 heures en deux prises à raison d'une pulvérisation (équivalente à 200 microgrammes de nafaréline) dans une narine le matin et d'une pulvérisation dans l'autre narine le soir.
Chez certaines patientes la dose quotidienne de 400 microgrammes peut s'avérer insuffisante pour obtenir l'aménorrhée. Dans ce cas, la dose pourra être portée à 400 microgrammes deux fois par jour (une pulvérisation dans chaque narine matin et soir). Dans tous les cas, il est indispensable de respecter une administration biquotidienne.
La durée de traitement est au maximum de 6 mois, en raison du risque d'ostéoporose (voir rubrique 4.8).
Il n’est pas souhaitable d’entreprendre une seconde cure par la nafaréline ou par un autre analogue de la GnRH.
Désensibilisation hypophysaire au cours de l'induction de l'ovulation en vue d'une fécondation in vitro suivie d'un transfert d'embryons
La posologie recommandée est :
· en protocole court : de 400 µg par jour soit une pulvérisation dans une narine le matin (200 µg) et une pulvérisation dans la narine controlatérale le soir (200 µg),
· en protocole long : de 400 µg par jour soit 1 pulvérisation le matin (200 µg) et 1 pulvérisation le soir (200 µg) par jour en première intention, avec augmentation à 800 µg par jour soit 2 pulvérisations le matin (200 µg dans chaque narine) et 2 pulvérisations le soir (200 µg dans chaque narine) en cas d'échec de désensibilisation lors d'un précédent cycle.
Le traitement doit être débuté soit au début de la phase folliculaire (2ème jour du cycle) soit au milieu de la phase lutéale (habituellement le 21ème jour du cycle menstruel).
Le traitement doit être poursuivi jusqu’à l’obtention de la désensibilisation hypophysaire. Si celle-ci ne survient pas au bout de 3 à 4 semaines, la cause de l’échec de la désensibilisation doit être recherchée, en vue de déterminer s’il est justifié ou non de poursuivre le traitement.
Mode d'administration
Il est nécessaire d'expliquer à la patiente comment utiliser correctement le flacon nébuliseur et d'insister sur l'importance du respect de la posologie quotidienne et du caractère continu du traitement. Celui-ci devra être poursuivi sans interruption même si la patiente est enrhumée.
Pour éviter tout oubli, la patiente peut noter chaque jour, la prise de chaque dose sur un calendrier en prenant soin de noter la date de la première utilisation du flacon.
Il convient d'informer les patientes que l'utilisation du flacon au-delà d'un traitement de 30 jours (400 microgrammes/jour) ou de 15 jours (800 microgrammes/jour) peut entraîner la délivrance de quantités insuffisantes.
Conseils importants sur l'utilisation de SYNAREL
· La pompe devrait produire une fine brume, qui ne peut se produire que par une action de pompage rapide et ferme. Il est normal de voir de plus grosses gouttelettes de liquide dans la fine brume. Cependant, si SYNAREL sort de la pompe sous la forme d'un mince filet de liquide au lieu d'une fine brume, SYNAREL peut ne pas fonctionner aussi bien, et le patient devra en parler à un pharmacien.
· Le patient doit s’assurer de nettoyer l’embout après l’amorçage (au moment de la première utilisation). L’embout de pulvérisation doit être ensuite nettoyé avant et après chaque utilisation. Ne pas le faire peut entraîner l’obstruction de l’embout ce qui peut empêcher le patient de prendre la bonne dose prescrite de médicament. Toujours remettre le clip de sécurité et le capuchon protecteur en plastique sur la partie nasale après utilisation pour éviter que la pointe ne soit obstruée.
· La pompe est conçue pour seulement administrer une quantité déterminée de médicament, quelle que soit la puissance de pompage.
· Le patient ne doit pas essayer d'agrandir le petit orifice de l’embout. Si le trou est plus grand, la pompe délivrera une dose incorrecte de SYNAREL.
MODE D'EMPLOI
AVANT LA PREMIERE UTILISATION : AMORCAGE DE LA POMPE
|
|
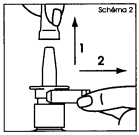
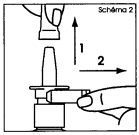
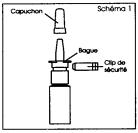
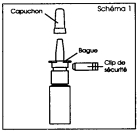
1. Retirer et mettre de côté le capuchon protecteur, puis le clip de sécurité (schéma 2). Le clip de sécurité puis le capuchon seront remis en place après chaque utilisation. |
|
|
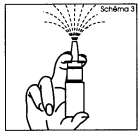
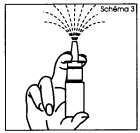
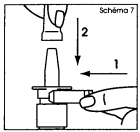
2. Tenir le flacon en position verticale loin de vous avec deux doigts sur la bague de chaque côté de l'embout et le pouce sur le fond du flacon (schéma 3). 3. Pour amorcer la pompe, actionner le mécanisme de pulvérisation en exerçant plusieurs pressions rapides et fermes, jusqu'à ce qu'une première pulvérisation apparaisse (schéma 3). |
|
4. Nettoyer l’extrémité de la pompe après l’amorçage. Tenir le flacon en position horizontale et rincer l’embout avec un filet d’eau chaude, tout en frottant avec le doigt ou avec un tissu doux et propre durant 15 secondes. Ne pas nettoyer l’embout du flacon pulvérisateur avec un objet pointu. Cela aurait pour conséquence de délivrer une dose incorrecte. Ne retirer pas la pompe du flacon, car cela expulserait la pression d’amorçage. Essuyer ensuite l’embout avec un chiffon ou un tissu doux et propre. |
|
|
Le flacon est alors prêt à l'emploi. |
|
|
Cette opération d'amorçage de la pompe n'est à réaliser que lors de la première utilisation. Le patient gaspillera son médicament s’il effectue cette opération d’amorçage à chaque fois qu’il l’utilise. |
INSTRUCTIONS D'UTILISATION
|
|
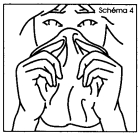
1. Effectuer un nettoyage soigneux du nez ; le mouchage facilitera en effet l'absorption du produit pulvérisé (schéma 4). Si le patient a un rhume (ou une rhinite), il doit continuer son traitement : il n'y a aucune contre-indication. En revanche, si un décongestionnant intranasal lui a été prescrit, le patient doit faire sa pulvérisation de SYNAREL au moins 30 minutes avant l'utilisation du décongestionnant. |
|
|
2. Retirer et mettre de côté le capuchon protecteur, puis le clip de sécurité (schéma 2). 3. Nettoyer l’extrémité de l’embout. Tenir le flacon en position horizontale et rincer l’embout sous un filet d’eau chaude (schéma 8), tout en le frottant légèrement avec le doigt ou avec un tissu doux et propre durant 15 secondes. IMPORTANT : Ne pas nettoyer l’embout du flacon pulvérisateur avec un objet pointu. Ceci pourrait l’endommager et cela aurait pour conséquence de délivrer une dose incorrecte. Ne jamais essayer de démonter la pompe : votre flacon serait alors inutilisable. Essuyer ensuite l’embout avec un chiffon ou un tissu doux et propre. 4. Placer les doigts comme indiqué précédemment (schéma 3).
5. Pencher légèrement la tête en avant. Introduire l'embout vers l'arrière du nez en veillant à ce que le flacon reste bien en position verticale (schéma 5). |
|
|
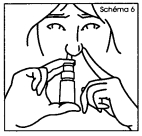
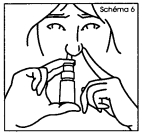
6. Fermer l'autre narine avec le doigt. Tout en inspirant doucement, exercer une seule pression ferme et rapide sur le fond du flacon (schéma 6). Après la pulvérisation, retirer l'embout et pencher légèrement la tête en arrière de manière à assurer une bonne répartition du produit vers l'arrière du nez. |
|
|
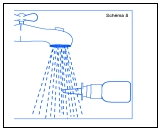
7. Nettoyer l’extrémité de l’embout. Tenir le flacon en position horizontale et rincer l’embout sous un filet d’eau chaude (schéma 8), tout en frottant légèrement avec le doigt ou avec un tissu doux et propre durant 15 secondes. IMPORTANT Ne pas nettoyer l'embout du flacon pulvérisateur avec un objet pointu. Ceci pourrait l'endommager et cela aurait pour conséquence de délivrer une dose incorrecte. Ne jamais essayer de démonter la pompe : votre flacon serait alors inutilisable. Essuyer ensuite l’embout avec un chiffon ou un tissu doux et propre. Le nettoyage de l’embout avant et après chaque utilisation est important pour éviter son encrassement, cela aurait pour conséquence de délivrer une dose incorrecte du produit. 8. Après utilisation, essuyer l’embout, remettre le clip de sécurité puis le capuchon protecteur à fond (schéma 7). Ceci est important car cela permet d’éviter que l’embout ne soit obstrué. |
· Hémorragie génitale de cause non déterminée.
4.4. Mises en garde spéciales et précautions d'emploi
L'absence de grossesse doit être confirmée avant de débuter le traitement.
Si l'utilisation d'un décongestionnant nasal est nécessaire pendant le traitement avec la nafaréline, il est recommandé de l'administrer au moins 30 minutes après la nafaréline.
Un éternuement pendant ou immédiatement après l’administration de la dose peut affecter l’absorption du produit. Une répétition de la dose est alors recommandée.
Comme avec d’autres produits de la classe, des cas de kystes ovariens ont été rapportés, survenant dans les deux premiers mois de traitement par la nafaréline. La plupart de ces évènements, mais pas tous, sont apparus chez des patientes souffrant de maladie polykystique de l’ovaire. Ils peuvent se résorber spontanément, généralement après 4 à 6 semaines de traitement, mais nécessitent dans certains cas l’arrêt du traitement et/ou une intervention chirurgicale (voir rubrique 4.8).
Comme pour les autres agonistes de la GnRH, des cas de syndrome d’hyperstimulation ovarienne (SHO) ont été rapportés, liés à l’utilisation de nafaréline en association avec la gonadotrophine. Les patientes traitées pour une stimulation ovarienne contrôlée avant une fécondation in vitro doivent faire l’objet d’une surveillance attentive. Si des signes de SHO apparaissent, le traitement doit être interrompu (voir rubrique 4.8).
Endométriose
L'expérience clinique relative au traitement de l'endométriose est limitée aux femmes âgées de 18 ans et plus.
L'utilisation régulière de la nafaréline, aux doses recommandées, inhibe l'ovulation. En cas d'oubli de plusieurs doses, une ovulation peut se produire avec risque de grossesse.
Il doit être recommandé aux patientes d’utiliser des méthodes de contraception non hormonales.
En cas de grossesse survenant durant le traitement, il conviendra d'arrêter l'administration de la nafaréline. La patiente devra être informée des risques potentiels sur le développement du fœtus et/ou de fausse couche. Du fait du risque existant de fausse couche chez cette population de patientes, le lien de causalité avec nafaréline est incertain.
Si les symptômes d’endométriose et de fibromes persistent après un premier traitement, et qu’il est envisagé un traitement supplémentaire par la nafaréline, il est recommandé de mesurer la densité osseuse avant de recommencer le traitement, afin de s’assurer que les valeurs sont normales.
Diminution de la densité minérale osseuse (DMO) :
Chez l’adulte après six mois de traitement, des diminutions de la densité minérale osseuse ont été observées, telles que mesurées par absorptiométrie biphotonique au niveau de plusieurs endroits du squelette.
Une restauration substantielle de l'os est survenue après arrêt du traitement, avec une restauration de la masse vertébrale totale moyenne 1,4 % inférieure à celle observée avant initiation du traitement (voir rubriques 4.8 et 5.1).
Désensibilisation hypophysaire au cours de l'induction de l'ovulation
L'association de la nafaréline avec les gonadotrophines peut entraîner une hyperstimulation ovarienne. Une hypertrophie ovarienne, des douleurs pelviennes et/ou abdominales peuvent s'observer (voir rubrique 4.8).
L'induction de l'ovulation ne doit être réalisée que sous étroite surveillance médicale avec contrôles biologiques et cliniques stricts et réguliers : dosage rapide de l'estradiol plasmatique, échographies.
Aucune donnée clinique relative à l’utilisation de nafaréline n’est disponible dans la stimulation ovarienne contrôlée chez des patientes souffrant de maladie polykystique de l’ovaire, cependant il existe un risque d’hyperstimulation ovarienne.
En cas de réponse excessive des ovaires, il est recommandé d'interrompre le cycle de traitement en cessant les injections de gonadotrophines.
Examens paracliniques
L'administration de nafaréline aux doses thérapeutiques entraîne une inhibition du système hypophyso-gonadique. Le fonctionnement normal du système est habituellement restauré entre 4 à 8 semaines après arrêt du traitement. Les tests d'exploration de l'axe hypophyso-gonadique effectués pendant le traitement et pendant cette période de 4 à 8 semaines seront en conséquence perturbés.
Un éternuement pendant ou immédiatement après l’administration de la dose peut affecter l’absorption du produit. Une répétition de la dose peut alors être recommandée.
Excipients
SYNAREL contient du chlorure de benzalkonium, un conservateur, qui peut provoquer des contractions des voies respiratoires. Le conservateur (chlorure de benzalkonium) dans SYNAREL peut provoquer un œdème de la muqueuse nasale, particulièrement dans le cas d’une utilisation à long terme. Si un œdème persistant dans la muqueuse nasale est suspecté, un médicament pour administration par voie nasale sans conservateur doit, si possible, être choisi. Si de tels produits pour administration par voie nasale ne sont pas disponibles, l’utilisation d’autres formulations du médicament doit être envisagée.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Aucune étude pour mettre en évidence des interactions médicamenteuses d'ordre pharmacocinétique n’a été réalisée.
Cependant, la dégradation est principalement due à l'action de peptidases et non à celle des systèmes enzymatiques à cytochrome P-450.
De plus, la nafaréline n'étant liée qu'à 80 % environ aux protéines plasmatiques (albumine) à 4 °C, les interactions médicamenteuses en rapport avec les liaisons aux protéines sont peu probables.
L’absorption nasale de nafaréline n’est pas diminuée en cas de rhinites. L’utilisation d’un décongestionnant nasal contenant de l’oxymétazoline chlorhydrate une demi-heure avant l’administration de nafaréline chez les sujets présentant des rhinites chroniques diminue de façon significative l’absorption de nafaréline (diminution de 39 % de l’ASC -8h ; diminution de la Cmax de 49 %), en comparaison avec des patients présentant une muqueuse nasale saine. L’utilisation de décongestionnant doit être évitée chez les patients recevant de la nafaréline (voir rubrique 4.4).
Mais s’il est nécessaire le décongestionnant doit être administré au moins 30 minutes après l’administration de la nafaréline.
4.6. Fertilité, grossesse et allaitement
Grossesse
Aucunes données de sécurité clinique sur l’utilisation de SYNAREL au cours de la grossesse n’ont été établies.
Les analogues de la GnRH sont actuellement utilisés comme inducteurs de l'ovulation, en association avec les gonadotrophines, en vue d'obtenir une grossesse. La grossesse ne représente donc pas une indication de ces produits.
Toutefois, l'expérience montre que certaines femmes, après induction de l'ovulation lors d'un précédent cycle, développent une grossesse sans en avoir connaissance et entreprennent de ce fait une nouvelle stimulation ovarienne.
Les données actuellement disponibles sur les effets de cette classe de produits au cours de la grossesse sont les suivantes : les études sur la reproduction chez le rat ont mis en évidence une toxicité fœtale lors de l’administration d’une dose 10 fois supérieure à celle administrée par voie intranasale chez l’homme. Une telle toxicité fœtale n’a pas été mise en évidence chez la souris ou le lapin (voir rubrique 5.3). L’administration de nafaréline au cours de la grossesse peut entrainer un effet malformatif du fœtus (voir rubrique 5.3).
Il n’a pas été établi dans quelles limites la nafaréline passait dans le lait maternel. Il n’a pas été établi si l’enfant nourri au sein pouvait être affecté. En l'absence de données concernant le passage de la nafaréline dans le lait maternel et les effets éventuels sur l'enfant nourri au sein, la nafaréline ne devra pas être utilisée en cas d'allaitement.
Fertilité
La suppression de la fertilité observée dans les études non cliniques chez des rats mâles et femelles a montré une restauration complète après l’arrêt du traitement.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
SYNAREL n’a aucun effet sur l’aptitude à conduire des véhicules et à utiliser des machines.
Dans les essais cliniques, des cas d’hypersensibilité immédiate ont été décrites : douleur thoracique, éruption, prurit, érythème urticaire, dyspnée.
Modification de la densité osseuse : L'utilisation prolongée des analogues de la GnRH peut induire une perte osseuse, facteur de risque d’ostéoporose (voir rubrique 5.1).
Comme avec d’autres produits de la classe, des cas de kystes ovariens ont été rapportés, survenant dans les deux premiers mois de traitement par la nafaréline.
L'association avec les gonadotrophines peut entraîner une hyperstimulation ovarienne. Une hypertrophie ovarienne, des douleurs pelviennes et/ou abdominales peuvent être observées (voir rubrique 4.4).
Les effets indésirables suivants ont été rapportés durant le traitement sur 282 patientes adultes avec de l’acétate de nafaréline avec les fréquences suivantes : très fréquent (≥ 1/10), fréquent (≥ 1/100 à < 1/10), peu fréquent (≥ 1/1 000 à < 1/100), rare (≥ 1/10 000 à < 1/1 000), très rare (< 1/10 000), fréquence indéterminée (ne peut être estimée sur la base des données disponibles).
|
MedDRA Système Organe Classe |
Fréquence |
Effets indésirables |
|
Affections du système immunitaire |
Fréquent |
Hypersensibilité médicamenteuse (douleur thoracique, dyspnée, prurit, éruption, urticaire, érythème) |
|
Affections endocriniennes |
Fréquent |
Déficit en œstrogènes |
|
Troubles du métabolisme et de la nutrition |
Très fréquent |
Prise de poids |
|
Fréquent |
Perte de poids |
|
|
Affections psychiatriques |
Très fréquent |
Labilité émotionnelle, diminution de la libido |
|
Fréquent |
Dépression, insomnie, augmentation de la libido |
|
|
Affections du Système Nerveux |
Très fréquent |
Céphalées |
|
Fréquent |
Paresthésies |
|
|
Affections vasculaires |
Très fréquent |
Bouffées de chaleur |
|
Fréquent |
Hypertension, Hypotension |
|
|
Affections respiratoires, thoraciques et médiastinales |
Très fréquent |
Rhinite |
|
Affections de la peau et du tissu sous-cutané |
Très fréquent |
Acné, séborrhée |
|
Fréquent |
Hirsutisme |
|
|
Peu fréquent |
Alopécie |
|
|
Affections musculo-squelettiques et systémiques |
Très fréquent |
Myalgies |
|
Fréquent |
Arthralgies |
|
|
Affections des organes de reproduction et du sein |
Très fréquent |
Atrophie mammaire, sécheresse vulvo-vaginale |
|
Fréquent |
Ménopause artificielle, hémorragie utérine, endométriose (aggravation) |
|
|
Fréquence indéterminée |
Syndrome d’hyperstimulation ovarienne |
|
|
Troubles généraux et anomalies au site d'administration |
Très fréquent |
Œdème de la muqueuse nasale |
|
Investigations |
Fréquent |
Diminution de la densité osseuse |
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/.
Aucun cas de surdosage n’a été rapporté.
Une administration sous-cutanée chez l’animal d’une dose 60 fois supérieure à la dose recommandée chez l’homme (exprimé en mcg/kg) n’a pas provoqué l’apparition d’effets indésirables.
En cas d'absorption orale accidentelle, la nafaréline subit une dégradation enzymatique au niveau du tractus gastro-intestinal et est ainsi rendue inactive.
En cas de surdosage, le traitement devra être symptomatique et supportif.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
La nafaréline est un décapeptide de synthèse, analogue de la GnRH naturelle.
Administrée à dose unique, la nafaréline stimule la sécrétion des gonadotrophines hypophysaires, LH et FSH, avec comme conséquence une stimulation de la sécrétion des stéroïdes ovariens et testiculaires.
Le traitement initial par nafaréline peut provoquer une exacerbation transitoire de l'endométriose. Lors d’une administration répétée de doses, la réponse à la stimulation diminue progressivement.
Après administration quotidienne pendant 3 à 4 semaines, on observe une diminution de la sécrétion de gonadotrophines hypophysaires et/ou une sécrétion de gonadotrophines de moindre activité biologique. Cela entraîne une diminution de la stéroïdogénèse gonadique et par conséquent une diminution de l'effet des stéroïdes gonadiques sur leurs tissus cibles. Ce blocage de l'axe hypophyso-gonadique est réversible après l'arrêt du traitement.
Diminution de la densité minérale osseuse
Chez l’adulte, après 6 mois de traitement, on n'a observé que peu, ou pas de diminution de la trame minérale de l'os compact mesurée au niveau de l'extrémité distale du radius et du 2ème métacarpe. Une réduction d'environ 8,7 % de la densité de l'os trabéculaire vertébral et une baisse de la masse osseuse vertébrale de l'ordre de 4,3 % ont été mises en évidence. La masse osseuse vertébrale totale, mesurée par absorptiométrie biphotonique avait diminuée de 5.9 % en moyenne à la fin du traitement. La masse vertébrale totale moyenne, réévaluée par absorptiométrie biphotonique 6 mois après l’arrêt du traitement, demeurait 1.4 % inférieure à celle observée avant son initiation.
5.2. Propriétés pharmacocinétiques
Elle atteint approximativement 0,62 ng/ml et 1,5 ng/ml respectivement après administration de dose unique de 200 et 400 µg.
La demi-vie plasmatique est approximativement de 4 heures chez l’adulte et de 2,6 heures chez l’enfant. La biodisponibilité de la solution nasale est, en moyenne, de 2,8 % (de 1,2 % à 5,6 %). L’administration deux fois par jour de 200 ou 400 µg de nafaréline chez 18 femmes saines pendant 22 jours n’a pas mis en évidence une accumulation du produit.
L'étude in vitro de la liaison de la nafaréline aux protéines plasmatiques montre qu'elle est comprise entre 78 et 84 % principalement sur l'albumine. Le taux de liaison de la GnRH naturelle est compris entre 22 et 25 %.
Le produit est éliminé par voies rénale (50 %) et fécale (50 %) essentiellement sous forme de métabolites inactifs. Chez 3 sujets, 44 % à 56 % et 19 % à 44 % de radioactivité ont été retrouvée respectivement dans les urines et les fèces, après administration sous-cutanée de nafaréline marquée au 14C. Près de 3 % sont excrétés inchangés dans les urines. 83 % en moyenne de la dose administrée a été mise en évidence. Six métabolites ont été identifiés ; cependant leur activité biologique n’a pas été déterminée.
5.3. Données de sécurité préclinique
Les études conduites sur des systèmes bactériens et chez des mammifères n’ont fourni aucune indication d’un potentiel mutagène pour la nafaréline.
Les études chez les rats mâles et femelles ont montré une réversibilité de la suppression de la fertilité lorsque le traitement était arrêté après une administration continue allant jusqu’à 6 mois.
Lors de l’administration intramusculaire chez les rats entre le 6ème et le 15ème jour de la grossesse aux doses de 0,4, 1,6 et 6,4 µg/kg/jour (0,6, 2,5 et 10,0 fois la dose intranasale administrable chez l’homme), 4 fœtus sur 80 parmi le groupe recevant la plus forte dose a présenté des anomalies majeures, non mis en évidence lors d’une étude répétée chez les rats. De plus, les études chez les souris et les lapins n’ont pas permis de mettre en évidence une augmentation des anomalies fœtales. Chez les rats, la mortalité fœtale a augmenté proportionnellement à l’augmentation de la dose, et une diminution du poids à la naissance lors de l’administration de la plus forte dose. Les effets sur les mortalités fœtales chez les rats sont des conséquences logiques d’une altération des concentrations hormonales provoquée par le médicament chez ces espèces.
6.4. Précautions particulières de conservation
A conserver à une température ne dépassant pas 25 °C et à l'abri de la lumière et de l'humidité.
6.5. Nature et contenu de l'emballage extérieur
8 ml (60 doses) en flacon (verre de type I) recouvert de PVC muni d'un embout nasal (polypropylène) fixé au flacon par un clip (polypropylène).
10 ml (60 doses) en flacon pulvérisateur (polyéthylène) avec pompe doseuse.
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
Pas d'exigences particulières.
Afin de s'assurer que la dose correcte du médicament est administrée, il est important que l’embout de la pompe soit nettoyé après l’amorçage (au moment de la première utilisation). L’embout de pulvérisation doit être ensuite nettoyé avant et après chaque utilisation pour éviter qu’il ne soit obstrué (voir rubrique 4.2).
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
23-25 AVENUE DU DOCTEUR LANNELONGUE
75014 PARIS
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 353 521 0 1 : 8 ml en flacon (verre) avec embout nasal (polypropylène) ; boîte de 1.
· 34009 332 856 3 0 : 10 ml en flacon (polyéthylène) avec pompe doseuse ; boîte de 1.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
A compléter ultérieurement par le titulaire
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Liste I.
ANSM - Mis à jour le : 10/11/2025
SYNAREL 0,2 mg/dose, solution pour pulvérisation nasale
Acétate de nafaréline
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin, votre pharmacien ou votre infirmier/ère.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable parlez-en à votre médecin, votre pharmacien ou votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que SYNAREL 0,2 mg/dose, solution pour pulvérisation nasale et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d'utiliser SYNAREL 0,2 mg/dose, solution pour pulvérisation nasale ?
3. Comment utiliser SYNAREL 0,2 mg/dose, solution pour pulvérisation nasale ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver SYNAREL 0,2 mg/dose, solution pour pulvérisation nasale ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE SYNAREL 0,2 mg/dose, solution pour pulvérisation nasale ET DANS QUELS CAS EST-IL UTILISE ?
Ce médicament est un produit comparable à une hormone naturelle.
Ce médicament est préconisé dans les situations suivantes :
· dans le traitement de l'endométriose. La durée du traitement est au maximum de 6 mois,
· dans le traitement de certaines stérilités. Ce traitement est généralement associé avec d'autres hormones (appelées gonadotrophines) au cours des traitements de procréation médicalement assistée (fécondation in vitro).
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER SYNAREL 0,2 mg/dose, solution pour pulvérisation nasale ?
N'utilisez jamais SYNAREL 0,2 mg/dose, solution pour pulvérisation nasale :
· si vous êtes allergique à l’acétate de nafaréline, à tout autre médicament semblable ou à l'un des autres composants contenus dans ce médicament, mentionnés dans la rubrique 6,
· si vous avez un saignement vaginal de cause non déterminée.
Avertissements et précautions
Vous devez être certaine de ne pas être enceinte avant de débuter le traitement.
Ce médicament est réservé à l’adulte.
Si vous utilisez un décongestionnant nasal pendant le traitement, vous devez l’utiliser au moins 30 minutes après SYNAREL 0,2 mg/dose, solution pour pulvérisation nasale.
Si vous éternuez pendant ou immédiatement après avoir pris la dose de SYNAREL, il est recommandé de prendre une dose supplémentaire.
Dans certains cas, l’administration de ce médicament a peut-être pu favoriser la survenue de kystes au niveau des ovaires, notamment en cas de syndrome polykystique des ovaires. Ceux-ci peuvent disparaitre spontanément ou nécessiter une intervention chirurgicale.
L'utilisation régulière de la nafaréline dans le traitement de l'endométriose, aux doses recommandées, inhibe l'ovulation.
En cas d'oubli de plusieurs doses, une ovulation peut se produire avec risque de grossesse. Il est donc conseillé dans ce cas d’utiliser une méthode de contraception appropriée.
L'utilisation dans le traitement de certaines stérilités doit se faire sous étroite surveillance médicale avec contrôles biologiques, cliniques et radiologiques stricts et réguliers. En cas d'apparition de douleurs pelviennes et/ou abdominales, consultez rapidement votre médecin.
L’utilisation de SYNAREL 0,2 mg/dose, solution pour pulvérisation nasale en association avec la gonadotrophine pour traiter l’infertilité peut parfois provoquer une réaction excessive de vos ovaires (syndrome d’hyperstimulation ovarienne, SHO). Vous pouvez remarquer des douleurs à l’estomac, un gonflement de votre estomac, et vous sentir ou être malade. Si cela se produit, parlez-en à votre médecin. Voir également rubrique 4 « Quels sont les effets indésirables éventuels ? ».
En raison de la présence de chlorure de benzalkonium, ce médicament peut provoquer une gêne respiratoire.
Adressez-vous à votre médecin, pharmacien ou votre infirmier/ère avant d’utiliser SYNAREL 0,2 mg/dose, solution pour pulvérisation nasale.
Enfants
Sans objet.
Autres médicaments et SYNAREL 0,2 mg/dose, solution pour pulvérisation nasale
Informez votre médecin ou pharmacien si vous utilisez, avez récemment utilisé ou pourriez utiliser tout autre médicament.
SYNAREL 0,2 mg/dose, solution pour pulvérisation nasale avec des aliments et boissons
Sans objet.
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin ou pharmacien avant de prendre ce médicament.
Grossesse
Ce médicament n'a pas à être utilisé pendant la grossesse. En cas de découverte fortuite d'une grossesse alors que vous preniez ce médicament, avertissez tout de suite votre médecin, qui interrompra alors le traitement.
Demandez conseil à votre médecin ou à votre pharmacien avant de prendre tout médicament.
Allaitement
En l'absence d'informations concernant le passage de la nafaréline dans le lait maternel et les effets éventuels sur l'enfant, la nafaréline ne devra pas être utilisée en cas d'allaitement.
Demandez conseil à votre médecin ou à votre pharmacien avant de prendre tout médicament.
Conduite de véhicules et utilisation de machines
SYNAREL n’a aucun effet sur l’aptitude à conduire des véhicules ou à utiliser des machines.
SYNAREL 0,2 mg/dose, solution pour pulvérisation nasale contient du chlorure de benzalkonium.
Ce médicament contient 0,01 mg de chlorure de benzalkonium dans chaque spray. Le chlorure de benzalkonium peut provoquer des irritations ou un gonflement à l’intérieur du nez, surtout s’il est utilisé sur une longue période.
3. COMMENT UTILISER SYNAREL 0,2 mg/dose, solution pour pulvérisation nasale ?
Veillez à toujours utiliser ce médicament en suivant exactement les indications de votre médecin.
Posologie
Vérifiez auprès de votre médecin, pharmacien ou infirmier/ère en cas de doute.
Endométriose
Le traitement doit être débuté dans les 5 premiers jours du cycle.
La dose habituelle est de 2 pulvérisations par jour : une pulvérisation le matin dans une narine, et une pulvérisation le soir dans l'autre narine.
Stérilité
Le traitement doit être débuté soit le 2ème jour du cycle soit le 21ème jour du cycle.
La posologie est habituellement de 2 pulvérisations par jour : une pulvérisation le matin dans une narine et une pulvérisation le soir dans l'autre narine.
Dans certains cas, cette posologie peut être doublée, c'est-à-dire une pulvérisation le matin dans chaque narine (200 microgrammes dans chaque narine) et une pulvérisation le soir dans chaque narine (200 microgrammes dans chaque narine).
Mode et voie d’administration
SYNAREL est une solution pour pulvérisation nasale.
DUREE D'UTILISATION DU FLACON
Un flacon délivre 60 doses. Afin d'assurer l'exactitude des doses délivrées, n'utilisez pas le flacon au-delà de 30 jours de traitement si la prescription est de 1 pulvérisation matin et soir. Chaque flacon de SYNAREL contient suffisamment de produit pour l'amorçage de la pompe et 60 pulvérisations, soit 30 jours de traitement à la posologie d'une pulvérisation le matin et une le soir.
A la fin des 30 jours, une petite quantité de liquide reste au fond du flacon. N'essayez pas de l'utiliser, les doses pulvérisées seraient alors trop faibles ou inégales et vous diminueriez ainsi l'efficacité du traitement.
Si votre médecin vous a prescrit 4 pulvérisations par jour, la quantité de produit contenue dans le flacon ne permet que 15 jours de traitement.
Conseils importants sur l'utilisation de SYNAREL
· Votre pompe devrait produire une fine brume, qui ne peut se produire que par une action de pompage rapide et ferme. Il est normal de voir de plus grosses gouttelettes de liquide dans la fine brume. Cependant, si SYNAREL sort de la pompe sous la forme d'un mince filet de liquide au lieu d'une fine brume, SYNAREL peut ne pas fonctionner aussi bien, et vous devriez en parler à votre pharmacien.
· Assurez-vous de nettoyer l’embout après l’amorçage (au moment de la première utilisation). L’embout de pulvérisation doit être ensuite nettoyé avant et après chaque utilisation. Ne pas le faire peut entraîner l’obstruction de l’embout ce qui peut vous empêcher de prendre la bonne dose prescrite de médicament. Toujours remettre le clip de sécurité et le capuchon protecteur en plastique sur la partie nasale après utilisation pour éviter que la pointe ne soit obstruée.
· La pompe est conçue pour seulement administrer une quantité déterminée de médicament, quelle que soit la puissance de pompage.
· N'essayez pas d'agrandir le petit orifice de l’embout. Si le trou est plus grand, la pompe délivrera une dose incorrecte de SYNAREL.
MODE D'EMPLOI
AVANT LA PREMIERE UTILISATION : AMORCAGE DE LA POMPE
|
|
1. Retirez et mettez de côté le capuchon protecteur, puis le clip de sécurité (schéma 2). Le clip de sécurité puis le capuchon seront remis en place après chaque utilisation. |
|
|
2. Tenez le flacon en position verticale loin de vous avec deux doigts sur la bague de chaque côté de l'embout et le pouce sur le fond du flacon (schéma 3). 3. Pour amorcer la pompe, actionnez le mécanisme de pulvérisation en exerçant plusieurs pressions rapides et fermes, jusqu'à ce qu'une première pulvérisation apparaisse (schéma 3). |
|
4. Nettoyer l’extrémité de la pompe après l’amorçage. Tenez le flacon en position horizontale et rincez l’embout avec un filet d’eau chaude, tout en frottant avec votre doigt ou avec un tissu doux et propre durant 15 secondes. Ne pas nettoyer l’embout du flacon pulvérisateur avec un objet pointu. Cela aurait pour conséquence de délivrer une dose incorrecte. Ne retirez pas la pompe du flacon, car cela expulserait la pression d’amorçage. Essuyez ensuite l’embout avec un chiffon ou un tissu doux et propre. |
|
|
Le flacon est alors prêt à l'emploi. |
|
|
Cette opération d'amorçage de la pompe n'est à réaliser que lors de la première utilisation. Vous gaspillerez votre médicament si vous effectuez cette opération d’amorçage à chaque fois que vous l’utilisez. |
INSTRUCTIONS D'UTILISATION
|
|
1. Effectuez un nettoyage soigneux du nez ; le mouchage facilitera en effet l'absorption du produit pulvérisé (schéma 4). Si vous avez un rhume (ou une rhinite), continuez votre traitement : il n'y a aucune contre-indication. En revanche, si votre médecin vous a prescrit un décongestionnant intranasal, faites votre pulvérisation de SYNAREL au moins 30 minutes avant l'utilisation du décongestionnant. |
|
|
2. Retirez et mettez de côté le capuchon protecteur, puis le clip de sécurité (schéma 2). 3. Nettoyez l’extrémité de l’embout. Tenez le flacon en position horizontale et rincez l’embout sous un filet d’eau chaude (schéma 8), tout en le frottant légèrement avec votre doigt ou avec un tissu doux et propre durant 15 secondes. IMPORTANT : Ne pas nettoyer l’embout du flacon pulvérisateur avec un objet pointu. Ceci pourrait l’endommager et cela aurait pour conséquence de délivrer une dose incorrecte. Ne jamais essayer de démonter la pompe : votre flacon serait alors inutilisable. Essuyez ensuite l’embout avec un chiffon ou un tissu doux et propre. 4. Placez vos doigts comme indiqué précédemment (schéma 3). 5. Penchez légèrement la tête en avant. Introduisez l'embout vers l'arrière du nez en veillant à ce que le flacon reste bien en position verticale (schéma 5).
|
|
|
6. Fermez l'autre narine avec le doigt. Tout en inspirant doucement, exercez une seule pression ferme et rapide sur le fond du flacon (schéma 6). Après la pulvérisation, retirez l'embout et penchez légèrement la tête en arrière de manière à assurer une bonne répartition du produit vers l'arrière du nez. |
|
|
7. Nettoyer l’extrémité de l’embout. Tenez le flacon en position horizontale et rincez l’embout sous un filet d’eau chaude (schéma 8), tout en frottant légèrement avec votre doigt ou avec un tissu doux et propre durant 15 secondes. IMPORTANT Ne pas nettoyer l'embout du flacon pulvérisateur avec un objet pointu. Ceci pourrait l'endommager et cela aurait pour conséquence de délivrer une dose incorrecte. Ne jamais essayer de démonter la pompe : votre flacon serait alors inutilisable. Essuyer ensuite l’embout avec un chiffon ou un tissu doux et propre. Le nettoyage de l’embout avant et après chaque utilisation est important pour éviter son encrassement, cela aurait pour conséquence de délivrer une dose incorrecte du produit. 8. Apres utilisation, essuyer l’embout, remettez le clip de sécurité puis le capuchon protecteur à fond (schéma 7). Ceci est important car cela permet d’éviter que l’embout ne soit obstrué. |
CALENDRIER
Il est important de respecter les doses prescrites par votre médecin, et ne pas oublier une prise.
Pour éviter tout oubli, vous pouvez noter au jour le jour chaque pulvérisation.
Date de la 1ère utilisation : .........................
Durée du traitement
Endométriose : 6 mois maximum.
Stérilité : suivre la prescription médicale.
Si vous avez utilisé plus de SYNAREL 0,2 mg/dose, solution pour pulvérisation nasale que vous n’auriez dû
Consultez immédiatement votre médecin ou votre pharmacien.
Si vous oubliez d'utiliser SYNAREL 0,2 mg/dose, solution pour pulvérisation nasale :
N'oubliez aucune pulvérisation
Le traitement par SYNAREL ne doit pas être interrompu. Aucune pulvérisation ne doit être oubliée pendant la durée du traitement. En cas d'oubli d'une dose, contactez immédiatement votre médecin.
Pour éviter tout oubli, se reporter à la fin du chapitre « Mode et voie d'administration » un calendrier sur lequel vous pourrez noter chaque jour, la prise de chaque dose.
Notez la date de la première utilisation du flacon.
Si vous arrêtez d’utiliser SYNAREL 0,2 mg/dose, solution pour pulvérisation nasale :
Sans objet.
Si vous avez d’autres questions sur l’utilisation de ce médicament, demandez plus d’informations à votre médecin, à votre pharmacien ou à votre infirmier/ère.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
· liés à l'effet du médicament peuvent survenir :
o des réactions allergiques telles que douleur au niveau de la poitrine, démangeaisons, rougeur, éruption, gêne respiratoire, rhinite ;
o des bouffées de chaleur, des œdèmes de la muqueuse nasale, une apparition anormale de poils, une modification du poids, de l’acné, un aspect gras de la peau ou du cuir chevelu ;
o une modification de la libido, une instabilité émotionnelle, une dépression, une insomnie ;
o des maux de tête, des sensations de fourmillement,
o une modification de la tension artérielle ;
o des douleurs musculaires et articulaires ;
o une sécheresse vaginale, des saignements vaginaux, une diminution du volume des seins, une disparition des règles en cas de traitement chronique, une augmentation anormale du volume des ovaires appelée syndrome d’hyperstimulation ovarienne ;
o l'association avec les gonadotrophines (traitement pour induire l'ovulation) peut entraîner des douleurs pelviennes et/ou abdominales ;
o dans le cas de l’utilisation de SYNAREL pour le traitement de l’endométriose, une aggravation des symptômes liés à cette maladie peut survenir en début de traitement.
o l'utilisation prolongée de ce médicament pourrait entraîner une diminution de la masse osseuse et un risque d'ostéoporose ;
· liés à la voie d'administration du produit : irritation de la muqueuse nasale.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, votre pharmacien ou votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER SYNAREL 0,2 mg/dose, solution pour pulvérisation nasale ?
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur le flacon. La date de péremption fait référence au dernier jour de ce mois.
A conserver à une température ne dépassant pas 25 °C et à l'abri de la lumière et de l'humidité.
Ne jetez aucun médicament au tout-à-l'égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l'environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient SYNAREL 0,2 mg/dose, solution pour pulvérisation nasale
· La substance active est : acétate de nafaréline
Quantité correspondant à nafaréline base ..........................................................................0,20* mg
Pour une dose*.
*Une dose correspond à 0,100 ml ± 0,02 ml contenant 0,160 mg à 0,240 mg de nafaréline base.
· Les autres composants sont :
Sorbitol, acide acétique glacial, hydroxyde de sodium et/ou acide chlorhydrique (pour ajuster le pH), eau purifiée.
Excipient à effet notoire : chlorure de benzalkonium (voir rubrique 2 « SYNAREL 0,2 mg/dose, solution pour pulvérisation nasale contient du chlorure de benzalkonium »).
Ce médicament se présente sous forme d'une solution pour pulvérisation nasale soit en flacon de verre de 8 ml (60 doses), soit en en flacon pulvérisateur polyéthylène de 10 ml (60 doses). Boîte de 1.
Toutes les présentations peuvent ne pas être commercialisées.
Titulaire de l’autorisation de mise sur le marché
23-25 AVENUE DU DOCTEUR LANNELONGUE
75014 PARIS
Exploitant de l’autorisation de mise sur le marché
23-25 AVENUE DU DOCTEUR LANNELONGUE
75014 PARIS
USINE DU PETIT PARIS
91731 BRETIGNY-SUR-ORGE CEDEX
FRANCE
OU
PFIZER SERVICE COMPANY BV
HERMESLAAN 11
1932 ZAVENTEM
BELGIQUE
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Sans objet.
La dernière date à laquelle cette notice a été révisée est :
A compléter ultérieurement par le titulaire.
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).