Dernière mise à jour le 06/11/2025
ALYOSTAL VENIN DE GUEPE VESPULA 550 microgrammes, poudre et solvant pour solution injectable
Indications thérapeutiques
Classe pharmacothérapeutique : allergènes - code ATC : V01AA07
Ce médicament est utilisé chez les adultes, adolescents et enfants de plus de 2 ans pour :
· le diagnostic cutané de l'allergie au venin de guêpe,
· le traitement de l’allergie aux piqûres (venin) de guêpe (immunothérapie allergénique).
L'utilisation de ALYOSTAL VENIN DE GUEPE Vespula spp. 550 microgrammes doit être supervisée par un médecin expérimenté en allergologie et dans le traitement de l'allergie par immunothérapie allergénique sous surveillance stricte en milieu hospitalier.
Présentations
> 1 flacon(s) en verre - 1 flacon(s) en verre de 6 ml
Code CIP : 332 827-3 ou 34009 332 827 3 8
Déclaration de commercialisation : 19/12/1991
Cette présentation est agréée aux collectivités
Service médical rendu (SMR)
Pas de SMR disponible pour ce médicament ( plus d'informations dans l'aide )
Amélioration du service médical rendu (ASMR)
Pas d'ASMR disponible pour ce médicament (plus d'informations dans l'aide )
Autres informations
- Titulaire de l'autorisation : STALLERGENES
- Conditions de prescription et de délivrance :
- liste I
- réservé à l'usage HOSPITALIER
- Statut de l'autorisation : Valide
- Type de procédure : Procédure nationale
- Code CIS : 6 393 331 9
ANSM - Mis à jour le : 28/10/2018
ALYOSTAL VENIN DE GUÊPE Vespula spp. 550 microgrammes, poudre et solvant pour solution injectable
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Venin de guêpe quantité correspondant en protéines à 550 microgrammes pour un flacon de poudre.
Chaque flacon contient 100 µg/ml de venin après reconstitution de la solution avec 5,5 ml de solvant.
Excipient(s) à effet notoire : chlorure de sodium
Pour la liste complète des excipients, voir rubrique 6.1.
Poudre et solvant pour solution injectable.
4.1. Indications thérapeutiques
ALYOSTAL VENIN DE GUÊPE Vespula spp. est utilisé pour :
· le diagnostic de l'hypersensibilité au venin de guêpe.
· le traitement par immunothérapie allergénique des sujets allergiques au venin de guêpe.
L’indication repose sur l'association des tests diagnostiques positifs et d'un historique de réactions systémiques sévères.
ALYOSTAL VENIN DE GUÊPE Vespula spp. est indiqué chez les adultes, adolescents et enfants de plus de 2 ans. Le bénéfice/risque de l’immunothérapie allergénique doit être soigneusement évalué avant de l'initier chez les enfants de 2 à 5 ans (voir rubrique 4.2).
4.2. Posologie et mode d'administration
L'utilisation d'ALYOSTAL VENIN DE GUÊPE Vespula spp. 550 microgrammes doit être supervisée par un médecin expérimenté en allergologie et dans l'immunothérapie allergénique sous surveillance stricte en milieu hospitalier.
Reconstitution de la solution et dilutions
La solution est reconstituée en ajoutant 5,5 ml de solvant au contenu d'un flacon de poudre.
La concentration ainsi obtenue dans le flacon est de 100 µg/ml.
Pour obtenir une concentration 10 fois plus faible (10 µg/ml), prélever un volume de 0,5 ml de la solution reconstituée et l’injecter dans le flacon contenant 4,5 ml de solvant. Cette opération sera renouvelée pour obtenir des dilutions successives au 1/10. Des flacons supplémentaires de solvant sont fournis si besoin séparément en fonction des dilutions utilisées.
Pour les instructions concernant la reconstitution et le schéma de dilution du médicament avant administration, voir la rubrique 6.6.
Posologie et mode d’administration
Utilisation pour le test diagnostique
. Prick-test : la concentration usuelle utilisée est de 100 µg/ml.
. Test par intradermoréaction : le test sera réalisé en injectant 0,05 ml d’une solution de venin diluée à 0,001 µg/ml par voie intradermique. En cas de réponse négative, répéter l’injection en utilisant une concentration 10 fois plus élevée et ceci jusqu’à obtention d’une réaction cutanée positive, sans dépasser une concentration maximale de 1 µg/ml. Dans certains cas, notamment pour des patients particulièrement sensibilisés au venin de guêpe, il est prudent de démarrer les tests à la concentration de 0,0001 µg/ml.
Le patient sera gardé sous surveillance médicale pendant au moins 30 minutes après un test diagnostique.
Les recommandations internationales préconisent de réaliser le test diagnostique au moins 2 semaines après la réaction à une piqûre afin d’éviter la possibilité d’un faux-négatif durant la période réfractaire. Néanmoins, la période réfractaire peut être plus longue. Par conséquent, si le test est négatif à la suite d’une réaction systémique consécutive à une piqûre de guêpe, il est préférable de répéter le test après 1 à 2 mois.
Utilisation pour l’immunothérapie allergénique
Voie sous cutanée stricte.
Ne PAS injecter par voie intraveineuse.
Le produit sera injecté lentement par voie sous-cutanée sur la face externe du bras ou dans la région deltoïdienne, en prenant soin de ne pas faire une injection intra-veineuse (procéder à cet effet à une légère aspiration préalable qui peut être renouvelée tous les 0,5 ml au cours de l'injection lente).
Avant chaque injection, vérifier soigneusement la nature de l’allergène utilisé, le dosage, le volume et la date de l'injection précédente (intervalle entre chaque injection).
Le patient doit être gardé sous surveillance médicale pendant au minimum 30 minutes après chaque injection.
Avertir le patient qu'il doit éviter les efforts physiques, les bains chauds, les repas copieux ou la prise d’alcool le jour de l'injection.
La conduite de l’immunothérapie allergénique doit être régulièrement inscrite sur le carnet de suivi que doit conserver le patient.
Schémas posologiques :
L'immunothérapie allergénique par ALYOSTAL VENIN DE GUÊPE Vespula spp. comprend une phase d'initiation (augmentation progressive de doses) suivie d'une phase d'entretien.
a. Phase d'initiation du traitement
Le protocole pour atteindre la dose d'entretien sera adapté par un médecin expérimenté en allergologie, en fonction de l'état clinique et de la tolérance du patient. La progression des doses, le volume du produit injecté ainsi que la fréquence des injections sont fonction de la réactivité propre de chaque individu en tenant compte du fait que le risque de survenue d'effets indésirables systémiques est moins important avec une lente progression de doses.
Quel que soit le protocole d'ascension de dose utilisé, l’initiation du traitement doit être réalisée sous surveillance stricte en milieu hospitalier.
Les délais pour atteindre la dose d’entretien sont fonction de la méthode utilisée :
- en quelques heures (Ultrarush) ou quelques jours (Rush),
- en quelques semaines: schéma dit "cluster" ou méthode conventionnelle.
Les schémas de progression de doses suivants sont issus de la littérature et ne sont proposés qu'à titre indicatif :
|
PROTOCOLES |
|||||
|
|
ULTRA-RUSH |
RUSH |
CLUSTER |
CONVENTIONNEL |
|
|
Jour |
Heure |
Dose en µg de venin |
|||
|
J 1 |
0 0.5 1 1.5 2.5 3.5 |
0.1 1 10 20 30 40 |
0.01 0.1 1
2
|
0.001 0.01 1
|
0.01 0.1
|
|
J 2 |
0 1 2 3 |
|
4 8 10 20 |
|
|
|
J 3 |
0 1 2 |
|
40 60 80 |
|
|
|
J 4 |
0 |
|
100 |
|
|
|
J 8 |
0 |
|
100 |
1 5 10 |
1 2
|
|
1 |
|
||||
|
2 |
|||||
|
J 15 |
0 1 |
50 50 |
100 |
20 30 |
4 8 |
|
|
|||||
|
J 22 |
0 1 |
|
|
50 50 |
10 20 |
|
J 29 |
|
|
100 |
100 |
40 |
|
J 36 |
|
|
|
100 |
60 |
|
J 43 ou J 45 |
|
100 |
100 |
|
80 |
|
J 50 |
|
|
|
|
100 |
|
J 57 |
|
|
|
|
100 |
|
J 64 |
|
|
|
100 |
|
|
J 71 ou J 75 |
|
100 |
100 |
|
100 |
|
J 85 |
|
|
|
|
100 |
|
J 92 |
|
|
|
100 |
|
|
J 99 ou J 105 |
|
100 |
100 |
|
|
|
J 106 |
|
|
|
|
100 |
b. Phase de traitement d'entretien :
La dose d’entretien préconisée est de 100 µg d’extrait de venin. Elle peut être augmentée à 200 μg pour des patients insuffisamment protégés par 100 µg. Elle peut être inférieure en fonction de la tolérance du patient.
La dose d’entretien est injectée toutes les 4 semaines au cours de la première année et toutes les 4 à 6 semaines les années suivantes.
L’immunothérapie allergénique peut être poursuivie pendant 3 à 5 ans, ou plus longtemps dans certains cas.
Interruption de traitement ou dépassement des délais recommandés entre 2 injections (sans lien avec la survenue d'effets secondaires) :
L’immunothérapie allergénique nécessite le strict respect du protocole.
En cas d’interruption du traitement, il n’est pas défini de protocole précis pour la reprise du traitement.
Le médecin prescripteur adaptera les modalités de reprise du traitement en fonction de chaque cas clinique et de la durée écoulée depuis la dernière injection. Une phase de reprise progressive peut être nécessaire pour revenir à la dose d’entretien.
Une surveillance stricte en milieu hospitalier est requise lors de la reprise du traitement.
Adaptation de la dose en cas de survenue d'effets indésirables :
En cas d’effets indésirables graves, il convient de réévaluer le schéma thérapeutique et la poursuite éventuelle du traitement.
En cas d'apparition d'une réaction locale au point d'injection, le schéma de diminution de doses ci-après est proposé à titre indicatif :
|
Diminution de la dose préconisée en cas d’effet indésirable local : diamètre maximum de la papule |
||
|
Enfants Adolescents |
Adultes |
Diminution de la dose recommandée |
|
< 5 cm |
< 8 cm |
Continuer le traitement normalement selon le protocole |
|
5 – 7 cm |
8 – 12 cm |
Répéter la dernière dose injectée |
|
7 – 12 cm |
12 – 20 cm |
Réduire la dose à la dose précédant celle-ci |
|
12 – 17 cm |
> 20 cm |
Réduire la dose à la 2ème dose précédant celle-ci |
|
> 17 cm |
|
Réduire la dose à la 3ème dose précédant celle-ci |
Ces réactions locales au point d'injection sont fréquentes mais elles ne sont pas prédictives d’une réaction générale. Un traitement anti-histaminique pris quelques heures avant l’injection peut aider à réduire leur apparition.
Il est recommandé de remonter les doses ensuite et de se rapprocher de la dose thérapeutique.
Population pédiatrique
Les schémas de traitement préconisés sont identiques chez les adultes, adolescents et enfants de plus de 2 ans.
Peu de données sont disponibles chez les enfants de moins de 5 ans.
Le rapport bénéfice/risque devra être soigneusement évalué avant d'initier une immunothérapie au venin de guêpe chez un enfant de 2 à 5 ans.
L'immunothérapie allergénique est contre-indiquée chez les enfants de moins de 2 ans (voir rubrique 4.3.).
Précautions à prendre pour la préparation, la manipulation et l’administration du médicament
- Nettoyer le bouchon perforable du flacon à l’alcool à 70°.
- Utiliser une seringue de 1 ml graduée au 1/100e avec une aiguille de 15-5/10e (seringue de type tuberculinique).
- Vérifier la concentration de la solution préparée dans le flacon avant usage.
- Agiter le flacon pour homogénéiser la dose à injecter.
- Prélever la solution au travers du bouchon du flacon, en mesurant avec précision la dose à injecter.
- Désinfecter la peau avant l'injection (alcool à 70 °).
· Hypersensibilité à l’un des excipients mentionnés à la rubrique 6.1,
· Réactions inhabituelles (rénales, musculaires, cutanées, neurologiques, hématologiques et articulaires) après piqûre d'hyménoptères,
· Maladies auto-immunes évolutives,
· Asthme non contrôlé ou sévère (VEMS<70% de la valeur théorique),
· Enfants âgés de moins de 2 ans.
4.4. Mises en garde spéciales et précautions d'emploi
Pour les patients ayant un facteur de risque associé en cas de piqûre d'hyménoptères ou dont la qualité de vie est gravement altérée par la crainte d’être piqués par une guêpe le recours à l’immunothérapie peut toutefois être envisagé si les tests diagnostiques de dosage des IgE sont positifs.
Risque d'effets systémiques sévères :
Du fait du risque de réactions allergiques systémiques sévères pouvant mettre en jeu le pronostic vital, toute injection de ce médicament doit être réalisée sous la responsabilité d’un médecin expérimenté en immunothérapie allergénique et dans des conditions permettant la mise en place d’un traitement d’urgence (comprenant de l’adrénaline injectable pour la prise en charge d’un éventuel choc anaphylactique). Les patients doivent être informés des signes et symptômes associés nécessitant un avis médical immédiat. En cas de survenue de réaction systémique, la poursuite de l’immunothérapie allergénique devra être réévaluée par le médecin.
Patients asthmatiques :
Comme pour tout traitement d’immunothérapie allergénique, il est nécessaire de vérifier, avant chaque injection, que l’asthme est bien contrôlé.
En cas d’aggravation récente de l’asthme, appréciée par la clinique et/ou la mesure du Débit Expiratoire de Pointe (DEP) et/ou du Volume Expiratoire Mesuré durant la première Seconde (VEMS), le traitement doit être suspendu. Il ne sera repris qu’après amélioration et avis du médecin prescripteur.
Surveillance des patients à risques cardiovasculaire ou broncho-pulmonaire :
Du fait du risque majoré en cas de survenue de réaction généralisée à l’injection, l’immunothérapie allergénique devra être réalisée sous surveillance stricte en milieu hospitalier chez les patients ayant des facteurs de risque associés tels que les pathologies cardiovasculaires et/ou broncho-pulmonaires.
Mastocytose :
Le risque de survenue de réactions systémiques sévères est augmenté chez les patients présentant une mastocytose et/ou une tryptasémie élevée > 20 ng/ml. En outre, l'efficacité de l'immunothérapie allergénique peut être amoindrie dans ces situations comparativement à la population générale allergique. L'immunothérapie allergénique chez ces patients devra être réalisée sous surveillance stricte en milieu hospitalier.
Traitements concomitants :
Antidépresseurs tricycliques et inhibiteurs de la monoamine oxydase (IMAO):
En cas de réactions allergiques sévères, l’utilisation d’adrénaline peut être nécessaire. Chez les patients traités par des antidépresseurs tricycliques ou par les inhibiteurs de la mono-amine oxydase (IMAO), le risque d’effets indésirables liés à l’adrénaline peut être augmenté jusqu’à mettre en jeu le pronostic vital. Ce risque devra être pris en considération avant de commencer une immunothérapie allergénique.
Bêta-bloquants :
Les bêta-bloquants (y compris en collyre) interagissent avec l'adrénaline et son utilisation peut se révéler moins efficace lors du traitement des possibles réactions anaphylactiques. Ce risque devrait être évalué avant d'initier l'immunothérapie allergénique.
Inhibiteurs de l'enzyme de conversion (IEC):
Les inhibiteurs de l’enzyme de conversion (IEC) ont été associés à un risque accru de réactions graves lors de piqûres ou de traitement d’immunothérapie aux venins d'hyménoptères. L’éventualité d’un arrêt du traitement par des IEC lors d’une immunothérapie allergénique aux venins d'hyménoptères doit être considérée. L'administration concomitante d'une immunothérapie aux venins et d'un IEC peut être justifiée dans les cas pour lesquels aucune alternative efficace aux IEC n’existe et qu’elle est jugée favorable d'un point de vue bénéfice/risque individuel.
En cas de nécessité absolue de maintien de ces traitements chez des patients chez qui une immunothérapie allergénique par venins d’hyménoptères est envisagée, le rapport bénéfice/risque de l’indication d’immunothérapie allergénique devra être soigneusement évalué et le traitement ne pourra être réalisé que sous surveillance stricte en milieu hospitalier.
Maladies néoplasiques, déficit immunitaire et maladie auto-immune en rémission :
En l'état actuel des connaissances les effets d'une immunothérapie allergénique chez les sujets ayant un cancer ou présentant un déficit immunitaire acquis ne sont pas clairement documentés. De plus, la prudence est requise lors de la prescription d’une immunothérapie allergénique chez les sujets présentant une maladie auto-immune en rémission.
Par conséquent, le rapport bénéfice/risque de l'indication d'une immunothérapie allergénique devra être soigneusement pesé dans ces situations.
Excipients:
Ce médicament contient du sodium. Le taux de sodium est inférieur à 1 mmol par dose, ce qui correspond à une quantité négligeable de sodium.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Médicaments interférant lors de l'utilisation en test diagnostique
Certains médicaments inhibent la réactivité cutanée. Il convient donc de respecter un délai entre la prise de tels médicaments et la réalisation des tests cutanés. Cette précaution concerne les antihistaminiques H1 par voie orale, ainsi que d'autres médicaments qui ne sont pas destinés au traitement de l’allergie, tels que les anxiolytiques. Les dermocorticoïdes peuvent modifier la réactivité cutanée.
Délai à respecter entre la dernière prise de certains médicaments et la réalisation d'un test diagnostic cutané :
|
Traitement |
Impact sur la réactivité cutanée |
Impact sur la lecture du test cutané |
Délai à respecter entre la prise du traitement et la réalisation du test cutané |
|
Antihistaminiques H1 par voie orale |
++++ |
Oui |
2 à 7 jours |
|
Antihistaminiques par voie intranasale : Antihistaminiques H1 Antihistaminiques H2 |
0 à + |
Aucun Aucun |
|
|
Imipramines |
++++ |
Oui |
21 jours |
|
Phénothiazines |
0 à ++ |
Oui |
10 jours |
|
Corticostéroïdes systémiques – courte durée systémiques – longue durée inhalés topiques |
0 Possible 0 + à ++ |
Aucun Aucun Aucun Oui |
7 jours |
|
Dopamine |
+ |
Aucun |
|
|
Clonidine |
++ |
Aucun |
|
|
Montelukast |
0 |
Aucun |
|
|
Immunothérapie allergénique |
0 à ++ |
Aucun |
|
|
Traitement systémique par lumière UV dépendant de la source lumineuse, plus intense avec PUVA |
+++ |
Oui |
4 semaines |
Utilisation pour l’immunothérapie allergénique
Aucune étude spécifique d’interactions médicamenteuses ou autre n’a été réalisée.
Mises en garde et précautions d'emploi concernant les traitements concomitants : voir rubrique 4.4.
4.6. Fertilité, grossesse et allaitement
Grossesse
Aucune étude de reproduction n’a été conduite chez l’animal avec ALYOSTAL VENIN DE GUÊPE Vespula spp.
Il n’existe pas d'étude épidémiologique de l’utilisation d’ALYOSTAL VENIN DE GUÊPE Vespula spp. chez la femme enceinte.
La pratique des tests de diagnostic cutanés avec ALYOSTAL VENIN DE GUÊPE Vespula spp n’est pas recommandée pendant la grossesse afin de ne pas exposer la femme enceinte à un risque de réaction allergique générale.
Dans tous les cas, l’immunothérapie allergénique ne doit pas être initiée pendant la grossesse. Généralement, la survenue d’une grossesse pendant l’immunothérapie allergénique n’impose pas l’arrêt du traitement s'il est bien toléré. Néanmoins, le risque de réaction allergique systémique (choc anaphylactique) ne pouvant être exclu y compris en phase d’entretien, le médecin évaluera le bien-fondé de la poursuite de l’immunothérapie allergénique pendant la grossesse.
Il n’existe pas de données sur le passage d’ALYOSTAL VENIN DE GUÊPE Vespula spp. dans le lait maternel.
Aucune étude n'a été menée chez l'animal pour étudier le passage d’ALYOSTAL VENIN DE GUÊPE Vespula spp. dans le lait maternel.
Le médecin évaluera s'il y a lieu ou non d’interrompre le traitement avec ALYOSTAL VENIN DE GUÊPE Vespula spp. au regard du bénéfice du traitement pour la mère.
Fertilité
Il n'a pas été conduit d'étude sur la fertilité avec ALYOSTAL VENIN DE GUÊPE Vespula spp.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
ALYOSTAL VENIN DE GUÊPE Vespula spp. n’a aucun effet connu sur l’aptitude à conduire des véhicules et à utiliser des machines.
Le traitement par ALYOSTAL VENIN DE GUÊPE Vespula spp. peut provoquer des réactions allergiques locales au site d’injection et/ou des réactions systémiques. Des cas de choc anaphylactique avec collapsus cardiovasculaire brutal nécessitant l’administration immédiate d’adrénaline ont été rapportés.
La tolérance d’une dose est susceptible de varier dans le temps en fonction de la réactivité spécifique de l’individu et de son environnement.
Depuis la mise sur le marché, les effets indésirables suivants ont été observés :
|
Classe de systèmes d’organes |
Fréquence |
Effets indésirables |
|
Troubles généraux et anomalies au site d’administration |
Indéterminée |
Œdème, malaise général, asthénie Au point d’injection : rougeur, douleur, œdème et prurit |
|
Troubles cutanés et du tissu sous-cutané |
Indéterminée |
Erythème, prurit, urticaire |
|
Troubles respiratoires, thoraciques et médiastinaux |
Indéterminée |
Crise d’asthme, toux, dyspnée |
|
Troubles du système immunitaire |
Indéterminée |
Choc anaphylactique |
|
Troubles digestifs |
Indéterminée |
Douleurs abdominales, dyspepsie et nausée |
Population pédiatrique
Le profil de tolérance observé chez l’enfant de plus de 5 ans et l’adolescent est identique à celui de l’adulte. Les données concernant les enfants de 2 à 5 ans sont limitées.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : www.ansm.sante.fr.
Symptômes
Si une dose supérieure à la dose prescrite a été injectée, le risque et la gravité d’effets indésirables augmentent avec possibilité de réactions allergiques locales ou systémiques graves.
Voir effets indésirables en 4.8.
Conduite à tenir :
Le traitement doit être adapté à l'état clinique du patient. Le patient devra rester sous surveillance médicale jusqu’à résolution complète des symptômes.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : ALLERGENES, code ATC : V01AA07
Mécanisme d’action
Le mécanisme d’action des extraits allergéniques administrés dans le cadre d'une d’immunothérapie allergénique n’est pas parfaitement connu.
L'immunothérapie allergénique induit des changements de réponses des lymphocytes T, suivis d'une augmentation des taux d'IgG4 et/ou d'IgG1 et parfois d'IgA spécifiques des allergènes, et une diminution des taux d'IgE spécifiques. Une autre réponse, probablement plus tardive, du système immunitaire, consisterait en une réorientation de la réponse lymphocytaire T.
5.2. Propriétés pharmacocinétiques
Aucune donnée de pharmacocinétique n’est disponible après administration d’ALYOSTAL VENIN DE GUÊPE Vespula spp. chez l’homme et l’animal.
5.3. Données de sécurité préclinique
Aucune étude long terme chez l’animal n’a été réalisée avec ALYOSTAL VENIN DE GUÊPE Vespula spp. pour déterminer son potentiel cancérigène ou d’altération de la fertilité.
Mannitol, albumine humaine
Solvant :
Chlorure de sodium, phénol, eau pour préparations injectables
3 ans.
Après reconstitution et dilution, les durées maximales de conservation varient selon la concentration des solutions
|
Concentration (µg/ml) |
Durée maximale de conservation |
|
100 |
28 jours |
|
inférieure à 100 |
A préparer et utiliser le jour même |
6.4. Précautions particulières de conservation
Pour les conditions de conservation du médicament après reconstitution et dilution, voir la rubrique 6.3.
6.5. Nature et contenu de l'emballage extérieur
Poudre en flacon (verre) + 6 ml de solvant en flacon (verre) muni d’un bouchon (chlorobutyle) – boite de 1..
6.6. Précautions particulières d’élimination et de manipulation
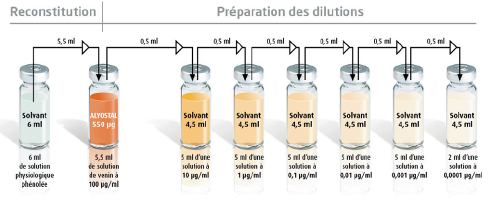
Les schémas de reconstitution et de dilution sont présentés ci-dessous :
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
6 RUE ALEXIS DE TOCQUEVILLE
92160 ANTONY
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 332 827-3 / 3400933282738: 1 flacon de poudre + 1 flacon de solvant (6 ml)
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
10. DATE DE MISE A JOUR DU TEXTE
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Liste I
Médicament réservé à l’usage hospitalier.
ANSM - Mis à jour le : 28/10/2018
ALYOSTAL VENIN DE GUÊPE Vespula spp. 550 microgrammes, poudre et solvant pour solution injectable
Venin de guêpe
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin ou votre pharmacien.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, qu'il soit mentionné ou non dans cettenotice, parlez-en à votre médecin ou votre pharmacien. Voir rubrique 4.
1. Qu'est-ce que ALYOSTAL VENIN DE GUÊPE Vespula spp.550 microgrammes, poudre et solvant pour solution injectable et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d'utiliser ALYOSTAL VENIN DE GUÊPE Vespula spp. 550 microgrammes, poudre et solvant pour solution injectable ?
3. Comment utiliser ALYOSTAL VENIN DE GUÊPE Vespula spp. 550 microgrammes, poudre et solvant pour solution injectable ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver ALYOSTAL VENIN DE GUÊPE Vespula spp. 550 microgrammes, poudre et solvant pour solution injectable ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE ALYOSTAL VENIN DE GUÊPE Vespula spp. 550 microgrammes, poudre et solvant pour solution injectable ET DANS QUELS CAS EST-IL UTILISE ?
Classe pharmacothérapeutique : allergènes - code ATC : V01AA07
Ce médicament est utilisé chez les adultes, adolescents et enfants de plus de 2 ans pour :
· le diagnostic cutané de l'allergie au venin de guêpe,
· le traitement de l’allergie aux piqûres (venin) de guêpe (immunothérapie allergénique).
L'utilisation de ALYOSTAL VENIN DE GUEPE Vespula spp. 550 microgrammes doit être supervisée par un médecin expérimenté en allergologie et dans le traitement de l'allergie par immunothérapie allergénique sous surveillance stricte en milieu hospitalier.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER ALYOSTAL VENIN DE GUÊPE Vespula spp. 550 microgrammes, poudre et solvant pour solution injectable ?
N’utilisez jamais ALYOSTAL VENIN DE GUÊPE Vespula spp. 550 microgrammes, poudre et solvant pour solution injectable :
· si vous êtes allergique à l’un des composants contenus dans ce médicament, en dehors du venin de guêpe, mentionnés dans la rubrique 6,
· si en plus de la réaction allergique, vous avez eu des réactions inhabituelles rénales, musculaires, cutanées, neurologiques, hématologiques et articulaires lorsque vous avez été piqué par une guêpe,
· si vous avez une maladie immunitaire (maladie chronique auto-immune) telles que vascularite systémique, périartérite noueuse ou autre...
· si vous avez un asthme et que les symptômes respiratoires ne sont pas suffisamment contrôlés.
Ce médicament est contre-indiqué chez les enfants de moins de 2 ans.
Avertissements et précautions
Adressez-vous à votre médecin ou pharmacien avant d’utiliser ALYOSTAL VENIN DE GUÊPE Vespula spp. 550 microgrammes, poudre et solvant pour solution injectable :
· si vous avez une maladie cardiovasculaire ou bronchopulmonaire,
· si vous avez une mastocytose ou un taux sanguin de tryptase élevé,
· si vous prenez des médicaments pour le traitement de la dépression (anti-dépresseurs tricycliques et inhibiteurs de la monoamine oxydase (IMAO)),
· si vous prenez des médicaments dits "inhibiteurs de l’enzyme de conversion" (IEC) qui sont des médicaments utilisés dans le traitement des problèmes cardiaques ou de l'hypertension artérielle,
· si vous prenez des médicaments dits "bêtabloquants" qui sont des médicaments utilisés pour le traitement de problèmes cardiaques, de l'hypertension artérielle, ou en collyres (goutte pour les yeux) pour le traitement du glaucome,
· si vous avez un cancer ou un déficit immunitaire,
· si vous avez une maladie auto-immune en rémission,
· si vous avez eu récemment une crise d’asthme,
· si votre état de santé s’est dégradé.
Enfants et adolescents
L'immunothérapie allergénique est contre-indiquée chez les enfants de moins de 2 ans.
La décision d'une immunothérapie allergénique chez les enfants de 2 à 5 ans doit faire l'objet d'une attention toute particulière.
En cas de doute, il est indispensable de demander l’avis de votre médecin ou de votre pharmacien.
Autres médicaments et ALYOSTAL VENIN DE GUÊPE Vespula spp. 550 microgrammes, poudre et solvant pour solution injectable
Informez votre médecin ou pharmacien si vous utilisez, avez récemment utilisé ou pourriez utiliser tout autre médicament.
Certains médicaments peuvent altérer les résultats des tests diagnostiques cutanés. Votre médecin peut vous demander d'interrompre certains traitements avant la réalisation de tests cutanés.
ALYOSTAL VENIN DE GUÊPE Vespula spp. 550 microgrammes, poudre et solvant pour solution injectable avec des aliments, boissons et de l’alcool
Les repas copieux et la prise d'alcool sont déconseillés les jours où sont réalisées les injections.
Grossesse, allaitement et fertilité
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou si vous envisagez une grossesse, demandez conseil à votre médecin ou à votre pharmacien avant de commencer l’immunothérapie allergénique avec ALYOSTAL VENIN DE GUÊPE Vespula spp.
Grossesse
Il n’y a pas d’expérience concernant l'utilisation ALYOSTAL VENIN DE GUÊPE Vespula spp. au cours de la grossesse.
La pratique des tests de diagnostic cutanés avec ALYOSTAL VENIN DE GUÊPE Vespula spp. n’est pas recommandée pendant la grossesse.
Un traitement de l’allergie au venin de guêpe avec ALYOSTAL VENIN DE GUÊPE Vespula spp. ne doit pas être débuté en cours de la grossesse.
Un traitement d’entretien déjà en cours et bien toléré peut être poursuivi durant la grossesse.
Si vous constatez que vous êtes enceinte en cours de traitement, demandez l'avis de votre médecin, qui déterminera avec vous si le traitement par ALYOSTAL VENIN DE GUÊPE Vespula spp. peut être poursuivi ou non.
Allaitement
Il n’y a pas d'étude concernant l'utilisation ALYOSTAL VENIN DE GUÊPE Vespula spp. au cours de l'allaitement.
Votre médecin déterminera s'il y a lieu ou pas d'interrompre le traitement pendant l'allaitement.
Fertilité
Il n’y a pas de donnée concernant l'utilisation ALYOSTAL VENIN DE GUÊPE Vespula spp. sur la fertilité.
Les efforts physiques sont déconseillés les jours où sont réalisées les injections.
Conduite de véhicules et utilisation de machines
ALYOSTAL VENIN DE GUÊPE Vespula spp. n’a pas d’effet connu sur l’aptitude à conduire des véhicules et à utiliser des machines.
ALYOSTAL VENIN DE GUÊPE Vespula spp. 550 microgrammes, poudre et solvant pour solution injectable contient du chlorure de sodium
Ce médicament contient du sodium, mais en très faible quantité (1 mmol par dose). Cette quantité de sodium est considérée comme négligeable.
3. COMMENT UTILISER ALYOSTAL VENIN DE GUÊPE Vespula spp. 550 microgrammes, poudre et solvant pour solution injectable ?
Ce médicament doit être utilisé sous la surveillance d'un médecin expérimenté en allergologie et dans le traitement par immunothérapie allergénique sous surveillance stricte en milieu hospitalier.
Préparation du médicament :
La poudre contenue dans le flacon doit être diluée avec le solvant spécifiquement destiné à cet effet. La dilution dépend de l'utilisation du médicament (cf ci-dessous)
Modalités d'administration :
Les modalités d'administration sont fonction de l'utilisation du médicament.
Utilisation en tests cutanés pour le diagnostic de l'allergie :
. "Prick test" : la concentration de la solution utilisée est habituellement de 100 µg/ml
. Intradermoréaction : le test consiste en des injections par voie intradermique de doses progressivement croissantes jusqu'à obtention d'une réaction sur la peau.
Utilisation pour le traitement de l'allergie aux piqûres (venin) de guêpes :
La solution reconstituée est injectée par voie sous cutanée stricte sur la face externe ou postérieure du bras.
Le jour de l'injection, il est recommandé d'éviter les repas copieux, la prise d'alcool, les bains chauds, l'exercice physique.
Les modalités du traitement (dose, fréquence des injections) seront déterminées par votre médecin.
Le suivi du traitement doit être régulièrement inscrit sur un carnet que vous devez conserver et qui doit mentionner la date et la dose injectée.
Le traitement de l’allergie au venin de guêpe comporte deux étapes :
· La phase initiale consiste en des injections permettant une augmentation progressive de la dose administrée pour atteindre la dose d’entretien. Il existe différents schémas d'administration plus ou moins rapide pour cette phase.
Quel que soit le protocole choisi, l'initiation du traitement doit être réalisée sous surveillance médicale stricte en milieu hospitalier.
· La deuxième phase consiste en des injections de cette dose d’entretien, en principe toutes les 4 semaines au cours de la première année puis toutes les 4 à 6 semaines les années suivantes.
Le traitement de l’allergie au venin de guêpe peut être poursuivi au minimum pendant 3 à 5 ans, ou plus longtemps dans certains cas.
Il est impératif que vous restiez sous surveillance médicale pendant au moins 30 minutes après chaque injection.
En cas de survenue de symptômes tels qu'une démangeaison importante au niveau de la paume des mains ou de la plante des pieds, une urticaire, un gonflement de la bouche et/ou de la muqueuse, une sensation d'étouffement, de gêne respiratoire, de difficulté à avaler ou une modification de la voix dans les heures qui suivent l'administration de ce produit, contactez immédiatement un médecin.
En cas de survenue d’une importante réaction locale après une injection du traitement, votre médecin peut être amené à modifier la dose administrée ou à vous prescrire des médicaments antihistaminiques en prévention pour les prochaines injections.
En cas d’effets indésirables graves après une injection, votre médecin peut décider de ne pas poursuivre le traitement.
Si vous interrompez votre traitement ou avez dépassé les délais recommandés entre 2 injections (sans lien avec des effets secondaires) :
· Le traitement de l’allergie au venin de guêpe nécessite le strict respect du protocole. Il est important de respecter le schéma d’injections défini par le médecin et le délai entre deux injections sauf si le traitement est interrompu à la suite d’un effet secondaire.
· En cas d’interruption du traitement, il n’est pas défini de protocole précis pour la reprise du traitement.
Votre médecin prescripteur adaptera avec vous les modalités de reprise des injections en fonction de votre cas et de la durée écoulée depuis la dernière injection. Une phase de reprise progressive peut être nécessaire pour revenir à la dose d'entretien. Une surveillance stricte en milieu hospitalier est requise lors de la reprise du traitement.
Utilisation chez les enfants et les adolescents
Les schémas de traitement préconisés sont identiques chez les adultes, les adolescents et les enfants.
Si vous avez utilisé plus de ALYOSTAL VENIN DE GUÊPE Vespula spp. 550 microgrammes, poudre et solvant pour solution injectable que vous n’auriez dû
Consultez immédiatement votre médecin ou votre pharmacien.
En cas de surdosage le risque d’effets indésirables, en particulier de manifestations généralisées ou locales telles que décrites dans la rubrique 4, est augmenté ; vous devez rester sous surveillance médicale.
Si vous avez d’autres questions sur l’utilisation de ce médicament, demandez plus d’informations à votre médecin ou à votre pharmacien.
Si vous oubliez d’utiliser ALYOSTAL VENIN DE GUÊPE Vespula spp. 550 microgrammes, poudre et solvant pour solution injectable
Si vous arrêtez d’utiliser ALYOSTAL VENIN DE GUÊPE Vespula spp. 550 microgrammes, poudre et solvant pour solution injectable
Sans objet.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Lors d’un traitement par ALYOSTAL VENIN DE GUÊPE Vespula spp., vous êtes exposé à des venins pouvant provoquer des réactions allergiques au site d’injection et/ou généralisées.
La tolérance d’une dose est susceptible de varier dans le temps en fonction de votre réactivité et de votre environnement.
Les effets indésirables suivants ont été observés :
· réactions locales pouvant s’accompagner d’un gonflement, d’une rougeur, d’une démangeaison
· manifestations généralisées: malaise général, démangeaisons, urticaire, crise d’asthme, toux, gêne respiratoire, choc anaphylactique (malaise brutal avec chute de la tension).
· sensation de fatigue importante.
· troubles digestifs : douleurs abdominales, douleurs gastriques et nausée.
Des cas de choc anaphylactique provoquant un malaise général brutal avec chute de la pression artérielle et nécessitant un traitement d’urgence ont été rapportés. Un choc anaphylactique est une réaction allergique sévère avec apparition brutale de symptômes qui affectent l’ensemble de l’organisme tels que des démangeaisons intenses ou éruption cutanée, des difficultés respiratoires, des douleurs abdominales, ou des symptômes liés à une chute de tension comme des vertiges ou des malaises. Contactez immédiatement votre médecin si vous ressentez l’un de ces effets.
Si cela vous arrivait, votre médecin aura à disposition une trousse d’urgence comprenant une seringue d’adrénaline prête à l’emploi. C’est la raison pour laquelle vous devez rester sous surveillance médicale pendant au moins 30 minutes après avoir reçu une injection de ce médicament.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou à votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : www.ansm.sante.fr
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER ALYOSTAL VENIN DE GUÊPE Vespula spp. 550 microgrammes, poudre et solvant pour solution injectable ?
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur le conditionnement extérieur. La date de péremption fait référence au dernier jour de ce mois.
Le produit, avant et après reconstitution, ainsi que les dilutions doivent être conservés au réfrigérateur (entre + 2°C et + 8°C).
Les durées maximales de conservation varient selon la concentration des solutions.
Pour une concentration de 100 µg/ml, la durée maximale de conservation de la solution est de 28 jours entre +2 et +8°C.
Pour une concentration inférieure à 100 µg/ml, la solution doit être préparée et utilisée le jour même.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
· La substance active est :
Venin de guêpe quantité correspondant en protéines à 550 microgrammes pour un flacon de poudre.
Les autres composants sont:
Flacon de poudre : mannitol, albumine humaine
Solvant : chlorure de sodium, phénol, eau pour préparations injectables.
Ce médicament se présente sous forme de poudre et solvant pour solution injectable.
1 flacon de poudre + 1 flacon de solvant (6 ml) - Boîte de 1
Titulaire de l’autorisation de mise sur le marché
6 Rue ALEXIS DE TOCQUEVILLE
92160 ANTONY
FRANCE
Exploitant de l’autorisation de mise sur le marché
STALLERGENES
6 Rue ALEXIS DE TOCQUEVILLE
92160 ANTONY
FRANCE
6 Rue ALEXIS DE TOCQUEVILLE
92160 ANTONY
FRANCE
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Sans objet.
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
Les informations suivantes sont destinées exclusivement aux professionnels de santé :
Reconstitution et dilutions
La solution est reconstituée en ajoutant 5,5 ml de solvant au contenu d'un flacon de poudre.
La concentration ainsi obtenue est de 100 µg/ml.
Pour obtenir une concentration 10 fois plus faible (10 µg/ml), prélever un volume de 0,5 ml de solution reconstituée et l’injecter dans le flacon contenant 4,5 ml de solvant. Cette opération sera renouvelée pour obtenir des dilutions successives au 1/10. Des flacons supplémentaires de solvant sont fournis si besoin séparément en fonction des dilutions utilisées.
Exemple de schéma de dilutions

Utilisation pour le test diagnostique
. Prick-test : la concentration usuelle utilisée est de 100 µg/ml.
. Test par intradermoréaction : le test sera réalisé en injectant 0,05 ml d’une solution de venin diluée à 0,001 µg/ml par voie intradermique. En cas de réponse négative, répéter l’injection en utilisant une concentration 10 fois plus élevée et ceci jusqu’à obtention d’une réaction cutanée positive, sans dépasser une concentration maximale de 1 µg/ml. Dans certains cas, notamment pour des patients particulièrement sensibilisés au venin de guêpe, il est prudent de démarrer les tests à la concentration de 0,0001 µg/ml.
Les recommandations internationales préconisent de réaliser le test diagnostique au moins 2 semaines après la réaction à une piqûre afin d’éviter la possibilité d’un faux-négatif durant la période réfractaire. Néanmoins, la période réfractaire peut être plus longue. Par conséquent, si le test est négatif à la suite d’une réaction systémique consécutive à une piqûre de guêpe, il est préférable de répéter le test après 1 à 2 mois.
Utilisation pour l’immunothérapie allergénique
Voie sous-cutanée stricte.
Ne PAS injecter par voie intraveineuse.
Le produit sera injecté lentement par voie sous-cutanée sur la face externe du bras ou dans la région deltoïdienne, en prenant soin de ne pas faire une injection intra-veineuse (procéder à cet effet à une légère aspiration préalable qui peut être renouvelée tous les 0,5 ml au cours de l'injection lente).
Avant chaque injection, vérifier soigneusement la nature de l’allergène utilisé, le dosage, le volume et la date de l'injection précédente (intervalle entre chaque injection).
Le patient doit être gardé sous surveillance médicale pendant au minimum 30 minutes après chaque injection.
Avertir le patient qu'il doit éviter les efforts physiques, les bains chauds, les repas copieux ou la prise d’alcool le jour de l'injection.
L’initiation du traitement (quel que soit le protocole utilisé) doit être réalisée sous surveillance stricte en milieu hospitalier.
Le protocole utilisé pour atteindre la dose d'entretien doit être adapté par un médecin expérimenté en allergologie, en fonction de l'état clinique et de la tolérance du patient.
Les délais pour atteindre la dose d’entretien sont fonction de la méthode utilisée :
· en quelques heures (Ultrarush) ou quelques jours (Rush),
· en quelques semaines: cluster ou méthode conventionnelle.
La dose d’entretien est de 100 µg d’extrait de venin. Elle peut être augmentée à 200 μg pour des patients insuffisamment protégés par 100 µg.
Carnet de suivi :
La conduite de l’immunothérapie allergénique doit être régulièrement inscrite sur le carnet de suivi que doit conserver le patient