Dernière mise à jour le 01/12/2025
AQUAREST 0,2 %, gel opthalmique en récipient unidose
Indications thérapeutiques
Classe pharmacothérapeutique : Agent ophtalmique, Substitut lacrymal - code ATC : S01XA
Ce médicament est un substitut du fluide lacrymal.
Il est indiqué dans le traitement symptomatique de l’œil sec.
Vous devez vous adresser à votre médecin si vous ne ressentez aucune amélioration ou si vous vous sentez moins bien après 3 jours de traitement.
Présentations
> 60 récipient(s) unidose(s) polyéthylène basse densité (PEBD) de 0,6 g
Code CIP : 391 566-8 ou 34009 391 566 8 2
Déclaration de commercialisation : 31/03/2010
Cette présentation est agréée aux collectivités
- Prix hors honoraire de dispensation : 5,50 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 6,52 €
- Taux de remboursement :65%
Service médical rendu (SMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Important | Avis du 08/01/2020 | Renouvellement d'inscription (CT) | Le service médical rendu par les spécialités AQUAREST 0,2 % (carbomère), gel ophtalmique en récipient unidose, LACRINORM 0,2 % (carbomère) et LIPOSIC 2 mg/g (carbomère), gel ophtalmique, reste important dans l’indication de l’AMM. |
Amélioration du service médical rendu (ASMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprés de la HAS (plus d'informations dans l'aide). Les avis et synthéses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur de l'ASMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| V (Inexistant) | Avis du 04/02/2009 | Inscription (CT) | Absence d’amélioration du service médicale rendu par rapport à la spécialité LACRIGEL. |
ANSM - Mis à jour le : 12/01/2024
AQUAREST 0,2%, gel ophtalmique en récipient unidose
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Carbomère............................................................................................................................... 2 mg
Pour 1g de gel ophtalmique
1 g de gel ophtalmique contient 2 mg de carbomère (viscosité 40 000-60 000 mPa.s).
Excipient à effet notoire :
AQUAREST 0,2%, gel ophtalmique en récipient unidose contient 0,00831 mg de phosphates dans chaque goutte ce qui équivaut à 1 mg/g.
Pour la liste complète des excipients, voir rubrique 6.1.
Gel liquide, blanchâtre, trouble.
4.1. Indications thérapeutiques
Traitement symptomatique de l’œil sec.
4.2. Posologie et mode d'administration
Le traitement du syndrome de l’œil sec requiert une posologie individualisée.
En fonction de la sévérité et de l’intensité des symptômes, instiller une goutte dans le cul de sac conjonctival 3 à 5 fois par jour ou plus fréquemment si nécessaire et au coucher.
Prendre soin d’administrer de petites gouttes en appuyant doucement sur l’unidose et en le tenant verticalement.
Eviter le contact de l’unidose avec l’œil et les paupières.
Consulter un ophtalmologiste si le traitement de la sécheresse oculaire est un traitement au long cours ou permanent. Si les symptômes de l’œil sec persistent ou s’aggravent, cesser d’utiliser ce médicament et consulter son docteur.
Mode d’administration
Voie ophtalmique.
Population pédiatrique
La sécurité et l’efficacité d’AQUAREST 0,2%, gel ophtalmique en récipient unidose chez les enfants et les adolescents, à la posologie recommandée chez les adultes, a été établie par l’expérience clinique, mais il n’existe pas de donnée d’essai clinique disponible.
Hypersensibilité à la substance active ou à l’un des excipients mentionnés à la rubrique 6.1.
4.4. Mises en garde spéciales et précautions d'emploi
Les utilisateurs de lentilles de contact doivent retirer leurs lentilles avant l’instillation d’AQUAREST 0,2%, gel ophtalmique en récipient unidose, et attendre 15 minutes avant de les remettre.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
A noter :
Si vous utilisez AQUAREST 0,2%, gel ophtalmique en récipient unidose en même temps que d’autres collyres, laissez un intervalle de 15 minutes entre les applications.
Si vous utilisez AQUAREST 0,2%, gel ophtalmique en récipient unidose en même temps que d’autres pommades ophtalmiques, laissez un intervalle de 15 minutes entre les applications.
AQUAREST 0,2%, gel ophtalmique en récipient unidose peut prolonger la rémanence des autres collyres et ainsi accroître leur action. Afin d’éviter cela, AQUAREST 0,2%, gel ophtalmique en récipient unidose doit toujours être le dernier médicament à être appliqué.
4.6. Fertilité, grossesse et allaitement
Fertilité
Concernant le carbomère aucune donnée sur la fertilité n’est disponible. Cependant, l’exposition systémique suite à l’utilisation d’AQUAREST 0,2%, gel ophtalmique en récipient unidose est supposée faible et les effets sur la fertilité sont peu probables.
Grossesse
Pour AQUAREST 0,2%, gel ophtalmique en récipient unidose aucune donnée clinique sur l’utilisation durant la grossesse n’est disponible. Le carbomère est probablement absorbé seulement en petite proportion et l’exposition systémique est de ce fait supposée être faible.
Aucun effet sur les enfants allaités n’est attendu étant donné la faible exposition systémique au carbomère chez la femme allaitante. AQUAREST 0,2%, gel ophtalmique en récipient unidose peut être utilisé durant l’allaitement.
En règle générale, ce médicament ne doit pas être utilisé pendant la grossesse ou l’allaitement, sauf si un médecin a pris en compte avec attention tous les risques et bénéfices potentiels.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Les effets indésirables sont catégorisés par fréquence comme suit :
· Très fréquents (≥ 1/10)
· Fréquents (≥ 1/100 à < 1/10)
· Peu fréquents (≥ 1/1 000 et < 1/100)
· Rares (≥ 1/10 000 et < 1/1 000)
· Très rares (< 1/10 000)
· Fréquence indéterminée (ne peut être estimée sur la base des données disponibles)
|
Affections du système immunitaire |
|
|
Très rares (< 1/10 000) |
Réactions d’intolérance à l’un des composants de ce médicament. |
|
Affections ophtalmiques |
|
|
Fréquence indéterminée |
Comme avec toutes les préparations oculaires, une vision trouble peut survenir peu de temps après l’instillation. |
|
Fréquence indéterminée |
D’autres réactions telles que démangeaisons et brûlures ont été observées dans des études avec des produits comparables. |
|
Très rares (< 1/10 000) |
Quelques très rares cas de calcification cornéenne ont été signalés en association avec l’utilisation de gouttes contenant des phosphates chez certains patients atteints de cornée gravement endommagées. |
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet https://signalement.social-sante.gouv.fr/.
Aucun cas de surdosage n’a été rapporté.
Tout surdosage oculaire ou prise orale pouvant survenir n’a pas de conséquence clinique.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : Agent ophtalmique, substitut lacrymal, code ATC : S01XA.
La substance active carbomère forme un film hydrophile qui adhère à la surface oculaire. Elle se lie aux molécules d’eau et stabilise le film lacrymal.
5.2. Propriétés pharmacocinétiques
En raison de la structure macromoléculaire du carbomère, il est admis que cette proportion est éliminée sans être métabolisée, c’est-à-dire qu’elle ne passe pas dans la circulation entéro-hépatique.
5.3. Données de sécurité préclinique
Triglycérides à chaîne moyenne
Phosphate disodique dodécahydraté
Hydroxyde de sodium
Eau pour préparations injectables.
Les récipients non ouverts de ce gel ont une durée de conservation de 2 ans.
AQUAREST 0,2%, gel ophtalmique en récipient unidose ne contient pas de conservateur.
Ne pas conserver un récipient unidose déjà entamé.
Jeter tout contenu non utilisé du récipient unidose après application.
6.4. Précautions particulières de conservation
Conserver à une température ne dépassant pas 25°C.
A conserver dans l’emballage extérieur d’origine, à l’abri de la lumière.
6.5. Nature et contenu de l'emballage extérieur
Récipient unidose (PEBD) de 0,6 g, boîtes de 10, 30, 60 et 120.
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
A usage unique.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
416 RUE SAMUEL MORSE – CS 99535
34961 MONTPELLIER
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 391 995 6 6 : 0,6 g de gel en récipient unidose (PEBD), boîte de 10.
· 34009 391 565 1 4 : 0,6 g de gel en récipient unidose (PEBD), boîte de 30.
· 34009 391 566 8 2 : 0,6 g de gel en récipient unidose (PEBD), boîte de 60.
· 34009 391 567 4 3 : 0,6 g de gel en récipient unidose (PEBD), boîte de 120.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Médicament non soumis à prescription médicale.
ANSM - Mis à jour le : 12/01/2024
AQUAREST 0,2%, gel ophtalmique en récipient unidose
Carbomère
Vous devez toujours utiliser ce médicament en suivant scrupuleusement les informations fournies dans cette notice ou par votre médecin, ou votre pharmacien.
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Adressez-vous à votre pharmacien pour tout conseil ou information.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
· Vous devez vous adresser à votre médecin si vous ne ressentez aucune amélioration ou si vous vous sentez moins bien après 3 jours.
1. Qu'est-ce que AQUAREST 0,2%, gel ophtalmique en récipient unidose et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d'utiliser AQUAREST 0,2%, gel ophtalmique en récipient unidose ?
3. Comment utiliser AQUAREST 0,2%, gel ophtalmique en récipient unidose ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver AQUAREST 0,2%, gel ophtalmique en récipient unidose ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE AQUAREST 0,2%, gel ophtalmique en récipient unidose ET DANS QUELS CAS EST-IL UTILISE ?
Classe pharmacothérapeutique : Agent ophtalmique, Substitut lacrymal - code ATC : S01XA
Ce médicament est un substitut du fluide lacrymal.
Il est indiqué dans le traitement symptomatique de l’œil sec.
Vous devez vous adresser à votre médecin si vous ne ressentez aucune amélioration ou si vous vous sentez moins bien après 3 jours de traitement.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER AQUAREST 0,2%, gel ophtalmique en récipient unidose ?
N’utilisez jamais AQUAREST 0,2%, gel ophtalmique en récipient unidose :
· si vous êtes allergique au carbomère ou à l’un des autres composants contenus dans ce médicament, mentionnés dans la rubrique 6.
Avertissements et précautions
Adressez-vous à votre médecin ou pharmacien avant d’utiliser AQUAREST 0,2%, gel ophtalmique en récipient unidose :
· si vous portez des lentilles de contact. En cas de syndrome de l’œil sec, le port de lentilles de contact est souvent déconseillé.
Si toutefois, votre ophtalmologiste vous le permet, retirez vos lentilles avant l’instillation d’AQUAREST 0,2%, gel ophtalmique en récipient unidose et attendez au moins 15 minutes avant de les remettre.
Enfants et adolescents jusqu’à 18 ans
La sécurité et l’efficacité d’AQUAREST 0,2%, gel ophtalmique en récipient unidose chez les enfants et les adolescents, à la posologie recommandée chez les adultes, a été établie par l’expérience clinique, mais il n’existe pas de donnée d’essai clinique disponible.
Autres médicaments et AQUAREST 0,2%, gel ophtalmique en récipient unidose
Informez votre médecin ou pharmacien si vous prenez, avez récemment pris ou pourriez prendre tout autre médicament, y compris des médicaments obtenus sans ordonnance.
Aucune interaction n’est connue à ce jour.
A noter :
· Si vous utilisez AQUAREST 0,2%, gel ophtalmique en récipient unidose en même temps que d’autres collyres, laissez un intervalle d’au moins 15 minutes entre les applications.
· Si vous utilisez AQUAREST 0,2%, gel ophtalmique en récipient unidose en même temps que d’autres pommades ophtalmiques, laissez un intervalle de 15 minutes entre les applications.
· AQUAREST 0,2%, gel ophtalmique en récipient unidose peut prolonger la rémanence des autres collyres et ainsi accroître leur action. Afin d’éviter cela, AQUAREST 0,2%, gel ophtalmique en récipient unidose doit toujours être le dernier médicament à être appliqué.
AQUAREST 0,2%, gel ophtalmique en récipient unidose avec des aliments et boissons
Aucune interaction n’est connue à ce jour.
Grossesse, allaitement et fertilité
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin ou pharmacien avant de prendre ce médicament.
Pour AQUAREST 0,2%, gel ophtalmique en récipient unidose, aucune donnée clinique sur l’utilisation durant la grossesse n’est disponible, mais d’autre part, il n’y a pas de facteur de risque connu plaidant contre l’utilisation d’AQUAREST 0,2%, gel ophtalmique en récipient unidose durant la grossesse ou l’allaitement.
Conduite de véhicules et utilisation de machines
Une vision trouble, due à la formation de traînées durant quelques minutes, peut apparaître après l’instillation de ce gel dans le cul de sac conjonctival ; en conséquence, ne conduisez pas, ne travaillez pas en dehors des conditions de sécurité, n’utilisez pas de machines durant cette période.
AQUAREST 0,2%, gel ophtalmique en récipient unidose contient des phosphates
Ce médicament contient 0,00831 mg de phosphates dans chaque goutte ce qui équivaut à 1 mg/g.
Si vous souffrez de dommages sévères de la cornée (couche transparente située à l’avant de l’œil) les phosphates peuvent causer, dans de très rares cas, des troubles de la vision en raison de l’accumulation de calcium pendant le traitement (nuage).
3. COMMENT UTILISER AQUAREST 0,2%, gel ophtalmique en récipient unidose ?
Le traitement du syndrome de l’œil sec requiert une posologie individualisée.
En fonction de la sévérité et de l’intensité des symptômes, instillez une goutte dans le cul de sac conjonctival 3 à 5 fois par jour, ou plus fréquemment, et au coucher.
Utilisez un nouveau récipient unidose à chaque application.
Consultez un ophtalmologiste si votre traitement de l’œil sec est un traitement au long cours ou permanent.
AQUAREST 0,2%, gel ophtalmique en récipient unidose est utilisable pour un traitement à long terme.
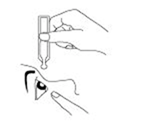
Penchez votre tête en arrière et tirez délicatement votre paupière inférieure avec l’un des index. Avec l’autre main, maintenez le récipient unidose en position verticale au-dessus de l’œil (sans toucher l’œil), et instillez une goutte dans le cul de sac conjonctival. Fermez votre paupière lentement et faites bouger votre œil afin de répartir uniformément le gel ophtalmique.
|
|
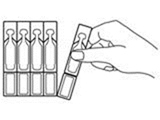
1. Séparez un récipient unidose de la barrette avec précaution. |
|
|
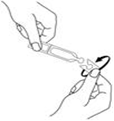
2. Ouvrez en tournant le capuchon du récipient unidose (sans tirer). |
|
|
3. Penchez légèrement votre tête en arrière et tirez délicatement la paupière inférieure de l’œil vers le bas. 4. Tenez le récipient unidose en position verticale avec l’ouverture vers le bas. 5. Pressez doucement le récipient unidose en évitant de toucher l’œil ou la peau autour de l’œil jusqu’à ce qu’une goutte tombe dans le cul de sac conjonctival. Vous éviterez ainsi de vous blesser l’œil ou de contaminer le gel. 6. Fermez l’œil et faites-le bouger de droite à gauche afin de répartir uniformément le gel ophtalmique sur la surface de l’œil. |
Utilisation chez les enfants et les adolescents jusqu’à 18 ans
La sécurité et l’efficacité d’AQUAREST 0,2%, gel ophtalmique en récipient unidose chez les enfants et les adolescents, à la posologie recommandée chez les adultes, a été établie par l’expérience clinique, mais il n’existe pas de donnée d’essai clinique disponible.
Si vous avez utilisé plus de AQUAREST 0,2%, gel ophtalmique en récipient unidose que vous n’auriez dû
Si vous utilisez accidentellement une dose plus importante que celle recommandée, cela peut entraîner une vision trouble, mais régressant rapidement.
Si vous oubliez d’utiliser AQUAREST 0,2%, gel ophtalmique en récipient unidose
Ne prenez pas de dose double pour compenser la dose que vous avez oubliée de prendre ; poursuivez votre traitement à la dose prévue et au moment prévu. Au besoin, vous pouvez également utiliser AQUAREST 0,2%, gel ophtalmique en récipient unidose, entre deux instillations prévues.
Si vous arrêtez d’utiliser AQUAREST 0,2%, gel ophtalmique en récipient unidose
Vous devez vous attendre à la réapparition des symptômes typiques de l’œil sec. De préférence, n’arrêtez pas votre traitement sans en avoir parlé à votre médecin.
Si vous avez d’autres questions sur l’utilisation de médicament, demandez plus d’informations à votre médecin ou à votre pharmacien.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Des réactions d’intolérance peuvent apparaître dans de rares cas (peut affecter jusqu'à 1 personne sur 10 000), par exemple sensation de brûlure dans l’œil.
Si vous souffrez de dommages sévères de la cornée (couche transparente située à l’avant de l’œil) les phosphates peuvent causer, dans de très rares cas, des troubles de la vision en raison de l’accumulation de calcium pendant le traitement (nuage).
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/.
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER AQUAREST 0,2%, gel ophtalmique en récipient unidose ?
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur la boîte et le récipient unidose après EXP. La date de péremption fait référence au dernier jour de ce mois.
AQUAREST 0,2%, gel ophtalmique en récipient unidose ne contient pas de conservateur. Ne conservez pas un récipient unidose déjà entamé. Jetez tout contenu non utilisé du récipient unidose après application.
Conservez ce médicament à une température ne dépassant pas 25°C.
Conservez ce médicament dans l’emballage extérieur d’origine, à l’abri de la lumière.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient AQUAREST 0,2%, gel ophtalmique en récipient unidose
· La substance active est :
Carbomère (viscosité 40 000-60 000 mPa.s)........................................................................ 2 mg
Pour 1 g de gel ophtalmique
· Les autres composants sont :
Sorbitol, triglycérides à chaîne moyenne, phosphate disodique dodécahydraté, hydroxyde de sodium, eau pour préparations injectables.
AQUAREST 0,2%, gel ophtalmique en récipient unidose est un gel liquide, blanchâtre, trouble.
Boîtes de 10, 30, 60 et 120 récipients unidose de 0,6 g de gel ophtalmique.
Toutes les présentations peuvent ne pas être commercialisées.
Titulaire de l’autorisation de mise sur le marché
416 RUE SAMUEL MORSE – CS99535
34961 MONTPELLIER
Exploitant de l’autorisation de mise sur le marché
LABORATOIRE CHAUVIN
416 RUE SAMUEL MORSE – CS99535
34961 MONTPELLIER
DR GERHARD MANN CHEM. PHARM. FABRIK GMBH
BRUNSBÜTTELER DAMM, 165/173
13581 BERLIN
ALLEMAGNE
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Ce médicament est autorisé dans les Etats membres de l'Espace Economique Européen sous les noms suivants : Conformément à la réglementation en vigueur.
[à compléter ultérieurement par le titulaire]
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
{mois AAAA}.
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).
Conseil d’éducation sanitaire :
Il est important que vous consultiez régulièrement votre ophtalmologiste pour des examens de suivi, car la sécheresse oculaire peut conduire à une maladie grave, si elle est mal traitée ou de façon insuffisante.