Dernière mise à jour le 01/12/2025
DEXAMETHASONE KALCEKS 4 mg/1 mL, solution injectable/pour perfusion
Indications thérapeutiques
DEXAMETHASONE KALCEKS contient la substance active phosphate de dexaméthasone (ci-après dénommée dexaméthasone). La dexaméthasone est un glucocorticoïde synthétique (hormone corticosurrénale). Il réduit les symptômes inflammatoires et intervient dans les processus métaboliques essentiels.
Administration par voie générale
DEXAMETHASONE KALCEKS est souvent utilisé après un traitement d'urgence commencé à dose élevée :
· Traitement et prophylaxie de l'œdème cérébral (gonflement du cerveau) des tumeurs cérébrales (après chirurgie et après irradiation par rayons X) et après traumatisme de la moelle épinière.
· État de choc dû à une réaction allergique sévère appelée « choc anaphylactique » (par exemple, réaction au produit de contraste).
· États de choc après blessures graves, prévention du « syndrome respiratoire aigu » post-traumatique (insuffisance respiratoire aiguë).
· Crise d'asthme sévère
· Traitement initial de certaines affections cutanées étendues, aiguës et sévères (par exemple pemphigus vulgaire, érythrodermie).
· Maladies graves du sang (par exemple, purpura thrombocytopénique aigu, anémie hémolytique, en tant que médicament associé dans le cadre des traitements de la leucémie).
· En traitement de deuxième intention chez les patients dont la fonction corticosurrénale est réduite ou inexistante (insuffisance corticosurrénale, crise addisonienne).
DEXAMETHASONE KALCEKS est utilisé comme traitement de la maladie à coronavirus 2019 (COVID-19) chez les patients adultes et adolescents (âgés de 12 ans et plus pesant au moins 40 kg) rencontrant des difficultés respiratoires et nécessitant une oxygénothérapie.
Administration locale (injection dans une partie restreinte du corps)
· Injection à proximité des articulations (périarticulaire) et traitement pénétrant le tissu (infiltrant), par exemple, pour l'inflammation de l'articulation de l'épaule (périarthrite scapulo-humérale), de l'articulation du coude (épicondylite), des tissus entourant les articulations (bursite), de la gaine du tendon (tenosynovite) et du poignet (styloïdite).
· Injection dans une articulation (injection intra-articulaire), par exemple dans la polyarthrite rhumatoïde, lorsque des articulations isolées sont atteintes ou répondent (polyarthrite rhumatoïde). Injection intra-articulaire, par exemple, dans la polyarthrite rhumatoïde, en cas d’atteinte articulaire isolée ou de non réponse au traitement par voie systémique ; en cas de poussées inflammatoires de la polyarthrite rhumatoïde.
Présentations
> 10 ampoule(s) en verre suremballée(s)/surpochée(s) de 1 ml
Code CIP : 34009 302 406 5 6
Déclaration de commercialisation : 30/11/2022
Cette présentation est agréée aux collectivités
Service médical rendu (SMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Important | Avis du 16/02/2022 | Inscription (CT) | Le service médical rendu par DEXAMETHASONE KALCEKS (dexaméthasone) est IMPORTANT dans l’indication de l’AMM, à l’exception de l’indication « choc polytraumatique/prophylaxie du syndrome pulmonaire de choc post-traumatique » où il est insuffisant pour justifier d’une prise en charge par la solidarité nationale en l’absence de données cliniques. |
Amélioration du service médical rendu (ASMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprés de la HAS (plus d'informations dans l'aide). Les avis et synthéses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur de l'ASMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| V (Inexistant) | Avis du 16/02/2022 | Inscription (CT) | Cette spécialité est un eurogénérique qui n’apporte pas d’amélioration du service médical rendu (ASMR V) par rapport aux spécialités à base de dexaméthasone déjà inscrites. |
ANSM - Mis à jour le : 26/06/2024
DEXAMETHASONE KALCEKS 4 mg/1 mL, solution injectable/pour perfusion
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Phosphate de dexaméthasone............................................................................................... 4,0 mg
Pour une ampoule de 1 mL.
Excipient(s) à effet notoire :
Chaque mL de solution contient environ 3 mg de sodium.
Pour la liste complète des excipients, voir rubrique 6.1.
Solution injectable/pour perfusion.
Solution claire et incolore exempte de particules visibles.
pH compris entre 7,0 et 8,5.
Osmolalité entre 270 et 310 mOsm/kg.
4.1. Indications thérapeutiques
La solution injectable/pour perfusion de DEXAMETHASONE KALCEKS est souvent utilisée après un traitement d'urgence initié à dose élevée :
· Traitement et prophylaxie de l'œdème cérébral des tumeurs cérébrales (en postopératoire et après irradiation par rayons X) et après traumatisme de la moelle épinière.
· Choc anaphylactique (par exemple, réaction au produit de contraste) en association avec adrénaline, antihistaminiques et correction de la volémie (attention : seringues mixtes).
· Etat de choc chez les polytraumatisés/ prévention du syndrome respiratoire aigu post-traumatique.
· Exacerbations sévères de l'asthme (uniquement en association aux sympathomimétiques).
· Dermatose aiguë sévère (exemple : pemphigus vulgaire, érythrodermie).
· Hémopathies sévères (exemple : purpura thrombocytopénique aigu, anémie hémolytique, traitement adjuvant de la leucémie.).
· Traitement de deuxième intention de l'insuffisance corticosurrénale aiguë (crise surrénalienne).
2. Administration locale
· Injection périarticulaire et infiltration par exemple, dans la périarthrite scapulo-humérale, l'épicondylite, la bursite, la tenosynovite, la styloïdite.
· Injection intra-articulaire, par exemple, dans la polyarthrite rhumatoïde, en cas d’atteinte articulaire isolée ou de non réponse au traitement par voie systémique ; en cas de poussées inflammatoires de la polyarthrite rhumatoïde.
4.2. Posologie et mode d'administration
La posologie dépend de la gravité des symptômes pathologiques, de la réponse individuelle du patient et, en utilisation intra-articulaire, de la taille de l'articulation.
Les glucocorticoïdes ne doivent être utilisés qu'aussi longtemps – et uniquement à des doses aussi faibles – qu'absolument nécessaire pour obtenir et maintenir l'effet thérapeutique souhaité.
Si des doses élevées sont nécessaires en un seul traitement, l'utilisation de médicaments contenant de la dexaméthasone avec des dosages/volumes plus élevés doit être envisagée.
Pour le traitement et la prophylaxie de l'œdème cérébral des tumeurs cérébrales (en postopératoire et après irradiation par rayons X) et après un traumatisme de la moelle épinière
Selon la cause et la gravité, la dose initiale est de 8 à 10 mg (jusqu'à 80 mg) en IV, puis de 16 à 24 mg (jusqu'à 48 mg)/jour répartis en 3 à 4 (6) doses uniques en IV pendant 4 à 8 jours. L'administration à long terme d'une dose plus faible de phosphate de dexaméthasone peut être nécessaire pendant la radiothérapie et dans le traitement conservateur des tumeurs cérébrales inopérables.
Pour le choc anaphylactique, la première injection d'adrénaline IV, puis 40 à 100 mg (enfants 40 mg) par injection IV, répétée si nécessaire.
Etat de choc chez les polytramatisés/ prévention du syndrome respiratoire aigu post- traumatique
Pour les exacerbations sévères de l'asthme, 8 à 40 mg en IV le plus tôt possible. Si besoin, injections répétées de 8 mg toutes les 4 heures.
Pour les dermatoses aiguës sévères et les hémopathies sévères, traitement initial avec 20 à 40 mg de phosphate de dexaméthasone en IV et traitement ultérieur en fonction de la gravité du cas, avec la même dose quotidienne ou des doses inférieures au cours des premiers jours et passer au traitement par voie orale.
Pour le traitement de l'insuffisance corticosurrénale aiguë (crise surrénalienne), initiation du traitement par 4 à 8 mg de phosphate de dexaméthasone en IV.
Pour le traitement de la COVID-19
Patients adultes : 6 mg en IV, une fois par jour pendant 10 jours maximum.
Sujet âgé, insuffisance rénale, insuffisance hépatique (à faible dose (6 mg par jour) et de courte durée) : aucun ajustement posologique n'est nécessaire.
Population pédiatrique : il est recommandé aux patients pédiatriques (adolescents âgés de 12 ans et plus pesant au moins 40 kg) d'utiliser 6 mg en IV, une fois par jour pendant 10 jours maximum.
La durée du traitement doit être guidée par la réponse clinique et les besoins individuels du patient.
2. Administration locale
Pour un traitement local infiltrant, périarticulaire et intra-articulaire dans des conditions strictement aseptiques, injection de 4 mg ou 8 mg de phosphate de dexaméthasone. Pour l'injection dans une petite articulation, 2 mg de phosphate de dexaméthasone suffisent. Selon la gravité de la maladie, il ne faut pas effectuer plus de 3 à 4 infiltrations ou 3 à 4 injections par articulation. L'intervalle entre les injections ne doit pas être inférieur à 3 à 4 semaines.
Insuffisance rénale
Aucun ajustement posologique n'est nécessaire chez les patients insuffisants rénaux (voir également rubrique 5.2).
Insuffisance hépatique
Chez les patients atteints d'une maladie hépatique sévère, un ajustement de la dose peut être nécessaire (voir également rubrique 5.2).
Population pédiatrique
Chez les enfants jusqu'à 14 ans, un intervalle sans traitement de 4 jours (traitement intermittent) doit être inséré après chaque cure de 3 jours de traitement, pendant le traitement à long terme, en raison du risque de troubles de la croissance.
Pour usage intraveineux, intramusculaire, intra-articulaire ou local (infiltration).
La solution injectable/pour perfusion de DEXAMETHASONE KALCEKS est généralement administrée lentement (2 à 3 minutes) par voie intraveineuse dans les maladies aiguës, par injection ou perfusion. Cependant, il peut également être administré par voie intramusculaire (uniquement dans des cas exceptionnels), en infiltration locale ou en intra-articulaire.
Hypersensibilité à la substance active ou à l’un des excipients mentionnés à la rubrique 6.1.
Infection fongique systémique ; infection systémique, sauf si un traitement anti-infectieux spécifique est utilisé.
L'injection intra-articulaire est contre-indiquée en cas de :
· infections à l'intérieur ou à proximité immédiate de l'articulation à traiter ;
· arthrite bactérienne ;
· instabilité de l'articulation à traiter ;
· diathèse hémorragique (spontanée ou due aux anticoagulants) ;
· calcification périarticulaire ;
· ostéonécrose avasculaire ;
· rupture tendineuse ;
· l'articulation de Charcot.
L'infiltration sans thérapie causale supplémentaire est contre-indiquée en présence d'infections dans la zone d'administration.
4.4. Mises en garde spéciales et précautions d'emploi
Insuffisance corticosurrénale aiguë
L'arrêt brutal du traitement durant plus de 10 jours peut entraîner l'apparition d'une insuffisance corticosurrénale aiguë. La dose doit donc être réduite lentement si l'arrêt est envisagé. En fonction de la dose et de la durée du traitement, l'insuffisance corticosurrénale induite par la corticothérapie peut persister plusieurs mois et, dans certains cas, plus d'un an après l'arrêt du traitement.
Si des situations particulières de stress physique (par exemple, accident, intervention chirurgicale, accouchement) surviennent pendant le traitement par le phosphate de dexaméthasone, une augmentation temporaire de la dose peut s'avérer nécessaire. L'administration de glucocorticoïdes peut également être nécessaire dans des situations de stress physique si l'insuffisance corticosurrénale persiste après la fin du traitement.
Risque d'infections bactériennes, virales, fongiques, parasitaires et opportunistes
Le traitement par le phosphate de dexaméthasone peut augmenter le risque d'infections bactériennes, virales, fongiques, parasitaires et opportunistes en raison de l'effet immunosuppresseur.
Les symptômes d'une infection manifeste ou en développement peuvent être masqués, ce qui peut rendre le diagnostic plus difficile. Une prudence particulière est de mise en cas d'infections virales aiguës (hépatite B, zona, herpès simplex, varicelle, kératite herpétique). En cas d'infections bactériennes aiguës et chroniques, une antibiothérapie ciblée doit être utilisée.
Les infections latentes, telles que la tuberculose ou l'hépatite B, peuvent être réactivées. Chez les patients ayant des antécédents de tuberculose, la dexaméthasone ne doit être utilisée qu'avec une prophylaxie tuberculostatique.
En cas de mycoses systémiques, un traitement antifongique concomitant doit être utilisé.
En cas de certaines maladies parasitaires (infection amibienne, nématodes), un traitement antiparasitaire concomitant doit être utilisé. Chez les patients présentant une infection connue ou suspectée de nématodes, les glucocorticoïdes peuvent entraîner une activation et une prolifération.
Utilisation simultanée de corticoïdes
Les corticoïdes systémiques ne doivent pas être arrêtés chez les patients qui sont déjà traités par des corticoïdes systémiques (oraux) pour d'autres raisons (par exemple, les patients atteints de bronchopneumopathie chronique obstructive), mais ne nécessitant pas d'oxygène supplémentaire.
Crise de phéochromocytome
Des crises de phéochromocytome, qui peuvent être fatales, ont été rapportées après administration de corticoïdes systémiques. Les corticostéroïdes ne doivent être administrés aux patients présentant un phéochromocytome suspecté ou identifié qu'après une évaluation appropriée des risques/bénéfices.
Une attention particulière est requise dans les situations suivantes :
· Environ 8 semaines avant et jusqu'à 2 semaines après les vaccinations prophylactiques avec des vaccins vivants : L'évolution des maladies virales peut être particulièrement sévère chez les patients traités par la dexaméthasone. Les enfants immunodéprimés, ainsi que les personnes qui n'ont pas encore eu la rougeole ou la varicelle, sont particulièrement exposés. Si ces personnes entrent en contact avec des personnes atteintes de la rougeole ou de la varicelle pendant le traitement par la dexaméthasone, elles doivent consulter immédiatement leur médecin, qui pourra instaurer un traitement préventif si nécessaire. Voir la rubrique "Vaccinations" ci-dessous.
· Ostéoporose : selon la posologie et la durée du traitement, un effet négatif sur le métabolisme du calcium doit être anticipé. Par conséquent, une administration supplémentaire de calcium est nécessaire et la vitamine D est recommandée. Un traitement supplémentaire doit être envisagé chez les patients présentant une ostéoporose préexistante. Chez les patients atteints d'ostéoporose sévère, n'utiliser que dans des situations mettant la vie en danger ou sur de courtes périodes. Chez les patients âgés, une analyse spécifique bénéfice/risque doit être réalisée et la vigilance est de mise sur les effets indésirables tels que l'ostéoporose.
· Diabète sucré : Surveillance clinique et ajustement du traitement antidiabétique.
· Antécédents psychiatriques, y compris risque suicidaire (passé ou présent) : Une surveillance neurologique ou psychiatrique est proposée.
· Insuffisance rénale : Traitement efficace concomitant de la maladie sous-jacente et surveillance continue.
· Myasthénie grave : une aggravation initiale des symptômes après l'administration de corticoïdes est possible. Par conséquent, une sélection soigneuse et prudente de la dose initiale.
Problèmes gastro-intestinaux
Chez les patients présentant des ulcères gastro-intestinaux, un traitement concomitant avec des agents antiulcéreux, ainsi qu'une surveillance attentive (y compris une surveillance radiologique ou une gastroscopie) sont indiqués.
En raison du risque de perforation intestinale, le phosphate de dexaméthasone ne peut être utilisé que lorsqu'il est clairement indiqué, avec une surveillance appropriée, chez les patients présentant :
· colite ulcéreuse sévère avec perforation imminente ;
· formation d'abcès ou infections purulentes ;
· diverticulite ;
· anastomose intestinale (immédiatement postopératoire).
Les signes d'irritation péritonéale secondaire à une perforation gastro-intestinale peuvent être absents chez les patients recevant des doses élevées de glucocorticoïdes.
Risque de troubles tendineux
Le risque de troubles tendineux, de tendinite et de rupture tendineuse augmente avec l'utilisation concomitante de fluoroquinolones et de corticoïdes par voie orale.
Vaccinations
En principe, les vaccinations avec des vaccins inactivés sont possibles. Cependant, il ne faut pas oublier que la réponse immunitaire et donc le succès de la vaccination à des doses plus élevées de corticostéroïdes peuvent être compromis.
Risque de réactions anaphylactiques
Des réactions anaphylactiques graves peuvent survenir.
Thérapie à long terme
En thérapie de longue durée, des examens médicaux réguliers (y compris des examens ophtalmologiques à intervalles de trois mois) sont indiqués ; à des doses comparativement élevées, des précautions doivent être prises pour assurer un apport adéquat en potassium et une restriction sodée, et les taux sériques de potassium doivent être surveillés.
Grossesse
Troubles cardiovasculaires
Une surveillance étroite est indiquée chez les patients atteints d'insuffisance cardiaque sévère.
En cas d'hypertension difficile à contrôler, un traitement antihypertenseur combiné et une surveillance régulière sont nécessaires. Une bradycardie peut survenir avec des doses élevées de dexaméthasone.
Chez les patients atteints d'insuffisance cardiaque, un traitement concomitant efficace de la maladie sous-jacente et une surveillance continue sont nécessaires.
Cardiomyopathie hypertrophique
Une cardiomyopathie hypertrophique a été rapportée après une administration systémique de corticostéroïdes incluant de la dexaméthasone à des nourrissons prématurés. Dans la majorité des cas signalés, cette situation était réversible à l’arrêt du traitement. Chez les nourrissons prématurés traités par dexaméthasone systémique, une évaluation diagnostique et une surveillance de la fonction et de la structure cardiaques doivent être réalisées (voir rubrique 4.8).
Œdème cérébral ou augmentation de la pression intracrânienne
Les corticostéroïdes ne doivent pas être utilisés en conjonction avec un traumatisme crânien ou un accident vasculaire cérébral, car ils ne seront probablement pas bénéfiques ou pourraient même nuire.
Syndrome de lyse tumorale (SLT)
Dans l'expérience post-commercialisation, un syndrome de lyse tumorale (SLT) a été observé chez des patients atteints de maladies hématologiques malignes après l'utilisation de dexaméthasone seule ou en association avec d'autres agents chimio thérapeutiques. Les patients à haut risque de SLT, tels que les patients présentant un taux de prolifération élevé, une charge tumorale élevée et une sensibilité élevée aux cytostatiques, doivent être étroitement surveillés et traités avec les précautions appropriées.
Troubles visuels
Des troubles visuels peuvent survenir lors de l'utilisation systémique et topique de corticostéroïdes. Si un patient présente des symptômes tels qu'une vision floue ou d'autres troubles visuels, il faut envisager d'orienter le patient vers un ophtalmologiste pour évaluer les causes possibles ; ceux-ci peuvent inclure la cataracte, le glaucome ou des maladies rares, par exemple,. choriorétinopathie séreuse centrale (CSC), qui ont été rapportées après l'utilisation de corticostéroïdes systémiques ou topiques.
Une prudence particulière doit être observée chez les patients atteints de glaucome à angle fermé et à angle ouvert. En cas d'ulcération et de lésion cornéennes, une surveillance ophtalmologique étroite et un traitement sont nécessaires.
Patients âgés
Chez les patients âgés, une analyse spécifique bénéfice/risque doit être réalisée et la vigilance est de mise sur les effets indésirables tels que l'ostéoporose.
Population pédiatrique
Prématurés : Les données disponibles indiquent des effets indésirables à long terme sur le développement neuronal après un traitement précoce (< 96 heures) des prématurés atteints d'une maladie pulmonaire chronique à des doses de 0,25 mg/kg deux fois par jour au début du traitement.
Les enfants en croissance et les adolescents ne doivent pas être traités sauf indication contraire.
Informations relatives à des modes d'administration spécifiques
Administration intramusculaire
DEXAMETHASONE KALCEKS ne doit être administré par voie intramusculaire que dans des cas exceptionnels pour les raisons suivantes :
· une intolérance locale et une fonte tissulaire (tissu adipeux et atrophie musculaire) sont possibles ;
· incertitude de dosage : d'abord dose excessive, ensuite effet insuffisant.
Administration intraveineuse
En cas d'utilisation intraveineuse, le phosphate de dexaméthasone doit être injecté lentement (2 à 3 minutes), car une administration trop rapide est plus susceptible d'entraîner de brefs effets secondaires sous forme de picotements désagréables ou de paresthésies, qui sont en soi inoffensifs et durent jusqu'à 3 minutes.
Administration intra-articulaire
L'administration intra-articulaire de glucocorticoïdes augmente le risque d'infections articulaires. L'utilisation prolongée et répétée de glucocorticoïdes dans les articulations portantes peut entraîner une aggravation des changements dégénératifs dans l'articulation. Une cause possible est la surcharge de l'articulation touchée après la régression de la douleur ou d'autres symptômes.
Administration locale
En utilisation locale, la vigilance est de mise pour d'éventuelles réactions indésirables systémiques et interactions.
Excipients
Ce médicament contient environ 3 mg de sodium par mL de solution, soit 0,15 % de l'apport quotidien maximal recommandé par l'OMS de 2 g de sodium pour un adulte.
Étant donné que ce médicament peut être dilué avec des solutions contenant du sodium (voir rubrique 6.6) cela doit être considéré par rapport au sodium total provenant de toutes les sources qui sera administré au patient.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
|
Effet glycosidique potentialisé par une carence en potassium |
|
|
Salurétiques : |
Excrétion supplémentaire de potassium |
|
Antidiabétiques : |
Diminution de la réduction glycémique |
|
Dérivés de coumarine : |
Effet anticoagulant atténué ou augmenté. Un ajustement de la dose est nécessaire en cas d'administration concomitante. |
|
Éphédrine : |
Effet corticoïde réduit |
|
Rifampicine, phénytoïne, carbamazépine, barbituriques, primidone et autres médicaments inducteurs du CYP3A4 : |
Effet corticoïde réduit |
|
Kétoconazole, itraconazole, ritonavir, cobicistat, antibiotiques macrolides et autres médicaments inhibiteurs du CYP3A4 : |
Lors d'un traitement concomitant par des inhibiteurs du CYP3A, y compris des produits contenant du cobicistat, un risque accru d'effets indésirables systémiques peut être anticipé. De telles associations doivent être évitées, à moins que le bénéfice ne l'emporte sur le risque accru de réactions systémiques indésirables aux corticostéroïdes ; auquel cas, les patients doivent être surveillés pour les effets systémiques des corticostéroïdes. |
|
Anti-inflammatoires non stéroïdiens/agents antirhumatismaux (par exemple, salicylés et indométacine) : |
Augmentation des ulcérations gastro-intestinales et du risque de saignement |
|
Contraceptifs contenant des œstrogènes : |
Effet corticoïde augmenté |
|
Praziquantel : |
Réduction des concentrations sanguines de praziquantel possible |
|
Inhibiteurs de l'ECA : |
Risque accru d'apparition de dyscrasies sanguines |
|
Chloroquine, hydroxychloroquine, méfloquine : |
Risque accru d'apparition de myopathie, cardiomyopathie |
|
Somatropine : |
Effet de la somatropine réduit en cas d'administration à long terme |
|
Laxatifs : |
Augmentation de la perte de potassium |
|
Atropine, autres anticholinergiques : |
Augmentation supplémentaire de la pression intraoculaire non exclue |
|
Myorelaxants non dépolarisants : |
La relaxation musculaire peut être prolongée |
|
Agents immunosuppresseurs (ciclosporine) : |
Sensibilité accrue aux infections et aggravation ou manifestation d'infections latentes. Avec la ciclosporine, le risque de convulsions cérébrales est en outre accru. |
|
Bupropion : |
La co-administration avec des glucocorticoïdes systémiques peut augmenter le risque de convulsions |
|
Fluoroquinolones : |
Le risque de troubles tendineux, tendinites et ruptures tendineuses est accru |
Effet sur les méthodes de test :
Les réactions cutanées aux tests d'allergie peuvent être supprimées.
Protireline : L'augmentation de la TSH lors de l'administration de protireline peut être réduite.
Si le traitement par glucocorticoïdes est administré 8 semaines avant ou jusqu'à 2 semaines après l'immunisation active, une atténuation ou une absence d'immunisation peut être attendue.
4.6. Fertilité, grossesse et allaitement
Grossesse
La dexaméthasone traverse le placenta. Pendant la grossesse, en particulier au cours des trois premiers mois, il ne doit être utilisé qu'après une évaluation minutieuse du rapport bénéfice/risque. DEXAMETHASONE KALCEKS ne doit être utilisé pendant la grossesse que dans des situations mettant le pronostic vital en danger. En cas de traitement au long cours par des glucocorticoïdes pendant la grossesse, des troubles de la croissance fœtale ne peuvent être exclus. L'administration de corticostéroïdes à des animaux gravides peut provoquer des malformations du développement fœtal, notamment une fente palatine, un retard de croissance intra-utérin et des effets sur la croissance et le développement cérébral. Rien n'indique que les corticostéroïdes entraînent une augmentation de l'incidence des anomalies congénitales telles que la fente palatine/la fente labiale chez l'homme. Voir également la rubrique 5.3. Si des glucocorticoïdes sont administrés en fin de grossesse, il existe un risque fœtal d'atrophie corticosurrénale, ce qui peut nécessiter un traitement substitutif progressif chez le nouveau-né. Les études ont montré un risque accru d’hypoglycémie néonatale à la suite de l’administration de corticostéroïdes, y compris de dexaméthasone, pendant une courte période chez des femmes à risque d’accouchement prématuré tardif.
Les glucocorticoïdes sont excrétés dans le lait maternel. Aucun mal pour le nourrisson n'a été signalé à ce jour. Néanmoins, ils ne doivent être utilisés que lorsqu'ils sont strictement indiqués pendant l'allaitement. Si des doses plus élevées sont nécessaires en raison de la maladie, l'allaitement doit être interrompu.
Fertilité
Aucune étude de fertilité n'a été réalisée.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Le risque d'effets indésirables est faible avec un traitement de courte durée à la dexaméthasone. Cependant, la vigilance est de mise pour les ulcères gastro-intestinaux (souvent liés au stress) qui, du fait de la corticothérapie, peuvent produire peu de symptômes, ainsi que pour les signes de diminution de la tolérance au glucose et de résistance aux infections.
En particulier lors d'un traitement à long terme (plus de 2 semaines environ), des réactions indésirables aux glucocorticoïdes peuvent survenir, qui, en tant qu'effet hormonal exagéré, sont similaires au syndrome de Cushing.
Les effets indésirables suivants peuvent survenir, qui dépendent fortement de la dose et de la durée du traitement et dont la fréquence est indéterminée (ne peut être estimée sur la base des données disponibles) :
Infections et infestations
Masquage d'infections, manifestation, prolifération ou réactivation d'infections (infections bactériennes, virales, fongiques et parasitaires et opportunistes), activation de nématode (voir rubrique 4.4).
Troubles sanguins et lymphatiques
Dyscrasies sanguines (leucocytose modérée, lymphocytopénie, éosinopénie, polyglobulie).
Troubles du système immunitaire
Réactions d'hypersensibilité (par exemple exanthème), réactions anaphylactiques sévères telles qu'arythmies, bronchospasme, hypo- ou hypertension, collapsus circulatoire, arrêt cardiaque, affaiblissement du système immunitaire.
Troubles endocriniens
Syndrome de Cushing (par exemple face lunaire, obésité tronculaire), inactivation ou atrophie corticosurrénale.
Troubles du métabolisme et de la nutrition
Rétention de sodium avec formation d'œdème, augmentation de l'excrétion de potassium (attention : arythmies), prise de poids, diminution de la tolérance au glucose, diabète sucré, augmentation de l'appétit, hypercholestérolémie et hypertriglycéridémie.
Troubles psychiatriques
Psychose, dépression, irritabilité, euphorie, troubles du sommeil, labilité, anxiété, manie, hallucinations, idées suicidaires.
Troubles du système nerveux
Pseudotumeur cérébrale, manifestation d'épilepsie latente et susceptibilité accrue aux crises en cas d'épilepsie manifeste.
Troubles oculaires
Augmentation de la pression intraoculaire (glaucome), opacité du cristallin (cataracte). Aggravation des symptômes de l'ulcère cornéen, promotion de l'inflammation oculaire virale, fongique et bactérienne, aggravation de l'inflammation bactérienne de la cornée, ptosis, mydriase, chémosis, perforation sclérale iatrogène, choriorétinopathie. Dans de très rares cas, exophtalmie réversible (voir également rubrique 4.4).
Affections cardiaques
Cardiomyopathie hypertrophique chez les nourrissons prématurés (voir rubrique 4.4).
Troubles vasculaires
Hypertension, risque accru d'athérosclérose et de thrombose, inflammation des vaisseaux sanguins (vascularite, également comme symptôme de sevrage après un traitement à long terme), fragilité capillaire.
Problèmes gastro-intestinaux
Maux d'estomac, activation et développement d'un ulcère gastrique ou d'un ulcère duodénal, pancréatite (chez les patients prédisposés, par exemple dus à l'alcoolisme), saignement gastro-intestinal, risque de perforation dans la colite ulcéreuse.
Affections de la peau et du tissu sous-cutané
Vergetures (striae rubra), amincissement de la peau (atrophie), saignements localisés sous la peau (pétéchies), ecchymoses, acné stéroïdienne, dermatite périorale, télangiectasies, hypertrichose, modifications de la pigmentation de la peau.
Troubles musculo‑squelettiques et du tissu conjonctif
Faiblesse musculaire, fonte musculaire (atrophie), myopathie, troubles tendineux, tendinite, rupture tendineuse, ostéoporose, ostéonécrose aseptique, retard de croissance chez l'enfant, lipomatose péridurale.
Troubles de l'appareil reproducteur et du sein
Troubles de la sécrétion des hormones sexuelles (aménorrhée, hirsutisme, impuissance).
Troubles généraux et anomalies au site d'administration
Cicatrisation retardée.
Usage local : Des irritations locales et des signes d'intolérance sont possibles (sensations de chaleur, douleurs prolongées), notamment en usage oculaire. Le développement d'une atrophie cutanée et d'une atrophie du tissu sous-cutané au site d'injection ne peut être exclu si les corticostéroïdes ne sont pas injectés avec précaution dans la cavité articulaire.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/.
Il n'y a pas de cas connus d'intoxication aiguë à la dexaméthasone. En cas de surdosage, une augmentation des effets indésirables (voir rubrique 4.8) peut être attendue, notamment sur le système endocrinien, le métabolisme et l'équilibre électrolytique. Il n'y a pas d'antidote connu.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
La dexaméthasone est un glucocorticoïde monofluoré doté de propriétés anti-allergiques, anti-inflammatoires et stabilisatrices de membrane marquées, ainsi que d'effets sur le métabolisme des glucides, des protéines et des lipides.
Avec une demi-vie biologique de plus de 36 heures, la dexaméthasone appartient aux glucocorticoïdes à très longue durée d'action. En raison de sa longue durée d'action, la dexaméthasone peut entraîner une accumulation et un surdosage lorsqu'elle est administrée quotidiennement en continu.
La dexaméthasone possède un effet glucocorticoïde environ 7,5 fois plus puissant que la prednisolone et la prednisone. Comparé à l'hydrocortisone, il est 30 fois plus puissant. Il n'a pas d'effet minéralocorticoïde.
Les glucocorticoïdes tels que la dexaméthasone exercent leur effet biologique en activant la transcription de gènes sensibles aux corticostéroïdes. Les effets anti-inflammatoires, immunosuppresseurs et antiprolifératifs sont induits par des facteurs tels qu'une formation, une libération et une activité réduites de médiateurs inflammatoires et par l'inhibition de fonctions spécifiques et la migration de cellules inflammatoires. De plus, l'effet des lymphocytes T et des macrophages sensibilisés sur les cellules cibles par les corticostéroïdes est peut-être empêché.
Traitement du COVID-19
L'étude RECOVERY (Randomised Evaluation of COVid-19 thERapY)1 est une étude sur plateforme adaptative, initiée par un chercheur, individuellement randomisé, contrôlé, ouvert et adaptatif pour évaluer les effets des traitements potentiels chez les patients hospitalisés avec COVID-19.
L'essai a été mené dans 176 centres hospitaliers au Royaume-Uni.
Il y avait 6425 patients randomisés recevant soit de la dexaméthasone (2104 patients) soit des soins habituels seuls (4321 patients). 89 % des patients présentaient une infection au SRAS-CoV-2 confirmée en laboratoire.
Lors de la randomisation, 16 % des patients recevaient une ventilation mécanique invasive ou une oxygénation extracorporelle par membrane, 60 % recevaient de l'oxygène uniquement (avec ou sans ventilation non invasive) et 24 % ne recevaient ni l'un ni l'autre.
L'âge moyen des patients était de 66,1 +/- 15,7 ans. 36 % des patients étaient des femmes. 24 % des patients avaient des antécédents de diabète, 27 % de maladie cardiaque et 21 % de maladie pulmonaire chronique.
Critère d'évaluation principal
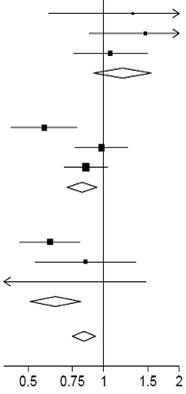
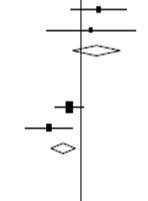
La mortalité à 28 jours était significativement plus faible dans le groupe dexaméthasone que dans le groupe de soins habituels, avec des décès signalés chez 482 des 2104 patients (22,9 %) et chez 1110 des 4321 patients (25,7 %), respectivement (rapport de taux, 0,83 ; 95 % intervalle de confiance [IC], 0,75 à 0,93 ; P < 0,001).
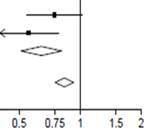
Dans le groupe dexaméthasone, l'incidence des décès était inférieure à celle du groupe de soins habituels chez les patients recevant une ventilation mécanique invasive (29,3 % contre 41,4 % ; rapport de taux, 0,64 ; IC à 95 % : 0,51 à 0,81) et chez ceux recevant un supplément d'oxygène sans ventilation mécanique invasive (23,3 % contre 26,2 % ; rapport de taux, 0,82 ; IC à 95 % : 0,72 à 0,94).
Il n'y avait pas d'effet clair de la dexaméthasone chez les patients qui ne recevaient aucune assistance respiratoire lors de la randomisation (17,8 % contre 14,0 % ; rapport de taux, 1,19 ; IC à 95 %, 0,91 à 1,55).
Critères secondaires
Les patients du groupe dexaméthasone ont eu une durée d'hospitalisation plus courte que ceux du groupe de soins habituels (médiane, 12 jours contre 13 jours) et une plus grande probabilité de sortie en vie dans les 28 jours (rapport de taux, 1,10 ; IC à 95 % : 1,03 à 1,17).
Conformément au critère d'évaluation principal, l'effet le plus important concernant la sortie dans les 28 jours a été observé chez les patients recevant une ventilation mécanique invasive lors de la randomisation (rapport de taux, 1,48 ; IC à 95 %, 1,16 à 1,90), suivi par l'oxygène seul (rapport de taux, 1,15 ; IC à 95 % 1,06-1,24) sans effet bénéfique chez les patients ne recevant pas d'oxygène (rapport de taux : 0,96 ; IC à 95 % 0,85-1,08).
|
Résultats |
Dexaméthasone (N = 2104) |
Soins usuels (N = 4321) |
Risque relatif ou ratio (95% CI) * |
|
Nombre/Nombre total de patients (%) |
|||
|
Critère principal |
|||
|
Mortalité à 28 jours |
482/2104 (22,9) |
1110/4321 (25,7) |
0,83 (0,75‑0,93) |
|
Critères secondaires |
|||
|
Sortie de l’hôpital sous 28 jours |
1413/2104 (67,2) |
2745/4321 (63,5) |
1,10 (1,03‑1,17) |
|
Ventilation mécanique invasive ou décès |
456/1780 (25,6) |
994/3638 (27,3) |
0,92 (0,84‑1,01) |
|
Ventilation mécanique invasive |
102/1780 (5,7) |
285/3638 (7,8) |
0,77 (0,62‑0.95) |
|
Décès |
387/1780 (21,7) |
827/3638 (22,7) |
0,93 (0,84‑1,03) |
* Les risques relatifs ont été ajustés sur l’âge en fonction du taux de mortalité à 28 jours et du délai de sortie en vie de l’hôpital. Les risques relatifs ont été ajustés sur l’âge en fonction du taux de progression vers ventilation mécanique invasive ou de décès et des sous-composants.
Les patients qui recevaient une ventilation mécanique invasive au moment de la randomisation ont été exclus de cette catégorie.
Données de sécurité
Quatre effets indésirables (EI) graves ont été observés en lien avec le traitement à l’étude : deux cas graves d’hyperglycémie, un cas grave de psychose induite par la corticothérapie et un cas d’hémorragie digestive haute. Les évènements ont tous été résolus.
Analyses en sous-groupes
Effets de l’administration de la DEXAMÉTHASONE sur la mortalité à 28 jours, en fonction de l’âge et de l’assistance respiratoire reçue au moment de la randomisation2
|
|
Dexaméthasone |
Soins habituels |
|
RR (IC 95 %) |
|
|
Pas d’oxygène ( |
|||||
|
<70 ≥70 <80 ≥80 Sous-total |
10/197 (5,1 %) 25/114 (21,9 %) 54/190 (28,4 %) 89/501 (17,8 %) |
18/462 (3,9 %) 35/224 (15,6 %) 92/348 (26,4 %) 145/1034 (14,0 %) |
|
1,31 (0,60-2,83) 1,46 (0,88-2,45) 1,06 (0,76-1,49) 1,19 (0,91-1,55) |
|
|
Oxygène seul ( |
|
||||
|
<70 ≥70 <80 ≥80 Sous-total |
53/675 (7,9 %) 104/306 (34,0 %) 141/298 (47,3 %) 298/1279 (23,3 %) |
193/1473 (13,1 %) 178/531 (33,5 %) 311/600 (51,8 %) 682/2604 (26,2 %) |
0,58 (0,43-0,78) 0,98 (0,77-1,25) 0,85 (0,70-1,04) 0,82 (0,72-0,94) |
||
|
Ventilation mécanique ( |
|
||||
|
<70 ≥70 <80 ≥80 Sous-total Tous les participants |
66/269 (24,5 %) 26/49 (53,1 %) 3/6 (50,0 %) 95/324 (29,3 %) 482/2104 (22,9 %) |
217/569 (38,1 %) 58/104 (55,8 %) 8/10 (80,0 %) 283/683 (41,4 %) 1110/4321 (25,7 %) |
0,61 (0,46-0,81) 0,85 (0,53-1,34) 0,39 (0,10-1,47) 0,64 (0,51-0,81) 0,83 (0,75-0,93) p<0,001 |
||
|
|
|
|
Dexaméthasone plus efficace |
Soins habituels plus efficace |
|
|
|
|
|
|
|
|
Effets de l’administration de la DEXAMÉTHASONE sur la mortalité à 28 jours, en fonction de l’assistance respiratoire reçue au moment de la randomisation et d’antécédents de maladie chronique3
|
|
Dexaméthasone |
Soins habituels |
|
RR (IC 95 %) |
|||
|
Pas d’oxygène ( |
|||||||
|
Antécédent de maladie Pas d’antécédent de maladie Sous-total |
65/313 (20,8 %) 24/188 (12,8 %) 89/501 (17,8 %) |
100/598 (16,7 %) 45/436 (10,3 %) 145/1034 (14,0 %) |
|
1,22 (0,89-1,66) 1,12 (0,68-1,83) 1,19 (0,91-1,55) |
|||
|
Oxygène seul ( |
|
||||||
|
Pas d’antécédent de maladie Sous-total |
221/702 (31,5 %) 77/577 (13,3 %) 298/1279 (23,3 %) |
481/1473 (32,7 %) 201/1131 (17,8 %) 682/2604 (26,2 %) |
0,88 (0,75-1,03) 0,70 (0,54-0,91) 0,82 (0,72-0,94) |
||||
|
Ventilation mécanique ( |
|
||||||
|
Antécédent de maladie Pas d’antécédent de maladie Sous-total Tous les participants |
51/159 (32,1 %) 44/165 (26,7 %) 95/324 (29,3 %) 482/2104 (22,9 %) |
150/346 (43,4 %) 133/337 (39,5 %) 283/683 (41,4 %) 1110/4321 (25,7 %)
|
0,75 (0,54-1,02) 0,56 (0,40-0,78) 0,64 (0,51-0,81) 0,83 (0,75-0,93) p<0,001 |
||||
|
|
|
|
Dexaméthasone plus efficace |
Soins habituels plus efficace |
|
||
2, 3 (source: Horby P. et al., 2020; https://www.medrxiv.org/content/10.1101/2020.06.22.20137273v1; doi: https://doi.org/10.1101/2020.06.22.20137273)
5.2. Propriétés pharmacocinétiques
La dexaméthasone est liée de manière dose-dépendante principalement aux albumines plasmatiques. À des concentrations très élevées, la fraction majeure est disponible librement dans le sang, c'est-à-dire non liée aux protéines. En cas d'hypoalbuminémie, la fraction de corticostéroïde non lié (actif) augmente.
Pénétration du liquide céphalorachidien (LCR)
Chez l'homme, les concentrations maximales de dexaméthasone dans le LCR approximativement 1/6 des concentrations plasmatiques concomitantes sont mesurées quatre heures après l'administration intraveineuse de dexaméthasone radiomarquée.
Transfert placentaire
Comme tous les glucocorticoïdes, la dexaméthasone peut traverser la barrière placentaire, mais, contrairement à la plupart des autres corticoïdes, elle n'est pas métabolisée.
Excrétion dans le lait maternel
Aucune donnée n'est disponible sur la dexaméthasone. De petites quantités de glucocorticoïdes sont excrétées dans le lait maternel, l'exposition du nourrisson étant généralement inférieure à 1/100 de la dose systémiquement disponible chez la mère qui allaite. Néanmoins, avec l'utilisation de doses plus élevées ou pendant un traitement à long terme, l'allaitement doit être interrompu.
Biotransformation
Après injection intraveineuse de phosphate de dexaméthasone, le clivage de l'ester est très rapide. Les valeurs maximales de l'alcool dexaméthasone libre sont mesurées après 10 minutes.
Il est partiellement métabolisé par conjugaison avec l'acide glucuronique ou sulfurique dans le foie avec une excrétion ultérieure principalement par les reins.
Élimination
La demi-vie d'élimination sérique moyenne de la dexaméthasone chez l'homme adulte est de 4,1 ± 1,3 heures. La dexaméthasone est en grande partie éliminée par les reins dans l'urine sous forme d'alcool de dexaméthasone libre. Les lésions rénales n'affectent pas de manière significative l'élimination de la dexaméthasone. Dans les maladies hépatiques sévères, par exemple, hépatite, cirrhose du foie, ainsi que pendant la grossesse et l'administration d'œstrogènes, la demi-vie d'élimination des glucocorticoïdes est prolongée.
Chez l'homme, le phosphate de dexaméthasone est principalement excrété sous forme de dexaméthasone. Dans une moindre mesure, les molécules sont hydrogénées ou hydroxylées, ce qui donne les principaux métabolites 6-hydroxydexaméthasone et 20-dihydrodexaméthasone. Chez l'homme, 30-40 % de la quantité excrétée dans l'urine est liée à l'acide glucuronique ou à l'acide sulfurique.
5.3. Données de sécurité préclinique
Chez la souris et le rat, la DL50 pour la dexaméthasone après une dose orale unique est de 16 g/kg de poids corporel et de plus de 3 g/kg de poids corporel, respectivement, au cours des 7 premiers jours. Après une dose sous-cutanée unique, la DL50 chez la souris est supérieure à 700 mg/kg de poids corporel et chez le rat d'environ 120 mg/kg de poids corporel, au cours des 7 premiers jours.
Sur une période de 21 jours, ces valeurs diminuent, ce qui est interprété comme une conséquence de maladies infectieuses graves causées par l'immunosuppression induite par les hormones.
Toxicité chronique
Il n'y a pas de données sur la toxicité chronique chez l'homme et l'animal. Les intoxications induites par les corticoïdes ne sont pas connues. Lors d'un traitement à plus long terme avec des doses supérieures à 1,5 mg/jour, des effets indésirables prononcés peuvent être attendus (voir rubrique 4.8).
Potentiel mutagène et cancérigène
Les résultats des études disponibles pour les glucocorticoïdes ne montrent aucune preuve de propriétés génotoxiques cliniquement pertinentes.
Toxicité pour la reproduction
Dans les études animales, une fente palatine a été observée chez les rats, les souris, les hamsters, les lapins, les chiens et les primates ; pas chez les chevaux et les moutons. Dans certains cas, ces divergences étaient associées à des anomalies du système nerveux central et du cœur. Chez les primates, des effets dans le cerveau ont été observés après exposition. De plus, la croissance intra-utérine peut être retardée. Tous ces effets ont été observés à des doses élevées.
Créatinine, citrate de sodium (pour l'ajustement du pH), édétate disodique, hydroxyde de sodium (pour l'ajustement du pH), eau pour préparations injectables.
Après ouverture de l'ampoule : Une fois ouvert, le médicament doit être utilisé immédiatement.
Durée de conservation après dilution
La stabilité physico-chimique en cours d'utilisation a été démontrée pendant 48 heures à 25 °C (à l'abri de la lumière) et à 2-8 °C.
D'un point de vue microbiologique, la solution diluée doit être utilisée immédiatement. Si elle n'est pas utilisée immédiatement, les durées et conditions de conservation avant utilisation sont de la responsabilité de l'utilisateur et ne devraient normalement pas dépasser 24 heures entre 2 et 8 °C, à moins que la dilution n'ait eu lieu dans des conditions aseptiques contrôlées et validées.
6.4. Précautions particulières de conservation
À conserver à une température ne dépassant pas 30 °C.
Conserver les ampoules dans l’emballage extérieur, à l'abri de la lumière.
Pour les conditions de conservation après dilution et ouverture de l'ampoule, voir rubrique 6.3.
6.5. Nature et contenu de l'emballage extérieur
La solution injectable est conditionnée dans des ampoules en verre transparent incolore de type I de 1 mL avec un système d’ouverture OPC (One Point Cut). Les ampoules sont marquées d'un code d'anneau de couleur spécifique.
Les ampoules sont présentées dans une pochette et placées dans un emballage extérieur.
3, 10, 25, 50 ou 100 ampoules de 1 mL.
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
À usage unique.
Une fois ouvert, le médicament doit être utilisé immédiatement. Tout contenu restant doit être éliminé.
Le médicament doit être inspecté visuellement avant utilisation. Seules des solutions claires exemptes de particules doivent être utilisées.
La solution injectable/pour perfusion de DEXAMETHASONE KALCEKS doit de préférence être administrée par voie intraveineuse directe ou injectée dans le tube de perfusion. Cependant, les solutions injectables sont compatibles avec les solutions pour perfusion suivantes (250 mL et 500 mL) :
· 9 mg/mL (0,9 %) de solution de chlorure de sodium
· 50 mg/mL (5 %) de solution de glucose
· solution de Ringer.
Lors de la combinaison avec des solutions pour perfusion, les informations des fabricants respectifs sur leurs solutions pour perfusion, y compris les données sur la compatibilité, les contre-indications, les effets indésirables et l'interaction, doivent être prises en compte.
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
KRUSTPILS IELA 71E
RĪGA, LV-1057
LETTONIE
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 302 406 4 9 : 1 mL en ampoule (verre). Boîte de 3.
· 34009 302 406 5 6 : 1 mL en ampoule (verre). Boîte de 10.
· 34009 302 406 6 3 : 1 mL en ampoule (verre). Boîte de 25.
· 34009 302 406 7 0 : 1 mL en ampoule (verre). Boîte de 50.
· 34009 302 406 8 7 : 1 mL en ampoule (verre). Boîte de 100.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Liste I.
ANSM - Mis à jour le : 26/06/2024
DEXAMETHASONE KALCEKS 4 mg/1 mL, solution injectable/pour perfusion
phosphate de dexaméthasone
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin ou votre pharmacien.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que DEXAMETHASONE KALCEKS 4 mg/1 mL, solution injectable/pour perfusion et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d'utiliser DEXAMETHASONE KALCEKS 4 mg/1 mL, solution injectable/pour perfusion ?
3. Comment utiliser DEXAMETHASONE KALCEKS 4 mg/1 mL, solution injectable/pour perfusion ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver DEXAMETHASONE KALCEKS 4 mg/1 mL, solution injectable/pour perfusion ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE DEXAMETHASONE KALCEKS 4 mg/1 mL, solution injectable/pour perfusion ET DANS QUELS CAS EST-IL UTILISE ?
DEXAMETHASONE KALCEKS contient la substance active phosphate de dexaméthasone (ci-après dénommée dexaméthasone). La dexaméthasone est un glucocorticoïde synthétique (hormone corticosurrénale). Il réduit les symptômes inflammatoires et intervient dans les processus métaboliques essentiels.
Administration par voie générale
DEXAMETHASONE KALCEKS est souvent utilisé après un traitement d'urgence commencé à dose élevée :
· Traitement et prophylaxie de l'œdème cérébral (gonflement du cerveau) des tumeurs cérébrales (après chirurgie et après irradiation par rayons X) et après traumatisme de la moelle épinière.
· État de choc dû à une réaction allergique sévère appelée « choc anaphylactique » (par exemple, réaction au produit de contraste).
· États de choc après blessures graves, prévention du « syndrome respiratoire aigu » post-traumatique (insuffisance respiratoire aiguë).
· Crise d'asthme sévère
· Traitement initial de certaines affections cutanées étendues, aiguës et sévères (par exemple pemphigus vulgaire, érythrodermie).
· Maladies graves du sang (par exemple, purpura thrombocytopénique aigu, anémie hémolytique, en tant que médicament associé dans le cadre des traitements de la leucémie).
· En traitement de deuxième intention chez les patients dont la fonction corticosurrénale est réduite ou inexistante (insuffisance corticosurrénale, crise addisonienne).
DEXAMETHASONE KALCEKS est utilisé comme traitement de la maladie à coronavirus 2019 (COVID-19) chez les patients adultes et adolescents (âgés de 12 ans et plus pesant au moins 40 kg) rencontrant des difficultés respiratoires et nécessitant une oxygénothérapie.
Administration locale (injection dans une partie restreinte du corps)
· Injection à proximité des articulations (périarticulaire) et traitement pénétrant le tissu (infiltrant), par exemple, pour l'inflammation de l'articulation de l'épaule (périarthrite scapulo-humérale), de l'articulation du coude (épicondylite), des tissus entourant les articulations (bursite), de la gaine du tendon (tenosynovite) et du poignet (styloïdite).
· Injection dans une articulation (injection intra-articulaire), par exemple dans la polyarthrite rhumatoïde, lorsque des articulations isolées sont atteintes ou répondent (polyarthrite rhumatoïde). Injection intra-articulaire, par exemple, dans la polyarthrite rhumatoïde, en cas d’atteinte articulaire isolée ou de non réponse au traitement par voie systémique ; en cas de poussées inflammatoires de la polyarthrite rhumatoïde.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER DEXAMETHASONE KALCEKS 4 mg/1 mL, solution injectable/pour perfusion ?
N’utilisez jamais DEXAMETHASONE KALCEKS 4 mg/1 mL, solution injectable/pour perfusion :
· Si vous êtes allergique à la dexaméthasone ou à l’un des autres composants contenus dans ce médicament, mentionnés dans la rubrique 6.
· L'infection affectant tout le corps, y compris celle qui pourrait avoir été causée par un champignon (par exemple le muguet), qui n'est pas traitée avec des antibiotiques.
· L'injection dans une articulation ne doit pas être pratiquée dans les cas suivants : infections à l'intérieur ou à proximité immédiate de l'articulation à traiter, inflammation articulaire causée par des bactéries (arthrite bactérienne), instabilité de l'articulation à traiter, tendance à saigner (spontanée ou due aux anticoagulants), dépôts de calcium près de l'articulation (calcification périarticulaire), mort localisée du tissu osseux notamment au niveau de la tête de l'humérus et du fémur (nécrose avasculaire de l'os), rupture du tendon, maladie d'une articulation due à la syphilis (articulation de Charcot).
· L'infiltration sans traitement supplémentaire de la cause est contre-indiquée en cas d'infections dans la zone d'administration.
Avertissements et précautions
Adressez-vous à votre médecin, pharmacien ou infirmier/ère avant de recevoir ce médicament, car des soins particuliers sont nécessaires si :
· Vous avez une infection bactérienne aiguë ou chronique
· Vous avez eu la tuberculose
· Vous avez une maladie fongique qui affecte les organes internes
· Vous souffrez d'une maladie parasitaire (par exemple, infection amibienne, infection par nématode)
· Vous avez une infection virale aiguë (hépatite B, infection herpétique, varicelle)
· Vous (ou votre enfant) avez été ou devez être vacciné (voir « Autres médicaments et DEXAMETHASONE KALCEKS »). Informez particulièrement votre médecin si vous n'avez pas encore eu de rougeole ou de varicelle ou si le système immunitaire de votre enfant est affaibli
· Vous avez des ulcères gastriques ou intestinaux
· Vous souffrez d'ostéoporose (dégradation du tissu osseux). Votre médecin voudra peut-être déterminer votre densité osseuse avant de commencer un traitement à long terme. Votre médecin peut vous prescrire des suppléments de calcium, de vitamine D et/ou des médicaments pour réduire la densité osseuse, si nécessaire. Chez les patients atteints d'ostéoporose sévère, ce médicament ne sera utilisé que pour des raisons mettant en jeu le pronostic vital ou sur de courtes périodes.
· Vous souffrez d'hypertension artérielle difficile à contrôler
· Vous souffrez de diabète
· Vous avez des antécédents de maladie psychique, y compris un risque de suicide
· Vous avez une pression accrue à l'intérieur de l'œil (glaucome à angle fermé et à angle ouvert), une lésion cornéenne ou des ulcères de l'œil (car une surveillance étroite et un traitement par un ophtalmologiste sont nécessaires)
· Vous souffrez de troubles cardiaques ou rénaux
· Vous souffrez de myasthénie grave (une maladie musculaire), car les symptômes peuvent initialement s'aggraver après l'administration de dexaméthasone ; la dose de départ doit être choisie avec prudence
· Vous avez une tumeur de la glande surrénale (phéochromocytome).
Si vous n'êtes pas sûr que l'un des cas ci-dessus s'applique à vous, demandez conseil à votre médecin ou à votre pharmacien.
Informez votre médecin si vous remarquez l'un des symptômes suivants pendant le traitement par ce médicament :
· Crampes musculaires, faiblesse musculaire, confusion, altération ou perte de la vision et essoufflement, en cas de maladie sanguine maligne. Ceux-ci peuvent être des symptômes du syndrome de lyse tumorale.
· Vision trouble ou autres troubles visuels.
Utilisation simultanée de corticoïdes
Vous ne devez pas arrêter de prendre d'autres médicaments stéroïdes à moins que votre médecin ne vous l'ait demandé.
Les précautions générales concernant l'utilisation de stéroïdes dans des maladies spécifiques, le masquage d'une infection, les médicaments concomitants, etc. doivent être conformes aux recommandations actuelles.
Réactions allergiques sévères
Des réactions allergiques sévères et même une anaphylaxie (réaction potentiellement mortelle) avec des symptômes tels qu'un rythme cardiaque irrégulier, une constriction des muscles respiratoires, une diminution ou une augmentation de la pression artérielle, une insuffisance circulatoire ou un arrêt cardiaque, peuvent survenir.
Insuffisance corticosurrénale
L'arrêt brutal du traitement qui a duré plus de 10 jours peut entraîner le développement d'une insuffisance corticosurrénale aiguë. La dose doit donc être réduite lentement si l'arrêt est souhaité. En fonction de la dose et de la durée du traitement, l'insuffisance corticosurrénale induite par la corticothérapie peut persister encore plusieurs mois et, dans certains cas, plus d'un an après l'arrêt du traitement.
Si des situations de stress physique spécifiques surviennent pendant le traitement, telles qu'une fièvre, un accident ou une intervention chirurgicale, le médecin doit être immédiatement informé ou le médecin urgentiste doit être informé de la poursuite du traitement par la dexaméthasone. Il peut être nécessaire d'augmenter temporairement la dose quotidienne de dexaméthasone. L'administration de glucocorticoïdes peut également être nécessaire dans des situations de stress physique si l'insuffisance corticosurrénale persiste après la fin du traitement.
Risque d'infection
La dexaméthasone à des doses supérieures à celles requises pour le traitement d'entretien est associée à un risque plus élevé d'infection, à l'aggravation possible d'une infection préexistante et à l'activation possible d'une infection cachée. L'effet anti-inflammatoire peut masquer les symptômes de l'infection jusqu'à ce que l'infection ait atteint un niveau plus élevé.
Troubles gastro-intestinaux
En raison du risque de perforation de la paroi intestinale avec péritonite (inflammation du péritoine), ce médicament sera utilisé s'il existe des raisons médicales impérieuses, assorties d'une surveillance appropriée, dans les cas suivants :
· inflammation sévère du côlon (colite ulcéreuse) avec perforation imminente ;
· abcès ou infections purulentes (remplies de pus) ;
· diverticulite (inflammation des renflements [appelés diverticules] sur la paroi du côlon) ;
· après certains types de chirurgie intestinale (anastomose intestinale) immédiatement après la chirurgie.
Les signes d'irritation péritonéale après perforation d'un ulcère gastrique ou intestinal peuvent être absents chez les patients recevant des doses élevées de glucocorticoïdes.
Traitement à long terme
Dans le cadre d'un traitement à long terme, des examens médicaux réguliers (y compris des examens oculaires de suivi tous les 3 mois) sont indiqués. À des doses comparativement élevées, un apport adéquat en potassium (par exemple, légumes, bananes) et un apport limité en sodium (sel) doivent être assurés et les taux sanguins de potassium doivent être surveillés. Une surveillance attentive est également indiquée chez les patients atteints d'insuffisance cardiaque sévère (incapacité du cœur à fournir la quantité de sang éjectée nécessaire au métabolisme, à l'effort ou même au repos).
Avertissements liés à des modes d'administration spécifiques
· Dans une veine, le médicament sera injecté lentement (2 à 3 minutes), car une injection trop rapide peut entraîner des picotements désagréables temporaires ou des sensations cutanées anormales pouvant durer jusqu'à 3 minutes. Ces effets sont inoffensifs en eux-mêmes.
· L'injection dans une articulation de glucocorticoïdes augmente le risque d'infections articulaires. L'utilisation prolongée et répétée de glucocorticoïdes dans les articulations portantes peut entraîner une aggravation des changements dégénératifs au sein de l'articulation. Une cause possible est la surcharge de l'articulation touchée après que la douleur ou d'autres symptômes se soient dissipés.
Autres avertissements
· À fortes doses, une diminution de la fréquence cardiaque peut survenir.
· Le risque de troubles tendineux, d'inflammation tendineuse et de rupture tendineuse augmente lorsque les fluoroquinolones (antibiotiques) sont utilisées en même temps que la dexaméthasone.
· En principe, les vaccinations avec des vaccins morts (inactivés) sont possibles. Cependant, il ne faut pas oublier que la réponse immunitaire et donc la vaccination réussie peuvent être compromises à des doses plus élevées.
· Chez les patients âgés, le médecin évaluera soigneusement les bénéfices et les risques et surveillera les effets secondaires tels que l'ostéoporose (dégradation du tissu osseux).
· Si la dexaméthasone est administrée à un bébé prématuré, une surveillance de la fonction et de la structure cardiaques est nécessaire.
Enfants et adolescents
La dexaméthasone ne doit pas être utilisée systématiquement chez les bébés prématurés ayant des problèmes respiratoires.
Chez l'enfant et l'adolescent, le traitement ne doit être administré que s'il existe des raisons médicales impérieuses, en raison du risque de retard de croissance. Dans la mesure du possible, un traitement intermittent doit être visé pendant le traitement à long terme.
Autres médicaments et DEXAMETHASONE KALCEKS 4 mg/1 mL, solution injectable/pour perfusion
Informez votre médecin ou pharmacien si vous utilisez, avez récemment utilisé ou pourriez utiliser tout autre médicament.
Certains médicaments peuvent augmenter les effets de la dexaméthasone et votre médecin voudra peut-être vous surveiller attentivement si vous utilisez ces médicaments (y compris les médicaments contre le VIH : ritonavir, cobicistat).
Informez votre médecin ou pharmacien si vous utilisez l'un des médicaments suivants :
· médicaments pour traiter l'insuffisance cardiaque (glycosides cardiaques) ;
· médicaments utilisés pour augmenter la diurèse ;
· médicaments pour abaisser le taux de sucre dans le sang (antidiabétiques) ;
· médicaments pour prévenir les caillots sanguins/anticoagulants (dérivés de la coumarine) ;
· éphédrine (utilisée pour l'asthme et une mauvaise circulation) ;
· rifampicine (utilisée pour traiter la tuberculose) ;
· médicaments pour traiter les convulsions et l'épilepsie (phénytoïne, carbamazépine, primidone) ;
· barbituriques (médicaments pour vous aider à dormir) ;
· kétoconazole, itraconazole (utilisés pour traiter les infections fongiques) ;
· médicaments pour traiter les infections (antibiotiques macrolides, par exemple l'érythromycine, ou les fluoroquinolones, par exemple la ciprofloxacine) ;
· les analgésiques et les agents anti-inflammatoires/antirhumatismaux (par exemple, les salicylates et l'indométacine) ;
· contraceptifs contenant des œstrogènes ;
· un médicament pour traiter les infestations parasitaires intestinales (praziquantel) ;
· médicaments pour traiter l'hypertension artérielle et certaines maladies cardiaques (inhibiteurs de l'ECA) ;
· agents antipaludiques (chloroquine, hydroxychloroquine, méfloquine) ;
· la somatropine (une hormone de croissance) ;
· laxatifs ;
· atropine et autres anticholinergiques (médicaments qui bloquent l'action d'un certain neurotransmetteur cérébral) ;
· des médicaments pour détendre les muscles ;
· médicaments qui affaiblissent le système immunitaire (ciclosporine) ;
· bupropion (aide au sevrage tabagique).
Effet sur les méthodes de test : Les réactions cutanées aux tests d'allergie peuvent être supprimées. Des interactions sont possibles avec un médicament utilisé dans les tests thyroïdiens (protireline : l'augmentation de la TSH lors de l'administration de protireline peut être réduite).
Si le traitement par la dexaméthasone est effectué 8 semaines avant et jusqu'à 2 semaines après la vaccination prophylactique active, on peut s'attendre à ce que l'efficacité d'une telle vaccination soit réduite ou absente.
DEXAMETHASONE KALCEKS 4 mg/1 mL, solution injectable/pour perfusion avec des aliments et boissons
Sans objet.
Grossesse, allaitement et fertilité
Grossesse
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin ou pharmacien avant de prendre ce médicament.
La dexaméthasone traverse le placenta. Pendant la grossesse, en particulier au cours des trois premiers mois, il ne doit être utilisé qu'après une évaluation minutieuse du rapport bénéfice/risque. Par conséquent, les femmes doivent informer leur médecin si elles sont enceintes ou si elles tombent enceintes pendant le traitement. Lors d'un traitement prolongé pendant la grossesse, des troubles de la croissance chez l'enfant à naître ne peuvent être exclus. Si des glucocorticoïdes sont administrés vers la fin de la grossesse, il existe un risque d'hypoactivité du cortex surrénalien chez le nouveau-né, ce qui peut nécessiter un traitement substitutif chez le nouveau-né, qui doit être progressivement réduit. Les nouveau-nés de mères ayant reçu DEXAMETHASONE KALCEKS vers la fin de la grossesse peuvent présenter de faibles taux de sucre dans le sang après la naissance.
Allaitement
Les glucocorticoïdes sont excrétés dans le lait maternel. Aucun préjudice pour le nourrisson n'a été signalé à ce jour. Néanmoins, ils ne doivent être utilisés que lorsqu'ils sont strictement indiqués pendant l'allaitement. Si des doses plus élevées doivent être utilisées, l'allaitement doit être arrêté.
Fertilité
Aucune étude de fertilité n'a été réalisée.
Conduite de véhicules et utilisation de machines
Aucune étude sur les effets sur l'aptitude à conduire des véhicules et à utiliser des machines n'a été réalisée.
DEXAMETHASONE KALCEKS 4 mg/1 mL, solution injectable/pour perfusion contient du sodium
Ce médicament contient environ 3 mg de sodium (composant principal du sel de cuisine/de table) dans chaque mL de solution. Cela équivaut à 0,15 % de l'apport alimentaire quotidien maximal recommandé en sodium pour un adulte.
3. COMMENT UTILISER DEXAMETHASONE KALCEKS 4 mg/1 mL, solution injectable/pour perfusion ?
Veillez à toujours utiliser ce médicament en suivant exactement les indications de votre médecin. Votre médecin décidera pendant combien de temps vous devez utiliser la dexaméthasone. Vérifiez auprès de votre médecin ou pharmacien en cas de doute.
Ce médicament peut être administré dans une veine, dans un muscle, dans une articulation ou par infiltration des tissus mous.
La posologie dépend de l'indication, de la gravité des symptômes, de la réponse individuelle du patient et, en cas d'injection dans une articulation, de la taille de l'articulation.
Les glucocorticoïdes ne doivent être utilisés qu'aussi longtemps – et uniquement à des doses aussi faibles – qu'absolument nécessaire pour obtenir et maintenir l'effet souhaité. La durée d'utilisation est guidée par l'indication. L'utilisation prolongée de dexaméthasone ne doit pas être arrêtée brutalement, mais la dose doit plutôt être réduite progressivement, selon les directives du médecin.
Pour le traitement du COVID 19
Il est recommandé aux patients adultes de recevoir 6 mg dans une veine une fois par jour pendant 10 jours maximum.
Utilisation chez les adolescents : il est recommandé aux patients pédiatriques (adolescents de 12 ans ou plus pesant au moins 40 kg) de recevoir 6 mg dans une veine une fois par jour pendant 10 jours maximum.
Insuffisance rénale
Aucun ajustement posologique n'est nécessaire.
Insuffisance hépatique
Chez les patients atteints d'une maladie hépatique sévère, un ajustement de la dose peut être nécessaire.
Utilisation chez les enfants et les adolescents
Chez l'enfant jusqu'à 14 ans, un intervalle sans traitement de 4 jours doit être mis en place après chaque cure de 3 jours, pendant le traitement à long terme, en raison du risque de troubles de la croissance.
Si vous avez utilisé plus de DEXAMETHASONE KALCEKS 4 mg/1 mL, solution injectable/pour perfusion que vous n’auriez dû
Il n'y a pas de cas connus d'intoxication aiguë à la dexaméthasone. En cas de surdosage, des effets secondaires accrus sont à prévoir. Si vous pensez que vous avez reçu trop de ce médicament, informez-en immédiatement votre médecin.
Si vous oubliez d’utiliser DEXAMETHASONE KALCEKS 4 mg/1 mL, solution injectable/pour perfusion
Sans objet.
Si vous arrêtez d’utiliser DEXAMETHASONE KALCEKS 4 mg/1 mL, solution injectable/pour perfusion
Le traitement ne doit pas être interrompu ou arrêté brutalement, sauf indication contraire d'un médecin. Néanmoins, si vous décidez d'arrêter le traitement par vous-même, par exemple, en raison des effets secondaires qui surviennent ou parce que vous vous sentez mieux, non seulement vous mettrez le succès de votre traitement en danger, mais vous vous exposerez également à des risques importants. En particulier, après une période de traitement prolongée, vous ne devez jamais arrêter ce médicament par vous-même. Vous devez toujours consulter votre médecin au préalable.
Si vous avez d'autres questions sur l'utilisation de ce médicament, demandez plus d'informations à votre médecin ou votre pharmacien.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Lors d'un traitement à court terme par la dexaméthasone, le risque d'effets secondaires est faible. Les effets secondaires suivants sont possibles :
· ulcères gastriques ou duodénaux ;
· diminution des défenses de l'organisme contre les infections ;
· augmentation de la glycémie (diminution de la tolérance au glucose).
Les effets indésirables suivants peuvent survenir, qui dépendent fortement de la dose et de la durée du traitement et dont la fréquence n'est donc pas connue (la fréquence ne peut être estimée sur la base des données disponibles) :
Infections et infestations
Masquage des infections, infections fongiques, virales et autres (infections opportunistes) encouragées à se développer ou à s'aggraver, activation de nématode (voir rubrique 2, « Avertissements et précautions »).
Troubles sanguins et lymphatiques
Modifications de la numération globulaire (leucocytose modérée, lymphopénie, éosinopénie, polyglobulie).
Troubles du système immunitaire
Réactions d'hypersensibilité (par exemple éruption cutanée), affaiblissement du système immunitaire, réactions allergiques et même anaphylaxie (une réaction allergique aiguë mettant la vie en danger), avec des symptômes tels qu'un rythme cardiaque irrégulier, une constriction des muscles respiratoires, une diminution ou une augmentation de la pression artérielle, une insuffisance circulatoire, crise cardiaque.
Troubles du système hormonal
Syndrome de Cushing (par exemple, face lunaire, obésité du haut du corps), inactivité corticosurrénale ou rétrécissement (atrophie).
Troubles du métabolisme et de la nutrition
Rétention de sodium dans l'organisme avec accumulation d'eau dans les tissus, augmentation de l'excrétion de potassium (attention : troubles du rythme cardiaque possibles), prise de poids, augmentation de la glycémie (tolérance au glucose réduite), diabète, augmentation des taux de lipides sanguins (cholestérol et triglycérides), augmentation de l'appétit.
Troubles psychiatriques
Psychose, dépression, irritabilité, euphorie (bonheur excessif), troubles du sommeil, labilité, anxiété, manie, hallucinations, pensées suicidaires.
Troubles du système nerveux
Pseudotumeur cérébrale (« fausse » tumeur dans le cerveau), apparition initiale de l'épilepsie favorisée chez les patients atteints d'épilepsie latente (auparavant « dormante ») et susceptibilité accrue aux convulsions dans les cas d'épilepsie préexistante (crises).
Troubles oculaires
Glaucome, cataracte, aggravation des symptômes de l'ulcère cornéen, promotion de l'inflammation oculaire virale, fongique et bactérienne ; aggravation d'une inflammation bactérienne de la cornée, paupière tombante (ptosis), pupilles dilatées, œdème de la conjonctive dans l'œil, perforation sclérale iatrogène (lésion de la sclérotique [paroi blanche de l'œil] induite par un médecin), altération ou perte de la vision, vision floue. Dans de rares cas, protrusion réversible du globe oculaire (exophtalmie).
Troubles cardiaques
Épaississement du muscle cardiaque (cardiomyopathie hypertrophique) chez les bébés nés prématurément, qui revient généralement à la normale après l’arrêt du traitement.
Troubles vasculaires
Hypertension artérielle, risque accru d'athérosclérose (modification de la paroi des vaisseaux sanguins) et de thrombose (obstruction des vaisseaux sanguins par un caillot sanguin), inflammation des vaisseaux sanguins et lymphatiques (vascularite, également sous forme de syndrome de sevrage après un traitement à long terme), fragilité de la paroi des vaisseaux sanguins (fragilité capillaire).
Troubles gastro-intestinaux
Troubles gastriques, ulcères gastro-intestinaux, saignements gastro-intestinaux, inflammation du pancréas, risque de perforation intestinale dans la rectocolite hémorragique (inflammation sévère du gros intestin).
Affections de la peau et du tissu sous-cutané
Vergetures, amincissement de la peau, saignements localisés sous la peau, ecchymoses, acné stéroïdienne, inflammation de la peau autour de la bouche, dilatation des vaisseaux sanguins superficiels, pilosité excessive, modifications de la pigmentation de la peau.
Troubles musculo‑squelettiques et du tissu conjonctif
Faiblesse musculaire, atrophie musculaire, maladie musculaire inflammatoire, troubles des tendons, inflammation des tendons, rupture des tendons, dégradation du tissu osseux (ostéoporose), retard de croissance chez les enfants, nécrose osseuse aseptique (mort du tissu osseux sans implication des germes), augmentation du tissu adipeux chez le canal rachidien.
Troubles de l'appareil reproducteur et du sein
Troubles de la sécrétion d'hormones sexuelles, tels que menstruations absentes, croissance excessive des cheveux chez les femmes, impuissance.
Troubles généraux et anomalies au site d'administration
Cicatrisation retardée.
Administration locale
Des irritations locales et des signes d'intolérance sont possibles (sensations de chaleur, douleurs prolongées), notamment en cas d'utilisation dans les yeux. Le développement d'une atrophie tissulaire ne peut être exclu si la dexaméthasone n'est pas soigneusement injectée dans la cavité articulaire.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/.
5. COMMENT CONSERVER DEXAMETHASONE KALCEKS 4 mg/1 mL, solution injectable/pour perfusion ?
Tenir ce médicament hors de la vue et de la portée des enfants.
À conserver à une température ne dépassant pas 30 °C.
Conserver les ampoules dans l’emballage extérieur, à l'abri de la lumière.
Après ouverture de l'ampoule : Une fois ouvert, le médicament doit être utilisé immédiatement.
Durée de conservation après dilution
La stabilité physico-chimique en cours d'utilisation a été démontrée pendant 48 heures à 25 °C (à l'abri de la lumière) et à 2-8 °C.
D'un point de vue microbiologique, la solution diluée doit être utilisée immédiatement. Si elle n'est pas utilisée immédiatement, les durées et conditions de conservation avant utilisation sont de la responsabilité de l'utilisateur et ne devraient normalement pas dépasser 24 heures entre 2 et 8 °C, à moins que la dilution n'ait eu lieu dans des conditions aseptiques contrôlées et validées.
N’utilisez pas ce médicament après la date de péremption indiquée sur l’emballage et l’ampoule après EXP. La date de péremption fait référence au dernier jour de ce mois.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient DEXAMETHASONE KALCEKS 4 mg/1 mL, solution injectable/pour perfusion
· La substance active est :
Phosphate de dexaméthasone............................................................................................... 4,0 mg
Equivalent au phosphate sodique de dexaméthasone
Pour une ampoule de 1 mL.
· Les autres composants sont :
Créatinine, citrate de sodium (pour l'ajustement du pH), édétate disodique, hydroxyde de sodium (pour l'ajustement du pH), eau pour préparations injectables.
Solution claire et incolore exempte de particules visibles.
Ampoules en verre incolore de type I de 1 mL avec un système d’ouverture OPC (One Point Cut).
Les ampoules sont marquées d'un code d'anneau de couleur spécifique.
Les ampoules sont présentées dans une pochette et placées dans un emballage extérieur.
Présentations :
3, 10, 25, 50 ou 100 ampoules de 1 mL.
Toutes les présentations peuvent ne pas être commercialisées.
Titulaire de l’autorisation de mise sur le marché
KRUSTPILS IELA 71E
RĪGA, LV-1057
LETTONIE
Exploitant de l’autorisation de mise sur le marché
84 QUAI JOSEPH GILLET
69004 LYON
KRUSTPILS IELA 71E
RĪGA, LV-1057
LETTONIE
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Ce médicament est autorisé dans les Etats membres de l'Espace Economique Européen sous les noms suivants : Conformément à la réglementation en vigueur.
[À compléter ultérieurement par le titulaire]
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).
Les informations suivantes sont destinées exclusivement aux professionnels de santé :
Posologie et mode d'administration
Si des doses élevées sont nécessaires en un seul traitement, l'utilisation de médicaments contenant de la dexaméthasone avec des dosages/volumes plus élevés doit être envisagée.
1. Administration systémique
Pour le traitement et la prophylaxie de l'œdème cérébral dans les tumeurs cérébrales (en postopératoire et après irradiation aux rayons X) et après un traumatisme de la moelle épinière
Selon la cause et la gravité, la dose initiale est de 8 à 10 mg (jusqu'à 80 mg) en IV, puis de 16 à 24 mg (jusqu'à 48 mg)/jour répartis en 3 à 4 (6) doses uniques en IV pendant 4 à 8 jours. L'administration à long terme d'une dose plus faible de phosphate de dexaméthasone peut être nécessaire pendant la radiothérapie et dans le traitement conservateur des tumeurs cérébrales inopérables.
Pour le choc anaphylactique, la première injection d'adrénaline IV, puis 40 à 100 mg (enfants 40 mg) par injection IV, répétée si nécessaire.
Choc polytraumatique / prophylaxie du choc post-traumatique pulmonaire
Initialement 40 à 100 mg (enfants 40 mg) en IV, répétition de la dose après 12 heures, ou toutes les 6 heures 16 à 40 mg pendant 2-3 jours.
Pour les exacerbations sévères de l'asthme, 8 à 40 mg en IV le plus tôt possible. Si besoin, injections répétées de 8 mg toutes les 4 heures.
Pour les dermatoses aiguës sévères et les maladies du sang sévères, traitement initial avec 20 à 40 mg de phosphate de dexaméthasone en IV et traitement ultérieur en fonction de la gravité du cas, avec la même dose quotidienne ou des doses inférieures au cours des premiers jours et passer au traitement par voie orale.
Pour le traitement de l'insuffisance corticosurrénale aiguë (crise surrénalienne), initiation du traitement par 4 à 8 mg de phosphate de dexaméthasone en IV.
Pour le traitement du COVID-19
Patients adultes : 6 mg en IV, une fois par jour pendant 10 jours maximum.
Sujet âgé, insuffisance rénale, insuffisance hépatique (à faible dose (6 mg par jour) et de courte durée) : aucun ajustement posologique n'est nécessaire.
Population pédiatrique : il est recommandé aux patients pédiatriques (adolescents âgés de 12 ans et plus pesant au moins 40 kg) d'utiliser 6 mg en IV, une fois par jour pendant 10 jours maximum.
La durée du traitement doit être guidée par la réponse clinique et les besoins individuels du patient.
2. Administration locale
Pour un traitement local infiltrant, périarticulaire et intra-articulaire dans des conditions strictement aseptiques, injection de 4 mg ou 8 mg de phosphate de dexaméthasone. Pour l'injection dans une petite articulation, 2 mg de phosphate de dexaméthasone suffisent. Selon la gravité de la maladie, il ne faut pas effectuer plus de 3 à 4 infiltrations ou 3 à 4 injections par articulation. L'intervalle entre les injections ne doit pas être inférieur à 3 à 4 semaines.
Mode d’administration
Pour usage intraveineux, intramusculaire, intra-articulaire ou local (infiltration).
La solution injectable/pour perfusion de DEXAMETHASONE KALCEKS est généralement administrée lentement (2 à 3 minutes) par voie intraveineuse dans les maladies aiguës, par injection ou perfusion. Cependant, elle peut également être administrée par voie intramusculaire (uniquement dans des cas exceptionnels), en infiltration locale ou en intra-articulaire.
Instructions d'utilisation et autres manipulations
À usage unique.
Une fois ouvert, le médicament doit être utilisé immédiatement. Eliminez tout contenu restant.
Inspectez visuellement l'ampoule avant utilisation. Seules des solutions claires exemptes de particules doivent être utilisées. pH de la solution entre 7,0 et 8,5.
Ce médicament ne doit pas être mélangé avec d'autres médicaments à l'exception de ceux mentionnés ci-dessous.
La solution injectable/pour perfusion de DEXAMETHASONE KALCEKS doit de préférence être administrée par voie intraveineuse directe ou injectée dans le tube de perfusion. Cependant, les solutions injectables sont compatibles avec les solutions pour perfusion suivantes (250 mL et 500 mL) :
· 9 mg/mL (0,9 %) de solution de chlorure de sodium
· 50 mg/mL (5 %) de solution de glucose
· solution de Ringer.
Lors de l'association avec des solutions pour perfusion, les informations des fabricants respectifs sur leurs solutions pour perfusion, y compris les données sur la compatibilité, les contre-indications, les effets indésirables et l'interaction, doivent être prises en compte.
Instruction d'ouverture de l'ampoule
1) Retournez l'ampoule avec la pointe colorée vers le haut. S'il y a de la solution dans la partie supérieure de l'ampoule, tapotez doucement avec votre doigt pour obtenir toute la solution dans la partie inférieure de l'ampoule.
2) Utilisez les deux mains pour ouvrir ; tout en tenant la partie inférieure de l'ampoule dans une main, utilisez l'autre main pour casser la partie supérieure de l'ampoule dans la direction opposée au point coloré (voir les images ci-dessous).
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.