
ANSM - Mis à jour le : 14/03/2022
RAPIFEN 5 mg (0,5 mg/ml), solution injectable
2. COMPOSITION QUALITATIVE ET QUANTITATIVE 
Quantité correspondant en alfentanil......................................................................................... 5 mg
Pour une ampoule de 10 ml.
Excipent à effet notoire : sodium (35,4 mg par ampoule de 10 ml).
Pour la liste complète des excipients, voir rubrique 6.1.
4.1. Indications thérapeutiques 
Analgésique central réservé à l'anesthésie.
RAPIFEN est indiqué chez l’adulte :
· En raison de son action rapide et de courte durée, l'alfentanil est particulièrement indiqué pour l'anesthésie ambulatoire ou de courte durée.
· L'alfentanil peut être également utilisé pour les interventions de durée moyenne ou longue sous forme de réinjections à la demande ou en perfusion continue.
RAPIFEN est indiqué chez le nouveau-né, le nourrisson, l’enfant et l’adolescent :
· Comme analgésique opioïde, en association à un hypnotique, pour induire l’anesthésie.
· Comme analgésique opioïde, en association à une anesthésie générale, pour les interventions chirurgicales de courte ou longue durée.
4.2. Posologie et mode d'administration 
Ce produit ne doit être administré que par des médecins spécialisés en anesthésie-réanimation ou en médecine d’urgence et familiarisés avec l’utilisation des anesthésiques, ou sous leur contrôle, et disposant de tout le matériel d’anesthésie-réanimation nécessaire.
Les recommandations des sociétés savantes concernées doivent être respectées, notamment en cas d’utilisation en situation extrahospitalière (situation d’urgence ou transport médicalisé).
La posologie sera individualisée. Les facteurs à prendre en compte pour déterminer la posologie sont l'âge, le poids corporel, l'état physique, les maladies sous-jacentes (voir rubrique 4.4), l'utilisation d'autres médicaments (voir rubrique 4.5), le type d'anesthésie employé et le type et la durée de l'intervention chirurgicale.
La dose d'alfentanil utilisée tiendra compte de la demi-vie d'élimination qui est fonction de l'âge du patient (voir rubrique 5.2).
Afin d’éviter une bradycardie, il est recommandé d’administrer une faible dose d’agent anticholinergique en intraveineuse (I.V) peu de temps avant l’induction anesthésique.
Selon la durée de l'intervention, la posologie sera la suivante :
|
Ventilation spontanée (adultes) |
|||
|
Durée de l'intervention |
Doses d'induction |
Réinjection (toutes les 10 à 15 min si prolongation) |
|
|
< 10 min |
7 à 12 µg/kg |
5 à 10 µg/kg |
|
|
Ventilation assistée * |
|||
|
Durée de l'intervention |
Doses d'induction |
Doses d'entretien |
|
|
|
|
Soit injections répétées toutes les 10 à 15 min |
Soit perfusion continue (µg/kg/min) |
|
10 à 30 min 30 à 60 min > 60 min |
20 à 40 µg/kg 40 à 80 µg/kg 80 à 150 µg/kg (en plusieurs min) |
15 µg/kg 15 µg/kg |
- 1 à 1,5 1 à 1,5 |
*Ces doses impliquent une surveillance attentive de la ventilation au moins 3 heures après la fin de l'intervention.
· Afin d'éviter une dépression respiratoire post-opératoire, l'administration d'alfentanil sera arrêtée avant la fin de l'intervention.
· La dose d'entretien peut être augmentée au moment des temps opératoires douloureux ou si le protocole anesthésique ne comporte pas d'anesthésiques par inhalation.
· A la dose de 120 µg/kg, l'alfentanil pourra être employé comme inducteur d'anesthésie à condition d'assurer simultanément une relaxation musculaire suffisante.
Population pédiatrique
Du matériel permettant une ventilation assistée doit toujours être disponible lors de l’utilisation chez l’enfant quel que soit son âge, même lors d’interventions de courte durée chez des enfants respirant spontanément.
Les données chez l’enfant sont limitées, particulièrement entre 1 mois et 1 an (voir rubrique 5.2).
Nouveau-nés (0 à 27 jours) :
Les paramètres pharmacocinétiques sont très variables chez les nouveau-nés, particulièrement chez les prématurés. La clairance et la liaison aux protéines sont plus faibles et une dose plus faible de RAPIFEN peut être nécessaire. Les nouveau-nés doivent être étroitement surveillés et la dose d’alfentanil doit être adaptée en fonction de la réponse.
Nourrissons et très jeunes enfants (28 jours à 23 mois) :
La clairance peut être supérieure à celle de l’adulte. Il peut être nécessaire d’augmenter la vitesse de perfusion de RAPIFEN pour maintenir l’analgésie.
Enfants (2 à 11 ans) :
La clairance peut être légèrement supérieure chez l’enfant et il peut être nécessaire d’augmenter la vitesse de perfusion.
Adolescents :
Les paramètres pharmacocinétiques de RAPIFEN chez l’adolescent sont similaires à ceux de l’adulte et aucune adaptation posologique spécifique n’est requise.
Recommandations posologiques dans la population pédiatrique :
En raison de la grande variabilité de réponse à l’alfentanil, il est difficile d’établir des recommandations posologiques chez le jeune enfant. Chez l’enfant plus âgé, une dose bolus de 10 à 20 µg/kg convient pour induire une anesthésie (en complément du propofol ou d’une anesthésie par inhalation) ou une analgésie. Des boli supplémentaires d’alfentanil de 5 à 10 µg/kg peuvent être administrés à des intervalles appropriés. Pour maintenir l’analgésie chez l’enfant au cours d’une opération, RAPIFEN peut être administré par perfusion à une vitesse de 0,5 à 2 µg/kg/min. La posologie peut être augmentée ou diminuée en fonction des besoins de chaque patient. En association avec un agent anesthésique par voie intraveineuse, la posologie recommandée est d’environ 1 µg/kg/min.
Les risques de complications respiratoires et de rigidité musculaire peuvent être augmentés lorsque RAPIFEN est administré à des nouveau-nés ou à de très jeunes enfants. Les précautions nécessaires sont détaillées en rubrique 4.4.
Sujet âgé et sujet en mauvaise condition physique
La posologie initiale d'alfentanil sera réduite chez le sujet âgé (> 65 ans) et le sujet en mauvaise condition physique. L’effet de la dose initiale doit être pris en compte avant l’injection de doses supplémentaires.
Mode d’administration
RAPIFEN doit être utilisé sous forme de bolus (interventions de courte durée), de bolus complété par des injections répétées, ou par perfusion (interventions chirurgicales longues et douloureuses).
Ce médicament NE DOIT JAMAIS ÊTRE UTILISÉ dans les cas suivants :
· Hypersensibilité à la substance active ou à l’un des excipients mentionnés à la rubrique 6.1, ou aux morphiniques.
· Dépression respiratoire non assistée.
· Pneumopathie chronique obstructive.
· Myasthénie contre-indiquant l'usage de myorelaxant.
· Association aux morphiniques agonistes-antagonistes ou aux morphiniques antagonistes partiels (voir rubrique 4.5).
4.4. Mises en garde spéciales et précautions d'emploi 
· L'assistance respiratoire doit obligatoirement être prévue ; l'utilisation de doses élevées sera de préférence accompagnée d'un contrôle post-opératoire minutieux de la ventilation. Les antimorphiniques sont, en cas de nécessité, des antagonistes fiables de la dépression respiratoire.
· L'administration d'un anticholinergique (atropine) doit être pratiquée de préférence immédiatement avant l'injection par voie IV pour prévenir les effets cholinergiques.
· Une bradycardie et éventuellement un arrêt cardiaque peuvent survenir dans le cas où le patient a reçu une dose insuffisante d’anticholinergique ou lorsque RAPIFEN est associé à des myorelaxants non vagolytiques.
· Lors de l'induction, l'alfentanil peut induire une rigidité musculaire. Cette rigidité peut être évitée en prenant les mesures suivantes :
o l'administration en injection lente doit être suffisamment lente lorsque l'alfentanil est utilisé à faibles doses ;
o l'administration de benzodiazépines ;
o l'administration de myorelaxants immédiatement avant celle d'alfentanil prévient la rigidité musculaire.
· Des mouvements (myo) cloniques non épileptiques peuvent être observés.
· Pendant l'anesthésie, l'hyperventilation peut modifier les réponses du patient au CO2, entraînant une modification de la ventilation post-opératoire.
· Chez les patients traités par IMAO, il est recommandé d’arrêter le traitement 2 semaines avant toute anesthésie ou intervention chirurgicale.
· L’administration de ce médicament est à éviter avec le crizotinib, l’idélalisib et l’oxybate de sodium, ainsi qu’avec les boissons alcoolisées et les médicaments contenant de l’alcool (voir rubrique 4.5).
· Ce médicament contient 35,4 mg de sodium par ampoule de 10 ml, ce qui équivaut à 1,8 % de l’apport quotidien maximal recommandé par l’OMS de 2 g de sodium pour un adulte. A prendre en compte chez les personnes suivant un régime hyposodé strict.
· Risque lié à l'utilisation concomitante de médicaments sédatifs tels que les benzodiazépines ou autres médicaments apparentés :
L'utilisation concomitante de RAPIFEN et de sédatifs tels que les benzodiazépines ou autres médicaments apparentés peut entraîner une sédation, une dépression respiratoire, un coma et la mort. En raison de ces risques, la prescription concomitante avec ces médicaments sédatifs doit être réservée aux patients pour lesquels d'autres options thérapeutiques ne sont pas possibles. Si la décision de prescrire RAPIFEN en même temps que des médicaments sédatifs est prise, la dose efficace la plus faible doit être utilisée et la durée du traitement doit être aussi courte que possible.
Les patients doivent être suivis de près pour surveiller la survenue de signes et symptômes de dépression respiratoire et de sédation.
À cet égard, il est fortement recommandé d'informer les patients et leurs soignants afin qu’ils connaissent ces symptômes (voir rubrique 4.5).
Précautions d’emploi
· En cas d'hypovolémie non corrigée ou d'insuffisance cardiaque non compensée, la dose d'induction devra être adaptée et administrée lentement afin d'éviter une dépression cardiovasculaire souvent majorée par l'administration concomitante d'autres drogues anesthésiques.
· L'administration d'alfentanil en bolus IV rapides doit être évitée chez les patients présentant des troubles de la circulation intracérébrale : chez ces patients, une diminution transitoire de la pression artérielle a parfois été associée à une réduction de courte durée de la pression cérébrale de perfusion.
· Les patients sous traitement morphinique chronique ou présentant des antécédents de toxicomanie aux morphiniques peuvent nécessiter des doses plus élevées.
· Chez le sujet âgé et chez l'obèse, ainsi qu'au cours d'une utilisation en perfusion d'une durée supérieure à 3 heures, la demi-vie terminale pourra être allongée : il conviendra d'en tenir compte au cours de l'administration du médicament.
· En cas d’insuffisance rénale, la surveillance post-opératoire doit être prolongée et la posologie doit être déterminée avec prudence.
· En cas d'insuffisance hépatique, étant donné que le métabolisme de l'alfentanil est presque exclusivement hépatique, sa durée d'action peut être prolongée. En conséquence, la surveillance post-opératoire doit être prolongée et les doses devront être réduites quand 40 µg/kg sont atteints.
· Chez les patients alcooliques, la surveillance post-opératoire doit être prolongée et la posologie doit être déterminée avec prudence.
· En cas d'insuffisance respiratoire chronique, la surveillance pendant et après administration d'alfentanil devra être accrue.
· En cas d'hypothyroïdie non contrôlée, de rares cas de chutes tensionnelles ont été rapportés. En conséquence, la dose initiale sera diminuée et la surveillance post-opératoire doit être prolongée.
Pharmacodépendance et risque d’usage abusif
L’administration répétée d’opioïdes peut développer une tolérance, une dépendance physique et une dépendance psychologique. Les risques sont accrus chez les patients ayant des antécédents personnels ou familiaux d’abus de substance (y compris l’abus de drogue ou de médicament ou d’alcool) ou souffrant de maladie mentale (p. ex. dépression majeure). Par conséquent, il est possible qu’une dose plus élevée de Rapifen soit nécessaire pour produire le même résultat.
La dépendance physique peut entraîner des symptômes de sevrage aigus après une interruption abrupte ou une importante réduction de la dose d’opioïdes.
Le alfentanil peut faire l’objet d’abus de manière similaire à d’autres agonistes opioïdes. L’abus ou le mésusage intentionnel de Rapifen peut entraîner un surdosage et/ou le décès. Les personnes à risque accru d’un abus d’opioïdes peuvent tout de même être traitées de manière appropriée par Rapifen.
Hyperalgésie induite par les opioïdes
L’hyperalgésie induite par les opioïdes (HIO) est une réaction paradoxale à un opioïde, en particulier à des doses élevées ou en cas d’utilisation chronique, dans laquelle la perception de la douleur augmente malgré une exposition aux opioïdes stable ou accrue. Elle est différente de la tolérance, pour laquelle des doses d’opioïdes plus élevées sont nécessaires pour atteindre le même effet analgésique ou traiter la douleur récurrente. L’HIO peut se manifester par des niveaux de douleur accrus, une douleur plus généralisée (c.-à-d. moins focale), ou une douleur générée par des stimuli ordinaires, c.-à-d. non douloureux (allodynie), sans preuve de progression de la maladie. Lorsqu’une HIO est suspectée, la dose des opioïdes doit être réduite ou arrêtée progressivement, si possible.
Population pédiatrique
Le risque de complications respiratoires lorsque l’alfentanil est administré à des nouveau-nés ou à de très jeunes enfants peut être supérieur au risque chez les enfants plus âgés et les adultes. Pour cette raison, les jeunes enfants doivent être surveillés immédiatement après que l’administration d’alfentanil ait débuté.
Du matériel permettant une ventilation assistée doit toujours être disponible lors de l’utilisation chez l’enfant quel que soit son âge, même lors d’interventions de courte durée chez des enfants respirant spontanément.
Si l’alfentanil est utilisé chez le nouveau-né ou le jeune enfant, l’utilisation simultanée d’un myorelaxant doit être envisagée compte tenu du risque de rigidité musculaire. Tous les enfants doivent être surveillés durant une période suffisante après l’arrêt du traitement par l’alfentanil afin de s’assurer du retour à une respiration spontanée.
En raison de la variabilité de la pharmacocinétique chez les nouveau-nés, une dose plus faible d’alfentanil peut être requise. Les nouveau-nés doivent être étroitement surveillés et la dose d’alfentanil doit être adaptée en fonction de la réponse (voir rubrique 4.2).
4.5. Interactions avec d'autres médicaments et autres formes d'interactions 
Associations contre-indiquées (voir rubrique 4.3)
+ Morphiniques agonistes-antagonistes : nalbuphine, buprénorphine
Diminution de l'effet antalgique par blocage compétitif des récepteurs, avec risque d'apparition d'un syndrome de sevrage
+ Morphiniques antagonistes partiels : nalméfène, naltrexone
Risque de diminution de l’effet antalgique.
Associations déconseillées (voir rubrique 4.4)
+ Consommation d’alcool
Majoration par l'alcool de l'effet sédatif des analgésiques morphiniques. L'altération de la vigilance peut rendre dangereuses la conduite de véhicule et l'utilisation des machines.
La consommation concomitante d’alcool avec RAPIFEN chez les patients respirant spontanément peut augmenter le risque de dépression respiratoire, de sédation profonde, de coma ou de mort.
Eviter la prise de boissons alcoolisées et de médicaments contenant de l'alcool.
+ Crizotinib
Risque de majoration de la toxicité de l’alfentanil par diminution de son métabolisme et/ou augmentation de sa biodisponibilité par le crizotinib.
+ Oxybate de sodium
Majoration de la dépression centrale. L’altération de la vigilance peut rendre dangereuses la conduite de véhicules et l’utilisation de machines.
+ Idélalisib
Augmentation des concentrations plasmatiques d’alfentanil par diminution de son métabolisme hépatique par l’idélalisib.
Associations faisant l’objet de précautions d’emploi
+ Cimétidine
Avec la cimétidine utilisée à des doses supérieures ou égales à 800 mg/j : augmentation de l'effet dépresseur respiratoire de l'analgésique opiacé par diminution de son métabolisme hépatique.
Adapter la posologie de l'alfentanil en cas de traitement par la cimétidine.
+ Diltiazem, érythromycine, fluconazole
Augmentation de l'effet dépresseur respiratoire de l'analgésique opiacé par diminution de son métabolisme hépatique.
Adapter la posologie de l'alfentanil en cas de traitement par : diltiazem, érythromycine, fluconazole.
+ Inhibiteurs puissants du CYP3A4 (clarithromycine, érythromycine, télithromycine, kétoconazole, itraconazole, voriconazole, posaconazole, ritonavir, nelfinavir))
Augmentation de l'effet dépresseur respiratoire de l'analgésique opiacé par diminution de son métabolisme hépatique.
Surveillance clinique et adaptation de la posologie de l'analgésique opiacé en cas de traitement par un inhibiteur puissant du CYP3A4.
Associations à prendre en compte
Médicaments sédatifs
Il faut prendre en compte le fait que de nombreux médicaments ou substances peuvent additionner leurs effets dépresseurs du système nerveux central et contribuer à diminuer la vigilance. Il s’agit des dérivés morphiniques (analgésiques, antitussifs et traitements de substitution), des neuroleptiques, des barbituriques, des benzodiazépines, des anxiolytiques autres que les benzodiazépines (par exemple, le méprobamate), des hypnotiques, des antidépresseurs sédatifs (amitryptiline, doxépine, miansérine, mirtazapine, trimipramine), des antihistaminiques H1 sédatifs, des antihypertenseurs centraux, du baclofène et du thalidomide.
Les médicaments tels que les barbituriques, les benzodiazépines ou des médicaments apparentés, les neuroleptiques, les anesthésiques généraux et d'autres médicaments sédatifs peuvent majorer la dépression respiratoire due aux opioïdes. Chez les patients ayant reçu des médicaments sédatifs, il peut être nécessaire de réduire la dose de RAPIFEN par rapport à la dose usuelle.
L’utilisation concomitante de médicaments sédatifs avec RAPIFEN chez les patients respirant spontanément peut augmenter le risque de dépression respiratoire, de sédation profonde, de coma ou de mort (voir rubrique 4.4).
En cas d’utilisation de médicaments sédatifs après administration de RAPIFEN, la dose de ces médicaments doit être réduite. Ceci est particulièrement important après une intervention chirurgicale, car une anesthésie profonde est accompagnée d’une dépression respiratoire marquée, pouvant persister ou se répéter en période post-opératoire. L’administration d’un médicament sédatif, tel qu’une benzodiazépine ou des médicaments apparentés, durant cette période peut considérablement augmenter le risque de dépression respiratoire (voir rubrique 4.4).
Concernant l’interaction avec l’alcool, voir le paragraphe « association déconseillée » ci-dessus.
+ Autres analgésiques morphiniques agonistes (codéine, dihydrocodéine, fentanyl, hydromorphone, morphine, oxycodone, pethidine, rémifentanil, sufentanil, tramadol).
Risque majoré de dépression respiratoire, pouvant être fatale en cas de surdosage.
+ Antitussifs morphine-like (dextrometorphane, noscapine, pholcodine)
Risque majoré de dépression respiratoire pouvant être fatale en cas de surdosage.
+ Antitussifs morphiniques vrais (codéine, éthylmorphine)
Risque majoré de dépression respiratoire pouvant être fatale en cas de surdosage.
+ Barbituriques
Risque majoré de dépression respiratoire pouvant être fatale en cas de surdosage
+ Benzodiazépines et apparentés
Risque majoré de dépression respiratoire pouvant être fatale en cas de surdosage
+ Médicaments sérotoninergiques
La co-administration de l’alfentanil avec un agent sérotoninergique, comme un inhibiteur sélectif de la recapture de la sérotonine (IRSS) ou un inhibiteur de la recapture de la sérotonine et de la noradrénaline (IRSNa) ou un inhibiteur de la monoamine oxydase (IMAO) peut augmenter le risque de syndrome sérotoninergique, situation pouvant mettre en jeu le pronostic vital.
4.6. Fertilité, grossesse et allaitement 
Grossesse
L’utilisation de l’alfentanil IV en fin de grossesse pendant l’accouchement (y compris par césarienne) n’est pas recommandée car RAPIFEN traverse la barrière placentaire, et peut supprimer la respiration spontanée du nouveau-né. Par analogie avec la morphine et ses dérivés, l'alfentanil est susceptible d'entraîner une dépression respiratoire chez le nouveau-né.
Par conséquent, un antagoniste opioïde doit toujours être disponible pour le nouveau-né. Sa demi-vie pouvant être plus courte que celle de l’alfentanil, des administrations répétées de l’antagoniste opioïde pourront être nécessaires.
Allaitement
RAPIFEN peut être excrété dans le lait maternel. En conséquence, l'allaitement ou l’utilisation de lait maternel exprimé est contre-indiqué pendant les 24 heures suivant l'administration de RAPIFEN.
Fertilité
Aucune donnée de fertilité n’est disponible.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines 
Les effets indésirables sont inclus dans le tableau ci-après qui décrit les effets indésirables rapportés avec RAPIFEN soit au cours des études cliniques (18 essais cliniques portant sur 1157 patients) soit après commercialisation. Les fréquences sont définies de la manière suivante : très fréquent (≥ 1/10), fréquent (≥1/100 à <1/10), peu fréquent (≥1/1000 à <1/100), rare (≥1/10000 à <1/1000) et indéterminé (fréquence ne pouvant être estimée sur la base des données disponibles).
|
Classe de systèmes organes |
Effets indésirables |
|||||
|
Fréquence |
|
|||||
|
Très fréquent (≥ 1/10) |
Fréquent (≥ 1/100 à < 1/10) |
Peu fréquent (≥1/1000 à <1/100) |
Rare (³1/10 000, <1/1 000) |
Indéterminé |
|
|
|
Affections du système immunitaire |
|
|
|
|
Hypersensibilité (incluant réaction anaphylactique, réaction anaphylactoïde et urticaire) |
|
|
Affections psychiatriques |
|
Euphorie |
|
|
|
|
|
Affections du système nerveux |
|
Troubles du mouvement, vertiges, sédation, dyskinésies |
Céphalées, somnolence |
|
Perte de conscience (période post-opératoire), convulsions, myoclonies |
|
|
Affections oculaires |
|
|
|
|
Myosis |
|
|
Affections cardiaques |
|
Bradycardie |
Arythmie |
|
Arrêt cardiaque |
|
|
Affections vasculaires |
|
Hypotension, hypertension |
|
|
|
|
|
Affections respiratoires, thoraciques et médiastinales |
|
Apnée |
Hypercapnie, laryngospasme, dépression respiratoire (incluant une évolution fatale) |
Bronchospasme |
Arrêt respiratoire |
|
|
Affections gastro-intestinales |
Nausées, vomissements |
|
|
|
|
|
|
Affections de la peau et du tissu sous-cutané |
|
|
Dermatite allergique, hyperhidrose |
Prurit |
Erythème, rash |
|
|
Affections musculo-squelettiques et systémiques |
|
Rigidité musculaire |
|
|
|
|
|
Troubles généraux et anomalies au site d'administration |
|
Frissons, douleur au site d’injection |
|
|
Pyrexie, hyperthermie |
|
Population pédiatrique
On s’attend à ce que la fréquence, le type et la sévérité des effets indésirables chez l’enfant soient les mêmes que chez l’adulte, sauf pour les effets indésirables mentionnés ci-dessous.
Des cas de rigidité musculaire légère ou modérée ont été fréquemment observés chez le nouveau-né, alors que le nombre de nouveau-nés inclus dans les études cliniques était faible. Plus rarement, une rigidité sévère et des secousses pouvant être accompagnées de troubles transitoires de la ventilation peuvent se produire, particulièrement avec de fortes doses de RAPIFEN ou lors d’injections intraveineuses rapides.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : www.signalement-sante.gouv.fr.
Symptômes et signes
Symptomatologie de l'intoxication morphinique se manifestant par une dépression respiratoire, allant d'une bradypnée à l'apnée, accompagnée ou non d'une rigidité musculaire.
Traitement
Dans l'éventualité d'un surdosage avéré ou suspecté, la conduite à tenir est la suivante : arrêter l'administration d'alfentanil, assurer la perméabilité des voies aériennes, entreprendre une ventilation assistée ou contrôlée avec une oxygénation et maintenir une fonction cardiovasculaire adaptée. Si la dépression respiratoire est associée à une rigidité musculaire, l'administration d'un curare peut être nécessaire pour faciliter la ventilation assistée ou contrôlée. Le remplissage vasculaire, l'administration de vasopresseurs pour corriger l'hypotension artérielle et d'autres mesures d'assistance des fonctions vitales peuvent être utiles.
En cas de dépression respiratoire sévère et de rigidité musculaire, un antagoniste morphinique, peut être administré par voie intraveineuse à titre d'antidote spécifique.
Le patient doit être étroitement surveillé, la température corporelle et l’apport hydrique doivent être maintenus. Si l’hypotension est sévère ou si elle est persistante, la possibilité d’une hypovolémie doit être envisagée, et dans ce cas, elle doit être contrôlée par l’administration parentérale de fluide approprié.
5. PROPRIETES PHARMACOLOGIQUES 
5.1. Propriétés pharmacodynamiques 
Classe pharmacothérapeutique : ANESTHESIQUES OPIOIDES ; Code ATC : N01AH02
L’alfentanil est un opioïde de synthèse possédant les propriétés pharmacologiques d’un agoniste des récepteurs µ utilisé uniquement par voie intraveineuse.
C’est un analgésique central puissant d'action rapide et brève possédant :
· une puissance analgésique 7 fois moindre que celle du fentanyl ;
· un début d'action très rapide (1/4 du fentanyl) ;
· une durée d'action très courte (1/3 du fentanyl) ;
· une dépression respiratoire dose-dépendante entraînant :
o la ventilation spontanée pour des doses < 12 µg/kg,
o la ventilation assistée avec ou sans intubation pour des doses > 12 µg/kg,
· une durée d'analgésie dose-dépendante de plus longue durée que la dépression respiratoire.
L'alfentanil est compatible avec les agents utilisés habituellement en anesthésie : autres analgésiques, anesthésiques généraux et locaux, neuroleptiques, tranquillisants, curares, ganglioplégiques et substances vasomotrices diverses.
5.2. Propriétés pharmacocinétiques 
Les demi-vies séquentielles de distribution de l’alfentanil varient de 0,4 à 2,2 min et de 8 à 32 min. Le faible degré d'ionisation (11 % à pH = 7,4) contribue significativement à la distribution rapide du produit. Le volume du compartiment central (Vc) varie de 1,27 à 4,81 L et le volume de distribution à l’état d’équilibre (Vdss) varie de 12,1 à 98,2 L.
La liaison aux protéines plasmatiques est d’environ 92 %.
Biotransformation
L’alfentanil est principalement métabolisé par le foie. Seulement 1 % de la dose administrée est retrouvé sous forme inchangée dans l'urine.
Élimination
L’élimination est principalement métabolique.
Les métabolites sont inactifs et 70 à 80 % de ces métabolites sont éliminés dans les urines.
La clairance plasmatique chez les sujets de moins de 40 ans avoisine 356 ml/min, et diminue d’environ 8% par décade au-delà de 40 ans.
L’alfentanil est rapidement éliminé après administration intraveineuse. Des demi-vies d’élimination terminale variant de 83 à 223 minutes ont été observées.
Lorsque l'état d'équilibre est atteint après perfusion, la demi-vie d'élimination demeure inchangée.
Populations particulières
Populations pédiatriques
Les données chez l’enfant sont limitées. Les valeurs des paramètres pharmacocinétiques sont présentées dans le tableau ci-dessous.
|
Paramètres pharmacocinétiques de l’alfentanil chez l’enfant |
|||
|
|
t1/2β |
Cl |
Vdss |
|
Nouveau-nés prématurés (0 à 27 jours) |
0,7-8,8 |
0,9-8,4 |
0,3-1,2 |
|
Nouveau-nés à terme (0 à 27 jours) |
4,1-5,5 |
1,7-3,2 |
0,5-0,8 |
|
Nourrissons et très jeunes enfants |
0,9-1,2 |
7,7-13,1 |
0,4-1,1 |
|
Enfants |
0,7-1,3 |
4,7-10,2 |
0,2-1,0 |
|
Adolescents |
1,1-1,9 |
5,5-7,4 |
0,3-0,6 |
Note : Les données chez le nouveau-né, le nourrisson, le très jeune enfant et l’enfant sont présentées sous forme de fourchettes de valeurs moyennes.
Cl = Clairance ; Vdss = volume de distribution à l’état d’équilibre ; t1/2β = demi-vie dans la phase d’élimination.
La liaison aux protéines est de 75 % chez le nouveau-né et augmente chez l’enfant jusqu’à 85 %.
Les données de pharmacocinétique sur l’utilisation de l’alfentanil chez l’enfant sont limitées. L’alfentanil est métabolisé par le CYP 3A4. L’activité du CYP 3A4 est faible chez le nouveau-né et augmente après la naissance pour atteindre 30 à 40% de l’activité chez l’adulte à l’âge de 1 mois ; cette activité augmente ensuite pour atteindre environ 45% à l’âge de 6 mois 80% à l’âge de 12 mois et atteint les niveaux observés chez l’adulte à l’âge de 6 ans.
Insuffisance hépatique
Après administration IV d’une dose unique de 50 µg/kg en 2 minutes, la demi-vie terminale chez les sujets cirrhotiques est significativement plus longue que dans le groupe contrôle (patients avec une fonction hépatique normale). Le volume de distribution reste inchangé. La fraction libre d’alfentanil est augmentée jusqu’à 18,5 % chez les patients cirrhotiques par rapport au groupe contrôle (11,5 %). Cette augmentation de la fraction libre associée à une réduction de la clairance plasmatique de 3,06 mL/min/kg (groupe contrôle) à 1,60 mL chez les sujets cirrhotiques conduit à un effet clinique prolongé et plus prononcé (voir rubrique 4.4).
Insuffisance rénale
Le volume de distribution et la clairance totale de la fraction libre sont similaires chez les insuffisants rénaux par rapport aux sujets sains. La fraction libre d’alfentanil chez l’insuffisant rénal est augmentée de 12,4 % à 19 % par rapport au groupe contrôle (10,3 % à 11 %). Ceci peut entrainer une augmentation de l’effet clinique de l’alfentanil (voir rubrique 4.4).
5.3. Données de sécurité préclinique 
Chez le rat, le ratio LD50/ED50 pour des niveaux d’analgésie les plus bas est de 1080.
Les études de toxicité à doses répétées, ainsi que des fonctions de reproduction et de génotoxicité de l’alfentanil n’ont montré que des effets toxicologiques correspondant à une exacerbation de l’effet pharmacologique. Ces effets n’ont été observés qu’à des doses comprises entre 2 et 8 fois la dose thérapeutique usuelle humaine.
Chlorure de sodium, eau pour préparations injectables.
5 ans.
Après ouverture : le produit doit être utilisé immédiatement.
6.4. Précautions particulières de conservation 
A conserver à une température inférieure à 25°C.
Pour les conditions de conservation du médicament après première ouverture, voir la rubrique 6.3.
6.5. Nature et contenu de l'emballage extérieur 
Boite de 1 ou 10 ampoules (verre) de 10 ml.
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation 
Vous devez porter des gants de protection lorsque vous ouvrez les ampoules.
1- Maintenir l'ampoule entre le pouce et l'index en laissant dépasser le haut de l'ampoule.
2- De l'autre main, saisir la partie supérieure de l'ampoule, l'index posé contre le col, et le pouce posé sur le point coloré, parallèlement aux anneaux (ou à l'anneau) de couleur.
3- En maintenant le pouce sur le point, casser d'un mouvement sec le haut de l'ampoule en maintenant fermement le corps de l'ampoule dans la main.
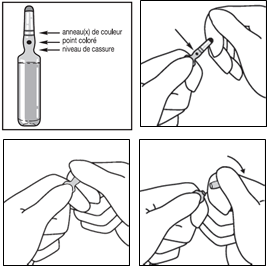
Toute exposition cutanée accidentelle doit donner lieu à un rinçage de la zone exposée à l’eau claire. Evitez d’utiliser du savon, de l’alcool ou tout autre nettoyant pouvant causer une abrasion chimique ou physique de la peau.
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE 
ROUBOSLAAN 32, 2252 TR,
VOORSCHOTEN,
PAYS-BAS
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE 
· 34009 554 606 3 3 : 10 ml en ampoule (verre). Boîte de 1.
· 34009 554 608 6 2 : 10 ml en ampoule (verre). Boîte de 10.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION 
[à compléter ultérieurement par le titulaire]
<Date de première autorisation : {JJ mois AAAA}>
<Date de dernier renouvellement : {JJ mois AAAA}>
10. DATE DE MISE A JOUR DU TEXTE 
[à compléter ultérieurement par le titulaire]
<{JJ mois AAAA}>
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES 
Stupéfiant.
Prescription sur ordonnances sécurisées.
Prescription limitée à 7 jours.
Médicament réservé à l'usage hospitalier.
Médicament pouvant être administré par tout médecin spécialisé en anesthésie-réanimation ou en médecine d’urgence dans les cas où il intervient en situation d’urgence ou dans le cadre d’une structure d’assistance médicale mobile ou de rapatriement sanitaire (article R. 5121-96 du code de la santé publique).
|
| Plan du site | Accessibilité | Contact | Téléchargement | Declaration de confidentialité | Service-Public.fr | Legifrance | Gouvernement.fr |