Dernière mise à jour le 08/01/2026
APOMORPHINE VIATRIS 5 mg/ml, solution injectable
Indications thérapeutiques
Classe pharmacothérapeutique : ANTIPARKINSONIEN DOPAMINERGIQUE - code ATC : N04BC07 (N : Système nerveux)
Indications thérapeutiques : Ce médicament est indiqué dans le traitement de la maladie de Parkinson en complément du traitement par la lévodopa, en cas de fluctuations motrices invalidantes.
Présentations
> 10 ampoule(s) en verre de 10 ml
Code CIP : 34009 301 693 4 6
Déclaration de commercialisation : 19/11/2019
Cette présentation est agréée aux collectivités
- Prix hors honoraire de dispensation : 69,10 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 70,12 €
- Taux de remboursement :65 %
Service médical rendu (SMR)
Amélioration du service médical rendu (ASMR)
Ce médicament étant un générique, l'ASMR n'a pas été évalué par la commission de la transparence (CT), il est possible de se référer à la /aux spécialité(s) de référence du groupe générique auquel appartient ce médicament (cliquez ici pour aller à la rubrique des groupes génériques)
ANSM - Mis à jour le : 14/06/2024
APOMORPHINE VIATRIS 5 mg/ml, solution injectable
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Chlorhydrate d’apomorphine.................................................................................................. 5,0 mg
Pour 1 ml de solution injectable.
Une ampoule de 10 ml contient 50 mg de chlorhydrate d’apomorphine.
Excipient à effet notoire : 1 ml de solution contient 0,5 mg de métabisulfite de sodium (E223).
Pour la liste complète des excipients, voir rubrique 6.1.
Solution limpide
pH 2,5-4,0
osmolalité 20-50 mOsm/kg.
4.1. Indications thérapeutiques
4.2. Posologie et mode d'administration
Sélection de patients candidats au traitement par APOMORPHINE VIATRIS
|
Les patients chez qui le traitement par APOMORPHINE VIATRIS est indiqué doivent pouvoir reconnaître les symptômes annonciateurs de la phase «off» et être capables de se faire leurs injections ou disposer d'un accompagnant capable de faire les injections à leur place si nécessaire. Le traitement par l'apomorphine doit être instauré par un spécialiste. Le patient doit être suivi par un médecin expérimenté dans le traitement de la maladie de Parkinson (neurologue). Le traitement du patient par lévodopa, seule ou en association avec d'autres agonistes dopaminergiques, doit être optimisé avant le début du traitement par APOMORPHINE VIATRIS. Chez les patients traités par l’apomorphine, l’administration de dompéridone doit généralement débuter au moins deux jours avant le début du traitement. La dose de dompéridone doit être ajustée à la dose minimale efficace et le traitement arrêté dès que possible. Avant la décision d’instaurer le traitement par dompéridone et apomorphine, les facteurs de risque d’allongement de l’intervalle QT doivent être évalués soigneusement chez chaque patient afin de s’assurer que le bénéfice est supérieur au risque (voir rubrique 4.4). |
Posologie
Adultes
Perfusion continue
Chez les patients qui ont présenté une bonne réponse sous forme de période « on » au cours du stade d'instauration du traitement par l'apomorphine mais chez qui le contrôle global demeure insuffisant en recourant à des injections intermittentes ou qui nécessitent des injections nombreuses et fréquentes, on peut débuter immédiatement par un traitement par perfusion sous-cutanée continue au moyen d'une minipompe et/ou d'un pousse-seringue ou passer à cette forme de traitement en procédant comme suit :
Le choix de la minipompe et/ou du pousse-seringue à utiliser et les paramètres d'administration requis seront déterminés par le médecin en fonction des besoins spécifiques du patient.
La dose seuil pour la perfusion continue doit être déterminée comme suit :
La perfusion continue débutera à raison de 1 mg de chlorhydrate d'apomorphine (0,2 ml) par heure, après quoi on augmentera chaque jour la vitesse de perfusion en fonction de la réponse individuelle.
L'augmentation de la vitesse de perfusion ne doit pas dépasser 0,5 mg par heure avec des intervalles d'au moins 4 heures.
La perfusion ne doit être administrée que durant les périodes d'éveil.
Une perfusion 24 heures sur 24 est déconseillée, sauf si le patient est confronté à de graves problèmes pendant la nuit.
Une tolérance au traitement ne semble pas apparaître dans la mesure où l'on respecte une période nocturne sans traitement d'au moins 4 heures.
Dans tous les cas, il est nécessaire de changer de site de perfusion toutes les 12 heures.
Les patients peuvent avoir besoin de compléter leur perfusion continue par des bolus intermittents si nécessaire selon les directives du médecin.
Une réduction de la posologie des autres agonistes dopaminergiques peut être envisagée pendant la perfusion continue.
Mise en place du traitement
On peut procéder à des ajustements de la posologie en fonction de la réponse du patient.
La dose optimale de chlorhydrate d'apomorphine varie selon les individus mais, une fois établie, elle demeure relativement constante pour chaque patient.
Précautions pour la poursuite du traitement
Les vitesses de perfusion sont généralement comprises entre 1 et 7 mg/h, avec un maximum de 100 mg par jour.
Dans les études il a été possible de réduire dans une certaine mesure la dose de lévodopa ; cette diminution varie considérablement selon les patients et doit être réalisée avec précaution sous le contrôle d'un médecin expérimenté.
Une fois le traitement établi, chez certains patients on peut réduire progressivement le traitement par dompéridone voire le supprimer complètement, sans vomissements ou hypotension, pour un petit nombre uniquement.
Population pédiatrique
APOMORPHINE VIATRIS est contre-indiquée chez les enfants et les adolescents de moins de 18 ans (voir rubrique 4.3).
Sujets âgés
Les sujets âgés constituent une population importante de patients atteints de la maladie de Parkinson et une proportion importante des sujets inclus dans les études cliniques d'apomorphine. La prise en charge des patients âgés traités par apomorphine ne diffère pas de celle des patients plus jeunes. Une attention particulière est toutefois recommandée chez ces patients lors de l'instauration du traitement en raison des risques d'hypotension orthostatique.
Insuffisance rénale
Un schéma posologique similaire à celui recommandé pour les adultes et les sujets âgés peut être utilisé chez les patients atteints d'insuffisance rénale.
Mode d’administration
APOMORPHINE VIATRIS est destinée à être utilisée sans dilution sous forme de perfusion sous-cutanée à l'aide d'une mini pompe et/ou d'un pousse-seringue.
L’apomorphine ne doit pas être utilisée par voie intraveineuse.
Ce médicament est contre indiqué en cas de :
· hypersensibilité à la substance active ou à l’un des excipients mentionnés à la rubrique 6.1,
· enfants et adolescents âgés de moins de 18 ans,
· insuffisance hépatique,
· dépression respiratoire,
· démence,
· confusion mentale,
· manifestations psychotiques,
· association aux neuroleptiques antiémétiques (voir rubrique 4.5),
· utilisation concomitante avec l’ondansétron (voir rubrique 4.5).
4.4. Mises en garde spéciales et précautions d'emploi
Une somnolence a été rapportée lors du traitement par apomorphine et des cas d'accès de sommeil d'apparition soudaine lors du traitement par agonistes dopaminergiques particulièrement chez les patients atteints de maladie de Parkinson. Les patients doivent être informés de la possibilité de survenue de ces effets (voir section 4.7).
L'apomorphine doit être utilisée avec prudence en cas d'antécédents de troubles psychiques après administration d'antiparkinsoniens, d'affections cardiovasculaires récentes et sévères.
Des cas d’anémie hémolytique ont été signalés chez les patients traités par lévodopa et apomorphine. Des examens hématologiques devront être réalisés à intervalles réguliers, en cas d’association de lévodopa à l’apomorphine.
L’apomorphine, en particulier à doses élevées, pouvant augmenter le risque d’allongement de l’intervalle QT, la prudence s’impose lors du traitement de patients présentant un risque d’arythmie de type torsades de pointe.
En cas d’utilisation en association avec la dompéridone, les facteurs de risque doivent être évalués soigneusement chez chaque patient. Cela doit être fait avant le début du traitement et pendant le traitement. Les facteurs de risque importants comprennent les affections cardiaques sous-jacentes telles que l’insuffisance cardiaque congestive, l’insuffisance hépatique sévère ou les déséquilibres électrolytiques significatifs. De plus, un traitement ayant un effet possible sur l’équilibre électrolytique, le métabolisme par le CYP3A4 ou l’intervalle QT doit être évalué. La surveillance d’un effet sur l’intervalle QTc est recommandée. Un ECG doit être réalisé :
· avant le traitement par la dompéridone,
· pendant la phase d’instauration du traitement,
· lorsqu'il est cliniquement indiqué par la suite.
Le patient doit être informé qu’il doit signaler les symptômes cardiaques éventuels incluant palpitations, syncope ou lipothymie. Ils doivent également signaler les modifications cliniques susceptibles d’entraîner une hypokaliémie telles que gastro-entérite ou instauration d’un traitement diurétique.
Lors de chaque consultation, les facteurs de risque doivent être réévalués.
Les troubles digestifs et l'hypotension orthostatique seront prévenus par l'administration de dompéridone par voie orale. Il existe une légère augmentation du risque d'effets indésirables cardiaques graves liés à l'utilisation de la dompéridone. Ce risque a particulièrement été observé chez les patients âgés de plus de 60 ans, chez les patients traités par une dose quotidienne de dompéridone de plus de 30 mg, ou en cas de prise concomitante de médicaments qui allongent l'intervalle QT ou d'inhibiteurs du cytochrome P450 3A4 (voir rubriques 4.2 et 4.5).
En cas de perfusion sous-cutanée continue, une réduction de la posologie des autres médicaments dopaminergiques doit être prévue.
En raison de la possibilité de survenue de nodules sous-cutanés inflammatoires chez les patients en perfusion continue, le site de perfusion doit être changé toutes les 12 heures environ. Les sites d'injection possibles sont : abdominal antérieur, dorsal sous- ou sub-scapulaire, face antéro-latérale des cuisses, épaules. L'injection doit être faite en sous-cutanée profonde.
Les effets sous-cutanés locaux peuvent parfois être atténués par la rotation des sites d’injection ou, éventuellement, par l’utilisation d’ultrasons (le cas échéant) dans les zones présentant des nodules et des indurations.
En plus des nodules sous-cutanés, d’autres réactions au site d’injection de type panniculite ont également été rapportées (voir paragraphe 4.8).
Troubles du contrôle des impulsions
Les patients doivent être contrôlés régulièrement en cas de développement des troubles du contrôle des impulsions. Les patients et les personnes qui les soignent doivent prendre conscience que les symptômes du comportement dans les troubles du contrôle des impulsions comprenant le jeu pathologique, l’augmentation de la libido, l’hypersexualité, les dépenses et achats compulsifs, la frénésie alimentaire, la boulimie peuvent apparaître chez des patients traités avec des agonistes de la dopamine et/ou d’autres traitements dopaminergiques contenant de la lévodopa, y compris l’association lévodopa-bensérazide. Il convient de revoir le traitement en cas d’apparition de ces symptômes.
Chez certains patients traités par apomorphine, il a été observé des cas de syndrome de dysrégulation dopaminergique (SDD). Le syndrome de dysrégulation dopaminergique (SDD) est un trouble de l’addiction résultant en une utilisation excessive du produit. Aussi, avant l’instauration du traitement, les patients et les aidants doivent être avertis du risque potentiel de survenue de ce type de syndrome.
Mise en garde :
Ce médicament contient du métabisulfite de sodium (E223) et peut, dans de rares cas, provoquer des réactions d’hypersensibilité sévères et des bronchospasmes (voir rubrique 4.8).
Ce médicament contient moins de 1 mmol (23 mg) de sodium par ampoule, c.-à-d. qu’il est essentiellement « sans sodium ».
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
+ Neuroleptiques antiémétiques
Antagonisme réciproque entre le dopaminergique et le neuroleptique.
Utiliser un antiémétique dénué d'effets extrapyramidaux.
L'utilisation concomitante d'apomorphine et d'ondansétron peut entraîner une hypotension sévère et une perte de conscience et est par conséquent contre-indiquée (voir section 4.3). De tels effets peuvent également se produire avec d'autres antagonistes 5-HT3.
Associations déconseillées
Il est recommandé d'éviter l'association d'apomorphine avec d'autres médicaments qui allongent l'intervalle QT.
+ Neuroleptiques antipsychotiques (sauf clozapine)
Antagonisme réciproque du dopaminergique et des neuroleptiques.
Le dopaminergique peut provoquer ou aggraver les troubles psychotiques. En cas de nécessité d'un traitement par neuroleptiques chez le patient parkinsonien traité par dopaminergique, ces derniers doivent être diminués progressivement jusqu'à l'arrêt (l'arrêt brutal des dopaminergiques expose à un risque de «syndrome malin des neuroleptiques»).
+ Tétrabenazine
Antagonisme réciproque entre le dopaminergique et la tétrabenazine.
+ Alcool (boisson ou excipient)
Majoration par l'alcool de l'effet sédatif de ces substances. L'altération de la vigilance peut rendre dangereuses la conduite de véhicules et l'utilisation de machines.
Eviter la prise de boissons alcoolisées et de médicaments contenant de l'alcool.
Associations à prendre en compte
+ Autres médicaments sédatifs
Majoration de la dépression centrale. L'altération de la vigilance peut rendre dangereuses la conduite de véhicules et l'utilisation de machines.
+ Dapoxétine
Risque de majoration des effets indésirables, notamment à type de vertiges ou de syncopes.
4.6. Fertilité, grossesse et allaitement
Grossesse
Il n'y a pas de données fiables de tératogenèse chez l'animal.
En clinique, il n'existe pas actuellement de données suffisamment pertinentes pour évaluer un éventuel effet malformatif ou fœtotoxique de l'apomorphine lorsqu'elle est administrée pendant la grossesse.
En conséquence, l'utilisation de ce médicament est déconseillée chez la femme enceinte, même si l'âge de la population concernée rend la survenue d'une grossesse improbable.
Ce médicament passant dans le lait maternel, l'allaitement est à éviter pendant l'utilisation de celui-ci.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Très fréquent (³1/10)
Fréquent (³1/100, <1/10)
Peu fréquent (³1/1 000, <1/100)
Rare (³1/10 000, <1/1 000)
Très rare (<1/10 000)
Fréquence indéterminée (ne peut être estimée sur la base des données disponibles)
Les principaux effets indésirables sont liés à la stimulation des récepteurs dopaminergiques.
Affections hématologiques et du système lymphatique :
· Rare : éosinophilie.
· Fréquence indéterminée : des cas d’anémie hémolytique ont été signalés chez les patients traités à l’apomorphine.
Affections du système immunitaire :
· Rare : en raison de la présence de métabisulfite de sodium, risque de réactions allergiques, y compris réactions anaphylactiques et bronchospasmes (voir rubrique 4.4).
Affections psychiatriques :
· Très fréquent : hallucinations.
· Fréquent : troubles psychiques (incluant état confusionnel) devant faire réduire la posologie, voire interrompre le traitement.
· Fréquence indéterminée :
o agressivité, agitation,
o troubles du contrôle des impulsions : des jeux pathologiques, une augmentation de la libido, une hypersexualité, des dépenses ou achats compulsifs, une consommation excessive de nourriture et une alimentation compulsive peuvent survenir chez les patients traités par des agonistes dopaminergiques, y compris APOMORPHINE VIATRIS (voir rubrique 4.4).
Affections du système nerveux :
· Fréquent : une somnolence, ainsi que des accès de sommeil ont été rapportés lors du traitement par l'apomorphine. Une somnolence transitoire peut être observée à l'initiation du traitement.
· Fréquence indéterminée : syncope, maux de tête, des dyskinésies pendant les périodes « on ». Ces dyskinésies peuvent être sévères et peuvent entraîner l’arrêt du traitement chez certains patients.
Affections vasculaires :
· Peu fréquent : hypotension orthostatique.
· Fréquence indéterminée : pâleur.
Affections gastro-intestinales :
· Fréquent : nausées, vomissements.
· Fréquence indéterminée : constipations, hypersalivation.
Affection de la peau et des tissus sous cutanés
· Fréquence indéterminée : éruptions cutanées
Troubles généraux et anomalies au site d'administration :
· Réactions au point d'injection :
o Très fréquent : prurit, érythème, nodules, panniculite.
o Peu fréquent : nécroses cutanées.
· Fréquence indéterminée : asthénie, hyperhidrose, œdèmes périphériques.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/ .
· Dépression respiratoire sévère : traitement par la naloxone.
· Bradycardie : traitement par l'atropine.
· Hypotension : traitement symptomatique.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Apomorphine : agoniste dopaminergique stimulant les récepteurs D1 et D2.
Au niveau nigrostrié, en stimulant les récepteurs dopaminergiques post-synaptiques, l'apomorphine exerce une action antiparkinsonienne.
En stimulant les récepteurs dopaminergiques de l'area postrema, elle exerce un puissant effet émétique.
5.2. Propriétés pharmacocinétiques
L'apomorphine est métabolisée par conjugaison avec l'acide glucuronique.
Elle est excrétée dans l'urine, principalement sous forme glucurono-conjuguée.
5.3. Données de sécurité préclinique
3 ans.
6.4. Précautions particulières de conservation
Ce médicament ne nécessite pas de précautions particulières de conservation.
6.5. Nature et contenu de l'emballage extérieur
10 ml de solution injectable en ampoule (verre incolore de type I) ; boîte de 10, 20 et 50.
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
Ne pas utiliser des ampoules présentant une coloration verte.
Ce produit est à manipuler avec précaution car bien qu'incolore, il est sensible à l'oxydation et provoque des taches indélébiles sur les textiles et les revêtements (apparition non-immédiate).
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
1 RUE DE TURIN
69007 LYON
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 301 693 4 6 : 10 ml de solution en ampoule (verre), boîte de 10.
· 34009 301 693 6 0 : 10 ml de solution en ampoule (verre), boîte de 20.
· 34009 301 693 7 7 : 10 ml de solution en ampoule (verre), boîte de 50.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Liste I.
ANSM - Mis à jour le : 14/06/2024
APOMORPHINE VIATRIS 5 mg/ml, solution injectable
Chlorhydrate d’apomorphine
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin, votre pharmacien ou votre infirmier/ère.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, votre pharmacien ou votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que APOMORPHINE VIATRIS 5 mg/ml, solution injectable et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d’utiliser APOMORPHINE VIATRIS 5 mg/ml, solution injectable ?
3. Comment utiliser APOMORPHINE VIATRIS 5 mg/ml, solution injectable?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver APOMORPHINE VIATRIS 5 mg/ml, solution injectable?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE APOMORPHINE VIATRIS 5 mg/ml, solution injectable ET DANS QUELS CAS EST-IL UTILISE ?
Classe pharmacothérapeutique : ANTIPARKINSONIEN DOPAMINERGIQUE - code ATC : N04BC07 (N : Système nerveux)
Indications thérapeutiques : Ce médicament est indiqué dans le traitement de la maladie de Parkinson en complément du traitement par la lévodopa, en cas de fluctuations motrices invalidantes.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER APOMORPHINE VIATRIS 5 mg/ml, solution injectable ?
N’utilisez jamais APOMORPHINE VIATRIS 5 mg/ml, solution injectable :
· si vous êtes allergique à la substance active ou à l’un des autres composants contenus dans ce médicament, mentionnés dans la rubrique 6,
· enfants et adolescents âgés de moins de 18 ans,
· maladie grave du foie,
· dépression respiratoire,
· troubles intellectuels ou psychiatriques graves,
· association avec certains médicaments neuroleptiques utilisés pour la prévention des nausées et vomissements,
· si vous prenez de l'ondansétron (médicament pour traiter les nausées et les vomissements).
En cas de doute, il est indispensable de demander l'avis de votre médecin ou de votre pharmacien.
Avertissements et précautions
Avant le début du traitement par APOMORPHINE VIATRIS, votre médecin fera réaliser un ECG (électrocardiogramme) et vous demandera la liste de tous les autres médicaments que vous prenez. Cet ECG sera répété au cours des premiers jours de votre traitement et à tout moment si votre médecin le juge nécessaire. Il vous interrogera également sur les autres maladies que vous pouvez présenter, en particulier les affections cardiaques. Certaines questions et investigations pourront être répétées lors de chaque consultation. Si vous présentez des symptômes pouvant être d'origine cardiaque, par exemple palpitations, évanouissement ou malaise avec sensation de perte de connaissance imminente, vous devez le signaler immédiatement à votre médecin. De plus, en cas de diarrhée ou si vous commencez un nouveau traitement, cela doit être signalé à votre médecin.
En cas de somnolence excessive ou d'accès de sommeil d'apparition soudaine lors de votre traitement par APOMORPHINE VIATRIS, vous devez contacter votre médecin.
Prévenir votre médecin en cas de maladie du cœur grave et récente, de troubles psychiques par le passé lors de la prise de médicaments antiparkinsoniens.
Prévenir votre médecin si vous ou quelqu'un de votre famille présente une anomalie de l'électrocardiogramme (ECG) appelée « syndrome du QT long ».
Les troubles digestifs et l’hypotension provoqués par l'apomorphine peuvent être évités par la prise de dompéridone. La dompéridone doit être utilisée à la dose efficace la plus faible (la dose maximale quotidienne étant de 30 mg), pour une période la plus courte possible. La dompéridone doit être arrêtée progressivement dès que possible et la durée maximale de traitement ne doit généralement pas dépasser une semaine. Conformez-vous aux instructions de votre médecin.
Lors du recours à la perfusion sous-cutanée, la dose des autres médicaments antiparkinsoniens de la même classe peut être diminuée et adaptée à chaque cas.
En raison de la possibilité de survenue de nodules sous-cutanés inflammatoires, il est préférable de changer de site d'injection toutes les 12 heures environ.
En plus des nodules sous-cutanés, d’autres réactions au site d’injection de type panniculite ont également été rapportées.
Parlez à votre médecin si vous ou votre famille/votre accompagnant notez que vous développez des besoins urgents ou des envies d’agir de manière inhabituelle et que vous ne pouvez pas résister à l’impulsion, la motivation ou à la tentation de mener certaines activités qui peuvent être nuisibles pour vous ou pour les autres. Ces comportements sont appelés troubles du contrôle des impulsions et ils peuvent inclure une dépendance au jeu, le fait de manger ou dépenser en quantités excessives, un comportement sexuel anormalement élevé ou une augmentation des pensées ou sentiments de type sexuel. Votre médecin devra éventuellement revoir votre traitement.
Vous pouvez présenter des symptômes pouvant s’apparenter à de l’addiction qui vous amènent à ressentir un besoin irrépressible de prendre le traitement APOMORPHINE VIATRIS de façon excessive ainsi que d’autres médicaments utilisés dans le traitement de la maladie de Parkinson.
Ce médicament contient du métabisulfite de sodium et peut, dans de rares cas, provoquer des réactions d’hypersensibilité sévères et des bronchospasmes.
Ce médicament contient moins de 1 mmol de sodium par ampoule ou cartouche, c.-à-d. qu’il est essentiellement « sans sodium ».
En cas de doute, ne pas hésiter à demander l'avis de votre médecin ou de votre pharmacien.
Enfants et adolescents
Sans objet.
Autres médicaments et APOMORPHINE VIATRIS 5 mg/ml, solution injectable
L'utilisation de ce médicament est déconseillée en association avec :
· Les neuroleptiques (sauf clozapine) : médicaments utilisés dans les traitements de l'agitation, de l'anxiété et des symptômes psychotiques,
· La tétrabenazine,
· Les médicaments contenant de l'alcool,
· Des médicaments qui peuvent modifier votre rythme cardiaque. Ces médicaments peuvent être utilisés notamment pour traiter des troubles de la conduction cardiaque (comme la quinidine ou l'amiodarone), pour traiter la dépression (y compris les antidépresseurs tricycliques comme l'amitriptyline et l'imipramine) ou pour traiter des infections bactériennes (antibiotiques de la famille des « macrolides » comme l'érythromycine, l'azithromycine et la clarithromycine).
Avant d’utiliser ce médicament, demandez l'avis à votre médecin ou pharmacien si vous prenez :
· Des médicaments sédatifs,
· La dapoxétine.
Si vous prenez de l'ondansétron (médicament pour traiter les nausées et les vomissements), car cela peut entraîner une chute importante de la pression artérielle et une perte de conscience.
Informez votre médecin ou votre pharmacien si vous prenez, avez récemment pris ou pourriez prendre tout autre médicament, notamment les traitements utilisés pour la prévention des nausées et vomissements même s'il s'agit d'un médicament obtenu sans ordonnance.
Si vous prenez de la lévodopa (un autre médicament de la maladie de Parkinson) en même temps que l'apomorphine, votre médecin devra demander des analyses sanguines régulières.
APOMORPHINE VIATRIS 5 mg/ml, solution injectable avec des aliments, boissons et de l’alcool
La prise de boissons alcoolisées avec ce médicament est déconseillée.
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin ou pharmacien avant de prendre ce médicament.
Grossesse
L'utilisation de ce médicament est déconseillée pendant la grossesse.
Allaitement
L'allaitement est à éviter pendant l'utilisation de ce médicament.
Demandez conseil à votre médecin ou à votre pharmacien avant de prendre tout médicament.
Conduite de véhicules et utilisation de machines
L'attention des conducteurs de véhicules ou des utilisateurs de machines est attirée sur la possibilité de somnolence attachée à l'utilisation de ce médicament. Ne pas conduire sans l'avis d'un professionnel de santé.
Niveau 2 : Soyez très prudent. Ne pas conduire sans l'avis d'un professionnel de santé.
APOMORPHINE VIATRIS 5 mg/ml, solution injectable contient du métabisulfite de sodium (E223)
Ce médicament contient du métabisulfite de sodium (E223) et peut provoquer des réactions allergiques sévères et une gêne respiratoire.
Ce médicament contient moins de 1 mmol (23 mg) de sodium par ampoule, c.-à-d. qu’il est essentiellement « sans sodium ».
3. COMMENT UTILISER APOMORPHINE VIATRIS 5 mg/ml, solution injectable?
Avant votre traitement par APOMORPHINE VIATRIS, votre médecin s’assurera que vous tolérez le médicament et un médicament antiémétique que vous devrez prendre en même temps.
Posologie
La posologie est définie par votre médecin en fonction de vos besoins. Elle est adaptée en fonction de la réponse clinique.
Si vous avez l'impression que l'effet d’APOMORPHINE VIATRIS 5 mg/ml, solution injectable est trop fort ou trop faible, consultez votre médecin ou votre pharmacien.
Voie sous-cutanée : perfusion sous-cutanée continue.
Ne pas administrer par voie intraveineuse.
Les ampoules sont munies d’un système d’ouverture OPC (One point Cut) et doivent être cassées selon les instructions suivantes :
Bas de l’ampoule Tête de l’ampoule

· Tapoter doucement sur la tête de l’ampoule avec le doigt pour faire descendre la solution dans le bas de l’ampoule.
· Tenir fermement le bas de l’ampoule, le point coloré face à vous, l’ampoule inclinée sur le côté (voir figure 1).
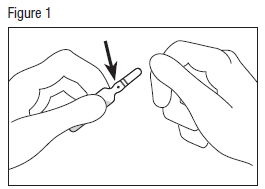
· Saisir la tête de l’ampoule avec l’autre main, entre le pouce et l’index (le pouce sur le point coloré), puis exercer une pression vers l’extérieur, d’un mouvement sec (voir figure 2).
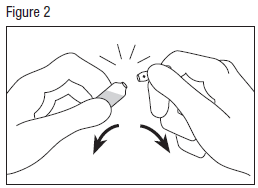
Il est possible d’utiliser un mouchoir ou une compresse comme protection.
· Vérifier l’absence de particules de verre dans la solution contenue dans l’ampoule.
· Les bords en verre au niveau de l'ouverture peuvent être tranchants, soyez prudent lorsque vous manipulez l'ampoule.
Fréquence d'administration et durée du traitement
Dans tous les cas, se conformer strictement à la prescription médicale.
Si vous avez utilisé plus d’APOMORPHINE VIATRIS 5 mg/ml, solution injectable que vous n’auriez dû
Consultez immédiatement votre médecin ou votre pharmacien.
Si vous oubliez d’utiliser APOMORPHINE VIATRIS 5 mg/ml, solution injectable
Demandez l’avis de votre médecin.
Si vous arrêtez d’utiliser APOMORPHINE VIATRIS 5 mg/ml, solution injectable
Sans objet.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Effets indésirables très fréquents (rapportés chez plus de 1 patient sur 10) :
· hallucinations (voir, entendre ou sentir des choses qui n’existent pas),
· réactions au point d'injection : prurit, érythème, nodules, lésions d'inflammation (panniculite).
Effets indésirables fréquents (rapportés chez moins de 1 patient sur 10) :
· nausées, vomissements,
· une somnolence, ainsi que des accès de sommeil ont été rapportés,
· troubles psychiques (confusions).
Effets indésirables peu fréquents (rapportés chez moins de 1 patient sur 100) :
· réactions au point d'injection : nécroses cutanées,
· baisse de la tension artérielle lors du passage de la position couchée à debout (hypotension orthostatique).
Effets indésirables rares (rapportés chez moins de 1 patient sur 1 000) :
· en raison de la présence de sulfites, risque de réactions allergiques sévères et de gêne respiratoire,
· éosinophilie.
Effets indésirables rapportés chez un nombre indéterminé de patients :
· agressivité, agitation,
· évanouissement,
· constipation,
· fatigue, pâleur, salivation, transpiration,
· une somnolence transitoire (effet calmant, sensation d’endormissement) peut être observée à l'initiation de traitement et qui se résout généralement au cours des premières semaines,
· impossibilité de résister aux impulsions, désirs ou tentations de réaliser une activité qui peut être dangereuse pour vous ou pour les autres, y compris :
o une forte impulsion pour les jeux d'argent malgré les graves conséquences personnelles et familiales,
o un intérêt pour la sexualité modifié ou augmenté et un comportement inquiétant pour vous et les autres, par exemple, une augmentation des désirs sexuels,
o des dépenses et achats excessifs et incontrôlés,
o manger de façon excessive (prise de grandes quantités de nourriture dans un court laps de temps) ou manger de façon compulsive (manger plus que la normale et plus que nécessaire pour satisfaire son appétit),
· anémie hémolytique, une destruction anormale des globules rouges dans les vaisseaux sanguins ou ailleurs dans le corps. C'est un effet indésirable qui peut survenir chez des patients qui prennent en même temps de la lévodopa.
· maux de tête,
· des difficultés à contrôler ses mouvements (dyskinésies),
· éruptions cutanées,
· œdème : gonflement notamment des chevilles et des pieds.
Prévenez votre médecin si vous présentez l'un de ces comportements, il/elle vous indiquera la conduite à tenir pour gérer ou réduire les symptômes.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, votre pharmacien ou à votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet: https://signalement.social-sante.gouv.fr/
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER APOMORPHINE VIATRIS 5 mg/ml, solution injectable ?
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur l’emballage et l’ampoule. La date de péremption fait référence au dernier jour de ce mois.
Ce médicament ne nécessite pas de précautions particulières de conservation.
Ne pas utiliser des ampoules présentant une coloration verte.
Ce produit est à manipuler avec précaution car bien qu'incolore, il est sensible à l'oxydation et provoque des tâches indélébiles sur les textiles et les revêtements (apparition non-immédiate).
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient APOMORPHINE VIATRIS 5 mg/ml, solution injectable
· La substance active est :
Chlorhydrate d’apomorphine........................................................................................... 5,0 mg
Pour 1 ml de solution injectable.
· Les autres composants sont :
Métabisulfite de sodium (E223), acide chlorhydrique (pour ajustement du pH), eau pour préparations injectables.
Qu’est-ce que APOMORPHINE VIATRIS 5 mg/ml, solution injectable et contenu de l’emballage extérieur
Ce médicament se présente sous forme d'une solution injectable limpide en ampoule de 10 ml. Boîte de 10, 20 ou 50 ampoules.
Toutes les présentations peuvent ne pas être commercialisées.
Titulaire de l’autorisation de mise sur le marché
1 RUE DE TURIN
69007 LYON
Exploitant de l’autorisation de mise sur le marché
1 RUE DE TURIN
69007 LYON
1 RUE COMTE DE SINARD
26250 LIVRON SUR DROME
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Sans objet.
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France)