Dernière mise à jour le 08/01/2026
TIOTROPIUM VIATRIS 18 microgrammes, poudre pour inhalation en gélule
Indications thérapeutiques
TIOTROPIUM VIATRIS 18 microgrammes, poudre pour inhalation en gélule est un traitement qui a pour objectif d’aider les personnes atteintes de bronchopneumopathie chronique obstructive (BPCO) à respirer plus facilement. La BPCO est une maladie pulmonaire chronique qui provoque des difficultés respiratoires et une toux. Le terme BPCO est associé aux états de bronchite chronique et d’emphysème. La BPCO est une maladie chronique et vous devez donc utiliser TIOTROPIUM VIATRIS 18 microgrammes, poudre pour inhalation en gélule quotidiennement et pas seulement quand vous ressentez une gêne respiratoire ou d'autres symptômes de BPCO.
TIOTROPIUM VIATRIS 18 microgrammes, poudre pour inhalation en gélule est un bronchodilatateur de longue durée d’action qui aide à ouvrir vos bronches pour ainsi faciliter la circulation de l’air dans les poumons. L’utilisation régulière de TIOTROPIUM VIATRIS 18 microgrammes, poudre pour inhalation en gélule peut diminuer l’essoufflement que vous ressentez du fait de votre BPCO et contribue ainsi à diminuer les effets de la maladie sur votre vie de tous les jours. Cela peut vous aider pour poursuivre vos activités quotidiennes. L’utilisation quotidienne de TIOTROPIUM VIATRIS 18 microgrammes permettra également de prévenir l’aggravation soudaine à court terme des symptômes de BPCO qui peuvent se prolonger sur plusieurs jours. La durée d’action de ce médicament est de 24h, vous n'avez donc besoin de l’utiliser qu’une seule fois par jour. Pour assurer un dosage correct de TIOTROPIUM VIATRIS 18 microgrammes, poudre pour inhalation en gélule, veuillez-vous conformer à la rubrique 3. « Comment utiliser TIOTROPIUM VIATRIS 18 microgrammes, poudre pour inhalation en gélule », ainsi qu’aux instructions d’utilisation fournies au verso de la notice.
Présentations
> plaquettes aluminium PVC de 30 gélules avec dispositif d’administration NeumoHaler
Code CIP : 34009 301 671 0 6
Déclaration de commercialisation : 02/11/2021
Cette présentation est agréée aux collectivités
- Prix hors honoraire de dispensation : 15,75 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 16,77 €
- Taux de remboursement :65 %
Service médical rendu (SMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Important | Avis du 09/03/2022 | Inscription (CT) | Le service médical rendu par TIOTROPIUM VIATRIS 18 µg, poudre pour inhalation en gélule (tiotropium) est important dans l’indication de l’AMM. |
Amélioration du service médical rendu (ASMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprés de la HAS (plus d'informations dans l'aide). Les avis et synthéses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur de l'ASMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| V (Inexistant) | Avis du 09/03/2022 | Inscription (CT) | Cette spécialité est un hybride qui n’apporte pas d’amélioration du service médical rendu (ASMR V) par rapport à la spécialité de référence déjà inscrite. |
ANSM - Mis à jour le : 16/12/2021
TIOTROPIUM VIATRIS 18 microgrammes, poudre pour inhalation en gélule
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Chaque gélule contient 21,7 microgrammes de bromure de tiotropium anhydre équivalent à 18 microgrammes de tiotropium.
La dose délivrée à l'embout buccal du dispositif NeumoHaler, est de 12 microgrammes de tiotropium.
Excipient à effet notoire : chaque capsule contient 5,5 milligrammes de lactose (sous forme anhydre).
Pour la liste complète des excipients, voir rubrique 6.1.
Poudre pour inhalation en gélule.
Gélules blanches à blanchâtres avec l’impression T18 à l’encre noire sur la tête et contenant une poudre blanche à blanchâtre.
4.1. Indications thérapeutiques
4.2. Posologie et mode d'administration
Ce médicament est destiné à être utilisé par voie inhalée uniquement.
La posologie recommandée de bromure de tiotropium est l’inhalation du contenu d’une gélule une fois par jour à heure fixe dans la journée (le contenu de la gélule est à inhaler à l'aide du dispositif NeumoHaler).
Ne pas dépasser la dose recommandée. Les gélules de bromure de tiotropium sont destinées à l’inhalation exclusivement et non à la voie orale. Ne pas avaler les gélules.
Le bromure de tiotropium devra être inhalé uniquement à l'aide du dispositif NeumoHaler.
Populations particulières
Sujets âgés
Le bromure de tiotropium peut être utilisé chez les sujets âgés à la dose recommandée.
Insuffisance rénale
Chez les patients atteints d'insuffisance rénale, le bromure de tiotropium peut être utilisé à la dose recommandée. En cas d'insuffisance rénale modérée à sévère (clairance de la créatinine ≤ 50 ml/min) voir rubriques 4.4 et 5.2.
Insuffisance hépatique
Le bromure de tiotropium peut être utilisé à la dose recommandée chez les patients atteints d'insuffisance hépatique (voir rubrique 5.2).
Population pédiatrique
BPCO : Il n'y a pas de justification à l'utilisation de ce médicament dans la population pédiatrique (patients de moins de 18 ans) dans l’indication mentionnée à la rubrique 4.1.
Mucoviscidose : La sécurité et l’efficacité de TIOTROPIUM VIATRIS 18 microgrammes chez les enfants et les adolescents n’ont pas été établies dans cette indication. Aucune étude n’est disponible.
Mode d’administration
Pour une administration correcte du médicament, le médecin ou un autre professionnel devra éduquer le patient au bon usage du dispositif.
Instructions pour la manipulation et l’utilisation
Suivez toujours scrupuleusement les instructions de votre médecin pour utiliser TIOTROPIUM VIATRIS. Le dispositif NeumoHaler est exclusivement conçu pour TIOTROPIUM VIATRIS. Vous ne devez pas l’utiliser pour prendre un autre médicament. Vous pouvez utiliser NeumoHaler jusqu’à ce que vous ayez fini le médicament contenu dans cette boîte (au maximum jusqu’à 3 mois).
|
|
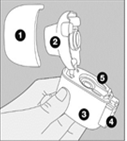
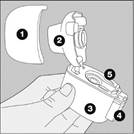
Le dispositif NeumoHaler |
|
1 Capuchon anti-poussière |
|
|
2 Embout buccal |
|
|
3 Base |
|
|
4 Bouton perforateur |
|
|
5 Chambre centrale |
|
|
|
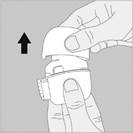
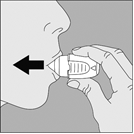
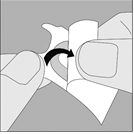
1. Retirez le capuchon anti-poussière. Vérifiez qu’aucun corps étranger ne se trouve dans le canal d’inhalation. |
|
|
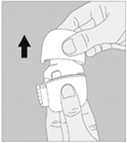
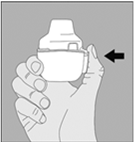
2. Ouvrez l’embout buccal en le tirant vers le haut tout en appuyant sur les deux renfoncements. |
|
|
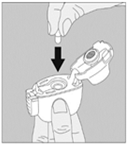
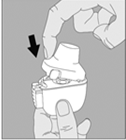
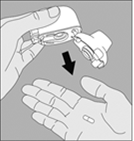
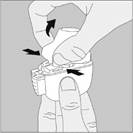
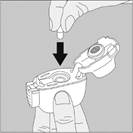
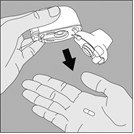
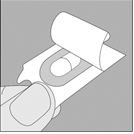
3. Enlevez la gélule de TIOTROPIUM VIATRIS du blister (juste avant l’utilisation, voir l’instruction « Manipulation du blister ») et placez‑la dans la chambre centrale du dispositif NeumoHaler, conformément à l’illustration. La façon dont la gélule est placée dans la chambre centrale importe peu. Ne placez jamais directement la gélule dans l’embout buccal. |
|
|
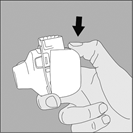
4. Refermez l’embout buccal jusqu’à ce que vous entendiez un clic. |
|
|
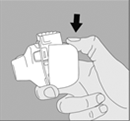
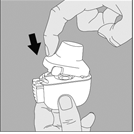
5. Tenez le dispositif NeumoHaler vertical, l’embout buccal dirigé vers le haut et enfoncez complètement le bouton‑perforateur d’une seule pression, puis relâchez. Ceci perfore la gélule et libère le médicament que vous inhalerez lorsque vous inspirerez. |
|
|
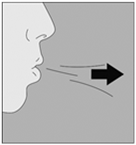
6. Expirez à fond. |
|
Important : ne jamais expirer dans l’embout buccal. |
|
|
|
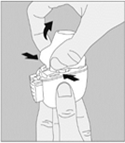
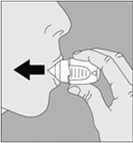
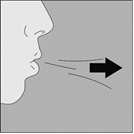
7. Portez le NeumoHaler à votre bouche et refermez fermement les lèvres autour de l’embout buccal. Maintenez la tête droite et inspirez lentement et profondément, à un rythme toutefois suffisant pour que vous entendiez ou sentiez la gélule vibrer. Inspirez jusqu’à remplir complètement vos poumons, puis retenez votre respiration aussi longtemps que vous le pouvez et ôtez le disposition NeumoHaler de votre bouche. |
|
Répétez une fois les étapes 6 et 7, ce qui videra totalement la gélule de son contenu |
|
|
|
8. Ouvrez à nouveau l’embout buccal. Faites tomber la gélule utilisée et jetez‑la. Refermez l’embout buccal et replacez le capuchon anti‑poussière. Assurez‑vous que le capuchon anti‑poussière est bien fermé. |
|
Nettoyage du NeumoHaler |
|
|
Nettoyez votre NeumoHaler une fois par mois. |
|
|
|
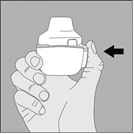
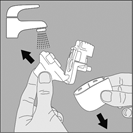
1. Ouvrez le capuchon anti‑poussière et l’embout buccal puis ouvrez la base en appuyant avec votre pouce sur le triangle gravé sous le bouton perforateur, comme le montre la figure ci‑contre. |
|
|
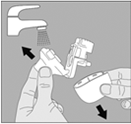
2. Rincez complètement l’inhalateur à l’eau chaude pour enlever toute poudre restante. Séchez soigneusement le NeumoHaler, en absorbant l’excès d’eau sur une serviette en papier, puis laissez sécher à l’air, sans réassembler ces éléments. |
|
Cette opération de séchage à l’air prend 24 heures. Nettoyez‑le donc juste après l’avoir utilisé et il sera prêt pour votre dose suivante. Si nécessaire, nettoyez la surface externe de l’embout buccal avec un chiffon humide mans non mouillé. |
|
|
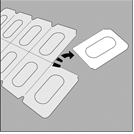
Manipulation du blister |
|
|
|
1. Séparez l’une des alvéoles prédécoupées du reste en détachant selon la perforation. |
|
|
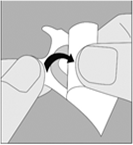
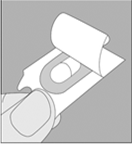
2. Prenez l’alvéole prédécoupée et relevez la feuille protectrice jusqu’à ce qu’une seule gélule devienne complètement visible. |
|
Ne poussez pas la gélule à travers l’aluminium. |
|
|
|
3. Les gélules doivent toujours être stockées dans leur blister et retirées seulement immédiatement avant utilisation. Avec des mains sèches, retirez la gélule du blister. |
|
Ne pas avaler la gélule. |
|
Les gélules de TIOTROPIUM VIATRIS ne contiennent qu’une petite quantité de poudre et ne sont donc que partiellement remplies.
4.4. Mises en garde spéciales et précautions d'emploi
Des réactions d'hypersensibilité immédiate peuvent apparaître après l'administration de bromure de tiotropium sous forme de poudre pour inhalation.
Compte tenu de son activité anticholinergique, le bromure de tiotropium doit être utilisé avec prudence en cas de glaucome à angle fermé, d'hypertrophie de la prostate ou de rétrécissement du col de la vessie (voir rubrique 4.8).
D’une façon générale, l’administration de médicaments par voie inhalée est susceptible de déclencher un bronchospasme.
Le tiotropium doit être utilisé avec prudence chez les patients ayant eu un infarctus du myocarde au cours des six derniers mois, ou une arythmie cardiaque instable ou engageant le pronostic vital ou une arythmie cardiaque nécessitant une intervention ou un changement de thérapie au cours de l’année précédente ; ou chez les patients ayant été hospitalisés pour une insuffisance cardiaque (NYHA classe III ou IV) au cours de l’année précédente. Ces patients ont été exclus des essais cliniques et ces maladies peuvent être affectées par le mécanisme d’action des anticholinergiques.
Les concentrations plasmatiques de bromure de tiotropium augmentent en cas d’altération de la fonction rénale ; par conséquent, chez les patients atteints d'insuffisance rénale modérée à sévère (clairance de la créatinine £ 50 ml/min), le produit ne sera utilisé que si le bénéfice attendu dépasse le risque potentiel. À ce jour, il n'y a pas d'expérience à long terme chez les patients souffrant d'insuffisance rénale sévère (voir rubrique 5.2).
Il conviendra d’avertir les patients du risque de déclenchement ou d’aggravation d'un glaucome à angle fermé, de douleur ou gêne oculaire, de vision floue transitoire avec halo visuel coloré associé à une rougeur et un œdème cornéo-conjonctival, en cas de projection intraoculaire de la poudre. Si une combinaison quelconque de ces symptômes oculaires apparaît, les patients doivent interrompre immédiatement l’utilisation du bromure de tiotropium et consulter immédiatement un médecin.
La sécheresse buccale, observée avec les traitements anticholinergiques en général, peut à long terme favoriser la survenue de caries dentaires.
La posologie du bromure de tiotropium ne doit pas dépasser une prise par jour (voir rubrique 4.9).
TIOTROPIUM VIATRIS gélule contient 5,5 mg de lactose anhydre. Cette quantité ne provoque habituellement pas de problèmes chez les patients intolérants au lactose. Les patients présentant une intolérance au galactose, un déficit total en lactase ou un syndrome de malabsorption du glucose et du galactose (maladies héréditaires rares) ne doivent pas prendre ce médicament.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
La co-administration de bromure de tiotropium avec d'autres médicaments anticholinergiques n'a pas été étudiée et n’est, par conséquent, pas recommandée.
L’utilisation des LABA ou des CSI n’a pas été jugée comme modifiant l’exposition au tiotropium.
4.6. Fertilité, grossesse et allaitement
Grossesse
Il existe des données très limitées sur l’utilisation du tiotropium chez la femme enceinte. Les études effectuées chez l’animal n’ont pas mis en évidence d’effets délétères directs ou indirects sur la reproduction à des doses cliniques significatives (voir rubrique 5.3). Par mesure de précaution, il est préférable d’éviter l’utilisation de TIOTROPIUM VIATRIS pendant la grossesse.
Allaitement
Il n'a pas été établi si le bromure de tiotropium était excrété dans le lait maternel. Malgré des études effectuées chez les rongeurs ayant démontré que le bromure de tiotropium était excrété dans le lait maternel uniquement en petites quantités, l'utilisation de TIOTROPIUM VIATRIS n'est pas recommandée au cours de l'allaitement. Le bromure de tiotropium est un composé à longue durée d'action. La décision de poursuivre ou d'interrompre l'allaitement ou le traitement par TIOTROPIUM VIATRIS doit être prise en tenant compte du bénéfice de l'allaitement chez l'enfant et du bénéfice du traitement par TIOTROPIUM VIATRIS chez la femme.
Fertilité
Aucune donnée clinique sur la fertilité n'est disponible avec le tiotropium. Une étude animale réalisée avec du tiotropium n'a pas montré d'effets indésirables sur la fertilité (voir rubrique 5.3).
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Résumé du profil de sécurité
Un grand nombre des effets indésirables rapportés peuvent être attribués aux propriétés anticholinergiques du tiotropium.
Tableau résumé des effets indésirables
Les fréquences des effets indésirables présentés ci-dessous sont basées sur les taux d'incidence bruts des effets indésirables observés dans les groupes de patients traités par tiotropium (9 647 patients) (c’est-à-dire les événements imputables au tiotropium), à partir du regroupement de 28 études cliniques contrôlées contre placebo dont les durées de traitement étaient comprises entre 4 semaines et 4 ans.
La fréquence est définie selon la classification conventionnelle : très fréquent (≥ 1/10) ; fréquent (≥ 1/100, < 1/10) ; peu fréquent (≥ 1/1 000, < 1/100) ; rare (≥ 1/10 000, < 1/1 000) ; très rare (< 1/10 000) ; fréquence indéterminée (ne peut être estimée sur la base des données disponibles).
|
Classe de systèmes d’organes / Terme MedDRA |
Fréquence |
|
Troubles du métabolisme et de la nutrition |
|
|
Déshydratation |
Indéterminée |
|
Affections du système nerveux |
|
|
Étourdissements |
Peu fréquents |
|
Céphalées |
Peu fréquentes |
|
Dysgueusie |
Peu fréquentes |
|
Insomnie |
Rare |
|
Affections oculaires |
|
|
Vision trouble |
Peu fréquente |
|
Glaucome |
Rare |
|
Augmentation de la pression intraoculaire |
Rare |
|
Affections cardiaques |
|
|
Fibrillation auriculaire |
Peu fréquente |
|
Tachycardie supraventriculaire |
Rare |
|
Tachycardie |
Rare |
|
Palpitations |
Rare |
|
Affections respiratoires, thoraciques et médiastinales |
|
|
Pharyngite |
Peu fréquente |
|
Dysphonie |
Peu fréquente |
|
Toux |
Peu fréquente |
|
Bronchospasme |
Rare |
|
Épistaxis |
Rare |
|
Laryngite |
Rare |
|
Sinusite |
Rare |
|
Affections gastro-intestinales |
|
|
Sécheresse buccale |
Fréquente |
|
Reflux gastro-œsophagien |
Peu fréquent |
|
Constipation |
Peu fréquente |
|
Candidose oropharyngée |
Peu fréquente |
|
Occlusion intestinale, y compris iléus paralytique |
Rare |
|
Gingivite |
Rare |
|
Glossite |
Rare |
|
Dysphagie |
Rare |
|
Stomatite |
Rare |
|
Nausée |
Rare |
|
Caries dentaires |
Indéterminée |
|
Affections de la peau et du tissu sous-cutané, affections du système immunitaire |
|
|
Éruption cutanée |
Peu fréquente |
|
Urticaire |
Rare |
|
Prurit |
Rare |
|
Hypersensibilité (y compris réactions d’hypersensibilité immédiate) |
Rare |
|
Œdème de Quincke |
Rare |
|
Réaction anaphylactique |
Indéterminée |
|
Infection cutanée, ulcération cutanée |
Indéterminée |
|
Peau sèche |
Indéterminée |
|
Affections musculosquelettiques et systémiques |
|
|
Articulations enflées |
Indéterminée |
|
Affections du rein et des voies urinaires |
|
|
Dysurie |
Peu fréquente |
|
Rétention d’urine |
Peu fréquente |
|
Infection urinaire |
Rare |
Description de certains effets indésirables
Dans les essais cliniques contrôlés, les effets indésirables les plus fréquemment observés ont été des effets indésirables de type anticholinergique tels que la sécheresse buccale survenue chez environ 4 % des patients.
Dans 28 essais cliniques, la sécheresse buccale a été à l’origine de 18 arrêts de traitement parmi les 9 647 patients traités par le tiotropium (soit 0,2 % des patients traités).
Les effets indésirables graves attribués aux effets anticholinergiques incluent : glaucome, constipation et occlusion intestinale incluant iléus paralytique, ainsi que rétention urinaire.
Autres populations particulières
L’incidence des effets anticholinergiques peut augmenter avec l’âge.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : www.signalement-sante.gouv.fr.
Cependant, l'inhalation d'une dose unique allant jusqu’à 340 microgrammes de bromure de tiotropium n'a été suivie d'aucun effet indésirable de type anticholinergique systémique chez des volontaires sains. En outre, aucun effet indésirable significatif, hormis la sécheresse buccale, n'a été observé après 7 jours d'administration de doses de bromure de tiotropium allant jusqu'à 170 microgrammes chez des volontaires sains. Aucun effet indésirable significatif n'a par ailleurs été observé lors d’une étude en dose répétée de 4 semaines réalisée chez des patients atteints de BPCO, recevant des doses journalières maximales de 43 microgrammes de bromure de tiotropium.
En cas d'ingestion accidentelle de gélules de bromure de tiotropium, l'intoxication aiguë est peu probable compte tenu de la faible biodisponibilité orale.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Mécanisme d'action
Le bromure de tiotropium est un antagoniste spécifique des récepteurs muscariniques de longue durée d'action, souvent désigné en pratique clinique sous le terme « anticholinergique ». En se fixant aux récepteurs muscariniques des muscles lisses des bronches, le bromure de tiotropium inhibe les effets cholinergiques (bronchoconstriction) de l'acétylcholine, libérée à partir des terminaisons nerveuses parasympathiques. Il possède une affinité similaire pour les sous-types de récepteurs muscariniques M1 à M5. Dans les voies aériennes, le bromure de tiotropium inhibe de façon réversible et compétitive les récepteurs M3, ce qui se traduit par une relaxation. L'effet est dose-dépendant et persiste plus de 24 heures. La longue durée d'action est probablement due à la dissociation très lente des récepteurs M3, la demi-vie de dissociation étant significativement plus longue que celle observée avec l’ipratropium. Anticholinergique N-quaternaire, le bromure de tiotropium exerce un effet sélectif direct au niveau des bronches lorsqu'il est administré par inhalation ; et offre ainsi une marge thérapeutique acceptable avant l’apparition d’effets anticholinergiques systémiques.
Effets pharmacodynamiques
La bronchodilatation est principalement due à un effet local (sur les voies aériennes) et non pas à un effet systémique. Le tiotropium se dissocie plus rapidement des récepteurs M2 que des récepteurs M3, comme le suggèrent les études in vitro, marquant une sélectivité plus importante (exprimée de façon cinétique) pour les récepteurs de type M3 par rapport à M2. La fixation importante et prolongée aux récepteurs explique la bronchodilatation cliniquement significative et de longue durée chez les patients atteints de BPCO.
Électrophysiologie cardiaque
Électrophysiologie : Lors d’une étude spécifique de l’intervalle QT conduite chez 53 volontaires sains, le tiotropium administré à la dose de 18 mcg et 54 mcg (soit trois fois la dose thérapeutique) pendant 12 jours n’a pas augmenté de façon significative l’intervalle QT sur l’électrocardiographe.
Efficacité et sécurité clinique
Le programme de développement clinique comprend quatre études d’un an et deux études de 6 mois, toutes randomisées et en double aveugle, portant sur un total de 2 663 patients, dont 1 308 ont reçu le bromure de tiotropium. Parmi les études menées sur un an, deux étaient contrôlées contre placebo et deux contre comparateur actif (ipratropium) ; les deux études de 6 mois étaient contrôlées contre placebo et salmétérol. Ces études ont inclus des mesures de la fonction pulmonaire et des critères cliniques tels que dyspnée, exacerbations et qualité de vie en rapport avec l’état de santé.
Fonction pulmonaire
Le bromure de tiotropium, en dose unique journalière, a permis d'obtenir une augmentation significative de la fonction pulmonaire [volume expiré maximum lors de la première seconde (VEMS) et capacité vitale forcée (CVF)] dans les 30 minutes suivant la première dose et se maintenant pendant 24 heures. L'état d'équilibre pharmacodynamique a été atteint en une semaine, l’effet bronchodilatateur maximal étant observé dès le troisième jour. Les mesures effectuées quotidiennement par le patient ont montré que le bromure de tiotropium a significativement amélioré le DEP (débit expiratoire de pointe) du matin et du soir. L’activité bronchodilatatrice du bromure de tiotropium s’est maintenue au cours de l'année pendant laquelle le produit était administré, sans épuisement de l'effet.
Une étude clinique randomisée, contrôlée contre placebo, réalisée chez 105 patients atteints de BPCO, a révélé pendant la totalité de l'intervalle de 24 heures entre deux prises, un effet bronchodilatateur par rapport au placebo se maintenant, quel que soit le moment de l'administration, le matin ou le soir.
Études cliniques (jusqu’à 12 mois)
Dyspnée, tolérance à l’effort
Le bromure de tiotropium a significativement amélioré la dyspnée (mesurée d'après l'indice de dyspnée transitionnel de Mahler), cette amélioration se maintenant sur toute la période de traitement.
Le retentissement de l’amélioration de la dyspnée sur la tolérance à l’exercice a été étudié dans deux essais cliniques randomisés, en double aveugle, contrôlés versus placebo chez 433 patients atteints de bronchopneumopathie chronique obstructive (BPCO) modérée à sévère. Lors de ces essais, un traitement de 6 semaines avec le tiotropium a significativement amélioré le temps d’endurance au cours d’un exercice standardisé sur cycloergomètre à 75 % de la puissance maximale, de 19,7 % (essai A) et de 28,3 % (essai B) en comparaison au placebo.
Qualité de vie en rapport avec l’état de santé
Lors d’un essai clinique randomisé, en double aveugle et contre placebo de 9 mois chez 492 patients, le tiotropium a amélioré la qualité de vie telle que déterminée par le score total du questionnaire respiratoire du Saint George’s Hospital (SGRQ). La proportion des patients traités par le tiotropium chez lesquels le score total de ce questionnaire s’est cliniquement amélioré de plus de 4 unités, était de 10,9 % plus élevée que dans le groupe placebo (59,1 % dans le groupe le tiotropium contre 48,2 % dans le groupe placebo (p=0,029)). La différence moyenne entre les groupes était de 4,19 unités (p=0,001 ; intervalle de confiance : 1,69 – 6,68). Les améliorations du score SGRQ étaient de 8,19 unités pour le domaine relatif aux « symptômes », de 3,91 unités pour le domaine « activité » et de 3,61 unités pour le domaine « impact sur la vie quotidienne ». Les améliorations de ces domaines distincts étaient statistiquement significatives.
Exacerbations de BPCO
Dans un essai clinique randomisé, en double aveugle, contrôlé versus placebo chez 1 829 patients atteints de bronchopneumopathie chronique obstructive (BPCO) modérée à très sévère, le bromure de tiotropium a réduit de façon statistiquement significative la proportion de patients présentant des exacerbations de BPCO (de 32,2 % à 27,8 %) et réduit de façon statistiquement significative le nombre d’exacerbations de 19 % (de 1,05 à 0,85 exacerbation par patient par an). De plus, 7,0 % des patients du groupe bromure de tiotropium contre 9,5 % des patients du groupe placebo ont été hospitalisés pour une exacerbation de BPCO (p = 0,056). Le nombre d’hospitalisations dues à la BPCO a été réduit de 30 % (de 0,25 à 0,18 par patient par an).
Un essai de 1 an, randomisé, en double aveugle, double placebo, en groupe parallèle, a comparé l’effet d’un traitement avec TIOTROPIUM VIATRIS 18 microgrammes une fois par jour à celui de salmétérol 50 microgrammes en inhalateur doseur pressurisé deux fois par jour sur la survenue d’exacerbations modérées et sévères chez un total de 7 376 patients atteints de BPCO et ayant des antécédents d’exacerbations durant l’année précédant l'inclusion dans l'étude (cf. tableau ci-dessous).
Tableau 1 : Résumé de l’analyse des exacerbations
|
Critères de jugement |
Tiotropium |
Salmétérol |
Risque relatif (hazard ratio) |
Valeur de p |
|
|
18 microgrammes |
50 microgrammes (inhalateur doseur pressurisé) |
(95 % IC) |
|
|
|
N= 3 707 |
N=3 669 |
|
|
|
Délai (jours) de survenue de la première exacerbation |
187 |
145 |
0,83 |
< 0,001 |
|
(0,77 - 0,90) |
||||
|
Délai de survenue de la première exacerbation sévère (nécessitant une hospitalisation)§ |
- |
- |
0,72 |
< 0,001 |
|
(0,61 - 0,85) |
||||
|
Patients avec ≥ 1 exacerbation, n (%)* |
1 277 (34,4) |
1 414 (38,5) |
0,90 |
< 0,001 |
|
(0,85 - 0,95) |
||||
|
Patients avec ≥ 1 exacerbation sévère (nécessitant une hospitalisation), n (%)* |
262 (7,1) |
336 (9,2) |
0,77 |
< 0,001 |
|
(0,66 - 0,89) |
Le délai (en jours) se réfère au 1er quartile des patients. Le délai a été analysé en utilisant le modèle de régression à effet proportionnel (Cox) avec comme covariables le centre (regroupé) et le traitement (le risque relatif se réfère au rapport de risques : « Hazard ratio »).
§ Le délai a été analysé en utilisant le modèle de régression à effet proportionnel (Cox) avec comme covariables le centre (regroupé) et le traitement. Le délai (en jours) pour le 1er quartile de patients ne peut pas être calculé du fait d’un nombre trop faible de patients présentant une exacerbation sévère.
* Le nombre de patients présentant un événement a été analysé par un test de Cochran-Mantel-Haenszel stratifié par centre regroupé (Le risque relatif se réfère au rapport de risques « Hazard ratio »).
Le délai moyen de survenue de la première exacerbation était supérieur dans le groupe tiotropium comparé au groupe de traitement par salmétérol (187 jours versus 145 jours), avec une réduction du risque de survenue de 17 % (Hazard ratio=0,83 ; Intervalle de confiance (IC) à 95 % : 0,77 à 0,90 ; p< 0,001). Le délai moyen de survenue de la première exacerbation sévère (nécessitant une hospitalisation) était également supérieur dans le groupe tiotropium (Hazard ratio =0,72 ; IC 95 % : 0,61 à 0,85 ; p< 0,001).
Études à long terme (plus d’un an, jusqu’à 4 ans)
Dans un essai clinique de 4 ans, randomisé, en double aveugle, contrôlé versus placebo chez 5 993 patients randomisés (3 006 dans le groupe placebo et 2 987 dans le groupe tiotropium), l’amélioration du VEMS résultant du tiotropium par rapport au placebo est restée constante tout au long de la période d’étude de 4 ans.
Une plus grande proportion de patients ont pris au moins 45 mois de traitement dans le groupe tiotropium par rapport au groupe placebo (63,8 % vs. 55,4 %, p< 0,001). Le taux annuel de déclin du VEMS comparé au placebo a été similaire entre tiotropium et le placebo. Pendant la période de traitement, il a été retrouvé une réduction du risque de mortalité de l’ordre de 16 %. L’incidence de la mortalité a été de 4,79 pour 100 patients-années dans le groupe placebo vs. 4,10 pour 100 patients-années dans le groupe tiotropium (hazard ratio (tiotropium/placebo) = 0,84, intervalle de confiance à 95 % : 0,73 – 0,97). Avec le traitement par tiotropium, la survenue de cas d’insuffisances respiratoires (déclarés en tant qu’événements indésirables) a été plus faible par rapport au groupe placebo de 19 % (2,09 versus 1,68 cas pour 100 patients-années, risque relatif (tiotropium/placebo) =0,81, intervalle de confiance à 95 % : 0,65 – 0,999).
Étude du tiotropium contrôlée par une substance active
Une étude à long terme à grande échelle, randomisée, en double aveugle, contrôlée par une substance active et avec une période d’observation de 3 ans, a été réalisée afin de comparer l’efficacité et la sécurité de bromure de tiotropium poudre pour inhalation et de bromure de tiotropium solution pour inhalation (5 694 patients recevant bromure de tiotropium poudre pour inhalation ; 5 711 patients recevant bromure de tiotropium solution pour inhalation). Les critères principaux d’évaluation ont été le délai de survenue de la première exacerbation de BPCO, le délai de survenue du décès toutes causes confondues et dans une sous-étude (906 patients) le VEMS résiduel (pré-dose).
Le délai avant la première exacerbation de BPCO a été numériquement similaire au cours de l’étude entre bromure de tiotropium poudre pour inhalation et bromure de tiotropium solution pour inhalation (risque relatif (bromure de tiotropium poudre pour inhalation / bromure de tiotropium solution pour inhalation) de 1,02 avec un IC à 95 % : 0,97 à 1,08). Le nombre médian de jours avant la première exacerbation a été de 719 jours pour bromure de tiotropium poudre pour inhalation et de 756 jours pour bromure de tiotropium solution pour inhalation.
L’effet bronchodilatateur de bromure de tiotropium poudre pour inhalation a été maintenu pendant 120 semaines, et a été similaire à celui de bromure de tiotropium solution pour inhalation. La différence moyenne du VEMS résiduel pour bromure de tiotropium poudre pour inhalation versus bromure de tiotropium solution pour inhalation a été de 0,010 L (IC à 95 % : -0,018 à 0,038 ml).
Dans l’étude clinique post-commercialisation comparant bromure de tiotropium solution pour inhalation et bromure de tiotropium poudre pour inhalation, la mortalité toutes causes (incluant le suivi du statut vital) a été similaire (risque relatif tiotropium poudre pour inhalation / tiotropium solution pour inhalation de 1,04 avec un IC à 95 % : 0,91 à 1,19).
Population pédiatrique
L’agence européenne du médicament a accordé une dérogation à l'obligation de soumettre les résultats d’études réalisées avec bromure de tiotropium dans tous les sous-groupes de la population pédiatrique dans le traitement de la BPCO et de la mucoviscidose (voir rubrique 4.2 sur l’usage pédiatrique).
5.2. Propriétés pharmacocinétiques
Le bromure de tiotropium est un ammonium quaternaire non chiral, peu soluble dans l'eau. Il est administré par voie inhalée sous forme de poudre sèche. Après inhalation, la majorité de la dose délivrée se dépose au niveau du tractus digestif et, dans une plus faible mesure, au niveau de l'organe cible, le poumon. De nombreux résultats pharmacocinétiques décrits dans les paragraphes suivants ont été obtenus avec des doses plus élevées que celles recommandées en clinique.
b) Caractéristiques générales de la substance active après l’administration du médicament
Absorption
Après inhalation de poudre sèche chez de jeunes volontaires sains, la biodisponibilité absolue est de 19,5 %, ce qui suggère que la fraction atteignant le poumon présente une biodisponibilité élevée. La biodisponibilité absolue des solutions orales de tiotropium est de 2 à 3 %. Les concentrations plasmatiques maximales de tiotropium ont été observées 5 à 7 minutes après l'inhalation.
À l’équilibre, les concentrations plasmatiques maximales de tiotropium chez les patients souffrant de BPCO ont été de 12,9 pg/ml et ont diminué rapidement selon un modèle à compartiments multiples. Les concentrations plasmatiques minimales à l’équilibre ont été de 1,71 pg/ml.
L’exposition systémique au tiotropium après inhalation par l’inhalateur de poudre sèche a été similaire à celle observée après inhalation de tiotropium par l’inhalateur de solution.
Distribution
La liaison du tiotropium aux protéines plasmatiques est de 72 % et son volume de distribution est de 32 l/kg.
On ne connaît pas les concentrations pulmonaires locales, mais le mode d'administration laisse penser qu'elles sont beaucoup plus élevées. Les études chez le rat ont montré que le bromure de tiotropium ne traverse pas la barrière hémato-encéphalique de façon significative.
Biotransformation
Le métabolisme du bromure de tiotropium est faible. Chez de jeunes volontaires sains, l'excrétion urinaire de la substance non métabolisée atteint 74 % de la dose après une administration intraveineuse. L'ester du bromure de tiotropium est clivé, indépendamment d’un mécanisme enzymatique, en un dérivé alcool (N-méthylscopine) et un dérivé acide (acide dithiénylglycolique), inactifs sur les récepteurs muscariniques. Les études réalisées in vitro sur des microsomes hépatiques et des hépatocytes d'origine humaine montrent qu'une petite partie supplémentaire (< 20 % de la dose administrée par voie intraveineuse) est métabolisée par une réaction d'oxydation dépendante du cytochrome P450 (CYP), puis par conjugaison avec le glutathion, donnant naissance à une série de métabolites de phase II.
Les études in vitro effectuées sur des microsomes hépatiques suggèrent une inhibition du métabolisme par les inhibiteurs du CYP 2D6 (et 3A4), la quinidine, le kétoconazole et le gestodène. Les iso-enzymes CYP 2D6 et 3A4 sont donc impliquées pour une part dans le métabolisme. Il n’a pas été mis en évidence d’effet inhibiteur, même avec des concentrations élevées, sur les iso-enzymes CYP 1A1, 1A2, 2B6, 2C9, 2C19, 2D6, 2E1 ou 3A sur microsomes hépatiques humains.
Élimination
La demi-vie effective du tiotropium est comprise entre 27 et 45 heures chez les patients atteints de BPCO. La clairance totale a été de 880 ml/min après une dose intraveineuse chez de jeunes volontaires sains. Le tiotropium administré par voie intraveineuse est essentiellement éliminé par voie urinaire sous forme inchangée (74 %). Après inhalation de la poudre à l’état d’équilibre par des patients atteints de BPCO, 7 % (1,3 µg) sont excrétés sous forme inchangée par voie urinaire dans les 24h, le reste étant éliminé sous forme inchangée dans les fèces. La clairance rénale du tiotropium est plus élevée que la clairance de la créatinine, reflétant une sécrétion urinaire. Après inhalation chronique quotidienne en une prise par jour chez des patients atteints de BPCO, l'état d'équilibre pharmacocinétique a été atteint au 7e jour, sans accumulation par la suite.
Linéarité/non-linéarité
Le tiotropium montre des propriétés pharmacocinétiques linéaires dans l’intervalle thérapeutique quel que soit la formulation.
c) Caractéristiques selon les patients
Sujets âgés
Comme pour les médicaments excrétés majoritairement par voie rénale, la clairance rénale du tiotropium diminue avec l'âge (365 ml/min chez des sujets atteints de BPCO de moins de 65 ans contre 271 ml/min chez des patients atteints de BPCO âgés de 65 ans ou plus. Cela n’a pas entraîné une augmentation des valeurs de l’ASC0-6,ss ou de la Cmax,SS.
Patients insuffisant rénaux
Après inhalation de la dose quotidienne de tiotropium à l’état d’équilibre chez des patients atteints de BPCO, une insuffisance rénale légère (CLCR 50-80 ml/min) a entraîné des valeurs d’ASC0-6,ss légèrement supérieures (de 1,8 à 30 %) et des valeurs de Cmax,SS similaires par rapport aux patients présentant une fonction rénale normale (CLCR > 80 ml/min).
Chez les patients atteints de BPCO et présentant une insuffisance rénale modérée à sévère (CLCR < 50 ml/min), l'administration intraveineuse de tiotropium a entraîné le doublement de l’exposition totale (augmentation de 82 % de l’ASC0-4h et de 52 % de la Cmax) par rapport aux patients présentant une insuffisance rénale normale, ce qui a été confirmé par la mesure des concentrations plasmatiques après inhalation sous forme de poudre.
Patients insuffisant hépatiques
Il n’est pas attendu de modification significative de la pharmacocinétique du tiotropium en cas d’insuffisance hépatique, dans la mesure où le produit est essentiellement éliminé par voie urinaire (74 % chez le jeune volontaire sain) et métabolisé par simple clivage non enzymatique des liaisons esters en produits pharmacologiquement inactifs.
Patients japonais atteints de BPCO
Dans une comparaison croisée d’études, les concentrations plasmatiques maximales moyennes de tiotropium 10 minutes après l’administration à l’état d’équilibre étaient de 20 % à 70 % supérieures chez les patients japonais atteints de BPCO par rapport aux patients caucasiens après inhalation de tiotropium, mais aucun signal d’une mortalité supérieure ou d’un risque cardiaque augmenté n’a été détecté chez les patients japonais par rapport aux patients caucasiens. Les données pharmacocinétiques disponibles pour les autres races ou origines ethniques sont insuffisantes.
Pédiatrie
Voir rubrique 4.2.
d) Relation(s) entre paramètres pharmacocinétiques et paramètres pharmacodynamiques
Il n'y a pas de relation directe entre les paramètres pharmacocinétiques et la pharmacodynamie du produit.
5.3. Données de sécurité préclinique
De nombreux effets observés dans les études conventionnelles de pharmacologie de sécurité, de toxicité en administration répétée et de toxicité des fonctions de reproduction peuvent s'expliquer par les propriétés anticholinergiques du bromure de tiotropium. Chez l'animal, ont ainsi été observées une diminution de la consommation de nourriture, une réduction de la prise de poids, une sécheresse buccale et nasale, une réduction de la sécrétion de larmes et de salive, une mydriase et une augmentation du rythme cardiaque. D'autres effets notables ont été observés lors des études de toxicité en administration répétée : légère irritation du tractus respiratoire chez le rat et la souris, se manifestant par une rhinite et des altérations de l'épithélium de la cavité nasale et du larynx, et prostatite avec dépôts de substances de type protéinique et lithiases vésicales chez le rat.
Des effets délétères sur la gestation, le développement embryo-fœtal, la parturition ou le développement post-natal n’ont été observés qu'à des doses toxiques pour les mères.
Le bromure de tiotropium n'a pas induit d'effets tératogènes chez le rat et le lapin. Dans une étude de la reproduction et de la fertilité chez le rat, aucun effet indésirable n’a été observé sur la fertilité ou l'accouplement chez les parents et leur descendance aux doses administrées.
Les effets sur l'appareil respiratoire (irritation) et uro-génital (prostatite), ainsi que des effets délétères sur les fonctions de reproduction ont été observés après administration locale ou systémique de doses cinq fois supérieures à la dose thérapeutique. Les études de génotoxicité et de carcinogenèse n’ont pas révélé de risque particulier pour l’Homme.
Contenu de la gélule : lactose (qui contient des protéines de lait).
Enveloppe de la gélule : hypromellose, dioxyde de titane (E171), encre noire.
2 ans.
Jeter le dispositif NeumoHaler après avoir terminé le médicament contenu dans cette boîte (maximum jusqu’à 3 mois).
6.4. Précautions particulières de conservation
À conserver à une température ne dépassant pas 30 °C.
À conserver dans l’emballage d’origine, à l’abri de l’humidité.
6.5. Nature et contenu de l'emballage extérieur
30, 60, 90 gélules sous plaquettes (aluminium/aluminium-PVC) pelables + le dispositf NeumoHaler.
Le dispositif NeumoHaler est dispositif unidose pour inhalation avec un corps et une tête verts et un bouton poussoir blanc fait en plastique (ABS) et en acier inoxydable.
Le dispositif NeumoHaler est emballé/disponible dans chaque boîte en carton.
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
1 RUE DE TURIN
69007 LYON
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 301 671 0 6 : Gélule sous plaquette (Almunium/Aluminium-PVC) avec dispositif d’administration NeumoHaler, boîte de 30.
· 34009 550 610 7 6 : Gélule sous plaquette (Almunium/Aluminium-PVC) avec dispositif d’administration NeumoHaler, boîte de 60.
· 34009 550 610 8 3 : Gélule sous plaquette (Almunium/Aluminium-PVC) avec dispositif d’administration NeumoHaler, boîte de 90.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
Date de première autorisation:{JJ mois AAAA}
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
{JJ mois AAAA}
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Liste I
ANSM - Mis à jour le : 16/12/2021
TIOTROPIUM VIATRIS 18 microgrammes, poudre pour inhalation en gélule
Tiotropium
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin, votre pharmacien ou votre infirmier/ère.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, votre pharmacien ou votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que TIOTROPIUM VIATRIS 18 microgrammes, poudre pour inhalation en gélule et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d'utiliser TIOTROPIUM VIATRIS 18 microgrammes, poudre pour inhalation en gélule ?
3. Comment utiliser TIOTROPIUM VIATRIS 18 microgrammes, poudre pour inhalation en gélule ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver TIOTROPIUM VIATRIS 18 microgrammes, poudre pour inhalation en gélule ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE TIOTROPIUM VIATRIS 18 microgrammes, poudre pour inhalation en gélule ET DANS QUELS CAS EST-IL UTILISE ?
TIOTROPIUM VIATRIS 18 microgrammes, poudre pour inhalation en gélule est un traitement qui a pour objectif d’aider les personnes atteintes de bronchopneumopathie chronique obstructive (BPCO) à respirer plus facilement. La BPCO est une maladie pulmonaire chronique qui provoque des difficultés respiratoires et une toux. Le terme BPCO est associé aux états de bronchite chronique et d’emphysème. La BPCO est une maladie chronique et vous devez donc utiliser TIOTROPIUM VIATRIS 18 microgrammes, poudre pour inhalation en gélule quotidiennement et pas seulement quand vous ressentez une gêne respiratoire ou d'autres symptômes de BPCO.
TIOTROPIUM VIATRIS 18 microgrammes, poudre pour inhalation en gélule est un bronchodilatateur de longue durée d’action qui aide à ouvrir vos bronches pour ainsi faciliter la circulation de l’air dans les poumons. L’utilisation régulière de TIOTROPIUM VIATRIS 18 microgrammes, poudre pour inhalation en gélule peut diminuer l’essoufflement que vous ressentez du fait de votre BPCO et contribue ainsi à diminuer les effets de la maladie sur votre vie de tous les jours. Cela peut vous aider pour poursuivre vos activités quotidiennes. L’utilisation quotidienne de TIOTROPIUM VIATRIS 18 microgrammes permettra également de prévenir l’aggravation soudaine à court terme des symptômes de BPCO qui peuvent se prolonger sur plusieurs jours. La durée d’action de ce médicament est de 24h, vous n'avez donc besoin de l’utiliser qu’une seule fois par jour. Pour assurer un dosage correct de TIOTROPIUM VIATRIS 18 microgrammes, poudre pour inhalation en gélule, veuillez-vous conformer à la rubrique 3. « Comment utiliser TIOTROPIUM VIATRIS 18 microgrammes, poudre pour inhalation en gélule », ainsi qu’aux instructions d’utilisation fournies au verso de la notice.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER TIOTROPIUM VIATRIS 18 microgrammes, poudre pour inhalation en gélule ?
N’utilisez jamais TIOTROPIUM VIATRIS 18 microgrammes, poudre pour inhalation en gélule :
· Si vous êtes allergique hypersensible) à la substance active, au tiotropium ou à l’un des autres composants contenus dans ce médicament, mentionnés dans la rubrique 6.
· Si vous êtes allergique (hypersensible) à l’atropine ou ses dérivés tels que l’ipratropium ou l’oxitropium.
Avertissements et précautions
Adressez-vous à votre médecin ou pharmacien avant d’utiliser TIOTROPIUM VIATRIS 18 microgrammes, poudre pour inhalation en gélule.
· Informez votre médecin si vous avez un glaucome à angle fermé, des problèmes de prostate ou des difficultés à uriner.
· Si vous avez des problèmes rénaux, informez-en votre médecin.
· TIOTROPIUM VIATRIS 18 microgrammes, poudre pour inhalation en gélule est indiqué en traitement d’entretien de votre bronchopneumopathie chronique obstructive (BPCO), il n’est pas destiné à être utilisé pour le soulagement immédiat d’une gêne respiratoire ou d’une respiration sifflante apparue soudainement.
· Des réactions allergiques immédiates, telles qu’une éruption cutanée, un œdème, des démangeaisons, une respiration sifflante ou une gêne respiratoire, peuvent survenir immédiatement après l’administration de TIOTROPIUM VIATRIS 18 microgrammes, poudre pour inhalation en gélule. Dans ce cas, consultez immédiatement votre médecin.
· Comme tous les autres traitements administrés par voie inhalée, une sensation d’oppression thoracique, une toux, une respiration sifflante ou une gêne respiratoire peuvent survenir immédiatement après l’inhalation de TIOTROPIUM VIATRIS 18 microgrammes, poudre pour inhalation en gélule. Dans ce cas, consultez immédiatement votre médecin.
· Prenez soin de ne pas projeter de la poudre pour inhalation dans vos yeux car cela pourrait provoquer ou aggraver un glaucome à angle fermé (affection de l’œil). Une douleur ou une gêne oculaire, des troubles de la vision, la vision de halos autour de la lumière ou d’images colorées, associés à une rougeur oculaire sont des signes annonciateurs d’une crise aiguë de glaucome à angle fermé. Les symptômes oculaires peuvent s’accompagner de céphalées, de nausées ou de vomissements. En cas de survenue de signes ou symptômes évocateurs d’un glaucome à angle fermé, vous devez interrompre le bromure de tiotropium et consulter immédiatement votre médecin (de préférence un ophtalmologiste).
· La sécheresse buccale, telle qu'observée avec les traitements anticholinergiques, peut à long terme favoriser le développement des caries dentaires. Vous devez donc veiller particulièrement à garder une bonne hygiène buccale.
· Dans le cas où vous auriez eu un infarctus du myocarde au cours des 6 derniers mois, ou un trouble du rythme cardiaque instable ou menaçant le pronostic vital ou une insuffisance cardiaque grave au cours de l’année précédente, veuillez en informer votre médecin. Ces éléments sont déterminants pour décider si TIOTROPIUM VIATRIS 18 microgrammes est le traitement adapté à votre cas.
· Ne pas utiliser TIOTROPIUM VIATRIS 18 microgrammes, poudre pour inhalation en gélule plus d'une fois par jour.
Enfants et adolescents
TIOTROPIUM VIATRIS 18 microgrammes, poudre pour inhalation en gélule n’est pas recommandé chez les enfants et les adolescents âgés de moins de 18 ans.
Autres médicaments et TIOTROPIUM VIATRIS 18 microgrammes, poudre pour inhalation en gélule
Informez votre médecin ou pharmacien si vous prenez, avez récemment pris ou pourriez prendre tout autre médicament, incluant les médicaments obtenus sans ordonnance.
Informez votre médecin ou pharmacien si vous utilisez ou avez utilisé des médicaments similaires, tels que les médicaments à base d'ipratropium ou de l’oxitropium, pour traiter vos problèmes respiratoires.
Aucun effet indésirable spécifique n’a été signalé lorsque TIOTROPIUM VIATRIS 18 microgrammes, poudre pour inhalation en gélule a été administré avec d’autres produits utilisés pour traiter la BPCO, notamment les médicaments par voie inhalée destinés à soulager les symptômes, par exemple du salbutamol, les méthylxanthines (par exemple, la théophylline) et/ou les stéroïdes inhalés ou oraux (par exemple, la prednisolone).
TIOTROPIUM VIATRIS 18 microgrammes, poudre pour inhalation en gélule avec des aliments, boissons et de l’alcool
Sans objet.
Grossesse, allaitement et fertilité
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin ou pharmacien avant de prendre ce médicament.
Vous ne devez pas utiliser ce médicament sauf s’il vous a été recommandé spécifiquement par votre médecin.
Conduite de véhicules et utilisation de machines
La survenue d’étourdissements, d’une vision trouble ou de céphalées peut influencer votre aptitude à conduire des véhicules ou à utiliser des machines.
TIOTROPIUM VIATRIS 18 microgrammes, poudre pour inhalation en gélule contient du lactose
Lorsque ce médicament est administré conformément à la posologie recommandée, une gélule par jour, chaque dose contient 5,5 microgrammes de lactose anhydre.
Si votre médecin vous a informé d’une intolérance à certains sucres, contactez-le avant de prendre ce médicament.
3. COMMENT UTILISER TIOTROPIUM VIATRIS 18 microgrammes, poudre pour inhalation en gélule ?
La dose habituelle est l’inhalation du contenu d’une gélule (18 microgrammes de tiotropium) une fois par jour. Ne pas dépasser la dose recommandée.
TIOTROPIUM VIATRIS 18 microgrammes, poudre pour inhalation en gélule n’est pas recommandé chez les enfants et les adolescents âgés de moins de 18 ans.
Le traitement devra être administré à la même heure chaque jour car TIOTROPIUM VIATRIS 18 microgrammes, poudre pour inhalation en gélule agit pendant 24 heures.
Les gélules doivent être utilisées par voie inhalée uniquement et non par voie orale.
NE PAS AVALER LES GELULES.
Le dispositif NeumoHaler, dans lequel vous devez mettre la gélule de TIOTROPIUM VIATRIS 18 microgrammes, poudre pour inhalation en gélule, perfore la gélule ce qui vous permet d’inhaler la poudre qu'elle contient.
Vous devez vérifier que vous avez bien un dispositif d'inhalation NeumoHaler et que vous pouvez l’utiliser correctement. Les instructions pour l'utilisation du dispositif NeumoHaler sont fournies à la fin de la notice.
Vous ne devez pas souffler dans le dispositif NeumoHaler.
Si vous rencontrez des difficultés pour l’utilisation du dispositif NeumoHaler, demandez à votre médecin, infirmier/ère ou pharmacien de vous montrer comment il fonctionne.
Vous devez nettoyer votre dispositif NeumoHaler au moins une fois par mois. Les instructions pour le nettoyage du dispositif NeumoHaler sont fournies à la fin de la notice.
Lorsque vous prenez TIOTROPIUM VIATRIS 18 microgrammes, poudre pour inhalation en gélule, veillez à ne pas projeter de la poudre dans vos yeux. En cas de projection de poudre dans vos yeux, vous risquez d’avoir une vision floue, une douleur et/ou une rougeur oculaire. Vous devez rincer immédiatement vos yeux à l’eau tiède, puis consulter immédiatement votre médecin pour avis.
Si vous sentez que votre respiration se détériore, vous devez consulter rapidement votre médecin.
Si vous avez utilisé plus de TIOTROPIUM VIATRIS 18 microgrammes, poudre pour inhalation en gélule que vous n’auriez dû
Si vous avez inhalé plus d’une gélule de TIOTROPIUM VIATRIS 18 microgrammes en une journée, consultez immédiatement votre médecin. Vous risquez alors davantage de présenter des effets indésirables comme une sécheresse buccale, une constipation, des difficultés à uriner, une augmentation de la fréquence cardiaque ou une vision floue.
Si vous oubliez d’utiliser TIOTROPIUM VIATRIS 18 microgrammes, poudre pour inhalation en gélule
Si vous avez oublié de prendre une dose, prenez-la dès que vous vous en rendez compte, mais ne prenez pas deux doses en même temps ou au cours de la même journée. Prenez votre dose suivante conformément à votre traitement habituel.
Si vous arrêtez d’utiliser TIOTROPIUM VIATRIS 18 microgrammes, poudre pour inhalation en gélule
Consultez votre médecin ou votre pharmacien avant d’arrêter d’utiliser TIOTROPIUM VIATRIS 18 microgrammes. Si vous arrêtez d’utiliser TIOTROPIUM VIATRIS 18 microgrammes, poudre pour inhalation en gélule, les signes et les symptômes de la BPCO peuvent s’aggraver.
Si vous avez d’autres questions sur l’utilisation de ce médicament, demandez plus d'informations à votre médecin ou à votre pharmacien.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Les effets indésirables décrits ci-dessous ont été observés chez des patients prenant ce médicament et sont listés selon leur fréquence de survenue : fréquent, peu fréquent, rare, ou avec une fréquence non déterminée.
Fréquent (peut affecter jusqu’à 1 personne sur 10)
· Sécheresse buccale : légère dans la majorité des cas.
Peu fréquent (peut affecter jusqu’à 1 personne sur 100)
· Sensations vertigineuses,
· Maux de tête,
· Troubles du goût,
· Vision trouble,
· Irrégularité du rythme cardiaque (fibrillation auriculaire),
· Inflammation de la gorge (pharyngite),
· Enrouement de la voix (dysphonie),
· Toux,
· Aigreur d’estomac (reflux gastro œsophagien),
· Constipation,
· Infection dans la bouche et la gorge causée par un champignon (candidose oropharyngée),
· Éruption cutanée (rash),
· Émission d’urine douloureuse (dysurie),
· Difficulté à uriner (rétention urinaire).
Rare (peut affecter jusqu’à 1 personne sur 1 000)
· Difficulté à s’endormir (insomnies),
· Vision de halos lumineux autour des lumières ou des images colorées, avec rougeur oculaire (glaucome),
· Augmentation de la pression à l’intérieur de l’œil,
· Irrégularité du rythme cardiaque (tachycardie supraventriculaire),
· Accélération du rythme cardiaque (tachycardie),
· Perception anormale de battements cardiaques dans la poitrine (palpitations),
· Oppression du thorax associée à une toux, une respiration sifflante ou des difficultés respiratoires survenant immédiatement après l’inhalation du produit (bronchospasme),
· Saignements du nez (épistaxis),
· Inflammation du larynx (laryngite),
· Inflammation des sinus (sinusite),
· Blocage du transit intestinal ou absence de mouvements intestinaux (occlusion intestinale ou iléus paralytique),
· Inflammation des gencives (gingivite),
· Inflammation de la langue (glossite),
· Difficultés à avaler (dysphagie),
· Inflammation de la bouche (stomatite),
· Envie de vomir (nausées),
· Réactions allergiques immédiates (hypersensibilité),
· Réactions allergiques sévères entraînant un gonflement du visage ou de la gorge (Œdème de Quincke),
· Urticaire,
· Démangeaisons (prurit),
· Infections urinaires.
Fréquence indéterminée (ne peut être estimée sur la base des données disponibles)
· Perte d’eau corporelle (déshydratation),
· Caries dentaires,
· Réaction allergique sévère (réaction anaphylactique),
· Infections ou ulcérations de la peau,
· Sécheresse de la peau,
· Gonflement des articulations.
Les effets indésirables graves comprennent les réactions allergiques entraînant un gonflement du visage ou de la gorge (œdème de Quincke) ou d'autres réactions d'hypersensibilité (telles qu’une brusque diminution de la pression artérielle ou des sensations vertigineuses) pouvant survenir de façon isolée ou dans le cadre d’une réaction allergique sévère (réaction anaphylactique) après la prise de TIOTROPIUM VIATRIS 18 microgrammes/dose, poudre pour inhalation. En outre, comme pour tous les médicaments inhalés, certains patients peuvent présenter une oppression inattendue de la poitrine, une toux, des sifflements respiratoires ou un essoufflement immédiatement après l’inhalation (bronchospasme). Dans ce cas, arrêtez le traitement et consultez un médecin.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, votre pharmacien ou à votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : www.signalement-sante.gouv.fr.
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER TIOTROPIUM VIATRIS 18 microgrammes, poudre pour inhalation en gélule ?
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur l’emballage ou la plaquette après EXP. La date de péremption fait référence au dernier jour de ce mois.
Vous pouvez utiliser votre dispositif NeumoHaler jusqu’à ce que vous ayez terminé les gélules contenues dans la boîte (maximum jusqu’à 3 mois).
À conserver à une température ne dépassant pas 30 °C.
À conserver dans l’emballage d’origine, à l’abri de l’humidité.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient TIOTROPIUM VIATRIS 18 microgrammes, poudre pour inhalation en gélule
· La substance active est le tiotropium.
Chaque gélule contient 18 microgrammes du principe actif tiotropium (sous forme de bromure anhydre). Au cours de l’inhalation, 12 microgrammes de tiotropium sont délivrés à l'embout buccal du dispositif NeumoHaler.
· Les autres excipients sont :
Lactose, hypromellose, dioxyde de titane (E171), encre noire.
Poudre pour inhalation en gélule.
Gélules blanches à blanchâtres avec l’impression T18 à l’encre noire sur la tête et contenant une poudre blanche à blanchâtre.
30, 60, 90 gélules sous plaquettes (aluminium/aluminium-PVC) pelables + le dispositif NeumoHaler.
Le dispositif NeumoHaler est dispositif unidose pour inhalation avec un corps et une tête verts et un bouton poussoir blanc fait en plastique (ABS) et en acier inoxydable.
Le dispositif NeumoHaler est emballé/disponible dans chaque boîte en carton.
Toutes les présentations peuvent ne pas être commercialisées.
Titulaire de l’autorisation de mise sur le marché
1 RUE DE TURIN
69007 LYON
Exploitant de l’autorisation de mise sur le marché
VIATRIS SANTE
1 RUE DE TURIN
69007 LYON
JOAN BUSCALLÀ 1-9
08173 SANT CUGAT DEL VALLES (BARCELONA)
ESPAGNE
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Ce médicament est autorisé dans les Etats membres de l'Espace Economique Européen sous les noms suivants : Conformément à la réglementation en vigueur.
[À compléter ultérieurement par le titulaire]
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
{mois AAAA}.
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).
Instructions pour la manipulation et l’utilisation :
Cher patient,
Le dispositif NeumoHaler vous permet d’inhaler le médicament contenu dans la gélule de TIOTROPIUM VIATRIS, que votre médecin vous a prescrit pour vos difficultés respiratoires.
Suivez toujours scrupuleusement les instructions de votre médecin pour utiliser TIOTROPIUM VIATRIS. Le dispositif NeumoHaler est exclusivement conçu pour TIOTROPIUM VIATRIS. Vous ne devez pas l’utiliser pour prendre un autre médicament. Vous pouvez utiliser NeumoHaler jusqu’à ce que vous ayez fini le médicament contenu dans cette boîte (au maximum jusqu’à 3 mois). Le dispositif a un capuchon anti-poussière (couvercle supérieur courbé), embout buccal (situé sous le capuchon anti-poussière), base, bouton de perçage (sur le côté du NeumoHaler) et chambre centrale (située sous l'embout buccal).
|
|
Le dispositif NeumoHaler |
|
1 Capuchon anti-poussière |
|
|
2 Embout buccal |
|
|
3 Base |
|
|
4 Bouton-perforateur |
|
|
5 Chambre centrale |
|
|
|
1. Retirez le capuchon anti-poussière. Vérifiez qu’aucun corps étranger ne se trouve dans le canal d’inhalation. |
|
|
2. Ouvrez l’embout buccal en le tirant vers le haut tout en appuyant sur les deux renfoncements. |
|
|
3. Enlevez la gélule de TIOTROPIUM VIATRIS du blister (juste avant l'utilisation, voir l’instruction « Manipulation du blister ») et placez-la dans la chambre centrale du dispositif NeumoHaler, conformément à l'illustration. La façon dont la gélule est placée dans la chambre centrale importe peu. Ne placez jamais directement la gélule dans l’embout buccal. |
|
|
4. Refermez l'embout buccal jusqu'à ce que vous entendiez un clic. |
|
|
5. Tenez le dispositif NeumoHaler vertical, l'embout buccal dirigé vers le haut et enfoncez complétement le bouton-perforateur d'une seule pression, puis relâchez. Ceci perfore la gélule et libère le médicament que vous inhalerez lorsque vous inspirerez. |
|
|
6. Expirez à fond. |
|
Important : ne jamais expirer dans l'embout buccal. |
|
|
|
7. Portez le NeumoHaler à votre bouche et refermez fermement les lèvres autour de l'embout buccal. Maintenez la tête droite et inspirez lentement et profondément, à un rythme toutefois suffisant pour que vous entendiez ou sentiez la gélule vibrer. Inspirez jusqu'à remplir complétement vos poumons, puis retenez votre respiration aussi longtemps que vous le pouvez et ôtez le dispositif NeumoHaler de votre bouche. Répétez une fois les étapes 6 et 7, ce qui videra totalement la gélule de son contenu |
|
|
8. Ouvrez à nouveau l'embout buccal. Faites tomber la gélule utilisée et jetez-la. Refermez l’embout buccal et replacez le capuchon anti-poussière. Assurez-vous que le capuchon anti-poussière est bien fermé. |
|
Nettoyage du NeumoHaler |
|
|
Nettoyez votre NeumoHaler une fois par mois. |
|
|
|
1. Ouvrez le capuchon anti-poussière et l'embout buccal puis ouvrez la base en appuyant avec votre pouce sur le triangle gravé sous le bouton perforateur, comme le montre la figure ci-contre. |
|
|
2. Rincez complètement l'inhalateur à l'eau chaude pour enlever toute poudre restante. Séchez soigneusement le NeumoHaler en absorbant l'excès d'eau sur une serviette en papier, puis laissez sécher à l'air, sans réassembler ces éléments. |
|
Cette opération de séchage à l'air prend 24 heures. Nettoyez-le donc juste après l'avoir utilisé et il sera prêt pour votre dose suivante. Si nécessaire, nettoyez la surface externe de l'embout buccal avec un chiffon humide mais non mouillé. |
|
|
Manipulation du blister |
|
|
|
1. Séparez l’une des alvéoles prédécoupées du reste en détachant selon la perforation. |
|
|
2. Prenez l’alvéole prédécoupée et relevez la feuille protectrice jusqu'à ce qu'une seule gélule devienne complétement visible. |
|
Ne pas poussez la gélule à travers l’aluminium. |
|
|
|
3. Les gélules doivent toujours être stockées dans leur blister et retirées seulement immédiatement avant utilisation. Avec des mains sèches, retirez la gélule du blister. |
|
Ne pas avaler la gélule. |
|
Les gélules de TIOTROPIUM VIATRIS ne contiennent qu’une petite quantité de poudre et ne sont donc que partiellement remplies.
Fabricant du dispositif NeumoHaler
FERRER INTERNACIONAL, S.A
JOAN BUSCALLÀ 1-9
08173 SANT CUGAT DEL VALLÈS
ESPAGNE