Dernière mise à jour le 08/01/2026
CROMOGLICATE DE SODIUM VIATRIS 2 %, collyre en solution
Indications thérapeutiques
Classe pharmacothérapeutique : ANTI-ALLERGIQUE LOCAL (S = organe sensoriel).
Ce collyre est indiqué en cas de maladie de l'œil d'origine allergique (conjonctivite allergique).
Présentations
> 1 flacon(s) polyéthylène basse densité (PEBD) de 5 ml
Code CIP : 278 932-2 ou 34009 278 932 2 3
Déclaration de commercialisation : 12/11/2018
Cette présentation est agréée aux collectivités
- Prix hors honoraire de dispensation : 2,46 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 3,48 €
- Taux de remboursement :30%
> 1 flacon(s) polyéthylène basse densité (PEBD) de 10 ml
Code CIP : 278 933-9 ou 34009 278 933 9 1
Déclaration de commercialisation : 12/11/2018
Cette présentation est agréée aux collectivités
- Prix hors honoraire de dispensation : 4,22 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 5,24 €
- Taux de remboursement :30%
Service médical rendu (SMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Modéré | Avis du 01/04/2015 | Inscription (CT) | Le service médical rendu par CROMOGLICATE DE SODIUM MYLAN 2 %, collyre en solution (flacon de 10 ml), est modéré dans l’indication de l’AMM. |
Amélioration du service médical rendu (ASMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprés de la HAS (plus d'informations dans l'aide). Les avis et synthéses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur de l'ASMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| V (Inexistant) | Avis du 01/04/2015 | Inscription (CT) | Cette spécialité n’apporte pas d’amélioration du service médical rendu (ASMR V) par rapport au princeps. |
ANSM - Mis à jour le : 20/03/2025
CROMOGLICATE DE SODIUM VIATRIS 2 %, collyre en solution
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Cromoglicate de sodium ................................................................................................................ 2,00 g
Pour 100 mL.
Excipient à effet notoire : Ce médicament contient 0,1 mg de chlorure de benzalkonium par mL de collyre.
Pour la liste complète des excipients, voir rubrique 6.1.
4.1. Indications thérapeutiques
Traitement symptomatique des affections ophtalmiques d'origine allergique.
4.2. Posologie et mode d'administration
Mode d’administration
Voie locale.
EN INSTILLATION OCULAIRE.
Se laver soigneusement les mains avant de procéder à l'instillation.
Eviter le contact de l'embout avec l'œil ou les paupières.
Reboucher le flacon, après utilisation.
Posologie
Adulte et enfant : selon la sévérité des symptômes, instiller 1 goutte de collyre 2 à 6 fois par jour, à intervalles réguliers, dans le cul de sac conjonctival de l'œil malade, en regardant vers le haut, et en tirant légèrement la paupière vers le bas.
Chez l'enfant un avis médical est nécessaire.
Hypersensibilité au cromoglicate de sodium ou à l'un des constituants du collyre.
4.4. Mises en garde spéciales et précautions d'emploi
Précautions d'emploi
NE PAS INJECTER, NE PAS AVALER.
Ne pas dépasser la posologie recommandée.
En l'absence d'amélioration comme en cas de persistance des symptômes, prendre un avis médical.
Eviter le contact de l'embout avec l'œil ou les paupières.
Reboucher le flacon, après utilisation.
Ce médicament contient 0,1 mg de chlorure de benzalkomium par millilitre de collyre.
Le chlorure de benzalkonium peut être absorbé par les lentilles de contact souples et changer leur couleur. Le patient doit retirer les lentilles de contact avant application et attendre au moins 15 minutes avant de les remettre.
Le chlorure de benzalkonium peut également provoquer une irritation des yeux, surtout si le patient souffre du syndrome de l’œil sec ou de troubles de la cornée (couche transparente à l’avant de l’œil).
En cas de sensation anormale, de picotements ou de douleur dans les yeux après avoir utilisé ce médicament, le patient doit contacter un médecin.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
4.6. Fertilité, grossesse et allaitement
Grossesse
Il y a peu ou pas de données sur l’utilisation du produit CROMOGLICATE DE SODIUM VIATRIS 2 %, collyre en solution chez la femme enceinte. Les études chez l’animal ne mettent pas en évidence d’effet indésirable direct ou indirect sur les fonctions de la reproduction (voir rubrique 5.3).
Compte-tenu du faible passage systémique après une administration topique oculaire, aucun effet indésirable sur la grossesse n’est attendu. CROMOGLICATE DE SODIUM VIATRIS 2 %, collyre en solution peut être utilisé pendant la grossesse.
Allaitement
Compte-tenu du faible passage systémique après une administration topique oculaire, aucun effet indésirable n’est attendu. CROMOGLICATE DE SODIUM VIATRIS 2 %, collyre en solution peut être utilisé pendant l’allaitement.
Fertilité
Compte-tenu du faible passage systémique après une administration topique oculaire, aucun effet sur la fertilité chez l’Homme n’est attendu. Les données chez l’animal ne mettent pas en évidence d’effet sur la fertilité (voir rubrique 5.3).
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Une gêne visuelle passagère peut être ressentie après instillation du collyre en solution.
Dans ce cas, il est conseillé de ne pas conduire ou d'utiliser de machines jusqu'au retour de la vision normale.
Les effets indésirables rapportés avec CROMOGLICATE DE SODIUM VIATRIS 2 %, collyre en solution sont répertoriés ci-dessous par Système Organe Classe (SOC) et par fréquence.
|
Les fréquences ne peuvent pas être estimées sur la base des données disponibles (fréquence indéterminée). SOC (MedDRA) |
Fréquence |
Effet indésirable |
|
Affections du système immunitaire |
Indéterminée |
Hypersensibilité (voir rubrique 4.3). |
|
Affections oculaires |
Indéterminée |
Irritation oculaire, douleur oculaire* |
*Des sensations de picotement et de brûlure transitoires peuvent survenir après l’instillation. D'autres symptômes d'irritation locale ont été rapportés.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/.
En cas de surdosage, rincer au sérum physiologique stérile.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : ANTI-ALLERGIQUE LOCAL
(S = organe sensoriel)
Le cromoglicate de sodium possède des propriétés anti-allergiques reconnues au niveau des muqueuses ; il prévient, par stabilisation de la membrane mastocytaire, la libération des médiateurs chimiques responsable des réactions anaphylactiques.
5.2. Propriétés pharmacocinétiques
Le cromoglicate de sodium est en partie absorbé par la muqueuse. Il n'est pas métabolisé. Il est excrété tel quel dans la bile et les urines.
5.3. Données de sécurité préclinique
Les données précliniques ne mettent pas en évidence de risque particulier pour l’administration de CROMOGLICATE DE SODIUM VIATRIS 2 %, collyre en solution chez l’Homme, sur la base d’études conventionnelles de pharmacologie de sécurité, de toxicité par administration répétée, de génotoxicité, de cancérogénèse, de toxicité de la reproduction et du développement. CROMOGLICATE DE SODIUM VIATRIS 2 %, collyre en solution est bien toléré après application oculaire, une légère irritation transitoire de la conjonctive a été observée chez le lapin. Dans les modèles précliniques, le produit n’induit pas de sensibilisation ou de photosensibilisation, et n’interfère pas avec les processus de cicatrisation de la cornée.
Edétate de sodium, solution de chlorure de benzalkonium à 50 %, eau pour préparations injectables.
Avant ouverture : 2 ans.
Après première ouverture : le flacon doit être utilisé dans les 28 jours et doit être conservé à une température ne dépassant pas 25°C.
6.4. Précautions particulières de conservation
A conserver dans l’emballage extérieur d’origine.
6.5. Nature et contenu de l'emballage extérieur
5 mL ou 10 mL en flacon (PEBD) avec bouchon en polypropylène blanc.
Boîte de 1 flacon.
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
Pas d’exigences particulières.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
1 RUE DE TURIN
69007 LYON
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 278 932 2 3 : 5 mL en flacon (PEBD).
· 34009 278 933 9 1 : 10 mL en flacon (PEBD).
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Médicament non soumis à prescription médicale.
ANSM - Mis à jour le : 20/03/2025
CROMOGLICATE DE SODIUM VIATRIS 2 %, collyre en solution
Cromoglicate de sodium
Vous devez toujours utiliser ce médicament en suivant scrupuleusement les informations fournies dans cette notice ou par votre médecin ou votre pharmacien.
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Adressez-vous à votre pharmacien pour tout conseil ou information.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
· Vous devez vous adresser à votre médecin si vous ne ressentez aucune amélioration ou si vous vous sentez moins bien.
1. Qu'est-ce que CROMOGLICATE DE SODIUM VIATRIS 2 %, collyre en solution et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d’utiliser CROMOGLICATE DE SODIUM VIATRIS 2 %, collyre en solution ?
3. Comment utiliser CROMOGLICATE DE SODIUM VIATRIS 2 %, collyre en solution ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver CROMOGLICATE DE SODIUM VIATRIS 2 %, collyre en solution ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE CROMOGLICATE DE SODIUM VIATRIS 2 %, collyre en solution ET DANS QUELS CAS EST-IL UTILISE ?
Classe pharmacothérapeutique : ANTI-ALLERGIQUE LOCAL (S = organe sensoriel).
Ce collyre est indiqué en cas de maladie de l'œil d'origine allergique (conjonctivite allergique).
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER CROMOGLICATE DE SODIUM VIATRIS 2 %, collyre en solution ?
N’utilisez jamais CROMOGLICATE DE SODIUM VIATRIS 2 %, collyre en solution :
· en cas d’antécédent d'allergie à l'un des composants du collyre.
EN CAS DE DOUTE, IL EST INDISPENSABLE DE DEMANDER L'AVIS DE VOTRE MEDECIN OU DE VOTRE PHARMACIEN.
Avertissements et précautions
Adressez-vous à votre médecin ou à votre pharmacien avant d’utiliser CROMOGLICATE DE SODIUM VIATRIS 2 %, collyre en solution.
NE JAMAIS LAISSER A PORTEE DES ENFANTS.
NE PAS INJECTER, NE PAS AVALER.
Ne pas dépasser la posologie recommandée.
En l'absence d'amélioration comme en cas de persistance des symptômes, prenez un avis médical.
En cas de traitement concomitant par un autre collyre, attendre 15 minutes entre chaque instillation.
Reboucher le flacon après utilisation.
EN CAS DE DOUTE NE PAS HESITER A DEMANDER L'AVIS DE VOTRE MEDECIN OU DE VOTRE PHARMACIEN.
Enfants
Sans objet.
Autres médicaments et CROMOGLICATE DE SODIUM VIATRIS 2 %, collyre en solution
Informez votre médecin ou pharmacien si vous prenez, avez récemment pris ou pourriez prendre tout autre médicament.
En cas de traitement concomitant par un autre collyre, attendre 15 minutes entre chaque instillation.
CROMOGLICATE DE SODIUM VIATRIS 2 %, collyre en solution avec des aliments et boissons
Sans objet.
CROMOGLICATE DE SODIUM VIATRIS 2 %, collyre en solution passe peu dans la circulation générale. Si vous êtes enceinte ou que vous allaitez, vous pouvez utiliser ce médicament.
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin ou pharmacien avant de prendre ce médicament.
Conduite de véhicules et utilisation de machines
Une gêne visuelle passagère peut être ressentie après instillation du collyre en solution.
Dans ce cas, attendre la fin des symptômes pour conduire ou utiliser une machine.
CROMOGLICATE DE SODIUM VIATRIS 2 %, collyre en solution contient du chlorure de benzalkonium.
Ce médicament contient 0,1 mg de chlorure de benzalkonium par millilitre de collyre.
Le chlorure de benzalkonium peut être absorbé par les lentilles de contact souples et changer leur couleur. Retirer les lentilles de contact avant application et attendre au moins 15 minutes avant de les remettre.
Le chlorure de benzalkonium peut également provoquer une irritation des yeux, surtout si vous souffrez du syndrome de l’œil sec ou de troubles de la cornée (couche transparente à l’avant de l’œil). En cas de sensation anormale, de picotements ou de douleur dans les yeux après avoir utilisé ce médicament, contactez votre médecin.
3. COMMENT UTILISER CROMOGLICATE DE SODIUM VIATRIS 2 %, collyre en solution ?
Veillez à toujours utiliser ce médicament en suivant exactement les instructions de cette notice ou les indications de votre médecin ou de votre pharmacien. Vérifiez auprès de votre médecin ou de votre pharmacien en cas de doute.
· Adulte et enfant : selon la sévérité des symptômes, instillez 1 goutte dans chaque œil, 2 à 6 fois par jour, à intervalles réguliers.
Chez l'enfant un avis médical est nécessaire.
· Ne dépassez pas la posologie recommandée.
DANS TOUS LES CAS SE CONFORMER STRICTEMENT A L'ORDONNANCE DE VOTRE MEDECIN.
Mode et voie d'administration
Voie locale.
EN INSTILLATION OCULAIRE.
Vous ne devez pas utiliser le flacon si la bague d’inviolabilité a été cassée avant sa première utilisation.
Ouverture du flacon avant la première utilisation
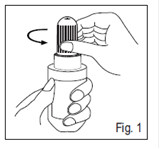
1. Tourner le bouchon dans le sens inverse des aiguilles d’une montre. Cela cassera la bague d’inviolabilité (Fig. 1).

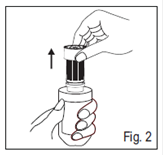
2. Retirer la bague d’inviolabilité tout en maintenant le bouchon sur le flacon (Fig. 2).

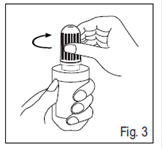
3. Revisser complètement le bouchon en tournant dans le sens des aiguilles d’une montre. La pointe dans le bouchon percera l’extrémité du flacon (Fig. 3).

Instillation du collyre
Lavez-vous soigneusement les mains avant de procéder à l'instillation.
Ouvrez le bouchon en tournant dans le sens inverse des aiguilles d’une montre (Fig. 4).
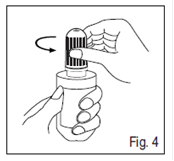

Instillez 1 goutte de collyre dans le cul de sac conjonctival de l'œil malade en regardant vers le haut, et en tirant légèrement la paupière vers le bas et en évitant le contact de l'embout avec l'œil ou les paupières.
Rebouchez le flacon après utilisation.
Fréquence d'administration
En cas de traitement concomitant par un autre collyre, attendez 15 minutes entre chaque instillation.
Durée du traitement
Ne prolongez pas le traitement sans avis médical.
En l'absence d'amélioration comme en cas de persistance des symptômes, prenez un avis médical.
Si vous avez utilisé plus de CROMOGLICATE DE SODIUM VIATRIS 2 %, collyre en solution que vous n’auriez dû
En cas de surdosage, rincer au sérum physiologique stérile.
Si vous oubliez d’utiliser CROMOGLICATE DE SODIUM VIATRIS 2 %, collyre en solution
Sans objet.
Si vous arrêtez d’utiliser CROMOGLICATE DE SODIUM VIATRIS 2 %, collyre en solution
Sans objet.
Si vous avez d’autres questions sur l’utilisation de ce médicament, demandez plus d’informations à votre médecin ou à votre pharmacien.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Effets indésirables avec une fréquence indéterminée (ne pouvant être estimée sur la base des données disponibles) :
· réaction allergique aux composants du produit ;
· irritation oculaire pouvant inclure des sensations de brûlures et de picotement des yeux, de façon transitoire après instillation.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, votre pharmacien ou à votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER CROMOGLICATE DE SODIUM VIATRIS 2 %, collyre en solution ?
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur la boîte ou sur le flacon après {EXP}. La date de péremption fait référence au dernier jour de ce mois.
A conserver dans l’emballage extérieur d’origine.
Après première ouverture : le collyre en solution se conserve 28 jours à une température ne dépassant pas 25°C.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient CROMOGLICATE DE SODIUM VIATRIS 2 %, collyre en solution
· La substance active est :
cromoglicate de sodium ................................................................................................................ 2,00 g
pour 100 mL de collyre en solution.
· Les autres composants sont :
édédate de sodium, solution de chlorure de benzalkonium à 50 %, eau pour préparations injectables.
Ce médicament se présente sous forme de collyre en solution.
Flacon de 5 mL ou 10 mL.
Toutes les présentations peuvent ne pas être commercialisées.
Titulaire de l’autorisation de mise sur le marché
1 RUE DE TURIN
69007 LYON
Exploitant de l’autorisation de mise sur le marché
1 RUE DE TURIN
69007 LYON
1 RUE DE TURIN
69007 LYON
ou
EUROFINS BIOPHARMA PRODUCT TESTING BUDAPEST KFT.
ANONYMUS UT 6.
H-1045 BUDAPEST
HONGRIE
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Sans objet.
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).