
ANSM - Mis à jour le : 06/02/2024
BOSUTINIB BIOGARAN 400 mg, comprimé pelliculé
2. COMPOSITION QUALITATIVE ET QUANTITATIVE 
Pour un comprimé pelliculé.
Pour la liste complète des excipients, voir rubrique 6.1.
Comprimé pelliculé.
Comprimé pelliculé orange, ovale et biconvexe (largeur : 9 mm ; longueur : 17 mm), avec la mention « C19 » gravée d'un côté.
4.1. Indications thérapeutiques 
BOSUTINIB BIOGARAN est indiqué dans le traitement des patients adultes atteints :
· de leucémie myéloïde chronique à chromosome Philadelphie positif (LMC Ph+) en phase chronique (PC) nouvellement diagnostiquée ;
· LMC Ph+ en PC, en phase accélérée (PA) et en crise blastique (CB) précédemment traités par un ou plusieurs inhibiteurs de la tyrosine kinase [ITK(s)] et pour lesquels l'imatinib, le nilotinib et le dasatinib ne sont pas considérés comme des traitements appropriés.
4.2. Posologie et mode d'administration 
Posologie
LMC Ph+ en PC nouvellement diagnostiquée
La dose recommandée est de 400 mg de bosutinib une fois par jour.
LMC Ph+ en PC, PA ou CB avec résistance ou intolérance au traitement précédent
La dose recommandée est de 500 mg de bosutinib une fois par jour.
Dans les essais cliniques menés sur les deux indications, le traitement par bosutinib a été poursuivi jusqu’à progression de la maladie ou intolérance du traitement.
Ajustements posologiques
Dans l’étude clinique de phase 1/2 menée chez des patients atteints de LMC présentant une résistance ou une intolérance au traitement précédent, des augmentations de la dose de 500 mg à 600 mg une fois par jour (au moment des repas) ont été autorisées chez les patients n’ayant pas présenté de réponse hématologique complète (RHC) dans les 8 semaines ou de réponse cytogénétique complète (RCyC) dans les 12 semaines et n’ayant pas présenté d’événements indésirables de grade 3 ou supérieur susceptibles d’être liés au médicament expérimental. Dans l’étude clinique de phase 3 menée chez des patients atteints de LMC-PC nouvellement diagnostiquée traités par 400 mg de bosutinib, des augmentations de dose par paliers de 100 mg jusqu’à 600 mg maximum une fois par jour (au moment des repas) ont été autorisées si le patient ne présentait pas un taux du transcrit breakpoint cluster region-Abelson (BCR-ABL) ≤ 10 % au Mois 3, si le patient ne présentait pas d’effet indésirable de grade 3 ou 4 au moment de l’augmentation, et que toutes les toxicités non hématologiques de grade 2 aient été résolues et soient revenues au moins au grade 1. Dans l’étude clinique de phase 4 menée chez des patients atteints de LMC Ph+ précédemment traités par un ou plusieurs ITK, des augmentations de dose de 500 mg à 600 mg une fois par jour au moment d’un repas ont été autorisées chez les patients présentant une réponse insatisfaisante ou des signes de progression de la maladie en l’absence d’effets indésirables de grade 3 ou 4 ou de grade 2 persistants.
Dans l’étude de phase 1/2 menée chez des patients atteints de LMC présentant une résistance ou une intolérance au traitement précédent et ayant débuté un traitement ≤ 500 mg, 93 (93/558 ; 16,7 %) patients ont eu des augmentations de dose jusqu’à 600 mg par jour.
Dans l’étude de phase 3 menée chez des patients atteints de LMC-PC nouvellement diagnostiquée ayant débuté le traitement par bosutinib à 400 mg, 58 patients (21,6 %) au total ont eu des augmentations de dose journalière jusqu’à 500 mg. De plus, 10,4 % des patients du bras traités par bosutinib ont eu des augmentations de dose journalière jusqu’à 600 mg.
Dans l’étude de phase 4 menée chez des patients atteints de LMC Ph+ précédemment traités par 1 ou plusieurs ITK et qui ont commencé le traitement par bosutinib à 500 mg par jour, 1 patient (0,6 %) a eu une augmentation de la dose journalière jusqu’à 600 mg.
Les doses supérieures à 600 mg/jour n’ont pas fait l’objet d’études et ne doivent pas être administrées.
Ajustements posologiques consécutifs à des effets indésirables
Effets indésirables non hématologiques
En cas de développement d'une toxicité non hématologique modérée ou sévère cliniquement significative, le traitement par bosutinib doit être interrompu et peut être repris à une dose réduite d’un palier de 100 mg une fois par jour après résolution de la toxicité. Si cliniquement indiqué, une nouvelle augmentation peut être envisagée à la dose reçue avant la réduction de la dose en une prise une fois par jour (voir rubrique 4.4). Des doses inférieures à 300 mg/jour ont été utilisées chez certains patients. Toutefois, l’efficacité n’a pas été établie.
Elévation des transaminases hépatiques : en cas d'élévation des transaminases hépatiques > 5 x la limite supérieure de la normale (LSN), le traitement par bosutinib doit être interrompu jusqu'à un retour à un taux ≤ 2,5 x LSN, et pourra être repris à une dose de 400 mg une fois par jour. Si le taux est toujours trop élevé après 4 semaines, l'arrêt du traitement par bosutinib doit être envisagé. Si l'élévation des transaminases ≥ 3 x LSN s'accompagne d'une élévation de la bilirubine > 2 x LSN et un taux de phosphatase alcaline < 2 x LSN, le traitement par bosutinib doit être arrêté (voir rubrique 4.4).
Diarrhée : en cas de diarrhée de grade 3-4 selon la classification NCI Critères de Terminologie Communs pour les Evénements Indésirables (CTCAE), le traitement par bosutinib doit être interrompu et peut être repris à une dose de 400 mg une fois par jour après un retour au grade ≤ 1 (voir rubrique 4.4).
Effets indésirables hématologiques
Des réductions de la dose sont recommandées en cas de neutropénie et de thrombopénie sévères ou persistantes, comme décrit au tableau 1 :
Tableau 1 – Ajustements posologiques en cas de neutropénie et de thrombopénie
|
PNNa < 1,0 x 109/l et/ou Plaquettes < 50 x 109/l
|
Interrompre le traitement par bosutinib jusqu'à l'obtention d’une numération avec des PNN ≥ 1,0 x 109/l et un taux de plaquettes ≥ 50 x 109/l. Reprendre le traitement par bosutinib à la même dose si récupération dans les 2 semaines. Si la numération reste basse pendant une durée > 2 semaines, réduire la dose de 100 mg et reprendre le traitement après la résolution de l’évènement. En cas de rechute de la cytopénie, réduire la dose d’un palier supplémentaire de 100 mg et reprendre le traitement après la résolution de l’évènement. Des doses inférieures à 300 mg/jour ont été utilisées. Toutefois, l’efficacité n’a pas été établie. |
a PNN = polynucléaires neutrophiles
Populations spécifiques
Patients âgés (≥ 65 ans)
Aucune recommandation posologique spécifique n'est nécessaire pour les patients âgés. Etant donné que l’information disponible chez les patients âgés est limitée, la prudence est de rigueur dans cette population.
Atteinte de la fonction rénale
Les patients dont la créatinine sérique est > 1,5 x LSN ont été exclus des études sur la LMC. Une augmentation de l'exposition (aire sous la courbe [ASC]) chez les patients souffrant d'une atteinte modérée ou sévère de la fonction rénale a été observée pendant les études.
LMC Ph+ en PC nouvellement diagnostiquée
Chez les patients présentant une atteinte modérée de la fonction rénale (clairance de la créatinine [ClCr] comprise entre 30 et 50 ml/min, selon la formule de Cockcroft-Gault), la dose recommandée de bosutinib est de 300 mg par jour au moment des repas (voir rubriques 4.4 et 5.2).
Chez les patients présentant une atteinte sévère de la fonction rénale (ClCr < 30 ml/min, selon la formule de Cockcroft-Gault), la dose recommandée de bosutinib est de 200 mg par jour au moment des repas (voir rubriques 4.4 et 5.2).
Une augmentation de la dose à 400 mg une fois par jour (prise au moment des repas) chez les patients présentant une atteinte modérée de la fonction rénale et à 300 mg une fois par jour chez les patients présentant une atteinte sévère de la fonction rénale peut être envisagée sous réserve qu’ils n’aient pas présenté d’effets indésirables sévères ou modérés persistants, et s’ils ne sont pas en réponse hématologique, cytogénétique ou moléculaire adéquate.
LMC Ph+ en PC, PA ou CB avec résistance ou intolérance au traitement précédent
Chez les patients présentant une atteinte modérée de la fonction rénale (ClCr comprise entre 30 et 50 ml/min, selon la formule de Cockcroft-Gault), la dose recommandée de bosutinib est de 400 mg par jour (voir rubriques 4.4 et 5.2).
Chez les patients présentant une atteinte sévère de la fonction rénale (ClCr < 30 ml/min, selon la formule de Cockcroft-Gault), la dose recommandée de bosutinib est de 300 mg par jour (voir rubriques 4.4 et 5.2).
Une augmentation de la dose à 500 mg une fois par jour chez les patients souffrant d’une atteinte modérée de la fonction rénale et à 400 mg une fois par jour chez les patients souffrant d’une atteinte sévère de la fonction rénale peut être envisagée sous réserve qu’ils n’aient pas présenté d’effets indésirables sévères ou modérés persistants, et s’ils ne sont pas en réponse hématologique, cytogénétique ou moléculaire adéquate.
Affections cardiaques
Les patients atteints d'affections cardiaques non contrôlées ou significatives (par. ex. infarctus du myocarde récent, insuffisance cardiaque congestive ou angor instable) ont été exclus des études cliniques. Il convient de faire preuve de prudence chez les patients souffrant d'affections cardiaques cliniquement pertinentes (voir rubrique 4.4).
Affections gastro-intestinales cliniquement significatives récentes ou en cours
Les patients atteints d'affections gastro-intestinales cliniquement significatives récentes ou en cours (par. ex. diarrhée et/ou vomissements sévères) ont été exclus des études cliniques. Il convient de faire preuve de prudence chez les patients souffrant d'affections gastro-intestinales cliniquement significatives récentes ou en cours (voir rubrique 4.4).
Population pédiatrique
La sécurité et l’efficacité du bosutinib chez les enfants et les adolescents âgés de moins de 18 ans n’ont pas été établies. Aucune donnée n’est disponible.
Mode d’administration
BOSUTINIB BIOGARAN doit être pris par voie orale une fois par jour, au moment des repas (voir rubrique 5.2). En cas d'omission d'une dose depuis plus de 12 heures, le patient ne doit pas recevoir de dose supplémentaire.
Il doit prendre la dose prescrite habituelle le lendemain.
Hypersensibilité à la substance active ou à l’un des excipients mentionnés à la rubrique 6.1.
Atteinte hépatique (voir rubriques 5.1 et 5.2).
4.4. Mises en garde spéciales et précautions d'emploi 
Anomalies de la fonction hépatique
Le traitement par bosutinib est associé à une élévation des transaminases sériques (alanine aminotransférase [ALAT], aspartate aminotransférase [ASAT]).
Des élévations des transaminases ont généralement été observées en début de traitement (parmi tous les patients ayant présenté une élévation quelconque des transaminases, > 80 % ont connu leur premier événement au cours des 3 premiers mois). Les patients sous bosutinib doivent subir des tests de la fonction hépatique avant l’initiation du traitement et mensuellement au cours des 3 premiers mois du traitement ou quand cela est cliniquement indiqué.
Les patients présentant des élévations des transaminases doivent être pris en charge en interrompant temporairement le traitement par bosutinib (en envisageant une réduction de la dose après un retour au Grade 1 ou à la valeur de référence) et/ou en arrêtant définitivement bosutinib. Des élévations de transaminases, notamment dans le cadre d’élévations concomitantes de la bilirubine, peuvent être le signe précoce d’une lésion du foie induite par le médicament et ces patients doivent être pris en charge en conséquence (voir rubriques 4.2 et 4.8).
Diarrhée et vomissements
Le traitement par bosutinib est associé à de la diarrhée et des vomissements ; par conséquent, les patients souffrant de troubles gastro-intestinaux cliniquement significatifs récents ou en cours doivent utiliser ce médicament avec prudence et uniquement si une évaluation approfondie du rapport bénéfice-risque a été menée, dans la mesure où les patients respectifs ont été exclus des études cliniques. Les patients souffrant de diarrhée et de vomissements doivent être pris en charge avec un traitement standard, comprenant un antidiarrhéique ou un antiémétique et/ou une réhydratation. La diarrhée et les vomissements peuvent également être pris en charge en interrompant temporairement, en réduisant la dose et/ou en arrêtant définitivement le traitement par bosutinib (voir rubriques 4.2 et 4.8). Le dompéridone, utilisé comme antiémétique, peut entraîner un allongement de l’intervalle QT (QTc) et induire des arythmies de type torsades de pointes ; par conséquent, l’utilisation concomitante de dompéridone doit être évitée. Ce médicament ne doit être utilisé que si les autres médicaments ne sont pas efficaces. Dans ce cas, une évaluation du rapport bénéfice-risque individuelle doit impérativement être effectuée et les patients doivent être surveillés quant à la survenue d’allongement de l’intervalle QTc.
Myélosuppression
Le traitement par bosutinib est associé à une myélosuppression, définie comme une anémie, une neutropénie et une thrombopénie. Une numération de la formule sanguine complète doit être réalisée une fois par semaine pendant le premier mois du traitement et mensuellement par la suite, ou quand cela est cliniquement indiqué. La myélosuppression doit/peut être prise en charge en interrompant temporairement, en réduisant la dose et/ou en arrêtant définitivement le traitement par bosutinib (voir rubriques 4.2 et 4.8).
Rétention liquidienne
Le traitement par bosutinib peut être associé à une rétention liquidienne avec épanchement péricardique, épanchement pleural, œdème pulmonaire et/ou œdème périphérique. Les patients doivent être surveillés et pris en charge à l'aide d'un traitement standard. La rétention liquidienne peut également être prise en charge en interrompant temporairement, en réduisant la dose et/ou en arrêtant définitivement le traitement par bosutinib (voir rubriques 4.2 et 4.8).
Lipase sérique
Une élévation de la lipase sérique a été observée. La prudence est de rigueur chez les patients présentant des antécédents de pancréatite. Si les élévations de la lipase sont accompagnées de symptômes abdominaux, le traitement par bosutinib doit être interrompu et des mesures appropriées pour établir le diagnostic et exclure une pancréatite doivent être envisagées (voir rubrique 4.2).
Infections
Bosutinib peut prédisposer les patients à des infections causées par des bactéries, des champignons, des virus, ou des protozoaires.
Potentiel pro-arythmique
Un allongement de l'intervalle QTc (mesuré automatiquement) sans arythmie a été observé. Bosutinib doit être administré avec prudence chez les patients présentant des antécédents ou une prédisposition à l‘allongement de l'intervalle QTc, souffrant d'une maladie cardiaque non contrôlée ou significative y compris un infarctus du myocarde récent, une insuffisance cardiaque congestive, un angor instable ou une bradycardie cliniquement significative, ou traités avec des médicaments ayant pour effet d’allonger le QTc (par ex. médicaments anti-arythmiques et autres substances susceptibles d’allonger le QTc [rubrique 4.5]). La présence d'une hypokaliémie et d'une hypomagnésémie peut exacerber cet effet.
Il est conseillé de contrôler l'effet exercé sur le QTc et un électrocardiogramme (ECG) de référence est donc recommandé avant d‘initier le traitement par bosutinib et quand cela est cliniquement indiqué.
L'hypokaliémie ou l’hypomagnésémie doit être corrigée avant l'administration de bosutinib et doit être surveillée périodiquement pendant le traitement.
Atteinte de la fonction rénale
Le traitement par bosutinib peut entraîner un déclin cliniquement significatif de la fonction rénale chez les patients atteints de LMC. Un déclin dans le temps du débit de filtration glomérulaire estimé (DFGe) a été observé dans des études cliniques chez les patients traités par bosutinib. Chez les patients atteints de LMC en PC nouvellement diagnostiquée, traités à 400 mg, le déclin médian du DFGe par rapport à l’inclusion était de 11,1 ml/min/1,73 m2 à 1 an et de 14,1 ml/min/1,73 m2 à 5 ans pour les patients sous traitement. Les patients atteints de LMC naïfs de traitement et traités à 500 mg ont présenté un déclin médian du DFGe de 9,2 ml/min/1,73 m2 à 1 an, de 12,0 ml/min/1,73 m2 à 5 ans et de 16,6 ml/min/1,73 m2 à 10 ans pour les patients sous traitement. Chez les patients atteints de LMC en PC ou en phase avancée précédemment traités et traités par bosutinib à 500 mg, le déclin médian du DFGe était de 7,6 ml/min/1,73 m2 à 1 an, de 12,3 ml/min/1,73 m2 à 5 ans et de 15,9 ml/min/1,73 m2 à 10 ans pour les patients sous traitement. Chez les patients atteints de LMC Ph+ précédemment traités par au moins un ITK et traités par bosutinib à la dose de 500 mg, la diminution médiane du DFGe par rapport à l’inclusion était de 9,2 ml/min/1,73 m2 à 1 an et de 14,5 ml/min/1,73 m2 à 4 ans pour les patients sous traitement.
Il est important d’évaluer la fonction rénale avant l’initiation du traitement et de la surveiller étroitement pendant le traitement par bosutinib, en particulier chez les patients présentant une altération préexistante de la fonction rénale ou des facteurs de risque de dysfonctionnement rénal, y compris en cas d’utilisation concomitante de médicaments potentiellement néphrotoxiques tels que les diurétiques, les inhibiteurs de l'enzyme de conversion de l'angiotensine (IEC), les antagonistes des récepteurs de l’angiotensine (ARA-II) et les anti-inflammatoires non stéroïdiens (AINS).
Lors d’une étude sur l’atteinte de la fonction rénale, les expositions au bosutinib ont augmenté chez les patients présentant une atteinte modérée ou sévère de la fonction rénale. Une diminution de la dose est recommandée chez les patients souffrant d’une atteinte modérée ou sévère de la fonction rénale (voir rubriques 4.2 et 5.2).
Les patients dont la créatinine sérique était >1,5 x LSN ont été exclus des études sur la LMC. Sur la base d'une analyse pharmacocinétique de population, une augmentation de l'exposition (ASC) au bosutinib a été observée, à l’initiation du traitement, chez les patients présentant une atteinte modérée ou sévère de la fonction rénale, au cours des études cliniques (voir rubriques 4.2 et 5.2).
Les données cliniques sont très limitées (n = 3) chez les patients atteints de LMC présentant une atteinte de la fonction rénale et ayant reçu une dose de bosutinib augmentée à 600 mg.
Population asiatique
D’après les analyses pharmacocinétiques de population, les Asiatiques ont présenté une clairance inférieure, ce qui a entraîné une exposition accrue. Par conséquent, ces patients doivent faire l’objet d’une surveillance étroite afin de détecter tout effet indésirable, notamment en cas d’augmentation de la dose.
Réactions cutanées sévères
Le bosutinib peut provoquer des réactions cutanées sévères telles qu’un syndrome de Stevens-Johnson ou une nécrolyse épidermique toxique. Le bosutinib doit être arrêté définitivement chez les patients présentant une réaction cutanée sévère au cours du traitement.
Syndrome de lyse tumorale
En raison de la survenue possible d’un syndrome de lyse tumorale (SLT), il est recommandé de corriger toute déshydratation cliniquement significative et de traiter l’hyperuricémie avant l’initiation du traitement par bosutinib (voir rubrique 4.8).
Réactivation d'hépatite B
Des cas de réactivation du virus l’hépatite B (VHB) ont été rapportés chez des patients porteurs chroniques du virus et traités par des ITKs BCR-ABL. Certains de ces cas ont évolué vers une insuffisance hépatique aiguë ou une hépatite fulminante requérant une transplantation hépatique ou dont l’issue a été fatale.
Tous les patients doivent faire l’objet d’un dépistage d’une infection par le VHB avant l’initiation d’un traitement par bosutinib. Un médecin spécialisé en hépatologie doit être consulté avant instauration du traitement chez les patients porteurs de marqueurs sérologiques positifs (y compris ceux ayant une VHB active) et chez les patients dont la sérologie devient positive en cours du traitement. Les patients porteurs du VHB doivent être étroitement suivis tout au long du traitement par bosutinib et plusieurs mois après la fin du traitement (voir rubrique 4.8).
Photosensibilité
Une exposition directe au soleil ou au rayonnement ultraviolet (UV) doit être évitée ou réduite en raison du risque de photosensibilité associé au traitement par bosutinib. Les patients doivent être informés qu'ils doivent utiliser des mesures telles que des vêtements de protection et un écran solaire avec un filtre de protection solaire (SPF) élevé.
Inhibiteurs du cytochrome P450 (CYP)3A
L'administration concomitante de bosutinib et d’inhibiteurs puissants ou modérés du CYP3A doit être évitée, car elle entraîne une élévation de la concentration plasmatique en bosutinib (voir rubrique 4.5).
Il est recommandé, dans la mesure du possible, de s’orienter vers un autre traitement concomitant sans potentiel d'inhibition du CYP3A (ou avec un faible potentiel).
Si un inhibiteur du CYP3A puissant ou modéré doit être administré pendant le traitement par bosutinib une interruption ou une réduction de la dose de bosutinib doit être envisagée.
Inducteurs du CYP3A
L'administration concomitante de bosutinib et d’inducteurs puissants ou modérés du CYP3A doit être évitée, car elle entraîne une baisse de la concentration plasmatique en bosutinib (voir rubrique 4.5).
Interactions alimentaires
Les produits à base de pamplemousse, y compris le jus de pamplemousse, et les autres aliments exerçant un effet inhibiteur du CYP3A doivent être évités (voir rubrique 4.5).
Sodium alimentaire
Ce médicament contient moins de 1 mmol (23 mg) de sodium par comprimé. Les patients suivant un régime hyposodé doivent être informés que ce produit est essentiellement « sans sodium ».
4.5. Interactions avec d'autres médicaments et autres formes d'interactions 
Effets des autres médicaments sur bosutinib
Inhibiteurs du CYP3A
L'administration concomitante de bosutinib et d’inhibiteurs puissants du CYP3A (y compris, sans s'y limiter, itraconazole, kétoconazole, posaconazole, voriconazole, clarithromycine, télithromycine, néfazodone, mibéfradil, indinavir, lopinavir/ritonavir, nelfinavir, ritonavir, saquinavir, bocéprévir, télaprévir, produits à base de pamplemousse y compris le jus de pamplemousse) ou d’inhibiteurs modérés du CYP3A (y compris, sans s'y limiter, fluconazole, ciprofloxacine, érythromycine, diltiazem, vérapamil, amprénavir, atazanavir, darunavir/ritonavir, fosamprénavir, aprépitant, crizotinib, imatinib) doit être évitée, car elle entraîne une élévation de la concentration plasmatique du bosutinib.
La prudence est de rigueur en cas d'administration concomitante d'inhibiteurs faibles du CYP3A et de bosutinib.
Il est recommandé, dans la mesure du possible, de s’orienter vers un autre traitement concomitant sans potentiel d'inhibition de l'enzyme CYP3A (ou avec un faible potentiel).
Si un inhibiteur du CYP3A puissant ou modéré doit être administré pendant le traitement par bosutinib, une interruption ou une réduction de la dose de bosutinib doit être envisagée.
Dans une étude portant sur 24 sujets sains recevant 5 doses quotidiennes de 400 mg de kétoconazole (un inhibiteur puissant du CYP3A) en concomitance avec une dose unique de 100 mg de bosutinib à jeun, le kétoconazole a multiplié par 5,2 la Cmax de bosutinib et par 8,6 l'ASC de bosutinib dans le plasma, en comparaison avec l'administration de bosutinib seul.
Dans une étude portant sur 20 sujets sains, recevant une dose unique de 125 mg d'aprépitant (un inhibiteur modéré du CYP3A) en association avec une dose unique de 500 mg de bosutinib après un repas, l'aprépitant a multiplié par 1,5 la Cmax de bosutinib et par 2,0 l'ASC de bosutinib dans le plasma, en comparaison avec l'administration de bosutinib seul.
Inducteurs du CYP3A
L'administration concomitante de bosutinib et d’inducteurs puissants du CYP3A (y compris, sans s'y limiter, carbamazépine, phénytoïne, rifampicine, millepertuis) ou d’inducteurs modérés du CYP3A (y compris, sans s'y limiter, bosentan, éfavirenz, étravirine, modafinil, nafcilline) doit être évitée, car elle entraîne une baisse de la concentration plasmatique du bosutinib.
Etant donné l’importante diminution de l'exposition au bosutinib observée en cas de co-administration de bosutinib et de rifampicine, il est peu probable que l'augmentation de la dose de bosutinib lors de l'administration concomitante d'inducteurs puissants ou modérés du CYP3A compense suffisamment la perte d'exposition.
La prudence est de rigueur en cas d'administration concomitante d'inducteurs faibles du CYP3A avec bosutinib.
Après la co-administration d'une dose unique de BOSUTINIB BIOGARAN et de 6 doses quotidiennes de 600 mg de rifampicine chez 24 sujets sains après le repas, l'exposition au bosutinib (Cmax et ASC dans le plasma) a diminué de 14 % et 6 %, respectivement, par rapport aux valeurs enregistrées lors de l'administration de 500 mg de bosutinib seul.
Inhibiteurs de la pompe à protons (IPP)
La prudence est de rigueur lors de l'administration concomitante de bosutinib et IPPs. Des antiacides d'action rapide doivent être envisagés en remplacement des IPP. Les heures d'administration de bosutinib et des antiacides doivent être différentes dans la mesure du possible (par ex. prise de bosutinib le matin et des antiacides le soir). Bosutinib présente une hydrosolubilité dépendante du pH in vitro. Lorsqu'une dose unique de bosutinib (400 mg) par voie orale était co-administrée avec des doses multiples de lansoprazole (60 mg) par voie orale chez 24 sujets sains à jeun, la Cmax et l'ASC de bosutinib ont chuté à 54 % et 74 %, respectivement, par rapport aux valeurs obtenues lorsque bosutinib (400 mg) était administré seul.
Effets de bosutinib sur les autres médicaments
Dans une étude portant sur 27 sujets sains, recevant une dose unique de 500 mg de bosutinib en association avec une dose unique de 150 mg de mésilate de dabigatran étexilate (un substrat de la glycoprotéine P [P-gp]) après un repas, bosutinib n'a pas augmenté la Cmax ni l'ASC du dabigatran dans le plasma, en comparaison avec l'administration de mésilate de dabigatran étexilate seul. Les résultats de l'étude indiquent que bosutinib ne présente pas d'effets inhibiteurs de la P-gp cliniquement significatifs.
Une étude in vitro indique que les interactions médicamenteuses sont peu probables aux doses thérapeutiques en raison de l'induction par bosutinib du métabolisme de médicaments substrats du CYP1A2, du CYP2B6, du CYP2C9, du CYP2C19 et du CYP3A4.
Des études in vitro indiquent que les interactions médicamenteuses cliniques sont peu probables aux doses thérapeutiques en raison de l'inhibition par bosutinib du métabolisme de médicaments substrats du CYP1A2, du CYP2A6, du CYP2C8, du CYP2C9, du CYP2C19, du CYP2D6 ou du CYP3A4/5.
Des études in vitro indiquent que le bosutinib présente un faible potentiel d’inhibition de la protéine de résistance au cancer du sein (BCRP, systémique), du polypeptide de transport des anions organiques (OATP)1B1, OATP1B3, du transporteur des anions organiques (OAT)1, OAT3, du transporteur des cations organiques (OCT)2 à des concentrations cliniquement pertinentes, mais il est susceptible d’inhiber la BCRP dans le tractus gastro-intestinal et l’OCT1.
Anti-arythmiques et autres substances susceptibles d’allonger l'intervalle QT
Bosutinib doit être utilisé avec prudence chez les patients présentant, ou susceptibles de développer, un allongement de l'intervalle QT, notamment les patients sous anti-arythmiques tels que l'amiodarone, le disopyramide, le procaïnamide, la quinidine et le sotalol, ou d'autres médicaments pouvant entraîner un allongement de l'intervalle QT tels que la chloroquine, l'halofantrine, la clarithromycine, le dompéridone, l'halopéridol, la méthadone et la moxifloxacine (voir rubrique 4.4).
4.6. Fertilité, grossesse et allaitement 
Femmes en âge de procréer/Contraception
Les femmes en âge de procréer doivent être informées de la nécessité d'utiliser un moyen de contraception efficace pendant le traitement par bosutinib et durant au moins 1 mois après l'administration de la dernière dose afin d'éviter toute grossesse pendant le traitement par bosutinib. En outre, elles doivent être averties que les vomissements ou diarrhées sont susceptibles de réduire l'efficacité des contraceptifs oraux en empêchant leur absorption complète.
Grossesse
Il existe des données limitées sur l'utilisation de bosutinib chez la femme enceinte. Les études effectuées chez l'animal ont mis en évidence une toxicité sur la reproduction (voir rubrique 5.3).
Bosutinib n'est pas recommandé pendant la grossesse et chez les femmes en âge de procréer n'utilisant pas de contraception. Si bosutinib est administré pendant la grossesse ou si la patiente tombe enceinte pendant le traitement par bosutinib, elle doit être informée des risques potentiels pour le fœtus.
Allaitement
On ne sait pas si bosutinib et ses métabolites sont excrétés dans le lait maternel. Une étude avec bosutinib radiomarqué au [14C] chez des rats a démontré l'excrétion d'une radioactivité dérivée du bosutinib dans le lait maternel (voir rubrique 5.3). Un risque pour les nourrissons allaités ne peut être exclu. L'allaitement doit être interrompu au cours du traitement avec bosutinib.
Fertilité
Sur base de résultats non cliniques, il est possible que bosutinib nuise à la fonction de reproduction et à la fertilité chez l'être humain (voir rubrique 5.3).
Il est conseillé aux hommes traités par bosutinib de se renseigner sur la conservation des spermatozoïdes avant le traitement en raison d'une possible diminution de la fertilité due au traitement par bosutinib.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines 
Résumé du profil de sécurité d’emploi
Au total, 1 372 patients atteints de leucémie ont reçu au moins une dose unique de bosutinib en monothérapie. La durée médiane du traitement était de 26,30 mois (intervalle : 0,03 à 170,49 mois).
Ces patients étaient soit atteints d’une LMC-PC nouvellement diagnostiquée, soit résistants ou intolérants aux traitements précédents d’une LMC en phase chronique ou accélérée, ou en crise blastique, ou encore atteints d’une leucémie aiguë lymphoblastique (LAL) Ph+. Parmi ces patients, 268 (dose d’initiation de bosutinib à 400 mg) et 248 (dose d’initiation de bosutinib à 500 mg) sont issus de 2 études de phase 3 menées sur des patients LMC n’ayant reçu aucun traitement antérieur, 60 (dose d’initiation de bosutinib à 400 mg) sont issus d’une étude de phase 2 menée sur des patients LMC n’ayant reçu aucun traitement antérieur, 570 et 63 (phase 2 : dose d’initiation de bosutinib à 500 mg) sont issus de 2 études de phase 1/2 menées sur des patients atteints de leucémies Ph+ précédemment traitées, et 163 (dose d’initiation de bosutinib à 500 mg) sont issus d’une étude de phase 4 menée sur des patients LMC précédemment traitées. La durée médiane du traitement était de 55,1 mois (intervalle : 0,2 à 60,05 mois), 61,6 mois (intervalle : 0,03 à 145,86 mois), 15,3 mois (intervalle : 0,3 à 21,8 mois), 11,1 mois (intervalle : 0,03 à 170,49 mois), 30,2 mois (intervalle : 0,2 à 85,6 mois) et 37,8 mois (intervalle : 0,16 à 50,0 mois) respectivement. Les analyses de sécurité ont inclus des données provenant d’une étude d’extension terminée.
Au moins un effet indésirable au médicament, tous grades de toxicité confondus, a été rapporté chez 1 349 (98,3 %) patients. Les effets indésirables les plus fréquemment rapportés chez ≥ 20 % des patients étaient : diarrhée (80,4 %), nausées (41,5 %), douleur abdominale (35,6%), thrombopénie (34,4 %), vomissements (33,7 %), rash (32,8 %), élévation de l’ALAT (28,0 %), anémie (27,2 %), fièvre (23,4 %), élévation de l’ASAT (22,5 %), fatigue (32,0 %), et céphalée (20,3 %). Au moins un effet indésirable au médicament de grade 3 ou 4 a été rapporté chez 943 (68,7 %) patients. Les effets indésirables de grade 3 ou 4 rapportés chez ≥ 5 % des patients étaient : thrombopénie (19,7 %), élévation de l’ALAT (14,6 %), neutropénie (10,6 %), diarrhée (10,6 %), anémie (10,3 %), élévation de la lipase (10,1 %), élévation de l’ASAT (6,7 %), et rash (5,0 %).
Tableau des effets indésirables
Les effets indésirables suivants ont été rapportés au cours des essais cliniques menés sur bosutinib (tableau 2). Ils représentent une évaluation des données concernant les événements indésirables survenus chez 1 372 patients atteints soit de LMC-PC nouvellement diagnostiquée, de LMC en phase chronique ou accélérée ou en crise blastique résistante ou intolérante à des traitements antérieurs soit de LAL Ph+ ayant reçu au moins 1 dose unique de bosutinib en monothérapie. Ces effets indésirables sont présentés par classe de systèmes d'organes et par fréquence. Les catégories de fréquence sont définies comme suit : très fréquent (≥1/10), fréquent (≥ 1/100, <1/10), peu fréquent (≥ 1/1 000, < 1/100), rare (≥ 1/10 000, < 1/1 000), très rare (< 1/10 000), fréquence indéterminée (ne peut être estimée sur la base des données disponibles). Dans chaque groupe de fréquence, les effets indésirables sont classés par ordre de gravité décroissante.
Tableau 2 – Effets indésirables de bosutinib
|
Très fréquent |
Infection des voies respiratoires (incluant infection des voies respiratoires inférieures, infection virale des voies respiratoires, infection des voies respiratoires supérieures, infection virale des voies respiratoires supérieures), rhinopharyngite |
|
|
Fréquent |
Pneumonie (incluant pneumonie atypique, pneumonie bactérienne, pneumonie fongique, pneumonie nécrosante, pneumonie streptococcique , grippe (incluant la grippe H1N1), bronchite |
|
|
Tumeurs bénignes, malignes et non précisées (incl. kystes et polypes) |
||
|
Peu fréquent |
Syndrome de lyse tumorale** |
|
|
Affections hématologiques et du système lymphatique |
||
|
Très fréquent |
Thrombopénie (incluant diminution du taux de plaquettes), neutropénie (incluant diminution du taux de neutrophiles), anémie (incluant diminution du taux d’hémoglobine, diminution du taux de globules rouges) |
|
|
Fréquent |
Leucopénie (incluant diminution du taux de globules blancs) |
|
|
Peu fréquent |
Neutropénie fébrile, granulocytopénie |
|
|
Affections du système immunitaire |
||
|
Fréquent |
Hypersensibilité médicamenteuse |
|
|
Peu fréquent |
Choc anaphylactique |
|
|
Troubles du métabolisme et de la nutrition |
||
|
Très fréquent |
Appétit diminué |
|
|
Fréquent |
Déshydratation, hyperkaliémie (incluant augmentation du potassium sanguin), hypophosphatémie (incluant diminution du phosphore sanguin) |
|
|
Affections du système nerveux |
||
|
Très fréquent |
Sensation vertigineuse, céphalée |
|
|
Fréquent |
Dysgueusie |
|
|
Affections de l'oreille et du labyrinthe |
||
|
Fréquent |
Acouphènes |
|
|
Affections cardiaques |
||
|
Fréquent |
Épanchement péricardique |
|
|
Peu fréquent |
Péricardite |
|
|
Affections vasculaires |
||
|
Fréquent |
Hypertension (incluant augmentation de la pression artérielle, augmentation de la pression artérielle systolique, hypertension essentielle, crise d'hypertension) |
|
|
Affections respiratoires, thoraciques et médiastinales |
||
|
Très fréquent |
Épanchement pleural, dyspnée, toux |
|
|
Fréquent |
Hypertension pulmonaire (incluant hypertension artérielle pulmonaire, augmentation de la pression artérielle pulmonaire), insuffisance respiratoire |
|
|
Peu fréquent |
Œdème pulmonaire aigu (incluant œdème pulmonaire) |
|
|
Fréquence indéterminée |
Pneumopathie interstitielle |
|
|
Affections gastro-intestinales |
||
|
Très fréquent |
Diarrhée, vomissement, nausées, douleur abdominale (incluant gêne abdominale, douleurs abdominales basse et haute, abdomen sensible, douleur gastro-intestinale) |
|
|
Fréquent |
Hémorragies gastro-intestinales (incluant hémorragie anale, hémorragie gastrique, hémorragie intestinale, hémorragie gastro-intestinale basse, hémorragie rectale, hémorragie gastro-intestinale haute), pancréatite (incluant pancréatite aiguë), gastrite |
|
|
Affections hépatobiliaires |
||
|
Fréquent |
Hépatotoxicité (incluant hépatite, hépatite toxique, troubles hépatiques), fonction hépatique anormale (incluant augmentation des enzymes hépatiques, test de la fonction hépatique anormal, test de la fonction hépatique augmenté, augmentation des transaminases) |
|
|
Peu fréquent |
Lésion du foie (incluant lésion du foie d’origine médicamenteuse, lésion hépatocellulaire) |
|
|
Affections de la peau et du tissu sous-cutané |
||
|
Très fréquent |
Rash (incluant rash maculaire, rash maculopapulaire, rash papuleux, rash pruritique), prurit |
|
|
Fréquent |
Réaction de photosensibilité (incluant éruption lumineuse polymorphe), urticaire, acné |
|
|
Peu fréquent |
Érythème polymorphe, rash avec exfoliation, éruption d’origine médicamenteuse |
|
|
Fréquence indéterminée |
Syndrome de Stevens-Johnson**, nécrolyse épidermique toxique** |
|
|
Affections musculo-squelettiques et systémiques |
||
|
Très fréquent |
Arthralgie, dorsalgie |
|
|
Fréquent |
Myalgie |
|
|
Affections du rein et des voies urinaires |
||
|
Fréquent |
Insuffisance rénale aiguë, insuffisance rénale, altération de la fonction rénale |
|
|
Troubles généraux et anomalies au site d'administration |
||
|
Très fréquent |
Œdème (incluant œdème des paupières, œdème de la face, œdème généralisé, œdème localisé, œdème périphérique, œdème périorbitaire, gonflement périorbitaire, gonflement périphérique, gonflement, gonflement des paupières), fièvre, fatigue (incluant asthénie, malaise) |
|
|
Fréquent |
Douleur thoracique (incluant gêne thoracique), douleur |
|
|
Investigations |
|
|
|
Très fréquent |
Augmentation du taux de lipase (incluant hyperlipasémie), augmentation de l’alanine aminotransférase (incluant anomalie de l’alanine aminotransférase), augmentation de l’aspartate aminotransférase, augmentation de la créatinine sanguine. |
|
|
Fréquent |
Allongement de l’intervalle QT de l’électrocardiogramme (incluant le syndrome du QT long), augmentation de l’amylase (incluant l’hyperamylasémie), augmentation de la créatine phosphokinase sanguine, augmentation de la gamma glutamyltransférase, augmentation de la bilirubine sanguine (incluant l’hyperbilirubinémie, augmentation de la bilirubine conjuguée, augmentation de la bilirubine non conjuguée) |
|
** Effet indésirable identifié après la commercialisation.
Description de certains effets indésirables
Les descriptions figurant ci-dessous sont basées sur un groupe de 1 372 patients ayant reçu au moins une dose de bosutinib et ayant été traités soit pour une LMC-PC nouvellement diagnostiquée, soit pour une LMC, qu’elle soit en PC, PA ou CB, ou une LAL Ph+ présentant une résistance ou une intolérance au traitement précédent.
Affections hématologiques et du système lymphatique
Sur les 372 (27,1 %) patients ayant rapporté des événements indésirables d’anémie, 6 ont arrêté le traitement par bosutinib en raison d’une anémie. Une toxicité maximale de Grade 1 a été rapportée chez 95 (25,5 %) patients, de Grade 2 chez 135 (36,3 %) patients, de Grade 3 chez 113 patients (30,4 %) et de Grade 4 chez 29 (7,8 %) patients. Parmi ces patients, le délai médian d'apparition du premier événement était de 29 jours (intervalle : 1 à 3 999 jours) et la durée médiane par événement était de 22 jours (intervalle : 1 à 3 682 jours).
Sur les 209 (15,2 %) patients ayant rapporté une neutropénie comme effet indésirable, 19 ont arrêté le traitement par bosutinib en raison de la neutropénie. Une toxicité maximale de Grade 1 a été rapportée chez 19 (9,1 %) patients, de Grade 2 chez 45 (21,5 %) patients, de Grade 3 chez 95 (45,5 %) patients et de Grade 4 chez 50 (23,9 %) patients. Parmi ces patients, le délai médian d'apparition du premier événement était de 56 jours (intervalle : 1 à 1 769 jours) et la durée médiane par événement de 15 jours (intervalle : 1 à 913 jours).
Sur les 472 (34,4 %) patients ayant rapporté une thrombopénie comme effet indésirable, 42 sujets ont arrêté bosutinib en raison de la thrombopénie. Une toxicité maximale de Grade 1 a été rapportée chez 114 (24,2 %) patients, de Grade 2 chez 88 (18,6 %) patients, de Grade 3 chez 172 (36,4 %) patients et de Grade 4 chez 98 (20,8 %) patients. Parmi ces patients, le délai médian d’apparition du premier événement était de 28 jours (intervalle : 1 à 1 688 jours) et la durée médiane par événement de 15 jours (intervalle : 1 à 3 921 jours).
Affections hépatobiliaires
Parmi les patients ayant rapporté des élévations de l'ALAT ou de l'ASAT (tous grades confondus) comme effets indésirables, le délai médian d’apparition observé était de 29 jours, avec un intervalle d’apparition de 1 à 3 995 jours pour l’ALAT et l’ASAT. La durée médiane d'un événement était de 17 jours (intervalle : 1 à 1 148 jours), et de 15 jours (intervalle : 1 à 803 jours) pour l’ALAT et l'ASAT respectivement.
Deux cas compatibles avec une toxicité hépatique d’origine médicamenteuse (définis comme des élévations concomitantes des ALAT ou des ASAT ≥ 3 x LSN et de la bilirubine totale > 2 x LSN avec une phosphatase alcaline < 2 x LSN) sans autres causes ont été rapportés chez 2/1 711 (0,1 %) sujets ayant reçu bosutinib.
Réactivation d'hépatite B
Des cas de réactivation du virus de l’hépatite B ont été rapportés chez des patients traités par des inhibiteurs de la tyrosine kinase BCR-ABL. Certains de ces cas ont évolué vers une insuffisance hépatique aiguë ou une hépatite fulminante requérant une transplantation hépatique ou dont l’issue a été fatale (voir rubrique 4.4).
Affections gastro-intestinales
Sur les 1 103 (80,4 %) patients ayant présenté une diarrhée, 14 patients ont arrêté le traitement par bosutinib en raison de cet évènement. Des médicaments concomitants ont été administrés pour traiter la diarrhée chez 756 (68,5 %) patients. Une toxicité maximale de Grade 1 a été reportée chez 575 (52, 1 %) patients, de grade 2 chez 383 (34,7 %) patients, de Grade 3 chez 144 (13,1 %) patients ; 1 seul patient (0,1 %) ayant présenté un événement de Grade 4. Parmi les patients atteints de diarrhée, le délai médian d'apparition du premier événement était de 2 jours (intervalle : 1 à 2 702 jours) et la durée médiane de la diarrhée (tous grades confondus) de 2 jours (intervalle : 1 à 4 247 jours).
Parmi les 1 103 patients souffrant de diarrhée, 218 patients (19,8 %) ont été pris en charge par une interruption de leur traitement et 208 (95,4 %) d'entre eux ont repris ensuite le traitement par bosutinib. Parmi les patients ayant repris le traitement, 201 (96,6 %) n'ont pas constaté d'autre événement ni arrêté le traitement par bosutinib en raison d'un nouvel événement de diarrhée.
Affections cardiaques
Sept patients (0,5 %) ont présenté un allongement de QTcF (supérieur à 500 ms). Onze patients (0,8 %) ont présenté un allongement QTcF > 60 ms par rapport aux valeurs initiales. Les patients atteints d'une maladie cardiovasculaire non contrôlée ou significative, y compris un allongement du QTc, à l'inclusion ont été exclus des études cliniques (voir rubriques 5.1 et 5.3).
Déclaration des effets indésirables suspectés.
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/.
L'expérience concernant un surdosage de bosutinib dans les études cliniques s'est limitée à des cas isolés. Les patients prenant une surdose de bosutinib doivent être mis sous surveillance et recevoir un traitement approprié.
5. PROPRIETES PHARMACOLOGIQUES 
5.1. Propriétés pharmacodynamiques 
Mécanisme d’action
Bosutinib appartient à une classe pharmacologique de médicaments appelée inhibiteurs des protéines kinases. Bosutinib inhibe la protéine kinase anormale BCR-ABL à l'origine de la LMC. Selon les études de modélisation, bosutinib se lie au domaine kinase de BCR-ABL. Bosutinib est également un inhibiteur des kinases de la famille Src, dont Src, Lyn et Hck ; bosutinib inhibe de manière minimale le récepteur du facteur de croissance dérivé des plaquettes (PDGF) et le c-Kit.
Dans les études in vitro, bosutinib inhibe la prolifération et la survie des lignées cellulaires établies de la LMC, des lignées cellulaires de la LAL Ph+ et des cellules primitives de LMC dérivées du patient.
Bosutinib a inhibé 16 des 18 formes de BCR-ABL résistantes à l'imatinib exprimées dans des lignées cellulaires myéloïdes murines. Le traitement par bosutinib a réduit la taille des tumeurs de la LMC se développant chez des souris Nude et a inhibé la croissance des tumeurs myéloïdes murines exprimant des formes de BCR-ABL résistantes à l'imatinib. Bosutinib inhibe également le récepteur des tyrosine kinases c-Fms, les récepteurs EphA et B, les kinases des familles Trk, Axl et Tec, certains membres de la famille ErbB, la tyrosine kinase non réceptrice Csk, les sérine/thréonine kinases de la famille Ste20, et 2 protéines kinases dépendantes de la calmoduline.
Effets pharmacodynamiques
L'effet de l'administration de bosutinib 500 mg sur le QTc a été évalué dans le cadre d'une étude randomisée, à dose unique, en double aveugle, avec permutation, contrôlée vs placebo et avec le moxifloxacine en ouvert chez des sujets sains.
Les résultats de cette étude indiquent que bosutinib n’allonge pas le QTc chez les sujets sains à la dose journalière de 500 mg prise au moment des repas et dans des conditions entraînant des concentrations plasmatiques supra-thérapeutiques. Après l'administration d'une dose unique de bosutinib 500 mg par voie orale (dose thérapeutique) et de bosutinib 500 mg avec du kétoconazole 400 mg (pour atteindre des concentrations supra-thérapeutiques de bosutinib) chez des sujets sains, la limite supérieure de l'intervalle de confiance (IC) unilatéral à 95 % concernant le changement moyen de l'intervalle QTc était inférieure à 10 ms à tous les moments en post-dose et aucun effet indésirable suggérant un allongement du QTc n'a été observé.
Dans une étude portant sur des sujets insuffisants hépatiques, une fréquence accrue de l’allongement de l'intervalle QTc > 450 ms, accompagnée d'une baisse de la fonction hépatique, a été observée. Dans l'étude clinique de phase 1/2 portant sur des patients atteints de leucémies Ph+ précédemment traitées par 500 mg de bosutinib, un allongementdu QTcF >60 ms par rapport à la valeur de référence a été constatée chez 9 (1,6 %) des 570 patients. Dans l’étude clinique de phase 3 portant sur des patients atteints de LMC-PC nouvellement diagnostiquée, traités par 400 mg de bosutinib, aucun allongement du QTcF > 60 ms (N = 268) par rapport à la valeur de référence n’a été constatée. Dans l'étude clinique de phase 3 portant sur des patients atteints de LMC-PC Ph+ nouvellement diagnostiquée, traités par 500 mg de bosutinib, un allongement de l'intervalle QTcF > 60 ms par rapport à la valeur de référence a été constatée chez 2 (0,8 %) des 248 patients sous bosutinib.
Dans l’étude clinique de phase 4 menée chez des patients atteints de LMC Ph+ précédemment traités par un ou plusieurs ITK et traités par le 500 mg de bosutinib (N = 163), aucun patient n’a présenté un allongement du QTcF > 60 ms par rapport à la valeur de référence. Un effet proarythmique du bosutinib ne peut être exclu.
Efficacité clinique
Étude clinique sur la LMC en PC non précédemment traitée
Étude évaluant le bosutinib à 400 mg
Un essai de supériorité, de phase 3, multicentrique, en ouvert, randomisé en 2 bras a été mené pour évaluer l’efficacité et l’innocuité du bosutinib 400 mg une fois par jour en monothérapie, par rapport à l’imatinib 400 mg une fois par jour en monothérapie chez les patients adultes atteints de LMC-PC Ph+ nouvellement diagnostiquée. L’essai a randomisé 536 patients (268 dans chaque groupe de traitement) atteints de LMC-PC Ph+ ou Ph- nouvellement diagnostiquée (population en intention de traiter [ITT]) incluant 487 patients atteints d’une LMC Ph+ présentant des transcrits b2a2 et/ou b3a2 et un nombre de copies BCR–ABL identifiées à l’inclusion > 0 (population en intention de traiter modifiée [ITTm]).
La proportion de réponse moléculaire majeure (RMM) à 12 mois (48 semaines) dans le groupe traité par bosutinib par rapport à celle du groupe traité par imatinib dans la population ITTm constituait le critère d’efficacité principal. La RMM a été définie comme étant un rapport BCR–ABL/ABL ≤ 0,1 % selon l’échelle internationale (correspondant à une réduction ≥ 3 log par rapport aux valeurs de référence standard) avec un minimum de 3 000 transcrits ABL évalués par le laboratoire central.
Les principaux critères secondaires comprenaient la réponse cytogénétique complète (RCyC) cumulée sur 12 mois, la durée de la RCyC, la durée de la RMM, la survie sans événement (SSE) et la survie globale (SG). La RCyC cumulée sur 12 mois a été définie comme l’absence de métaphases Ph+ dans l’analyse des bandes chromosomiques de ≥ 20 métaphases provenant de l’aspiration de moelle osseuse ou de la RMM en l’absence d’une évaluation cytogénétique adéquate. Les valeurs de p pour les critères d’évaluation autres que la RMM à 12 mois et la RCyC cumulée sur 12 mois n’ont pas été ajustées pour les comparaisons multiples.
Les caractéristiques initiales avant traitement de la population ITTm étaient bien équilibrées entre les 2 groupes de traitement en fonction de l’âge (l’âge médian était de 52 ans pour le groupe bosutinib et de 53 ans pour le groupe imatinib avec 19,5 % et 17,4 % de patients âgés de 65 ans et plus, respectivement) ; du sexe (42,3 % et 44,0 % de femmes, respectivement) ; de l’origine ethnique (78,0 % et 77,6 % de Caucasiens, 12,2 % et 12,4 % d’Asiatiques, 4,1 % et 4,1 % de Noirs ou d’Afro- américains, et 5,7 % et 5,4 % de la catégorie « Autre », respectivement, ainsi qu’une personne d’origine ethnique « inconnue » dans le groupe imatinib) ; et du score de risque de Sokal (risque faible : 35,0 % et 39,4 %, risque intermédiaire : 43,5 % et 38,2 %, risque élevé : 21,5 % et 22,4 %, respectivement).
Après une période de suivi de 60 mois dans la population ITTm,60,2 % des patients traités par bosutinib (N = 246) et 59,8 % des patients traités par imatinib (N = 239) recevaient toujours un traitement de première intention.
Après une période de suivi de 60 mois dans la population ITTm, les arrêts de traitement dus à la progression de la maladie vers une LMC en PA ou CB pour les patients traités par bosutinib ont été de 0,8 % contre 1,7 % pour les patients traités par imatinib. Six (2,4 %) patients sous bosutinib et 7 (2,9 %) patients sous imatinib ont subi une progression de la maladie vers une LMC-PA ou une LMC-CB. Des arrêts de traitement dus à une réponse sous-optimale ou à un échec du traitement, tels qu'évalués par l’investigateur, sont survenus chez 5,3 % des patients du groupe traité par bosutinib contre 15,5 % des patients du groupe traité par imatinib. Douze (4,9 %) patients sous bosutinib et 14 (5,8 %) patients sous imatinib sont décédés au cours de l’étude. Aucune progression supplémentaire n’est survenue dans la population ITT, il y a eu 2 décès supplémentaires dans le bras bosutinib dans la population ITT.
Les résultats d’efficacité de la RMM et de la RCyC sont récapitulés dans le tableau 3.
Tableau 3 – Résumé des taux de RMM à 12 mois et à 18 mois ; et des taux de la RCyC cumulée sur 12 mois, par groupe de traitement dans la population ITTm
|
Réponse |
Bosutinib (N = 246) |
Imatinib (N = 241) |
Odds ratio (IC à 95 %)a |
|
Réponse moléculaire majeure RMM à 12 mois, n (%) (IC à 95 %) |
116 (47,2)b (40,9 ; 53,4) |
89 (36,9) (30,8 ; 43,0) |
1,55 (1,07 ; 2,23) |
|
Valeur de p unilatérale |
0,0100b |
||
|
RMM à 18 mois, n (%) |
140 (56,9) |
115 (47,7) |
1,45 (1,02 ; 2,07) |
|
(IC à 95 %) |
(50,7 ; 63,1) |
(41,4 ; 54,0) |
|
|
Valeur de p unilatérale |
0,0208c |
||
|
Réponse cytogénétique |
|
|
|
|
complète |
190 (77,2)b |
160 (66,4) |
1,74 (1,16 ; 2,61) |
|
RCyC cumulée sur 12 mois, n |
(72,0 ; 82,5) |
(60,4 ; 72,4) |
|
|
(%) |
|
|
|
|
(IC à 95 %) |
|
|
|
|
Valeur de p unilatérale |
0,0037b |
||
Remarque : la RMM a été définie comme étant un rapport BCR–ABL/ABL ≤ 0,1 % selon l’échelle internationale (correspondant à une réduction ≥ 3 log par rapport aux valeurs de référence standard) avec un minimum de 3 000 transcrits ABL évalués par le laboratoire central. La réponse cytogénétique complète a été définie comme l’absence de métaphases Ph+ dans l’analyse des bandes chromosomiques de ≥ 20 métaphases provenant de l’aspiration de moelle osseuse ou de la RMM en l’absence d’une évaluation cytogénétique adéquate.
Abréviations : BCR–ABL = breakpoint cluster region–Abelson ; IC = intervalle de confiance ; CMH = Cochran–Mantel–Haenszel ; RCyC = réponse cytogénétique complète ; ITTm = intention de traiter modifiée ; RMM = réponse moléculaire majeure ; N/n = nombre de patients ; Ph+ = chromosome Philadelphie positif.
a Ajusté en fonction du score de Sokal et de la zone géographique au moment de la randomisation.
b Comparaison statistiquement significative au niveau du seuil de significativité prédéfini ; d’après le test de CMH stratifié en fonction du score de Sokal et de la zone géographique au moment de la randomisation.
C D’après le test de CMH stratifié en fonction du score de Sokal et de la zone géographique au moment de la randomisation.
A 12 mois, le taux de RM4 (défini comme BCR–ABL ≤ 0,01 % [correspondant à une réduction ≥ 4 log par rapport aux valeurs de référence standard] avec un minimum de 9 800 transcrits ABL) était plus élevé dans le groupe traité par bosutinib que dans le groupe traité par imatinib dans la population ITTm (20,7 % [IC à 95 % : 15,7 %, 25,8 %] versus 12,0 % [IC à 95 % : 7,9 %, 16,1 %], respectivement, odds ratio (OR) de 1,88 [IC à 95 % : 1,15 ; 3,08], valeur de p unilatérale = 0,0052).
A 3, 6 et 9 mois, la proportion de patients présentant une RMM était plus élevée dans le groupe traité par bosutinib que dans le groupe traité par imatinib (tableau 4).
Tableau 4 – Comparaison des taux de RMM à 3, 6 et 9 mois de traitement dans la population ITTm
|
Délai |
Nombre (%) de sujets présentant une RMM |
Odds ratio (IC à 95 %)a |
|
|
Bosutinib (N = 246) |
Imatinib (N = 241) |
||
|
3 mois |
10 (4,1) |
4 (1,7) |
2,48 (0,77 ; |
|
(IC à 95 %) |
(1,6 ; 6,5) |
(0,0 ; 3,3) |
7,98) |
|
Valeur de p unilatéraleb |
0,0578 |
||
|
6 mois |
86 (35,0) |
44 (18,3) |
2,42 (1,59 ; |
|
(IC à 95 %) |
(29,0 ; 40,9) |
(13,4 ; 23,1) |
3,69) |
|
Valeur de p unilatéraleb |
< 0,0001 |
||
|
9 mois |
104 (42,3) |
71 (29,5) |
1,78 (1,22 ; |
|
(IC à 95 %) |
(36,1 ; 48,4) |
(23,7 ; 35,2) |
2,60) |
|
Valeur de p unilatéraleb |
0,0015 |
||
Remarque : les pourcentages étaient basés sur le nombre de patients dans chaque groupe de traitement. La RMM a été définie comme étant un rapport BCR–ABL/ABL ≤ 0,1 % selon l’échelle internationale (correspondant à une réduction ≥ 3 log par rapport aux valeurs de référence standard) avec un minimum de 3 000 transcrits ABL évalués par le laboratoire central.
Abréviations : BCR–ABL = breakpoint cluster region–Abelson ; IC = intervalle de confiance ; CMH = Cochran–Mantel–Haenszel ; ITTm = intention de traiter modifiée ; RMM = réponse moléculaire majeure ; N = nombre de patients.
a Ajusté en fonction du score de Sokal et de la zone géographique au moment de la randomisation.
b D’après le test de CMH stratifié en fonction du score de Sokal et de la zone géographique au moment de la randomisation.
Cumulée sur 60 mois, dans la population ITTm, la proportion de patients présentant une RMM, une RM4 et une RM4,5 était plus élevée dans le groupe bosutinib que dans le groupe imatinib (tableau 5).
Les taux de RMM cumulée sur 60 mois dans les sous-groupes de risque de Sokal sont récapitulés dans le tableau 6.
Tableau 5 — Résumé de la réponse moléculaire cumulée sur 60 mois dans la population ITTm
|
Réponse |
Bosutinib (N = 246) |
Imatinib (N = 241) |
Odds ratio (IC à 95 %)a |
|
Réponse moléculaire cumulée sur 60 mois, n (%) (IC à 95 %) |
|
|
|
|
RMM |
182 (74,0) (68,5 ; 79,5) |
158 (65,6) (59,6 ; 71,6) |
1,52 (1,02 ; 2,25) |
|
RM4 |
145 (58,9) (52,8 ; 65,1) |
120 (49,8) (43,5 ; 56,1) |
1,46 (1,02 ; 2,09) |
|
RM4,5 |
119 (48,4) (42,1 ; 54,6) |
93 (38,6) (32,4 ; 44,7) |
1,50 (1,05 ; 2,16) |
Remarque : les RMM/RM4/RM4,5 ont été définies comme étant un rapport BCR–ABL/ABL ≤ 0,1/0,01/0,0032 % selon l’échelle internationale (correspondant à une réduction ≥ 3/4/4,5 log par rapport aux valeurs de référence standard) avec un minimum de 3 000/9 800/30 990 transcrits ABL évalués par le laboratoire central.
Abréviations : BCR–ABL = breakpoint cluster region–Abelson ; IC = intervalle de confiance ; ITTm = intention de traiter modifiée ; RMM = réponse moléculaire majeure ; RM = réponse moléculaire ; N/n = nombre de patients.
a Ajusté en fonction du score de Sokal et de la zone géographique au moment de la randomisation.
Tableau 6 — Résumé de la RMM cumulée sur 60 mois par score de risque de Sokal dans la population ITTm
|
Réponse |
Bosutinib |
Imatinib |
Odds ratio (IC à 95 %) |
|
Risque de Sokal faible RMM, n (%) (IC à 95 %) |
N = 86 67 (77,9) (69,1 ; 86,7) |
N = 95 68 (71,6) (62,5 ; 80,6) |
1,40 (0,71 ; 2,76) |
|
Risque de Sokal intermédiaire RMM, n (%) (IC à 95 %) |
N = 107 79 (73,8) (65,5 ; 82,2) |
N = 92 62 (67,4) (57,8 ; 77,0) |
1,37 (0,74 ; 2,52) |
|
Risque de Sokal élevé RMM, n (%) (IC à 95 %) |
N = 53 36 (67,9) (55,4 ; 80,5) |
N = 54 28 (51,9) (38,5 ; 65,2) |
1,97 (0,90 ; 4,32) |
Remarque : les pourcentages étaient basés sur le nombre de patients dans chaque groupe de traitement. La RMM a été définie comme étant un rapport BCR–ABL/ABL ≤ 0,1 % selon l’échelle internationale (correspondant à une réduction ≥ 3 log par rapport aux valeurs de référence standard) avec un minimum de 3 000 transcrits ABL évalués par le laboratoire central.
Abréviations : BCR–ABL = breakpoint cluster region–Abelson ; IC = intervalle de confiance ; ITTm = intention de traiter modifiée ; RMM = réponse moléculaire majeure ; N/n = nombre de patients.
L’incidence cumulée de la RCyC ajustée en fonction du risque concurrent d’arrêt du traitement sans RCyC était plus élevée dans le groupe traité par bosutinib que dans le groupe traité par imatinib dans la population ITTm (83,3 % [IC à 95 % : 78,1 %, 87,4 %] versus 76,8 % [IC à 95 % : 70,9 %, 81,6 %] au Mois 60 ; hazard ratio [HR] à partir d’un modèle de sous-répartition proportionnelle stratifié : 1,35, [IC à 95 % : 1,11, 1,64]) . Le délai médian d’obtention de la RCyC (répondeurs uniquement) était de 24,0 semaines (intervalle : 11,4 à 120,7) dans le groupe bosutinib versus 24,3 semaines (intervalle : 11,4 à 96,6) pour le groupe imatinib.
Le délai médian d’obtention de la RMM, de la RM4 et de la RM4,5 (répondeurs uniquement) était de 36,1 semaines (intervalle : 11,9 à 241,9), 83,7 semaines (intervalle : 12,4 à 244,3) et 108,0 semaines (intervalle : 24,1 à 242,1), respectivement, pour le groupe bosutinib versus 47,7 semaines (intervalle : 12,1 à 216,1), 84,4 semaines (intervalle : 23,6 à 241,9), et 120,4 semaines (intervalle : 24,6 à 240,7), respectivement, pour le groupe imatinib dans la population ITTm.
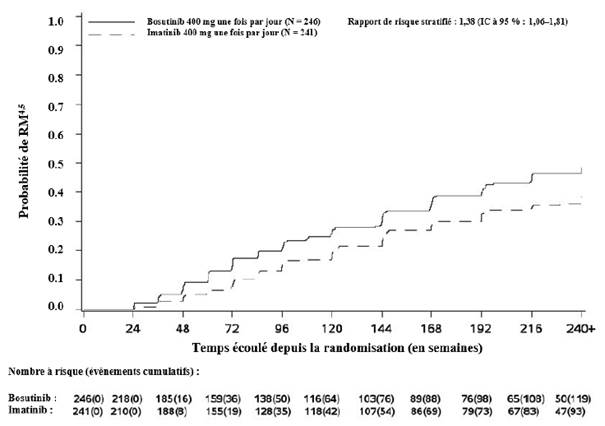
L’incidence cumulée de la RMM, de la RM4 et de la RM4,5 ajustée en fonction du risque concurrent d’arrêt du traitement sans l’événement était plus élevée dans le groupe traité par bosutinib que dans le groupe traité par imatinib, comme illustré aux figures 1 à 3.
Figure 1 — Incidence cumulée de la RMM (population ITTm)
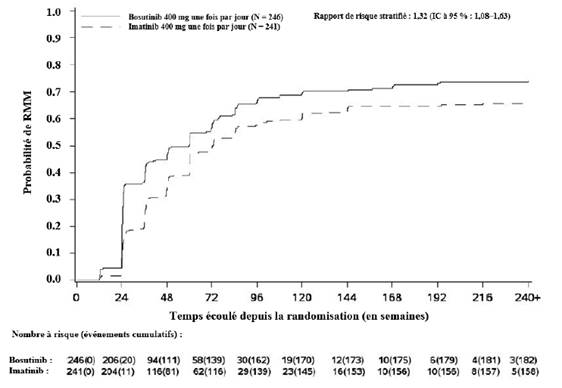
Figure 2 — Incidence cumulée de la RM4 (population ITTm)
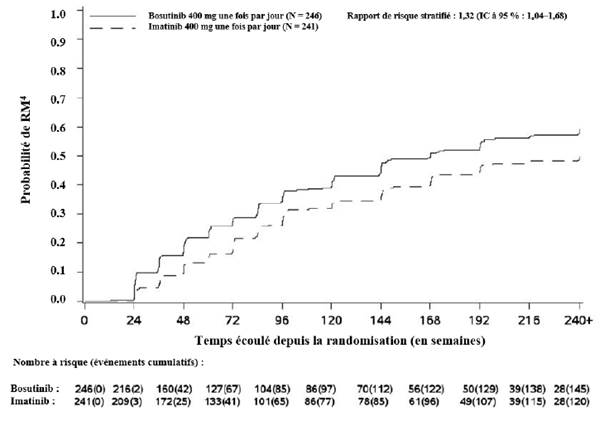
Figure 3 — Incidence cumulée de la RM4,5 (population ITTm)
Dans la population ITTm, parmi les patients ayant obtenu une RCyC, l’estimation de Kaplan-Meier du maintien d’une réponse à 4 ans était de 97,4 % (IC à 95 % : 93,9 % ; 98,9 %) et de 93,7 % (IC à 95 % : 88,9 % ; 96,5 %) dans les groupes bosutinib et imatinib (RR : 0,39 [IC à 95 % : 0,14 ; 1,13]), respectivement. Parmi les patients ayant obtenu une RMM, l’estimation de Kaplan-Meier du maintien d’une réponse à 4 ans était de 92,2 % (IC à 95 % : 86,8 % ; 95,4 %) et de 92,0 % (IC à 95 % : 85,9 % ; 95,5 %) dans les groupes bosutinib et imatinib (HR : 1,09 [IC à 95 % : 0,49 ; 2,44]), respectivement.
Cumulé sur 60 mois, dans la population ITTm, 43,9 % (IC à 95 % : 37,7 % ; 50,1 %) et 38,6 % (IC à 95 % : 32,4 % ; 44,7 %) des patients traités par bosutinib et imatinib (OR : 1,24 [IC à 95 % : 0,87 ; 1,78]), respectivement, avaient une RM4 stable définie par les critères suivants : sous traitement pendant au moins 3 ans avec au moins une RM4 à toutes les évaluations pendant une période de 1 an.
L’incidence cumulée des événements de SSE sous traitement à 60 mois dans la population ITTm était de 6,9 % (IC à 95 % : 4,2 % ; 10,5 %) dans le bras bosutinib et de 10,4 % (IC à 95 % : 6,9 % ; 14,6 %) dans le bras imatinib (HR : 0,64 ; IC à 95 % : 0,35 ; 1,17).
Les estimations de Kaplan–Meier de SG à 60 mois pour les patients sous bosutinib et imatinib dans la population ITTm étaient de 94,9 % (IC à 95 % : 91,1 %, 97,0 %) et 94,0 % (IC à 95 % : 90,1 %, 96,4 %), respectivement (HR : 0,80 ; IC à 95 % : 0,37 ; 1,73).
Dans une analyse rétrospective, parmi les patients évaluables de la population en ITT, plus de patients du bras bosutinib 200/248 (80,6 %) ont obtenu une réponse moléculaire précoce (transcrits BCR-ABL ≤ 10 % à 3 mois) par rapport aux patients du bras imatinib 153/253 (60,5 %), OR : 2,72 (IC à 95 % : 1,82 ; 4,08). La RMM et la SSE à 60 mois chez les patients sous bosutinib avec et sans réponse moléculaire précoce sont récapitulées dans le tableau 7.
Tableau 7 — Résultats à 60 mois chez les patients sous bosutinib avec un BCR-ABL ≤ 10 % vs > 10 % à 3 mois dans la population ITT
|
Bosutinib (N = 248) |
Patients avec un BCR-ABL ≤ 10 % à 3 mois (N = 200) |
Patients avec un BCR-ABL > 10 % à 3 mois (N = 48) |
Hazard ratio (IC à 95 %)a |
|
Incidence cumulée de la RMM, % (IC à 95 %) |
84,0 (78,1 ; 88,4) |
56,5 (41,1 ; 69,4) |
2,67 (1,90 ; 3,75) |
|
Incidence cumulée des événements de SSE, % (IC à 95 %) |
5,5 (2,9 ; 9,3) |
12,5 (5,1 ; 23,4) |
0,40 (0,14 ; 1,17) |
Abréviations : BCR–ABL = breakpoint cluster region–Abelson ; IC = intervalle de confiance ; ITT = intention de traiter ; RMM = réponse moléculaire majeure ; SSE = survie sans événement ; N = nombre de patients présentant des copies ABL ≥ 3 000 à 3 mois.
a Ajusté en fonction du score de Sokal et de la zone géographique au moment de la randomisation.
Moins de patients du bras bosutinib [6 (2,4 %) pour bosutinib et 12 (5,0 %) pour imatinib] présentaient des nouvelles mutations à 60 mois dans la population ITTm.
Étude clinique de phase 1//2 chez des patients atteints de LMC résistante ou intolérante à l'imatinib en PC, PA et en CB
Un essai de phase 1/2 multicentrique, en ouvert, à bras unique a été mené afin d'évaluer l'efficacité et la sécurité d’emploi de bosutinib 500 mg une fois par jour chez des patients atteints de LMC résistante ou intolérante à l'imatinib avec des cohortes distinctes pour les malades en phase chronique, accélérée et en crise blastique précédemment traités avec 1 ITK (imatinib) ou plusieurs ITK (imatinib suivi de dasatinib et/ou de nilotinib).
Au cours de cet essai, 570 sujets ont été traités avec bosutinib, dont des patients atteints de LMC-PC précédemment traités avec 1 seul ITK (imatinib), des patients atteints de LMC-PC précédemment traités avec de l'imatinib et au moins 1 ITK supplémentaire (dasatinib et/ou nilotinib), des patients atteints de LMC en phase accélérée ou en crise blastique précédemment traités avec un ITK au moins (imatinib) et des patients atteints de LAL Ph+ précédemment traités avec 1 ITK au moins (imatinib).
Le principal critère d'évaluation de l'efficacité de l'étude était le taux de réponse cytogénétique majeure (RCyM) à 24 semaines chez les patients atteints de LMC-PC résistants à l'imatinib précédemment traités avec 1 seul ITK (imatinib). Les autres critères d’évaluation d’efficacité comprennent les taux cumulés de réponse cytogénétique et moléculaire, le délai d’obtention et la durée des réponses cytogénétiques et moléculaires, la réponse en fonction des mutations identifiées à l’inclusion, le taux de transformation en PA/CB, la survie sans progression et la SG pour toutes les cohortes.
Les patients qui recevaient encore du bosutinib à la fin de l’étude de phase 1/2 et qui bénéficiaient du traitement par bosutinib selon le jugement de l’investigateur, ainsi que les patients qui avaient déjà arrêté le bosutinib dans le cadre de l’étude de phase 1/2 et qui faisaient l’objet d’un suivi de survie à long terme ou qui avaient terminé l’étude de phase 1/2, étaient admissibles dans l’étude d’extension.
Chaque patient est resté dans l’étude d’extension, soit sous traitement par bosutinib, soit en suivi de survie à long terme, jusqu’à ce que le dernier patient atteigne 10 ans de suivi, calculé à partir de la date de sa première dose de bosutinib administrée dans l’étude de phase 1/2.
Les critères d’efficacité de l’étude d’extension comprenaient la durée des réponses cytogénétiques et moléculaires, le taux de transformation en PA/CB, la survie sans progression et la SG.
Les analyses d’efficacité ont inclus les données finales de cette étude d’extension.
Patients atteints de LMC en PC
Les résultats d'efficacité chez les patients atteints de LMC-PC Ph+ précédemment traités avec de l'imatinib et au moins un ITK supplémentaire (suivi minimum de 120 mois, durée médiane de traitement de 9 mois (intervalle : de 0,23 à 164,28 mois) et 20,2 % et 7,6 % toujours sous traitement à 60 et 120 mois, respectivement) et les résultats de patients atteints de LMC-PC Ph+ précédemment traités avec de l’imatinib uniquement (suivi minimum de 120 mois, durée médiane du traitement de 26 mois (intervalle : de 0,16 à 170,49 mois) et 40,5 % et 19,4 % toujours sous traitement à 60 et 120 mois, respectivement) sont présentés dans le tableau 8.
Patients atteints de LMC en PA et CB
Les résultats d'efficacité chez les patients atteints de LMC Ph+ en PA (suivi minimum de 120 mois, durée médiane du traitement de 10 mois (intervalle : de 0,10 à 156,15 mois) et 12,7 % et 7,6 % toujours sous traitement à 60 et 120 mois, respectivement) et en CB (suivi minimum de 120 mois, durée médiane du traitement de 2,8 mois (intervalle : de 0,03 à 71,38 mois) et 3,1 % et 0 % toujours sous traitement à 60 et 120 mois respectivement) sont présentés dans le tableau 8.
Tableau 8 - Résultats d'efficacité chez des patients précédemment traités atteints de LMC* en phase chronique et avancée
|
|
LMC-PC Ph+ avec traitement antérieur par imatinib uniquement |
LMC-PC Ph+ avec traitement antérieur par imatinib et dasatinib ou nilotinib |
Phase accélérée avec traitement antérieur par imatinib au moins |
Crise blastique avec traitement antérieur par imatinib au moins |
|
Réponse cytogénétique cumuléea |
N = 262 |
N = 112 |
N = 72 |
N = 54 |
|
RCyM, % (IC à 95 %) |
59,9(53,7 ; 65,9) |
42,0(32,7 ; 51,7) |
40,3(28,9 ; 52,5) |
37,0(24,3 ; 51,3) |
|
RCyC, % (IC à 95 %) |
49,6(43,4 ; 55,8) |
32,1(23,6 ; 41,6) |
30,6(20,2 ; 42,5) |
27,8(16,5 ; 41,6) |
|
Réponse moléculaire cumuléea |
N = 197 |
N = 107 |
N = 54 |
N = 48 |
|
RMM, % (IC à 95 %) |
42,1 (35,1 ; 49,4) |
17,8 (11,0 ; 26,3) |
16,7 (7,9 ; 29,3) |
10,4 (3,5 ; 22,7) |
|
RM4, % (IC à 95 %) |
37,1 (30,3 ; 44,2) |
15,0 (8,8 ; 23,1) |
13,0 (5,4 ; 24,9) |
10,4 (3,5 ; 22,7) |
|
Délai d’obtention de la RCyM chez les répondeurs uniquementb, médiane (intervalle), sem. |
12,3(4,0 ; 346,0) |
12,3(3,9 ; 550,6) |
12,0(3,9 ; 144,7) |
8,2(3,9 ; 25,1) |
|
Durée de la RCyMb K-M à 5 ans, % (IC à 95 %)cK-M à 10 ans, % (IC à 95 %)cMédiane, sem (IC à 95 %) |
N = 157 70,7 (63,1 ; 78,3) 65,3 (56,6 ; 74,0)
N/Att |
N = 47 66,6 (51,5 ; 81,7) 55,3 (36,3 ; 74,4)
N/Att |
N = 29 40,8 (20,9 ; 60,7) 40,8 (20,9 ; 60,7) 84,0 (24,0 ; N/E) |
N = 20 21,2 (0,1 ; 42,3) N/E 29,1 (11,9 ; 38,3) |
|
Délai d’obtention de la RCyC pour les répondeurs uniquementb, médiane (intervalle), sem |
24,0 (7,7 ; 240,6) |
24,0 (11,6 ; 216,0) |
23,8 (4,1 ; 120,0) |
8,4 (3,9 ; 25,1) |
|
Durée de la RCyCb |
N = 130 |
N = 36 |
N = 22 |
N = 15 |
|
K-M à 5 ans, % (IC à 95 %) K-M à 10 ans, % (IC à 95 %) Médiane, sem (IC à 95 %) |
69,7 (61,3 ; 78,2) 63,4 (54,0 ; 72,8) N/Att |
54,4 (36,7 ; 72,1) 40,8 (22,0 ; 59,6) 252,0 (24,0 ; N/E) |
40,0 (18,5 ; 61,5) 40,0 (18,5 ; 61,5) 72,0 (36,1 ; N/E) |
24,9 (0,9 ; 48,9) N/E 20,0 (9,1 ; 29,6) |
|
Délai d’obtention de la RMM pour les répondeurs uniquementb, médiane (intervalle), sem |
35,6 (3,1 ; 367,1) |
12,4 (4,0 ; 171,7) |
36,1 (12,1 ; 144,1) |
4,7 (3,9 ; 168,9) |
|
Durée de la RMMb K-M à 5 ans, % (IC à 95 %) K-M à 10 ans (IC à 95 %) Médiane, sem (IC à 95 %) |
N = 83 74,1 (64,2 ; 83,9) 63,4 (50,2 ; 76,6) N/Att |
N = 19 70,0 (47,5 ; 92,5) 70,0 (47,5 ; 92,5) N/Att |
N = 9 66,7 (35,9 ; 97,5) 66,7 (35,9 ; 97,5) N/Att |
N = 5 60,0 (17,1 ; 100,0) N/E N/Att |
|
Délai d’obtention de la RM4 pour les répondeurs uniquementb, médiane (intervalle), sem |
28,0 (3,1 ; 583,1) |
23,8 (4,0 ; 240,1) |
24,1 (22,9 ; 96,0) |
4,7 (3,9 ; 284,9) |
|
Durée de la RM4b,e K-M à 5 ans, % (IC à 95 %) K-M à 10 ans (IC à 95 %) Médiane, sem (IC à 95 %) |
N = 73 74,7 (64,2 ; 85,2) 60,8 (46,1 ; 75,4) N/Att |
N/A |
N/A |
N/A |
|
Transformation en PA/CBc en cours de traitement, n |
N = 284 15 |
N = 119 5 |
N = 79 3 |
N/A |
|
Survie sans progression c IncCum à 5 ans, % (IC à 95 %)d IncCum à 10 ans, % (IC à 95 %)d |
N = 284 19,7 (15,6 ; 24,9) 23,9 (19,5 ; 29,5) |
N = 119 24,4 (17,8 ; 33,4) 26,9 (20,0 ; 36,2) |
N=79 41,8 (32,2 ; 54,2) 41,8 (32,2 ; 54,2) |
N=64 67,2 (56,6 ; 79,7) N/E |
|
Survie globale c K-M à 5 ans, % (IC à 95 %) K-M à 10 ans, % (IC à 95 %) Médiane, mois (IC à 95 %) |
N=284 83,5 (78,7 ; 88,3) 71,5 (64,4 ; 78,7) N/R |
N=119 74,1 (64,8 ; 83,4) 60,4 (47,2 ; 73,7) N/R |
N=79 58,5 (46,9 ; 70,2) 50,7 (36,5 ; 65,0) N/R |
N=64 22,5 (7,1 ; 37,9) 22,5 (7,1 ; 37,9) 10,9 (8,7 ; 19,7) |
Données au : Phase 1/2 2 oct 2015, étude d’extension 02 sept 2020.
Critères de réponse cytogénétique : la RCyM englobait les réponses complètes [0 % de métaphases Ph+ de la moelle osseuse et < 1 % de cellules positives après hybridation in situ en fluorescence (FISH) ou partielles (1- 35 %). Les réponses cytogénétiques étaient basées sur le pourcentage de métaphases Ph+ sur ≥ 20 cellules métaphasiques dans chaque prélèvement de moelle osseuse. L'analyse FISH (≥ 200 cellules) a pu être utilisée pour les évaluations cytogénétiques post-inclusion en l'absence de ≥ 20 métaphases. Dans l’étude d’extension, la RCyC a été imputée à partir de la RMM si une évaluation cytogénétique valide n’était pas disponible à une date spécifique.
Critères de réponse moléculaire : dans l’étude de phase 1/2, les RMM/RM4 ont été définies comme étant un rapport BCR–ABL/ABL ≤ 0,1/0 Dans 01 % selon l’échelle internationale évalués par le laboratoire central.
Dans l’étude d’extension, les répondeurs avaient une les RMM/RM4 ont été rapportées comme indiquée sur le rapport d’analyse, évaluée par un laboratoire local.Abréviations : PA = phase accélérée ; CB = crise blastique ; Ph+ = chromosome Philadelphie positif ; PC = phase chronique ; LMC = leucémie myéloïde chronique ; K-M = Kaplan–Meier ; N/n = nombre de patients ; N/A = non applicable ; N/Att = non atteint lors du suivi minimum ; N/E = non estimable ; IC = intervalle de confiance ; RCyM = réponse cytogénétique majeure ; RCyC = réponse cytogénétique complète ; RHG = réponse hématologique globale ;IncCum = incidence cumulée ; RMM = réponse moléculaire majeure ; BCR ABL=breakpoint cluster region-Abelson.
a. Inclut les patients (N) présentant une évaluation valide à l'inclusion pour l’évaluation cytogénétique et les patients ne provenant pas de Chine, d’Afrique du Sud, d’Inde ou de Russie pour l’évaluation moléculaire car les échantillons ne pouvaient pas être exportés pour l’évaluation moléculaire dans ces pays. Les analyses permettent d'inclure les patients présentant une réponse à l'inclusion et la maintenant par la suite.
Durée minimum de suivi (délai entre la première dose du dernier patient et la date de consultation des données) de 120 mois.
b. Inclut les patients (N) qui ont atteint ou maintenu une réponse.
c. Inclut les patients (N) qui ont reçu au moins une dose de bosutinib.
d. Analyse de l’incidence cumulée ajustée pour le risque concurrent d’arrêt du traitement sans l’effet.
e Non analysé pour les groupes à effectifs réduit.
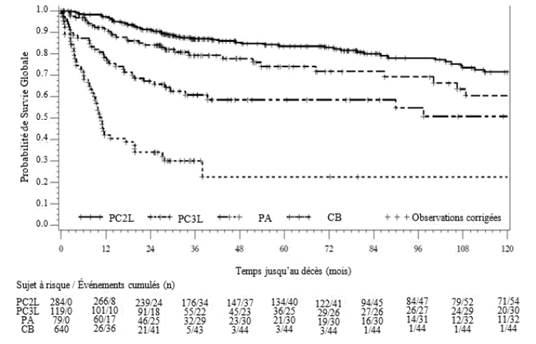
La survie globale dans les cohortes PC, PA et CB est représentée graphiquement dans la Figure 4.
Figure 4 – Estimation de Kaplan-Meier de la survie globale (SG) dans les cohortes PC2L, PC3L, PA et CB
Sur la base des informations cliniques limitées de l’étude de phase 1/2, une activité clinique chez des patients porteurs de mutations BCR-ABL (voir tableau 9) a été mise en évidence.
Tableau 9 – Réponse en fonction des mutations BCR-ABL identifiées à l’inclusion chez les patients évaluables atteints de LMC-PC : avant traitement par imatinib et dasatinib et/ou nilotinib (3eme ligne).
|
Mutation BCR-ABL à l’inclusion |
Fréquence à l’inclusion (%)a |
RcyM atteinte ou maintenue Rep/Evalb(%) N=112 |
|
Mutation évaluée |
98 (100,0) |
36/92 (39,1) |
|
Pas de mutation |
59 (60,2) |
23/55 (41,8) |
|
Au moins 1 mutation |
39 (39,8) |
13/37 (35,1) |
|
Mutations résistantes au Dasatinib |
10 (10,2) |
1/9 (11,1) |
|
E255K/V |
2 (2,0) |
0/2 |
|
F317L |
8 (8,2) |
1/7 (14,3) |
|
Mutations résistantes au Nilotinib c |
13 (13,3) |
8/13 (61,5) |
|
Y253H |
6 (6,1) |
5/6 (83,3) |
|
E255K/V |
2 (2,0) |
0/2 |
|
F359C/I/V |
7 (7,1) |
5/7 (71,4) |
Données au : Phase ½ 2 oct 2015, étude d’extension 02 sept 2020.
Remarque : les mutations ont été identifiées à l’inclusion avant l’administration de la première dose de traitement.
Abréviations : BCR–ABL = breakpoint cluster region–Abelson ; PC = phase chronique ; LMC = leucémie myéloïde chronique ; RCyM = réponse cytogénétique majeure ; N/n = nombre de patients ; Rep = répondeur ; Eval = évaluable.
a Le pourcentage est base sur l’évaluation du nombre de patients porteurs de mutations à l’inclusion.
b la population évaluable comprend les patients atteints d’une évaluation valide de la pathologie à inclusion.
c 2 patients avec plus d’une mutation dans cette catégorie.
Un patient porteur d’une mutation E255V précédemment traitée par nilotinib a atteint comme meilleure réponse une RHC.
Les essais in vitro indiquaient une activité limitée de bosutinib contre les mutations T315I ou V299L.
Aucune activité clinique n’est donc attendue chez les patients portant ces mutations.
Étude clinique de phase 4 chez des patients atteints de LMC Ph+ et ayant déjà reçu au moins 1 ITK. Une étude de phase 4, ouverte, non randomisée, multicentrique et à bras unique a été menée pour évaluer l’efficacité et la sécurité du bosutinib à la dose de 500 mg pris une fois par jour chez des patients atteints de LMC résistants ou intolérants aux ITK, avec des cohortes séparées distinctes par phase de la maladie (PC, PA ou CB) et par ligne de traitement précédente (1 ITK ou plus).
163 patients ont été traités par bosutinib dans cet essai, dont 46 patients atteints de LMC PC Ph+ et ayant été traités précédemment par1 ITK (imatinib, dasatinib ou nilotinib), 61 patients atteints de LMC PC Ph+ ayant été traités précédemment par 2 ITK (imatinib et/ou dasatinib et/ou nilotinib), 49 patients atteints de LMC Ph+ PC ayant été traités précédemment par 3 ITK (imatinib et dasatinib et nilotinib), 4 patients atteints de LMC Ph+ PA ayant été traités précédemment par au moins 1 ITK (2 patients traités précédemment par 2 ITK et 2 patients traités précédemment par 3 ITK) et 3 patients atteints de LMC Ph- traités précédemment par au moins 1 ITK.
Le critère principal d’efficacité était la RCyM confirmée cumulée sur 1 an (semaine 52) chez les patients atteints de LMC Ph+ PC précédemment traités par 1 ou 2 ITK et chez les patients atteints de LMC Ph+ PC traités précédemment par 3 ITK. Chez les patients atteints de LMC Ph+ PA et CB ayant reçu précédemment un traitement par ITK, le critère principal d'efficacité était la réponse hématologique globale (RHG) confirmée cumulée sur 1an (semaine 52). Les autres critères d’efficacité chez les patients atteints de LMC Ph+ PC comprenaient le taux de réponse cytogénétique et moléculaire cumulée, la durée des réponses cytogénétiques et moléculaires, le taux de réponse en fonction des mutations identifiées à l’inclusion, le taux de transformation en PA/CB, la SSP et la SG.
Les critères d’évaluation supplémentaires dans la cohorte PA/CB Ph+ comprenaient les taux de réponses cytogénétiques et moléculaires cumulées, la SSP et la SG.
Patients atteints de LMC en PC
Le critère principal d’évaluation du taux de RCyM confirmées cumulées (IC à 95 %) sur 1 an (52 semaines) était de 76,5 % (66,9 ; 84,5) chez les patients traités précédemment par 1 ou 2 ITK et de 62,2 % (46,5 ; 76,2) chez les patients traités précédemment par 3 ITK.
Le tableau 10 présente d’autres résultats d’efficacité à la clôture de l’étude, après un suivi minimal de 3 ans, chez les patients atteints de LMC Ph+ traités précédemment par 1 (durée médiane du traitement de 47,5 mois (intervalle : 0,9 à 50,1 mois) et 60,9 % toujours sous traitement), 2 (durée médiane du traitement de 41,9 mois (intervalle : 0,4 à 48,9 mois) et 45,9 % toujours sous traitement) et 3 (durée médiane du traitement de 20,0 mois (intervalle : 0,2 à 48,9 mois) et 38,8 % toujours sous traitement) ITK.
Tableau 10 - Résultats d’efficacité chez des patients précédemment traités atteints de LMC en phase chronique Ph+.
|
|
LMC Ph+ PC traitée précédemment par 1 ITK |
LMC Ph+ PC traitée précédemment par 2 ITK |
LMC Ph+ PC traitée précédemment par 3 ITK |
Cohorte totale LMC Ph+ PC |
|
RCyMa confirmée cumulée sur 1 an, % (IC à 95 %) |
N=43 |
N=55 |
N=45 |
N=143 |
|
|
83,7 (69,3 ; 93,2) |
70,9 (57,1 ; 82,4) |
62,2 (46,5 ; 76,2) |
72,0 (63,9 ; 79,2) |
|
Réponse cytogénétique cumulée a,b |
N=43 |
N=55 |
N=45 |
N=143 |
|
RCyM, % (IC à 95 %) |
88,4 (74,9 ; 96,1) |
85,5 (73,3 ; 93,5) |
77,8 (62,9 ; 88,8) |
83,9 (76,9 ; 89,5) |
|
RCyC, % (IC à 95 %) |
86,0 (72,1 ; 94,7) |
83,6 (71,2 ; 92,2) |
73,3 (58,1 ; 85,4) |
81,1 (73,7 ; 87,2) |
|
Réponse moléculaire cumulée a,b
RMM, % (IC à 95 %) RM4, % (IC à 95 %) RM4,5, % (IC à 95 %) |
N=46 |
N=55 |
N=48 |
N=149 |
|
82,6 (68,6 ; 92,2) |
76,4 (63,0 ; |
56,3 (41,2 ; 70,5) |
71,8 (63,9 ; 78,9) |
|
|
|
86,8) |
|
|
|
|
73,9 (58,9 ; 85,7) |
63,6 (49,6 ; |
41,7 (27,6 ;56,8) |
59,7 (51,4 ; 67,7) |
|
|
|
76,2) |
|
|
|
|
58,7 (43,2 ; 73,0) |
50,9 (37,1 ; |
35,4 (22,2 ; 50,5) |
48,3 (40,1 ; 56,6) |
|
|
|
64,6) |
|
|
|
|
Délai d’obtention de la réponse cytogénétique pour les répondeurs uniquement b, médiane (intervalle), mois |
|
|
|
|
|
RCyM |
3,0 (1,0 ; 11,8) |
2,9 (0,3 ; 6,4) |
3,0 (1,8 ; 8,8) |
3,0 (0,3 ; 11,8) |
|
RCyC |
3,0 (1,0 ; 17,6) |
2,9 (0,3 ; 6,4) |
3,0 (1,8 ; 8,8) |
3,0 (0,3 ; 17,6) |
|
Durée d’obtention de la réponse cytogénétique b |
|
|
|
|
|
MCyR, K-M à 3 ans, % (IC à 95 %) |
96,6 (77,9 ; 99,5) |
94,4 (79,2 ; 98,6) |
96,9 (79,8 ; 99,6) |
95,6 (88,7 ; 98,4) |
|
CCyR, K-M à 3 ans, % (IC à 95 %) |
96,4 (77,2 ; 99,5) |
94,4 (79,2 ; 98,6) |
100,0 (100,0 ; 100,0) |
96,5 (89,5 ; 98,9) |
|
Délai d’obtention de la réponse moléculaire pour les répondeurs uniquement, médiane (intervalle), mois |
|
|
|
|
|
RMM |
3,0 (2,8 ; 23,3) |
3,0 (1,0 ; 35,9) |
3,1 (1,8 ; 9,3) |
3,0 (1,0 ; 35,9) |
|
RM4 |
6,0 (2,8 ; 47,4) |
3,1 (1,0 ; 36,1) |
3,2 (1,8 ; 47,9) |
5,5 (1,0 ; 47,9) |
|
RM4.5 |
9,2 (2,8 ; 47,6) |
6,0 (2,8 ; 36,2) |
5,8 (1,8 ; 18,0) |
6,0 (1,8 ; 47,6) |
|
Durée de la réponse moléculaire b |
|
|
|
|
|
RMM, K-M à 3 ans, % (IC à 95 %) |
90,7 (73,9 ; 96,9) |
81.5 (63.2,91.3) |
90.2 (65.9,97.5) |
87.2 (78.0,92.7) |
|
RM4, K-M à 3 ans, % (IC à 95 %) |
89,5 (70,9 ; 96,5) |
68.7 (48.0,82.5) |
85.2 (51.9,96.2) |
80.7 (69.4,88.1) |
|
Données au : 23 nov 2020. Abréviations : Ph+ = chromosome de Philadelphie positif ; PC = phase chronique ; LMC = leucémie myélogène chronique ; K-M = Kaplan-Meier ; N = nombre de patients ; IC = intervalle de confiance ; RCyM = réponse cytogénétique majeure ; RCyC = réponse cytogénétique complète ; RMM = réponse moléculaire majeure ; RM4 = réduction du rapport BCR–ABL/ABL ≥ 4 log par rapport aux valeurs de référence standard; RM4,5 = réduction du rapport BCR–ABL/ABL ≥ 4,5 log par rapport aux valeurs de référence standard. Définition de la RCyM confirmée cumulée : la réponse est confirmée par 2 évaluations consécutives espacées d’au moins 28 jours. Pour être considéré comme un répondeur, le patient doit avoir maintenu la réponse présente à l’inclusion pendant au moins 52 semaines ou s’être amélioré par rapport à la réponse présente à l’inclusion. Les patients ayant une réponse cytogénétique partielle (RCyP) à l’inclusion doivent atteindre une RCyC sous traitement pour être considérés comme répondeurs cytogénétiques. Les patients ayant au moins une RMM et une réponse moléculaire plus profonde que la réponse présente à l’inclusion sont considérés comme des RCyC confirmés. Définition de la réponse cytogénétique cumulée : la réponse cytogénétique majeure comprenait les réponses cytogénétiques complètes [0 % de métaphases Ph+ dans moelle osseuse ou < 1 % de cellules positives par hybridation in situ fluorescente (FISH)] ou partielles (Ph+ de 1 % à 35 %). Les réponses cytogénétiques étaient basées sur le pourcentage de métaphases Ph+ parmi ≥ 20 cellules en métaphase dans chaque échantillon de moelle osseuse. Une analyse FISH (≥ 200 cellules) pouvait être utilisée pour évaluer la RCyC si ≥ 20 métaphases n’étaient pas évaluables. Les patients sans évaluation valide de la moelle osseuse ou de FISH et présentant au moins une RMM étaient comptés comme RCyC. Définition de la réponse moléculaire cumulée : RMM, RM4 et RM4,5 ont été définies comme étant respectivement un rapport BCR-ABL/ABL ≤ 0,1 %, ≤ 0,01 % et ≤ 0,0032 selon l’échelle internationale (correspondant à une réduction ≥ 3, ≥ 4 et ≥ 4,5 log par rapport aux valeurs de référence standard)) avec un minimum de 10 000, 10 000 et 32 000 transcrits ABL évalués par le laboratoire central. a Inclut les patients (N) avec une évaluation à l’inclusion valide. Durée minimale de suivi (temps écoulé entre la première dose administrée au patient et la date de prise en compte des données) de 36 mois. b Comprend les patients (N) qui ont obtenu ou maintenu une réponse. |
||||
L’incidence cumulée de RMM, RM4 et RM4,5 ajustée pour le risque concurrent d’arrêt du traitement sans l’événement est présentée dans la Figure 5.
Figure 5 - Incidence cumulée de la réponse moléculaire (population évaluable PC)
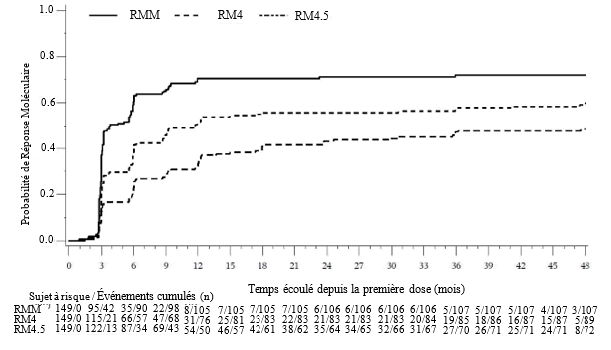
Les réponses moléculaires obtenues par ligne de traitement sont présentées dans le Tableau 11.
Tableau 11 - Réponses moléculaires obtenues
Chez les patients PC, il n’y a pas eu de progression en cours de traitement vers une LMC PA ou CB.
Patients atteints de LMC en PA
Chez les patients atteints de LMC Ph+ PA, la durée médiane du traitement était de 22,1 mois (intervalle : de 1,6 à 50,1 mois), le taux de RHC confirmée cumulé sur 1 an (52 semaines) était de 75,0 % (IC à 95 % : 19,4 à 99,4), tout comme le taux cumulé de RCyC, les 3 patients ont maintenu leur RCyC sous traitement.
Réponse en fonction des mutations BCR-ABL présentes à l’inclusion
Dix patients de la cohorte PC présentaient des mutations à l’inclusion (A365V, E453K, E255K, E255V, Q252H, L298V [n = 1 chacune], Y253F et G250E [n = 2 chacune]). Un patient de la cohorte PC présentait une mutation F359I identifiée au jour 8 de l’étude. Un patient de la cohorte PA présentait 2 mutations (F311L et L387F) à l’inclusion. Dans la cohorte PC, parmi les patients présentant des mutations, des réponses moléculaires ont été observées chez 4/11 (36,4 %) patients, 1 patient présentant une mutation E255V a atteint une RMM et 3 patients présentant respectivement F359I, Y253F et A365V ont obtenu une RMM4,5. Le patient présentant des mutations dans la cohorte PA n’a pas obtenu de réponse.
Population pédiatrique
L’Agence européenne des médicaments a différé l’obligation de soumettre les résultats d’études réalisées avec le bosutinib dans un ou plusieurs sous-groupes de la population pédiatrique atteints de LMC (voir rubrique 4.2 pour les informations concernant l’usage pédiatrique).
5.2. Propriétés pharmacocinétiques 
Après l'administration d'une dose unique de bosutinib (500 mg) au moment du repas à des sujets sains, la biodisponibilité absolue était de 34%. L’absorption était relativement lente, le temps médian nécessaire pour atteindre la concentration maximale (tmax) étant de plus de 6 heures. Bosutinib présente des augmentations proportionnelles de l'ASC et de la Cmax aux doses de 200 à 600 mg. L'absorption d'aliments a multiplié la Cmax de bosutinib par 1,8 et son ASC par 1,7 par rapport à une prise à jeun.
Chez les patients atteints de LMC à l’état d’équilibre, la Cmax (moyenne géométrique, coefficient de variation [CV] en %) était de 145 (14) ng/ml et l’ASC (moyenne géométrique, CV en %) était de 2 700 (16) ng•h/ml après l’administration quotidienne de 400 mg de bosutinib au moment du repas.
Après l’administration quotidienne de 500 mg de bosutinib au moment du repas, la Cmax était de 200 (6) ng/ml et l'ASC de 3 640 (12) ng•h/ml. La solubilité de bosutinib est dépendante du pH et l’absorption est réduite lorsque le pH gastrique augmente (voir rubrique 4.5).
Distribution
Après l’administration d’une dose intraveineuse unique de 120 mg de bosutinib à des sujets sains, bosutinib possédait un volume de distribution moyen (% de coefficient de variation [CV]) de 2 331 (32) l, ce qui suggère que bosutinib est largement distribué dans les tissus extravasculaires.
Bosutinib était fortement lié aux protéines plasmatiques humaines in vitro (94 %) et ex vivo chez des sujets sains (96 %), indépendamment de la concentration.
Biotransformation
Des études in vitro et in vivo ont indiqué que bosutinib (composé d'origine) était principalement soumis au métabolisme hépatique chez l'homme. Après l'administration d'une ou plusieurs doses de bosutinib (400 ou 500 mg) à des humains, les principaux métabolites en circulation semblaient être du bosutinib oxychloré (M2) et N-déméthylé (M5), le N-oxyde (M6) de bosutinib étant un métabolite mineur en circulation. L'exposition systémique au métabolite N-déméthylé correspondait à 25 % du composé d'origine, contre 19 % pour le métabolite oxychloré. Les 3 métabolites présentaient une activité 5 % de celle de bosutinib au cours d'un test de prolifération des fibroblastes transformés par Src indépendamment de l'ancrage. Bosutinib et le bosutinib N-déméthylé étaient les principaux composants médicamenteux présents dans les selles. Des études in vitrosur des microsomes hépatiques humains ont indiqué que le principal isoenzyme cytochrome P450 intervenant dans le métabolisme de bosutinib était le CYP3A4 et des études sur les interactions médicamenteuses ont indiqué que le kétoconazole et la rifampicine ont produit des effets sur la pharmacocinétique de bosutinib (voir rubrique 4.5). Aucun métabolisme de bosutinib n'a été observé avec les CYP 1A2, 2A6, 2B6, 2C8, 2C9, 2C19, 2D6, 2E1 ou 3A5.
Élimination
Chez des sujets sains ayant reçu une seule dose intraveineuse de 120 mg de bosutinib, la demi-vie d'élimination terminale moyenne (% CV) était de 35 ,5 (24) heures et la clairance moyenne (% CV) de 61,9 (26) l/h. Dans une étude de bilan de masse avec bosutinib par voie orale, 94,6 % de la dose totale a été récupérée en moyenne en 9 jours ; la principale voie d'excrétion était les fèces (91,3 %), 3,29 % de la dose étant récupérée dans les urines. 75 % de la dose a été récupérée dans les 96 heures.
L'excrétion de bosutinib inchangé dans les urines était faible (avec environ 1 % de la dose), tant chez les sujets sains que chez ceux souffrant de tumeurs solides malignes au stade avancé.
Populations spécifiques
Atteinte hépatique
Une dose de 200 mg de bosutinib administrée au moment des repas, a été évaluée dans une cohorte de 18 sujets avec une atteinte hépatique (Child-Pugh de classes A, B et C) et chez 9 sujets sains correspondants. La Cmax de bosutinib dans le plasma a été multipliée par 2,4, 2 et 1,5, respectivement, dans les classes A, B et C de Child-Pugh, l'ASC de bosutinib dans le plasma étant multipliée par 2,3, 2 et 1,9, respectivement. La t½ de bosutinib a augmenté chez les patients avec une atteinte hépatique par rapport aux sujets sains.
Atteinte de la fonction rénale
Dans une étude sur l’atteinte de la fonction rénale, une dose unique de 200 mg de bosutinib a été administrée au moment du repas à 26 sujets présentant une atteinte légère, modérée, ou sévère de la fonction rénale et à 8 volontaires sains appariés. L’atteinte de la fonction rénale reposait sur les valeurs de ClCr (calculée par la formule Cockcroft-Gault) suivantes : < 30 ml/min (atteinte sévère), 30 ≥ ClCr ≥ 50 ml/min (atteinte modérée) ou 50 < ClCr ≥ 80 ml/min (atteinte légère). Les sujets souffrant d’une atteinte modérée ou sévère de la fonction rénale ont présenté une augmentation de l’ASC de 35 % et de 60 %, respectivement, par rapport aux volontaires sains. La Cmax après exposition maximale a augmenté de 28 % et 34 % dans les groupes de sujets ayant une atteinte modérée ou sévère, respectivement. L’exposition au bosutinib n’a pas augmenté chez les sujets souffrant d’une atteinte légère de la fonction rénale. La demi-vie d’élimination du bosutinib chez les sujets présentant une atteinte de la fonction rénale était similaire à celle observée chez les sujets sains.
Les ajustements posologiques en cas d’atteinte de la fonction rénale ont été effectués en fonction des résultats de cette étude, et des propriétés pharmacocinétiques linéaires connues du bosutinib dans l’intervalle de dose compris entre 200 et 600 mg.
Age, sexe et origine ethnique
Aucune étude formelle n'a été menée pour évaluer l'influence de ces facteurs démographiques. Les analyses pharmacocinétiques chez des patients atteints de leucémie Ph+ ou d'une tumeur solide maligne et chez des sujets sains indiquent une absence d'impact cliniquement significatif de l'âge, du sexe ou du poids corporel. Les analyses pharmacocinétiques de population ont révélé que les Asiatiques avaient une clairance inférieure de 18 % correspondant à une augmentation d’environ 25 % de l’exposition au bosutinib (ASC).
Population pédiatrique
BOSUTINIB BIOGARAN n'a pas encore été étudié chez les enfants et les adolescents de moins de 18 ans.
5.3. Données de sécurité préclinique 
Bosutinib a été évalué dans le cadre d'études de pharmacologie de sécurité, toxicologie en administration répétée, génotoxicité, phototoxicité, et toxicité pour les fonctions de reproduction.
Pharmacologie de sécurité
Bosutinib n'exerçait aucun effet sur les fonctions respiratoires. Dans une étude du système nerveux central (SNC), les rats traités par bosutinib présentaient une contraction des pupilles et une démarche anormale. Aucune relation dose-effet pour la taille des pupilles n'a été établie, mais celle-ci a été observée pour la démarche anormale et correspondait à une exposition équivalente à environ 11 fois l’exposition chez l’homme avec la dose clinique de 400 mg et 8 fois l’exposition chez l’homme avec la dose clinique de 500 mg (sur la base de la Cmax de la fraction non liée dans chaque espèce).
L'activité de bosutinib in vitro lors de tests hERG suggérait un risque d’allongement de la repolarisation ventriculaire (QTc). Dans une étude portant sur bosutinib administré par voie orale à des chiens, bosutinib n'a pas entraîné de modification de la tension artérielle, d'arythmies auriculaires ou ventriculaires anormales ni d’allongement de l'intervalle PR, QRS ou QTc à l'ECG à des expositions allant jusqu’à 3 fois l’exposition chez l’homme avec la dose clinique de 400 mg et 2 fois l’exposition chez l’homme avec la dose clinique de 500 mg (sur la base de la Cmax de la fraction non liée dans chaque espèce). Une accélération de la fréquence cardiaque tardive a été observée. Dans une étude portant sur l'administration par voie intraveineuse à des chiens, des accélérations transitoires de la fréquence cardiaque, des chutes de la tension artérielle et un allongement minimal du QTc (< 10 ms) ont été observées à des expositions d’environ 6 à 20 fois l’exposition chez l’homme avec la dose clinique de 400 mg et de 4 à 15 fois l’exposition chez l’homme avec la dose clinique de 500 mg (sur la base de la Cmax
de la fraction non liée dans chaque espèce). Aucune conclusion n'a pu être tirée concernant le rapport entre les effets observés et le traitement médicamenteux.
Toxicologie en administration répétée
Des études de toxicologie en administration répétée chez des rats (pendant 6 mois maximum) et des chiens (pendant 9 mois maximum) ont révélé que le système gastro-intestinal était le principal organe cible pour la toxicité de bosutinib. Les signes cliniques de toxicité englobaient une modification des selles et étaient associés à une perte de l'appétit et une perte de poids pouvant entraîner le décès ou une euthanasie programmée.
Sur le plan histopathologique, une dilatation luminale, une hyperplasie des cellules caliciformes, une hémorragie, une érosion et un œdème des voies intestinales, ainsi qu'une érythrocytose sinusale et une hémorragie des ganglions mésentériques ont été observés. Le foie a également été identifié comme un organe cible chez les rats. Des toxicités ont été caractérisées par une augmentation du poids du foie en corrélation avec une hypertrophie hépatocellulaire survenue en l’absence d’enzymes hépatiques élevés ou des signes microscopiques de cytotoxicité hépatocellulaire. La pertinence de ces observations reste inconnue pour l’homme. La comparaison de l'exposition entre les espèces indique que les expositions n'ayant pas entraîné d'événements indésirables au cours des études de toxicologie de 6 et 9 mois chez le rat et le chien, respectivement, étaient semblables à l’exposition chez l’homme avec la dose clinique de 400 mg ou 500 mg (sur la base de l’ASC de la fraction non liée dans chaque espèce).
Génotoxicité
Les études de génotoxicité dans des systèmes in vitro bactériens et des systèmes in vitro et in vivo mammaliens, avec et sans activation métabolique, n'ont révélé aucun signe de potentiel mutagène de bosutinib.
Toxicité pour les fonctions de reproduction et de développement
Dans une étude de fertilité menée sur les rats, la fertilité des mâles a légèrement diminué. Chez les femelles, une augmentation des résorptions embryonnaires et une diminution du nombre d'implantations et d'embryons viables ont été observées. La dose ne présentant aucun effet indésirable pour la reproduction chez les mâles (30 mg/kg/jour) et les femelles (3 mg/kg/jour) entraînait des expositions correspondant à 0,6 fois et 0,3 fois, respectivement, l’exposition chez l’homme avec la dose clinique de 400 mg, et correspondant à 0,5 fois et 0,2 fois, respectivement, l'exposition chez l'homme avec la dose clinique de 500 mg (sur la base de l'ASC de la fraction non liée dans chaque espèce). Un effet sur la fertilité masculine ne peut être exclu (voir rubrique 4.6).
L'exposition fœtale à la radioactivité dérivée de bosutinib pendant la gestation a été démontrée par une étude du passage transplacentaire chez des rates Sprague-Dawley gravides. Au cours d'une étude portant sur le développement prénatal et postnatal chez le rat, une réduction du nombre de petits nés à ≥ 30 mg/kg/jour et une incidence accrue de perte totale de la portée ainsi qu’une croissance réduite de la progéniture après la naissance à 70 mg/kg/jour ont été observées. La dose à laquelle aucun effet indésirable sur le développement n'a été observé (10 mg/kg/jour) a entraîné des expositions correspondant à 1,3 fois et 1 fois l'exposition chez l'homme avec la dose clinique de 400 mg et 500 mg, respectivement (sur la base de l'ASC de la fraction non liée dans chaque espèce). Une étude de la toxicité pour les fonctions de développement chez le lapin, à une dose toxique administrée à la mère, a relevé des anomalies fœtales (fusion des sternèbres, ainsi que diverses modifications viscérales chez 2 fœtus) et une légère baisse du poids fœtal. L'exposition à la dose maximale testée chez le lapin (10 mg/kg/jour) n'entraînant pas d'effets indésirables pour le fœtus correspondait à 0,9 et 0,7 fois l'exposition chez l'homme avec la dose clinique de 400 mg ou 500 mg, respectivement (sur la base de l'ASC de la fraction non liée dans chaque espèce).
Après l'administration d'une dose unique (10 mg/kg) par voie orale de bosutinib radiomarqué au [14C] à des rates Sprague-Dawley allaitantes, la radioactivité a été rapidement excrétée dans le lait maternel dès 0,5 h après l'administration. La concentration de radioactivité dans le lait était jusqu'à 8 fois supérieure à la concentration plasmatique, ce qui a permis l'apparition de concentrations mesurables de radioactivité dans le plasma des petits allaités.
Carcinogénicité
Bosutinib ne s'est pas révélé carcinogène dans les études de carcinogénicité de 2 ans chez le rat et de 6 mois chez la souris rasH2.
Phototoxicité
Bosutinib a démontré une capacité à absorber les rayons UV-B et UV-A et se distribue dans la peau et le canal uvéal de rats pigmentés. Néanmoins, bosutinib n'a pas révélé de risque de phototoxicité pour la peau ou les yeux des rats pigmentés exposés au bosutinib en présence de rayons UV à des expositions jusqu’à 3 et 2 fois l’exposition chez l’homme avec la dose clinique de 400 mg ou 500 mg, respectivement (sur la base de la Cmax de la fraction non liée dans chaque espèce).
Noyau du comprimé :
Cellulose microcristalline, croscarmellose sodique, silice colloïdale anhydre, stéarate de magnésium.
Pelliculage :
Alcool polyvinylique, macrogol, talc, dioxyde de titane (E171), oxyde de fer jaune (E172), oxyde de fer rouge (E172).
2 ans.
6.4. Précautions particulières de conservation 
Ce médicament ne nécessite pas de précautions particulières de conservation.
6.5. Nature et contenu de l'emballage extérieur 
28 comprimés sous plaquettes (Aluminium/PVC/Aluminium/OPA).
6.6. Précautions particulières d’élimination et de manipulation 
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE 
15 BOULEVARD CHARLES DE GAULLE
92700 COLOMBES
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE 
· 34009 302 892 2 8 : 28 comprimés sous plaquettes (Aluminium/PVC/Aluminium/OPA).
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION 
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE 
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES 
Liste I.
Médicament soumis à prescription initiale hospitalière semestrielle.
Prescription initiale et renouvellement réservés aux spécialistes en oncologie ou en hématologie, ou aux médecins compétents en cancérologie.
Médicament nécessitant une surveillance particulière pendant le traitement
|
| Plan du site | Accessibilité | Contact | Téléchargement | Declaration de confidentialité | Service-Public.fr | Legifrance | Gouvernement.fr |