Dernière mise à jour le 01/12/2025
ARSENIC TRIOXYDE ARROW 1 mg/mL, solution à diluer pour perfusion
Ce médicament n'est ou ne sera bientôt plus disponible sur le marché.
Si vous prenez actuellement ce médicament, il vous est recommandé d'en parler avec votre médecin
ou avec votre pharmacien qui pourra vous orienter vers un autre traitement.
Service médical rendu (SMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Important | Avis du 23/10/2019 | Inscription (CT) | Le service médical rendu par ARSENIC TRIOXYDE ARROW 1 mg/ml, solution à diluer pour perfusion est important dans les indications de l’AMM. |
Amélioration du service médical rendu (ASMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprés de la HAS (plus d'informations dans l'aide). Les avis et synthéses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur de l'ASMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| V (Inexistant) | Avis du 23/10/2019 | Inscription (CT) | La spécialité ARSENIC TRIOXYDE ARROW 1 mg/ml, solution à diluer pour perfusion n’apporte pas d’amélioration du service médical rendu (ASMR V) par rapport au princeps TRISENOX 1 mg/ml, solution à diluer pour perfusion. |
ANSM - Mis à jour le : 03/05/2022
ARSENIC TRIOXYDE ARROW 1 mg/mL, solution à diluer pour perfusion
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Trioxyde d’arsenic................................................................................................................... 1 mg
Pour 1 mL de solution à diluer pour perfusion
Excipient(s) à effet notoire : sodium. 1 mL de solution à diluer pour perfusion contient 0,7 mg de sodium.
Pour la liste complète des excipients, voir rubrique 6.1.
Solution à diluer pour perfusion.
ARSENIC TRIOXYDE ARROW 1 mg/mL, solution à diluer pour perfusion est une solution aqueuse stérile, incolore, limpide avec un pH compris entre 7,0 et 8,5.
4.1. Indications thérapeutiques
· leucémie promyélocytaire aiguë (LPA) à risque faible ou intermédiaire (numération leucocytaire : ≤ 10 x 103/μL) nouvellement diagnostiquée, en association avec l’acide tout-trans-rétinoïque (ATRA ou trétinoïne),
· leucémie promyélocytaire aiguë (LPA) en rechute/réfractaire (le traitement antérieur doit avoir comporté un rétinoïde et une chimiothérapie),
caractérisée par la présence de la translocation t(15;17) et/ou la présence du gène PML/RAR-alpha (Pro-Myelocytic Leukaemia/Retinoic Acid Receptor-alpha).
Le taux de réponse des autres sous-types de leucémie aiguë myéloblastique au trioxyde d'arsenic n’a pas été examiné.
4.2. Posologie et mode d'administration
Posologie
La dose recommandée est identique pour les adultes et les sujets âgés.
Leucémie promyélocytaire aiguë (LPA) à risque faible ou intermédiaire nouvellement diagnostiquée
Plan du traitement d’induction
ARSENIC TRIOXYDE ARROW doit être administré par voie intraveineuse à la dose de 0,15 mg/kg/jour, injectée quotidiennement jusqu’à rémission complète. Si une rémission complète n’est pas intervenue après 60 jours, le traitement doit être interrompu.
Plan du traitement de consolidation
ARSENIC TRIOXYDE ARROW doit être administré par voie intraveineuse à la dose de 0,15 mg/kg/jour, 5 jours par semaine. Le traitement doit être poursuivi pendant 4 semaines, suivies de 4 semaines d’interruption, le nombre de cycles étant de 4 au total.
Leucémie promyélocytaire aiguë (LPA) en rechute/réfractaire
Plan du traitement d'induction
ARSENIC TRIOXYDE ARROW doit être administré par voie intraveineuse, à la dose fixe de 0,15 mg/kg/jour prise quotidiennement jusqu'à rémission complète (moins de 5 % de blastes présents dans la moelle osseuse riche en cellules, sans trace de cellules leucémiques). Si une rémission complète n’est pas intervenue après 50 jours, le traitement doit être interrompu.
Plan du traitement de consolidation
Le traitement de consolidation doit commencer 3 à 4 semaines après la fin du traitement d'induction. ARSENIC TRIOXYDE ARROW doit être administré par voie intraveineuse à la dose de 0,15 mg/kg/jour, 25 fois, réparties à raison de 5 jours par semaine, suivis par 2 jours d’interruption, et ce pendant 5 semaines.
Suspension, modification et réinitiation de traitement
Le traitement par ARSENIC TRIOXYDE ARROW devra être suspendu temporairement avant le terme programmé du traitement, dès lors qu’une toxicité de grade 3 ou plus (National Cancer Institute, Common Toxicity Criteria) est observée et jugée comme pouvant être liée au traitement par ARSENIC TRIOXYDE ARROW. Les patients présentant de telles réactions considérées comme liées à ARSENIC TRIOXYDE ARROW ne pourront reprendre le traitement qu’après résolution de l’effet toxique ou après retour à l’état initial de l’anomalie ayant provoqué l’interruption. Dans ce cas, le traitement devra reprendre à 50 % de la dose quotidienne précédente. Si l’effet toxique ne se reproduit pas dans les 7 jours suivant la reprise du traitement à la dose réduite, la dose quotidienne pourra repasser à 100 % de la dose originale. Le traitement sera abandonné chez les patients présentant une récurrence de la toxicité.
Pour des valeurs d’ECG et d’électrolytes anormales et pour l’hépatotoxicité, voir rubrique 4.4.
Populations particulières
Patients présentant une insuffisance hépatique
Du fait de l’absence de données dans tous les groupes de patients présentant une insuffisance hépatique et compte tenu de la survenue possible d’effets hépatotoxiques pendant le traitement par le Trioxyde d’arsenic, il est recommandé d’utiliser ARSENIC TRIOXYDE ARROW avec prudence chez les patients ayant une insuffisance hépatique (voir rubriques 4.4 et 4.8).
Patients présentant une insuffisance rénale
Du fait de l’absence de données dans tous les groupes de patients présentant une insuffisance rénale, il est recommandé d’utiliser ARSENIC TRIOXYDE ARROW avec prudence chez les patients ayant une insuffisance rénale.
Population pédiatrique
La sécurité et l’efficacité du Trioxyde d’arsenic chez les enfants jusqu’à l’âge de 17 ans n’ont pas été établies. Les données actuellement disponibles chez les enfants âgés de 5 à 16 ans sont décrites à la rubrique 5.1 mais aucune recommandation sur la posologie ne peut être donnée. Aucune donnée n’est disponible chez les enfants de moins de 5 ans.
Mode d’administration
ARSENIC TRIOXYDE ARROW doit être administré en perfusion intraveineuse de 1 à 2 heures. La durée de la perfusion peut être portée à 4 heures en cas de réactions vasomotrices. Aucun cathéter veineux central n’est nécessaire. Les patients doivent être hospitalisés au début du traitement en raison des symptômes de la maladie et afin d’assurer une surveillance adéquate.
Pour les instructions concernant la préparation du médicament avant administration, voir la rubrique 6.6.
Hypersensibilité à la substance active ou à l’un des excipients mentionnés à la rubrique 6.1
4.4. Mises en garde spéciales et précautions d'emploi
Syndrome d'activation des leucocytes (syndrome de différenciation LPA)
27 % des patients atteints de LPA en rechute/réfractaire et traités par trioxyde d'arsenic ont présenté des symptômes analogues à ceux d'un syndrome appelé syndrome de l'acide rétinoïque-LPA (RA- APL) ou syndrome de différenciation LPA, caractérisé par une fièvre, une dyspnée, une prise de poids, des infiltrats pulmonaires et des épanchements pleuraux ou péricardiques, avec ou sans hyperleucocytose. Ce syndrome peut être fatal. Chez les patients atteints de LPA nouvellement diagnostiquée et traités par le trioxyde d'arsenic et la trétinoïne, un syndrome de différenciation LPA a été observé chez 19 % d’entre eux, dont 5 cas sévères. Dès les premiers signes évoquant ce syndrome (fièvre inexpliquée, dyspnée et/ou prise de poids, signes anormaux à l'auscultation thoracique ou anomalies radiographiques), le traitement par le trioxyde d’arsenic doit être temporairement interrompu et une corticothérapie à hautes doses (dexaméthasone 10 mg par voie intraveineuse, deux fois par jour) doit être immédiatement instituée, quelle que soit la numération leucocytaire, et poursuivie pendant 3 jours ou plus jusqu’à ce que les signes et symptômes se soient atténués. Un traitement diurétique concomitant est également recommandé s’il est justifié/nécessaire au vu de la clinique. Dans la majorité des cas, il n'est pas nécessaire d'arrêter définitivement l'administration du trioxyde d’arsenic pendant le traitement du syndrome de différenciation LPA. Il est possible de reprendre le traitement par le trioxyde d’arsenic à une dose égale à 50 % de la dose précédente pendant les 7 premiers jours dès lors que les signes et symptômes se sont résorbés. En l’absence d’aggravation de la toxicité antérieure, le trioxyde d’arsenic peut ensuite être poursuivi à la dose totale. En cas de réapparition des symptômes, le trioxyde d’arsenic doit être réduit à la dose précédente. Pour prévenir la survenue d’un syndrome de différenciation LPA pendant le traitement d’induction, de la prednisone (0,5 mg/kg de poids corporel par jour tout au long du traitement d’induction) peut être administrée du premier jour de l’administration du trioxyde d’arsenic à la fin du traitement d’induction chez les patients atteints de LPA. Il est recommandé que la chimiothérapie ne soit pas ajoutée à la corticothérapie, car il n’existe aucune expérience précédente d’administration conjointe de corticoïdes et d’une chimiothérapie durant le traitement du syndrome d'activation des leucocytes dû au trioxyde d’arsenic. L’expérience de post- commercialisation sous-tend qu’un syndrome similaire peut avoir lieu chez les patients atteints d'autres types de malignité. Les modes de traitement et de contrôle inhérents à ces patients doivent être tels que décrits ci-dessus.
Anomalies de l'électrocardiogramme (ECG)
Le trioxyde d'arsenic peut occasionner une prolongation de l'intervalle QT et un bloc auriculo- ventriculaire complet. La prolongation de l'intervalle QT peut aboutir à une arythmie ventriculaire de type torsade de pointes, qui peut être fatale. Tout traitement antérieur à base d’anthracyclines peut accroître le risque de prolongation de l'intervalle QT. Le risque de torsade de pointes est lié aux facteurs suivants : degré de prolongation de l'intervalle QT, administration concomitante de médicaments prolongeant l'intervalle QT (tels que les antiarythmiques de classe Ia et III (ex. : quinidine, amiodarone, sotalol, dofétilide), les antipsychotiques (ex. : thioridazine), les antidépresseurs (ex. : amitriptyline), certains macrolides (ex. : érythromycine), certains antihistaminiques (ex. : terfenadine et astémizole), certains antibiotiques de la famille des quinolones (ex. : sparfloxacine) et autres médicaments connus pour prolonger l’intervalle QT (ex. : cisapride), antécédents de torsade de pointes, prolongation préexistante de l'intervalle QT, insuffisance cardiaque congestive, administration de diurétiques éliminant le potassium, amphotéricine B ou autre affection entraînant une hypokaliémie ou une hypomagnésémie. Lors des essais cliniques, en situation de rechute/maladie réfractaire, 40 % des patients traités par le trioxyde d’arsenic ont présenté au moins une prolongation de l'intervalle QT corrigé (QTc) supérieure à 500 msec. Une prolongation de l'intervalle QTc a été observée 1 à 5 semaines après la perfusion de ARSENIC TRIOXYDE ARROW, avec retour à la valeur initiale au terme de la 8ème semaine suivant la perfusion du trioxyde d’arsenic. Une patiente (recevant plusieurs médicaments concomitants, dont l'amphotéricine B) a présenté un phénomène de torsade de pointes asymptomatique pendant le traitement d'induction d’une rechute de LPA par le trioxyde d'arsenic. Dans le cas de LPA nouvellement diagnostiquées, 15,6 % des patients atteints ont présenté une prolongation du QTc sous traitement par le trioxyde d’arsenic en association avec la trétinoïne (voir rubrique 4.8). Chez un patient atteint d’une LPA nouvellement diagnostiquée, le traitement d’induction a été interrompu en raison d’une prolongation importante de l’intervalle QTc et d’anomalies électrolytiques le troisième jour du traitement d’induction.
Recommandations de contrôle de l’ECG et du profil électrolytique
Avant de commencer un traitement par le trioxyde d’arsenic, un ECG à 12 dérivations sera pratiqué, ainsi qu'un dosage sérique des électrolytes (potassium, calcium et magnésium) et de la créatinine. Les anomalies électrolytiques préexistantes seront corrigées et, si possible, les traitements connus pour prolonger l'intervalle QT seront interrompus. Les patients présentant des facteurs de risque de prolongation de QTc ou des facteurs de risque de torsade de pointes devront faire l’objet d’une surveillance cardiaque continue (ECG). Pour QTc supérieur à 500 msec, des mesures correctives doivent être prises et QTc réévalué par des ECG en série avant d’envisager l’utilisation du trioxyde d’arsenic, l’avis d’un spécialiste pouvant également être sollicité dans la mesure du possible. Pendant le traitement par le trioxyde d’arsenic, on veillera à maintenir constamment la kaliémie à plus de 4 mEq/L et la magnésémie à plus de 1,8 mg/dL. Les patients dont l'intervalle QT atteint une valeur absolue > 500 msec doivent être réévalués et une action immédiate sera entreprise pour corriger les éventuels facteurs de risque concomitants, alors qu’il faudra également évaluer les rapports bénéfices/risques de la poursuite et de l'arrêt du traitement par le trioxyde d’arsenic. En cas de syncope ou d’accélération ou irrégularités du rythme cardiaque, le patient devra être hospitalisé et surveillé en continu, un dosage sérique des électrolytes sera pratiqué et le traitement par le trioxyde d’arsenic sera suspendu jusqu'à ce que l'intervalle QTc repasse sous 460 msec, que les anomalies électrolytiques soient corrigées et que la syncope et les irrégularités du rythme cardiaque disparaissent. Une fois observé le retour à l’état initial, le traitement devra être repris à une dose égale à 50 % de la dose quotidienne précédente. En l’absence de survenue d’une nouvelle prolongation du QTc dans les 7 jours suivant la reprise du traitement à la dose réduite, le traitement par le trioxyde d’arsenic peut être réinstauré à la dose de 0,11 mg/kg de poids corporel par jour pendant une deuxième semaine. La dose quotidienne pourra repasser à 100 % de la dose d’origine en l’absence de toute prolongation. Il n’existe aucune donnée concernant l’effet du trioxyde d'arsenic sur l’intervalle QTc durant la perfusion. Un ECG sera effectué deux fois par semaine, et plus fréquemment pour les patients cliniquement instables, pendant les phases d'induction et de consolidation.
Hépatotoxicité (grade 3 ou plus)
Dans les cas de LPA à risque faible ou intermédiaire nouvellement diagnostiquées, 63,2 % des patients atteints ont présenté des effets hépatotoxiques de grade 3 ou 4 pendant le traitement d’induction ou de consolidation par le trioxyde d'arsenic en association avec la trétinoïne (voir rubrique 4.8). Toutefois, les effets toxiques ont disparu après l'arrêt temporaire du trioxyde d'arsenic ou de la trétinoïne, ou des deux médicaments. Le traitement par le trioxyde d’arsenic doit être interrompu avant la fin programmée du traitement dès lors qu’est observée une hépatotoxicité de grade 3 ou plus sur l’échelle NCI-CTC (National Cancer Institute Common Toxicity Criteria). Dès, qu’une diminution de la bilirubine et/ou des ASAT et/ou des phosphatases alcalines supérieure à 4 fois la limite supérieure de la normale est observée, le traitement doit être repris à une dose égale à 50 % de la dose précédente pendant les 7 premiers jours. Le trioxyde d’arsenic sera ensuite réinstauré à la dose totale en l’absence d’aggravation de la toxicité antérieure. La survenue d’une nouvelle hépatotoxicité impose l’arrêt définitif du trioxyde d’arsenic.
Suspension de traitement et modification de la posologie
Le traitement par le trioxyde d’arsenic devra être temporairement interrompu avant le terme programmé du traitement, dès lors qu’une toxicité de grade 3 ou plus (National Cancer Institute, Common Toxicity Criteria) sera observée et jugée comme pouvant être liée au traitement par le trioxyde d’arsenic (voir rubrique 4.2).
Examens biologiques
Le profil électrolytique, la glycémie, ainsi que les bilans hématologique, hépatique, rénal et de coagulation du patient doivent être surveillés au moins deux fois par semaine, et plus fréquemment pour les patients cliniquement instables, pendant la phase d'induction et au moins une fois par semaine pendant la phase de consolidation.
Patients présentant une insuffisance rénale
Du fait de l’absence de données dans tous les groupes de patients présentant une insuffisance rénale, il est recommandé d’utiliser le trioxyde d’arsenic avec prudence chez les patients ayant une insuffisance rénale. L’expérience chez les patients ayant une insuffisance rénale sévère est insuffisante pour déterminer si une adaptation de la dose est requise.
L’utilisation du trioxyde d’arsenic chez les patients dialysés n’a pas été étudiée.
Patients présentant une insuffisance hépatique
Du fait de l’absence de données dans tous les groupes de patients présentant une insuffisance hépatique et compte tenu de la survenue possible d’effets hépatotoxiques pendant le traitement par trioxyde d'arsenic, il est recommandé d’utiliser le trioxyde d’arsenic avec prudence chez les patients ayant une insuffisance hépatique (voir le paragraphe relatif à l’hépatotoxicité dans la rubrique 4.4 et voir la rubrique 4.8). L’expérience chez les patients ayant une insuffisance hépatique sévère est insuffisante pour déterminer si une adaptation de la dose est requise.
Sujets âgés
Il existe peu de données cliniques sur l'usage du trioxyde d’arsenic au sein de la population âgée. Une prudence particulière est requise chez ces patients.
Hyperleucocytose
Le traitement par trioxyde d'arsenic a été associé à l'apparition d'une hyperleucocytose (≥ 10 x 103/μL) chez certains patients atteints de LPA en rechute/réfractaire. Il n'est apparu aucune corrélation entre le nombre de globules blancs (GB) à la visite de référence et l'apparition d'une hyperleucocytose, pas plus qu'entre le nombre de GB à la visite de référence et le nombre maximum de GB. L'hyperleucocytose n'a jamais fait l'objet d'une chimiothérapie supplémentaire et a cédé spontanément à la poursuite du traitement par le trioxyde d’arsenic. Le nombre des GB pendant le traitement de consolidation était inférieur par rapport à la période du traitement d'induction et était toujours inférieur à 10 x 103/μL, sauf chez un patient présentant un nombre de GB de 22 x 103/μL pendant le traitement de consolidation. Vingt patients (50 %) atteints de LPA en rechute/réfractaire ont présenté une hyperleucocytose ; cependant, chez tous ces patients, le nombre de GB était en baisse ou avait retrouvé une valeur normale au moment de la rémission médullaire et aucune chimiothérapie cytotoxique ou leucophérèse n’a été nécessaire. Parmi les patients atteints de LPA à risque faible ou intermédiaire nouvellement diagnostiquée, une hyperleucocytose est apparue pendant le traitement d’induction chez 35 des 74 patients (47 %) (voir rubrique 4.8). L’hydroxycarbamide a cependant permis de prendre en charge efficacement l’ensemble des cas observés.
L’hydroxycarbamide doit être administré chez les patients atteints de LPA nouvellement diagnostiquée et chez ceux atteints de LPA en rechute/réfractaire présentant une hyperleucocytose prolongée après mise en route du traitement. L’hydroxycarbamide doit être poursuivi à une dose permettant de maintenir la numération leucocytaire à un niveau inférieur ou égal à 10 x 103/μL, la dose étant ensuite diminuée progressivement.
Tableau 1 Recommandation pour la mise en route de l’hydroxycarbamide
|
Leucocytes |
Hydroxycarbamide |
|
10 – 50 x 103/µL |
500 mg quatre fois par jour |
|
> 50 x 103/µL |
1 000 mg quatre fois par jour |
Survenue d’un deuxième cancer primitif
La substance active de ARSENIC TRIOXYDE ARROW, le trioxyde d’arsenic, est cancérogène chez l’homme. La survenue d’un deuxième cancer primitif doit être surveillée.
Encéphalopathie
Des cas d’encéphalopathie ont été signalés lors du traitement par le trioxyde d’arsenic. Une encéphalopathie de Wernicke a été signalée, après traitement par le trioxyde d’arsenic, chez des patients présentant un déficit en vitamine B1. Les signes et symptômes d’encéphalopathie doit être étroitement surveillés chez les patients présentant un risque de déficit en vitamine B1 après instauration d’un traitement par le trioxyde d’arsenic. Une récupération a été observée dans certains cas à la suite d’une complémentation en vitamine B1.
Excipients
Ce médicament contient moins de 1 mmol de sodium (23 mg) par mL de solution à diluer pour perfusion, c’est-à-dire qu’il est considéré essentiellement sans sodium.
Ce médicament contient 0,7 mg de sodium pour 1 mL de solution à diluer pour perfusion, équivalent à 0,035 % de l’apport journalier maximal recommandé par l’OMS, de 2 g pour un adulte.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Médicaments connus pour entraîner une prolongation de l’intervalle QT/QTc, une hypokaliémie ou une hypomagnésémie
Une prolongation de l'intervalle QT/QTc est attendue sous traitement par trioxyde d'arsenic, et des cas de torsade de pointes et de bloc auriculo-ventriculaire complet ont été décrits. Les patients qui reçoivent ou ont reçu des médicaments connus pour provoquer une hypokaliémie ou une hypomagnésémie, comme les diurétiques ou l'amphotéricine B, peuvent avoir un risque supérieur de torsade de pointes. La prudence s'impose lorsque le trioxyde d’arsenic est coadministré avec des médicaments connus pour prolonger l'intervalle QT/QTc, comme les macrolides, l’antipsychotique thioridazine ou les médicaments connus pour provoquer une hypokaliémie ou une hypomagnésémie. Des informations complémentaires sur les agents thérapeutiques prolongeant l’intervalle QT sont mentionnées dans la rubrique 4.4.
Médicaments connus pour provoquer des effets hépatotoxiques
Compte tenu de la survenue possible d’effets hépatotoxiques pendant le traitement par trioxyde d'arsenic, la prudence s’impose lors d’associations du trioxyde d’arsenic avec d’autres médicaments connus pour provoquer des effets hépatotoxiques (voir rubriques 4.4 et 4.8).
Autres médicaments antileucémiques
L'influence du trioxyde d’arsenic sur l'efficacité des autres antileucémiques est inconnue.
4.6. Fertilité, grossesse et allaitement
Contraception chez les hommes et les femmes
Les femmes en âge de procréer, ainsi que les hommes, doivent utiliser une contraception efficace pendant le traitement par le trioxyde d’arsenic.
Grossesse
Il a été démontré que le trioxyde d'arsenic possède des propriétés embryotoxiques et tératogènes dans les études effectuées chez l’animal (voir rubrique 5.3). Il n'a pas été conduit d'étude avec le trioxyde d’arsenic chez la femme enceinte. Si ce produit est administré pendant la grossesse ou si la patiente devient enceinte pendant la prise de ce produit, elle doit être informée du risque potentiel pour le fœtus.
L'arsenic est excrété dans le lait maternel. En raison du risque d’effets indésirables graves causés par le trioxyde d’arsenic chez les nourrissons allaités, l'allaitement doit être interrompu avant et pendant toute la durée d'administration du produit.
Fertilité
Aucune étude clinique ou non clinique de fertilité n’a été conduite avec le trioxyde d’arsenic.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Le trioxyde d’arsenic n’a aucun effet ou un effet négligeable sur l’aptitude à conduire des véhicules et à utiliser des machines.
Résumé du profil de sécurité
Lors des essais cliniques, des effets indésirables rapportés de CTC (critères de toxicité courants) de grade 3 et 4 sont intervenus chez 37 % des patients atteints de LPA en rechute/réfractaire. Les effets les plus couramment rapportés étaient les suivants : hyperglycémie, hypokaliémie, neutropénie et augmentation des taux d'alanine aminotransférase (ALT). Une hyperleucocytose a été observée chez 50 % des patients atteints de LPA en rechute/réfractaire, d'après les bilans hématologiques.
Les effets indésirables sérieux étaient fréquents (1-10 %) et attendus dans cette population atteinte de LPA en rechute/réfractaire. Les effets indésirables sérieux imputés au trioxyde d'arsenic étaient un syndrome de différenciation LPA (3), une hyperleucocytose (3), une prolongation de l'intervalle QT (4, dont 1 avec torsade de pointes), une fibrillation/un flutter auriculaire (1), une hyperglycémie (2) et différents effets indésirables sérieux à type d'hémorragies, d'infections, de douleur, de diarrhée et de nausées.
En général, les événements indésirables survenant sous traitement tendaient à diminuer avec le temps chez les patients atteints de LPA en rechute/réfractaire, peut-être suite à l'amélioration de la maladie traitée. Les patients avaient tendance à mieux tolérer le traitement de consolidation et d'entretien que le traitement d'induction. Cela provient probablement de l'effet confondant créé autour des événements indésirables par le processus pathologique mal contrôlé, au début du traitement, ainsi que par les nombreux traitements concomitants indispensables pour maîtriser les symptômes et la morbidité.
Lors d’un essai de non-infériorité multicentrique de phase III, comparant la trétinoïne (ou acide tout-trans-rétinoïque (ATRA) associée à une chimiothérapie avec la trétinoïne associée au trioxyde d’arsenic chez des patients atteints de LPA à risque faible à intermédiaire nouvellement diagnostiquée (étude APL0406; voir également rubrique 5.1), des effets indésirables graves comprenant hépatotoxicité, thrombocytopénie, neutropénie et prolongation du QTc ont été observés chez des patients traités par trioxyde d'arsenic.
Tableau listant les effets indésirables
Les effets indésirables suivants ont été rapportés lors de l’étude APL0406 chez des patients de diagnostic récent ainsi qu’au cours des essais cliniques et/ou lors du suivi post commercialisation chez des patients atteints de LPA en rechute/réfractaire. Les effets indésirables sont présentés dans le tableau 2 ci-dessous selon la classification MedDRA par classe de système d’organes et par fréquence observés au cours des essais cliniques avec le trioxyde d’arsenic chez 52 patients réfractaires/en rechute atteints de LPA. Les fréquences des effets indésirables sont définies comme : très fréquent (≥ 1/10), fréquent (≥ 1/100, < 1/10), peu fréquent (≥ 1/1 000, < 1/100) et fréquence indéterminée (ne peut être estimée sur la base des données disponibles).
Dans chaque groupement par fréquence, les effets indésirables sont présentés par ordre de gravité décroissant.
Tableau 2
|
Tous grades Grades ≥ 3 |
|
Infections et infestations Herpès zoster Fréquent Fréquence indéterminée Septicémie Fréquence indéterminée Fréquence indéterminée Pneumonie Fréquence indéterminée Fréquence indéterminée |
|
Affections hématologiques et du système lymphatique Neutropénie fébrile Fréquent Fréquent Hyperleucocytose Fréquent Fréquent Neutropénie Fréquent Fréquent Pancytopénie Fréquent Fréquent Thrombocytopénie Fréquent Fréquent Anémie Fréquent Fréquence indéterminée Leucopénie Fréquence indéterminée Fréquence indéterminée Lymphopénie Fréquence indéterminée Fréquence indéterminée |
|
Troubles du métabolisme et de la nutrition Hyperglycémie Très fréquent Très fréquent Hypokaliémie Très fréquent Très fréquent Hypomagnésémie Très fréquent Fréquent Hypernatrémie Fréquent Fréquent Acidocétose Fréquent Fréquent Hypermagnésémie Fréquent Fréquence indéterminée Déshydratation Fréquence indéterminée Fréquence indéterminée Rétention hydrique Fréquence indéterminée Fréquence indéterminée |
|
Affections psychiatriques État confusionnel Fréquence indéterminée Fréquence indéterminée |
|
Affections du système nerveux Paresthésie Très fréquent Fréquent Vertiges Très fréquent Fréquence indéterminée Céphalées Très fréquent Fréquence indéterminée Convulsions Fréquent Fréquence indéterminée Encéphalopathie, Fréquence indéterminée Fréquence indéterminée encéphalopathie de Wernicke |
|
Affections oculaires Vision floue Fréquent Fréquence indéterminée |
|
Affections cardiaques Tachycardie Très fréquent Fréquent Épanchement péricardique Fréquent Fréquent Extrasystoles ventriculaires Fréquent Fréquence indéterminée Insuffisance cardiaque Fréquence indéterminée Fréquence indéterminée Tachycardie ventriculaire Fréquence indéterminée Fréquence indéterminée |
|
Affections vasculaires Vascularites Fréquent Fréquent Hypotension Fréquent Fréquence indéterminée |
|
Affections respiratoires, thoraciques et médiastinales Syndrome de différenciation Très fréquent Très fréquent Dyspnée Très fréquent Fréquent Hypoxie Fréquent Fréquent Épanchement pleural Fréquent Fréquent Douleur pleurétique Fréquent Fréquent Hémorragie alvéolaire Fréquent Fréquent Pneumopathie Fréquence indéterminée Fréquence indéterminée |
|
Affections gastro-intestinales Diarrhées Très fréquent Fréquent Vomissements Très fréquent Fréquence indéterminée Nausées Très fréquent Fréquence indéterminée Douleurs abdominales Fréquent Fréquent |
|
Affections de la peau et du tissu sous-cutané Prurit Très fréquent Fréquence indéterminée Rougeurs Très fréquent Fréquence indéterminée Érythème Fréquent Fréquent Œdème facial Fréquent Fréquence indéterminée |
|
Affections musculo-squelettiques et systémiques Myalgie Très fréquent Fréquent Arthralgie Fréquent Fréquent Douleur osseuse Fréquent Fréquent |
|
Affections du rein et des voies urinaires Insuffisance rénale Fréquent Fréquence indéterminée |
|
Troubles généraux et anomalies au site d'administration Pyrexie Très fréquent Fréquent Douleur Très fréquent Fréquent Fatigue Très fréquent Fréquence indéterminée Œdème Très fréquent Fréquence indéterminée Douleur thoracique Fréquent Fréquent Frissons Fréquent Fréquence indéterminée |
|
Investigations Augmentation de l’alanine Très fréquent Fréquent aminotransférase Augmentation de l’aspartate Très fréquent Fréquent aminotransférase ECG : Prolongation de Très fréquent Fréquent l’intervalle QT Hyperbilirubinémie Fréquent Fréquent Augmentation de la créatinine Fréquent Fréquence indéterminée sanguine Prise de poids Fréquent Fréquence indéterminée Augmentation de la gamma Fréquence indéterminée* Fréquence indéterminée* glutamyltransférase* |
* Dans l’étude CALBG C9710, 2 cas d’augmentation des GGT de grade > 3 ont été rapportés parmi 200 patients ayant reçu du trioxyde d’arsenic en cycle de consolidation (cycle 1 et cycle 2) versus aucun dans le bras contrôle.
Description d’effets indésirables sélectionnés
Syndrome de différenciation
Pendant le traitement par le trioxyde d’arsenic, 14 des 52 patients des études sur la LPA en rechute ont présenté un ou plusieurs symptômes du syndrome de différenciation LPA, caractérisé par une fièvre, une dyspnée, une prise de poids, des infiltrats pulmonaires et des épanchements pleuraux ou péricardiques, avec ou sans hyperleucocytose (voir rubrique 4.4). Vingt-sept patients avaient une hyperleucocytose (GB ≥ 10 x 103/µL) pendant le traitement d'induction, dont 4 une valeur > 100 000/µL. Le nombre de GB à la visite de référence n'était pas corrélé au développement ultérieur d'une hyperleucocytose pendant l'étude, et les nombres de GB pendant le traitement de consolidation n'étaient pas aussi élevés que pendant le traitement d'induction. Dans ces études, l'hyperleucocytose n'a fait l'objet d'aucune chimiothérapie. Les médicaments utilisés pour réduire le nombre de globules blancs aggravent souvent les toxicités associées à l'hyperleucocytose et aucune stratégie standard ne s'est révélée efficace. Un patient traité dans le cadre d'une autorisation temporaire d’utilisation est décédé d'un ictus cérébral dû à l'hyperleucocytose, après une chimiothérapie visant à réduire le nombre de GB. L'attitude conseillée est un attentisme prudent, en n'intervenant que dans certains cas particulièrement sélectionnés.
Dans les études majeures en situation de rechute, la mortalité par coagulation intravasculaire disséminée (CIVD) était très fréquente (> 10 %), ce qui est conforme aux taux de mortalité précoce rapportés dans la littérature.
Un syndrome de différenciation a été observé chez 19 % des patients atteints de LPA à risque faible à intermédiaire nouvellement diagnostiquée, dont 5 cas sévères.
Dans le cadre du suivi de pharmacovigilance réalisé après commercialisation, un syndrome de différenciation, comme le syndrome de l'acide rétinoïque, a également été rapporté lors du traitement de cancers autres que la LPA par le trioxyde d’arsenic.
Prolongation de l’intervalle QT
Le trioxyde d'arsenic est susceptible d’entraîner une prolongation de l'intervalle QT (voir rubrique 4.4), laquelle peut conduire à une arythmie ventriculaire du type torsade de pointes, qui peut être fatale. Le risque de torsade de pointes est lié à différents facteurs : degré de prolongation de l'intervalle QT, administration concomitante de médicaments prolongeant l'intervalle QT, antécédents de torsade de pointes, prolongation préexistante de l'intervalle QT, insuffisance cardiaque congestive, administration de diurétiques d'élimination potassique ou autres pathologies donnant une hypokaliémie ou une hypomagnésémie. Une patiente (recevant plusieurs médicaments concomitants, dont l'amphotéricine B) a présenté un phénomène de torsade de pointes asymptomatique pendant le traitement d'induction d’une rechute de LPA par le trioxyde d'arsenic. Elle est passée au traitement de consolidation sans autre manifestation de prolongation de l'intervalle QT.
Une prolongation de l'intervalle QTc a été observée chez 15,6 % des patients atteints de LPA à risque faible à intermédiaire nouvellement diagnostiquée. Il a été mis fin au traitement d'induction chez un patient en raison d'une prolongation sévère de l'intervalle QTc et d'anomalies électrolytiques le troisième jour du traitement.
Neuropathie périphérique
La neuropathie périphérique, caractérisée par des paresthésies/dysesthésies, est un effet courant et bien connu de l’arsenic présent dans l’environnement. Seuls 2 patients atteints de LPA en rechute/réfractaire ont arrêté précocement le traitement en raison de cet événement indésirable et un a continué à recevoir le trioxyde d’arsenic dans le cadre d'un protocole ultérieur. Quarante-quatre pour cent des patients atteints de LPA en rechute/réfractaire ont présenté des symptômes pouvant être associés à une neuropathie, la plupart ont été légers à modérés et ont régressé après l'arrêt du traitement par le trioxyde d’arsenic.
Hépatotoxicité (grade 3-4)
Chez 63,2 % des patients atteints de LPA à risque faible à intermédiaire nouvellement diagnostiquée, des toxicités hépatiques de grade 3 ou 4 sont survenues pendant le traitement d’induction ou de consolidation par le trioxyde d’arsenic en association avec la trétinoïne. Cependant, ces toxicités ont disparu après l’arrêt temporaire du trioxyde d’arsenic, de la trétinoïne, ou des deux (voir rubrique 4.4).
Toxicité hématologique et gastro-intestinale
Des toxicités gastro-intestinales, des neutropénies de grade 3 ou 4 et des thrombocytopénies de grade 3 ou 4 sont survenues chez des patients atteints de LPA à risque faible à intermédiaire nouvellement diagnostiquée. Elles ont toutefois été 2,2 fois moins fréquentes chez les patients traités par le trioxyde d’arsenic en association avec la trétinoïne que chez ceux traités par trétinoïne et chimiothérapie.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : www.signalement-sante.gouv.fr.
Si des symptômes suggérant une toxicité aiguë sérieuse de l'arsenic (ex. : convulsions, faiblesse musculaire et état confusionnel) venaient à apparaître, il faut interrompre immédiatement le traitement par ARSENIC TRIOXYDE ARROW et envisager l'administration de pénicillamine à une dose quotidienne inférieure ou égale à 1 gramme par jour. La durée du traitement par pénicillamine doit être évaluée en prenant en considération les valeurs du laboratoire de l'arsenic urinaire. Pour les patients ne pouvant prendre de médicament par voie orale, il est possible d’envisager l’administration de dimercaprol par voie intramusculaire, à la dose de 3 mg/kg toutes les 4 heures, jusqu'à ce que toute menace sur le pronostic vital soit dissipée. Par la suite, il est possible d’administrer de la pénicillamine à une dose quotidienne de < 1 gramme par jour. En présence d’une coagulopathie, l’administration du chélateur appelé succimer ou acide dimercaptosuccinique (DCI) à 10 mg/kg ou 350 mg/m2 est recommandée toutes les 8 heures pendant 5 jours, puis toutes les 12 heures pendant 2 semaines. Pour les patients présentant un surdosage aigu et grave à l’arsenic, il est nécessaire d'envisager une dialyse.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : Autres anticancéreux, code ATC : L01XX27.
Mécanisme d’action
Le mécanisme d'action du trioxyde d’arsenic n'est pas complètement élucidé. Le trioxyde d'arsenic induit in vitro des altérations morphologiques et des fragmentations de l'acide désoxyribonucléique (ADN) caractéristiques de l'apoptose des cellules NB4 humaines de la leucémie promyélocytaire. Le trioxyde d'arsenic provoque également la lésion ou la dégradation de la protéine de fusion PML/RAR-alpha.
Efficacité et sécurité cliniques
LPA nouvellement diagnostiquée ne présentant pas de risque élevé
Le trioxyde d’arsenic a été évalué chez 77 patients atteints de LPA à risque faible à intermédiaire nouvellement diagnostiquée dans le cadre d’une étude clinique de non-infériorité de phase III, randomisée et contrôlée, comparant l’efficacité et la sécurité du trioxyde d’arsenic en association avec la trétinoïne (ou acide tout-trans-rétinoïque) par rapport à un traitement associant trétinoïne et chimiothérapie (par exemple, l’idarubicine et la mitoxantrone) (étude APL0406). Les patients inclus étaient atteints de LPA nouvellement diagnostiquée confirmée par la présence de la translocation t(15; 17) ou du gène PML-RARα par RT-PCR (Reverse Transcriptase - Polymerase Chain Reaction) ou par un aspect microponctué des corps nucléaires PML dans les cellules leucémiques. Aucune donnée n’est disponible concernant les patients porteurs de translocations variantes comme la t(11;17) (PLZF/RARα). Étaient exclus de l’étude les patients présentant des arythmies significatives, des anomalies de l’ECG (syndrome du QT long congénital, antécédents ou présence de tachyarythmie ventriculaire ou auriculaire significative, bradycardie au repos cliniquement significative [< 50 battements/min], QTc > 450 ms lors de l’ECG pratiqué à la sélection, bloc de branche droit plus hémibloc antérieur gauche, bloc bifasciculaire) ou une neuropathie. Les patients du groupe de traitement trétinoïne + trioxyde d’arsenic ont reçu la trétinoïne à la dose de 45 mg/m2/jour et trioxyde d’arsenic par voie IV à la dose de 0,15 mg/kg/jour jusqu’à obtention d’une rémission complète (RC). Lors du traitement de consolidation, la trétinoïne a été administrée à la même dose à raison de cycles alternant 2 semaines avec traitement et 2 semaines sans traitement pour un total de 7 cycles, tandis que le trioxyde d’arsenic a été administré à la même dose 5 jours par semaine, à raison de cycles alternant 4 semaines avec traitement et 4 semaines sans traitement pour un total de 4 cycles. Les patients du groupe de traitement trétinoïne + chimiothérapie ont reçu l’idarubicine par voie IV à la dose de 12 mg/m2 en jours 2, 4, 6 et 8 et la trétinoïne par voie orale à la dose de 45 mg/m2/jour jusqu’à obtention d’une RC. Lors du traitement de consolidation, les patients ont reçu l’idarubicine à la dose de 5 mg/m2 en jours 1 à 4 et la trétinoïne à la dose de 45 mg/m2/jour pendant 15 jours, puis la mitoxantrone par voie IV à la dose de 10 mg/m2 en jours 1 à 5 et la trétinoïne de nouveau à la dose de 45 mg/m2/jour pendant 15 jours, et enfin une administration unique d’idarubicine à la dose de 12 mg/m2 et la trétinoïne à la dose de 45 mg/m2/jour pendant 15 jours. Chaque cycle de consolidation a été mis en route dès lors qu’il était constaté une récupération hématologique après le cycle précédent, celle-ci étant définie par une numération des polynucléaires neutrophiles > 1,5×109/L et une numération plaquettaire > 100×109/L. Les patients du groupe de traitement trétinoïne + chimiothérapie ont également reçu un traitement d'entretien d'une durée de 2 ans au maximum, constitué de 6- mercaptopurine par voie orale à la dose de 50 mg/m2/jour, de méthotrexate par voie intramusculaire (IM) à la dose de 15 mg/m2 par semaine et de trétinoïne à la dose de 45 mg/m2/jour pendant 15 jours tous les 3 mois.
Les principaux résultats obtenus en termes d’efficacité sont résumés dans le tableau 3 ci-dessous : Table 3
|
Critère d'évaluation |
Trétinoïne + trioxyde d’arsenic (n = 77) [%] |
Trétinoïne + chimiothérapie (n = 79) [%] |
Intervalle de confiance (IC) |
Valeur de p |
|
Survie sans événement à 2 ans (EFS, event-free survival) |
97 |
86 |
IC à 95 % de la différence : 2 - 22 points de pourcentage |
p < 0,001 pour la non- infériorité p = 0,02 pour la supériorité de l'association trétinoïne + trioxyde d’arsenic |
|
Rémission hématologique complète (RHC) |
100 |
95 |
|
p = 0,12 |
|
Survie globale (SG) à 2 ans |
99 |
91 |
|
p = 0,02 |
|
Survie sans rechute à 2 ans |
97 |
90 |
|
p = 0,11 |
|
Incidence cumulée des rechutes à 2 ans |
1 |
6 |
|
p = 0,24 |
LPA en rechute/réfractaire
le trioxyde d’arsenic a été étudié chez 52 patients atteints de LPA, précédemment traités par une anthracycline et un rétinoïde, dans deux essais ouverts non comparatifs, à un seul groupe. L'un était une étude monocentrique (n = 12) et l'autre une étude multicentrique effectuée dans 9 centres (n = 40). Les patients de la première étude ont reçu une dose médiane du trioxyde d’arsenic de 0,16 mg/kg/jour (limites : 0,06 à 0,20 mg/kg/jour) et ceux de l'étude multicentrique une dose fixe de 0,15 mg/kg/jour. Le trioxyde d’arsenic a été administré en perfusions intraveineuses de 1 à 2 heures jusqu'à disparition complète des cellules leucémiques de la moelle osseuse, pendant 60 jours au maximum. Les patients obtenant une rémission complète ont reçu un traitement de consolidation par le trioxyde d’arsenic consistant en 25 doses supplémentaires sur une période de 5 semaines. Le traitement de consolidation a commencé 6 semaines (limites : 3 à 8 semaines) après le traitement d'induction dans l'étude monocentrique et 4 semaines (limites : 3 à 6 semaines) après le traitement d'induction dans l'étude multicentrique. Par définition, la rémission complète (RC) était caractérisée par l'absence de cellules leucémiques visibles dans la moelle osseuse et par la reconstitution d'une formule leucocytaire et plaquettaire normale dans le sang périphérique.
Les patients de l'étude monocentrique avaient rechuté après 1 à 6 traitements antérieurs et 2 patients avaient rechuté après une transplantation de cellules souches. Les patients de l'étude multicentrique avaient rechuté après 1 à 4 traitements antérieurs et 5 patients avaient rechuté après une transplantation de cellules souches. L'âge médian des patients était de 33 ans (limites : 9 à 75 ans) dans l'étude monocentrique et de 40 ans (limites : 5 à 73 ans) dans l'étude multicentrique.
Les résultats sont résumés dans le tableau 4 ci-dessous.
Tableau 4
|
|
Étude monocentrique N = 12 |
Étude multicentrique N = 40 |
|
Dose de trioxyde d’arsenic, mg/kg/jour (Médiane, limites) |
0,16 (0,06 – 0,20) |
0,15 |
|
Rémission Complète |
11 (92 %) |
34 (85 %) |
|
Délai de rémission médullaire (Médiane) |
32 jours |
35 jours |
|
Délai de RC (Médiane) |
54 jours |
59 jours |
|
Survie à 18 mois |
67 % |
66 % |
L'étude monocentrique comprenait 2 enfants (< 18 ans) et tous deux ont obtenu une rémission complète (RC). L'essai multicentrique comprenait 5 enfants (< 18 ans), dont 3 ont obtenu une RC. Aucun enfant de moins de 5 ans n'a été traité.
Dans le suivi après le traitement de consolidation, 7 patients de l'étude monocentrique et 18 patients de l'étude multicentrique ont reçu un traitement d'entretien par trioxyde d’arsenic. Trois patients de l'étude monocentrique et 15 patients de l'étude multicentrique ont reçu une transplantation de cellules souches après avoir terminé le traitement par trioxyde d’arsenic. La durée médiane de la RC, selon la méthode de Kaplan-Meier, est de 14 mois pour l'étude monocentrique (elle n'a pas été atteinte pour l'étude multicentrique). À la dernière visite de contrôle, 6 patients sur 12 étaient vivants dans l'étude monocentrique, avec un suivi médian de 28 mois (limites : 25 à 29 mois). Dans l'étude multicentrique, 27 patients sur 40 étaient vivants, avec un suivi médian de 16 mois (limites : 9 à 25 mois). Les estimations de Kaplan-Meier de la survie à 18 mois pour chaque étude sont présentées ci-dessous.
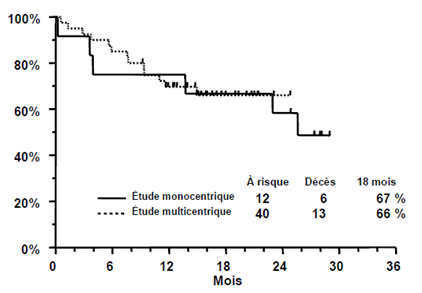
Le tableau 5 ci-dessous présente la confirmation cytogénétique de la conversion à un génotype normal et la détection par RT-PCR (reverse transcriptase - polymerase chain reaction) de la conversion du facteur PML/RAR-α à la normale.
Analyse cytogénétique après traitement par Trioxyde d’arsenic
Tableau 5
|
|
|
Étude pilote monocentrique N avec RC = 11 |
Étude multicentrique N avec RC = 34 |
|
Cytogénétique classique [t(15;17)] Absente Présente Non évaluable |
|
8 (73 %) 1 (9 %) 2 (18 %) |
31 (91 %) 0 % 3 (9 %) |
|
RT-PCR pour PML/RAR α
Négative Positive Non évaluable |
|
8 (73 %) 3 (27 %) 0 |
27 (79 %) 4 (12 %) 3 (9 %) |
Des réponses ont été observées dans toutes les tranches d'âge étudiées, allant de 6 à 75 ans. Les taux de réponses étaient similaires dans les deux sexes. Il n’existe aucune expérience de l’effet du Trioxyde d’arsenic sur la variante de la LPA caractérisée par la présence des translocations chromosomiques t(11;17) et t(5;17).
Population pédiatrique
L’expérience chez l’enfant est limitée. Sur les 7 patients âgés de moins de 18 ans (entre 5 et 16 ans) et traités avec Trioxyde d’arsenic à la dose recommandée de 0,15 mg/kg/jour, 5 patients ont obtenu une rémission complète (voir rubrique 4.2).
5.2. Propriétés pharmacocinétiques
La forme inorganique, lyophilisée du trioxyde d’arsenic, mise en solution, forme immédiatement le produit d’hydrolyse : l’acide arsénieux (AsIII). AsIII est la forme pharmacologiquement active du trioxyde d’arsenic.
Distribution
Le volume de distribution (Vd) d’AsIII est élevé (> 400 L) indiquant une distribution significative dans les tissus, avec une liaison négligeable aux protéines. Vd est aussi dépendant du poids, augmentant avec l’augmentation du poids corporel. L’arsenic total s’accumule principalement dans le foie, le rein et le cœur, et dans une moindre mesure, dans le poumon, les cheveux et les ongles.
Biotransformation
Le métabolisme du trioxyde d’arsenic implique l’oxydation de l’acide arsénieux (AsIII), la forme active du trioxyde d’arsenic, en acide arsénique (AsV) ainsi que la méthylation oxydative en acide monométhylarsonique (MMAV) et en acide diméthylarsinique (DMAV) par des méthyltransférases, essentiellement dans le foie. Les métabolites pentavalents, MMAV et DMAV, sont lents à apparaître dans le plasma (environ 10-24 heures après la première administration de trioxyde d’arsenic), mais du fait de leur demi-vie longue, ils s’accumulent plus à des doses multiples que l’AsIII. L’étendue de l’accumulation de ces métabolites dépend du régime posologique. L’accumulation suivant une administration de dose multiple est approximativement de 1,4 à 8 fois supérieure à celle suivant une administration en dose unique. AsV est présent uniquement dans le plasma à des niveaux relativement faibles.
Dans des études enzymatiques menées in vitro sur microsomes hépatiques humains, il a été démontré que le trioxyde d’arsenic ne possédait pas d’activité inhibitrice sur les substrats des enzymes principaux de cytochromes P450 tels que 1A2, 2A6, 2B6, 2C8, 2C9, 2C19, 2D6, 2E1,3A4/5, 4A9/11. Les substances substrats de ces enzymes P450 ne sont pas censées induire une interaction avec le trioxyde d’arsenic.
Élimination
Environ 15 % de la dose administrée de Trioxyde d’arsenic est excrétée dans les urines en AsIII inchangé. Les métabolites méthylés de l’AsIII (MMAV, DMAV) sont principalement excrétés dans les urines. La concentration plasmatique de l’AsIII décline de manière biphasique à partir de la concentration du pic plasmatique avec une demi-vie moyenne d’élimination terminale de 10 à 14 heures. La clairance totale de l’AsIII pour un intervalle de dose unique de 7-32 mg (administrée à 0,15 mg/kg) est de 49 L/h. La clairance n’est pas dépendante du poids du sujet ni de la dose administrée pour l’intervalle de dose étudié. Les demi-vies moyennes d’élimination terminale estimées des métabolites MMAV et DMAV sont respectivement de 32 heures et de 70 heures.
Insuffisance rénale
La clairance plasmatique de l’AsIII n’a pas été altérée chez les patients présentant une insuffisance rénale faible (clairance de la créatinine de 50-80 mL/min) ou une insuffisance rénale modérée (clairance de la créatinine de 30-49 mL/min). La clairance plasmatique de l’AsIII chez les patients ayant une insuffisance rénale sévère (clairance de la créatinine inférieure à 30 mL/min) était 40 % inférieure à celle de patients ayant une fonction rénale normale (voir rubrique 4.4).
L’exposition systématique au MMAV et au DMAV tend à être plus importante chez les patients ayant une insuffisance rénale ; la conséquence clinique en est inconnue mais aucune augmentation de la toxicité n’a été notée.
Insuffisance hépatique
Des données pharmacocinétiques chez des patients ayant une insuffisance hépatique faible à modérée avec un carcinome hépatocellulaire indiquent que l’AsIII ou l’AsV ne s’accumulent pas lorsque les perfusions sont bihebdomadaires. Sur la base des ASC doses-normalisées (par mg de dose), l’altération de la fonction hépatique ne semble pas augmenter l’exposition systémique de l’AsIII, AsV, MMAV ou DMAV.
Linéarité/non-linéarité
Dans l’intervalle de dose unique totale de 7 à 32 mg (administrée à 0,15 mg/kg), l’exposition systémique (ASC) apparaît linéaire. La décroissance à partir de la concentration du pic plasmatique d’AsIII intervient de manière biphasique et est caractérisée par une phase initiale de distribution rapide suivie d’une phase terminale d’élimination lente. Après administration de 0,15 mg/kg à une fréquence journalière (n = 6) ou bihebdomadaire (n = 3), l’accumulation d’AsIII a été approximativement doublée par rapport à celle observée en administration unique. Cette accumulation était légèrement supérieure à ce qui était attendu sur la base des résultats en dose unique.
5.3. Données de sécurité préclinique
Des études limitées chez l’animal de toxicité sur la reproduction avec le trioxyde d'arsenic indiquent des propriétés embryotoxiques et tératogènes (anomalies du tube neural, anophtalmie et microphtalmie) en cas d’administration de 1 à 10 fois la dose clinique recommandée (mg/m2). Il n'a pas été conduit d'études de fertilité avec le Trioxyde d’arsenic. Les arsénieux induisent des aberrations chromosomiques et des transformations morphologiques dans des cellules de mammifères in vitro et in vivo. Il n'a pas été conduit d'études formelles de potentiel carcinogène avec le trioxyde d'arsenic. Cependant, le trioxyde d'arsenic et d’autres arsénieux inorganiques sont reconnus comme cancérogènes chez l'homme.
En l’absence d’études de compatibilité, ce médicament ne doit pas être mélangé avec d’autres médicaments, à l’exception de ceux mentionnés dans la rubrique 6.6.
3 ans.
La stabilité physico-chimique après dilution dans des solutions de chlorure de sodium à 0,9 % ou de glucose à 5% a été démontrée pendant 24 heures à 25°C et 48 heures au réfrigérateur (entre 2 ºC et 8 ºC).
D’un point de vue microbiologique, le produit doit être utilisé immédiatement. En cas d’utilisation non immédiate, les durées et conditions de conservation en cours d'utilisation relèvent de la responsabilité de l’utilisateur et ne devraient pas dépasser 24 heures à une température comprise entre 2 et 8 °C, sauf en cas de dilution réalisées en conditions d’asepsie dûment contrôlées et validées.
6.4. Précautions particulières de conservation
Ce médicament ne nécessite pas de précautions particulières de conservation.
6.5. Nature et contenu de l'emballage extérieur
Ampoule en verre de type I borosilicaté contenant 10 mL de solution à diluer.
Chaque boîte contient 10 ampoules.
6.6. Précautions particulières d’élimination et de manipulation
Préparation de ARSENIC TRIOXYDE ARROW
Une technique aseptique doit être strictement observée durant la manipulation de ARSENIC TRIOXYDE ARROW car il ne contient aucun conservateur.
ARSENIC TRIOXYDE ARROW doit être dilué dans 100 à 250 mL de solution injectable de sérum glucosé à 50 mg/mL (5 %), ou de solution injectable de chlorure de sodium à 9 mg/mL (0,9 %), immédiatement après le prélèvement dans l'ampoule. L’ampoule est à usage unique et toute fraction inutilisée de chaque ampoule doit être jetée en respectant les mesures de sécurité. Ne conserver aucune fraction inutilisée pour l'administrer ultérieurement.
ARSENIC TRIOXYDE ARROW ne doit pas être mélangé avec ou administré en même temps et dans la même ligne intraveineuse que d'autres médicaments.
ARSENIC TRIOXYDE ARROW doit être administré en perfusion intraveineuse lente de 1 à 2 heures. La durée de la perfusion peut être portée à 4 heures en cas de réactions vasomotrices. Il n'est pas nécessaire de mettre en place un cathéter veineux central.
La solution diluée doit être limpide et incolore. L’absence de particules et de décoloration doit être contrôlée visuellement dans toute solution parentérale avant administration. Ne pas utiliser la préparation en cas de présence de particules étrangères.
Procédure correcte d’élimination
Tout médicament non utilisé, tout élément entrant en contact avec le produit ou tout déchet doit être éliminé conformément à la réglementation en vigueur.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
VAULT14, LEVEL 2,
VALLETTA WATERFRONT,
FLORIANA, FRN 1914
MALTE
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 550 660 1 9 : Ampoule (verre) de 10 mL ; boîte de 10.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Liste I.
Médicament réservé à l’usage hospitalier.
ANSM - Mis à jour le : 03/05/2022
ARSENIC TRIOXYDE ARROW 1 mg/mL, solution à diluer pour perfusion
Trioxyde d’arsenic
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin, votre pharmacien ou votre infirmier/ère.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, votre pharmacien ou votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que ARSENIC TRIOXYDE ARROW 1 mg/mL, solution à diluer pour perfusion et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d'utiliser ARSENIC TRIOXYDE ARROW 1 mg/mL, solution à diluer pour perfusion ?
3. Comment utiliser ARSENIC TRIOXYDE ARROW 1 mg/mL, solution à diluer pour perfusion ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver ARSENIC TRIOXYDE ARROW 1 mg/mL, solution à diluer pour perfusion ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE ARSENIC TRIOXYDE ARROW 1 mg/mL, solution à diluer pour perfusion ET DANS QUELS CAS EST-IL UTILISE ?
Classe pharmacothérapeutique : Autres anticancéreux- code ATC : L01XX27.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER ARSENIC TRIOXYDE ARROW 1 mg/mL, solution à diluer pour perfusion ?
ARSENIC TRIOXYDE ARROW doit être administré sous la surveillance d'un médecin ayant l'expérience du traitement des leucémies aiguës.
N’utilisez jamais ARSENIC TRIOXYDE ARROW 1 mg/mL, solution à diluer pour perfusion :
· si vous êtes allergique au trioxyde d’arsenic ou à l’un des autres composants contenus dans ce médicament, mentionnés dans la rubrique 6.
Avertissements et précautions
Adressez-vous à votre médecin ou votre infirmier/ère avant d’utiliser ARSENIC TRIOXYDE ARROW 1 mg/mL, solution à diluer pour perfusion :
· atteinte de la fonction rénale
· problèmes hépatiques
Votre médecin prendra les précautions suivantes :
· Des analyses seront réalisées pour être sûr que vous avez suffisamment de potassium, de magnésium, de calcium et de créatinine dans votre sang avant l’administration de la première dose de ARSENIC TRIOXYDE ARROW.
· Vous devrez réaliser un enregistrement de la stimulation électrique du cœur (électrocardiogramme ECG) avant l’administration de la première dose.
· Des examens sanguins (potassium, calcium, fonction hépatique) devront être renouvelés pendant le traitement par ARSENIC TRIOXYDE ARROW.
· Vous devrez également passer un électrocardiogramme deux fois par semaine.
· Si vous présentez un risque d’apparition d’un certain type d’anomalie du rythme cardiaque (ex. : torsade de pointes ou prolongation de QTc), vous ferez l’objet d’une surveillance cardiaque continue.
· Votre médecin surveillera votre santé pendant et après le traitement, car le trioxyde d’arsenic, substance active de ARSENIC TRIOXYDE ARROW, est susceptible de provoquer d’autres cancers. Les situations et symptômes nouveaux et exceptionnels qui se présenteraient doivent être signalés à votre médecin lors des consultations.
· Un suivi de vos fonctions cognitives et de votre mobilité sera assuré si vous présentez un risque de déficit en vitamine B1.
Enfants et adolescents
ARSENIC TRIOXYDE ARROW n’est pas recommandé chez les enfants et les adolescents âgés de moins de 18 ans.
Autres médicaments et ARSENIC TRIOXYDE ARROW 1 mg/mL, solution à diluer pour perfusion
Informez votre médecin ou pharmacien si vous prenez, avez récemment pris ou pourriez prendre tout autre médicament, y compris un médicament obtenu sans ordonnance.
En particulier, prévenez votre médecin si :
· si vous prenez des médicaments susceptibles de modifier le rythme cardiaque, notamment :
o certains types d’antiarythmiques (médicaments utilisés afin de corriger les irrégularités du rythme cardiaque, ex. : quinidine, amiodarone, sotalol, dofétilide),
o les médicaments utilisés dans le traitement de la psychose (perte de contact avec la réalité, ex. : thioridazine),
o les médicaments utilisés dans le traitement de la dépression (ex. : amitriptyline),
o certains médicaments utilisés dans le traitement des infections bactériennes (ex. : érythromycine et sparfloxacine),
o certains médicaments utilisés dans le traitement des allergies comme le rhume des foins, appelés antihistaminiques (ex. : terfénadine et astémizole),
o tout médicament pouvant provoquer une baisse du taux de magnésium ou de potassium dans le sang (ex. : amphotéricine B),
o le cisapride (médicament utilisé afin de soulager certains problèmes d’estomac).
Les effets de ces médicaments sur votre rythme cardiaque peuvent empirer avec l’utilisation de ARSENIC TRIOXYDE ARROW. Votre devez bien informer votre médecin de tout médicament que vous prenez.
· vous prenez ou avez pris récemment n’importe quel médicament qui pourrait affecter votre foie. Si vous n’êtes pas sûr, montrez le flacon ou la boîte à votre médecin.
ARSENIC TRIOXYDE ARROW 1 mg/mL, solution à diluer pour perfusion avec des aliments et boissons
Le traitement par ARSENIC TRIOXYDE ARROW n'implique aucune restriction sur les aliments et les boissons.
Grossesse
Demandez conseil à votre médecin ou à votre pharmacien avant de prendre tout médicament. ARSENIC TRIOXYDE ARROW peut être nocif pour le fœtus lorsqu'il est pris pendant la grossesse.
Si vous êtes en âge de procréer, vous devez utiliser un mode de contraception efficace pendant le traitement par ARSENIC TRIOXYDE ARROW.
Si vous êtes enceinte ou devenez enceinte pendant le traitement par ARSENIC TRIOXYDE ARROW, demandez conseil à votre médecin.
Les hommes doivent également utiliser une contraception efficace pendant le traitement par ARSENIC TRIOXYDE ARROW.
Allaitement
Demandez conseil à votre médecin ou à votre pharmacien avant de prendre tout médicament.
L'arsenic contenu dans ARSENIC TRIOXYDE ARROW est excrété dans le lait des patientes traitées.
ARSENIC TRIOXYDE ARROW pouvant être nocif chez les nourrissons, n’allaitez pas au cours d’un traitement par ARSENIC TRIOXYDE ARROW.
Conduite de véhicules et utilisation de machines
Il n’est attendu aucun effet ou seulement un effet négligeable de ARSENIC TRIOXYDE ARROW sur la capacité à conduire des véhicules et à utiliser des machines.
Si vous ressentez une gêne ou une sensation de malaise après une perfusion de ARSENIC TRIOXYDE ARROW, vous devez attendre que les symptômes aient disparu avant de conduire un véhicule ou d'utiliser une machine.
ARSENIC TRIOXYDE ARROW 1 mg/mL, solution à diluer pour perfusion contient du sodium
ARSENIC TRIOXYDE ARROW contient moins de 1 mmol (23 mg) de sodium par dose, c.-à-d. qu’il est essentiellement « sans sodium ».
3. COMMENT UTILISER ARSENIC TRIOXYDE ARROW 1 mg/mL, solution à diluer pour perfusion ?
Patients atteints de leucémie promyélocytaire aiguë nouvellement diagnostiquée
Votre médecin vous administrera ARSENIC TRIOXYDE ARROW une fois par jour en perfusion. Lors de votre premier cycle thérapeutique, vous pourrez être traité chaque jour jusqu’à 60 jours au plus ou jusqu’à ce que votre médecin juge que votre maladie s’est améliorée. Si votre maladie répond au traitement par ARSENIC TRIOXYDE ARROW, vous recevrez 4 cycles thérapeutiques supplémentaires de 20 doses réparties sur 5 jours par semaine (suivis de 2 jours d’interruption) pendant 4 semaines suivis de 4 semaines d’interruption. Votre médecin décidera de la durée exacte de la poursuite du traitement par ARSENIC TRIOXYDE ARROW.
Patients atteints de leucémie promyélocytaire aiguë n’ayant pas répondu aux autres traitements
Votre médecin vous administrera ARSENIC TRIOXYDE ARROW une fois par jour en perfusion. Lors de votre premier cycle thérapeutique, vous pourrez être traité(e) chaque jour pendant 50 jours au maximum ou jusqu’à ce que votre médecin juge que votre maladie s’est améliorée. Si votre maladie répond au traitement par ARSENIC TRIOXYDE ARROW, vous recevrez un second cycle de 25 doses réparties sur 5 jours par semaine (suivi de 2 jours d’interruption) pendant 5 semaines. Votre médecin décidera de la durée exacte de la poursuite du traitement par ARSENIC TRIOXYDE ARROW.
Mode et voie d’administration
ARSENIC TRIOXYDE ARROW doit être dilué dans une solution contenant du glucose ou une solution contenant du chlorure de sodium.
ARSENIC TRIOXYDE ARROW est administré par votre médecin ou votre infirmier/ère. Il est administré au compte-goutte (perfusion) en intraveineuse pendant 1 à 2 heures, mais la perfusion peut durer plus longtemps en cas d’apparition d’effets secondaires tels que bouffées congestives et vertiges.
ARSENIC TRIOXYDE ARROW ne doit pas être mélangé avec ou administré par le même tube de perfusion que d'autres médicaments.
Si votre médecin vous a administré plus de ARSENIC TRIOXYDE ARROW qu’il n’aurait dû
Vous pourriez ressentir les effets suivants : convulsions, faiblesse musculaire et confusion. Dans ce cas, le traitement par ARSENIC TRIOXYDE ARROW doit être immédiatement interrompu et votre médecin vous donnera un traitement contre le surdosage d’arsenic.
Si vous avez d’autres questions sur l’utilisation de ce médicament, demandez plus d’informations à votre médecin ou à votre pharmacien.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Appelez immédiatement votre médecin ou votre infirmier/ère si vous remarquez les effets indésirables suivants qui peuvent être le signe d’une grave affection appelée « syndrome de différenciation », potentiellement fatale :
· difficulté à respirer,
· quinte de toux,
· douleur dans la poitrine,
· fièvre.
Appelez immédiatement votre médecin ou votre infirmier/ère si vous remarquez un ou plusieurs des effets indésirables suivants, qui peuvent être le signe d’une réaction allergique :
· difficulté à respirer,
· fièvre,
· prise de poids subite,
· rétention d’eau,
· perte de conscience,
· palpitations (battements cardiaques violents que vous ressentez dans la poitrine).
Pendant le traitement par ARSENIC TRIOXYDE ARROW, il est possible que vous présentiez l'une des réactions suivantes :
Très fréquent (pouvant toucher plus d’1 personne sur 10) :
· fatigue (épuisement), douleur, fièvre, maux de tête,
· nausées, vomissements, diarrhées,
· étourdissements, douleurs musculaires, engourdissement ou fourmillement,
· éruption cutanée ou démangeaisons,
· augmentation du taux de sucre dans le sang, œdème (gonflement dû à un excès de fluide),
· essoufflement, battements cardiaques accélérés, tracé anormal à l’ECG,
· diminution du potassium ou du magnésium dans le sang, tests anormaux de la fonction hépatique dont excès de bilirubine ou de gamma glutamyltransférase dans le sang.
Fréquent (pouvant toucher jusqu’à 1 personne sur 10) :
· diminution du nombre de cellules sanguines (plaquettes, globules rouges et/ou blancs), augmentation du nombre de globules blancs,
· frissons, prise de poids,
· fièvre due à une infection et à des niveaux bas de globules blancs, zona,
· douleur dans la poitrine, saignement dans le poumon, hypoxie (niveau d’oxygène bas), accumulation de liquide autour du cœur ou du poumon, pression sanguine basse, rythme cardiaque anormal,
· convulsion, douleur articulaire ou osseuse, inflammation des vaisseaux sanguins,
· augmentation du sodium ou du magnésium, cétones dans le sang et les urines (acidocétose), tests anormaux de la fonction rénale, insuffisance rénale,
· maux d’estomac ou douleurs abdominales,
· rougeur de la peau, visage gonflé, vision floue.
Fréquence indéterminée (ne peut être estimée sur la base des données disponibles) :
· infection pulmonaire, infection dans le sang,
· inflammation des poumons qui peut entraîner une douleur dans la poitrine et une difficulté à respirer, insuffisance cardiaque,
· déshydratation, confusion,
· maladie cérébrale (encéphalopathie, encéphalopathie de Wernicke) associée à diverses manifestations, notamment des difficultés à utiliser ses bras et ses jambes, des troubles de l’élocution et une confusion.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, votre pharmacien ou à votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : www.signalement-sante.gouv.fr
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER ARSENIC TRIOXYDE ARROW 1 mg/mL, solution à diluer pour perfusion ?
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur l’emballage, le flacon.
Ce médicament ne nécessite pas de précautions particulières de conservation.
La stabilité physico-chimique après dilution dans des solutions de chlorure de sodium à 0,9 % ou de glucose à 5% a été démontrée pendant 24 heures à 25°C et 48 heures au réfrigérateur (entre 2 ºC et 8 ºC).
D’un point de vue microbiologique, le produit doit être utilisé immédiatement. En cas d’utilisation non immédiate, les durées et conditions de conservation en cours d'utilisation relèvent de la responsabilité de l’utilisateur et ne devraient pas dépasser 24 heures à une température comprise entre 2 et 8 °C, sauf en cas de dilution réalisées en conditions d’asepsie dûment contrôlées et validées.
Ce médicament ne doit pas être utilisé si vous constatez des particules visibles ou si la solution est décolorée.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient ARSENIC TRIOXYDE ARROW 1 mg/mL, solution à diluer pour perfusion
· La substance active est :
Le trioxyde d’arsenic.......................................................................................................... 1 mg/mL
· Les autres composants sont : hydroxyde de sodium, acide chlorhydrique (pour ajustement du pH) et eau pour préparations injectables.
ARSENIC TRIOXYDE ARROW est une solution à diluer pour perfusion.
ARSENIC TRIOXYDE ARROW est fourni dans des ampoules en verre sous forme de solution aqueuse concentrée stérile, limpide, incolore qui est préparée et diluée à l’hôpital et administrée par perfusion dans un vaisseau sanguin. Chaque boîte contient 10 ampoules en verre à usage unique. Chaque ampoule contient 10 mg de trioxyde d’arsenic.
Titulaire de l’autorisation de mise sur le marché
VAULT14, LEVEL 2,
VALLETTA WATERFRONT,
FLORIANA, FRN 1914
MALTE
Exploitant de l’autorisation de mise sur le marché
26 AVENUE TONY GARNIER
69007 LYON
SMETANOVO NABREZI 1238/20A
HRADEC KRALOVE 500 02
REPUBLIQUE TCHEQUE
OU
ARROW GENERIQUES
26 AVENUE TONY GARNIER
69007 LYON
FRANCE
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Ce médicament est autorisé dans les Etats membres de l'Espace Economique Européen sous les noms suivants : Conformément à la réglementation en vigueur.
[À compléter ultérieurement par le titulaire]
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
< {MM/AAAA}>< {mois AAAA}.>
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).
Les informations suivantes sont destinées exclusivement aux professionnels de santé :
UNE TECHNIQUE ASEPTIQUE DOIT ÊTRE STRICTEMENT OBSERVÉE DURANT LA MANIPULATION DE ARSENIC TRIOXYDE ARROW CAR IL NE CONTIENT AUCUN CONSERVATEUR.
Dilution de ARSENIC TRIOXYDE ARROW
ARSENIC TRIOXYDE ARROW doit être dilué avant administration.
Le personnel doit être formé à manipuler et à diluer le trioxyde d'arsenic et doit porter des vêtements de protection appropriés.
Ouverture de l’ampoule : Tenir l’ampoule de ARSENIC TRIOXYDE ARROW avec la pointe colorée vers le haut et face à vous. Secouer ou tapoter l’ampoule pour faire passer du liquide dans la tige de l’ampoule. Maintenant, appuyer avec votre pouce sur la pointe colorée et casser l’ampoule en maintenant fermement le reste de l’ampoule avec l’autre main.
Dilution : Insérer soigneusement l’aiguille de la seringue dans l’ampoule et aspirer tout le contenu. ARSENIC TRIOXYDE ARROW doit ensuite être immédiatement dilué dans 100 à 250 mL d’une solution injectable de glucose à 50 mg/mL (5 %) ou d’une solution injectable de chlorure de sodium à 9 mg/mL (0,9 %).
Toute fraction inutilisée de chaque ampoule doit être jetée en respectant les mesures de sécurité. Ne conserver aucune fraction inutilisée pour l’administrer ultérieurement.
Utilisation de ARSENIC TRIOXYDE ARROW
Usage individuel. ARSENIC TRIOXYDE ARROW ne doit pas être mélangé avec ou administré en même temps et dans la même ligne intraveineuse que d'autres médicaments.
ARSENIC TRIOXYDE ARROW doit être administré en perfusion intraveineuse lente de 1 à 2 heures. La durée de la perfusion peut être portée à 4 heures en cas de réactions vasomotrices. Il n'est pas nécessaire de mettre en place un cathéter veineux central.
La solution diluée doit être limpide et incolore. L’absence de particules et de décoloration doit être contrôlée visuellement dans toute solution parentérale avant administration. Ne pas utiliser la préparation en cas de présence de particules étrangères.
La stabilité physico-chimique après dilution dans des solutions de chlorure de sodium à 0,9 % ou de glucose à 5% a été démontrée pendant 24 heures à 25°C et 48 heures au réfrigérateur (entre 2 ºC et 8 ºC).
D’un point de vue microbiologique, le produit doit être utilisé immédiatement. En cas d’utilisation non immédiate, les durées et conditions de conservation en cours d'utilisation relèvent de la responsabilité de l’utilisateur et ne devraient pas dépasser 24 heures à une température comprise entre 2 et 8 °C, sauf en cas de dilution réalisées en conditions d’asepsie dûment contrôlées et validées.
Procédure correcte d’élimination
Tout produit non utilisé, tout élément entrant en contact avec le produit ou tout déchet doit être éliminé conformément à la réglementation en vigueur.