Dernière mise à jour le 02/02/2026
VOLTARENPLAST 1 %, emplâtre médicamenteux
Présentations
> sachet(s) papier polyéthylène basse densité (PEBD) aluminium copolymère d'éthylène et d'acide méthacrylique de 5 emplâtre(s)
Code CIP : 394 223-4 ou 34009 394 223 4 3
Déclaration de commercialisation : 26/05/2010
Cette présentation n'est pas agréée aux collectivités
> sachet(s) papier polyéthylène basse densité (PEBD) aluminium copolymère d'éthylène et d'acide méthacrylique de 10 emplâtre(s)
Code CIP : 394 224-0 ou 34009 394 224 0 4
Déclaration d'arrêt de commercialisation : 16/04/2024
Cette présentation n'est pas agréée aux collectivités
Service médical rendu (SMR)
Pas de SMR disponible pour ce médicament ( plus d'informations dans l'aide )
Amélioration du service médical rendu (ASMR)
Pas d'ASMR disponible pour ce médicament (plus d'informations dans l'aide )
ANSM - Mis à jour le : 11/10/2024
VOLTARENPLAST 1%, emplâtre médicamenteux
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Diclofénac sodique ............................................................................................................ 140 mg
Pour un emplâtre médicamenteux.
Excipients à effet notoire : 2,8 mg de butylhydroxytoluène (E321) et 1400 mg propylèneglycol (E1520) par emplâtre.
Pour la liste complète des excipients, voir rubrique 6.1.
Emplâtre de 10 cm sur 14 cm avec une couche uniforme de pâte blanche à brun clair étalée sur un support non tissé et un film protecteur détachable.
4.1. Indications thérapeutiques
4.2. Posologie et mode d'administration
Chez l'adulte, appliquer un emplâtre sur la région douloureuse 2 fois par jour (matin et soir). La dose maximale totale pouvant être utilisée est de deux emplâtres par jour, même s'il y a plus d'un traumatisme à traiter. Ne pas traiter plus d'une région douloureuse à la fois.
VOLTARENPLAST 1%, emplâtre médicamenteux doit être utilisé pour une durée la plus courte possible en fonction de l’indication.
Enfants et adolescents de moins de 16 ans
Cet emplâtre médicamenteux n’est pas recommandé chez l’enfant et l’adolescent de moins de 16 ans car les données disponibles sur l’efficacité et la tolérance sont insuffisantes (voir rubrique 4.3).
Patients âgés
Ce médicament doit être utilisé avec prudence chez les patients âgés qui sont plus sujets aux effets indésirables (voir rubrique 4.4.).
Patients souffrant d'insuffisance rénale ou d'insuffisance hépatique
Pour l’utilisation de VOLTARENPLAST 1 %, emplâtre médicamenteux chez les patients atteints d’insuffisance hépatique ou rénale, voir rubrique 4.4.
Mode d'application
Pour application cutanée uniquement.
Le produit doit être appliqué uniquement sur une peau intacte et saine et ne doit pas être appliqué lors du bain ou de la douche.
Couper l’enveloppe contenant l’emplâtre médicamenteux, comme indiqué. Retirer un emplâtre médicamenteux, enlever le film plastique utilisé pour protéger la surface adhésive et appliquer sur la zone douloureuse. Si nécessaire, l’emplâtre peut être maintenu en place par un filet élastique. Refermer soigneusement l’enveloppe avec la fermeture coulissante. Ne jamais découper l'emplâtre.
Durée d'utilisation
Sur la base de données limitées disponibles, un traitement de courte durée est recommandé.
Le bénéfice thérapeutique d’une utilisation d’une durée de plus de 7 jours n'a pas été démontré.
Si aucune amélioration n’a été constatée suite à la durée de traitement recommandée, un médecin doit être consulté (voir rubrique 4.4).
Chez les adolescents de plus de 16 ans et les adultes, si une utilisation du produit de plus de 7 jours est nécessaire pour soulager la douleur, ou si les symptômes s’aggravent, les parents des adolescents/patients sont invités à consulter un médecin.
· hypersensibilité à tout autre médicament analgésique utilisé en rhumatologie [anti-inflammatoires non stéroïdiens (AINS), y compris acide acétylsalicylique],
· antécédents de crise d'asthme, d'urticaire ou de rhinite aiguë provoquées par l'acide acétylsalicylique ou un autre AINS,
· ulcère peptique évolutif,
· application sur une peau endommagée, quelle que soit la lésion : dermatite exsudative, plaies ouvertes, brûlures, infections cutanées ou eczéma.
· pendant le dernier trimestre de la grossesse (voir rubrique 4.6).
· L’utilisation chez l’enfant et l’adolescent de moins de 16 ans est contre-indiquée.
4.4. Mises en garde spéciales et précautions d'emploi
Ne pas mettre VOLTARENPLAST 1 %, emplâtre médicamenteux en contact ou appliqué sur les yeux ou les muqueuses. Il doit être appliqué sur une peau intacte, saine et ne doit pas être appliqué sur une plaie ou sur une blessure ouverte.
Ne pas utiliser l’emplâtre sous pansement occlusif.
La survenue d'effets indésirables peut être minimisée, par l'utilisation de la dose la plus faible possible pendant la durée de traitement la plus courte possible nécessaire au soulagement des symptômes.
Ne pas administrer de manière concomitante tout médicament contenant du diclofénac ou d’autres AINS, par voie systémique ou topique.
Les bronchospasmes peuvent être provoqués chez les patients présentant ou ayant présenté un asthme ou des allergies.
L'apparition d'une éruption cutanée après application de VOLTARENPLAST 1 %, emplâtre médicamenteux, impose l'arrêt immédiat du traitement.
Afin de réduire tout risque de photosensibilité, les patients doivent être informés d'éviter l'exposition de la zone traitée aux rayonnements solaires (soleil ou cabines UV) pendant environ une journée après le retrait de l'emplâtre.
Bien que la survenue d'effets indésirables d'ordre systémique soit rare, VOLTARENPLAST 1 %, emplâtre médicamenteux doit être utilisé avec précaution chez les patients présentant une altération de la fonction rénale, cardiaque ou hépatique ou chez les patients présentant des antécédents d'ulcère gastro-intestinal, de maladie inflammatoire intestinale ou de saignements digestifs. Les anti-inflammatoires non-stéroïdiens doivent être utilisés avec une précaution particulière chez les patients âgés qui sont davantage sujets aux effets indésirables.
VOLTARENPLAST 1%, emplâtre médicamenteux contient du propylèneglycol et du butylhydroxytoluène. Le propylèneglycol peut provoquer une irritation cutanée et le butylhydroxytoluène des réactions cutanées locales (par exemple dermatite de contact) ou une irritation des yeux et des muqueuses.
L’utilisation du diclofénac peut altérer la fécondité et n’est pas recommandée aux femmes qui souhaitent concevoir un enfant. Chez les femmes pouvant avoir des difficultés à concevoir un enfant ou chez celles qui sont en cours d’investigation pour rechercher une cause d’infertilité, l’arrêt du diclofénac peut être envisagé (voir rubrique 4.6).
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
En raison du faible passage systémique lors d'un usage normal de VOLTARENPLAST 1 %, emplâtre médicamenteux, les interactions médicamenteuses signalées pour le diclofénac per os sont peu probables.
4.6. Fertilité, grossesse et allaitement
Fécondité
L’utilisation du diclofénac peut altérer la fécondité et n’est pas recommandée aux femmes qui souhaitent concevoir un enfant. Chez les femmes pouvant avoir des difficultés à concevoir un enfant ou chez celles qui sont en cours d’investigation pour rechercher une cause d’infertilité, l’arrêt du diclofénac devrait être envisagé.
Grossesse
Il n'existe pas suffisamment de données cliniques pour l'utilisation du diclofénac par voie cutanée pendant la grossesse. Les études chez l'animal ont montré une toxicité sur la reproduction après administration par voie générale (voir rubrique 5.3).
La concentration systémique de diclofénac est plus faible après une application topique qu’après une administration orale. Avec l’expérience des traitements par AINS à absorption systémique, les recommandations sont les suivantes :
L’inhibition de la synthèse des prostaglandines peut affecter le déroulement de la grossesse et/ou le développement de l’embryon ou du fœtus. Les données des études épidémiologiques suggèrent une augmentation du risque de fausse-couche, de malformations cardiaques et de gastroschisis, après traitement par un inhibiteur de la synthèse des prostaglandines en début de grossesse. Le risque absolu de malformation cardiovasculaire est passé de moins de 1%, à approximativement 1,5%. Le risque semble augmenter en fonction de la dose et de la durée de traitement. Chez l’animal, il a été montré que l’administration d’un inhibiteur de la synthèse des prostaglandines provoquait une perte pré et post-implantatoire accrue et une augmentation de la létalité embryo-fœtale. De plus, une incidence supérieure de certaines malformations, y compris cardiovasculaires, a été rapportée chez des animaux ayant reçu un inhibiteur de la synthèse des prostaglandines au cours de la phase d’organogénèse de la gestation. Sauf nécessité absolue, le diclofénac ne doit donc pas être prescrit au cours des premier et deuxième trimestres. Si le diclofénac est administré chez une femme souhaitant être enceinte ou enceinte de moins de six mois, la dose devra être la plus faible possible et la durée du traitement la plus courte possible.
La dose maximale utilisable est de deux emplâtres par jour (voir rubrique 4.2.).
Pendant le troisième trimestre de la grossesse, l'utilisation des inhibiteurs de la synthèse des prostaglandines exposent le fœtus aux risques suivants :
· toxicité cardio-pulmonaire (hypertension pulmonaire avec fermeture prématurée du canal artériel);
· perturbation de la fonction rénale pouvant aller jusqu'à l'insuffisance rénale avec oligoamnios ;
· En fin de grossesse, les risques pour la mère et le nouveau-né sont les suivants :
· risque d'allongement du temps de saignement, effet antiagrégant plaquettaire pouvant survenir même à très faible dose;
· inhibition des contractions utérines, aboutissant à un retard ou à un allongement du travail obstétrical.
L'usage du diclofénac est donc contre-indiqué pendant le troisième trimestre de la grossesse.
Allaitement
Le diclofénac et ses métabolites sont excrétés en faibles quantités dans le lait maternel. Cependant, à des doses thérapeutiques de VOLTARENPLAST 1%, emplâtre médicamenteux, aucun effet sur le nourrisson n’est attendu. En raison d’un manque d’études contrôlées chez les femmes allaitantes, le produit ne doit être utilisé pendant l’allaitement qu’après conseil du professionnel de santé. Dans ces circonstances, VOLTARENPLAST 1%, emplâtre médicamenteux ne doit pas être appliqué sur les seins des mères allaitantes, ni ailleurs sur des zones étendues de la peau ou pour une période prolongée (voir rubrique 4.4.).
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
|
Très fréquents (≥1/10), |
|
Fréquents (≥1/100 à < 1/10), |
|
Peu fréquents (≥ 1/1 000 à < 1/100), |
|
Rares (≥1/10 000 à <1/1 000), |
|
Très rares (<1/10 000), |
|
Fréquence indéterminée (ne peut être estimée sur la base des données disponibles). |
Infection et infestations
Très rare : éruption pustuleuse.
Troubles du système immunitaire
Peu fréquent : érythèmes généralisés, réaction d’hypersensibilité (incluant l’urticaire), œdème de Quincke, réaction de type anaphylactique.
Troubles du système respiratoire, thoracique et médiastinal
Très rare : crise d’asthme.
Troubles du système cutané ou sous-cutané
Fréquents : réactions cutanées locales telles que rougeur de la peau, eczéma, érythème, dermatite (incluant dermatite de contact et allergique), gonflement de la peau, prurit et sensations de brûlure.
Rare : dermatite bulleuse, sécheresse cutanée.
Très rare : eczéma grave, éruption avec des ulcérations, réactions de photosensibilité (les patients doivent être mis en garde contre une exposition excessive aux rayons du soleil afin de réduire l’incidence de la photosensibilité).
Fréquence indéterminée : hématome sur le site d’application.
Troubles généraux et anomalies au site d’administration
Fréquent : réactions au site d’application.
L'absorption systémique du diclofénac après application topique est très faible et les niveaux plasmatiques de diclofénac sont également très faibles comparés aux taux plasmatiques de principe actif observés après l'utilisation de formes orales. La probabilité de survenue d'effets indésirables d'ordre systémique (tels que troubles gastro-intestinaux ou rénaux, bronchospasme) est très faible comparée à la fréquence de tels effets associés au diclofénac par voie orale. Cependant, lorsque le diclofénac est appliqué sur surface de peau étendue et pendant une période prolongée, la possibilité de survenue d'effets indésirables d'ordre systémique ne peut être exclue.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr.
Aucun cas de surdosage n'a été signalé.
S'il survient des effets indésirables d'ordre systémique graves après une utilisation incorrecte ou lors d'un surdosage accidentel (par exemple chez l'enfant), se référer aux mesures habituelles en cas d'intoxication par des anti-inflammatoires non-stéroïdiens.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Le diclofénac est un anti-inflammatoire non stéroïdien aux propriétés analgésiques, qui inhibe efficacement la synthèse des prostaglandines sur des modèles standard d'inflammation chez l'animal. Chez l'Homme, le diclofénac diminue la douleur, l'œdème et la fièvre associée à une inflammation. Par ailleurs, le diclofénac provoque une inhibition réversible de l'agrégation plaquettaire induite par l'ADP et le collagène.
5.2. Propriétés pharmacocinétiques
L'efficacité thérapeutique observée est essentiellement imputable aux concentrations tissulaires thérapeutiques du principe actif au niveau du site d'application. La pénétration jusqu'au site d'action dépend de l'étendue et de la nature de la lésion ainsi que des sites d'application et d'action.
Au niveau du pic plasmatique, les concentrations moyennes sont d'environ 3 ng/ml. Le taux de liaison du diclofénac aux protéines plasmatiques est élevé (99%). Le métabolisme et l'élimination sont comparables après application cutanée et administration orale. Après un métabolisme hépatique rapide (hydroxylation et liaison à l'acide glucuronique), les deux tiers du principe actif sont éliminés par voie rénale et un tiers par voie biliaire.
5.3. Données de sécurité préclinique
Dans les études menées chez l'animal à propos de la toxicité sur la reproduction, l'administration systémique de diclofénac a inhibé l'ovulation chez la lapine et perturbé l'implantation et le développement embryonnaire initial chez la rate. Le diclofénac a allongé la durée de la gestation et de la mise-bas. Le potentiel embryotoxique du diclofénac a été étudié dans trois espèces animales (rat, souris, lapin). Des morts fœtales et un retard de croissance ont été observés aux doses toxiques pour la mère. En l'état actuel des connaissances, le diclofénac est considéré comme non tératogène. Les doses inférieures aux doses toxiques pour la mère n'avaient pas d'influence sur le développement des petits.
Les études classiques de tolérance locale ne montrent aucun risque particulier pour l'Homme.
Support de polyester non tissé.
Film protecteur en polypropylène.
30 mois.
Après première ouverture d'un sachet : 4 mois
6.4. Précautions particulières de conservation
A conserver à une température ne dépassant pas 25ºC.
A conserver dans l'emballage extérieur d'origine, à l'abri du dessèchement et de la lumière.
Conserver le sachet soigneusement fermé pour éviter le dessèchement.
6.5. Nature et contenu de l'emballage extérieur
Sachets scellés et refermables constitués de papier/polyéthylène/aluminium/copolymère d'éthylène et d'acide méthacrylique, contenant 2 ou 5 emplâtres.
Boîtes de 2, 5, 10 ou 14 emplâtres.
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
Après l'utilisation, plier l'emplâtre en deux, avec la face adhésive vers l'intérieur.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
23 RUE FRANCOIS JACOB
92500 RUEIL-MALMAISON
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 394 223 4 3 : 5 emplâtres médicamenteux en sachet (papier/PEBD/ Aluminium/Copolymère d'éthylène et acide méthacrylique).
· 34009 394 224 0 4 : 10 emplâtres médicamenteux en sachet (papier/PEBD/ Aluminium/Copolymère d'éthylène et acide méthacrylique).
· 34009 394 225 7 2 : 14 emplâtres médicamenteux en sachet (papier/PEBD/ Aluminium/Copolymère d'éthylène et acide méthacrylique).
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Médicament non soumis à prescription médicale.
ANSM - Mis à jour le : 11/10/2024
VOLTARENPLAST 1%, emplâtre médicamenteux
diclofénac sodique
Vous devez toujours utiliser ce médicament en suivant scrupuleusement les informations fournies dans cette notice ou par votre médecin, ou votre pharmacien.
· Gardez cette notice, vous pourriez avoir besoin de la relire.
· Adressez-vous à votre pharmacien pour tout conseil ou information.
· Si vous ressentez l’un des effets indésirables, parlez-en à votre médecin, ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
· Vous devez vous adresser à votre médecin si vous ne ressentez aucune amélioration ou si vous vous sentez moins bien après 3 jours.
1. Qu'est-ce que VOLTARENPLAST 1%, emplâtre médicamenteux et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d'utiliser VOLTARENPLAST 1%, emplâtre médicamenteux ?
3. Comment utiliser VOLTARENPLAST 1%, emplâtre médicamenteux ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver VOLTARENPLAST 1%, emplâtre médicamenteux ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE VOLTARENPLAST 1%, emplâtre médicamenteux ET DANS QUELS CAS EST-IL UTILISE ?
VOLTARENPLAST 1%, emplâtre médicamenteux est utilisé dans le traitement local de courte durée en cas de traumatismes bénins douloureux : foulures, entorses ou contusions.
Pour application cutanée uniquement.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER VOLTARENPLAST 1%, emplâtre médicamenteux ?
N’utilisez jamais VOLTARENPLAST 1%, emplâtre médicamenteux :
· si vous êtes allergique au diclofénac, au propylèneglycol, au butylhydroxytoluène ou à l'un des autres composants contenus dans ce médicament (voir rubrique 6),
· si vous êtes allergique à d'autres médicaments anti-inflammatoires non stéroïdiens (AINS), comme l'acide acétylsalicylique ou l'ibuprofène,
· en cas d'antécédents d'asthme, de réaction cutanée ou de renflements à l'intérieur du nez provoquant une irritation faisant suite à la prise d'acide acétylsalicylique ou d'autres AINS,
· si vous êtes atteint d'un ulcère digestif en évolution,
· sur des plaies cutanées quelle que soit la plaie (par exemple écorchures, coupures, brûlures), dermatite exsudative, des lésions cutanées infectées ou des lésions d'eczéma,
· pendant les trois derniers mois de la grossesse,
· chez l’enfant et l’adolescent de moins de 16 ans.
Avertissements et précautions
Adressez-vous à votre médecin ou pharmacien avant d’utiliser VOLTARENPLAST 1%, emplâtre médicamenteux
· Si vous êtes atteint ou avez été atteint d'asthme ou d'allergies, l'utilisation de ce médicament risque d'entraîner un spasme des muscles bronchiques (bronchospasme), pouvant causer des difficultés pour respirer.
· L'apparition d'une éruption cutanée après application impose l'arrêt immédiat du traitement.
· en cas de maladie rénale, cardiaque ou hépatique, en cas d'antécédents ou d'atteinte d'ulcère gastro-intestinal, en cas de maladie intestinale inflammatoire ou de saignement digestif.
La survenue d'effets indésirables peut être minimisée, par l'utilisation de la dose la plus faible possible pendant la durée de traitement la plus courte possible nécessaire au soulagement des symptômes.
PRECAUTIONS IMPORTANTES :
· En cas de persistance des symptômes au delà de 3 jours, un médecin doit être consulté.
· Ne jamais appliquer l'emplâtre sur les yeux ni les muqueuses et éviter tout contact avec les yeux et les muqueuses.
· VOLTARENPLAST 1 %, emplâtre médicamenteux doit être appliqué sur une peau intacte, saine et ne doit pas être appliqué sur une plaie ou sur une blessure ouverte.
· Ne pas utiliser l’emplâtre sous pansement occlusif.
· VOLTARENPLAST 1%, emplâtre médicamenteux doit être utilisé avec précaution chez les patients âgés, qui sont davantage sujets aux effets indésirables.
Après le retrait de l'emplâtre, évitez l'exposition de la zone traitée aux rayonnements solaires (soleil ou cabines UV) pendant environ une journée, afin de réduire tout risque de photosensibilité.
Ne pas utiliser de manière simultanée, tout médicament contenant du diclofénac ou d’autres AINS, par voie orale ou locale.
Autres médicaments et VOLTARENPLAST 1%, emplâtre médicamenteux
Informez votre médecin ou pharmacien si vous utilisez, avez récemment utilisé ou pourriez utiliser tout autre médicament.
Dans des conditions normales d'utilisation de VOLTARENPLAST 1%, emplâtre médicamenteux, la quantité de diclofénac passant dans le sang est très faible, si bien que les interactions décrites pour le diclofénac par voie orale sont peu probables.
Grossesse, allaitement et fertilité
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin ou pharmacien avant de prendre ce médicament.
Grossesse
Bien qu’étant rares, des anomalies ont été rapportées chez les nourrissons dont la mère avait pris des AINS durant la grossesse. Pendant les 6 premiers mois de la grossesse, VOLTARENPLAST 1%, emplâtre médicamenteux ne peut être utilisé que sur les conseils de votre médecin.
Pendant les trois derniers mois de la grossesse, il ne faut en aucun cas utiliser VOLTARENPLAST 1%, emplâtre médicamenteux en raison du risque d'augmentation des conséquences graves pour la mère et l'enfant (voir le paragraphe « N'utilisez jamais VOLTARENPLAST 1%, emplâtre médicamenteux »).
Fertilité
L’utilisation de VOLTARENPLAST 1 %, emplâtre médicamenteux n’est pas recommandée aux femmes souhaitant concevoir un enfant, ayant des difficultés à concevoir un enfant ou en cours d’investigation pour rechercher une cause d’infertilité.
Allaitement
Demandez conseil à votre médecin ou à votre pharmacien avant de prendre tout médicament.
Le diclofénac passe en très faibles quantités dans le lait maternel. Aucune observation d'effets indésirables n'ayant été faite sur le nourrisson, il n'est généralement pas nécessaire de suspendre l'allaitement pendant une utilisation de courte durée. VOLTARENPLAST 1%, emplâtre médicamenteux ne doit toutefois jamais être appliqué directement sur les seins.
Sportifs
Sans objet.
Conduite de véhicules et utilisation de machines
Aucun effet de VOLTARENPLAST 1%, emplâtre médicamenteux sur l'aptitude à conduire des véhicules et utiliser des machines n'est attendu ou seul un effet négligeable.
VOLTARENPLAST 1%, emplâtre médicamenteux contient du propylèneglycol et du butylhydroxytoluène.
Ce médicament contient 1400 mg de propylèneglycol par emplâtre médicamenteux. Le propylèneglycol (E1520) peut induire des irritations de la peau.
Le butylhydroxytoluène (E321) peut provoquer des réactions cutanées locales (par exemple : eczéma) ou une irritation des yeux et des muqueuses.
3. COMMENT UTILISER VOLTARENPLAST 1%, emplâtre médicamenteux ?
Veillez à toujours utiliser ce médicament en suivant exactement les indications de votre médecin ou pharmacien. Vérifiez auprès de votre médecin ou pharmacien en cas de doute.
La dose recommandée est :
Adultes
Appliquez un emplâtre antalgique sur la région douloureuse deux fois par jour (matin et soir). La dose maximale totale pouvant être utilisée est de deux emplâtres par jour, même s'il y a plus d'un traumatisme à traiter. Ne pas traiter plus d'une région douloureuse à la fois.
Enfants et adolescents de moins de 16 ans
Du fait de l'absence d'étude spécifique, VOLTARENPLAST 1%, emplâtre médicamenteux ne doit pas être utilisé chez l'enfant et l'adolescent de moins de 16 ans.
Personnes âgées
Ce médicament doit être utilisé avec prudence chez les patients âgés qui sont plus sujets aux effets indésirables.
Patients souffrant d’insuffisance rénale ou hépatique
Ce médicament doit être utilisé avec prudence chez les patients atteints d’insuffisance hépatique ou rénale.
Mode d'administration
A utiliser exclusivement en application sur une peau intacte et saine. Pour une application sur la peau uniquement. Ne pas appliquer lors du bain ou de la douche. Ne pas ingérer !
1. Ouvrez le sachet contenant l'emplâtre, en découpant suivant le pointillé.
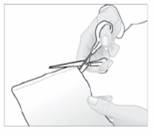
2. Extrayez un emplâtre et refermez soigneusement le sachet en appuyant sur la fermeture.

3. Retirez le film protecteur de la surface adhésive de l'emplâtre.
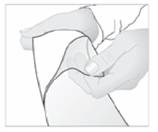
4. Ensuite, appliquez l'emplâtre sur la région douloureuse.
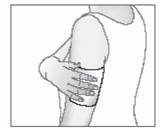
Au besoin, maintenez l'emplâtre antalgique en utilisant un filet élastique.
Ne recouvrez jamais l'emplâtre avec un pansement hermétique (occlusif).
Ne découpez jamais l'emplâtre.
Après utilisation de l'emplâtre, pliez-le en deux avec la face adhésive vers l'intérieur.
Durée du traitement
Sur la base de données limitées disponibles, un traitement d’une courte durée est recommandé.
N'utilisez jamais VOLTARENPLAST 1%, emplâtre médicamenteux pendant plus de trois jours sans consulter votre médecin. Il n’y a pas de bénéfice thérapeutique si vous utilisez VOLTARENPLAST pendant plus de 7 jours.
Chez les adolescents âgés de plus de 16 ans et les adultes, si une utilisation de plus de 7 jours est nécessaire pour soulager la douleur ou si les symptômes s’aggravent, les parents des adolescents / les patients sont invités à consulter un médecin.
Si vous avez utilisé plus de VOLTARENPLAST 1%, emplâtre médicamenteux que vous n’auriez dû :
Consultez votre médecin s'il apparaît de nets effets indésirables après une utilisation incorrecte de VOLTARENPLAST ou après un surdosage accidentel (par exemple chez l'enfant). Il vous indiquera les mesures à prendre, en fonction de la gravité de l'intoxication.
Si vous oubliez d’utiliser VOLTARENPLAST 1%, emplâtre médicamenteux :
Ne prenez pas de dose double pour compenser la dose que vous avez oublié de prendre.
Si vous avez d'autres questions sur l'utilisation de ce médicament, demandez plus d'informations à votre médecin ou à votre pharmacien.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Consultez immédiatement votre médecin et arrêtez d'utiliser l'emplâtre si vous constatez l'un des phénomènes suivants : Eruption cutanée brutale avec démangeaisons (urticaire), gonflement des mains, des pieds, des chevilles, du visage, des lèvres, de la bouche ou de la gorge ; difficultés pour respirer ; diminution de la pression artérielle ou fatigue.
Les effets indésirables possibles sont les suivants :
Fréquents (peut toucher jusqu’à un patient traité sur 10) : réactions cutanées au site d’application, rougeur de la peau, eczéma, rougeur inflammatoire de la peau (incluant dermatite de contact et allergique), gonflement de la peau, démangeaisons et sensations de brûlure,
Peu fréquents (peut toucher jusqu’à un patient traité sur 100) : rougeur de la peau généralisée, réactions d'hypersensibilité (incluant l’urticaire), gonflement de la peau et des muqueuses et réactions allergiques généralisées.
Rare (peut toucher jusqu’à un patient traité sur 1000) : Cloques, sécheresse de la peau.
Très rare (peut toucher jusqu’à un patient traité sur 10 000) : Crise d’asthme, eczéma grave, lésion de la peau avec des pustules, lésion de la peau avec des ulcérations et sensibilité à la lumière de la peau.
Fréquence inconnue (fréquence impossible à évaluer avec les données disponibles) : hématome sur le site d’application.
Après application cutanée, l'absorption du diclofénac dans le sang et le niveau de diclofénac dans le sang sont également extrêmement faibles, comparativement aux niveaux dans le sang qui sont atteintes après la prise orale de diclofénac. Le risque d'effets indésirables touchant l'ensemble du corps (par exemple troubles gastro-intestinaux, hépatiques ou rénaux ou difficultés pour respirer) est donc très faible après une application cutanée comparativement à la fréquence des effets indésirables associés à une prise orale de diclofénac. Si le diclofénac est utilisé sur une surface étendue de la peau ou pour une durée prolongée, des effets indésirables systémiques pourraient se produire.
Si vous remarquez des effets indésirables non mentionnés dans cette notice, ou si certains effets indésirables deviennent graves, veuillez en informer votre médecin ou votre pharmacien
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr.
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER VOLTARENPLAST 1%, emplâtre médicamenteux ?
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur la boîte et le sachet après EXP. La date d'expiration fait référence au dernier jour de ce mois.
Conserver à une température ne dépassant pas 25ºC.
Conserver dans l'emballage extérieur d'origine, à l'abri du dessèchement et de la lumière.
Conserver le sachet hermétiquement fermé pour éviter le dessèchement.
Le médicament se conserve 4 mois après l'ouverture d'un sachet.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient VOLTARENPLAST 1%, emplâtre médicamenteux
· La substance active est :
Diclofénac sodique ............................................................................................................ 140 mg
Pour un emplâtre médicamenteux.
· Les autres composants sont :
Glycérol, propylèneglycol (E1520), adipate de di-isopropyle, sorbitol liquide cristallisable (E420), carmellose sodique, polyacrylate de sodium, copolymère basique de méthacrylate de butyle, édétate disodique, sulfite de sodium (E221), butylhydroxytoluène (E321), sulfate d'aluminium et de potassium, silice colloïdale anhydre, kaolin léger (naturel), éther laurique de macrogol, lévomenthol, acide tartrique, eau purifiée.
Qu’est-ce que VOLTARENPLAST 1%, emplâtre médicamenteux et contenu de l’emballage extérieur
VOLTARENPLAST est un emplâtre mesurant 10 cm sur 14 cm, avec une couche uniforme de pâte blanche à brun clair étalée sur un support non tissé et un film protecteur détachable.
Boîtes de 2, 5, 10 ou 14 emplâtres, dans des sachets refermables contenant 2 ou 5 emplâtres.
Toutes les présentations peuvent ne pas être commercialisées.
Titulaire de l’autorisation de mise sur le marché
23 RUE FRANCOIS JACOB
92500 RUEIL-MALMAISON
Exploitant de l’autorisation de mise sur le marché
Haleon France
23 RUE FRANCOIS JACOB
92500 RUEIL-MALMAISON
LUDWIG-MERCKLE-STRASSE 3
89143 BLAUBEUREN
ALLEMAGNE
OU
TEVA OPERATIONS POLAND SP Z.O.O.
UL. MOGIMSKA 80
31-546 KRAKOW
POLOGNE
OU
SOFARIMEX-INDUSTRIA QUIMICA E FARMACEUTICA SA
AV. DAS INDUSTRIAS
ALTO DE COLARIDE/ALGUALVA
2735-213 CACEM
PORTUGAL
OU
HALEON France
23 RUE FRANCOIS JACOB
92500 RUEIL-MALMAISON
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Ce médicament est autorisé dans les Etats membres de l'Espace Economique Européen sous les noms suivants : Conformément à la réglementation en vigueur.
[À compléter ultérieurement par le titulaire]
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
< {MM/AAAA}>< {mois AAAA}.>
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).