Dernière mise à jour le 08/01/2026
DIAMOX 500 mg, poudre et solvant pour préparation injectable
Indications thérapeutiques
Classe pharmacothérapeutique : INHIBITEURS DE L'ANHYDRASE CARBONIQUE
Code ATC : S01EC01
Ce médicament permet de :
· diminuer rapidement la pression au niveau de l’œil,
· diminuer le taux de gaz carbonique dans le sang chez les patients ayant une maladie grave des poumons (insuffisance respiratoire).
DIAMOX 500 mg, poudre et solvant pour préparation injectable est utilisé pour :
· traiter rapidement une pression élevée au niveau de l’œil (glaucomes),
· traiter certains troubles de l’organisme (alcaloses), en particulier au cours de certains troubles respiratoires (décompensations respiratoires aiguës nécessitant le recours à la ventilation mécanique) chez les patients ayant une maladie des poumons (insuffisance respiratoire chronique).
Présentations
> 1 flacon(s) en verre de 500 mg - 1 ampoule(s) en verre de 5 ml
Code CIP : 303 053-3 ou 34009 303 053 3 1
Déclaration de commercialisation : 19/06/1960
Cette présentation est agréée aux collectivités
- Prix hors honoraire de dispensation : 13,06 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 14,08 €
- Taux de remboursement :65%
> 25 flacon(s) en verre de 500 mg
Code CIP : 553 373-5 ou 34009 553 373 5 5
Déclaration de commercialisation : 19/06/1960
Cette présentation est agréée aux collectivités
Service médical rendu (SMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Important | Avis du 20/07/2016 | Renouvellement d'inscription (CT) | Le service médical rendu par DIAMOX reste important dans les indications de l’AMM. |
Amélioration du service médical rendu (ASMR)
Pas d'ASMR disponible pour ce médicament (plus d'informations dans l'aide )
ANSM - Mis à jour le : 15/10/2024
DIAMOX 500 mg, poudre et solvant pour préparation injectable
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Acétazolamide...................................................................................................................... 500 mg
Pour un flacon de poudre.
Excipient à effet notoire : hydroxyde de sodium.
Pour la liste complète des excipients, voir rubrique 6.1.
Poudre et solvant pour préparation injectable.
4.1. Indications thérapeutiques
· Traitement d'attaque des hypertonies oculaires élevées.
· Traitement de certaines alcaloses métaboliques, en particulier au cours des décompensations des insuffisances respiratoires chroniques, nécessitant le recours à la ventilation mécanique.
4.2. Posologie et mode d'administration
· Adulte : la posologie usuelle est de 1 à 2 g par jour, soit 2 à 4 flacons de 500 mg/jour.
· Enfant de plus de 6 ans : 5 à 10 mg/kg/jour.
Mode d’administration
· Injection intraveineuse lente ou dans la tubulure de la perfusion.
· La voie intramusculaire peut être éventuellement utilisée.
RESERVE A L'ADULTE ET A L'ENFANT DE PLUS DE 6 ANS.
Ce médicament est contre-indiqué dans les situations suivantes :
· Hypersensibilité à la substance active ou à l’un des excipients mentionnés à la rubrique 6.1,
· Insuffisances hépatique, rénale ou surrénale sévères,
· Intolérance aux sulfamides,
· Antécédents de colique néphrétique.
L'acétazolamide est contre-indiqué au 1er trimestre de la grossesse (voir rubriques 4.4 et 4.6)
4.4. Mises en garde spéciales et précautions d'emploi
Mises en garde spéciales
Des cas de glaucome bilatéral aigu par fermeture d’angle et/ou de myopie ont été rapportés chez les patients traités par acétazolamide.
Le mécanisme supposé du glaucome aigu par fermeture d’angle et/ou de la myopie est un œdème cilio-choroïdien dû à une réaction allergique ou idiosyncrasique à la composante sulfonamide, également décrite avec d’autres dérivés des sulfamides.
Le traitement par DIAMOX doit être arrêté et il convient de demander conseil à un médecin.
Des cas d’épanchement / de décollement choroïdien ont été signalés après l’utilisation d’acétazolamide. Les symptômes incluent l’apparition soudaine d’une diminution de l’acuité visuelle ou d’une douleur oculaire et peuvent survenir dans les heures suivant le début du traitement par l’acétazolamide. Si un épanchement/décollement choroïdien est suspecté, le traitement par l’acétazolamide doit être arrêté le plus rapidement possible.
Chez les patients recevant un inhibiteur de l’anhydrase carbonique par voie oculaire et DIAMOX, il y a une possibilité d’addition des effets systémiques inhérents à l’inhibition de l’anhydrase carbonique.
L’administration simultanée de DIAMOX et d’inhibiteurs de l’anhydrase carbonique par voie oculaire n’a pas été étudiée et n’est pas recommandée.
Des cas d’insuffisance rénale aiguë ont été observés (voir rubrique 4.8). Une évolution favorable a été observée après l’arrêt de DIAMOX et après un traitement correcteur approprié si nécessaire.
Chez les patients souffrant d’insuffisance chronique, la fonction rénale doit être surveillée.
Des cas de décès suite à des réactions sévères aux sulfonamides et à leurs dérivés, dont l’acétazolamide, ont été rapportés. Ces réactions incluaient le syndrome de Stevens-Johnson et de nécrolyse épidermique toxique (la maladie de Lyell), une nécrose hépatique fulminante, une agranulocytose, une anémie aplasique et d’autres dyscrasies sanguines et une anaphylaxie.
L’apparition d’un érythème généralisé associé à une fièvre et à la formation de pustules au début du traitement peut être un symptôme d’une pustulose exanthématique aigüe généralisée (PEAG) (voir la rubrique 4.8). En cas de diagnostic de PEAG, le traitement par acétazolamide doit être interrompu et toute administration ultérieure d’acétazolamide est contre-indiquée.
Œdème pulmonaire non cardiogénique :
Des cas graves d’œdème pulmonaire non cardiogénique ont été signalés après la prise d’acétazolamide, y compris en dose unique (voir section 4.8). L’œdème pulmonaire non cardiogénique est survenu dans les minutes ou les heures ayant suivi la prise d’acétazolamide. Parmi les symptômes observés figuraient la dyspnée, l’hypoxie et l’insuffisance respiratoire. En cas de suspicion d’œdème pulmonaire non cardiogénique, la prise d’acétazolamide doit être interrompue et un traitement de soutien doit être administré. L’acétazolamide ne doit pas être administré aux patients ayant déjà présenté un œdème pulmonaire non cardiogénique dû à la prise d’acétazolamide.
Cette spécialité contient un principe actif (acétazolamide) pouvant induire une réaction positive des tests pratiqués lors de contrôles antidopage, chez les sportifs.
Précautions particulières d'emploi
Il est recommandé d’effectuer un contrôle complet de la formule sanguine et des électrolytes sanguins avant de débuter la thérapie par DIAMOX, et de répéter régulièrement ces tests pendant le traitement. Si une différence significative est observée dans la formule sanguine, il faut interrompre le traitement par DIAMOX, et instaurer un traitement adéquat.
Le traitement par acétazolamide peut causer un déséquilibre électrolytique, incluant une hyponatrémie, une hypokaliémie, et une acidose métabolique. Il est dès lors recommandé de contrôler régulièrement les taux sériques d’électrolytes. La prudence est surtout de rigueur chez les patients avec des affections associées à/prédisposant à des déséquilibres électrolytiques ou acido-basiques, par exemple chez les patients ayant des troubles de la fonction rénale (incluant les patients âgés), des maladies pulmonaires obstructives, l’emphysème, le diabète ou une mauvaise ventilation alvéolaire. Une acidose métabolique sévère a été rapportée chez les patients ayant une fonction rénale normale pendant le traitement par acétazolamide et des salicylés.
Une augmentation et une diminution des taux sanguins de glucose ont été décrites chez les patients traités par acétazolamide. Il faut en tenir compte chez les patients ayant une perturbation de la tolérance au glucose ou un diabète.
Ce médicament contient du sodium. Ce médicament contient 3,73 mmol (ou 85,64 mg) de sodium par flacon de poudre. A prendre en compte chez les patients suivant un régime hyposodé strict.
Femmes enceintes
L’acétazolamide est contre-indiqué au 1er trimestre de la grossesse et ne doit pas être utilisé au cours des 2ème et 3ème trimestres, sauf en cas d’absolue nécessité (voir rubriques 4.3 et 4.6).
Femmes en âge de procréer
En raison des effets observés chez les fœtus/nouveau-nés en cas d’exposition au cours de la grossesse, les femmes en âge de procréer doivent être informées du risque et utiliser une contraception efficace pendant le traitement (voir rubrique 4.6).
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
+ Acide acétylsalicylique
Majoration des effets indésirables, et notamment de l’acidose métabolique, de l’acide acétylsalicylique à des doses élevées et de l’acétazolamide, par diminution de l’élimination de l’acide acétylsalicylique par l’acétazolamide.
Associations faisant l'objet de précautions d’emploi
+ Carbamazépine
Augmentation des concentrations plasmatiques de carbamazépine avec signes de surdosage.
Surveillance clinique et, si besoin, contrôle des concentrations plasmatiques de carbamazépine et réduction éventuelle de sa posologie.
+ Hydroquinidine, quinidine
Augmentation des concentrations plasmatiques de l’hydroquinidine ou de la quinidine et risque de surdosage (diminution de l'excrétion de l’hydroquinidine ou de la quinidine par alcalinisation des urines).
Surveillance clinique, ECG et éventuellement contrôle de la concentration plasmatique de l’hydroquinidine ou de la quinidine ; si besoin, adaptation de la posologie pendant le traitement alcalinisant et après son arrêt.
+ Lithium
Diminution de la lithémie avec risque de baisse de l’efficacité thérapeutique.
Surveillance stricte de la lithémie et adaptation éventuelle de la posologie du lithium.
+ Valproïque (acide) et, par extrapolation, valpromide
Augmentation de l’hyperammoniémie (voir rubrique 4.8), avec risque accru d’encéphalopathie. Surveillance clinique et biologique régulière.
4.6. Fertilité, grossesse et allaitement
Femmes en âge de procréer
Les femmes en âge de procréer doivent utiliser une contraception efficace pendant le traitement.
Grossesse
Les études effectuées chez l'animal ont mis en évidence un effet tératogène (voir rubrique 5.3). En clinique, des cas de malformations concordantes avec celles observées chez l’animal (membres, œil) ainsi que des malformations cranio-maxillo-faciales et cardiaques ont été rapportés après exposition au cours du premier trimestre de grossesse. Des anomalies hydro-électrolytiques (acidose métabolique, hypocalcémie et hypomagnésémie, déshydratation, hypophosphatémie), des anomalies du volume de liquide amniotique (hydroamnios ou oligoamnios voire anamnios) et des retards de croissance ont été rapportés chez le nouveau-né exposé pendant la grossesse.
Compte tenu de ces données, l'acétazolamide :
· est contre-indiqué au 1er trimestre de la grossesse (existence d’alternatives plus sûres) ;
· ne doit pas être utilisé au cours des 2ème et 3ème trimestres, sauf en cas de nécessité absolue.
Les femmes en âge de procréer doivent être informées du risque et utiliser une contraception efficace pendant le traitement.
En cas d’exposition au cours de la grossesse, il conviendra de réaliser un suivi prénatal spécialisé orienté sur les malformations décrites ci-dessus ainsi qu’une surveillance du volume du liquide amniotique. En cas d’exposition en fin de grossesse, il conviendra de réaliser un bilan hydro-électrolytique chez le nouveau-né.
Allaitement
Compte tenu du passage de l’acétazolamide dans le lait, l’allaitement est déconseillé.
Fertilité
Il n’y a pas de données disponibles chez l’animal ou chez l’Homme pour évaluer le risque sur la fertilité associé à une exposition à l’acétazolamide.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Troubles du métabolisme et de la nutrition
Fréquence indéterminée :
Perturbation du métabolisme glucidique, diabète.
Hyperuricémie avec crise de goutte aiguë.
Hypokaliémie avec acidose métabolique.
Troubles du métabolisme calcique.
Perturbation du métabolisme de l'ammoniaque chez le cirrhotique (voir rubrique 4.3).
Hyperammoniémie chez les patients épileptiques (voir rubrique 4.5).
Affections endocriniennes
Rare : dysthyroïdies.
Affections du rein et des voies urinaires
Fréquence indéterminée : lithiase rénale, insuffisance rénale aiguë ou aggravation d’une insuffisance rénale chronique sous-jacente (voir rubrique 4.4).
Affections hépatobiliaires
Fréquence indéterminée : coma hépatique chez le cirrhotique (voir rubrique 4.3).
Troubles généraux et anomalies au site d’administration
Rare : asthénie.
Affections du système nerveux
Très fréquent : céphalées.
Fréquence indéterminée : dysgueusie.
Rare : somnolence, dysesthésies pouvant être corrigées par adjonction d'un sel de potassium.
Affections gastro-intestinales
Rare : troubles gastro-intestinaux.
Affections du système immunitaire
Fréquence indéterminée : réactions d'hypersensibilité essentiellement à type de rashs cutanés et de fièvre et quelques cas d’érythrodermie, cas isolés de chocs anaphylactiques pouvant être fatals.
Affections hématologiques et du système lymphatique
Fréquence indéterminée : anémie aplasique, leucopénie, thrombocytopénie, pancytopénie.
Rare : purpura thrombopénique, agranulocytose, aplasie médullaire, probablement par sensibilisation aux sulfamides.
Affections psychiatriques
Fréquence indéterminée : confusion pouvant être associée à des hallucinations.
Affections oculaires
Fréquence indéterminée : glaucome bilatéral aigu par fermeture d’angle et/ou myopie, épanchement choroïdien, décollement choroïdien (voir rubrique 4.4).
Affections de la peau et du tissu sous-cutané
Fréquence indéterminée : rash, prurit, dermite exfoliative généralisée, pustulose exanthématique aiguë généralisée (PEAG).
Affections respiratoires, thoraciques et médiastinales
Fréquence indéterminée : œdème pulmonaire non-cardiogénique, pouvant être dû à une réaction d’hypersensibilité (voir rubriques 4.3 et 4.4).
Troubles généraux et anomalies au site d’administration
Fréquence indéterminée : douleur lors de l'injection intramusculaire.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr
Symptômes
Un déséquilibre électrolytique, une acidose et des effets sur le système nerveux central peuvent être attendus.
Prise en charge
En cas de surdosage, l'hospitalisation est nécessaire dans un but de surveillance et de contrôle hydro-électrolytique.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : INHIBITEURS DE L'ANHYDRASE CARBONIQUE,
Code ATC : S01EC01.
Inhibiteur spécifique de l'anhydrase carbonique à différents niveaux : tubule rénal, corps ciliaire, plexus choroïde, système nerveux central et muqueuse digestive.
Au niveau du tubule rénal, l'acétazolamide est un diurétique entraînant par substitution ionique : une augmentation de la diurèse aqueuse, une forte élimination des bicarbonates, une excrétion moindre du sodium et du potassium, une alcalinisation des urines. La réponse rénale à une dose de 5 à 10 mg est de 6 à 12 h.
Au niveau de l'œil, l'acétazolamide, en cas d'hypertension oculaire préalable, provoque une chute rapide de la pression par action sur le corps ciliaire et élimination accélérée des bicarbonates et des autres électrolytes qui se trouvent normalement en concentration élevée dans les liquides intra-oculaires. Cette élimination accélérée diminue la pression osmotique des milieux liquidiens de l'œil et, de ce fait, fait baisser la pression intra-oculaire.
Au niveau du système nerveux : effet antisécrétoire sur les plexus choroïdes réduisant la formation du liquide céphalo-rachidien.
Effet sur l'hématose : diminution de l'hypercapnie par acidose métabolique et élimination urinaire des bicarbonates.
5.2. Propriétés pharmacocinétiques
L'absorption digestive de l'acétazolamide est très rapide.
Au niveau du plasma, il est fortement lié aux protéines plasmatiques (90-95 %).
La demi-vie plasmatique est de 5 h et l'excrétion urinaire est totale en 24 h sous forme non métabolisée.
5.3. Données de sécurité préclinique
Solvant : eau pour préparations injectables.
3 ans.
Après ouverture/reconstitution/dilution : le produit doit être utilisé immédiatement.
6.4. Précautions particulières de conservation
Pas de précautions particulières de conservation.
6.5. Nature et contenu de l'emballage extérieur
Poudre en flacon (verre) et 5 ml de solvant en ampoule (verre). Boîte de 1 flacon et ampoule.
Poudre en flacon (verre). Boîte de 25.
6.6. Précautions particulières d’élimination et de manipulation
Pas d’exigences particulières.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
COOPERATION PHARMACEUTIQUE FRANÇAISE
PLACE LUCIEN AUVERT
77020 MELUN CEDEX
[Tel, fax, e-mail : à compléter ultérieurement par le titulaire]
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 303 053 3 1 : poudre en flacon (verre) + 5 ml de solvant en ampoule (verre).
· 34009 553 373 5 5 : poudre en flacon (verre). Boîte de 25.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Liste I
ANSM - Mis à jour le : 15/10/2024
DIAMOX 500 mg, poudre et solvant pour préparation injectable
Acétazolamide
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin ou votre pharmacien.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que DIAMOX 500 mg, poudre et solvant pour préparation injectable et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d'utiliser DIAMOX 500 mg, poudre et solvant pour préparation injectable ?
3. Comment utiliser DIAMOX 500 mg, poudre et solvant pour préparation injectable ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver DIAMOX 500 mg, poudre et solvant pour préparation injectable ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE DIAMOX 500 mg, poudre et solvant pour préparation injectable ET DANS QUELS CAS EST-IL UTILISE ?
Classe pharmacothérapeutique : INHIBITEURS DE L'ANHYDRASE CARBONIQUE
Code ATC : S01EC01
Ce médicament permet de :
· diminuer rapidement la pression au niveau de l’œil,
· diminuer le taux de gaz carbonique dans le sang chez les patients ayant une maladie grave des poumons (insuffisance respiratoire).
DIAMOX 500 mg, poudre et solvant pour préparation injectable est utilisé pour :
· traiter rapidement une pression élevée au niveau de l’œil (glaucomes),
· traiter certains troubles de l’organisme (alcaloses), en particulier au cours de certains troubles respiratoires (décompensations respiratoires aiguës nécessitant le recours à la ventilation mécanique) chez les patients ayant une maladie des poumons (insuffisance respiratoire chronique).
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER DIAMOX 500 mg, poudre et solvant pour préparation injectable ?
N’utilisez jamais DIAMOX 500 mg, poudre et solvant pour préparation injectable :
· Si vous êtes allergique à la substance active (l’acétazolamide) ou à l’un des autres composants contenus dans ce médicament et mentionnés à la rubrique 6.
· Si vous êtes allergique à un médicament de la famille des sulfamides. Demandez à votre médecin ou à votre pharmacien si vous n’êtes pas sûr de ce qu’est un sulfamide.
· Si vous avez une maladie du foie (insuffisance hépatique sévère), des reins (insuffisance rénale sévère) ou des glandes situées au-dessus des reins (insuffisance surrénale sévère).
· Si vous avez eu, dans le passé, des crises douloureuses en bas du dos dues à un blocage des organes qui vous permettent d’uriner (coliques néphrétiques).
· Si vous êtes au 1er trimestre de votre grossesse.
Avertissements et précautions
Adressez-vous à votre médecin ou votre pharmacien avant d’utiliser DIAMOX 500 mg, poudre et solvant pour préparation injectable.
Si vous faites partie des sujets à risque : âgé, diabétique, avec des troubles de l’organisme : acidose, goutte (excès d’acide urique dans le sang) ou si vous prenez ce médicament de façon prolongée, votre médecin pourra vous demander de faire une prise de sang pour surveiller :
· votre taux de sucre dans le sang (glycémie),
· votre taux d’acide urique,
· votre composition chimique du sang (ionogramme sanguin) incluant votre taux de potassium,
· votre formule sanguine.
Si vous souffrez d’une maladie des reins (insuffisance rénale chronique), votre médecin surveillera également le fonctionnement de vos reins au cours du traitement. Si vous présentez des symptômes incluant une douleur à l’œil avec une baisse de la vue, ceux-ci nécessitent un traitement en urgence car ils peuvent conduire à la perte de la vue.
Le traitement par DIAMOX doit être arrêté et il convient de demander conseil à votre médecin.
Une diminution de la vision ou une douleur oculaire peuvent être des symptômes de l’accumulation de liquide dans la couche vasculaire de l’œil (épanchement choroïdien ou décollement choroïdien). Cela peut se produire dans les heures qui suivent la prise de DIAMOX 500 mg, poudre et solvant pour préparation injectable. Adressez-vous rapidement à votre médecin si vous ressentez ces symptômes. Prenez immédiatement contact avec un médecin si vous présentez une réaction cutanée sévère : rougeur se généralisant à tout le corps avec des pustules et pouvant être accompagnée de fièvre (pustulose exanthématique aiguë généralisée).
Prenez immédiatement contact avec un médecin si vous présentez une fièvre inexpliquée ou des infections à répétition, une pâleur de la peau, des muqueuses, de la langue ou des gencives, un essoufflement ou des palpitations à l’effort, une fatigue importante, des saignements notamment du nez et des gencives, des bleus fréquents et inexpliqués.
Si vous avez rencontré des problèmes pulmonaires ou respiratoires (liquide dans les poumons) après avoir pris de l’acétazolamide par le passé adressez-vous à votre médecin.
Si vous présentez un essoufflement ou des difficultés respiratoires après avoir pris DIAMOX 500 mg, poudre et solvant pour préparation injectable consultez immédiatement un médecin (voir également section 4).
Mises en garde spéciales
Les femmes en âge d’avoir des enfants doivent utiliser une contraception efficace pendant le traitement (voir la rubrique Grossesse et allaitement).
Ce médicament ne doit jamais être utilisé au 1er trimestre de grossesse et ne sera prescrit au 2ème ou 3ème trimestre de grossesse, qu’en cas de nécessité absolue.
Enfants
Ce médicament est réservé à l’enfant de plus de 6 ans.
Autres médicaments et DIAMOX 500 mg, poudre et solvant pour préparation injectable
Informez votre médecin ou pharmacien si vous prenez ou avez récemment pris tout autre médicament, y compris un médicament obtenu sans ordonnance.
Il est déconseillé de prendre DIAMOX 500 mg, avec de l’acide acétylsalicylique (utilisé pour traiter les douleurs et/ou les états fébriles) en raison du risque d’augmentation des effets indésirables.
Si vous prenez l’un des médicaments suivants, parlez-en à votre médecin, certaines précautions d’emploi particulières peuvent être nécessaires :
· carbamazépine (utilisé pour traiter l’épilepsie, certaines maladies psychiatriques ou certaines douleurs)
· quinidine ou l’hydroquinidine (utilisés pour traiter des troubles du rythme cardiaque)
· lithium (utilisé pour traiter la dépression)
· acide valproïque (utilisé pour traiter l’épilepsie) ou le valpromide (utilisé pour traiter certaines maladies psychiatriques)
· autre inhibiteur de l’anhydrase carbonique administré par voie oculaire (dorzolamide ou brinzolamide)
DIAMOX 500 mg, poudre et solvant pour préparation injectable avec des aliments et boissons
Sans objet.
Grossesse, allaitement et fertilité
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou si vous envisagez une grossesse, demandez conseil à votre médecin ou pharmacien avant de prendre ce médicament.
Grossesse
Si vous êtes enceinte, DIAMOX pourrait nuire gravement à votre enfant. Par conséquent, ce médicament ne doit jamais être utilisé au cours du 1er trimestre de votre grossesse. Au-delà du 1er trimestre, votre médecin ne pourra pas vous prescrire ce médicament, sauf en cas de nécessité absolue. En effet, des cas de malformations (de la face, des membres et du cœur), de modification du volume du liquide amniotique et des effets sur la croissance de l’enfant à naître et le métabolisme du bébé (par exemple augmentation de l’acidité du sang) ont été observés en cas d’utilisation au cours de la grossesse. Si vous avez pris ce médicament alors que vous êtes enceinte, parlez-en à votre médecin, un suivi particulier de votre grossesse et de votre bébé sera mis en place.
Allaitement
Ce médicament passe dans le lait maternel. Par conséquent, l’allaitement est déconseillé si vous prenez ce médicament.
Demandez conseil à votre médecin ou votre pharmacien avant de prendre tout médicament.
Fertilité
Il n’y a pas de données disponibles chez l’animal ou chez l’Homme pour évaluer le risque sur la fertilité associé à une exposition à l’acétazolamide
Sportifs
Cette spécialité contient un principe actif pouvant induire une réaction positive des tests pratiqués lors de contrôles antidopage, chez les sportifs.
Conduite de véhicules et utilisation de machines
Ce médicament peut affecter négativement les activités nécessitant une vigilance accrue, une coordination motrice et une prise de décision rapide en raison de son effet de somnolence.
DIAMOX 500 mg, poudre et solvant pour préparation injectable contient du sodium
Ce médicament contient 3,73 mmol (ou 85,64 mg) de sodium par flacon de poudre. A prendre en compte chez les patients contrôlant leur apport alimentaire en sodium.
3. COMMENT UTILISER DIAMOX 500 mg, poudre et solvant pour préparation injectable ?
Ce médicament est réservé à l’adulte et à l’enfant de plus de 6 ans.
Respectez toujours la dose prescrite par votre médecin. En cas de doute, consultez votre médecin ou votre pharmacien.
Adulte : la dose habituelle est de 1 à 2 g par jour (soit 2 à 4 flacons de 500 mg par jour).
Enfant à partir de 6 ans : la dose habituelle est de 5 à 10 mg/kg/jour.
Mode et voie d’administration
Un professionnel de santé préparera ce médicament et vous l’injectera dans une veine (voie intraveineuse) ou éventuellement dans un muscle (voie intramusculaire).
Reconstitution :
Dissoudre le flacon de poudre dans 5 ml d’eau pour préparations injectables.
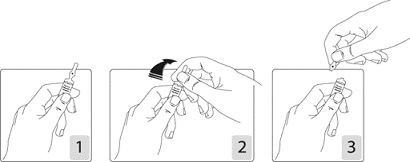
Pour ouvrir l’ampoule de solvant, lorsque celle-ci est fournie dans la boîte :
Tenir fermement l’ampoule, le point coloré face à vous (schéma 1). Saisir la tête de l’ampoule entre le pouce et l’index (le pouce sur le point coloré), puis exercer une pression vers l’arrière (schémas 2 et 3).
|
|
Durée du traitement
Votre médecin vous précisera pendant combien de temps vous devez recevoir ce médicament.
Si vous avez utilisé plus de DIAMOX 500 mg, poudre et solvant pour préparation injectable que vous n’auriez dû :
Consultez immédiatement votre médecin ou votre pharmacien.
Un surdosage peut entraîner des modifications des sels et minéraux présents dans les liquides de l’organisme et des troubles du système nerveux central. Votre médecin prendra les mesures appropriées. Une hospitalisation pourrait être nécessaire.
Si vous oubliez d’utiliser DIAMOX 500 mg, poudre et solvant pour préparation injectable :
N’utilisez pas de dose double pour compenser la dose que vous avez oublié d’utiliser.
Si vous arrêtez d’utiliser DIAMOX 500 mg, poudre et solvant pour préparation injectable :
Sans objet.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Les effets indésirables suivants peuvent survenir :
Très fréquent (pouvant affecter plus d’1 personne sur 10)
· Maux de tête.
Rare (pouvant affecter jusqu’à 1 personne sur 1 000)
· Troubles de la thyroïde (dysthyroïdie),
· Fatigue,
· Somnolence,
· Troubles digestifs,
· Troubles de la sensibilité (picotements, fourmillements).
· Modifications de la formule sanguine.
Fréquence indéterminée (la fréquence ne peut être estimée sur la base des données disponibles)
· Augmentation du taux de sucre dans le sang (diabète),
· Crise de goutte aiguë,
· Baisse du taux de potassium dans le sang avec des troubles de l’organisme (acidose métabolique),
· Perturbation d’un composant chimique (métabolisme de l’ammoniaque), coma chez le cirrhotique,
· Modification du taux de calcium, calculs rénaux,
· Myopie,
· Augmentation de la quantité d’ammonium dans le sang chez les patients épileptiques,
· Diminution de certains éléments du sang (plaquettes sanguines et globules blancs),
· Confusion pouvant être associée à des hallucinations (voir, entendre ou sentir des choses qui n’existent pas),
· Une réaction allergique avec une éruption sur la peau ou une fièvre. Cette réaction allergique peut être parfois grave provoquant un malaise brutal, une baisse importante de la tension artérielle et des anomalies du sang pouvant mettre votre vie en danger (choc anaphylactique et anomalies sévères des cellules du sang),
· Eruption cutanée, démangeaison (prurit), rougeur se généralisant à tout le corps ou peau qui pèle (dermite exfoliative), rougeur se généralisant à tout le corps avec des pustules et pouvant être accompagnée de fièvre (pustulose exanthématique aiguë généralisée),
· Accumulation de liquide dans les poumons se manifestant par un essoufflement ou des difficultés respiratoires (œdème pulmonaire),
· Augmentation de la pression du liquide de l'œil pouvant retentir sur la vue et pouvant toucher les deux yeux en même temps (glaucome bilatéral aigu par fermeture d’angle),
· Diminution de la vision ou douleur oculaire dues à l’accumulation de liquide dans la couche vasculaire de l’œil (épanchement choroïdien ou décollement choroïdien),
· Altération du rein (insuffisance rénale aiguë) ou aggravation de troubles préexistants (aggravation d’une insuffisance rénale chronique),
· Si ce médicament vous a été injecté dans un muscle, douleur au niveau du site d’administration,
· Modification du goût.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER DIAMOX 500 mg, poudre et solvant pour préparation injectable ?
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur la boîte, le flacon, l’ampoule.
Pas de précautions particulières de conservation.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient DIAMOX 500 mg, poudre et solvant pour préparation injectable
· La substance active est :
Acétazolamide................................................................................................................ 500 mg
Pour un flacon de poudre
· Les autres composants sont :
· Hydroxyde de sodium, eau pour préparations injectables pour une ampoule de 5 ml de solvant.
Ce médicament se présente sous la forme d’un flacon de poudre et d’une ampoule de solvant.
Chaque boîte contient 1 flacon de poudre et 1 ampoule de solvant.
Chaque boîte contient 25 flacons de poudre (modèle hospitalier).
Titulaire de l’autorisation de mise sur le marché
COOPERATION PHARMACEUTIQUE FRANÇAISE
PLACE LUCIEN AUVERT
77020 MELUN CEDEX
Exploitant de l’autorisation de mise sur le marché
COOPERATION PHARMACEUTIQUE FRANÇAISE
PLACE LUCIEN AUVERT
77020 MELUN CEDEX
AVENIDA DE MADRID, 82
28802 ALCALA DE HENARES - MADRID
ESPAGNE
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Sans objet.
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).