Dernière mise à jour le 01/12/2025
HYPNOMIDATE 2 mg/ml, solution injectable
Indications thérapeutiques
Classe pharmacothérapeutique : HYPNOMIDATE appartient à la classe des médicaments appelés anesthésiques généraux.
Ce médicament est utilisé au cours d'anesthésie générale pour provoquer le sommeil.
Présentations
> 5 ampoule(s) en verre de 10 ml
Code CIP : 560 691-9 ou 34009 560 691 9 4
Déclaration de commercialisation : 31/07/1987
Cette présentation est agréée aux collectivités
Service médical rendu (SMR)
Pas de SMR disponible pour ce médicament ( plus d'informations dans l'aide )
Amélioration du service médical rendu (ASMR)
Pas d'ASMR disponible pour ce médicament (plus d'informations dans l'aide )
Autres informations
- Titulaire de l'autorisation : PIRAMAL CRITICAL CARE B.V.
- Conditions de prescription et de délivrance :
- administration par tout médecin spécialiste en ANESTHESIE-REANIMATION ou en MEDECINE D'URGENCE
- liste I
- réservé à l'usage en situation d'urgence selon l'article R5121-96 du code de la santé publique
- réservé à l'usage HOSPITALIER
- réservé à une structure d'assistance médicale mobile ou de rapatriement sanitaire
- Statut de l'autorisation : Valide
- Type de procédure : Procédure nationale
- Code CIS : 6 344 417 1
ANSM - Mis à jour le : 06/11/2025
HYPNOMIDATE 2 mg/ml, solution injectable
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Pour 1 ml
Une ampoule de 10 ml contient 20 mg d’étomidate.
Excipient à effet notoire : Une ampoule de 10 ml contient 3,38 g de propylèneglycol (E1520).
Pour la liste complète des excipients, voir rubrique 6.1.
4.1. Indications thérapeutiques
Hypnotique pur à brève durée d'action, l'étomidate 2 mg/ml peut être utilisé comme :
· agent inducteur de l'anesthésie générale,
· potentialisateur d'agents anesthésiques gazeux ou volatils,
· agent hypnotique unique pour des interventions peu douloureuses de courte durée nécessitant un réveil rapide.
4.2. Posologie et mode d'administration
Les recommandations des sociétés savantes concernées doivent être respectées, notamment en cas d’utilisation en situation extra-hospitalière (situation d’urgence ou transport médicalisé).
Posologie
Ne pas injecter plus de 3 ampoules (30 ml).
Chez l'adulte :
· induction : 0,25 à 0,40 mg/kg ;
Chez l'enfant de moins de 15 ans :
Il peut être nécessaire d'augmenter la posologie. Une dose de 30 % supérieure à la dose utilisée chez l'adulte est parfois nécessaire pour obtenir une profondeur et une durée du sommeil égales à celles obtenues chez l'adulte.
La dose d'étomidate sera réduite chez :
· l'insuffisant hépatique,
· le malade susceptible d'avoir un débit cardiaque abaissé,
· ou les patients ayant reçu des neuroleptiques, des morphiniques ou des agents sédatifs.
Chez les sujets âgés : une dose unique de 0,15 à 0,20 mg/kg est recommandée. La dose pourra être ajustée selon les effets (voir rubriques 4.4 et 5.2).
Mode d’administration
HYPNOMIDATE doit être administré en injection lente par voie intraveineuse.
Hypersensibilité à la substance active (étomidate) ou à l’un des excipients mentionnés à la rubrique 6.1.
4.4. Mises en garde spéciales et précautions d'emploi
L'emploi d'étomidate est réservé aux anesthésistes, aux médecins exerçant sous la responsabilité des anesthésistes et aux médecins ayant l'expérience de la réanimation, en clinique ou à hôpital, et disposant de tout le matériel d'assistance respiratoire et de réanimation nécessaire à tout acte d'anesthésie générale.
L'étomidate ne doit être utilisé que par voie IV.
L’induction de l’anesthésie avec l’HYPNOMIDATE peut être accompagnée d’une légère et transitoire baisse de la pression artérielle en raison de la réduction de la résistance vasculaire périphérique. Chez les patients affaiblis chez qui l’hypotension peut être dangereuse, les mesures suivantes doivent être prises :
· Maintenir le patient couché durant l’induction.
· Assurez un bon accès intraveineux afin de contrôler la volémie.
· Administrez Hypnomidate par injection intraveineuse lente (par exemple 10 ml en 1 min).
· Dans la mesure du possible, évitez d’associer d'autres agents d'induction.
Des myoclonies, et des douleurs à l’injection incluant une douleur veineuse ont été parfois observées lors de l’administration d’étomidate, en particulier lorsque le produit est injecté dans une veine de petit calibre. Il est recommandé d’injecter l’étomidate lentement et dans une veine de gros calibre.
Des mouvements involontaires peuvent survenir au niveau d'un ou de plusieurs groupes musculaires, en particulier en l'absence de prémédication. Ces mouvements ont été attribués à une désinhibition sous-corticale.
La pré-administration par voie intraveineuse d’un morphinomimétique puissant à faible dose, 1 à 2 minutes avant l’injection peut diminuer les douleurs au site d’injection et l’apparition de myoclonies et de mouvements anormaux.
Précautions d'emploi
Prémédication vagolytique avant l'induction.
L'utilisation concomitante de dépresseurs du système nerveux central retarde le réveil.
Des doses d’induction uniques d’étomidate peuvent mener à une insuffisance surrénalienne transitoire et à une diminution des taux sériques de cortisol (voir rubrique 5.1 Propriétés pharmacodynamiques). Chez les patients soumis à un stress important, particulièrement en cas de dysfonctionnement cortico-surrénalien, une supplémentation en cortisol doit être discutée.
Une administration répétée ou une perfusion continue d’étomidate peut entraîner une suppression prolongée du cortisol et de l’aldostérone endogènes et doit donc être évitée. Dans ce cas, une stimulation de la glande surrénale par de l'ACTH n'est pas nécessaire.
L’étomidate doit être utilisé avec précaution chez les patients dont l’état est critique, y compris chez les patients présentant un sepsis.
Chez les patients cirrhotiques, ou chez ceux ayant déjà reçu des neuroleptiques, des morphiniques ou des agents sédatifs, la dose d'étomidate doit être réduite.
HYPNOMIDATE doit être utilisé avec prudence chez les patients âgés, car il existe un risque d’abaissement du débit cardiaque, observé avec des doses supérieures à celles recommandées (voir rubrique 4.2).
L'étomidate étant dépourvu d'effet analgésique, l'administration d'analgésiques appropriés est recommandée lors d'interventions chirurgicales.
HYPNOMIDATE contient du propylèneglycol et peut provoquer des symptômes semblables à ceux provoqués par l’alcool. Il est nécessaire de s'assurer de sa compatibilité avec le matériel d'injection.
Ce médicament contient 3,38 g de propylène glycol par ampoule de 10 ml.
L’administration concomitante avec n’importe quel substrat pour l’alcool déshydrogénase, comme l’éthanol, peut induire des effets indésirables graves chez les enfants de moins de 5 ans.
Même si le propylène glycol n’a pas montré de toxicité sur la reproduction ou le développement chez les animaux ou les humains, il peut atteindre le fœtus et a été observé dans le lait. En conséquence, l’administration de propylène glycol aux patientes enceintes ou allaitantes doit être envisagée au cas par cas.
Une surveillance médicale est requise chez les patients souffrant d’insuffisance rénale ou de troubles de la fonction hépatique, car divers effets indésirables attribués au propylène glycol ont été rapportés, tels qu’un dysfonctionnement rénal (nécrose tubulaire aiguë), une insuffisance rénale aiguë et une dysfonction hépatique.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
L'effet hypnotique de l'étomidate peut être majoré par des médicaments neuroleptiques, morphiniques et sédatifs, et par l'alcool.
L’induction de l’anesthésie avec l’étomidate peut être accompagnée d’une baisse légère et transitoire de la pression artérielle due à la diminution de la résistance vasculaire périphérique pouvant renforcer l'effet des autres médicaments diminuant la pression artérielle.
Associations déconseillées
+ Consommation d’alcool
Majoration de l'effet sédatif des analgésiques morphiniques.
L'altération de la vigilance peut rendre dangereuses la conduite de véhicules et l'utilisation de machines.
Eviter la prise de boissons alcoolisées et de médicaments contenant de l’alcool.
Associations à prendre en compte
+ Autres dépresseurs du système nerveux central
Autres dérivés morphiniques (analgésiques, antitussifs et traitement de substitution), antidépresseurs sédatifs, antihistaminiques H1 sédatifs, barbituriques, benzodiazépines, anxiolytiques autres que les benzodiazépines, neuroleptiques, antihypertenseurs centraux.
Majoration de la dépression centrale pouvant avoir des conséquences importantes, notamment en cas de conduite automobile ou d'utilisation de machines.
+ Autres dérivés morphiniques (analgésiques ou antitussifs)
Risque de dépression respiratoire par synergie potentialisatrice des effets dépresseurs morphiniques, en particulier chez le sujet âgé.
+ Alfentanil
Diminution de la demi-vie terminale de l’étomidate jusqu’à environ 29 minutes lors de l’administration concomitante d’alfentanil. La prudence est recommandée lors de l’administration concomitante d’étomidate et d’afentanil car les concentrations d’étomidate peuvent baisser en deçà du seuil hypnotique.
+ Kétamine
L’administration concomitante d’étomidate et de kétamine apparaît ne pas avoir d’effet significatif sur les concentrations plasmatiques ou les paramètres pharmacocinétiques de la kétamine ou de son métabolite principal, la norkétamine.
+ Fentanyl IV
La clairance plasmatique totale et le volume de distribution de l’étomidate sont diminués d’un facteur 2 à 3 sans modification de la demi-vie lors d’une co-administration avec du fentanyl par voie intraveineuse (IV).
Diminuer la posologie de l’étomidate en cas de traitement par le fentanyl IV.
4.6. Fertilité, grossesse et allaitement
Grossesse
Aucun effet tératogène ou embryotoxique n'a été constaté avec l’etomidate chez l'animal (voir rubrique 5.3).
Au cours de l'anesthésie obstétricale, l'étomidate franchit la barrière placentaire. Les scores Apgar de nouveau-nés de mères ayant reçu HYPNOMIDATE sont identiques à ceux de nouveau-nés nés après utilisation d'autres hypnotiques. Une diminution transitoire de la cortisolémie d'une durée d'environ 6 heures a été observée chez les nourrissons dont la mère a reçu de l'étomidate. La cortisolémie reste toutefois dans les valeurs de la normale.
En conséquence, l'étomidate ne sera utilisé pendant la grossesse que si les bénéfices potentiels justifient les risques fœtaux.
Des études chez l'animal ont mis en évidence une toxicité sur la reproduction (voir rubrique 5.3).
L’étomidate a été retrouvé dans le lait maternel. L'effet de l'étomidate sur les nouveau-nés est inconnu. L'allaitement doit être interrompu pendant l’administration et pendant une période d’au moins de 4 heures après arrêt de l’administration d’HYPNOMIDATE.
Fertilité
Les résultats d’une étude sur la reproduction effectuée chez l’animal n’ont pas montré d’effet d’HYPNOMIDATE sur la fertilité (voir rubrique 5.3).
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
L’utilisation d’une machine potentiellement dangereuse ou la conduite d’un véhicule pendant les 24 heures suivant l'administration n’est pas recommandée. Le retour à une vigilance normale peut varier en fonction de la durée de l'opération, de la dose totale d'étomidate administrée et du traitement concomitant utilisé. La décision d’autoriser la conduite ou l’utilisation de machines doit être prise par l'équipe soignante après l’anesthésie.
Ces effets indésirables sont inclus dans le tableau ci-après qui décrit les effets indésirables rapportés avec HYPNOMIDATE soit au cours des études cliniques soit après commercialisation. Les fréquences sont définies de la manière suivante : très fréquent (≥ 1/10), fréquent (≥ 1/100 à < 1/10), peu fréquent (≥ 1/1000 à < 1/100) et fréquence indéterminée (fréquence ne pouvant être estimée sur la base des données disponibles).
|
Classe de systèmes organes |
Effets indésirables |
|||
|
Catégorie de fréquence |
||||
|
Très fréquent (≥ 1/10) |
Fréquent (≥ 1/100 à < 1/10) |
Peu fréquent (≥ 1/1000 à < 1/100) |
Indéterminée |
|
|
Affections du système immunitaire |
|
|
|
Hypersensibilité (Choc anaphylactique, Réaction anaphylactique, Réaction anaphylactoïde) |
|
Affections endocriniennes |
Diminution du cortisol |
|
|
Insuffisance surrénalienne |
|
Affections du système nerveux |
Dyskinésie |
myoclonie |
Hypertonie, contractions musculaires involontaires, nystagmus |
Convulsions (incluant des crises tonico-cloniques) |
|
Affections cardiaques |
|
|
bradycardie, extrasystoles, extrasystoles ventriculaires |
Arrêt cardiaque, bloc auriculo-ventriculaire complet |
|
Affections vasculaires |
|
Douleur veineuse, hypotension |
Phlébite, Hypertension |
Collapsus, thrombophlébite (incluant thrombophlébite superficielle et thrombose veineuse profonde) |
|
Affections respiratoires, thoraciques et médiastinales |
|
Apnée, hyperventilation, stridor |
Hypoventilation, hoquets, toux |
Dépression respiratoire, bronchospasme (dont certains cas ont été fatals) |
|
Affections gastro-intestinales |
|
Vomissements, nausées |
Hypersécrétion salivaire |
|
|
Affections de la peau et du tissu sous-cutané |
|
Rash |
Erythème |
Syndrome de Stevens-Johnson, urticaire |
|
Affections musculo-squelettiques et systémiques |
|
|
Rigidité musculaire |
Trismus |
|
Troubles généraux et anomalies au site d'administration |
|
|
Douleur au site d’injection |
|
|
Lésions, intoxications et complications liées aux procédures |
|
|
Complication liée à l’anesthésie, retard à l’éveil, analgésie inadéquate, nausées liées à l’administration |
|
Aux doses d'induction, l'étomidate a parfois été associé à un abaissement des taux plasmatiques de cortisol ne répondant pas à l'injection d'ACTH. A ces doses, il n'a pas été observé de modifications des signes vitaux ou d'augmentation de la morbidité (voir rubrique 4.4).
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/
Signes et Symptômes
Lors d'administration en bolus, un surdosage en étomidate peut entraîner une hypotension, une diminution des sécrétions de la cortisosurrénale, un approfondissement de l'effet hypnotique, une dépression respiratoire ou un arrêt respiratoire. En cas d’arrêt respiratoire, une assistance ventilatoire est nécessaire.
Un surdosage survenant lors d'une perfusion prolongée peut entraîner une diminution importante de la sécrétion de cortisol. Une désorientation et un retard au réveil peuvent également se produire.
Traitement
Le traitement symptomatique (en particulier, assistance respiratoire) pourra être complété, si nécessaire, par l'administration d’une dose de 50 à 100 mg d'hydrocortisone (et non d'adrénocorticotrophine (ACTH)).
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : Autres Anesthésiques généraux, code ATC : N01AX07
Hypnotique intraveineux à brève durée d'action, dénué de propriétés analgésiques. L'effet hypnotique dépend de la dose administrée : en moyenne chez l’adulte 0,2 à 0,3 mg/kg d'étomidate procure un sommeil de 4 à 6 minutes.
L'étomidate se caractérise par :
· une bonne tolérance cardio-vasculaire,
· une dépression respiratoire minime,
· un effet protecteur cérébral accompagné d'une réduction de la pression intracrânienne,
· une action dépressive sur la tension intra-oculaire,
· l'absence de libération d'histamine,
· une inactivation rapide par métabolisation dans l'organisme, de sorte qu'il n'a pas d'effet différé.
Il n'exerce aucune influence sur la fonction hépatique.
Suppression surrénalienne
Lorsqu’il est utilisé pour l’induction de l’anesthésie, l’étomidate entraîne une diminution des concentrations plasmatiques du cortisol et de l’aldostérone qui se poursuit pendant 6 à 8 heures. Ces concentrations reviennent en général au niveau initial dans les 24 heures. Il semble que l’étomidate soit un inhibiteur spécifique et réversible de la 11-bêta-hydroxylation intervenant dans la synthèse des stéroïdes surrénaliens
5.2. Propriétés pharmacocinétiques
L'étomidate est une molécule lipophile faiblement basique non ionisée dans le plasma.
Profil plasmatique
Après injection IV, la cinétique de l’étomidate évolue selon un système tricompartimental reflétant les processus de distribution, métabolisme et élimination.
Distribution
L’étomidate se lie approximativement à 76,5 % aux protéines plasmatiques. L’étomidate se distribue rapidement vers le cerveau et les autres organes. Son volume total de distribution (Vdss) est d’environ 4,5 L/kg.
Biotransformation et élimination
L’étomidate est métabolisé par le foie. Après 24 heures, 75 % de la dose administrée sont éliminés dans les urines essentiellement sous forme de métabolites inactifs. Seuls 2 % de la dose administrée sont excrétés dans les urines sous forme inchangée. Sa demi-vie terminale est d'environ 3 à 5 heures.
Populations particulières
Pédiatrie
Dans une étude menée chez 12 enfants (âgés de 7 à 13 ans, de poids compris entre 22 et 48 kg), le volume de distribution initial ramené au poids a été 2,4 fois plus important que chez l’adulte (0,66 versus 0,27 L/kg) et la clairance chez l’enfant a été environ 58 % supérieure à celle observée chez l’adulte. Ces données suggèrent la nécessité d’administrer des doses plus élevées d’étomidate chez les enfants que chez les adultes.
Patient insuffisant hépatique
Une élévation de la demi-vie a été observée chez les cirrhotiques. La fraction libre d’étomidate augmente jusqu’à 44,2 ± 2,1 % chez l’insuffisant hépatique comparé à 24,9 ± 1,4 % chez le volontaire sain. Une réduction de la dose pourra être envisagée chez ces patients.
Sujets âgés
La clairance de l’étomidate est diminuée chez les sujets âgés (> 65 ans) comparativement aux sujets plus jeunes. Les concentrations plasmatiques initiales sont plus élevées chez les sujets âgés en raison d’un plus faible volume de distribution initial chez ces patients comparativement aux patients plus jeunes. Une adaptation des doses doit donc être envisagée chez ces patients.
5.3. Données de sécurité préclinique
Les résultats issus des études de toxicité par voie intraveineuse après administration de doses répétées chez le rat et le chien ont montré un lien entre la dose administrée et la survenue d'une ataxie et/ou d'un endormissement/hypnose avec une diminution de la consommation de nourriture et du poids. Une mortalité est observée de façon limitée à la plus forte dose testée (5 mg/kg) soit environ 17 fois la Dose Hypnotique Efficace chez l'Homme (DHEH). Pendant la période de rétablissement, il a été observé une bonne réversibilité des pertes de poids.
Aucun effet sur la fertilité n’a été rapporté chez les rats traités avec étomidate jusqu’à 5 mg/kg (17 fois la DHEH). Dans les études d'embryotoxicité et de tératogénicité chez le rat et le lapin, quelques morts ont été observées dans le groupe forte dose (4.5-5 mg/kg IV). Cependant, aucune embryotoxicité ni tératogénicité n'ont été spécifiquement attribuées au matériel testé.
L'administration d'étomidate pendant la période peri et post natale a entraîné une mortalité et une toxicité maternelle liées à la dose, entraînant une légère diminution de la survie des petits dans le groupe forte dose (5 mg/kg).
Les tests de mutagenèse (AMES in vitro et micronucleus chez la souris) n'ont pas mis en évidence de potentiel mutagène.
Les études de tolérance locale (irritation intraveineuse chez le lapin et subplantaire chez le rat) n'ont pas montré d'irritation intraveineuse au site d'injection mais seulement un gonflement modéré et réversible après injection subplantaire.
Des études publiées chez l'animal (y compris chez les primates) ont mis en évidence que l'utilisation d'agents anesthésiques, à des doses entraînant une anesthésie légère à modérée, pendant la période de croissance cérébrale rapide ou de synaptogenèse, entraîne une perte de cellules dans le cerveau en développement pouvant être associée à des déficiences cognitives prolongées. La pertinence de ces observations non cliniques pour une utilisation chez l'homme n'est pas connue.
Propylèneglycol (E1520), eau pour préparations injectables.
6.4. Précautions particulières de conservation
A conserver à une température ne dépassant pas 25°C.
Après ouverture : le produit doit être utilisé immédiatement.
6.5. Nature et contenu de l'emballage extérieur
10 ml en ampoule (verre). Boite de 5 et de 10 ampoules.
6.6. Précautions particulières d’élimination et de manipulation
Vous devez porter des gants de protection lorsque vous ouvrez les ampoules.
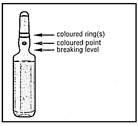
1- Maintenez l'ampoule entre le pouce et l'index en laissant dépasser le haut de l'ampoule.
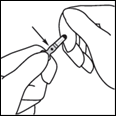
2- De l'autre main, saisir la partie supérieure de l'ampoule, l'index posé contre le col, et le pouce posé sur le point coloré, parallèlement aux anneaux (ou à l'anneau) de couleur.
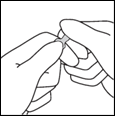
3- En maintenant le pouce sur le point, casser d'un mouvement sec le haut de l'ampoule en maintenant fermement le corps de l'ampoule dans la main.
Toute exposition cutanée accidentelle doit donner lieu à un rinçage de la zone exposée à l’eau claire. Evitez d’utiliser du savon, de l’alcool ou tout autre nettoyant pouvant causer une abrasion chimique ou physique de la peau.
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
ROUBOSLAAN 32, 2252 TR,
VOORSCHOTEN,
PAYS-BAS
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 560 691 9 4 : 10 ml en ampoule (verre) ; boite de 5.
· 34009 551 112 8 3: 10 ml en ampoule (verre) ; boite de 10.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
Date de première autorisation:{JJ mois AAAA}
Date de dernier renouvellement:{JJ mois AAAA}
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
{JJ mois AAAA}
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Liste I.
Médicament réservé à l’usage hospitalier.
Médicament pouvant être administré par tout médecin spécialisé en anesthésie-réanimation ou en médecine d’urgence dans les cas où il intervient en situation d’urgence ou dans le cadre d’une structure d’assistance médicale mobile ou de rapatriement sanitaire (article R. 5121-96 du code de la santé publique).
ANSM - Mis à jour le : 06/11/2025
HYPNOMIDATE 2 mg/ml, solution injectable
Etomidate
Veuillez lire attentivement cette notice avant d’utiliser ce médicament car elle contient des informations importantes pour vous.
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin, votre pharmacien ou votre infirmier/ère.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, votre pharmacien ou votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique
1. Qu'est-ce que HYPNOMIDATE 2 mg/ml, solution injectable et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d'utiliser HYPNOMIDATE 2 mg/ml, solution injectable ?
3. Comment utiliser HYPNOMIDATE 2 mg/ml, solution injectable ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver HYPNOMIDATE 2 mg/ml, solution injectable ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE HYPNOMIDATE 2 mg/ml, solution injectable ET DANS QUELS CAS EST-IL UTILISE ?
Classe pharmacothérapeutique : HYPNOMIDATE appartient à la classe des médicaments appelés anesthésiques généraux.
Ce médicament est utilisé au cours d'anesthésie générale pour provoquer le sommeil.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER HYPNOMIDATE 2 mg/ml, solution injectable ?
HYPNOMIDATE 2 mg/ml, solution injectable ne doit jamais être administré :
· en cas d’allergie (hypersensibilité) à la substance active (l’étomidate) ou à l’un des autres composants contenus dans ce médicament, mentionnés dans la rubrique 6.
Avertissements et précautions
Faites attention avec HYPNOMIDATE 2 mg/ml, solution injectable :
Ce médicament ne doit être utilisé que par voie intraveineuse.
L’injection d’étomidate sera faite lentement, dans une veine de gros calibre ; votre médecin pourra vous administrer un analgésique puissant (similaire à la morphine) de 1 à 2 minutes avant l’injection d’étomidate afin de diminuer les douleurs au site d’injection et l’apparition de mouvements anormaux.
Ce médicament contient du propylène glycol et peut provoquer des symptômes semblables à ceux de l’alcool.
Des doses d’induction uniques d’étomidate peuvent mener à une insuffisance surrénalienne transitoire et à une diminution des taux sériques de cortisol.
L’étomidate doit être utilisé avec prudence chez les patients en état critique, y compris chez les patients présentant un sepsis, car il a été associé à un risque accru de mortalité dans certaines études chez ces groupes de patients.
Avertissez votre médecin si :
· vous prenez des médicaments pouvant avoir une action sur le système nerveux central,
· vous avez un stress important ou un trouble hormonal surrénalien (au niveau de la glande surrénale),
· vous avez une insuffisance hépatique (maladie du foie),
· vous avez un débit du cœur abaissé.
Autres médicaments et HYPNOMIDATE 2 mg/ml, solution injectable
Ce médicament NE POURRA GENERALEMENT PAS vous être administré si vous prenez des médicaments contenant de l’alcool.
Informez votre médecin si vous prenez des médicaments qui agissent sur le système nerveux (par exemple, certains analgésiques, antitussifs, antihypertenseurs, antihistaminiques, antidépresseurs, somnifères, tranquillisants, médicaments utilisés dans les troubles mentaux ou traitements de substitution).
Informez votre médecin ou pharmacien si vous utilisez, avez récemment utilisé ou pourriez utiliser tout autre médicament.
HYPNOMIDATE 2 mg/ml, solution injectable avec des aliments, boissons et de l’alcool
L’effet de ce médicament est augmenté par l’alcool.
Grossesse, allaitement et fertilité
Avertissez votre médecin et l'anesthésiste si vous êtes enceinte ou si vous allaitez. Ils décideront si ce médicament peut vous être administré.
Ce médicament passe dans le lait maternel. L'effet de l'étomidate sur les nouveau-nés allaités est inconnu. L'allaitement doit être interrompu pendant l’administration et pendant une période d’au moins 4 heures après arrêt de l’administration d’HYPNOMIDATE.
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin ou pharmacien avant de prendre ce médicament.
Conduite de véhicules et utilisation de machines
Attention danger : ne pas conduire.
Pour la reprise de la conduite, demandez l’avis d’un médecin. Il décidera de la reprise de la conduite en fonction de la durée de l'intervention chirurgicale et des médicaments utilisés au cours de l'anesthésie.
HYPNOMIDATE 2 mg/ml, solution injectable contient du propylèneglycol (E1520).
Ce médicament contient 3,38 g de propylèneglycol par ampoule de 10 ml.
Si votre enfant a moins de 5 ans, adressez-vous à votre médecin ou à votre pharmacien avant de lui donner ce médicament, en particulier s’il reçoit d’autres médicaments contenant du propylène glycol ou de l’alcool.
Si vous êtes enceinte ou si vous allaitez, ne prenez pas ce médicament sauf avis contraire de votre médecin. Votre médecin pourra procéder à des contrôles supplémentaires pendant que vous prenez ce médicament.
Si vous souffrez d’une maladie du foie ou du rein, ne prenez ce médicament que sur avis de votre médecin. Votre médecin pourra procéder à des examens complémentaires pendant que vous prenez ce médicament
3. COMMENT UTILISER HYPNOMIDATE 2 mg/ml, solution injectable ?
Posologie
Votre médecin déterminera la dose à vous administrer.
Il pourra décider de réduire la dose dans les situations suivantes :
· si vous avez une maladie grave du foie,
· si vous êtes susceptible d'avoir un débit cardiaque abaissé,
· ou si vous avez reçu des médicaments déprimant le système nerveux central (neuroleptiques, morphiniques ou sédatifs),
· en fonction de votre âge.
Mode d’administration
Voie intraveineuse (dans une veine).
Si trop d’HYPNOMIDATE 2 mg/ml, solution injectable vous a été administré
Un surdosage se traduit par une dépression respiratoire. Dans ce cas, votre médecin prendra les mesures nécessaires (en particulier, assistance respiratoire).
Si vous avez d’autres questions sur l’utilisation de ce médicament, demandez plus d’informations à votre médecin, à votre pharmacien ou à votre infirmier/ère.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Effets indésirables très fréquents (survenant chez plus de 1 patient sur 10) :
· Mouvements anormaux
· Diminution du cortisol
Effets indésirables fréquents (survenant chez 1 à 10 patients sur 100) :
· Contractions musculaires involontaires
· Douleur veineuse
· Diminution de la pression artérielle (hypotension)
· Arrêt respiratoire
· Respiration profonde et rapide
· Bruit aigu et sifflant à la respiration
· Vomissements
· Nausées
· Eruption cutanée étendue
Effets indésirables peu fréquents (survenant chez 1 à 10 patients sur 1 000) :
· Augmentation du tonus musculaire
· Contractions musculaires involontaires
· Mouvements involontaires des yeux
· Ralentissement du rythme cardiaque
· Rythme cardiaque irrégulier
· Phlébite (obstruction d’une veine due à un caillot)
· Augmentation de la pression artérielle (hypertension)
· Inspiration insuffisante d'air par les poumons
· Hoquets
· Toux
· Hypersalivation
· Rougeur de la peau
· Rigidité musculaire
· Douleur au site d’injection
· Complication liée à l’anesthésie
· Retard à l’éveil
· Analgésie inadéquate
· Nausées liées à l’administration
Effets indésirables de fréquence indéterminée (ne peut être estimée sur la base des données disponibles)
· Réactions allergiques (anaphylaxie)
· Syndrome de Stevens-Johnson (décollement de la peau pouvant rapidement s’étendre de façon très grave à tout le corps)
· Défaillance de la fonction de la glande surrénale
· Convulsions y compris convulsions de type grand mal
· Arrêt cardiaque
· Trouble du rythme cardiaque
· Abaissement rapide et durable de la pression artérielle
· Caillot qui obstrue une veine
· Dépression respiratoire
· Gêne respiratoire (bronchospasme dont certains cas ont été fatals)
· Urticaire
· Contraction intense des mâchoires
· Abaissement du cortisol (hormone corticoïde) dans le sang.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, votre pharmacien ou à votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER HYPNOMIDATE 2 mg/ml, solution injectable ?
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur l’étiquette après {EXP}. La date de péremption fait référence au dernier jour de ce mois.
Après ouverture : le produit doit être utilisé immédiatement.
A conserver à une température ne dépassant pas 25°C.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient HYPNOMIDATE 2 mg/ml, solution injectable
· La substance active est :
Etomidate................................................................................................................................ 2 mg
Pour 1 ml
Une ampoule de 10 ml contient 20 mg d’étomidate.
· Les autres composants sont :
Propylèneglycol (E1520), eau pour préparations injectables.
Qu’est-ce que HYPNOMIDATE 2 mg/ml, solution injectable et contenu de l’emballage extérieur
Ce médicament se présente sous forme de solution injectable. Boîte de 5 et de 10 ampoules.
Titulaire de l’autorisation de mise sur le marché
ROUBOSLAAN 32, 2252 TR,
VOORSCHOTEN,
PAYS-BAS
Exploitant de l’autorisation de mise sur le marché
CENTRE SPECIALITES PHARMACEUTIQUES
76-78 AVENUE DU MIDI
63800 COURNON D’AUVERGNE
FRANCE
Nr. Information Médicale et Pharmacovigilance : 01.47.04.80.46
ROUBOSLAAN 32, 2252 TR
VOORSCHOTEN
PAYS-BAS
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Sans objet.
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
{MM/AAAA} {mois AAAA}.
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).
Les informations suivantes sont destinées exclusivement aux professionnels de santé :
POSOLOGIE ET MODE D'ADMINISTRATION
Ce produit ne doit être administré que par des médecins spécialisés en anesthésie-réanimation ou en médecine d’urgence et familiarisés avec l’utilisation des anesthésiques, ou sous leur contrôle, et disposant de tout le matériel d’anesthésie-réanimation nécessaire.
Les recommandations des sociétés savantes concernées doivent être respectées, notamment en cas d’utilisation en situation extra-hospitalière (situation d’urgence ou transport médicalisé).
HYPNOMIDATE doit être administré en injection lente par voie intraveineuse.
Ne pas injecter plus de 3 ampoules (30 ml).
Chez l'adulte : de 0,25 à 0,40 mg/kg,
Chez l'enfant de moins de 15 ans : Il peut être nécessaire d'augmenter la posologie. Une dose de 30 % supérieure à la dose utilisée chez l'adulte est parfois nécessaire pour obtenir une profondeur et une durée du sommeil égales à celles obtenues chez l'adulte.
La dose d'étomidate sera réduite chez :
· L’insuffisant hépatique,
· Le malade susceptible d'avoir un débit cardiaque abaissé,
· ou les patients ayants reçus des neuroleptiques, des morphiniques ou des agents sédatifs.
Chez les sujets âgés : une dose unique de 0,15 à 0,20 mg/kg est recommandée. La dose pourra être ajustée selon les effets (voir rubriques 4.4 et 5.2).
PRECAUTIONS D’EMPLOI
Il est recommandé d’injecter l’étomidate lentement et dans une veine de gros calibre
La pré-administration par voie intraveineuse d’un morphinomimétique puissant à faible dose, de 1 à 2 minutes avant l’injection d’étomidate, peut diminuer les douleurs au site d’injection et l’apparition de myoclonies et de mouvements anormaux.
L’induction de l’anesthésie avec l’HYPNOMIDATE peut être accompagnée d’une légère et transitoire baisse de la pression artérielle en raison de la réduction de la résistance vasculaire périphérique. Chez les patients affaiblis chez qui l’hypotension peut être dangereuse, les mesures suivantes doivent être prises :
· Maintenir le patient couché durant l’induction.
· Assurez un bon accès intraveineux afin de contrôler la volémie.
· Administrez Hypnomidate par injection intraveineuse lente (par exemple 10 ml en 1 min).
· Dans la mesure du possible, évitez d’associer d'autres agents d'induction.
L'étomidate étant dépourvu d'effet analgésique, l'administration d'analgésiques appropriés est recommandée lors d'interventions chirurgicales.
HYPNOMIDATE contenant du propylène glycol, il est nécessaire de s'assurer de sa compatibilité avec le matériel d'injection.
HYPNOMIDATE ne doit pas être mélangé avec d’autres médicaments.
Vous devez porter des gants de protection lorsque vous ouvrez et / ou manipulez les ampoules.
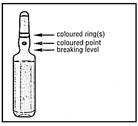
1- Maintenez l'ampoule entre le pouce et l'index en laissant dépasser le haut de l'ampoule.
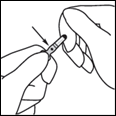
2- De l'autre main, saisir la partie supérieure de l'ampoule, l'index posé contre le col, et le pouce posé sur le point coloré, parallèlement aux anneaux (ou à l'anneau) de couleur.
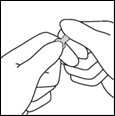
3- En maintenant le pouce sur le point, casser d'un mouvement sec le haut de l'ampoule en maintenant fermement le corps de l'ampoule dans la main.
Toute exposition cutanée accidentelle doit donner lieu à un rinçage de la zone exposée à l’eau claire. Evitez d’utiliser du savon, de l’alcool ou tout autre nettoyant pouvant causer une abrasion chimique ou physique de la peau.
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.