Dernière mise à jour le 02/02/2026
VITAMINE B 12 HORUS PHARMA 0,5 POUR MILLE, collyre en solution
Présentations
> 1 flacon(s) polyéthylène basse densité (PEBD) de 5 ml
Code CIP : 311 343-7 ou 34009 311 343 7 4
Déclaration de commercialisation : 19/01/1962
Cette présentation n'est pas agréée aux collectivités
Service médical rendu (SMR)
Pas de SMR disponible pour ce médicament ( plus d'informations dans l'aide )
Amélioration du service médical rendu (ASMR)
Pas d'ASMR disponible pour ce médicament (plus d'informations dans l'aide )
ANSM - Mis à jour le : 11/10/2013
VITAMINE B12 HORUS PHARMA 0,5 POUR MILLE, collyre en solution
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Cyanocobalamine ............................................................................................................................. 0,050 g
Pour 100 ml de solution.
Pour la liste complète des excipients, voir rubrique 6.1.
Collyre en solution.
Solution limpide rose.
4.1. Indications thérapeutiques
Traitement d'appoint des troubles de la cicatrisation cornéenne.
4.2. Posologie et mode d'administration
En instillation oculaire.
Tourner le capuchon pour ouvrir le flacon.
Instiller dans le cul de sac conjonctival en tirant légèrement la paupière inférieure vers le bas et en regardant vers le haut.
La posologie est de 1 goutte dans l'œil ou les yeux à traiter, 3 à 4 fois par jour en fonction des troubles oculaires.
Hypersensibilité à la substance active ou à l'un des excipients.
4.4. Mises en garde spéciales et précautions d'emploi
Ne pas injecter, ne pas avaler.
Pour éviter toute contamination, ne pas mettre l'embout du flacon en contact avec l'œil ou toute autre surface.
En raison de la coloration du collyre VITAMINE B12 HORUS PHARMA 0,5 POUR MILLE, collyre en solution, le port des lentilles de contact est déconseillé pendant toute la durée du traitement.
En cas de traitement concomitant par un autre collyre, attendre 15 minutes entre les deux instillations.
Reboucher le flacon après utilisation.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Aucune étude d'interaction n'a été réalisée.
Pour VITAMINE B12 HORUS PHARMA 0,5 POUR MILLE, collyre en solution, il n'existe pas de données sur l'utilisation de ce médicament chez la femme enceinte ou qui allaite.
En conséquence l'utilisation de VITAMINE B12 HORUS PHARMA 0,5 POUR MILLE, collyre en solution se fera avec prudence chez la femme enceinte ou allaitante.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
La vision peut être brouillée pendant quelques minutes après l'instillation. Dans ce cas, il doit être recommandé au patient de ne pas conduire ni utiliser de machines jusqu'à ce que la vision normale soit rétablie.
Les effets indésirables sont classés par classes de systèmes d'organes et listés ci-dessous comme Très fréquent (≥1/10); Fréquent (≥1/100, <1/10); Peu fréquent (≥1/1,000, <1/100); Rare (≥1/10,000, <1/1,000); Très rare (<1/10,000) et fréquence indéterminée (ne peut être estimée sur la base des données disponibles):
Les effets indésirables suivants ont été rapportés après utilisation de VITAMINE B12 HORUS PHARMA 0,5 POUR MILLE, collyre en solution avec une fréquence indéterminée (ne peut être estimée sur la base des données disponibles):
Affections du système immunitaire
Réaction allergique.
Affections oculaires
Irritation passagère (picotement, brûlures).
Aucun cas de surdosage n'a été rapporté.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique: MEDICAMENT OPHTALMOLOGIQUE CICATRISANT, Code ATC: S01XA.
5.2. Propriétés pharmacocinétiques
Il n'existe pas d'étude pharmacocinétique contrôlée chez l'animal ou chez l'homme.
5.3. Données de sécurité préclinique
Les données non cliniques issues des études conventionnelles de pharmacologie de sécurité et de toxicologie en administration répétée n'ont pas révélé de risque particulier pour l'homme.
Chlorure de sodium, bromure de benzododécinium, édétate de sodium, hydroxyde de sodium ou acide chlorhydrique (pour ajuster le pH), eau purifiée.
Sans objet.
A utiliser dans les 30 jours après ouverture du flacon.
6.4. Précautions particulières de conservation
A conserver à une température ne dépassant pas 25°C.
Pour les conditions de conservation du médicament après ouverture, voir rubrique 6.3.
6.5. Nature et contenu de l'emballage extérieur
Flacon de 5 ml (polyéthylène).
6.6. Précautions particulières d’élimination et de manipulation
Pas d'exigences particulières.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
horus pharma
148 avenue Georges Guynemer
cap vAr
06700 saint-laurent-du-var
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 311 343-7 ou 34009 311 343 7 4: 1 flacon polyéthylène basse densité (PEBD) de 5 ml.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Sans objet.
Médicament non soumis à prescription médicale.
ANSM - Mis à jour le : 11/10/2013
VITAMINE B12 HORUS PHARMA 0,5 POUR MILLE, collyre en solution
Cyanocobalamine
Veuillez lire attentivement cette notice avant d'utiliser ce médicament. Elle contient des informations importantes pour votre traitement.
Si vous avez d'autres questions, si vous avez un doute, demandez plus d'informations à votre médecin ou à votre pharmacien.
· Gardez cette notice, vous pourriez avoir besoin de la relire.
· Si vous avez besoin de plus d'informations et de conseils, adressez-vous à votre pharmacien.
· Si les symptômes s'aggravent ou persistent, consultez un médecin.
· Si vous remarquez des effets indésirables non mentionnés dans cette notice, ou si vous ressentez un des effets mentionnés comme étant grave, veuillez en informer votre médecin ou votre pharmacien.
Dans cette notice :
1. QU'EST-CE QUE VITAMINE B12 HORUS PHARMA 0,5 POUR MILLE, collyre en solution ET DANS QUELS CAS EST-IL UTILISE ?
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D'UTILISER VITAMINE B12 HORUS PHARMA 0,5 POUR MILLE, collyre en solution ?
3. COMMENT UTILISER VITAMINE B12 HORUS PHARMA 0,5 POUR MILLE, collyre en solution ?
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
5. COMMENT CONSERVER VITAMINE B12 HORUS PHARMA 0,5 POUR MILLE, collyre en solution ?
6. INFORMATIONS SUPPLEMENTAIRES
1. QU'EST-CE QUE VITAMINE B12 HORUS PHARMA 0,5 POUR MILLE, collyre en solution ET DANS QUELS CAS EST-IL UTILISE ?
Ce médicament est un cicatrisant oculaire.
Ce médicament est préconisé comme traitement d'appoint des troubles de la cicatrisation cornéenne.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D'UTILISER VITAMINE B12 HORUS PHARMA 0,5 POUR MILLE, collyre en solution ?
Liste des informations nécessaires avant la prise du médicament
Sans objet.
N'utilisez jamais VITAMINE B12 HORUS PHARMA 0,5 POUR MILLE, collyre en solution:
si vous êtes allergique (hypersensible) à la substance active ou à l'un des autres composants contenus dans VITAMINE B12 HORUS PHARMA 0,5 POUR MILLE, collyre en solution.
Précautions d'emploi ; mises en garde spéciales
Faites attention avec VITAMINE B12 HORUS PHARMA 0,5 POUR MILLE, collyre en solution:
Evitez de toucher l'œil ou toute autre surface avec l'embout du flacon.
Si vous avez des lentilles de contact, il est déconseillé de les porter pendant toute la durée du traitement en raison de la coloration du collyre VITAMINE B12 HORUS PHARMA 0,5 POUR MILLE, collyre en solution.
Interactions avec d'autres médicaments
Prise ou utilisation d'autres médicaments
Si vous prenez ou avez pris récemment un autre médicament, y compris un médicament obtenu sans ordonnance, parlez-en à votre médecin ou à votre pharmacien.
Si vous devez mettre un autre collyre, espacez les 2 administrations de 15 minutes.
Interactions avec les aliments et les boissons
Sans objet.
Interactions avec les produits de phytothérapie ou thérapies alternatives
Sans objet.
Utilisation pendant la grossesse et l'allaitement
Grossesse et allaitement
Demandez conseil à votre médecin ou à votre pharmacien avant de prendre tout médicament.
Sans objet.
Effets sur l'aptitude à conduire des véhicules ou à utiliser des machines
Conduite de véhicules et utilisation de machines
Une gêne visuelle passagère peut être ressentie, en général, après utilisation d'un collyre dans l'œil.
Vous devez attendre que votre vision redevienne normale avant de conduire un véhicule ou d'utiliser une machine.
Liste des excipients à effet notoire
Sans objet.
3. COMMENT UTILISER VITAMINE B12 HORUS PHARMA 0,5 POUR MILLE, collyre en solution ?
Instructions pour un bon usage
Sans objet.
Posologie, Mode et/ou voie(s) d'administration, Fréquence d'administration et Durée du traitement
Posologie
Respectez toujours la posologie indiquée par votre médecin. En cas de doute, consultez votre médecin ou votre pharmacien.
La dose habituelle est de 1 goutte dans l'œil ou les yeux à traiter 3 à 4 fois par jour si nécessaire.
Mode d'administration
A utiliser dans les yeux seulement.
Pour une bonne utilisation du collyre, certaines précautions doivent être prises:
Se laver soigneusement les mains avant,
Ne pas toucher votre œil, les paupières ou d'autres surfaces avec l'extrémité du flacon,
Ne pas utiliser si le capuchon semble cassé avant usage,
Placez-vous devant un miroir.
|
|
|
|
|
1. Inclinez la tête légèrement en arrière et regardez en haut.
2. Avec un doigt propre, tirez doucement la paupière inférieure jusqu'à ce qu'il y ait une petite poche.
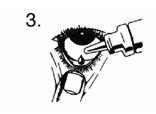
3. Retournez le flacon à l'envers et appuyez dessus pour en détacher 1 goutte dans l'œil à traiter.
4. Lâchez la paupière inférieure et fermez votre œil. Essuyez proprement l'excédent.
Si une goutte tombe à côté de votre œil, recommencez.
Si vous devez traiter les deux yeux, recommencez ces étapes pour l'autre œil.
Remettez le bouchon et refermez le flacon aussitôt après l'avoir utilisé.
Fréquence d'administration
Répartir les 3 ou 4 instillations au cours de la journée, en fonction des besoins.
Durée du traitement
Si les troubles persistent ou s'aggravent, consulter un médecin afin qu'il adapte votre traitement.
Symptômes et instructions en cas de surdosage
Si vous avez utilisé plus de VITAMINE B12 HORUS PHARMA 0,5 POUR MILLE, collyre en solution que vous n'auriez dû:
Consultez votre médecin ou votre pharmacien.
Instructions en cas d'omission d'une ou de plusieurs doses
Si vous oubliez d'utiliser VITAMINE B12 HORUS PHARMA 0,5 POUR MILLE, collyre en solution:
N'utilisez pas de dose double pour compenser la dose que vous avez oublié d'utiliser mais poursuivez simplement votre traitement.
Sans objet.
Si vous avez d'autres questions sur l'utilisation de ce médicament, demandez plus d'informations à votre médecin ou à votre pharmacien.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Description des effets indésirables
Comme tous les médicaments, VITAMINE B12 HORUS PHARMA 0,5 POUR MILLE, collyre en solution est susceptible d'avoir des effets indésirables, bien que tout le monde n'y soit pas sujet.
Les effets indésirables suivants ont été rapportés avec une fréquence indéterminée (ne peut être estimée sur la base des données disponibles):
Affections du système immunitaire
Réaction allergique.
Affections oculaires
Irritation passagère (picotement, brûlures).
Si vous remarquez des effets indésirables non mentionnés dans cette notice, ou si certains effets indésirables deviennent graves, veuillez en informer votre médecin ou pharmacien.
5. COMMENT CONSERVER VITAMINE B12 HORUS PHARMA 0,5 POUR MILLE, collyre en solution ?
Tenir hors de la portée et de la vue des enfants.
Ne pas utiliser VITAMINE B12 HORUS PHARMA 0,5 POUR MILLE, collyre en solution après la date de péremption mentionnée sur la boîte ou le flacon après EXP. La date d'expiration fait référence au dernier jour du mois.
A conserver à une température ne dépassant pas 25°C.
Tout flacon entamé doit être utilisé dans les 30 jours.
Si nécessaire, mises en garde contre certains signes visibles de détérioration
Les médicaments ne doivent pas être jetés au tout-à-l'égout ou avec les ordures ménagères. Demandez à votre pharmacien ce qu'il faut faire des médicaments inutilisés. Ces mesures permettront de protéger l'environnement.
6. INFORMATIONS SUPPLEMENTAIRES
Liste complète des substances actives et des excipients
Que contient VITAMINE B12 HORUS PHARMA 0,5 POUR MILLE, collyre en solution ?
La substance active est: la cyanocobalamine (vitamine B12).
Les autres composants sont: le chlorure de sodium, le bromure de benzododécinium, l'edétate de sodium, l'hydroxyde de sodium ou l'acide chlorhydrique (pour ajuster le pH), l'eau purifiée.
Forme pharmaceutique et contenu
Qu'est-ce que VITAMINE B12 HORUS PHARMA 0,5 POUR MILLE, collyre en solution et contenu de l'emballage extérieur ?
C'est un collyre en solution limpide, rose.
Chaque boîte contient 1 flacon en plastique de 5 ml.
Nom et adresse du titulaire de l'autorisation de mise sur le marché et du titulaire de l'autorisation de fabrication responsable de la libération des lots, si différent
horus pharma
148 avenue Georges Guynemer
cap vAr
06700 saint-laurent-du-var
HORUS PHARMA
148 avenue Georges Guynemer
Cap Var
06700 SAINT-LAURENT DU VAR
ALLERGAN PHARMACEUTICALS IRELAND
WESTPORT
CO. MAYO
IRLANDE
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Sans objet.
Date d’approbation de la notice
La dernière date à laquelle cette notice a été approuvée est le {date}.
AMM sous circonstances exceptionnelles
Sans objet.
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’Afssaps (France).
Informations réservées aux professionnels de santé
Sans objet.
Sans objet.