Dernière mise à jour le 02/02/2026
EFFERALGANMED PEDIATRIQUE 30 mg/ml, solution buvable
Indications thérapeutiques
Classe pharmacothérapeutique : AUTRES ANTALGIQUES ET ANTIPYRÉTIQUES-ANILIDES - code ATC : N02BE01.
Il est indiqué en cas de douleur et/ou fièvre telles que maux de tête, états grippaux, douleurs dentaires, courbatures.
Cette présentation est réservée à l’enfant de 3 à 32 kg (environ de la naissance à 12 ans) : lire attentivement la rubrique Posologie.
Pour les enfants ayant un poids différent, il existe d'autres présentations de paracétamol : demandez conseil à votre médecin ou à votre pharmacien.
Vous devez vous adresser à votre médecin si vous ne ressentez aucune amélioration ou si vous vous sentez moins bien après 3 jours, en cas de fièvre ou 5 jours en cas de douleur.
Présentations
> 1 flacon(s) polyéthylène téréphtalate avec fermeture de sécurité enfant de 150 ml avec cuillère doseuse en polystyrène
Code CIP : 377 843-8 ou 34009 377 843 8 2
Déclaration d'arrêt de commercialisation : 30/06/2024
Cette présentation n'est pas agréée aux collectivités
- Prix hors honoraire de dispensation : 2,10 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 3,12 €
- Taux de remboursement :65%
> 1 flacon(s) polyéthylène téréphtalate avec fermeture de sécurité enfant de 90 ml et avec seringue doseuse pour administration orale polyéthylène polystyrène
Code CIP : 34009 301 455 8 6
Déclaration de commercialisation : 04/09/2019
Cette présentation est agréée aux collectivités
- Prix hors honoraire de dispensation : 1,38 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 2,40 €
- Taux de remboursement :65%
Documents de bon usage du médicament
- Prise en charge de la fièvre chez l’enfant
Auteur : Haute autorité de santé
Type : Fiche mémo
Date de mise à jour :Octobre 2016
- Prise en charge médicamenteuse de la douleur chez l'enfant : alternatives à la codéine
Auteur : Haute autorité de santé
Type : Fiche mémo
Date de mise à jour :Février 2016
Service médical rendu (SMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Important | Avis du 24/04/2024 | Extension d'indication | Le service médical rendu par EFFERALGANMED 30 mg, solution buvable est important dans l’indication de l’AMM. |
| Important | Avis du 13/06/2018 | Inscription (CT) | Le service médical rendu par d’EFFERALGANMED PEDIATRIQUE 30 mg/ml, solution buvable est important dans l’indication de l’AMM. |
| Important | Avis du 11/10/2017 | Inscription (CT) | Le service médical rendu par DAFALGAN PEDIATRIQUE 3 POUR CENT, solution buvable est important dans l’indication de l’AMM. |
| Important | Avis du 01/04/2015 | Renouvellement d'inscription (CT) | Le service médical rendu par les spécialités DAFALGAN et EFFERALGAN reste important dans les indications de l’AMM. |
Amélioration du service médical rendu (ASMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprés de la HAS (plus d'informations dans l'aide). Les avis et synthéses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur de l'ASMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| V (Inexistant) | Avis du 13/06/2018 | Inscription (CT) | Cette spécialité est un complément de gamme qui n’apporte pas d’amélioration du service médical rendu (ASMR V) par rapport à la présentation déjà inscrite. |
| V (Inexistant) | Avis du 11/10/2017 | Inscription (CT) | Cette spécialité est un complément de gamme qui n’apporte pas d’amélioration du service médical rendu (ASMR V) par rapport à la présentation déjà inscrite. |
ANSM - Mis à jour le : 19/12/2023
EFFERALGANMED PEDIATRIQUE 30 mg/ml, solution buvable
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Pour 100 ml de solution buvable.
Excipients à effet notoire : saccharose, et dans l’arôme, 6,9 mg/kg/jour de propylène glycol (E1520).
Pour la liste complète des excipients, voir rubrique 6.1.
4.1. Indications thérapeutiques
Traitement symptomatique des douleurs d'intensité légère à modérée et/ou des états fébriles.
Cette présentation est RESERVEE A L'ENFANT de 3 à 32 kg (environ de la naissance à 12 ans).
4.2. Posologie et mode d'administration
La plus faible dose efficace doit généralement être utilisée, pour la durée la plus courte possible.
Population pédiatrique
Chez l'enfant, Il est impératif de respecter les posologies définies en fonction du poids de l'enfant et donc de choisir une présentation adaptée. Les âges approximatifs en fonction du poids sont donnés à titre d'information.
La dose quotidienne de paracétamol recommandée est d'environ 60 mg/kg/jour, à répartir en 4 prises, soit environ 15 mg/kg toutes les 6 heures.
Le système doseur est gradué en kg, avec mention des poids 3-4-6-8-10-12-14-16 kg. Les autres graduations correspondent aux poids intermédiaires 5-7-9-11-13-15 kg. Il permet d’administrer 15 mg/kg/prise. Cette dose peut être renouvelée en cas de besoin au bout de 6 heures, sans dépasser 4 prises par jour.
La dose à administrer pour une prise est donc obtenue en remplissant le système doseur jusqu’à la graduation correspondant au poids de l’enfant (voir rubrique 6.6).
· de 3 kg à 16 kg : remplir le système doseur jusqu'à la graduation correspondant au poids de l'enfant ou jusqu'à celle s'en approchant le plus. La prise peut être renouvelée en cas de besoin au bout de 6 heures.
Par exemple, pour un enfant de 3 à 3,5 kg : remplir le système doseur jusqu'à la graduation 3 kg.
Par exemple, pour un enfant au-delà de 3,5 jusqu’à 4 kg : remplir le système doseur jusqu'à la graduation 4 kg.
· de 16 kg à 32 kg : remplir une première fois le système doseur puis compléter en remplissant le système doseur une 2ème fois jusqu'à obtenir le poids de l'enfant. La prise peut être renouvelée en cas de besoin au bout de 6 heures.
Par exemple, pour un enfant de 18 kg : remplir une première fois le système doseur jusqu'à la graduation 10 kg puis remplir une 2ème fois jusqu'à la graduation 8 kg.
Doses maximales recommandées : voir rubrique 4.4
Attention : prendre en compte l'ensemble des médicaments pour éviter un surdosage, y compris si ce sont des médicaments obtenus sans prescription (voir rubrique 4.4).
Insuffisance rénale
En cas d'insuffisance rénale et sauf avis médical, il est recommandé de réduire la dose et d’augmenter l’intervalle minimum entre 2 prises selon le tableau suivant :
|
Clairance de la créatinine |
Intervalle d’administration |
|
>10 ml/min |
6 heures |
|
<10 ml/min |
8 heures |
La dose totale de paracétamol ne doit pas excéder 60 mg/kg/jour (sans dépasser 3 g/j).
Insuffisance hépatique
Chez les patients présentant une insuffisance hépatocellulaire ou un syndrome de Gilbert (jaunisse familiale non hémolytique), il est recommandé de réduire la dose et d’augmenter l’intervalle minimum entre deux prises. La dose journalière de paracétamol ne doit pas dépasser 60 mg/kg/jour (sans dépasser 3 g/j).
Situations cliniques particulières
La dose totale quotidienne maximale de paracétamol ne doit pas excéder 60 mg/kg/jour (sans dépasser 3 g/j) dans les situations suivantes :
· adulte de moins de 50 kg,
· alcoolisme chronique,
· malnutrition (réserves basses en glutathion hépatique),
· déshydratation.
Mode d’administration
Voie orale.
La solution peut être bue pure ou diluée dans une petite quantité de boisson (par exemple eau, lait, jus de fruit).
Hypersensibilité à la substance active ou à l’un des excipients mentionnés à la rubrique 6.1.
Insuffisance hépatocellulaire sévère.
4.4. Mises en garde spéciales et précautions d'emploi
Pour éviter un risque de surdosage :
· vérifier l'absence de paracétamol dans la composition d'autres médicaments (médicaments obtenus avec ou sans prescription),
· respecter les doses maximales recommandées.
Doses maximales recommandées :
La dose totale quotidienne maximale de paracétamol ne doit pas excéder 80 mg/kg/jour chez l’enfant de moins de 37 kg (voir rubrique 4.9). Il existe des spécialités adaptées aux enfants de plus de 32 kg qui doivent être utilisées.
A titre d’information, la dose totale quotidienne maximale de paracétamol ne doit pas excéder (voir rubrique 4.9) :
· 3 g par jour chez l'enfant de 38 kg à 50 kg,
· 4 g par jour chez l'adulte et l'enfant de plus de 50 kg.
Le paracétamol peut provoquer des réactions cutanées graves. Les patients doivent être informés des signes précoces de ces réactions cutanées graves, l'apparition d'une éruption cutanée ou de tout autre signe d'hypersensibilité impose l’arrêt du traitement.
Précautions d’emploi
Le paracétamol est à utiliser avec précaution en cas :
o d’insuffisance hépatocellulaire légère à modérée (voir rubrique 4.2),
o d’insuffisance rénale (voir rubrique 4.2),
o de syndrome de Gilbert (jaunisse familiale non hémolytique) (voir rubrique 4.2),
o d’alcoolisme chronique (voir rubrique 4.2),
o d’anorexie ou de cachexie,
o de malnutrition chronique (réserves basses en glutathion hépatique) (voir rubrique 4.2),
o de déshydratation (voir rubrique 4.2).
En cas de découverte d'une hépatite virale aigüe, il convient d'arrêter le traitement.
Chez un enfant traité par du paracétamol, l'association d'un autre médicament utilisé pour faire baisser la fièvre (antipyrétique) n'est justifiée qu'en cas d'inefficacité. L’association ne doit être instaurée et surveillée que par un médecin.
Ce médicament contient du saccharose. Les patients présentant une intolérance au fructose, un syndrome de malabsorption du glucose et du galactose ou un déficit en sucrase/isomaltase (maladies héréditaires rares) ne doivent pas prendre ce médicament.
Ce médicament contient moins d’1 mmol (23 mg) de sodium par prise, c.-à-d. qu’il est essentiellement « sans sodium ».
Ce médicament contient 6,9 mg/kg/jour de propylène glycol (E1520). L’administration concomitante avec n’importe quel substrat pour l’alcool déshydrogénase comme l’éthanol peut induire des effets indésirables graves chez les nouveau-nés.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Associations faisant l'objet de précautions d'emploi
Risque d'augmentation de l'effet de l'antivitamine K et du risque hémorragique en cas de prise de paracétamol aux doses maximales (4 g/j) pendant au moins 4 jours.
Contrôle plus fréquent de l'INR. Adaptation éventuelle de la posologie de l'antivitamine K pendant le traitement par le paracétamol et après son arrêt.
+ Flucloxacilline
La prudence est recommandée lorsque le paracétamol est administré de façon concomitante avec la flucloxacilline en raison du risque accru d'acidose métabolique à trou anionique élevé (AMTAE), en particulier chez les patients présentant un facteur de risque de déficit en glutathion tel qu’une insuffisance rénale sévère, un sepsis, une malnutrition ou un alcoolisme chronique. Une surveillance étroite est recommandée afin de détecter l’apparition d’AMTAE, par la recherche de la 5-oxoproline urinaire.
Interactions avec les examens paracliniques
La prise de paracétamol peut fausser le dosage de la glycémie par la méthode à la glucose oxydase- peroxydase en cas de concentrations anormalement élevées.
La prise de paracétamol peut fausser le dosage de l'acide urique sanguin par la méthode à l'acide phosphotungstique.
4.6. Fertilité, grossesse et allaitement
Grossesse
Les études effectuées chez l’animal n’ont pas mis en évidence d’effet tératogène ou foetotoxique du paracétamol.
Une vaste quantité de données portant sur les femmes enceintes démontrent l’absence de toute malformation ou de toute toxicité fœtale/néonatale. Les études épidémiologiques consacrées au neurodéveloppement des enfants exposés au paracétamol in utero produisent des résultats non concluants. Si cela s’avère nécessaire d’un point de vue clinique, le paracétamol peut être utilisé pendant la grossesse ; cependant, il devra être utilisé à la dose efficace la plus faible, pendant la durée la plus courte possible et à la fréquence la plus réduite possible.
Aux doses thérapeutiques, l'administration de ce médicament est possible pendant l'allaitement.
Fertilité
En raison du mécanisme d’action potentiel sur les cyclo-oxygénases et la synthèse de prostaglandines, le paracétamol pourrait altérer la fertilité chez la femme, par un effet sur l’ovulation réversible à l’arrêt du traitement.
Des effets sur la fertilité des mâles ont été observés dans une étude chez l'animal. La pertinence de ces effets chez l'homme n'est pas connue.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Les effets indésirables sont classés par système-organe. Leurs fréquences sont définies de la façon suivante :
· Très fréquent (≥ 1/10)
· Fréquent (≥ 1/100 à < 1/10)
· Peu fréquent (≥ 1/1 000 à < 1/100)
· Rare (≥ 1/10 000 à < 1/1 000)
· Très rare (< 1/10 000)
· Fréquence indéterminée (ne peut être estimée sur la base des données disponibles)
Affections du système immunitaire
Rares : réactions d'hypersensibilité à type de choc anaphylactique, œdème de Quincke, érythème, urticaire, rash cutané, purpura. Leur survenue impose l'arrêt définitif de ce médicament et des médicaments apparentés.
Affections de la peau et du tissu sous-cutané
Très rares : réactions cutanées graves. Leur survenue impose l’arrêt du traitement.
Affections hématologiques et du système lymphatique
Très rares : thrombopénie, leucopénie et neutropénie.
Un risque de déséquilibre de l’INR peut survenir en cas d’association d’un AVK et de paracétamol à dose maximale (4g/j) pendant une durée de 4 jours minimum (voir rubrique 4.5).
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/.
Symptômes
Nausées, vomissements, anorexie, pâleur, malaise, sudation, douleurs abdominales apparaissent généralement dans les 24 premières heures.
Un surdosage, à partir de 10 g de paracétamol en une seule prise chez l'adulte et 150 mg/kg de poids corporel en une seule prise chez l'enfant, provoque une cytolyse hépatique susceptible d'aboutir à une nécrose complète et irréversible se traduisant par une insuffisance hépatocellulaire, une acidose métabolique, une encéphalopathie pouvant aller jusqu'au coma et à la mort.
Simultanément, on observe une augmentation des transaminases hépatiques, de la lacticodéshydrogénase, de la bilirubine et une diminution du taux de prothrombine pouvant apparaître 12 à 48 heures après l'ingestion. Les symptômes cliniques de l’atteinte hépatique sont généralement observés après 1 à 2 jours, et atteignent un maximum après 3 à 4 jours.
Le surdosage peut également entrainer une pancréatite aiguë, une hyperamylasémie.
Conduite d'urgence
· Arrêter le traitement.
· Transfert immédiat en milieu hospitalier.
· Prélever un tube de sang pour faire le dosage plasmatique initial de paracétamol dès que possible à partir de la 4ème heure après l'ingestion.
· Evacuation rapide du produit ingéré, par lavage gastrique.
· Le traitement du surdosage comprend classiquement l'administration aussi précoce que possible de l'antidote N-acétylcystéine par voie I.V. ou voie orale si possible avant la dixième heure.
· Traitement symptomatique.
· Des tests hépatiques doivent être effectués au début du traitement et répétés toutes les 24 heures. Dans la plupart des cas, les transaminases hépatiques reviennent à la normale en 1 à 2 semaines avec une restitution intégrale de la fonction hépatique. Cependant, dans les cas très graves, une transplantation hépatique peut être nécessaire.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : AUTRES ANALGESIQUES ET ANTIPYRETIQUES-ANILIDES, code ATC : N02BE01.
N : Système nerveux central.
Mécanisme d’action
Le paracétamol a un mécanisme d'action central et périphérique.
5.2. Propriétés pharmacocinétiques
L'absorption du paracétamol par voie orale est complète et rapide. Les concentrations plasmatiques maximales sont atteintes 30 à 60 minutes après ingestion.
Distribution
Le paracétamol se distribue rapidement dans tous les tissus. Les concentrations sont comparables dans le sang, la salive et le plasma. La liaison aux protéines plasmatiques est faible.
Biotransformation
Le paracétamol est métabolisé essentiellement au niveau du foie. Les 2 voies métaboliques majeures sont la glycuroconjugaison et la sulfoconjugaison. Cette dernière voie est rapidement saturable aux posologies supérieures aux doses thérapeutiques. Une voie mineure, catalysée par le cytochrome P 450, est la formation d'un intermédiaire réactif (le N-acétyl benzoquinone imine), qui, dans les conditions normales d'utilisation, est rapidement détoxifié par le glutathion réduit et éliminé dans les urines après conjugaison à la cystéine et à l'acide mercaptopurique.
En revanche, lors d'intoxications massives, la quantité de ce métabolite toxique est augmentée.
Élimination
L'élimination est essentiellement urinaire. 90 % de la dose ingérée est éliminée par le rein en 24 heures, principalement sous forme glycuroconjuguée (60 à 80 %) et sulfoconjuguée (20 à 30 %). Moins de 5 % est éliminé sous forme inchangée.
La demi-vie d'élimination est d'environ 2 heures.
Variations physiopathologiques
Insuffisance rénale : en cas d'insuffisance rénale (voir rubrique 4.2), l'élimination du paracétamol et de ses métabolites est retardée.
5.3. Données de sécurité préclinique
Aucune étude conventionnelle s’appuyant sur les normes actuellement admises pour évaluer la toxicité pour la reproduction et le développement n’est disponible.
A des doses hépatotoxiques, le paracétamol a démontré un potentiel génotoxique et carcinogène (tumeurs au niveau du foie et de la vessie), chez la souris et le rat. Cependant, cette activité génotoxique et carcinogène est considérée comme liée aux modifications du métabolisme du paracétamol lors de l'administration de doses ou de concentrations élevées et ne présente pas de risque pour l'utilisation clinique.
Chez le rat, des effets sur la fertilité chez le mâle (oligospermie, motilité spermatique anormale et diminution du potentiel fertilisant des spermatozoïdes) à forte dose (500 et 1000 mg/kg de poids corporel par jour) ont été observés.
Après la première ouverture du flacon : 6 mois.
6.4. Précautions particulières de conservation
A conserver à une température ne dépassant pas 25°C.
6.5. Nature et contenu de l'emballage extérieur
Flacon 90 ml avec cuillère doseuse :
Flacon en polyéthylène téréphtalate brun de 90 ml muni d'un bouchon sécurité-enfant (child proof) en polyéthylène basse densité.
Système doseur (cuillère doseuse) en polystyrène gradué en kg de poids de l'enfant à 3 kg, 4 kg, 6 kg, 8 kg, 10 kg, 12 kg, 14 kg et 16 kg correspondant à une prise de 15 mg de paracétamol par kg de poids de l'enfant.
Un flacon de 90 ml permet d’administrer 180 doses de 15 mg (voir rubrique 4.2).
Flacon 90 ml avec seringue d’administration orale :
Flacon en polyéthylène téréphtalate brun de 90 mL muni d'un bouchon sécurité-enfant (child proof) en polyéthylène basse densité.
Système doseur (seringue d’administration orale), avec un corps en polyéthylène et un piston en polystyrène, gradué en kg de poids de l'enfant à 3 kg, 4 kg, 6 kg, 8 kg, 10 kg, 12 kg, 14 kg et 16 kg correspondant à une prise de 15 mg de paracétamol par kg de poids de l'enfant.
Un flacon de 90 ml permet d’administrer 180 doses de 15 mg (voir rubrique 4.2).
Flacon 150 ml avec cuillère doseuse :
Flacon en polyéthylène téréphtalate brun de 150 ml muni d'un bouchon sécurité-enfant (child proof) en polyéthylène basse densité.
Système doseur (cuillère doseuse) en polystyrène gradué en kg de poids de l'enfant à 3 kg, 4 kg, 6 kg, 8 kg, 10 kg, 12 kg, 14 kg et 16 kg correspondant à une prise de 15 mg de paracétamol par kg de poids de l'enfant.
Un flacon de 150 ml permet d’administrer 300 doses de 15 mg (voir rubrique 4.2).
6.6. Précautions particulières d’élimination et de manipulation
Flacon 90 ml/150 ml avec cuillère doseuse :
· Vérifier l’état de la cuillère doseuse et la lisibilité des graduations avant chaque utilisation.
· Ne pas utiliser en cas de constat d’une altération de la matière constitutive ou de la forme (matière fissurée ou manquante) de la cuillère. Informer les patients d’aller consulter leur pharmacien en cas de doute.
· Ne pas utiliser la cuillère doseuse en cas d’allergie connue au polystyrène.
· La cuillère doseuse doit être propre lors de son utilisation.
· Nettoyer la cuillère doseuse avant chaque utilisation.
· Si la cuillère doseuse a été égarée, ne pas utiliser d’autres types de cuillères.
· Pour ouvrir le flacon, il faut tourner le bouchon sécurité‑enfant en appuyant.
· La dose à administrer pour une prise est obtenue en remplissant la cuillère doseuse (1) jusqu’à la graduation correspondant au poids de l’enfant (2), selon le schéma ci-dessous (voir rubrique 4.2) :

· Remplir la cuillère doseuse jusqu’au volume prescrit en alignant le niveau du médicament à la graduation.
· Délivrer la totalité du volume dosé.
ATTENTION : incliner progressivement la cuillère doseuse lors de l’administration afin d’adapter le débit à la déglutition du patient.
· Ne pas introduire trop profondément la cuillère doseuse dans la bouche du patient.
· Après chaque utilisation, refermer le flacon de la solution buvable.
· La cuillère doseuse doit être nettoyée manuellement, sans outil abrasif, à l’eau tiède (30°C max) savonneuse.
· Elle doit être parfaitement séchée avant une nouvelle utilisation.
· Ne pas mordre la cuillère doseuse.
Flacon 90 ml avec seringue d’administration orale :
· Vérifier que la seringue n’est pas endommagée et bien nettoyée.
· Ne pas utiliser la seringue si elle a été mal nettoyée ou détériorée.
· Ne pas utiliser la seringue en cas d’allergie connue au polyéthylène polystyrène.
· Pour ouvrir le flacon, il faut tourner le bouchon sécurité‑enfant en appuyant.
· Plonger la seringue dans le flacon en ayant vérifié que le piston soit bien enfoncé.
· Un trait de butée est disposé sur le bas du piston et le haut du corps de la seringue, afin de bloquer les 2 éléments et éviter qu'ils ne se séparent lors de l'utilisation de la seringue. Les traits de butée ne servent pas à la mesure de la dose.
· La dose à administrer pour une prise est obtenue en tirant le piston (1) jusqu’à la graduation correspondant au poids de l’enfant (2), selon le schéma ci-dessous (voir rubrique 4.2) :
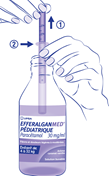
· Libérer le contenu de la seringue dans la bouche de l’enfant en appliquant une poussée lente et régulière sur le piston.
· Après chaque utilisation, refermer le flacon de la solution buvable.
· Séparer les deux parties de la seringue (corps et piston), les laver manuellement à l’eau jusqu’à disparition des résidus médicamenteux. La température de lavage ne doit pas excéder 50°C : ne pas laver au lave-vaisselle, ne pas faire bouillir.
· Sécher à l’air libre.
· Assembler le corps et le piston lorsqu’ils sont complètement secs.
Ranger immédiatement le système doseur dans sa boîte dans un endroit inaccessible aux enfants.
Ne jamais séparer le système doseur des autres éléments de conditionnement du médicament (flacon, boîte, notice).
L’usage du système doseur est strictement réservé à l’administration d’EFFERALGANMED PEDIATRIQUE 30 mg/ml, solution buvable.
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur. Le système doseur doit être éliminé en même temps que le contenant du médicament.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
3, RUE JOSEPH MONIER
92500 RUEIL-MALMAISON
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 301 455 8 6 : 90 ml en flacon (polyéthylène téréphtalate) + système doseur (seringue d’administration orale avec un corps en polyéthylène et un piston en polystyrène).
· 34009 377 843 8 2 : 150 ml en flacon (polyéthylène téréphtalate) + système doseur (cuillère doseuse en polystyrène).
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Médicament non soumis à prescription médicale.
ANSM - Mis à jour le : 19/12/2023
EFFERALGANMED pediatrique 30 mg/ml, solution buvable
Paracétamol
Vous devez toujours prendre ce médicament en suivant scrupuleusement les informations fournies dans cette notice ou par votre médecin, votre pharmacien ou votre infirmier/ère.
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Adressez-vous à votre pharmacien pour tout conseil ou information.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, votre pharmacien ou votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
· Vous devez vous adresser à votre médecin si vous ne ressentez aucune amélioration ou si vous vous sentez moins bien après 3 jours en cas de fièvre ou 5 jours en cas de douleur.
2. Quelles sont les informations à connaître avant de prendre EFFERALGANMED pediatrique 30 mg/ml, solution buvable ?
3. Comment prendre EFFERALGANMED pediatrique 30 mg/ml, solution buvable ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver EFFERALGANMED pediatrique 30 mg/ml, solution buvable ?
6. Contenu de l’emballage et autres informations
1. QU’EST-CE QUE EFFERALGANMED pediatrique 30 mg/ml, solution buvable ET DANS QUELS CAS EST-IL UTILISE ?
Classe pharmacothérapeutique : AUTRES ANTALGIQUES ET ANTIPYRÉTIQUES-ANILIDES - code ATC : N02BE01.
Il est indiqué en cas de douleur et/ou fièvre telles que maux de tête, états grippaux, douleurs dentaires, courbatures.
Cette présentation est réservée à l’enfant de 3 à 32 kg (environ de la naissance à 12 ans) : lire attentivement la rubrique Posologie.
Pour les enfants ayant un poids différent, il existe d'autres présentations de paracétamol : demandez conseil à votre médecin ou à votre pharmacien.
Vous devez vous adresser à votre médecin si vous ne ressentez aucune amélioration ou si vous vous sentez moins bien après 3 jours, en cas de fièvre ou 5 jours en cas de douleur.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT DE PRENDRE EFFERALGANMED pediatrique 30 mg/ml, solution buvable ?
Ne prenez jamais EFFERALGANMED pediatrique 30 mg/ml, solution buvable :
· si vous avez une maladie grave du foie.
EN CAS DE DOUTE, IL EST INDISPENSABLE DE DEMANDER L'AVIS DE VOTRE MEDECIN OU DE VOTRE PHARMACIEN.
Avertissements et précautions
Adressez-vous à votre médecin ou pharmacien avant de prendre EFFERALGANMED pediatrique 30 mg/ml, solution buvable.
En cas de surdosage ou de prise par erreur d'une dose trop élevée, consultez immédiatement votre médecin.
Ce médicament contient du paracétamol. D'autres médicaments en contiennent.
Vérifiez que vous ne prenez pas d’autres médicaments contenant du paracétamol, y compris si ce sont des médicaments obtenus sans prescription.
Ne les associez pas, afin de ne pas dépasser la dose quotidienne recommandée (voir rubrique 3 « Comment prendre EFFERALGANMED PEDIATRIQUE 30 mg/ml, solution buvable »).
· Si la douleur persiste plus de 5 jours ou la fièvre plus de 3 jours, ou en cas d'efficacité insuffisante ou de survenue de tout autre signe, ne pas continuer le traitement sans l'avis de votre médecin.
Informez votre médecin ou votre pharmacien avant de prendre ce médicament si une des conditions suivantes s'applique à vous :
· Si vous avez une maladie du foie ou des reins,
· Si vous êtes atteint(e) du syndrome de Gilbert (jaunisse familiale non hémolytique),
· Ou en cas d’abus d’alcool,
· Si vous avez des problèmes de nutrition (malnutrition) (réserves basses en glutathion hépatique), anorexie ou cachexie (perte de poids importante),
· Si vous êtes déshydraté,
· Si vous souffrez d’une hépatite virale aiguë ou en cas de découverte d’une hépatite virale aiguë pendant votre traitement avec EFFERALGANMED pediatrique 30 mg/ml, solution buvable, parlez-en à votre médecin. Votre traitement pourrait être suspendu par votre médecin.
EN CAS DE DOUTE, NE PAS HESITER A DEMANDER L'AVIS DE VOTRE MEDECIN OU DE VOTRE PHARMACIEN.
Enfants et adolescents
Chez un enfant traité par du paracétamol, l'association d'un autre médicament utilisé pour faire baisser la fièvre (antipyrétique) n'est justifiée qu'en cas d'inefficacité. L’association ne doit être instaurée et surveillée que par un médecin.
Autres médicaments et EFFERALGANMED pediatrique 30 mg/ml, solution buvable
Informez votre médecin ou pharmacien si vous prenez, avez récemment pris ou pourriez prendre tout autre médicament.
Vous devez contacter votre médecin si vous prenez un médicament qui ralentit la coagulation (anticoagulants oraux). A fortes doses, EFFERALGANMED pediatrique 30 mg/ml, solution buvable peut augmenter l'action de votre anticoagulant. Si nécessaire, votre médecin adaptera la posologie de votre anticoagulant.
Vous devez contacter votre médecin si vous prenez de la flucloxacilline (antibiotique de la classe des pénicillines) en raison du risque accru d’acidose métabolique, en particulier si vous présentez un facteur de risque de déficit en glutathion tel qu’une insuffisance rénale sévère, un sepsis (infection générale grave de l'organisme par des germes pathogènes), une malnutrition ou un alcoolisme chronique.
Signalez que vous ou votre enfant prenez ce médicament si votre médecin vous prescrit à vous ou à lui, un dosage du taux d'acide urique ou du sucre dans le sang.
EFFERALGANMED pediatrique 30 mg/ml, solution buvable avec des aliments, boissons et de l’alcool
L'absorption d'alcool pendant le traitement est déconseillée.
Grossesse, allaitement et fertilité
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin ou pharmacien avant de prendre ce médicament.
A titre informatif : Au besoin, EFFERALGANMED pédiatrique 30 mg/ml, solution buvable peut être utilisé pendant la grossesse et l’allaitement. Vous devez utiliser la dose la plus faible possible qui permette de soulager la douleur et/ou la fièvre et la prendre pendant la durée la plus courte possible. Contactez votre médecin si la douleur et/ou la fièvre ne diminuent pas ou si vous devez prendre le médicament plus fréquemment.
Il est possible que le paracétamol puisse altérer la fertilité des femmes, de façon réversible à l’arrêt du traitement.
Conduite de véhicules et utilisation de machines
Le paracétamol n’a aucun effet ou qu’un effet négligeable sur l’aptitude à conduire des véhicules et à utiliser des machines.
EFFERALGANMED PEDIATRIQUE 30 mg/ml, solution buvable contient du saccharose, du sodium, et dans l’arôme, du propylène glycol (E1520).
Ce médicament contient du saccharose. Si votre médecin vous a informé(e) que vous avez une intolérance à certains sucres, contactez-le avant de prendre ce médicament.
Ce médicament contient moins de 1 mmol (23 mg) de sodium par prise, c.-à-d. qu’il est essentiellement « sans sodium ».
Ce médicament contient 6,9 mg/kg/jour de propylène glycol (E1520). Si votre bébé a moins de 4 semaines, demandez à votre médecin ou à votre pharmacien avant de lui administrer ce médicament, en particulier si le bébé reçoit d’autres médicaments contenant du propylène glycol ou de l’alcool.
3. COMMENT PRENDRE EFFERALGANMED pediatrique 30 mg/ml, solution buvable ?
Veillez à toujours prendre ce médicament en suivant exactement les instructions de cette notice ou les indications de votre médecin ou pharmacien. Vérifiez auprès de votre médecin ou pharmacien en cas de doute.
Posologie
Cette présentation est réservée à l’enfant de 3 à 32 kg (environ de la naissance à 12 ans).
La plus faible dose efficace doit généralement être utilisée, pour la durée la plus courte possible.
La posologie du paracétamol dépend du poids de l'enfant ; les âges sont mentionnés à titre d'information.
Si vous ne connaissez pas le poids de l'enfant, il faut le peser afin de lui donner la dose la mieux adaptée.
Le paracétamol existe sous de nombreux dosages, permettant d'adapter le traitement au poids de chaque enfant.
La dose quotidienne de paracétamol maximale recommandée dépend du poids de l'enfant : sans avis médical, elle est d'environ 60 mg/kg par jour, à répartir en 4 prises par jour, soit environ 15 mg/kg toutes les 6 heures.
Le système doseur est gradué en kg, avec mention des poids 3-4-6-8-10-12-14-16 kg. Les autres graduations correspondent aux poids intermédiaires 5-7-9-11-13-15 kg. Il permet d’administrer 15 mg/kg/prise. Cette dose peut être renouvelée en cas de besoin au bout de 6 heures, sans dépasser 4 prises par jour.
Flacon 90 ml/150 ml avec cuillère doseuse :
La dose à administrer pour une prise est donc obtenue en remplissant la cuillère doseuse (1) jusqu’à la graduation correspondant au poids de l’enfant (2), selon le schéma et les indications ci-dessous :

Flacon 90 ml avec seringue d’administration orale :
La dose à administrer pour une prise est donc obtenue en tirant le piston (1) jusqu’à la graduation correspondant au poids de l’enfant (2), selon le schéma et les indications ci-dessous :
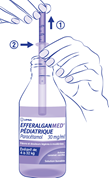
· de 3 kg à 16 kg : remplir le système doseur jusqu'à la graduation correspondant au poids de l'enfant ou jusqu'à celle s'en approchant le plus. La prise peut être renouvelée en cas de besoin au bout de 6 heures.
Par exemple, pour un enfant de 3 à 3,5 kg : remplir le système doseur jusqu'à la graduation 3 kg.
Par exemple, pour un enfant au-delà de 3,5 jusqu’à 4 kg : remplir le système doseur jusqu'à la graduation 4 kg.
· de 16 kg à 32 kg : remplir une première fois le système doseur puis compléter en remplissant le système doseur une 2ème fois jusqu'à obtenir le poids de l'enfant. La prise peut être renouvelée en cas de besoin au bout de 6 heures.
Par exemple, pour un enfant de 18 kg : remplir une première fois le système doseur jusqu'à la graduation 10 kg puis compléter en remplissant une 2ème fois le système doseur jusqu'à la graduation 8 kg.
Attention : Pour éviter un risque de surdosage, vérifiez l'absence de paracétamol dans la composition d'autres médicaments, y compris pour les médicaments obtenus sans ordonnance.
Si vous avez l'impression que l'effet de EFFERALGANMED PEDIATRIQUE 30 mg/ml, solution buvable est trop fort ou trop faible, consultez votre médecin ou votre pharmacien.
EN CAS DE DOUTE, DEMANDEZ CONSEIL A VOTRE MEDECIN OU A VOTRE PHARMACIEN.
Patients insuffisants rénaux, insuffisants hépatiques, syndrome de Gilbert (jaunisse familiale non hémolytique)
Veillez à toujours prendre ce médicament en suivant exactement les indications de votre médecin. Vérifiez auprès de votre médecin ou votre pharmacien en cas de doute.
Durée du traitement
Sauf avis médical, la durée du traitement est limitée :
· à 5 jours en cas de douleur,
· à 3 jours en cas de fièvre.
Si la douleur persiste plus de 5 jours ou la fièvre plus de 3 jours, si elles s'aggravent, ne pas continuer le traitement sans l'avis de votre médecin.
Mode et voie d'administration
Voie orale.
La solution peut être bue pure ou diluée dans une petite quantité de boisson (par exemple eau, lait, jus de fruit).
Flacon 90 ml/150 ml avec cuillère doseuse :
· Vérifier l’état de la cuillère doseuse et la lisibilité des graduations avant chaque utilisation.
· Ne pas utiliser en cas de constat d’une altération de la matière constitutive ou de la forme (matière fissurée ou manquante) de la cuillère. Aller voir votre pharmacien pour lui demander conseil.
· Ne pas utiliser la cuillère doseuse en cas d’allergie connue au polystyrène.
· La cuillère doseuse doit être propre lors de son utilisation.
· Nettoyer la cuillère doseuse avant chaque utilisation.
· Si la cuillère doseuse a été égarée, ne pas utiliser d’autres types de cuillères.
· Pour ouvrir le flacon, il faut tourner le bouchon sécurité‑enfant en appuyant.
· Remplir la cuillère doseuse jusqu’au volume prescrit en alignant le niveau du médicament à la graduation.
· Délivrer la totalité du volume dosé.
ATTENTION : incliner progressivement la cuillère doseuse lors de l’administration afin d’adapter le débit à la déglutition du patient.
· Ne pas introduire trop profondément la cuillère doseuse dans la bouche du patient.
· Après chaque utilisation, refermer le flacon de la solution buvable.
· La cuillère doseuse doit être nettoyée manuellement, sans outil abrasif, à l’eau tiède (30°C max) savonneuse.
· Elle doit être parfaitement séchée avant une nouvelle utilisation.
· Ne pas mordre la cuillère doseuse.
Flacon 90 ml avec seringue d’administration orale :
· Vérifier que la seringue n’est pas endommagée et bien nettoyée.
· Ne pas utiliser la seringue si elle a été mal nettoyée ou détériorée.
· Ne pas utiliser la seringue en cas d’allergie connue au polyéthylène polystyrène.
· Pour ouvrir le flacon, il faut tourner le bouchon sécurité‑enfant en appuyant.
· Plonger la seringue dans le flacon en ayant vérifié que le piston soit bien enfoncé.
· Un trait de butée est disposé sur le bas du piston et le haut du corps de la seringue, afin de bloquer les 2 éléments et éviter qu'ils ne se séparent lors de l'utilisation de la seringue. Les traits de butée ne servent pas à la mesure de la dose.
· Libérer le contenu de la seringue dans la bouche de l’enfant en appliquant une poussée lente et régulière sur le piston.
· Après chaque utilisation, refermer le flacon de la solution buvable.
· Séparer les deux parties de la seringue (corps et piston), les laver manuellement à l’eau jusqu’à disparition des résidus médicamenteux. La température de lavage ne doit pas excéder 50°C : ne pas laver au lave-vaisselle, ne pas faire bouillir.
· Sécher à l’air libre.
· Assembler le corps et le piston lorsqu’ils sont complètement secs.
Ranger immédiatement le système doseur dans sa boîte dans un endroit inaccessible aux enfants.
Ne jamais séparer le système doseur des autres éléments de conditionnement du médicament (flacon, boîte, notice).
L’usage du système doseur est strictement réservé à l’administration d’EFFERALGANMED PEDIATRIQUE 30 mg/ml, solution buvable.
EN CAS DE DOUTE, DEMANDEZ CONSEIL A VOTRE MEDECIN OU A VOTRE PHARMACIEN.
Si vous avez pris plus de EFFERALGANMED pediatrique 30 mg/ml, solution buvable que vous n’auriez dû
Arrêtez le traitement et consultez immédiatement votre médecin ou les urgences médicales.
Un surdosage peut être mortel.
Dans les 24 premières heures, les principaux symptômes d’intoxication sont : nausées, vomissements, pâleur, malaise, sudation, perte d’appétit, douleurs abdominales.
Si vous oubliez de prendre EFFERALGANMED pediatrique 30 mg/ml, solution buvable
Ne prenez pas de dose double pour compenser la dose que vous avez oublié de prendre.
Si vous arrêtez de prendre EFFERALGANMED pediatrique 30 mg/ml, solution buvable
Sans objet.
Si vous avez d’autres questions sur l’utilisation de ce médicament, demandez plus d’informations à votre médecin ou à votre pharmacien.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Effets indésirables rares : peuvent affecter jusqu'à 1 personne sur 1 000
· rougeur de la peau, éruption cutanée, urticaire. Il faut immédiatement arrêter le traitement, avertir votre médecin et ne plus jamais reprendre de médicaments contenant du paracétamol.
· taches de sang sur la peau (purpura). Il faut immédiatement arrêter le traitement, avertir votre médecin et ne plus jamais reprendre de médicaments contenant du paracétamol.
Effets indésirables très rares : peuvent affecter jusqu'à 1 personne sur 10 000
· réactions cutanées graves. Il faut immédiatement arrêter le traitement, avertir votre médecin et ne plus jamais reprendre de médicaments contenant du paracétamol.
· modifications biologiques nécessitant un contrôle du bilan sanguin : taux anormalement bas de certains globules blancs (leucopénie, neutropénie) ou de certaines cellules du sang comme les plaquettes (thrombopénie) pouvant se traduire par des saignements de nez ou des gencives. Dans ce cas, consultez un médecin.
Effets indésirables à fréquence indéterminée : la fréquence ne peut pas être estimée à partir des données disponibles
· éruption ou rougeur cutanée ou réaction allergique pouvant se manifester par un brusque gonflement du visage et du cou pouvant entraîner une difficulté à respirer (œdème de Quincke) ou par un malaise brutal avec chute de la pression artérielle (choc anaphylactique). Il faut immédiatement arrêter le traitement, avertir votre médecin et ne plus jamais reprendre de médicaments contenant du paracétamol.
· diarrhées, douleurs abdominales, anomalie du bilan hépatique.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/.
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER EFFERALGANMED pediatrique 30 mg/ml, solution buvable ?
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur l’emballage. La date de péremption fait référence au dernier jour de ce mois.
Ne pas utiliser plus de 6 mois après la première ouverture du flacon.
A conserver à une température ne dépassant pas 25°C.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement. Une fois votre traitement terminé, rapportez à votre pharmacien toutes les boîtes entamées y compris le système doseur ainsi que le flacon pour une destruction correcte et appropriée de ce médicament.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient EFFERALGANMED PEDIATRIQUE 30 mg/ml, solution buvable
· La substance active est :
Paracétamol......................................................................................................................... 3 g
Pour 100 ml de solution buvable.
· Les autres composants sont :
Macrogol 6000, glycérol (E422), solution de saccharose*, saccharine sodique*, sorbate de potassium, acide citrique, arôme fraise (dont propylène glycol (E1520)*), eau purifiée. *Voir rubrique 2.
Ce médicament se présente sous forme de solution buvable.
Flacon 90 ml avec cuillère doseuse :
Flacon en polyéthylène téréphtalate brun de 90 ml muni d'un bouchon sécurité-enfant (child proof) en polyéthylène basse densité avec un système doseur (cuillère doseuse en polystyrène).
Flacon 90 ml avec seringue d’administration orale :
Flacon en polyéthylène téréphtalate brun de 90 ml muni d'un bouchon sécurité-enfant (child proof) en polyéthylène basse densité avec un système doseur (seringue d’administration orale en polyéthylène polystyrène).
Flacon 150 ml avec cuillère doseuse :
Flacon en polyéthylène téréphtalate brun de 150 ml muni d'un bouchon sécurité-enfant (child proof) en polyéthylène basse densité avec un système doseur (cuillère doseuse en polystyrène).
Titulaire de l’autorisation de mise sur le marché
3, RUE JOSEPH MONIER
92500 RUEIL-MALMAISON
Exploitant de l’autorisation de mise sur le marché
3, RUE JOSEPH MONIER
92500 RUEIL-MALMAISON
304, AVENUE DU DOCTEUR JEAN BRU
47000 AGEN
ou
UPSA SAS
979, AVENUE DES PYRENEES
47520 LE PASSAGE
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Sans objet.
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).
Conseil d’éducation sanitaire :
QUE FAIRE EN CAS DE FIÈVRE :
La température normale du corps est variable d'une personne à l'autre et comprise entre 36,5°C et 37,5°C. Une élévation de la température au-delà de 38°C peut être considérée comme une fièvre mais il est déconseillé de traiter la fièvre avec un médicament en dessous de 38,5 °C.
Ce médicament est destiné à l'enfant de 3 à 32 kg (environ de la naissance à 12 ans).
Si les troubles que la fièvre entraîne sont trop gênants, vous pouvez prendre ce médicament qui contient du paracétamol en respectant les posologies indiquées.
Vous pouvez améliorer l'efficacité du traitement médicamenteux par les mesures suivantes :
· se découvrir,
· boire régulièrement pour éviter tout risque de déshydratation,
· ne pas rester dans un endroit trop chaud.
Avec ce médicament, la fièvre doit baisser rapidement. Néanmoins :
· si d'autres signes inhabituels apparaissent,
· si la fièvre persiste plus de 3 jours ou si elle s'aggrave,
· si les maux de tête deviennent violents, ou en cas de vomissements,
CONSULTEZ IMMÉDIATEMENT VOTRE MÉDECIN.
QUE FAIRE EN CAS DE DOULEUR :
L'intensité de la perception de la douleur et la capacité à lui résister varient d'une personne à l'autre.
· S'il n'y a pas d'amélioration au bout de 5 jours de traitement,
· si la douleur est violente, inattendue et survient de façon brutale (notamment une douleur forte dans la poitrine) et/ou au contraire revient régulièrement,
· si elle s'accompagne d'autres signes comme un état de malaise général, de la fièvre, un gonflement inhabituel de la zone douloureuse, une diminution de la force dans un membre,
· si elle vous réveille la nuit,
CONSULTEZ IMMÉDIATEMENT VOTRE MÉDECIN.