Dernière mise à jour le 02/02/2026
REVITALOSE SANS SUCRE, solution buvable édulcorée au sorbitol
Indications thérapeutiques
Classe pharmacothérapeutique : Voies digestives et métabolisme – Toniques - code ATC : A13A
REVITALOSE SANS SUCRE, solution buvable édulcorée au sorbitol contient 6 substances actives : 5 acides aminés (aspartate de magnésium dihydraté, L-Leucine, Monochlorhydrate de L-Lysine, L-Phénylalanine et L-Valine) et de la vitamine C (également appelée acide ascorbique). Ces substances permettent de lutter contre la fatigue.
Ce médicament est utilisé pour traiter les états de fatigue passagers qui accompagnent les efforts physiques intenses, les états de surmenage et de convalescence.
Ce médicament est réservé aux adultes et adolescents à partir de 15 ans.
Vous devez vous adresser à votre médecin si vous ne ressentez aucune amélioration ou si vous vous sentez moins bien après 15 jours de traitement.
Composition en substances actives
-
Solution A ( Composition pour 5 ml )
- > magnésium (aspartate de) dihydraté 0,200 g
- > leucine 0,025 g
- > DL-lysine (monochlorhydrate de) 0,200 g
- > phénylalanine 0,010 g
- > valine 0,010 g
-
Solution B ( Composition pour 5 ml )
- acide ascorbique1,000 g
- sous forme de : sodium (ascorbate de)1,125 g
- acide ascorbique1,000 g
Présentations
> 14 ampoule(s) en verre brun de 5 ml - 14 ampoule(s) en verre brun de 5 ml
Code CIP : 335 730-0 ou 34009 335 730 0 3
Déclaration de commercialisation : 01/11/1998
Cette présentation n'est pas agréée aux collectivités
Service médical rendu (SMR)
Pas de SMR disponible pour ce médicament ( plus d'informations dans l'aide )
Amélioration du service médical rendu (ASMR)
Pas d'ASMR disponible pour ce médicament (plus d'informations dans l'aide )
ANSM - Mis à jour le : 12/01/2023
REVITALOSE SANS SUCRE, solution buvable édulcorée au sorbitol
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
AMPOULE A:
Aspartate de magnésium dihydraté ....................................................................................... 0,200 g
L-Leucine ............................................................................................................................ 0,025 g
Monochlorhydrate de L-Lysine .............................................................................................. 0,200 g
L-Phénylalanine ................................................................................................................... 0,010 g
L-Valine ............................................................................................................................... 0,010 g
Pour une ampoule de 5 ml
AMPOULE B:
Ascorbate de sodium........................................................................................................... 1,125 g
Quantité correspondant en Acide ascorbique à ..................................................................... 1,000 g
Pour une ampoule de 5 ml
Excipients à effet notoire : sorbitol E420 (0,500 g), parahydroxybenzoate de méthyle sodé E 219 (0,0055 g), parahydroxybenzoate de propyle sodé E 217 (0,00125 g), parahydroxybenzoate de méthyle E 218 (0,004 g), parahydroxybenzoate de propyle E 216 (0,002 g), 96% V/V éthanol (0,015 ml), sodium (0,1327 g).
Pour la liste complète des excipients, voir rubrique 6.1.
· ampoule A (acides aminés) : liquide limpide incolore
· ampoule B (acide ascorbique) : Solution légèrement visqueuse, légèrement jaune.
4.1. Indications thérapeutiques
Traitement d'appoint de l'asthénie fonctionnelle.
Ce médicament est indiqué chez les adultes et les adolescents âgés de plus de 15 ans.
4.2. Posologie et mode d'administration
Adultes et adolescents âgés de plus de 15 ans : 1 dose par jour à diluer dans un verre d'eau, de préférence Ie matin (1 dose est composée de I'ampoule A et de I'ampoule B).
La durée maximale de traitement est de 15 jours.
Une alimentation équilibrée permet de couvrir les apports journaliers en vitamine C, Acides Aminés.
Population pédiatrique
REVITALOSE SANS SUCRE, solution buvable édulcorée au sorbitol est contre indiqué chez les enfants âgés de moins de 15 ans (voir rubrique 4.3).
Mode d’administration
Voie orale
Mélanger le contenu de l’ampoule A et B dans un verre d’eau.
Pour ouvrir l’ampoule : casser les 2 extrémités de l’ampoule à distance du verre et verser la solution dans le verre.
Pour plus d’informations sur comment casser les ampoules, merci de vous référer à la section 6.6 Précautions particulières d’élimination et de manipulation)
· Hypersensibilité aux substances actives ou à l’un des excipients mentionnés à la rubrique 6.1.
· Lithiases rénales oxalo-calciques lorsque la dose de vitamine C est supérieure à 1 g/24 heures ou en cas de néphrolithiases avec oxalurie (voir rubrique 4.4).
· En cas de phénylcétonurie, en raison de la présence de phénylalanine.
· Hémochromatose, thalassémie, ou patients recevant simultanément une supplémentation en fer, les doses élevées de vitamine C pouvant augmenter l’absorption du fer.
· Patients souffrant d’un déficit en glucose-6-phosphate déshydrogénase (risque d’hémolyse) lorsque la dose de vitamine C est supérieure à 1 g / 24 heures.Enfants âgés de moins de 15 ans.
4.4. Mises en garde spéciales et précautions d'emploi
Mises en garde concernant les excipients
Ce médicament contient du sorbitol. Les patients présentant une intolérance héréditaire au fructose (IHF) ne doivent pas prendre ce médicament. L’effet additif des produits administrés concomitamment contenant du sorbitol (ou du fructose) et l’apport alimentaire de sorbitol (ou de fructose) doit être pris en compte. La teneur en sorbitol dans les médicaments à usage oral peut affecter la biodisponibilité d’autres médicaments à usage oral administrés de façon concomitante.
Ce médicament contient du parahydroxybenzoate de méthyle (E218), du parahydroxybenzoate de propyle (E216), du parahydroxybenzoate de méthyle sodé (E219) et du parahydroxybenzoate de propyle sodé (E217) et peut provoquer des réactions allergiques (éventuellement retardées).
Ce médicament contient 27 mg d’alcool (éthanol) dans chaque dose. La quantité de chaque dose de ce médicament équivaut à moins de 1 ml de bière et 1 ml de vin. La petite quantité d’alcool contenue dans ce médicament n’aura aucun effet notable.
Ce médicament contient 132,7 mg de sodium par dose, ce qui correspond à 6,6% de l’apport alimentaire quotidien maximal recommandé par l’OMS de 2 g de sodium par adulte. A prendre en compte chez les patients suivant un régime hyposodé strict.
En cas de persistance des troubles au-delà de 15 jours de traitement ou d'aggravation des troubles, une recherche étiologique doit être effectuée et la conduite à tenir réévaluée.
Précautions d’emploi
En raison d’un effet légèrement stimulant, il est préférable de ne pas prendre ce produit en fin de journée.
En raison de la forte dose de Vitamine C, il est recommandé de respecter la posologie.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Liées à la présence d’acide ascorbique
Interférences avec les tests biologiques
L’acide ascorbique est un agent réducteur fort et peut interférer avec des tests biologiques impliquant des réactions d’oxydation et de réduction. Consommé à fortes doses (plus de 2 g/jour), I'acide ascorbique peut interférer avec les tests biologiques suivants : dosage de la créatinine et du glucose, sanguins et urinaires (contrôle du diabète par bandelette à la glucose-oxydase).
Associations faisant l'objet de précautions d’emploi
+ Déféroxamine
Avec l'acide ascorbique à fortes doses et par voie IV : anomalies de la fonction cardiaque, voire insuffisance cardiaque aiguë (en général réversible à l'arrêt de la vitamine C).
En cas d'hémochromatose, ne donner de la vitamine C qu'après avoir commencé le traitement par la déféroxamine. Surveiller la fonction cardiaque en cas d'association.
+ Défériprone
Par extrapolation à partir de l’interaction avec la déféroxamine : avec l’acide ascorbique à fortes doses et par voie IV, risque d’anomalies de la fonction cardiaque, voire insuffisance cardiaque aiguë (généralement réversible à l’arrêt de la vitamine C).
Associations à prendre en compte
+ Ciclosporine :
Risque de diminution des concentrations sanguines de la ciclosporine, notamment en cas d’association avec la vitamine E.
4.6. Fertilité, grossesse et allaitement
Grossesse
Il n'y a pas ou peu de données sur l'utilisation de REVITALOSE SANS SUCRE, solution buvable édulcorée au sorbitol chez les femmes enceintes. Les études chez l'animal n'ont pas mis en évidence d'effets nocifs directs ou indirects sur la toxicité pour la reproduction (voir rubrique 5.3). Par mesure de précaution, il est préférable d'éviter l'utilisation de REVITALOSE SANS SUCRE, solution buvable édulcorée au sorbitol pendant la grossesse.
Fertilité
Il n’existe pas de données animales ou cliniques sur l’effet de REVITALOSE SANS SUCRE, solution buvable édulcorée au sorbitol sur la fertilité.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Aux doses préconisées, aucun effet indésirable n’a été rapporté. Voir rubrique 4.9.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr
Aucun cas de surdosage n'a été rapporté. En cas d'ingestion massive par voie orale, I'acide ascorbique peut être éliminé par hémodialyse.
Des doses élevées d’acide ascorbique (supérieures à 1 g/jour) favorisent le risque de survenue de troubles digestifs (douleurs abdominales, diarrhée) ou urinaires (lithiases oxaliques, cystiniques et/ou uriques) et d’hémolyse chez les sujets déficients en G6PD.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : Voies digestives et métabolisme - Toniques, code ATC: A13A
Apport d'acides aminés et de vitamine C.
Les acides aminés sont à la fois des précurseurs de la synthèse des protéines et de leurs produits de dégradation, jouant ainsi un rôle clé dans le maintien des fonctions vitales. A l'exception de l'aspartate, les acides aminés présents dans REVITALOSE SANS SUCRE, solution buvable édulcorée au sorbitol sont des acides aminés essentiels.
Le magnésium joue un rôle multiple dans diverses réactions enzymatiques et est indispensable pour le bon déroulement de la contraction musculaire.
L'acide ascorbique renforce les défenses du système immunitaire. L'acide ascorbique joue un rôle important de régulation du potentiel d'oxydoréduction cellulaire en servant de transporteur d'hydrogène grâce à la réversibilité entre l'acide ascorbique et l'acide déhydroascorbique, sa forme oxydée. Il intervient dans la synthèse et la maturation du collagène et protège le stock d'acide folique actif en empêchant l'oxydation du tétrahydrofolate. Sa carence peut provoquer des troubles du métabolisme glucidique (hyperglycémie, résistance à l'insuline) et une diminution de l’absorption intestinale du fer (anémie ferriprive).
5.2. Propriétés pharmacocinétiques
L’absorption de la vitamine C est un processus saturable et dose-dépendant qui se produit par transport actif. La vitamine C est absorbée à travers l'intestin grêle. Sa biodisponibilité est de 100% après une dose unique de 200 mg et diminue lorsque la dose ingérée augmente.
Distribution
La vitamine C est stockée à travers les tissus du corps et le sang, les concentrations des tissus étant trois à dix fois supérieures à celles trouvées dans le plasma.
Les glandes pituitaires, les glandes surrénales et le cristallin de l'œil contiennent les concentrations les plus élevées de vitamine C, les plus faibles concentrations se trouvant dans la salive et le plasma.
Environ 25% de la dose est liée aux protéines plasmatiques.
Biotransformation
A des doses physiologiques, une partie est oxydée à l'étape de dioxyde de carbone et de l'eau ; son métabolisme conduit à la formation d'oxalate.
Élimination
La demi-vie moyenne de la vitamine C est comprise entre 16 et 20 jours. Sa demi-vie est inversement proportionnelle à la consommation.
La vitamine C et ses métabolites sont soumis à la filtration glomérulaire et la réabsorption tubulaire presque complète de la quantité filtrée. Lorsque les taux plasmatiques de vitamine C dépassent le seuil rénal de 14 mg / L, des quantités significatives de la dose sont excrétées principalement sous forme inchangée dans l’urine.
5.3. Données de sécurité préclinique
Sorbitol, arôme orange soluble*, parahydroxybenzoate de méthyle sodé (E219), parahydroxybenzoate de propyle sodé (E217), acétate de sodium trihydraté, acide acétique glacial, eau purifiée.
*Composition de l'arôme orange soluble : huiles essentielles d'orange et de mandarine, butyrate d'éthyle, acétaldéhyde, acétate d'éthyle, hexanol, dodécanol, acétate de linalyle, éthanol.
Ampoule B :
Parahydroxybenzoate de méthyle (E218), parahydroxybenzoate de propyle (E216), gallate de propyle, alcool à 96 % v/v, glycérol, eau purifiée.
3 ans
6.4. Précautions particulières de conservation
Ce médicament ne nécessite pas de précautions particulières de conservation.
6.5. Nature et contenu de l'emballage extérieur
Ampoules (verre brun) de 5ml.
Boites de 2*7, 2*10, 2*12,2* 14, 2*15 ou 2*20 ampoules (verre brun) de 5 ml.
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
Pour briser la pointe de l’ampoule plus facilement, il est recommandé de placer celle-ci dans le coin d’une serviette propre et d’exercer une légère flexion. La pointe se cassera selon le trait circulaire. Les ampoules autocassables peuvent générer lors de l’ouverture un croissant de verre, c’est-à-dire un morceau se détachant de la pointe. Pour éviter les débris de verre, il est important :
· d’ouvrir la première pointe hors du verre.
· puis retourner l’ampoule, l’incliner, placer l’ampoule cassée au-dessus du verre.
· ouvrir la deuxième pointe elle aussi hors du verre.
(Voir rubrique 4.2 Posologie et mode d’administration.)
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
LES CAUQUILLOUS
81500 LAVAUR
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 351 459 6 3 : 7 ampoules A (verre brun) de 5 ml + 7 ampoules B (verre brun) de 5 ml
· 34009 335 731 7 1 : 10 ampoules A (verre brun) de 5 ml + 10 ampoules B (verre brun) de 5 ml
· 34009 335 193 5 3 : 12 ampoules A (verre brun) de 5 ml + 12 ampoules B (verre brun) de 5 ml
· 34009 335 730 0 3 : 14 ampoules A (verre brun) de 5 ml + 14 ampoules B (verre brun) de 5 ml
· 34009 342 503 6 1 : 15 ampoules A (verre brun) de 5 ml + 15 ampoules B (verre brun) de 5 ml
· 34009 342 501 3 2 : 20 ampoules A (verre brun) de 5 ml + 20 ampoules B (verre brun) de 5 ml
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Médicament non soumis à prescription médicale.
ANSM - Mis à jour le : 12/01/2023
REVITALOSE SANS SUCRE, solution buvable édulcorée au sorbitol
Vous devez toujours prendre ce médicament en suivant scrupuleusement les informations fournies dans cette notice ou par votre médecin ou votre pharmacien.
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Adressez-vous à votre pharmacien pour tout conseil ou information.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
· Vous devez vous adresser à votre médecin si vous ne ressentez aucune amélioration ou si vous vous sentez moins bien après 15 jours de traitement.
1. Qu'est-ce que REVITALOSE SANS SUCRE, solution buvable édulcorée au sorbitol et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant de prendre REVITALOSE SANS SUCRE, solution buvable édulcorée au sorbitol ?
3. Comment prendre REVITALOSE SANS SUCRE, solution buvable édulcorée au sorbitol ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver REVITALOSE SANS SUCRE, solution buvable édulcorée au sorbitol ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE REVITALOSE SANS SUCRE, solution buvable édulcorée au sorbitol ET DANS QUELS CAS EST-IL UTILISE ?
Classe pharmacothérapeutique : Voies digestives et métabolisme – Toniques - code ATC : A13A
REVITALOSE SANS SUCRE, solution buvable édulcorée au sorbitol contient 6 substances actives : 5 acides aminés (aspartate de magnésium dihydraté, L-Leucine, Monochlorhydrate de L-Lysine, L-Phénylalanine et L-Valine) et de la vitamine C (également appelée acide ascorbique). Ces substances permettent de lutter contre la fatigue.
Ce médicament est utilisé pour traiter les états de fatigue passagers qui accompagnent les efforts physiques intenses, les états de surmenage et de convalescence.
Ce médicament est réservé aux adultes et adolescents à partir de 15 ans.
Vous devez vous adresser à votre médecin si vous ne ressentez aucune amélioration ou si vous vous sentez moins bien après 15 jours de traitement.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT DE PRENDRE REVITALOSE SANS SUCRE, solution buvable édulcorée au sorbitol ?
Ne prenez jamais REVITALOSE SANS SUCRE, solution buvable édulcorée au sorbitol :
· si vous êtes allergique aux substances actives ou à l’un des autres composants contenus dans ce médicament, mentionnés dans la rubrique 6.
· si vous souffrez de calculs rénaux et que vous prenez des doses de vitamine C supérieures à 1 g par jour.
· si vous avez une maladie héréditaire qui a été dépistée à la naissance et qui est appelée phénylcétonurie, car ce médicament contient de la phénylalanine.
· si vous avez une maladie caractérisée par une surcharge en fer (hémochromatose, thalassémie) ou si vous prenez des compléments de fer.
· si vous souffrez d’un trouble héréditaire affectant vos globules rouges (déficit en Glucose-6-Phosphate Déshydrogénase ou G6PD) pour des doses de Vitamine C supérieures à 1 g par jour.
· chez l’enfant de moins de 15 ans.
Avertissements et précautions
Adressez-vous à votre médecin ou pharmacien avant de prendre REVITALOSE SANS SUCRE, solution buvable édulcorée au sorbitol.
· Si vous avez des troubles du métabolisme, l'utilisation prolongée de la vitamine C à doses élevées peut conduire à une hyperoxalurie (excrétion de l'urine contenant une grande quantité de cristaux d'oxalate de calcium) entraînant l’apparition de calculs d’oxalate de calcium.
· Vous devez éviter de prendre ce médicament en fin de journée en raison de I'effet légèrement stimulant de la vitamine C.
· Vous devez respecter la posologie étant donné la forte dose de Vitamine C.
Enfants
Sans objet.
Autres médicaments et REVITALOSE SANS SUCRE, solution buvable édulcorée au sorbitol
· REVITALOSE SANS SUCRE, solution buvable édulcorée au sorbitol contenant de la vitamine C :
o peut être utilisée avec prudence avec la déféroxamine et la défériprone (médicaments utilisés en particulier dans les maladies causées par une surcharge en fer ou en aluminium)
o risque de diminuer les concentrations sanguines de la ciclosporine (médicament utilisé pour diminuer les réactions immunitaires de l’organisme) notamment en cas d’association avec la vitamine E
o peut interférer avec les tests biologiques suivants quand la vitamine C est prise à doses élevées (supérieures à 2 g/jour) : tests urinaires et sanguins du glucose (contrôle du diabète par bandelette) et de la créatinine.
Informez votre médecin ou pharmacien si vous prenez, avez récemment pris ou pourriez prendre tout autre médicament.
REVITALOSE SANS SUCRE, solution buvable édulcorée au sorbitol avec des aliments et boissons
Sans objet.
Grossesse, allaitement et fertilité
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte, demandez conseil à votre médecin ou pharmacien avant de prendre ce médicament.
Vous devez éviter de prendre ce médicament si vous êtes enceinte ou que vous allaitez.
Conduite de véhicules et utilisation de machines
REVITALOSE SANS SUCRE, solution buvable édulcorée au sorbitol n’a aucun effet ou un effet négligeable sur l’aptitude à conduire des véhicules et à utiliser des machines.
REVITALOSE SANS SUCRE, solution buvable édulcorée au sorbitol contient du sorbitol (E 420), du parahydroxybenzoate de méthyle (E218), du parahydroxybenzoate de propyle (E 216), du parahydroxybenzoate de méthyle sodé (E 219), du parahydroxybenzoate de propyle sodé (E 217), de l’éthanol, du sodium.
· Sorbitol (E420). Ce médicament contient 500 mg de sorbitol par dose, équivalent à 50 mg/ml. Le sorbitol est une source de fructose. Si votre médecin vous a informé(e) que vous (ou votre enfant) présentiez une intolérance à certains sucres ou si vous avez été diagnostiqué(e) avec une intolérance héréditaire au fructose (IHF), un trouble génétique rare caractérisé par l’incapacité à décomposer le fructose, parlez-en à votre médecin avant que vous (ou votre enfant) ne preniez ou ne receviez ce médicament.
· Parahydroxybenzoate de méthyle (E 218), parahydroxybenzoate de propyle (E 216), parahydroxybenzoate de méthyle sodé (E 219), parahydroxybenzoate de propyle sodé (E 217). Ce médicament peut provoquer des réactions allergiques (éventuellement retardées).
· Ethanol. Ce médicament contient 27 mg d’alcool (éthanol) par dose. La quantité dans chaque dose de ce médicament est équivalent à moins de 1 ml de bière et 1 ml de vin. La petite quantité d’alcool contenue dans ce médicament n’aura aucun effet notable. Sodium. Ce médicament contient 132,7 mg de sodium (composant principal du sel de cuisine/table) par dose. Cela équivaut à 6,6% de l’apport alimentaire quotidien maximal recommandé de sodium pour un adulte. A prendre en compte chez les patients contrôlant leur apport alimentaire en sodium.
· Ce médicament contient 10 mg de phénylalanine par dose, équivalent à 1 mg/ml. La phénylalanine peut être dangereuse pour les personnes atteintes de phénylcétonurie (PCU), une maladie génétique rare caractérisée par l’accumulation de phénylalanine ne pouvant être éliminée correctement.
3. COMMENT PRENDRE REVITALOSE SANS SUCRE, solution buvable édulcorée au sorbitol ?
Posologie
La dose recommandée pour les adultes et adolescents à partir de 15 ans est de 1 dose par jour, à prendre dans un verre d'eau, de préférence Ie matin. En effet, ce médicament contient de la vitamine C et a donc un effet stimulant. Il est donc préférable de ne pas prendre ce médicament en fin de journée.
Une dose est composée d'une ampoule A et B.
La durée maximale de traitement est de 15 jours.
Une alimentation équilibrée permet de couvrir les apports journaliers en vitamine C, Acides Aminés.
Mode d'administration
Ce médicament est utilisé par voie orale.
Diluez le contenu des 2 ampoules dans un verre d’eau avant de les avaler.
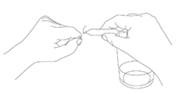
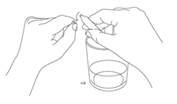
Pour ouvrir une ampoule, casser les deux extrémités. Pour briser la pointe de l’ampoule plus facilement, il est recommandé de placer celle-ci dans le coin d’une serviette propre et d’exercer une légère flexion. La pointe se cassera selon le trait circulaire.
Les ampoules autocassables peuvent générer lors de l’ouverture un croissant de verre, c’est-à-dire un morceau se détachant de la pointe. Il est recommandé de ne pas ouvrir l’ampoule au-dessus du verre.
Pour éviter de recueillir des débris de verre, il est important :
|
|
· d’ouvrir la première pointe hors du verre. |
|
|
· puis retourner l’ampoule, l’incliner, placer l’ampoule cassée au-dessus du verre. |
|
|
· ouvrir la deuxième pointe de la même manière, aussi hors du verre. |
Si vous avez pris plus de REVITALOSE SANS SUCRE, solution buvable édulcorée au sorbitol que vous n’auriez dû
Consultez immédiatement votre médecin ou votre pharmacien.
A doses supérieures à 1 g/jour en vitamine C, peuvent survenir :
· des troubles digestifs (douleurs abdominales, diarrhée)
· des troubles urinaires (calculs rénaux, insuffisance rénale)
· une hémolyse (destruction des globules rouges se manifestant notamment par une coloration rouge des urines) si vous avez une maladie héréditaire des globules rouges, appelée déficit déficit en Glucose-6-Phosphate Déshydrogénase ou G6PD (enzyme spécifique des globules rouges).
Si vous oubliez de prendre REVITALOSE SANS SUCRE, solution buvable édulcorée au sorbitol
Ne prenez pas de dose double pour compenser la dose simple que vous avez oubliée de prendre.
Si vous arrêtez de prendre REVITALOSE SANS SUCRE, solution buvable édulcorée au sorbitol
Sans objet.
Si vous avez d’autres questions sur l’utilisation de ce médicament, demandez plus d’informations à votre médecin ou à votre pharmacien.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Des effets indésirables peuvent survenir si vous prenez des doses élevées de vitamine C (supérieures à 1 g par jour) : voir « Si vous avez pris plus de REVITALOSE SANS SUCRE, solution buvable édulcorée au sorbitol que vous n’auriez dû » en rubrique 3, ci-dessus.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER REVITALOSE SANS SUCRE, solution buvable édulcorée au sorbitol ?
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur l’emballage et les ampoules buvables. La date de péremption fait référence au dernier jour du mois.
Ce médicament ne nécessite pas de précautions particulières de conservation.
Ne jetez aucun médicament au tout-à-l’égout ni avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger I’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient REVITALOSE SANS SUCRE, solution buvable édulcorée au sorbitol
Les substances actives sont :
AMPOULE A:
Aspartate de magnésium dihydraté ....................................................................................... 0,200 g
L-Leucine ............................................................................................................................ 0,025 g
Monochlorhydrate de L-Lysine .............................................................................................. 0,200 g
L-Phénylalanine ................................................................................................................... 0,010 g
L-Valine ............................................................................................................................... 0,010 g
Pour une ampoule de 5 ml
AMPOULE B:
Ascorbate de sodium........................................................................................................... 1,125 g
Quantité correspondant en Acide ascorbique à ..................................................................... 1,000 g
Pour une ampoule de 5 ml
· Les autres composants sont :
AMPOULE A :
Sorbitol, arôme orange soluble*, parahydroxybenzoate de méthyle sodé, parahydroxybenzoate de propyle sodé, acétate de sodium trihydraté, acide acétique glacial, eau purifiée.
* Composition de l'arôme orange soluble : huiles essentielles d'orange et de mandarine, butyrate d'éthyle, acétaldéhyde, acétate d'éthyle, hexanol, dodécanol, acétate de linalyle, éthanol.
AMPOULE B :
Parahydroxybenzoate de méthyle, parahydroxybenzoate de propyle, gallate de propyle, alcool à 96 % v/v, glycérol, eau purifiée.
Ce médicament se présente sous la forme d'une solution buvable, ampoule de 5 ml :
Ampoule A (acides aminées) : liquide limpide incolore
Ampoule B (acide ascorbique) : solution légèrement visqueuse et légèrement jaune
Boîte de 2*7, 2*10, 2*12, 2* 14, 2*15 et 2* 20 ampoules (ampoules A et B).
Toutes les présentations peuvent ne pas être commercialisées.
Titulaire de l’autorisation de mise sur le marché
LES CAUQUILLOUS
81500 LAVAUR
Exploitant de l’autorisation de mise sur le marché
PIERRE FABRE MEDICAMENT
PARC INDUSTRIEL DE LA CHARTREUSE
81100 CASTRES
17 ROUTE DE MEULAN
78520 LIMAY
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Sans objet.
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).
Conseils d’éducation sanitaires :
Ce médicament a pour but d'atténuer un état de fatigue passager.
Il convient de distinguer la fatigue physique normale survenant à la suite d'un effort important par exemple et l'asthénie qui est une fatigue en dehors de tout effort.
· La fatigue survenant à la suite d'un effort physique est normale : le repos suffit à la faire disparaître.
· La fatigue qui ne cède pas au repos ou asthénie est la sensation de ne pas pouvoir fournir un effort avant même de l'avoir commencé. Cette fatigue peut être la conséquence d'un surmenage, d'une maladie.
Certains médicaments peuvent aussi entraîner une fatigue inhabituelle : relisez la notice des médicaments que vous prenez et demandez l'avis de votre pharmacien ou de votre médecin. Mais, dans de nombreux cas, aucune cause précise n'est retrouvée.
La fatigue peut se manifester par des symptômes très variables. Cela peut être une impression générale de faiblesse. Mais parfois des symptômes peuvent s'y associer comme des troubles du sommeil (insomnie, sommeil agité ), intellectuels (difficultés de concentration, de la mémoire et de l'attention ), sexuels (diminution du désir ), du caractère (irritabilité, pessimisme, tristesse, démotivation )
Vous pouvez diminuer votre fatigue en respectant autant que possible les conseils suivants :
· Reposez-vous, relaxez-vous, cherchez les raisons de votre fatigue.
· Pratiquez une activité physique régulière et adaptée.
· Ayez une alimentation équilibrée (notamment évitez la prise d'alcool, de tabac, d'excitants).
· Retrouvez votre rythme de sommeil (heure du coucher régulière et durée suffisante de sommeil).
Demandez l'avis de votre pharmacien ou de votre médecin dans les cas suivants :
· Absence d'amélioration après 15 jours de traitement.
· Augmentation de la sensation de fatigue en cours de traitement.
· Survenue de nouveaux symptômes ou de symptômes inhabituels.