Dernière mise à jour le 01/12/2025
TANGANIL 500 mg/5 ml, solution injectable I.V. en ampoule
Indications thérapeutiques
Classe pharmacothérapeutique : ANTIVERTIGINEUX – code ATC : N07CA04
TANGANIL 500 mg/5 ml, solution injectable en ampoule contient la substance active acétylleucine.
Ce médicament est indiqué chez l’adulte dans le traitement symptomatique de la crise vertigineuse.
Présentations
> 5 ampoule(s) en verre de 5 ml
Code CIP : 327 225-9 ou 34009 327 225 9 4
Déclaration de commercialisation : 19/09/1986
Cette présentation est agréée aux collectivités
- Prix hors honoraire de dispensation : 2,31 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 3,33 €
- Taux de remboursement :30%
Service médical rendu (SMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Modéré | Avis du 06/07/2011 | Renouvellement d'inscription (CT) | Le service médical rendu par ces spécialités reste modéré dans l'indication de l'AMM. |
Amélioration du service médical rendu (ASMR)
Pas d'ASMR disponible pour ce médicament (plus d'informations dans l'aide )
ANSM - Mis à jour le : 17/04/2025
TANGANIL 500 mg/5 ml, solution injectable I.V. en ampoule
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Acétylleucine........................................................................................................................ 500 mg
Pour la liste complète des excipients, voir rubrique 6.1.
Solution aqueuse claire, pratiquement incolore et sans particules visibles.
4.1. Indications thérapeutiques
Ce médicament est indiqué dans le traitement symptomatique de la crise vertigineuse chez l’adulte.
4.2. Posologie et mode d'administration
2 ampoules par jour (jusqu’à 4 si nécessaire).
La durée du traitement est variable selon l’évolution clinique.
Mode d’administration
Utilisation intraveineuse directe.
Hypersensibilité à la substance active ou à l’un des excipients mentionnés à la rubrique 6.1.
4.4. Mises en garde spéciales et précautions d'emploi
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Aucune étude d’interaction n’a été réalisée.
4.6. Fertilité, grossesse et allaitement
Grossesse
Il n’existe pas de données ou il existe des données limitées sur l’utilisation de l’acétylleucine chez la femme enceinte. Il n’existe pas de données chez l’animal en ce qui concerne la toxicité sur la reproduction (voir rubrique 5.3). Par mesure de précaution, il est préférable d’éviter l’utilisation de TANGANIL 500 mg/5 ml, solution injectable I.V. en ampoule durant la grossesse.
On ne sait si l’acétylleucine et ses métabolites sont excrétés dans le lait maternel. Un risque pour l’enfant allaité ne peut être exclu. TANGANIL 500 mg/5 ml, solution injectable I.V. en ampoule ne doit pas être utilisé durant l’allaitement.
Fertilité
Il n’y a pas de données sur les effets de l’acétylleucine sur la fertilité.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Les effets indésirables sont classés comme indiqué ci-dessous par classe de systèmes d'organes MedDRA et par fréquence. La fréquence est définie selon la convention suivante : très fréquente (≥ 1/10), fréquente (≥ 1/100 et < 1/10), peu fréquente (≥ 1/1 000 et < 1/100), rare (≥ 1 /10 000 et < 1/1 000), très rare (< 1/10 000), fréquence indéterminée (ne peut être estimée à partir des données disponibles).
|
CLASSE DE SYSTEMES D’ORGANES (Classification MedDRA) |
Très rare (<1/10,000) |
Fréquence indéterminée |
|
Affections du système immunitaire |
|
Réactions d’hypersensibilité, choc anaphylactoïde et œdème laryngé |
|
Affections de la peau et du tissu sous-cutané |
Démangeaisons (parfois associées à du prurit), érythème, urticaire |
|
|
Troubles généraux et anomalies au site d’administration |
|
Réactions au site d’injection (telles que douleur, œdème ou hématome) |
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/
Les informations concernant les surdosages avec l’acétylleucine sont limitées.
En cas de surdosage, un traitement symptomatique doit être pris si nécessaire.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : ANTIVERTIGINEUX, Code ATC : N07CA04.
5.2. Propriétés pharmacocinétiques
Après administration de 1 g de TANGANIL par voie intraveineuse, on observe une cinétique bicompartimentale avec une phase de distribution très rapide (demi-vie moyenne de 0,11 heure) et une phase d’élimination rapide (demi-vie moyenne de 1,08 heure).
5.3. Données de sécurité préclinique
Il n'existe aucune donnée de toxicité disponible pour évaluer les effets du produit sur la fertilité et le développement embryo-fœtal.
Monoéthanolamine, eau pour préparations injectables.
Après ouverture : le produit doit être utilisé immédiatement.
6.4. Précautions particulières de conservation
Pas de précautions particulières de conservation.
6.5. Nature et contenu de l'emballage extérieur
5 ml en ampoule (verre) transparente à fond plat. Boîte de 5 ou 10.
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
Mode d’ouverture des ampoules OPC (One point cut)
Avant d’ouvrir l’ampoule assurez-vous qu’il ne reste plus de solution dans la partie supérieure de l’ampoule.
Les ampoules sont munies d’un système d’ouverture OPC et doivent être cassées selon les instructions suivantes :
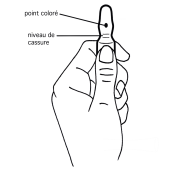
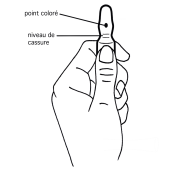
1. D’une main tenir fermement le corps de l’ampoule, point coloré face à vous (schéma 1).
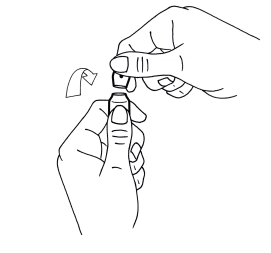
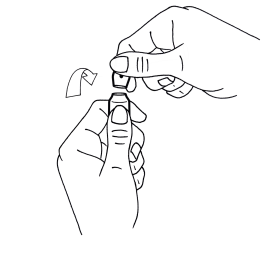
2. De l’autre saisir la partie supérieure de l’ampoule (index posé derrière le col de l’ampoule et le pouce sur le point coloré comme indiqué dans le schéma 2).
3. En tenant fermement chaque partie de l’ampoule, casser d’un coup sec la partie supérieure en exerçant une pression dans la direction opposée au point coloré (schéma 2).
|
|
|
|
Schéma 1 |
Schéma 2 |
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
les cauquillous
81500 lavaur
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 3400932722594 ou 327 225-9 : 5 ml en ampoule (verre), boîte de 5.
· 3400931033677 ou 310 336-7 : 5 ml en ampoule (verre), boîte de 10.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Médicament non soumis à prescription médicale.
ANSM - Mis à jour le : 17/04/2025
TANGANIL 500 mg/5 ml, solution injectable I.V. en ampoule
Acétylleucine
Vous devez toujours utiliser ce médicament en suivant scrupuleusement les informations fournies dans cette notice ou par votre médecin ou votre pharmacien.
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Adressez-vous à votre pharmacien pour tout conseil ou information.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
· Vous devez vous adresser à votre médecin si vous ne ressentez aucune amélioration ou si vous vous sentez moins bien après 3 jours.
1. Qu'est-ce que TANGANIL 500 mg/5 ml, solution injectable I.V. en ampoule et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d'utiliser TANGANIL 500 mg/5 ml, solution injectable I.V. en ampoule ?
3. Comment utiliser TANGANIL 500 mg/5 ml, solution injectable I.V. en ampoule ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver TANGANIL 500 mg/5 ml, solution injectable I.V. en ampoule ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE TANGANIL 500 mg/5 ml, solution injectable I.V. en ampoule ET DANS QUELS CAS EST-IL UTILISE ?
Classe pharmacothérapeutique : ANTIVERTIGINEUX – code ATC : N07CA04
TANGANIL 500 mg/5 ml, solution injectable en ampoule contient la substance active acétylleucine.
Ce médicament est indiqué chez l’adulte dans le traitement symptomatique de la crise vertigineuse.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER TANGANIL 500 mg/5 ml, solution injectable I.V. en ampoule ?
N’utilisez jamais TANGANIL 500 mg/5 ml, solution injectable I.V. en ampoule
si vous êtes allergique (hypersensible) à l’acétylleucine ou à l’un des autres composants de ce médicament (mentionnés dans la rubrique 6).
Avertissements et précautions
Adressez-vous à votre médecin ou pharmacien avant de prendre TANGANIL 500 mg/5 ml, solution injectable I.V. en ampoule.
Vous devez arrêter le traitement et consulter rapidement votre médecin dès les premiers signes de réactions allergiques (par exemple choc allergique (réaction allergique sévère et soudaine avec difficultés respiratoires, gonflements, étourdissements, rythme cardiaque rapide, transpiration et perte de conscience) et œdème laryngé(gonflement)) (voir également en rubrique 4).
Adressez-vous à votre médecin ou pharmacien avant de prendre TANGANIL 500 mg/5 ml, solution injectable I.V. en ampoule.
Enfants et adolescents
Sans objet.
Autres médicaments et TANGANIL 500 mg/5 ml, solution injectable I.V. en ampoule
Informez votre médecin ou pharmacien si vous prenez, avez récemment pris ou pourriez prendre tout autre médicament.
TANGANIL 500 mg/5 ml, solution injectable I.V. en ampoule avec des aliments et des boissons
Sans objet.
Grossesse et allaitement
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin ou pharmacien avant de prendre ce médicament. Il n’est pas recommandé d’utiliser ce médicament pendant la grossesse.
Ce médicament ne doit pas être utilisé pendant l’allaitement.
Si vous découvrez que vous êtes enceinte pendant le traitement, consultez votre médecin car lui seul peut juger de la nécessité de poursuivre le traitement. Demandez conseil à votre médecin ou à votre pharmacien avant de prendre tout médicament.
Conduite de véhicules et utilisation de machines
TANGANIL 500 mg/5 ml, solution injectable I.V. en ampoule n’a aucun effet ou un effet négligeable sur l’aptitude à conduire des véhicules et à utiliser des machines.
TANGANIL 500 mg/5 ml, solution injectable I.V. en ampoule contient
Sans objet.
3. COMMENT UTILISER TANGANIL 500 mg/5 ml, solution injectable I.V. en ampoule ?
Posologie
Chez l'adulte
La dose recommandée est de 2 ampoules par jour (jusqu'à 4 si nécessaire).
La durée du traitement est variable selon l'évolution clinique.
Mode d’administration
Voie intraveineuse directe.
Mode d’ouverture des ampoules OPC (One point cut) à l’usage du professionnel de santé formé à cette voie d’administration :
Avant d’ouvrir l’ampoule, s’assurer qu’il ne reste plus de solution dans la partie supérieure de l’ampoule.
Les ampoules sont munies d’un système d’ouverture OPC et doivent être cassées selon les instructions suivantes :
1. D’une main, tenir fermement le corps de l’ampoule, point coloré face à vous (schéma 1)
2. De l’autre, saisir la partie supérieure de l’ampoule (index posé derrière le col de l’ampoule et le pouce sur le point coloré comme indiqué sur le schéma 2)
3. En tenant fermement chaque partie de l’ampoule, casser d’un coup sec la partie supérieure en exerçant une pression dans la direction opposée au point coloré (schéma 2)
|
|
|
|
Schéma 1 |
Schéma 2 |
Si vous avez pris plus de TANGANIL 500 mg/5 ml, solution injectable I.V. en ampoule que vous n’auriez dû
Consultez immédiatement votre médecin ou pharmacien. Un traitement symptomatique doit être effectué si nécessaire.
Si vous oubliez de prendre TANGANIL 500 mg/5 ml, solution injectable I.V. en ampoule
Ne prenez pas de dose double pour compenser la dose que vous avez oubliée.
Si vous arrêtez de prendre TANGANIL 500 mg/5 ml, solution injectable I.V. en ampoule
Sans objet.
Si vous avez d’autres questions sur l’utilisation de ce médicament, demandez plus d’informations à votre médecin ou à votre pharmacien.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Contactez immédiatement votre médecin si vous développez l’un des symptômes suivants, car vous pourriez avoir besoin d'un traitement médical d'urgence.
Réactions allergiques, choc anaphylactoïde (réaction allergique sévère et soudaine avec difficultés respiratoires, gonflement, étourdissements, rythme cardiaque rapide, transpiration et perte de conscience) et œdème laryngé (gonflement) ont été observés à des fréquences indéterminées.
D’autres effets indésirables peuvent survenir :
· Très rare : peuvent affecter jusqu’à 1 à 10 000 personnes
Des réactions cutanées (éruption (parfois associées à des démangeaisons), rougeurs, urticaire).
· Fréquence indéterminée : ne peut être estimée sur la base des données disponibles
Réactions au site d’injection telles que douleur, œdème (gonflement) ou hématome (accumulation de sang sous la peau).
Si vous remarquez des effets indésirables non mentionnés dans cette notice, ou si l'un des effets indésirables devient grave, veuillez en informer votre médecin ou votre pharmacien.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER TANGANIL 500 mg/5 ml, solution injectable I.V. en ampoule ?
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur la boîte. La date de péremption fait référence au dernier jour de ce mois.
Après ouverture : le produit doit être utilisé immédiatement.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères.
Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient TANGANIL 500 mg/5 ml, solution injectable I.V. en ampoule
La substance active est :
Acétylleucine ....................................................................................................................... 500 mg
Pour une ampoule.
Les autres composants sont :
Monoéthanolamine, eau pour préparations injectables.
Toutes les présentations peuvent ne pas être commercialisées.
Titulaire de l’autorisation de mise sur le marché
les cauquillous
81500 lavaur
Exploitant de l’autorisation de mise sur le marché
parc industriel de la chartreuse
81100 castres
1 RUE COMTE DE SINARD
26250 LIVRON SUR DROME
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Sans objet.
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).