Dernière mise à jour le 01/12/2025
FULVESTRANT TEVA 250 mg, solution injectable en seringue préremplie
Indications thérapeutiques
Classe pharmacothérapeutique - code ATC : L02BA03
FULVESTRANT TEVA est utilisé soit :
· seul, pour traiter les femmes ménopausées avec un type de cancer du sein appelé cancer du sein positif pour les récepteurs aux estrogènes qui est localement avancé ou qui s’est étendu à d’autres parties du corps (métastatique), ou
· en association avec le palbociclib pour traiter les femmes avec un type de cancer du sein appelé cancer du sein positif pour les récepteurs hormonaux, négatif pour le récepteur 2 du facteur de croissance épidermique humain qui est localement avancé ou qui s’est étendu à d’autres parties du corps (métastatique). Les femmes qui n’ont pas encore atteint la ménopause seront également traitées avec un médicament appelé agoniste du facteur de libération de l’hormone lutéinisante (LHRH).
Lorsque le fulvestrant est administré en association avec le palbociclib, il est important que vous lisiez aussi la notice du palbociclib. Si vous avez des questions concernant le palbociclib, demandez à votre médecin.
Présentations
> 2 seringue(s) préremplie(s) en verre de 5 ml avec un piston polypropylène, munies d'un connecteur Luer-Lock avec 2 aiguilles protégées
Code CIP : 34009 301 030 0 5
Déclaration de commercialisation : 11/01/2021
Cette présentation est agréée aux collectivités
- Prix hors honoraire de dispensation : 184,67 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 185,69 €
- Taux de remboursement :100%
Service médical rendu (SMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Important | Avis du 25/07/2018 | Inscription (CT) | Le service médical rendu par FULVESTRANT TEVA 250 mg est important dans l’indication de l’AMM. |
Amélioration du service médical rendu (ASMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprés de la HAS (plus d'informations dans l'aide). Les avis et synthéses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur de l'ASMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| V (Inexistant) | Avis du 25/07/2018 | Inscription (CT) | Cette spécialité n’apporte pas d’amélioration du service médical rendu (ASMR V) par rapport à la spécialité FASLODEX 250 mg/5 ml déjà inscrite. |
ANSM - Mis à jour le : 22/07/2025
FULVESTRANT TEVA 250 mg, solution injectable en seringue préremplie
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Pour chaque seringue préremplie de 5 ml.
Chaque ml contient 50 mg de fulvestrant.
Excipients à effet notoire :
Chaque seringue préremplie contient 474 mg d’alcool (éthanol), ce qui équivaut à 94,8 mg/ml.
Chaque seringue préremplie contient 500 mg d’alcool benzylique, ce qui équivaut à 100 mg/ml.
Chaque seringue préremplie contient 750 mg de benzoate de benzyle, ce qui équivaut à 150 mg/ml.
Pour la liste complète des excipients, voir rubrique 6.1.
Solution injectable en seringue préremplie.
Solution limpide, incolore à jaune, visqueuse. Avant l'administration, les solutions à usage parentéral doivent être contrôlées visuellement afin de détecter la présence de particules ou un changement de coloration.
4.1. Indications thérapeutiques
FULVESTRANT TEVA est indiqué :
· en monothérapie dans le traitement du cancer du sein, localement avancé ou métastasé, positif pour les récepteurs aux estrogènes, chez les femmes ménopausées :
o non traitées précédemment par une hormonothérapie, ou
o avec une récidive pendant ou après un traitement adjuvant par un anti-estrogène ou une progression de la maladie sous traitement par anti-estrogène.
· en association avec le palbociclib dans le traitement du cancer du sein localement avancé ou métastatique, positif pour les récepteurs hormonaux (RH), négatif pour le récepteur 2 du facteur de croissance épidermique humain (HER2), chez les femmes ayant été traitées antérieurement par hormonothérapie (voir rubrique 5.1).
Chez les femmes en pré- ou périménopause, le traitement en association avec le palbociclib doit être associé à un agoniste de l’hormone de libération de la lutéinostimuline (LHRH).
4.2. Posologie et mode d'administration
Femmes adultes (y compris les personnes âgées)
La dose recommandée est de 500 mg une fois par mois, avec une dose supplémentaire de 500 mg deux semaines après la dose initiale.
Lorsque le fulvestrant est utilisé en association avec le palbociclib, veuillez également vous référer au Résumé des Caractéristiques du Produit du palbociclib.
Avant le début et pendant toute la durée du traitement associant le fulvestrant et le palbociclib, les femmes en pré/périménopause doivent être traitées par des agonistes de la LHRH conformément à la pratique clinique locale.
Populations particulières
Insuffisance rénale
Aucun ajustement posologique n’est recommandé chez les patientes souffrant d’une insuffisance rénale légère à modérée (clairance de la créatinine ≥ 30 ml/min). La sécurité et l’efficacité n’ont pas été évaluées chez les patientes souffrant d’insuffisance rénale sévère (clairance de la créatinine < 30 ml/min) et, en conséquence, la prudence est recommandée chez ces patientes (voir rubrique 4.4).
Insuffisance hépatique
Aucun ajustement posologique n’est recommandé chez les patientes atteintes d’une insuffisance hépatique légère à modérée. Cependant, comme l’exposition au fulvestrant peut être augmentée chez ces patientes, FULVESTRANT TEVA devra être utilisé avec précaution. Il n’y a pas de données chez les patientes atteintes d’insuffisance hépatique sévère (voir rubriques 4.3, 4.4 et 5.2).
Population pédiatrique
La sécurité et l’efficacité de FULVESTRANT TEVA chez les enfants, de la naissance à 18 ans, n’ont pas été établies. Les données actuellement disponibles sont décrites aux rubriques 5.1 et 5.2, mais aucune recommandation sur la posologie ne peut être donnée.
Mode d’administration
FULVESTRANT TEVA doit être administré en deux injections consécutives de 5 ml par injection intramusculaire lente dans le muscle fessier (1-2 minutes/injection), une dans chaque fesse (zone du fessier).
Il convient de faire preuve de prudence lors de l’injection de FULVESTRANT TEVA au niveau du site dorso-fessier en raison de la proximité du nerf sciatique sous-jacent.
Pour des instructions détaillées sur l’administration, voir rubrique 6.6.
Hypersensibilité à la substance active ou à l’un des excipients mentionnés à la rubrique 6.1.
Grossesse et allaitement (voir rubrique 4.6).
Insuffisance hépatique sévère (voir rubriques 4.4 et 5.2).
4.4. Mises en garde spéciales et précautions d'emploi
FULVESTRANT TEVA doit être utilisé avec prudence chez les patientes souffrant d’insuffisance rénale sévère (clairance de la créatinine inférieure à 30 ml/min).
En raison de la voie d’administration intramusculaire, FULVESTRANT TEVA doit être utilisé avec prudence en cas d’antécédents d’affections hémorragiques, de thrombopénie ou chez les patientes traitées par des anticoagulants.
Des événements thromboemboliques sont fréquemment observés chez les patientes atteintes de cancer du sein à un stade avancé et ont été rapportés avec le fulvestrant dans les études cliniques (voir rubrique 4.8). Ceci doit être pris en compte lorsque FULVESTRANT TEVA est prescrit à des patientes à risque.
Des événements liés au site d'injection comprenant sciatiques, névralgies, douleurs neuropathiques et neuropathies périphériques ont été rapportés lors de l’injection de fulvestrant. Des précautions doivent être prises lors de l'administration de FULVESTRANT TEVA au site d'injection dorso-fessier en raison de la proximité du nerf sciatique sous-jacent (voir rubriques 4.2 et 4.8).
Il n’y a pas de données sur les effets à long terme du fulvestrant sur les os. Etant donné le mécanisme d’action du fulvestrant, il existe un risque potentiel d’ostéoporose.
L’efficacité et la sécurité du fulvestrant (en monothérapie ou en association avec le palbociclib) n’ont pas été étudiées chez les patientes présentant une maladie viscérale grave.
Lorsque le fulvestrant est utilisé en association avec le palbociclib, veuillez également vous référer au Résumé des Caractéristiques du Produit du palbociclib.
Interférence avec des tests de dosage d’œstradiol par anticorps
En raison de la similarité structurale du fulvestrant et de l'œstradiol, le fulvestrant peut interférer avec des dosages d’œstradiol par anticorps et peut entraîner une fausse augmentation du taux d'œstradiol.
Population pédiatrique
FULVESTRANT TEVA est déconseillé pour l’utilisation chez les enfants et les adolescents car la sécurité et l’efficacité n’ont pas été établies dans ce groupe de patients (voir rubrique 5.1).
Excipients
Ethanol à 96 % (alcool)
La faible quantité d’éthanol contenue dans ce médicament n'est pas susceptible d'entraîner d'effet notable.
Alcool benzylique
L’alcool benzylique peut provoquer des réactions allergiques.
De grandes quantités d’alcool benzylique peuvent s’accumuler dans le corps et entraîner des effets secondaires (appelés « acidose métabolique »). A utiliser avec prudence et en cas de nécessité uniquement, en particulier chez les personnes atteintes d’insuffisance hépatique ou rénale.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
4.6. Fertilité, grossesse et allaitement
Femmes en âge d’avoir des enfants
Les patientes en âge de procréer doivent être informées sur l’utilisation d’une contraception efficace pendant le traitement par FULVESTRANT TEVA et pendant 2 ans après avoir reçu la dernière dose.
Grossesse
FULVESTRANT TEVA est contre-indiqué lors de la grossesse (voir rubrique 4.3). Le fulvestrant traverse le placenta après une injection intramusculaire unique chez la rate et la lapine. Des études chez l’animal ont montré une toxicité sur les fonctions de reproduction, y compris une augmentation de l’incidence des anomalies et des morts fœtales (voir rubrique 5.3). En cas de grossesse survenant lors du traitement par FULVESTRANT TEVA, la patiente devra être avertie du risque potentiel pour le fœtus et du risque potentiel de fausse couche.
L’allaitement doit être interrompu pendant le traitement par FULVESTRANT TEVA. Le fulvestrant est excrété dans le lait de rates qui allaitent. Il n’y a pas de données sur l’excrétion du fulvestrant dans le lait maternel. Compte tenu du risque potentiel d’effets indésirables graves du fulvestrant pour le nourrisson allaité, l’utilisation en cours d’allaitement est contre-indiquée (voir rubrique 4.3).
Fertilité
Les effets de FULVESTRANT TEVA sur la fertilité dans l’espèce humaine n’ont pas été étudiés.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Résumé du profil de sécurité
Monothérapie
Cette rubrique fournit des informations basées sur tous les effets indésirables observés lors des études cliniques, des études postérieures à la mise sur le marché ou des déclarations spontanées. Sur l’ensemble des données relatives au fulvestrant en monothérapie, les effets indésirables les plus fréquemment rapportés étaient : réactions au site d’injection, asthénie, nausées, et augmentation des enzymes hépatiques (ALAT, ASAT, phosphatases alcalines).
Dans le tableau 1, les catégories de fréquence des effets indésirables ci-après ont été calculées sur la base du groupe traité par fulvestrant 500 mg à partir des analyses de tolérance poolées des études qui ont comparé le fulvestrant 500 mg au fulvestrant 250 mg [CONFIRM (Etude D6997C00002), FINDER 1 (Etude D6997C00004), FINDER 2 (Etude D6697C00006), et NEWEST (Etude D6997C00003)] ou de FALCON (Etude D699BC00001) seule qui a comparé le fulvestrant 500 mg à l’anastrozole 1 mg. Lorsque les fréquences sont différentes entre l’analyse de tolérance poolée et FALCON, la fréquence la plus élevée est présentée. Les fréquences dans le tableau 1 ont été établies à partir de tous les effets indésirables rapportés, indépendamment de l’évaluation de la causalité par l’investigateur. La durée médiane du traitement par fulvestrant 500 mg sur l’ensemble des données (y compris les études mentionnées ci-dessus et FALCON) était de 6,5 mois.
Liste tabulée des effets indésirables
Les effets indésirables listés ci-dessous sont classés par fréquence et par classe de systèmes d’organes (SOC). Les groupes de fréquence sont définis selon la convention suivante : très fréquent (≥ 1/10), fréquent (≥ 1/100, < 1/10), peu fréquent (≥ 1/1 000, < 1/100). Au sein de chaque groupe de fréquence, les effets indésirables sont présentés par ordre décroissant de gravité.
Tableau 1 Effets indésirables rapportés chez les patientes traitées par fulvestrant en monothérapie
|
Effets indésirables par classe de systèmes d’organes et fréquence |
||
|
Infections et infestations |
Fréquent |
Infection du tractus urinaire |
|
Affections hématologiques et du système lymphatique |
Fréquent |
Numération plaquettaire réduitee |
|
Affections du système immunitaire |
Très fréquent |
Réactions d’hypersensibilitée |
|
Peu fréquent |
Réactions anaphylactiques |
|
|
Troubles du métabolisme et de la nutrition |
Fréquent |
Anorexiea |
|
Affections du système nerveux |
Fréquent |
Céphalées |
|
Affections vasculaires |
Très fréquent |
Bouffées de chaleure |
|
Fréquent |
Thrombo-embolies veineusesa |
|
|
Affections gastro-intestinales |
Très fréquent |
Nausées |
|
Fréquent |
Vomissements, diarrhées |
|
|
Affections hépatobiliaires |
Très fréquent |
Enzymes hépatiques élevées (ALAT, ASAT, phosphatases alcalines)a |
|
Fréquent |
Bilirubine élevéea |
|
|
Peu fréquent |
Insuffisance hépatiquec,f, hépatitef, gamma-GT élevéef |
|
|
Affections de la peau et du tissu sous-cutané |
Très Fréquent |
Eruption cutanéee |
|
Affections musculo-squelettiques et systémiques |
Très Fréquent |
Douleurs articulaires et musculo- squelettiquesd |
|
Fréquent |
Douleurs dorsalesa |
|
|
Affections des organes de reproduction et du sein |
Fréquent |
Hémorragie vaginalee |
|
Peu fréquent |
Moniliase vaginalef, leucorrhéef, |
|
|
Troubles généraux et anomalies au site d’administration |
Très fréquent |
Asthéniea, réactions au site d’injectionb |
|
Fréquent |
Neuropathie périphériquee, sciatiquee |
|
|
Peu fréquent |
Hémorragie au site d’injectionf, hématome au site d’injectionf, névralgiec,f |
|
a Inclut des effets indésirables pour lesquels l’étendue exacte de la contribution du fulvestrant ne peut être évaluée en raison de la maladie sous-jacente.
b Le terme réactions au site d’injection n’inclut pas les hémorragies au site d’injection, hématomes au site d’injection, sciatique, névralgie et neuropathie périphérique.
c L’événement n’a pas été observé dans les études cliniques majeures (CONFIRM, FINDER 1, FINDER 2, NEWEST). La fréquence a été calculée en utilisant la limite supérieure de l’intervalle de confiance à 95 % pour l’estimation de la valeur. Elle est calculée à 3/560 (où 560 est le nombre de patients des études cliniques majeures), ce qui correspond à la catégorie de fréquence « peu fréquent ».
d Inclut : arthralgies, et moins fréquemment, douleurs musculo-squelettiques, myalgies et douleurs dans les extrémités.
e La catégorie de fréquence diffère entre les données de tolérance poolées et FALCON.
f Cet effet indésirable n’a pas été observé dans FALCON.
Description des effets indésirables sélectionnés
Les descriptions incluses ci-dessous sont basées sur la population d’analyse de la tolérance composée de 228 patientes ayant respectivement reçu au moins une (1) dose de fulvestrant et de 232 patientes ayant reçu au moins une (1) dose d’anastrozole, dans l’étude de Phase III FALCON.
Douleurs articulaires et musculo-squelettiques
Dans l’étude FALCON, le nombre de patientes ayant rapporté un effet indésirable de douleurs articulaires et musculo-squelettiques a été de 65 (31,2 %) et de 48 (24,1 %) respectivement dans les bras fulvestrant et anastrozole. Sur les 65 patientes du bras fulvestrant, 40 % (26/65) ont rapporté des douleurs articulaires et musculo-squelettiques au cours du premier mois de traitement et 66,2 % (43/65) au cours des 3 premiers mois de traitement. Aucune patiente n’a rapporté d’événements de grade CTCAE ≥ 3 ou ayant nécessité une réduction de la dose, une interruption du traitement ou l’arrêt du traitement en raison de ces effets indésirables.
Traitement en association avec le palbociclib
Le profil de sécurité global du fulvestrant lorsqu'il est utilisé en association avec le palbociclib est basé sur les données de 517 patientes atteintes d’un cancer du sein avancé ou métastatique RH-positif, HER2-négatif dans l'étude randomisée PALOMA3 (voir rubrique 5.1). Les effets indésirables les plus fréquents (≥ 20 %) tous grades confondus signalés chez les patientes recevant du fulvestrant en association avec le palbociclib étaient la neutropénie, la leucopénie, les infections, la fatigue, la nausée, l'anémie, la stomatite, la diarrhée, la thrombocytopénie et les vomissements. Les effets indésirables de grade ≥ 3 les plus fréquents (≥ 2 %) étaient la neutropénie, la leucopénie, les infections, l'anémie, l'augmentation du taux d’ASAT, la thrombocytopénie et la fatigue.
Le tableau 2 rapporte les effets indésirables de PALOMA3.
La durée médiane de l'exposition au fulvestrant était de 11,2 mois dans le bras fulvestrant + palbociclib et de 4,8 mois dans le bras fulvestrant + placebo. La durée médiane de l'exposition au palbociclib dans le bras fulvestrant + palbociclib était de 10,8 mois.
Tableau 2 Réactions indésirables basées sur l’étude PALOMA3 (N=517)
|
Classes de systèmes d’organes Fréquence Termes préférentielsa |
Fulvestrant + Palbociclib (N=345) |
Fulvestrant +placebo (N=172) |
||
|
Tous grades |
Grade ≥ 3 |
Tous grades |
Grade ≥ 3 |
|
|
Infections et infestations |
||||
|
Très fréquent |
|
|
|
|
|
Infectionsb |
188 (54,5) |
19 (5,5) |
60 (34,9) |
6 (3,5) |
|
Affections hématologiques et du système lymphatique |
||||
|
Très fréquent |
|
|
|
|
|
Neutropéniec |
290 (84,1) |
240 (69,6) |
6 (3,5) |
0 |
|
Leucopénied |
207 (60,0) |
132 (38,3) |
9 (5,2) |
1 (0,6) |
|
Anémiee |
109 (31,6) |
15 (4,3) |
24 (14,0) |
4 (2,3) |
|
Thrombocytopénief |
88 (25,5) |
10 (2,9) |
0 |
0 |
|
Peu fréquent |
|
|
|
|
|
Neutropénie fébrile |
3 (0,9) |
3 (0,9) |
0 |
0 |
|
Troubles du métabolisme et de la nutrition |
||||
|
Très fréquent |
|
|
|
|
|
Diminution de l’appétit |
60 (17,4) |
4 (1,2) |
18 (10,5) |
1 (0,6) |
|
Affections du système nerveux |
||||
|
Fréquent |
|
|
|
|
|
Dysgueusie |
27 (7,8) |
0 |
6 (3,5) |
0 |
|
Affections oculaires |
||||
|
Fréquent |
|
|
|
|
|
Augmentation de la sécrétion lacrymale |
25 (7,2) |
0 |
2 (1,2) |
0 |
|
Vision trouble |
24 (7,0) |
0 |
3 (1,7) |
0 |
|
Sécheresse oculaire |
15 (4,3) |
0 |
3 (1,7) |
0 |
|
Affections respiratoires, thoraciques et médiastinales |
||||
|
Fréquent |
|
|
|
|
|
Epistaxis |
25 (7,2) |
0 |
4 (2,3) |
0 |
|
Affections gastro-intestinales |
||||
|
Très fréquent |
|
|
|
|
|
Nausée |
124 (35,9) |
2 (0,6) |
53 (30,8) |
1 (0,6) |
|
Stomatiteg |
104 (30,1) |
3 (0,9) |
24 (14,0) |
0 |
|
Diarrhées |
94 (27,2) |
0 |
35 (20,3) |
2 (1,2) |
|
Vomissement |
75 (21,7) |
2 (0,6) |
28 (16,3) |
1 (0,6) |
|
Affections de la peau et du tissu sous-cutané |
||||
|
Très fréquent |
|
|
|
|
|
Alopécie |
67 (19,4) |
NA |
11 (6,4) |
NA |
|
Eruption cutanéeh |
63 (18,3) |
3 (0,9) |
10 (5,8) |
0 |
|
Fréquent |
|
|
|
|
|
Sécheresse cutanée |
28 (8,1) |
0 |
3 (1,7) |
0 |
|
Troubles généraux et anomalies au site d’administration |
||||
|
Très fréquent |
|
|
|
|
|
Fatigue |
152 (44,1) |
9 (2,6) |
54 (31,4) |
2 (1,2) |
|
Fièvre |
47 (13,6) |
1 (0,3) |
10 (5,8) |
0 |
|
Fréquent |
|
|
|
|
|
Asthénie |
27 (7,8) |
1 (0,3) |
13 (7,6) |
2 (1,2) |
|
Investigations |
||||
|
Très fréquent |
|
|
|
|
|
Augmentation des ASAT |
40 (11,6) |
11 (3,2) |
13 (7,6) |
4 (2,3) |
|
Fréquent |
|
|
|
|
|
Augmentation des ALAT |
30 (8,7) |
7 (2,0) |
10 (5,8) |
1 (0,6) |
ALAT = alanine aminotransférase ; ASAT = aspartate aminotransférase ; N/n = nombre de patientes ; NA = non applicable
a Les termes préférentiels (PT) sont répertoriés selon le dictionnaire MedDRA 17.1.
b Le terme infections inclut tous les PT de la classe de systèmes d’organes infections et infestations.
c Le terme neutropénie inclut les PT suivants : neutropénie, neutrophiles diminués.
d Le terme leucopénie inclut les PT suivants : leucopénie, globules blancs diminués.
e Le terme anémie inclut les PT suivants : anémie, hémoglobine diminuée, hématocrite diminuée.
f Le terme thrombocytopénie inclut les PT suivants : thrombocytopénie, numération plaquettaire diminuée.
g Le terme stomatite inclut les PT suivants : stomatite aphteuse, chéilite, glossite, glossodynie, ulcération buccale, inflammation muqueuse, douleur buccale, gêne oropharyngé, douleur oropharyngée, stomatite.
h Le terme éruption cutanée inclut les PT suivants : éruption cutanée, éruption cutanée maculopapuleuse, éruption cutanée prurigineuse, éruption cutanée érythémateuse, éruption cutanée papuleuse, dermatite, dermatite acnéiforme, éruption cutanée toxique.
Description des effets indésirables sélectionnés
Neutropénie
Chez les patientes recevant du fulvestrant en association avec le palbociclib dans l'étude PALOMA3, une neutropénie tous grades confondus a été rapportée chez 290 patientes (84,1 %), une neutropénie de grade 3 étant signalée chez 200 patientes (58,0 %) et une neutropénie de grade 4 étant signalée chez 40 patientes (11,6 %).
Dans le bras fulvestrant + placebo (n = 172), une neutropénie de n'importe quelle classe a été signalée chez 6 patientes (3,5 %). Aucun cas de neutropénie de grade 3 et 4 n’a été rapporté dans le bras fulvestrant + placebo.
Chez les patientes recevant du fulvestrant en association avec le palbociclib, le temps moyen du premier épisode de neutropénie de n’importe quel grade était de 15 jours (entre 13 et 512 jours) et la durée moyenne de neutropénie de grade ≥ 3 était de 16 jours. Une neutropénie fébrile a été signalée chez 3 des patientes (0,9 %) recevant du fulvestrant en association avec le palbociclib.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/.
Des cas isolés de surdosage ont été rapportés avec le fulvestrant chez l’humain. En cas de surdosage, un traitement symptomatique est recommandé. Au cours des études chez l’animal, aucun effet autre que ceux liés directement ou indirectement à l’activité anti-estrogène n’a été mis en évidence à des doses plus élevées de fulvestrant (voir rubrique 5.3).
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : Thérapeutique endocrine, Anti-estrogènes, code ATC : L02BA03.
Mécanisme d’action et effets pharmacodynamiques
Le fulvestrant est un antagoniste compétitif des récepteurs aux estrogènes (RE) avec une affinité comparable à l’estradiol. Le fulvestrant bloque les actions trophiques des estrogènes sans posséder une quelconque activité agoniste partielle (de type estrogène). Son mécanisme d’action est associé à une diminution des taux d’expression de la protéine du récepteur aux estrogènes. Des études cliniques menées chez des patientes ménopausées présentant un cancer primaire du sein ont montré que le fulvestrant diminuait significativement l’expression de la protéine RE dans les tumeurs RE positives par comparaison au placebo. Une diminution significative de l’expression des récepteurs à la progestérone a été également observée, en corrélation avec l’absence d’effet estrogénique intrinsèque. Il a été également montré que le fulvestrant 500 mg diminue l’expression de la protéine RE et la prolifération du marqueur Ki67, d’une manière plus importante que le fulvestrant 250 mg en traitement néo-adjuvant des tumeurs mammaires après la ménopause.
Efficacité et sécurité cliniques dans le cancer du sein à un stade avancé
Monothérapie
Une étude clinique de Phase III a été réalisée chez 736 femmes ménopausées atteintes d’un cancer du sein à un stade avancé, dont la maladie a récidivé pendant ou après une hormonothérapie adjuvante ou dont la maladie a progressé suite à une hormonothérapie. L’étude a inclus 423 patientes dont la maladie a récidivé ou progressé sous traitement par anti-estrogène (sous-groupe AE) et 313 patientes dont la maladie a récidivé ou progressé sous traitement par inhibiteur de l’aromatase (sous-groupe IA). Cette étude a comparé l’efficacité et la tolérance du fulvestrant 500 mg (n = 362) au fulvestrant 250 mg (n = 374). Le critère principal était la survie sans progression (SSP), les critères secondaires clés d’efficacité incluaient le taux de réponse objective (RO%), le bénéfice clinique (BC) et la survie globale (SG). Les résultats d’efficacité de l’étude CONFIRM sont résumés dans le Tableau 3.
Tableau 3 Résumé des résultats du critère principal d’efficacité (SSP) et des critères secondaires clés d’efficacité de l’étude CONFIRM
|
Variable |
Méthode de calcul ; |
Fulvestrant 500 mg (N = 362) |
Fulvestrant 250 mg (N = 374) |
Comparaison entre les groupes |
||
|
|
|
|
|
Hazard ratio |
IC à 95 % |
Valeur de p |
|
SSP |
Médiane en mois de K-M ; |
|
|
|
|
|
|
Population globale -sous-groupe AE (n = 423) -sous-groupe IA (n = 313)a |
6,5 8,6 5,4 |
5,5 5,8 4,1 |
0,80 0,76 0,85 |
0,68 - 0,94 0,62 - 0,94 0,67 - 1,08 |
0,006 0,013 0,195 |
|
|
SGb |
Médiane en mois de K-M ; |
26,4 30,6 24,1 |
22,3 23,9 20,8 |
0,81 0,79 0,86 |
0,69 - 0,96 0,63 - 0,99 0,67 - 1,11 |
0,016c 0,038c 0,241c |
|
Population globale -sous-groupe AE (n = 423) -sous-groupe IA (n = 313)a |
||||||
|
Variable |
Méthode de calcul ; |
Fulvestrant 500 mg (N = 362) |
Fulvestrant 250 mg (N = 374) |
Comparaison entre les groupes
|
||
|
|
|
|
|
Différence absolue en % |
IC à 95 % |
|
|
RO(%)d |
% de patients avec une RO ; |
13,8 18,1 7,3 |
14,6 19,1 8,3 |
-0,8 -1,0 -1,0 |
-5,8 - 6,3 -8,2 - 9,3 -5,5 - 9,8 |
|
|
Population globale -sous-groupe AE (n = 296) -sous-groupe IA (n = 205)a |
||||||
|
BC(%)e |
% de patients avec un BC ; |
45,6 52,4 36,2 |
39,6 45,1 32,3 |
6,0 7,3 3,9 |
-1,1 - 13,3 -2,2 - 16,6 -6,1 - 15,2 |
|
|
Population globale -sous-groupe AE (n = 423) -sous-groupe IA (n = 313)a |
||||||
a Fulvestrant est indiqué chez les patientes dont la maladie a récidivé ou progressé sous traitement par anti-estrogène. Les résultats du sous-groupe IA ne peuvent faire l’objet d’une conclusion.
b La survie globale est présentée pour les analyses finales de survie à 75 % de maturité.
c Valeur de p sans ajustements pour la multiplicité des tests entre les analyses initiales de la survie globale à 50 % de maturité et les analyses actualisées de survie à 75 % de maturité.
d Le taux de RO a été calculé chez les patientes qui étaient évaluables à l’inclusion (c.-à-d., celles avec une pathologie mesurable à l’inclusion : 240 patientes dans le groupe fulvestrant 500 mg et 261 patientes dans le groupe fulvestrant 250 mg).
e Patientes dont la meilleure réponse objective est soit une réponse complète, soit une réponse partielle, soit une stabilité de la maladie ≥ 24 semaines.
SSP : Survie sans progression ; RO(%) : Taux de réponse objective ; RO : Réponse objective ; BC(%) : Pourcentage de bénéfice clinique ; BC : Bénéfice clinique ; SG : Survie globale ; K-M : Kaplan-Meier ; IC : Intervalle de confiance ; IA : Inhibiteur de l’Aromatase ; AE : Anti-Estrogène.
Une étude multicentrique de Phase III, randomisée, en double aveugle, double insu, évaluant fulvestrant 500 mg versus anastrozole 1 mg, a été conduite chez des femmes ménopausées atteintes d’un cancer du sein localement avancé ou métastatique, avec des RE positifs et/ou des RP positifs, non traitées précédemment par hormonothérapie. Au total, 462 patientes ont été randomisées de manière séquentielle selon un rapport 1/1 pour recevoir soit le fulvestrant 500 mg soit l’anastrozole 1 mg. La randomisation a été stratifiée en fonction du stade de la maladie (localement avancée ou métastatique), de la chimiothérapie antérieure pour une maladie avancée et des signes mesurables de la maladie.
Le critère principal d’efficacité de l’étude était la survie sans progression (SSP) évaluée par l’investigateur selon les critères RECIST 1.1 (Response Evaluation Criteria in Solid Tumors). Les critères secondaires clés d’efficacité incluaient la survie globale (SG) et le taux de réponse objective (TRO).
L’âge médian des patientes incluses dans cette étude étaient de 63 ans (de 36 à 90 ans). La majorité des patientes (87,0 %) avaient une maladie métastatique à l’inclusion. Cinquante-cinq pour cent (55,0 %) des patientes avaient des métastases viscérales à l’inclusion. Au total, 17,1 % des patientes avaient reçu une chimiothérapie antérieure pour une maladie avancée ; 84,2 % des patientes avaient une maladie mesurable.
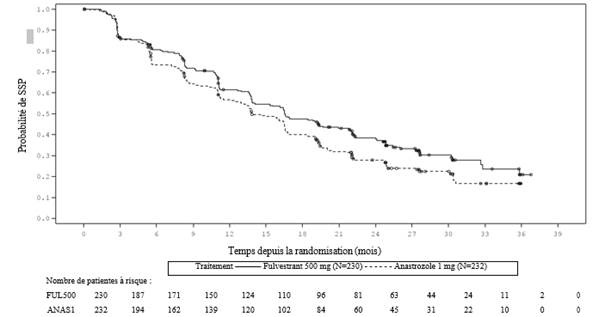
Des résultats cohérents ont été observés dans la majorité des sous-groupes de patientes pré-spécifiés. Pour le sous-groupe de patientes avec une maladie limitée à des métastases non viscérales (n = 208), le HR a été de 0,592 (IC à 95 % : 0,419-0,837) dans le bras fulvestrant comparé au bras anastrozole. Pour le sous-groupe de patientes avec des métastases viscérales (n = 254), le HR a été de 0,993 (IC à 95 % : 0,740-1,331) dans le bras fulvestrant comparé au bras anastrozole. Les résultats d’efficacité de l’étude FALCON sont présentés dans le Tableau 4 et la Figure 1.
Tableau 4 Résumé des résultats du critère principal d’efficacité (SSP) et des critères secondaires clés d’efficacité (évaluation par l’investigateur, population en intention de traiter) - étude FALCON
|
|
Fulvestrant 500 mg (N = 230) |
Anastrozole 1 mg (N = 232) |
|
Survie sans progression |
||
|
Nombre d’événements de SSP (%) |
143 (62,2 %) |
166 (71,6 %) |
|
Hazard ratio pour la SSP (IC à 95 %) et valeur de p |
HR 0,797 (0,637 - 0,999) |
|
|
p = 0,0486 |
||
|
Médiane de SSP [mois (IC à 95 %)] |
16,6 (13,8, 21,0) |
13,8 (12,0, 16,6) |
|
Nombre d’événements de SG* |
67 (29,1 %) |
75 (32,3 %) |
|
Hazard ratio pour la SG (IC à 95 %) et valeur de p |
HR 0,875 (0,629 – 1,217) |
|
|
p = 0,4277 |
||
|
TRO** |
89 (46,1 %) |
88 (44,9 %) |
|
Odds ratio pour le TRO (IC à 95 %) et valeur de p |
OR 1,074 (0,716 – 1,614) |
|
|
p = 0,7290 |
||
|
DDR médiane (mois) |
20,0 |
13,2 |
|
TBC |
180 (78,3 %) |
172 (74,1 %) |
|
Odds ratio pour le TBC (IC à 95 %) et valeur de p |
OR 1,253 (0,815 – 1,932) |
|
|
p = 0,3045 |
||
*(31 % de maturité) – analyse de la SG non finale
**pour les patientes avec une maladie mesurable
Figure 1 Courbe de Kaplan-Meier de la survie sans progression (évaluation par l’investigateur, population en intention de traiter) ─ étude FALCON
Deux études cliniques de Phase III ont été réalisées chez 851 femmes ménopausées atteintes d’un cancer du sein à un stade avancé, dont la maladie a récidivé pendant ou après une hormonothérapie adjuvante ou dont la maladie a progressé suite à une hormonothérapie. Soixante-dix-sept pour cent (77 %) de la population de l’étude présentait un cancer du sein avec des récepteurs aux estrogènes positifs. Ces études ont comparé la tolérance et l’efficacité d’une administration mensuelle du fulvestrant 250 mg à celles de l’administration quotidienne d’1 mg d’anastrozole (inhibiteur de l’aromatase). Fulvestrant à la dose mensuelle de 250 mg s’est montré dans son ensemble au moins aussi efficace que l’anastrozole en termes de survie sans progression, de réponse objective, de temps jusqu’au décès. Aucune différence statistiquement significative n’a été observée sur ces critères entre les deux groupes de traitement. Le critère principal était la survie sans progression. L’analyse combinée des deux études montre que 83 % des patientes du groupe fulvestrant ont vu leur maladie progresser contre 85 % des patientes du groupe anastrozole. L’analyse combinée des deux études montrait que le hazard ratio du fulvestrant 250 mg par rapport à l’anastrozole pour la survie sans progression était de 0,95 (IC à 95 % 0,82 à 1,10). Le taux de réponse objective était de 19,2 % dans le groupe fulvestrant 250 mg, de 16,5 % dans le groupe anastrozole. Le délai médian jusqu’au décès a été de 27,4 mois pour les patientes traitées par le fulvestrant et de 27,6 mois pour les patientes traitées par l’anastrozole. Le hazard ratio du fulvestrant 250 mg par rapport à l’anastrozole pour le temps jusqu’au décès était de 1,01 (IC à 95 % 0,86 à 1,19).
Traitement en association avec le palbociclib
Une étude multicentrique de phase III, internationale, randomisée, en double aveugle, en groupes parallèles, évaluant fulvestrant 500 mg plus palbociclib 125 mg versus fulvestrant 500 mg plus placebo, a été conduite chez des femmes atteintes d’un cancer du sein localement avancé, RH positif, HER2 négatif, non éligible à une résection chirurgicale ou à une radiothérapie à visée curative, ou d’un cancer du sein métastatique, quel que soit leur statut ménopausique, dont la maladie a progressé après une hormonothérapie antérieure dans le cadre d’un traitement (néo) adjuvant ou métastatique.
Au total, 521 femmes en pré/périménopause et ménopausées dont la maladie avait progressé durant ou dans les 12 mois suivant l’arrêt de l’hormonothérapie adjuvante, durant ou au cours du mois suivant une hormonothérapie antérieure pour une maladie avancée, ont été randomisées selon un rapport 2/1 pour recevoir l’association fulvestrant plus palbociclib ou fulvestrant plus placebo, et stratifiées selon la sensibilité documentée à une hormonothérapie antérieure, le statut ménopausique à l’entrée dans l’étude (pré/périménopause versus ménopause), et la présence de métastases viscérales. Les femmes en pré/périménopause ont reçu la goséréline en tant qu’agoniste de la LHRH. Les patientes présentant une extension viscérale, symptomatique, avancée/métastatique, et qui risquaient des complications mettant en jeu leur pronostic vital à court terme (incluant les patientes avec épanchement massif non contrôlé [pleural, péricardique, péritonéal], lymphangite pulmonaire et atteinte hépatique supérieure à 50 %), n’étaient pas éligibles à l’inclusion dans l’étude.
Les patientes ont poursuivi le traitement attribué jusqu’à progression objective de la maladie, détérioration des symptômes, toxicité inacceptable, décès, ou retrait du consentement, en fonction de la survenue du premier événement. Un cross-over entre les bras de traitement n’était pas autorisé.
Les patientes étaient bien appariées selon les caractéristiques démographiques et pronostiques à l’entrée dans l’étude entre le bras fulvestrant plus palbociclib et le bras fulvestrant plus placebo. L’âge médian des patientes incluses dans cette étude était de 57 ans (de 29 à 88 ans). Dans chacun des bras de traitement, la majorité des patientes étaient d’origine caucasienne, présentaient une sensibilité documentée à une hormonothérapie antérieure et étaient ménopausées.
Environ 20 % des patientes étaient en pré/périménopause. Toutes les patientes avaient reçu un traitement systémique antérieur et la plupart des patientes de chacun des bras de traitement avaient reçu une chimiothérapie préalable pour leur diagnostic initial. Plus de la moitié d’entre elles (62 %) présentaient un indice de performance ECOG de 0 ; 60 % présentaient des métastases viscérales et 60 % avaient reçu plusieurs traitements hormonaux antérieurs pour leur diagnostic initial.
Le critère d’évaluation principal de l’étude a été la SSP évaluée par l’investigateur selon les critères RECIST 1.1. Des analyses complémentaires sur la SSP ont été réalisées sur la base d’une revue radiologique centralisée indépendante. Les critères d’évaluation secondaires ont été les suivants : TRO, TBC, survie globale (SG), tolérance, et délai avant détérioration (TTD) du critère composite de la douleur.
L’étude a atteint son critère principal sur l’allongement de la SSP évaluée par l’investigateur lors de l’analyse intermédiaire réalisée sur 82 % des événements de SSP prévus ; les résultats ont dépassé la limite d’efficacité pré-spécifiée de Haybittle-Peto (α = 0,00135), démontrant un allongement statistiquement significatif de la SSP et un effet cliniquement significatif du traitement. Des données d’efficacité actualisées sont présentées dans le Tableau 5.
Après une période de suivi médiane de 45 mois, l’analyse finale de la SG a été effectuée sur la base de 310 événements (60 % des patients randomisés). Une différence de 6,9 mois a été observée au niveau de la SG médiane dans le bras palbociclib plus fulvestrant par rapport au bras placebo plus fulvestrant ; ce résultat n’était pas statistiquement significatif au seuil de significativité prédéfini de 0,0235 (test unilatéral). Dans le bras placebo plus fulvestrant, 15,5 % des patients randomisés ont reçu du palbociclib et d’autres inhibiteurs des CDK comme traitements ultérieurs post-progression.
Les résultats de la SSP évaluée par l’investigateur et les données de SG finales provenant de l’étude PALOMA3 sont présentés dans le Tableau 5. Les courbes de Kaplan-Meier correspondantes sont représentées au Figures 2 et 3, respectivement.
Tableau 5 Résultats d’efficacité - étude PALOMA3 (évaluation par l’investigateur, population en intention de traiter)
|
|
Analyse actualisée (au 23 octobre 2015) |
|
|
Fulvestrant plus palbociclib (N = 347) |
Fulvestrant plus placebo (N = 174) |
|
|
Survie sans progression |
|
|
|
Médiane [mois (IC à 95 %)] |
11,2 (9,5 ; 12,9) |
4,6 (3,5 ; 5,6) |
|
Hazard ratio (IC à 95 %) et valeur de p |
0,497 (0,398 ; 0,620), p <0,000001 |
|
|
Critères d’évaluation secondaires |
||
|
TRO [% (IC à 95 %)] |
26,2 (21,7 ; 31,2) |
13,8 (9,0 ; 19,8) |
|
TRO (maladie mesurable) [% (IC à 95 %)] |
33,7 (28,1 ; 39,7) |
17,4 (11,5 ; 24,8) |
|
TBC [% (IC à 95 %)] |
68,0 (62,8 ; 72,9) |
39,7 (32,3 ; 47,3) |
|
Survie globale (SG) finale (Au 13 avril 2018) |
||
|
Nombre d’événements (%) |
201 (57,9) |
109 (62,6) |
|
Médiane [mois (IC à 95 %)] |
34,9 (28,8 ; 40,0) |
28,0 (23,6 ; 34,6) |
|
Hazard ratio (IC à 95 %) et valeur de p |
0,814 (0,644 ; 1,029) p = 0,0429* |
|
TBC = taux de bénéfice clinique ; IC = intervalle de confiance ; N = nombre de patientes ; TRO = taux de réponse objective
Les résultats du critère d’évaluation secondaire reposent sur les réponses confirmées et non confirmées selon les critères RECIST 1.1.
* Non statistiquement significatif.
Valeur de p unilatérale basée sur un test du log-rank stratifié par la présence de métastases viscérales et la sensibilité à l’hormonothérapie antérieure par randomisation.
Figure 2 Courbe de Kaplan-Meier de la survie sans progression (évaluation par l’investigateur, population en intention de traiter) – étude PALOMA3 (au 23 octobre 2015)
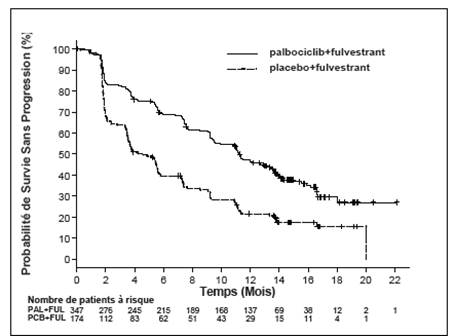
FUL = fulvestrant ; PAL = palbociclib ; PCB = placebo.
Dans le bras fulvestrant plus palbociclib, une réduction du risque de progression de la maladie ou de décès a été observée dans tous les sous-groupes de patientes définis par les facteurs de stratification et les caractéristiques initiales. Cela a été mis en évidence chez les femmes en pré/périménopause (HR de 0,46 [IC à 95 % : 0,28 - 0,75]) et les femmes ménopausées (HR de 0,52 [IC à 95 % : 0,40 - 0,66]), les patientes présentant des métastases viscérales (HR de 0,50 [IC à 95 % : 0,38 - 0,65]) et les patientes présentant des métastases non viscérales (HR de 0,48 [IC à 95 % : 0,33 - 0,71]). Un bénéfice a également pu être observé quel que soit le nombre de lignes de traitement antérieur dans le contexte métastatique : que ce soit 0 (HR de 0,59 [IC à 95 % : 0,37 - 0,93]), 1 (HR de 0,46 [IC à 95 % : 0,32 - 0,64]), 2 (HR de 0,48 [IC à 95 % : 0,30 - 0,76]), ou ≥ 3 lignes (HR de 0,59 [IC à 95 % : 0,28 - 1,22]).
Figure 3. Courbe de Kaplan-Meier de la survie globale (population en intention de traiter) Etude PALOMA3 (au 13 avril 2018)
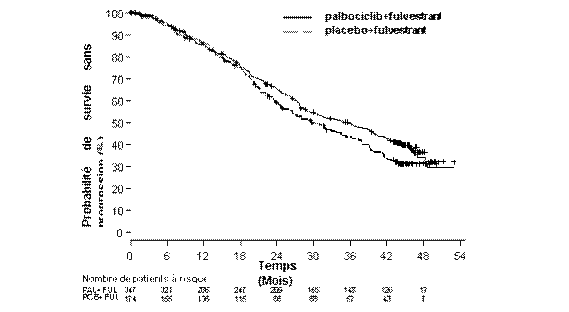
FUL = fulvestrant ; PAL = palbociclib ; PCB = placebo.
Des paramètres d’efficacité additionnels (TRO et TRT) évalués dans des sous-groupes de patientes avec ou sans maladie viscérale sont présentés dans le Tableau 6.
Tableau 6 Résultats d’efficacité de l’étude PALOMA3 dans la maladie viscérale et non viscérale (population en intention de traiter)
|
|
Maladie viscérale |
Maladie non viscérale |
||
|
|
Fulvestrant plus palbociclib |
Fulvestrant plus placebo |
Fulvestrant plus palbociclib |
Fulvestrant plus placebo |
|
TRO [% (IC à 95 %)] |
35,0 |
13,3 |
13,5 |
14,5 |
|
|
(28,5 ; 41,9) |
(7,5 ; 21,4) |
(8,3 ; 20,2) |
(7,2 ; 25,0) |
|
TRT*, Médiane |
3,8 |
5,4 |
3,7 |
3,6 |
|
[mois (intervalle)] |
(3,5 ; 16,7) |
(3,5 ; 16,7) |
(1,9 ; 13,7) |
(3,4 ; 3,7) |
*Critères d’évaluation de la réponse sur la base des réponses confirmées et non confirmées.
N = nombre de patientes ; IC = intervalle de confiance ; TRO = taux de réponse objective ; TRT = temps jusqu’à obtention de la première réponse tumorale.
Les symptômes rapportés par les patientes ont été évalués à l’aide du questionnaire sur la qualité de vie de l’European Organization for Research and Treatment of Cancer (EORTC) (QLQ)-C30 et de son module spécifique sur le cancer du sein (EORTC QLQ-BR23). Au total, 335 patientes du bras fulvestrant plus palbociclib et 166 patientes du bras fulvestrant plus placebo ont rempli le questionnaire à l’inclusion et au cours d’au moins une visite après la visite à l’inclusion dans l’étude.
Le délai avant détérioration était prédéfini comme étant le délai entre l’inclusion et la première survenue d’une augmentation ≥ 10 points des scores en termes de symptômes douloureux. L’ajout du palbociclib au fulvestrant a apporté un bénéfice sur les symptômes en allongeant significativement le délai avant détérioration de la douleur en comparaison avec l’association de fulvestrant plus placebo (médiane de 8,0 mois versus 2,8 mois ; HR de 0,64 [IC à 95 % : 0,49 - 0,85] ; p < 0,001).
Effets sur l’endomètre post-ménopausique
Les données pré-cliniques ne suggèrent pas un effet stimulant du fulvestrant sur l’endomètre post-ménopausique (voir rubrique 5.3). Une étude de 2 semaines réalisée chez des volontaires saines ménopausées traitées par 20 microgrammes/jour d’éthinylestradiol a montré qu’un pré-traitement par 250 mg de fulvestrant réduit significativement la stimulation de l’endomètre post-ménopausique comparé à un pré-traitement par placebo, évaluée par ultrasons de l’épaisseur de l’endomètre.
Un traitement néo-adjuvant jusqu’à 16 semaines chez des patientes ayant un cancer du sein traitées par le fulvestrant 500 mg ou fulvestrant 250 mg n’a pas entraîné des modifications cliniquement significatives de l’épaisseur de l’endomètre, indiquant une absence d’effet agoniste. Il n’y a aucune preuve d’effets indésirables sur l’endomètre chez les patientes étudiées atteintes d’un cancer du sein. Aucune donnée n’est disponible sur la morphologie de l’endomètre.
Dans deux études à court terme (1 et 12 semaines) portant sur des patientes préménopausées souffrant de pathologies gynécologiques bénignes, aucune différence significative au niveau de l’épaisseur de l’endomètre (mesures par ultra-sons) n’a été observée entre les groupes fulvestrant et placebo.
Effets sur l’os
Il n’y a pas de données sur les effets à long terme du fulvestrant sur l’os. Un traitement néo-adjuvant jusqu’à 16 semaines chez des patientes ayant un cancer du sein traitées par le fulvestrant 500 mg ou fulvestrant 250 mg n’a pas entraîné des modifications cliniquement significatives au niveau des marqueurs sériques du remodelage osseux.
Population pédiatrique
Le fulvestrant n’est pas indiqué pour une utilisation chez les enfants. L’Agence européenne des médicaments a différé l’obligation de soumettre les résultats d’études réalisées avec le médicament de référence contenant du fulvestrant dans plusieurs sous-groupes de la population pédiatrique ayant un cancer du sein (voir rubrique 4.2 pour les informations concernant l’usage pédiatrique).
Une étude en ouvert de Phase II a étudié la tolérance, l’efficacité et la pharmacocinétique du fulvestrant chez 30 filles âgées de 1 à 8 ans présentant une puberté précoce progressive associée à un syndrome de McCune Albright (SMA). Les patientes pédiatriques ont reçu en intramusculaire une dose mensuelle de 4 mg/kg de fulvestrant. Cette étude de 12 mois a évalué plusieurs critères du SMA et a montré une réduction de la fréquence des saignements vaginaux et un ralentissement du taux d’augmentation de l’âge osseux. Les concentrations minimales à l’état d’équilibre du fulvestrant chez l’enfant dans cette étude étaient alignées avec celles observées chez les adultes (voir rubrique 5.2).
Aucune nouvelle donnée concernant la tolérance n’a été rapportée au cours de cette étude à faible effectif, mais les données à 5 ans ne sont pas encore disponibles.
5.2. Propriétés pharmacocinétiques
Après injection intramusculaire de fulvestrant à action prolongée, le fulvestrant est absorbé lentement et la concentration plasmatique maximale (Cmax) est atteinte au bout de 5 jours environ. L’administration de fulvestrant 500 mg aboutit à des niveaux d’exposition proches de (ou équivalant à) l’état d’équilibre dans le premier mois de l’administration (moyenne [CV] : ASC 475 [33,4 %] ng.jours/ml, Cmax 25,1 [35,3 %] ng/ml, Cmin 16,3 [25,9 %] ng/ml, respectivement). A l’état d’équilibre, les concentrations plasmatiques du fulvestrant se situent dans une fenêtre relativement étroite et présentent jusqu’à environ un facteur 3 entre les concentrations maximales et les concentrations minimales observées. Après injection intramusculaire, les concentrations plasmatiques augmentent proportionnellement à la dose injectée, pour des doses allant de 50 à 500 mg.
Distribution
La distribution du fulvestrant est rapide et importante. Le volume apparent de distribution élevé à l’état d’équilibre (Vdss) d’environ 3 à 5 l/kg suggère une forte distribution extravasculaire. Le fulvestrant est fortement lié (99 %) aux protéines plasmatiques, principalement aux lipoprotéines de très basse densité (VLDL) de basse densité (LDL) et de haute densité (HDL). Aucune étude d’interactions par compétition au niveau des sites de fixation protéique n’a été menée. Le rôle éventuel des globulines se fixant aux hormones sexuelles (SHBG) n’a pas été déterminé.
Biotransformation
Le métabolisme du fulvestrant n’a pas été pleinement étudié mais il implique divers processus éventuels de biotransformation analogues à ceux des stéroïdes endogènes. Les métabolites identifiés (incluant les métabolites 17-cétone, sulfone, 3-sulfate, 3- et 17-glucuronide) présentent une activité inférieure ou similaire à celle du fulvestrant dans les modèles d’études de l’activité anti-estrogénique. Les études réalisées avec des préparations de foie humain et des enzymes humaines recombinantes montrent que parmi les iso-enzymes du cytochrome P450, seul le CYP3A4 intervient dans l’oxydation du fulvestrant, alors que des mécanismes autres que la voie P450 semblent prédominants in vivo.
Les données obtenues in vitro suggèrent que le fulvestrant n’inhibe pas les isoenzymes du cytochrome P450.
Élimination
Le fulvestrant est principalement éliminé sous forme métabolisée. L’élimination se fait principalement dans les fèces, moins de 1 % de la dose étant éliminé dans les urines. La clairance du fulvestrant est élevée, 11 ± 1,7 ml/min/kg, suggérant un taux d’extraction hépatique élevé. La demi-vie terminale (t1/2) après administration intramusculaire dépend du taux d’absorption et a été estimée à 50 jours.
Populations particulières
L’analyse de pharmacocinétique de population effectuée sur les données des études de Phase III n’a détecté aucune modification du profil pharmacocinétique du fulvestrant en fonction de l’âge (33 à 89 ans), du poids (40 à 127 kg) ou de la race des patientes.
Insuffisance rénale
Chez les patientes présentant une insuffisance rénale légère à modérée, aucune modification cliniquement significative des paramètres pharmacocinétiques du fulvestrant n’a été observée.
Insuffisance hépatique
La pharmacocinétique du fulvestrant a été évaluée en dose unique dans une étude clinique chez des femmes atteintes d’une insuffisance hépatique légère à modérée (scores de Child-Pugh A et B). Une dose élevée d’une formulation injectable intramusculaire, de courte durée d’action, a été utilisée. L’ASC des femmes présentant une insuffisance hépatique a été jusqu’à environ 2,5 fois supérieure à celle des sujets sains. Chez les femmes recevant du fulvestrant, une augmentation de l’exposition de cette amplitude devrait être bien tolérée. Les femmes atteintes d’une insuffisance hépatique sévère (score de Child-Pugh C) n’ont pas été évaluées.
Population pédiatrique
La pharmacocinétique du fulvestrant a été évaluée dans une étude clinique chez 30 filles présentant une puberté précoce progressive associée à un syndrome de McCune-Albright (voir rubrique 5.1). Les patientes pédiatriques étaient âgées de 1 à 8 ans et ont reçu en intramusculaire une dose mensuelle de 4 mg/kg de fulvestrant. La moyenne géométrique (écart-type) des concentrations minimales à l’état d’équilibre (Cmin,ss) et l’aire sous la courbe à l’état d’équilibre (ASCss) étaient respectivement de 4,2 (0,9) ng/ml et 3680 (1020) ng.h/ml. Bien que les données recueillies soient limitées, les concentrations minimales à l’état d’équilibre du fulvestrant chez les enfants étaient alignées avec celles observées chez les adultes.
5.3. Données de sécurité préclinique
La toxicité aiguë du fulvestrant est faible.
Le médicament de référence et d’autres formulations de fulvestrant ont été bien tolérées dans les espèces animales étudiées lors des études à doses multiples. Des réactions locales au site d’injection, incluant myosite et granulome ont été attribuées aux excipients, mais la sévérité de la myosite chez le lapin a été plus importante dans le groupe fulvestrant que dans le groupe contrôle (solution saline). Lors des études de toxicité par administration intramusculaire réitérée menées chez le rat et le chien, la plupart des effets observés, particulièrement les effets sur les organes reproducteurs femelles mais aussi sur les organes hormono-sensibles des deux sexes, ont pu être attribués à l’activité anti-estrogénique du fulvestrant. Une artérite au niveau de différents tissus a été observée chez plusieurs chiens après une administration chronique (12 mois).
Dans des études chez des chiens, après administration orale ou intraveineuse, des effets sur le système cardio-vasculaire ont été observés : léger allongement du segment S-T de l’électrocardiogramme (voie orale) et pause sinusale chez un chien (voie intraveineuse). Ces effets sont apparus pour des expositions supérieures à celles utilisées chez des patientes (Cmax > 15 fois) et sont considérés comme peu significatifs en matière de sécurité d’emploi pour l’espèce humaine aux doses cliniques.
Le fulvestrant n’a montré aucun potentiel génotoxique.
Les effets constatés, à des doses similaires aux doses cliniques, sur la reproduction et sur le développement embryonnaire et fœtal sont la conséquence de l’activité anti-estrogène du fulvestrant. Chez les rats, une diminution réversible de la fertilité des femelles, une diminution de la survie embryonnaire, une dystocie et une augmentation de la fréquence des anomalies fœtales y compris de la courbure du tarse ont été observées.
Chez des lapines ayant reçu du fulvestrant, la gestation n’a pu être maintenue. Une augmentation du poids du placenta et des pertes post-implantatoires ont été observées. Chez les lapines, il y a eu une augmentation de l’incidence des modifications fœtales (bascule en arrière du bassin et de la vertèbre présacrée 27).
Une étude de cancérogénicité de deux ans chez les rats (administration intramusculaire de fulvestrant) a mis en évidence une augmentation de la fréquence des tumeurs ovariennes bénignes des cellules de la granulosa chez les rats femelles pour des doses de 10 mg/rat/15 jours, et une augmentation des tumeurs des cellules testiculaires de Leydig chez les mâles. Lors d’une étude de cancérogénicité de deux ans chez la souris (administration orale quotidienne), il y a eu une augmentation de l’incidence des tumeurs du stroma et des cordons sexuels de l’ovaire (à la fois bénignes et malignes) à des doses de 150 et 500 mg/kg/jour. A la dose sans effet pour ces événements, les niveaux d’exposition systémique (ASC) étaient, chez les rats, approximativement de 1,5 fois les niveaux d’exposition humains attendus chez la femelle et de 0,8 fois chez le mâle et, chez les souris, approximativement de 0,8 fois les niveaux d’exposition humains attendus à la fois chez le mâle et chez la femelle. L’induction de telles tumeurs est cohérente avec les modifications pharmacologiques endocriniennes des taux de gonadotropine provoquées par les anti-estrogènes chez des animaux en activité hormonale. De ce fait, ces résultats ne sont pas considérés comme significatifs dans le cadre de l’utilisation du fulvestrant chez des femmes ménopausées souffrant d’un cancer du sein au stade avancé.
Evaluation du risque environnemental (ERE)
Les études sur l’évaluation du risque environnemental ont montré que le fulvestrant présente un potentiel de toxicité pour l’environnement aquatique (voir rubrique 6.6).
Ethanol (96%), alcool benzylique, benzoate de benzyle, huile de ricin raffinée.
6.4. Précautions particulières de conservation
A conserver et transporter réfrigéré (entre 2 °C et 8 °C).
Les excursions de température en dehors de 2 °C – 8 °C doivent être limitées. La conservation à des températures supérieures à 25 °C est exclue, et la durée de conservation à une température moyenne pour le produit inférieure à 25 °C (mais supérieure à 2 °C – 8 °C) ne doit pas excéder 4 mois. Après des excursions de température, le produit doit être replacé immédiatement dans les conditions de conservation recommandées (à conserver et transporter réfrigéré entre 2 °C et 8 °C). Les excursions de température ont un effet cumulatif sur la qualité du produit et la durée de 4 mois ne doit pas être dépassée au cours de la durée de conservation de 2 ans de FULVESTRANT TEVA (voir rubrique 6.3). Une exposition à des températures inférieures à 2 °C n’endommagera pas le produit sous réserve de ne pas le stocker en dessous de -20 °C.
Conserver la seringue préremplie dans l’emballage d’origine à l’abri de la lumière.
6.5. Nature et contenu de l'emballage extérieur
La présentation en seringue préremplie se compose de :
Une seringue préremplie (verre neutre transparent de type I), avec un piston (PP), munie d’un connecteur Luer-Lock, contenant 5 ml de solution de fulvestrant pour injection.
Une aiguille protégée à connecter au corps de la seringue est également fournie.
Ou
Deux seringues préremplies (verre neutre transparent de type I), avec un piston (PP), munies d’un connecteur Luer-Lock, contenant 5 ml de solution de fulvestrant pour injection. Des aiguilles protégées à connecter au corps de la seringue sont également fournies.
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
Instructions pour l’administration
Administrer l'injection selon les recommandations locales pour réaliser des injections intramusculaires de grand volume.
REMARQUE : En raison de la proximité du nerf sciatique sous-jacent, des précautions doivent être prises en cas d'administration de FULVESTRANT TEVA au site d'injection dorso-fessier (voir rubrique 4.4).
Avertissement - Ne jamais stériliser à l’autoclave l’aiguille protégée avant utilisation.
Pendant toute la durée de l’utilisation et de la procédure d’élimination de l’aiguille, les mains doivent toujours rester derrière l’aiguille.
Pour chacune des deux seringues :
|
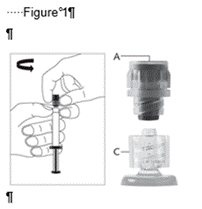
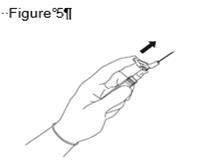
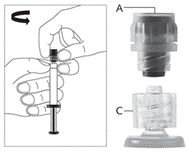
· Retirez le corps de la seringue en verre du plateau-support et vérifiez qu’il n’a pas été endommagé. · Retirez l’emballage extérieur de l’aiguille protégée. · Les solutions à usage parentéral doivent être contrôlées visuellement avant administration afin de détecter la présence de particules ou un changement de coloration. · Tenez la seringue à la verticale sur la partie nervurée (C). Avec l'autre main, saisir le capuchon (A) et tourner soigneusement dans le sens contraire des aiguilles d’une montre jusqu'à la déconnexion du capuchon qui peut alors être retiré (voir Figure 1).
|
|
|
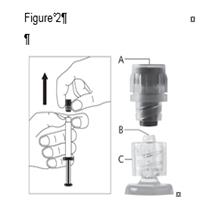
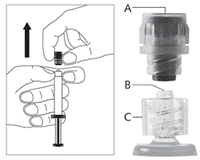
· Retirez le capuchon (A) droit vers le haut. Pour maintenir la stérilité NE PAS TOUCHER L’EMBOUT STERILE DE LA SERINGUE (Luer-Lock) (B) (voir Figure 2).
|
|
|
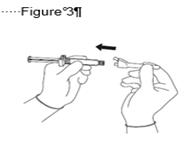
· Fixez l'aiguille protégée sur le connecteur Luer-Lock et tournez fermement jusqu'à fixation (voir Figure 3). · Vérifiez que l'aiguille est verrouillée sur la connexion Luer. · Transportez la seringue remplie jusqu'au site d'injection. · Retirez le protège-aiguille en tirant d'un coup sec afin de ne pas endommager la pointe de l'aiguille
|
|
|
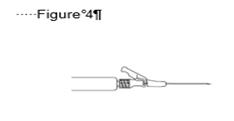
· Chassez les bulles de la seringue. · Injectez lentement en intramusculaire (1-2 minutes/injection) dans le muscle fessier (zone du fessier). Pour plus de facilité, le biseau de l'aiguille est orienté vers le levier (voir Figure 4).
|
|
|
· Après l'injection, enclenchez immédiatement le dispositif de protection de l'aiguille en poussant à fond le levier avec le doigt (voir Figure 5). REMARQUE : Tenez la seringue écartée de vous-même et d'autrui lorsque vous activez le mécanisme de protection. Ecoutez le clic et vérifiez visuellement que l'aiguille a bien été complètement recouverte.
|
|
Elimination
Les seringues préremplies sont exclusivement à usage unique.
Ce médicament peut présenter un risque pour l’environnement aquatique. Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur (voir rubrique 5.3).
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
100-110 ESPLANADE DU GENERAL DE GAULLE
92931 PARIS LA DEFENSE CEDEX
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 301 009 0 5 : Boîte de 1 seringue (verre type I) préremplie de 5 ml avec 1 aiguille protégée.
· 34009 301 030 0 5 : Boîte de 2 seringues (verre type I) préremplies de 5 ml avec 2 aiguilles protégées.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Liste I.
ANSM - Mis à jour le : 22/07/2025
FULVESTRANT TEVA 250 mg, solution injectable en seringue préremplie
Fulvestrant
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin, votre pharmacien ou votre infirmier/ère.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, votre pharmacien ou votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
2. Quelles sont les informations à connaître avant d'utiliser FULVESTRANT TEVA 250 mg, solution injectable en seringue préremplie ?
3. Comment utiliser FULVESTRANT TEVA 250 mg, solution injectable en seringue préremplie ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver FULVESTRANT TEVA 250 mg, solution injectable en seringue préremplie ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE FULVESTRANT TEVA 250 mg, solution injectable en seringue préremplie ET DANS QUELS CAS EST-IL UTILISE ?
Classe pharmacothérapeutique - code ATC : L02BA03
FULVESTRANT TEVA est utilisé soit :
· seul, pour traiter les femmes ménopausées avec un type de cancer du sein appelé cancer du sein positif pour les récepteurs aux estrogènes qui est localement avancé ou qui s’est étendu à d’autres parties du corps (métastatique), ou
· en association avec le palbociclib pour traiter les femmes avec un type de cancer du sein appelé cancer du sein positif pour les récepteurs hormonaux, négatif pour le récepteur 2 du facteur de croissance épidermique humain qui est localement avancé ou qui s’est étendu à d’autres parties du corps (métastatique). Les femmes qui n’ont pas encore atteint la ménopause seront également traitées avec un médicament appelé agoniste du facteur de libération de l’hormone lutéinisante (LHRH).
Lorsque le fulvestrant est administré en association avec le palbociclib, il est important que vous lisiez aussi la notice du palbociclib. Si vous avez des questions concernant le palbociclib, demandez à votre médecin.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER FULVESTRANT TEVA 250 mg, solution injectable en seringue préremplie ?
N’utilisez jamais FULVESTRANT TEVA 250 mg, solution injectable en seringue préremplie :
· si vous êtes allergique au fulvestrant ou à l’un des autres composants contenus dans ce médicament, mentionnés dans la rubrique 6,
· si vous êtes enceinte ou si vous allaitez (voir rubrique « Grossesse et allaitement »),
· si vous avez des problèmes hépatiques sévères.
Avertissements et précautions
Adressez-vous à votre médecin, votre pharmacien ou votre infirmier/ère avant d’utiliser FULVESTRANT TEVA si vous êtes concernée par l’une des situations ci-dessous :
· problèmes au niveau des reins ou du foie ;
· faible taux de plaquettes (qui favorisent la coagulation sanguine) ou maladie associée à des saignements ;
· antécédents de troubles de la coagulation sanguine ;
· ostéoporose (diminution de la densité osseuse) ;
· alcoolisme (voir rubrique « FULVESTRANT TEVA contient de l’éthanol à 96% (alcool) ».
L’efficacité et la sécurité du fulvestrant (en monothérapie ou en association avec le palbociclib) n’ont pas été étudiées chez les patientes présentant une maladie viscérale grave.
Enfants et adolescents
FULVESTRANT TEVA N’EST PAS indiqué chez les enfants et les adolescents de moins de 18 ans.
Autres médicaments et FULVESTRANT TEVA 250 mg, solution injectable en seringue préremplie
Informez votre médecin ou pharmacien si vous prenez, avez récemment pris ou pourriez prendre tout autre médicament.
En particulier, vous devez informer votre médecin si vous prenez des anticoagulants (médicaments destinés à empêcher la formation de caillots sanguins).
FULVESTRANT TEVA 250 mg, solution injectable en seringue préremplie avec des aliments et boissons
Sans objet.
Vous NE devez PAS utiliser FULVESTRANT TEVA en cas de grossesse. Si vous êtes en âge de procréer, vous devez utiliser une contraception efficace pendant le traitement par FULVESTRANT TEVA et pendant 2 ans après avoir reçu la dernière dose.
Vous NE devez PAS allaiter pendant le traitement par FULVESTRANT TEVA.
Conduite de véhicules et utilisation de machines
On ne s’attend pas à ce que FULVESTRANT TEVA puisse influencer l’aptitude à conduire une voiture ou à utiliser des machines. Cependant, si vous ressentez de la fatigue après administration du traitement, NE conduisez PAS ou N’utilisez PAS de machines.
FULVESTRANT TEVA 250 mg, solution injectable en seringue préremplie contient de l’éthanol à 96 % (alcool)
Ce médicament contient 474 mg d’alcool (éthanol) par seringue préremplie de 5 ml, ce qui équivaut à 94,8 mg/ml. La quantité dans une dose de 10 ml de ce médicament équivaut à moins de 24 ml de bière ou 10 ml de vin.
La faible quantité d'alcool contenue dans ce médicament n'est pas susceptible d'entraîner d'effet notable.
FULVESTRANT TEVA 250 mg, solution injectable en seringue préremplie contient de l’alcool benzylique
Ce médicament contient 500 mg d’alcool benzylique par seringue préremplie de 5 ml, ce qui équivaut à 100 mg/ml.
L’alcool benzylique peut provoquer des réactions allergiques.
Demandez conseil à votre médecin ou à votre pharmacien si vous souffrez d’une maladie du foie ou du rein. De grandes quantités d’alcool benzylique peuvent s’accumuler dans votre corps et entraîner des effets secondaires (appelés « acidose métabolique »).
FULVESTRANT TEVA 250 mg, solution injectable en seringue préremplie contient du benzoate de benzyle
Ce médicament contient 750 mg de benzoate de benzyle par seringue préremplie de 5 ml, ce qui équivaut à 150 mg/ml.
3. COMMENT UTILISER FULVESTRANT TEVA 250 mg, solution injectable en seringue préremplie ?
La dose recommandée est de 500 mg de fulvestrant (deux injections de 250 mg/5 ml) une fois par mois, avec une dose supplémentaire de 500 mg administrée 2 semaines après la dose initiale.
Votre médecin ou votre infirmier/ère vous administrera FULVESTRANT TEVA en injection intramusculaire lente, une dans chaque fesse.
Utilisation chez les enfants et les adolescents
Sans objet.
Si vous avez utilisé plus de FULVESTRANT TEVA 250 mg, solution injectable en seringue préremplie que vous n’auriez dû
Sans objet.
Si vous oubliez d’utiliser FULVESTRANT TEVA 250 mg, solution injectable en seringue préremplie
Sans objet.
Si vous arrêtez d’utiliser FULVESTRANT TEVA 250 mg, solution injectable en seringue préremplie
Sans objet.
Si vous avez d’autres questions sur l’utilisation de ce médicament, demandez plus d’informations à votre médecin, à votre pharmacien ou à votre infirmier/ère.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Vous pourriez avoir besoin d’un traitement médical en urgence si vous présentez l’un des effets indésirables suivants :
· réactions allergiques (hypersensibilité) y compris gonflement du visage, des lèvres, de la langue et/ou de la gorge pouvant être des signes de réactions anaphylactiques ;
· thrombo-embolies (risque accru de formation de caillots sanguins)* ;
· inflammation du foie (hépatite) ;
· insuffisance hépatique.
Informez votre médecin, votre pharmacien, ou votre infirmier/ère si vous constatez l’un des effets indésirables suivants :
Effets indésirables rapportés chez les patientes traitées par FULVESTRANT TEVA en monothérapie :
Très fréquent : pouvant affecter plus d’1 personne sur 10
· réactions au site d’injection telles que douleur et/ou inflammation ;
· taux anormal d’enzymes hépatiques (lors des tests sanguins)* ;
· nausées (envie de vomir) ;
· faiblesse, fatigue* ;
· douleurs articulaires et musculo-squelettiques ;
· bouffées de chaleur ;
· eruptions cutanées ;
· réactions allergiques (hypersensibilité) y compris gonflement du visage, des lèvres, de la langue et/ou de la gorge.
Autres effets indésirables :
Fréquent : pouvant affecter jusqu’à 1 personne sur 10
· maux de tête ;
· vomissements, diarrhées ou perte d’appétit* ;
· infections du tractus urinaire ;
· douleurs dorsales* ;
· augmentation de la bilirubine (un pigment biliaire produit par le foie) ;
· thrombo-embolies (risque accru de formation de caillots sanguins)* ;
· taux de plaquettes diminué (thrombocytopénie) ;
· saignements vaginaux ;
· douleurs au niveau du bas du dos irradiant dans la jambe d’un côté (sciatique) ;
· faiblesse soudaine, engourdissements, picotements ou perte de mouvement dans votre jambe, en particulier sur un seul côté de votre corps, des problèmes soudains pour marcher ou d’équilibre (neuropathie périphérique).
Peu fréquent : pouvant affecter jusqu’à 1 personne sur 100
· pertes vaginales épaisses et blanchâtres et candidose (infection) ;
· contusion et saignement au site d’injection ;
· augmentation de la gamma-GT, une enzyme du foie détectée par un test sanguin ;
· inflammation du foie (hépatite) ;
· insuffisance hépatique ;
· engourdissements, picotements et douleurs ;
· réactions anaphylactiques.
* inclut des effets indésirables pour lesquels le rôle exact de FULVESTRANT TEVA ne peut pas être évalué en raison de la maladie sous-jacente.
Effets indésirables rapportés chez les patientes traitées par FULVESTRANT TEVA en association avec le palbociclib :
Très fréquent : pouvant affecter plus d’1 personne sur 10
· diminution du taux de neutrophiles (neutropénie) ;
· diminution du nombre de globules blancs (leucopénie) ;
· infections ;
· fatigue ;
· nausées ;
· diminution du nombre de globules rouges (anémie) ;
· inflammation ou ulcération de la bouche ;
· diarrhée ;
· taux de plaquettes diminué (thrombocytopénie) ;
· vomissements ;
· perte des cheveux ou de poils ;
· rash ;
· perte d’appétit ;
· fièvre.
Fréquent : pouvant affecter jusqu’à 1 personne sur 10
· sensation de faiblesse ;
· taux d’enzymes hépatiques augmenté ;
· perte du goût ;
· saignement de nez ;
· yeux excessivement humides ;
· peau sèche ;
· vision trouble ;
· yeux secs.
Peu fréquent : pouvant affecter jusqu’à 1 personne sur 100
· fièvre accompagnée d’autres signes d’infection (neutropénie fébrile).
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, votre pharmacien ou à votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet: https://signalement.social-sante.gouv.fr/
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER FULVESTRANT TEVA 250 mg, solution injectable en seringue préremplie ?
Tenir ce médicament hors de la vue et de la portée des enfants.
Avant l'administration, n’utilisez pas ce médicament si vous détectez la présence de particules ou un changement de coloration.
A conserver et transporter réfrigéré (entre 2 °C et 8 °C).
Les excursions de température en dehors de 2 °C – 8 °C doivent être limitées. La conservation à des températures supérieures à 25°C est exclue, et la durée de conservation à une température moyenne pour le produit inférieure à 25°C (mais supérieure à 2 °C – 8 °C) ne doit pas excéder 4 mois. Après des excursions de température, le produit doit être replacé immédiatement dans les conditions de conservation recommandées (à conserver et transporter réfrigéré entre 2 °C et 8 °C). Les excursions de température ont un effet cumulatif sur la qualité du produit et la durée de 4 mois ne doit pas être dépassée au cours de la durée de conservation de 2 ans de FULVESTRANT TEVA. Une exposition à des températures inférieures à 2 °C n’endommagera pas le produit sous réserve de ne pas le stocker en dessous de -20 °C.
Conserver la seringue préremplie dans l’emballage d’origine à l’abri de la lumière.
Votre professionnel de santé sera responsable du stockage adéquat, de l’utilisation et de l’élimination du FULVESTRANT TEVA.
Ce médicament peut présenter un risque pour l’environnement aquatique. Ne jetez aucun médicament au tout-à-l’égout
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient FULVESTRANT TEVA 250 mg, solution injectable en seringue préremplie
· La substance active est :
Fulvestrant..................................................................................................................... 250 mg
Pour une seringue préremplie.
Chaque ml de solution contient 50 mg de fulvestrant.
· Les autres composants (excipients) sont :
L’éthanol (96%), l’alcool benzylique, le benzoate de benzyle et l’huile de ricin raffinée.
Il est disponible sous 2 conditionnements :
· Un conditionnement contenant une seringue préremplie en verre et une aiguille protégée à connecter au corps de la seringue.
· Un conditionnement contenant deux seringues préremplies en verre et deux aiguilles protégées à connecter au corps de chaque seringue sont également fournies.
Toutes les présentations peuvent ne pas être commercialisées.
Titulaire de l’autorisation de mise sur le marché
100-110 ESPLANADE DU GENERAL DE GAULLE
92931 PARIS LA DEFENSE CEDEX
Exploitant de l’autorisation de mise sur le marché
100-110 ESPLANADE DU GENERAL DE GAULLE
92931 PARIS LA DEFENSE CEDEX
PLIVA HRVATSKA D.O.O. (PLIVA CROATIA LTD.)
PRILAZ BARUNA FILIPOVICA 25
10000 ZAGREB
CROATIE
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Ce médicament est autorisé dans les Etats membres de l'Espace Economique Européen sous les noms suivants : Conformément à la réglementation en vigueur.
[à compléter ultérieurement par le titulaire]
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).
Les informations suivantes sont destinées exclusivement aux professionnels de santé :
FULVESTRANT TEVA 500 mg (2 x 250 mg/5 ml en solution injectable) doit être administré en utilisant deux seringues préremplies (voir rubrique 3).
Instructions pour l’administration
Administrer l'injection selon les recommandations locales pour réaliser des injections intramusculaires de grand volume.
REMARQUE : En raison de la proximité du nerf sciatique sous-jacent, des précautions doivent être prises en cas d'administration de FULVESTRANT TEVA au site d'injection dorso-fessier (voir rubrique 4.4).
Avertissement – NE JAMAIS stériliser à l’autoclave l’aiguille protégée avant utilisation. Pendant toute la durée de l’utilisation et de la procédure d’élimination de l’aiguille, les mains DOIVENT toujours rester derrière l’aiguille.
Pour chacune des deux seringues :
|
· Retirez le corps de la seringue en verre du plateau-support et vérifiez qu’il n’a pas été endommagé. · Retirez l’emballage extérieur de l’aiguille protégée. · Les solutions à usage parentéral doivent être contrôlées visuellement avant administration afin de détecter la présence de particules ou un changement de coloration. · Tenez la seringue à la verticale sur la partie nervurée (C). Avec l'autre main, saisissez le capuchon (A) et tournez soigneusement dans le sens contraire des aiguilles d’une montre jusqu'à la déconnexion du capuchon qui peut alors être retiré (voir figure 1).
|
Figure 1
|
|
· Retirez le capuchon (A) droit vers le haut. Pour maintenir la stérilité, NE TOUCHEZ PAS L’EMBOUT STERILE DE LA SERINGUE (Luer-Lock) (B) (voir figure 2).
|
Figure 2
|
|
· Fixez l’aiguille protégée sur le connecteur Luer-Lock et tournez fermement jusqu’à fixation (voir figure 3). · Vérifiez que l'aiguille est verrouillée sur la connexion Luer. · Transportez la seringue remplie jusqu’au site d’injection. · Retirez le protège-aiguille en tirant d’un coup sec afin de ne pas endommager la pointe de l’aiguille.
|
Figure 3
|
· Chassez les bulles de la seringue. · Injectez lentement en intramusculaire (1-2 minutes/injection) dans le muscle fessier (zone du fessier). Pour plus de facilité, le biseau de l’aiguille est orienté vers le levier (voir figure 4).
|
Figure 4
|
|
· Après l’injection, enclenchez immédiatement le dispositif de protection de l’aiguille en poussant à fond le levier avec le doigt (voir figure 5). REMARQUE : tenez la seringue écartée de vous-même et d’autrui lorsque vous activez le mécanisme de protection. Ecoutez le clic et vérifiez visuellement que l’aiguille a bien été complètement recouverte.
|
Figure 5
|
Elimination
Les seringues préremplies sont exclusivement à usage unique.
Ce médicament peut présenter un risque pour l’environnement aquatique. Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.