Dernière mise à jour le 01/12/2025
ABIRATERONE TEVA 500 mg, comprimé pelliculé
Indications thérapeutiques
ABIRATERONE TEVA contient un médicament appelé acétate d’abiratérone. Il est utilisé chez les hommes adultes pour traiter le cancer de la prostate qui s’est disséminé dans d’autres parties du corps. ABIRATERONE TEVA arrête la production de testostérone par votre corps, ce qui peut ralentir la croissance du cancer de la prostate.
Lorsqu’ABIRATERONE TEVA est prescrit au stade précoce de la maladie répondant encore à un traitement hormonal, il est utilisé en association avec un traitement qui diminue le taux de testostérone (suppression androgénique).
Lors de votre traitement par ce médicament, votre médecin vous prescrira également un autre médicament appelé prednisone ou prednisolone. Cela permettra de réduire vos risques de développer une pression artérielle élevée, d’accumuler une quantité excessive d’eau dans votre corps (rétention hydrique), ou de présenter des taux réduits d’un composant chimique appelé potassium dans votre sang.
Présentations
> 60 plaquettes unitaires prédécoupées PVC polychlortrifluoroéthylène PVC-Aluminium de 1 comprimé(s)
Code CIP : 34009 302 543 0 1
Déclaration de commercialisation : 09/09/2022
Cette présentation est agréée aux collectivités
- Prix hors honoraire de dispensation : 871,44 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 872,46 €
- Taux de remboursement :100 %
Service médical rendu (SMR)
Amélioration du service médical rendu (ASMR)
Ce médicament étant un générique, l'ASMR n'a pas été évalué par la commission de la transparence (CT), il est possible de se référer à la /aux spécialité(s) de référence du groupe générique auquel appartient ce médicament (cliquez ici pour aller à la rubrique des groupes génériques)
Autres informations
- Titulaire de l'autorisation : TEVA BV
- Conditions de prescription et de délivrance :
- liste I
- prescription initiale hospitalière annuelle
- prescription réservée aux médecins compétents en CANCEROLOGIE
- prescription réservée aux spécialistes et services ONCOLOGIE MEDICALE
- renouvellement non restreint
- Statut de l'autorisation : Valide
- Type de procédure : Procédure décentralisée
- Code CIS : 6 300 167 4
ANSM - Mis à jour le : 13/12/2023
ABIRATERONE TEVA 500 mg, comprimé pelliculé
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Acétate d’abiratérone............................................................................................................ 500 mg
Equivalant à abiratérone..................................................................................................... 446,3 mg
Pour un comprimé pelliculé.
Excipient à effet notoire : chaque comprimé pelliculé contient 85,5 mg de lactose (sous forme monohydratée).
Pour la liste complète des excipients, voir rubrique 6.1.
Comprimés pelliculés jaunes, de forme oblongue, comportant la mention « A436 » gravée en creux sur une face.
Dimensions : environ 19 mm × 8,2 mm.
4.1. Indications thérapeutiques
ABIRATERONE TEVA est indiqué en association avec la prednisone ou la prednisolone dans
· le traitement du cancer métastatique de la prostate hormono-sensible (mHSPC) à haut risque nouvellement diagnostiqué chez les hommes adultes, en association avec un traitement par suppression androgénique (ADT) (voir rubrique 5.1) ;
· le traitement du cancer métastatique de la prostate résistant à la castration (mCRPC) chez les hommes adultes asymptomatiques ou peu symptomatiques, après échec d’un traitement par suppression androgénique et pour lesquels la chimiothérapie n’est pas encore cliniquement indiquée (voir rubrique 5.1) ;
· le traitement du cancer métastatique de la prostate résistant à la castration (mCRPC) chez les hommes adultes dont la maladie a progressé pendant ou après une chimiothérapie à base de docétaxel.
4.2. Posologie et mode d'administration
Ce médicament doit être prescrit par un professionnel de santé habilité.
Posologie
La dose recommandée est de 1 000 mg (deux comprimés de 500 mg) en une seule prise quotidienne et ne doit pas être administrée avec de la nourriture (voir « Mode d’administration » ci-dessous). La prise des comprimés avec la nourriture augmente l’exposition systémique à l’abiratérone (voir rubriques 4.5 et 5.2).
Dose de prednisone ou de prednisolone
Dans le mHSPC, ABIRATERONE TEVA est utilisé en association avec 5 mg de prednisone ou de prednisolone par jour.
Dans le mCRPC, ABIRATERONE TEVA est utilisé en association avec 10 mg de prednisone ou de prednisolone par jour.
La castration médicale par analogue de l’hormone de libération des gonadotrophines hypophysaires (LH-RH) doit être maintenue pendant la durée du traitement pour les patients n’ayant pas subi de castration chirurgicale.
Surveillance recommandée
Les taux de transaminases sériques doivent êtres dosés avant le début du traitement, toutes les deux semaines pendant les trois premiers mois de traitement et tous les mois par la suite. La pression artérielle, le taux de potassium sérique et la rétention hydrique doivent être surveillés mensuellement. Cependant, les patients ayant un risque significatif d’insuffisance cardiaque congestive doivent être surveillés toutes les 2 semaines pendant les trois premiers mois du traitement et tous les mois par la suite (voir rubrique 4.4).
Chez les patients ayant une hypokaliémie pré-existante ou ayant développé une hypokaliémie au cours du traitement par ABIRATERONE TEVA, le maintien de la kaliémie à un taux ≥ 4,0 mM doit être envisagé.
Chez les patients qui développent des toxicités de grade ≥ 3 incluant hypertension artérielle, hypokaliémie, œdème et autres troubles d’origine non minéralocorticoïde, le traitement doit être interrompu et une prise en charge médicale appropriée doit être instaurée. Le traitement par ABIRATERONE TEVA ne doit pas être réintroduit tant que les symptômes de toxicité n’ont pas régressé au grade 1 ou à l’état initial.
En cas d’oubli d’une dose quotidienne d’ABIRATERONE TEVA, de prednisone ou de prednisolone, il convient de reprendre le traitement le lendemain à la dose quotidienne habituelle.
Hépatotoxicité
Chez les patients développant une hépatotoxicité au cours du traitement (alanine aminotransférase [ALT] augmentée ou aspartate aminotransférase [AST] augmentée de plus de 5 fois la limite supérieure de la normale [LSN]), le traitement doit être interrompu immédiatement (voir rubrique 4.4). Après le retour des tests fonctionnels hépatiques à leurs valeurs initiales, la reprise du traitement peut être effectuée à une dose réduite de 500 mg (un comprimé) une fois par jour. Chez les patients pour qui le traitement a été réintroduit, les taux de transaminases sériques doivent être surveillés au minimum toutes les deux semaines pendant les trois premiers mois et tous les mois par la suite. Si l’hépatotoxicité réapparait à la dose réduite de 500 mg par jour, le traitement doit être arrêté.
Si les patients développent une hépatotoxicité sévère (ALT ou AST 20 fois la LSN) à un moment quelconque au cours du traitement, celui-ci doit être arrêté et ne doit pas être réintroduit chez ces patients.
Insuffisance hépatique
Aucune adaptation posologique n’est nécessaire chez les patients présentant une insuffisance hépatique légère préexistante, classe A de Child-Pugh.
En cas d’insuffisance hépatique modérée (classe B de Child-Pugh), on observe une augmentation de l’exposition systémique à l’abiratérone d’environ quatre fois suite à l’administration de doses orales uniques de 1 000 mg d’acétate d’abiratérone (voir rubrique 5.2). Il n’existe pas de données sur la sécurité et l’efficacité clinique suite à l’administration de doses répétées d’acétate d’abiratérone chez des patients présentant une insuffisance hépatique modérée ou sévère (classe B ou C de Child-Pugh). Aucune adaptation posologique ne peut être prévue. L’utilisation d’ABIRATERONE TEVA doit être évaluée avec prudence chez les patients présentant une insuffisance hépatique modérée, chez lesquels le bénéfice doit être nettement supérieur au risque potentiel (voir rubriques 4.2 et 5.2). ABIRATERONE TEVA ne doit pas être utilisé chez les patients présentant une insuffisance hépatique sévère (voir rubriques 4.3, 4.4 et 5.2).
Insuffisance rénale
Aucune adaptation posologique n’est nécessaire chez les patients présentant une insuffisance rénale (voir rubrique 5.2). Cependant, il n’existe pas d’expérience clinique chez les patients présentant à la fois un cancer de la prostate et une insuffisance rénale sévère. La prudence est recommandée chez ces patients (voir rubrique 4.4).
Population pédiatrique
L’utilisation de l’acétate d’abiratérone dans la population pédiatrique n’est pas justifiée.
Mode d’administration
ABIRATERONE TEVA doit être administré par voie orale.
Les comprimés doivent être pris en une prise unique, une fois par jour, à jeun. ABIRATERONE TEVA doit être pris au moins deux heures après le repas et aucune nourriture ne doit être ingérée pendant au moins une heure après la prise d’ABIRATERONE TEVA. ABIRATERONE TEVA doit être avalé entier avec de l'eau.
· Hypersensibilité à la substance active ou à l’un des excipients mentionnés à la rubrique 6.1.
· Femmes enceintes ou susceptibles de l’être (voir rubrique 4.6).
· Insuffisance hépatique sévère (classe C de Child-Pugh [voir rubriques 4.2, 4.4 et 5.2]).
· L’association d’ABIRATERONE TEVA et de prednisone/prednisolone avec du radium (Ra-223) est contre-indiquée.
4.4. Mises en garde spéciales et précautions d'emploi
Hypertension artérielle, hypokaliémie, rétention hydrique et insuffisance cardiaque dues à un excès de minéralocorticoïdes
ABIRATERONE TEVA peut entraîner une hypertension artérielle, une hypokaliémie et une rétention hydrique (voir rubrique 4.8) en raison de l’augmentation du taux de minéralocorticoïdes secondaire à l’inhibition du CYP17 (voir rubrique 5.1). L’administration concomitante d’un corticoïde réduit la stimulation de l’hormone adrénocorticotrope (ACTH), entraînant une baisse de l’incidence et de la sévérité de ces effets indésirables. La prudence est de mise lors du traitement des patients présentant des pathologies sous-jacentes pouvant être aggravées par une augmentation de la pression artérielle, par une hypokaliémie (par exemple, ceux traités par des glucosides cardiotoniques), ou par une rétention hydrique (par exemple, ceux présentant une insuffisance cardiaque, un angor sévère ou instable, un infarctus du myocarde récent ou une arythmie ventriculaire et ceux présentant une insuffisance rénale sévère).
ABIRATERONE TEVA doit être utilisé avec prudence chez les patients présentant des antécédents de maladie cardiovasculaire. Les patients présentant une hypertension artérielle non contrôlée, une maladie cardiaque cliniquement significative, telle qu’un infarctus du myocarde ou des événements thrombotiques artériels dans les 6 mois précédents, un angor sévère ou instable, une insuffisance cardiaque de classe III ou IV (étude 301) selon la New York Heart Association (NYHA) ou une insuffisance cardiaque de classe II à IV (études 3011 et 302) ou avec une mesure de la fraction d’éjection cardiaque (FEVG) < 50 % ont été exclus des études de phase III menées avec l’acétate d’abiratérone. Dans les études 3011 et 302, les patients présentant une fibrillation auriculaire ou d’autres arythmies cardiaques nécessitant un traitement médical ont été exclus. La sécurité chez les patients présentant une fraction d’éjection ventriculaire gauche (FEVG) < 50 % ou une insuffisance cardiaque de classe III ou IV selon la NYHA (dans l’étude 301) ou une insuffisance cardiaque de classe II à IV selon la NYHA (dans les études 3011 et 302) n’a pas été établie (voir rubriques 4.8 et 5.1).
Avant de traiter les patients présentant un risque significatif d’insuffisance cardiaque congestive (par exemple, antécédents d’insuffisance cardiaque, hypertension artérielle non contrôlée ou événements cardiaques tels que cardiopathie ischémique), un bilan cardiaque doit être envisagé (par exemple, échographie cardiaque). Avant le traitement par ABIRATERONE TEVA, l’insuffisance cardiaque doit être traitée et la fonction cardiaque optimisée. Toute hypertension artérielle, hypokaliémie et rétention hydrique doit être corrigée et contrôlée. Pendant le traitement, la pression artérielle, la kaliémie, la rétention hydrique (prise de poids, œdème périphérique), et autres signes et symptômes d’insuffisance cardiaque congestive doivent être surveillés toutes les 2 semaines pendant 3 mois et tous les mois par la suite et les anomalies doivent être corrigées. Un allongement de l’intervalle QT a été observé chez des patients présentant une hypokaliémie au cours du traitement par acétate d’abiratérone. Evaluer la fonction cardiaque, instaurer une prise en charge appropriée et envisager l’arrêt de ce traitement en cas de détérioration cliniquement significative de la fonction cardiaque (voir rubrique 4.2).
Hépatotoxicité et insuffisance hépatique
Des élévations marquées du taux d’enzymes hépatiques entraînant l’arrêt du traitement ou une modification de la dose sont survenues lors des études cliniques contrôlées (voir rubrique 4.8). Les taux de transaminases sériques doivent êtres dosés avant le début du traitement, toutes les deux semaines pendant les trois premiers mois de traitement et tous les mois par la suite.
En cas d’apparition de symptômes cliniques ou de signes révélant le développement d’une hépatotoxicité, les transaminases sériques doivent être dosées immédiatement. Si les ALT ou AST augmentent de plus de 5 fois la LSN au cours du traitement, celui-ci devra être immédiatement interrompu et la fonction hépatique doit être étroitement surveillée. La reprise du traitement pourra se faire uniquement après le retour des tests fonctionnels hépatiques à leurs valeurs initiales et à doses réduites (voir rubrique 4.2).
Si les patients développent une hépatotoxicité sévère, (ALT ou AST 20 fois la LSN) à un moment quelconque au cours du traitement, celui-ci devra être arrêté et ne sera pas réintroduit chez ces patients.
Les patients présentant une hépatite virale active ou symptomatique ont été exclus des essais cliniques ; il n’existe donc pas de données relatives à l’utilisation de l’acétate d’abiratérone dans cette population.
Il n’existe aucune donnée clinique de sécurité et d’efficacité concernant l’administration de doses multiples d’acétate d’abiratérone chez les patients présentant une insuffisance hépatique modérée ou sévère (classe B ou C de Child-Pugh). L’utilisation d’ABIRATERONE TEVA doit être évaluée avec prudence chez les patients présentant une insuffisance hépatique modérée, chez lesquels le bénéfice doit être nettement supérieur au risque potentiel (voir rubriques 4.2 et 5.2). ABIRATERONE TEVA ne doit pas être utilisé chez les patients présentant une insuffisance hépatique sévère (voir rubriques 4.2, 4.3 et 5.2).
De rares cas d’insuffisance hépatique aiguë et d’hépatite fulminante, dont certains d’issue fatale, ont été rapportés après commercialisation (voir rubrique 4.8).
Sevrage des corticoïdes et prise en charge des situations de stress
La prudence est recommandée et une surveillance de l’insuffisance corticosurrénale doit être mise en place en cas d’arrêt de l’administration de la prednisone ou de la prednisolone. En cas de poursuite de l’administration d’ABIRATERONE TEVA après sevrage des corticoïdes, les patients doivent faire l’objet d’une surveillance afin de déceler les symptômes d’un surdosage en minéralocorticoïdes (voir informations ci-dessus).
Chez les patients sous prednisone ou prednisolone sujets à un stress inhabituel, une augmentation de la dose de corticoïdes avant, pendant et après la période de stress peut être indiquée.
Densité osseuse
Une diminution de la densité osseuse peut survenir chez les hommes atteints de cancer métastatique avancé de la prostate. L’utilisation d’ABIRATERONE TEVA en association avec un glucocorticoïde peut augmenter cet effet.
Utilisation antérieure de kétoconazole
Des taux de réponse plus faibles peuvent être attendus chez les patients traités précédemment par kétoconazole pour un cancer de la prostate.
Hyperglycémie
L’utilisation de glucocorticoïdes pouvant augmenter l’hyperglycémie, la glycémie doit être fréquemment contrôlée chez les patients diabétiques.
Hypoglycémie
Des cas d’hypoglycémie ont été rapportés lors de l’administration d’acétate d’abiratérone plus prednisone/prednisolone à des patients diabétiques recevant de la pioglitazone ou du répaglinide (voir rubrique 4.5) ; par conséquent, la glycémie doit être surveillée chez les patients diabétiques.
Utilisation avec une chimiothérapie
La sécurité et l’efficacité de l’utilisation concomitante d’acétate d’abiratérone avec une chimiothérapie par agent cytotoxique n’ont pas été établies (voir rubrique 5.1).
Risques potentiels
Une anémie et un dysfonctionnement sexuel peuvent apparaître chez les hommes présentant un cancer métastatique de la prostate, y compris ceux traités par ABIRATERONE TEVA.
Effets musculo-squelettiques
Des cas de myopathie et de rhabdomyolyse ont été rapportés chez des patients traités par acétate d’abiratérone. La plupart des cas se sont développés au cours des 6 premiers mois de traitement ; les patients se sont rétablis après l’arrêt de l’acétate d’abiratérone. La prudence est recommandée chez les patients traités simultanément avec des médicaments connus pour être associés à une myopathie/rhabdomyolyse.
Interactions avec d’autres médicaments
En raison du risque de diminution de l’exposition à l’abiratérone, les inducteurs puissants du CYP3A4 doivent être évités au cours du traitement, à moins qu’il n’existe aucune alternative thérapeutique (voir rubrique 4.5).
Association d’abiratérone et de prednisone/prednisolone avec du radium (Ra-223)
Le traitement par abiratérone et prednisone/prednisolone en association avec du radium (Ra-223) est contre-indiqué (voir rubrique 4.3) en raison d'une augmentation du risque de fractures et d’une tendance à l’augmentation de la mortalité chez les patients atteints d’un cancer de la prostate, asymptomatiques ou peu symptomatiques, comme cela a été observé dans les essais cliniques.
Il est recommandé de ne pas instaurer de traitement avec du radium (Ra-223) moins de 5 jours après la dernière administration d’ABIRATERONE TEVA en association avec la prednisone/prednisolone.
Ce médicament contient du lactose. Les patients présentant une intolérance au galactose, un déficit total en lactase ou un syndrome de malabsorption du glucose et du galactose (maladies héréditaires rares) ne doivent pas prendre ce médicament.
Ce médicament contient moins de 1 mmol (23 mg) de sodium par dose, c.-à-d. qu’il est essentiellement « sans sodium ».
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Effets de la nourriture sur l’abiratérone
L’administration avec la nourriture augmente de façon significative l’absorption de l’abiratérone. L’efficacité et la sécurité n’ayant pas été établies lorsqu’il est administré avec de la nourriture, ce médicament ne doit pas être pris avec de la nourriture (voir rubriques 4.2 et 5.2).
Interactions avec d’autres médicaments
Effet potentiel d’autres médicaments sur l’exposition à l’abiratérone
Dans une étude pharmacocinétique clinique d’interaction chez des sujets sains pré-traités avec de la rifampicine, un inducteur puissant du CYP3A4, à la dose de 600 mg par jour pendant 6 jours, suivie d’une dose unique de 1 000 mg d’acétate d’abiratérone, l’ASC∞ plasmatique moyenne de l’abiratérone était diminuée de 55 %.
Les inducteurs puissants du CYP3A4 (par exemple, phénytoïne, carbamazépine, rifampicine, rifabutine, rifapentine, phénobarbital, millepertuis [Hypericum perforatum]) doivent être évités au cours du traitement, à moins qu’il n’existe aucune alternative thérapeutique.
Dans une autre étude pharmacocinétique clinique d’interaction chez des sujets sains, l’administration concomitante de kétoconazole, un inhibiteur puissant du CYP3A4, n’a pas eu d’effet cliniquement significatif sur la pharmacocinétique de l’abiratérone.
Effet potentiel sur l’exposition à d’autres médicaments
L’abiratérone est un inhibiteur des enzymes hépatiques CYP2D6 et CYP2C8 métabolisant les médicaments.
Dans une étude visant à déterminer les effets de l’acétate d’abiratérone (plus prednisone) sur une dose unique de dextrométhorphane comme substrat du CYP2D6, l’exposition systémique (ASC) du dextrométhorphane a été augmentée d’environ 2,9 fois. Une augmentation d’environ 33 % de l’ASC24 du dextrorphane, métabolite actif du dextrométhorphane, a été observée.
La prudence est recommandée lors de l’administration avec des médicaments activés ou métabolisés par le CYP2D6, en particulier ceux ayant une marge thérapeutique étroite. Une diminution de la dose des médicaments à marge thérapeutique étroite métabolisés par le CYP2D6 doit être envisagée.
Des exemples de médicaments métabolisés par le CYP2D6 incluent le métoprolol, le propanolol, la désipramine, la venlafaxine, l’halopéridol, la rispéridone, la propafénone, la flécaïnide, la codéine, l’oxycodone et le tramadol (les trois derniers médicaments nécessitant le CYP2D6 pour la formation de leurs métabolites actifs analgésiques).
Dans une étude d’interaction médicamenteuse avec le CYP2C8 chez des sujets sains, l’ASC de la pioglitazone a été augmentée de 46 % et les ASC de M-III et M-IV, les métabolites actifs de la pioglitazone, ont chacune diminué de 10 % lorsque la pioglitazone était associée avec une dose unique de 1 000 mg d’acétate d’abiratérone. Les patients doivent être surveillés en vue de détecter des signes de toxicité liés à un substrat du CYP2C8 à marge thérapeutique étroite, s’ils sont utilisés de façon concomitante. Des exemples de médicaments métabolisés par le CYP2C8 incluent la pioglitazone et le répaglinide (voir rubrique 4.4).
In vitro, les métabolites principaux, le sulfate d’abiratérone et le sulfate de N-oxyde-abiratérone, inhibent l’absorption par le transporteur hépatique OATP1B1 ; en conséquence, cela peut augmenter les concentrations des médicaments éliminés par OATP1B1. Il n’existe pas de données cliniques disponibles permettant de confirmer l’interaction avec le transporteur.
Utilisation avec des produits connus pour allonger l’intervalle QT
Le traitement par suppression androgénique étant susceptible d’allonger l’intervalle QT, la prudence est conseillée lorsqu’ABIRATERONE TEVA est administré avec des médicaments connus pour allonger l’intervalle QT, ou des médicaments susceptibles d’induire des torsades de pointes tels que les antiarythmiques de classe IA (par exemple, quinidine, disopyramide) ou de classe III (par exemple, amiodarone, sotalol, dofétilide, ibutilide), la méthadone, la moxifloxacine, les antipsychotiques, etc.
Utilisation avec la spironolactone
La spironolactone se lie aux récepteurs des androgènes et peut augmenter le taux d’antigène prostatique spécifique (PSA). L’utilisation avec ABIRATERONE TEVA n’est pas recommandée (voir rubrique 5.1).
4.6. Fertilité, grossesse et allaitement
Femmes en âge de procréer
Il n’existe pas de données chez l’être humain sur l’utilisation de l’acétate d’abiratérone lors de la grossesse et ce médicament ne doit pas être utilisé chez les femmes en âge de procréer.
Contraception chez les hommes et les femmes
La présence de l’abiratérone ou de ses métabolites dans le sperme n’est pas connue. L’utilisation d’un préservatif est nécessaire en cas de rapport sexuel avec une femme enceinte. L’utilisation d’un préservatif associée à une autre méthode de contraception efficace est nécessaire en cas de rapport sexuel avec une femme en âge de procréer. Les études effectuées chez l’animal ont mis en évidence une toxicité sur la reproduction (voir rubrique 5.3).
Grossesse
ABIRATERONE TEVA ne doit pas être utilisé chez la femme et il est contre-indiqué chez la femme enceinte ou susceptible de l’être (voir rubriques 4.3 et 5.3).
Allaitement
ABIRATERONE TEVA ne doit pas être utilisé chez la femme.
Fertilité
L’acétate d’abiratérone a perturbé la fertilité des rats mâles et femelles, mais ces effets ont été entièrement réversibles (voir rubrique 5.3).
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Résumé du profil de sécurité
D’après une analyse des effets indésirables rapportés dans les différentes études de phase III menées avec l’acétate d’abiratérone, les effets indésirables observés chez ≥ 10 % des patients étaient : œdème périphérique, hypokaliémie, hypertension artérielle, infection des voies urinaires, alanine aminotransférase augmentée et/ou aspartate aminotransférase augmentée. Les autres effets indésirables importants incluent des affections cardiaques, une hépatotoxicité, des fractures et une alvéolite allergique.
Les conséquences pharmacodynamiques du mécanisme d’action de l’acétate d’abiratérone peuvent entraîner une hypertension artérielle, une hypokaliémie et une rétention hydrique. Au cours des études de phase III, des réactions indésirables minéralocorticoïdes attendues ont été observées plus fréquemment chez les patients traités par acétate d’abiratérone que chez les patients sous placebo : hypokaliémie 18 % vs 8 %, hypertension artérielle 22 % vs 16 % et rétention hydrique (œdème périphérique) 23 % vs 17 %, respectivement. Chez les patients traités par acétate d’abiratérone versus chez les patients sous placebo, des cas d’hypokaliémie de grades 3 et 4 selon la CTCAE (version 4.0) ont été observés respectivement chez 6 % versus 1 % des patients, des cas d’hypertension artérielle de grades 3 et 4 selon la CTCAE (version 4.0) ont été observés respectivement chez 7 % versus 5 % des patients, et des cas de rétention hydrique (œdème périphérique) de grades 3 et 4 ont été observés respectivement chez 1 % versus 1 % des patients. Dans l’ensemble, les réactions minéralocorticoïdes ont été prises en charge médicalement avec succès. L’administration concomitante d’un corticoïde réduit l’incidence et la sévérité de ces effets indésirables (voir rubrique 4.4).
Tableau listant les effets indésirables
Au cours d’études incluant des patients atteints de cancer de la prostate métastasique à un stade avancé traités par un analogue de la LH-RH ou traités précédemment par orchidectomie, l’acétate d’abiratérone a été administré à une dose de 1 000 mg par jour en association avec la prednisone ou la prednisolone à faible dose (5 ou 10 mg par jour selon l’indication).
Les effets indésirables observés au cours des études cliniques et de l’expérience post-commercialisation sont énumérés ci-dessous par catégorie de fréquence. Les catégories de fréquence sont définies comme suit : très fréquent (≥ 1/10), fréquent (≥ 1/100, < 1/10), peu fréquent (≥ 1/1 000, < 1/100) ; rare (≥ 1/10 000, < 1/1 000) ; très rare (< 1/10 000) et fréquence indéterminée (ne peut être estimée sur la base des données disponibles).
Dans chaque catégorie de fréquence, les effets indésirables sont présentés par ordre décroissant de gravité.
Tableau 1 : Effets indésirables observés au cours des études cliniques et de l’expérience post-commercialisation
|
Classe de systèmes d’organes |
Effet indésirable et fréquence |
|
Infections et infestations |
très fréquent : infection des voies urinaires fréquent : sepsis |
|
Affections du système immunitaire |
fréquence indéterminée : réactions anaphylactiques |
|
Affections endocriniennes |
peu fréquent : insuffisance surrénalienne |
|
Troubles du métabolisme et de la nutrition |
très fréquent : hypokaliémie fréquent : hypertriglycéridémie |
|
Affections cardiaques |
fréquent : insuffisance cardiaque*, angine de poitrine, fibrillation auriculaire, tachycardie peu fréquent : autres arythmies fréquence indéterminée : infarctus du myocarde, allongement de l’intervalle QT (voir rubriques 4.4 et 4.5) |
|
Affections vasculaires |
très fréquent : hypertension artérielle |
|
Affections respiratoires, thoraciques et médiastinales |
rare : alvéolite allergiquea |
|
Affections gastro-intestinales |
très fréquent : diarrhée fréquent : dyspepsie |
|
Affections hépatobiliaires |
très fréquent : alanine aminotransférase augmentée et/ou aspartate aminotransférase augmentéeb rare : hépatite fulminante, insuffisance hépatique aiguë |
|
Affections de la peau et du tissu sous-cutané |
fréquent : rash |
|
Affections musculo-squelettiques et systémiques |
peu fréquent : myopathie, rhabdomyolyse |
|
Affections du rein et des voies urinaires |
fréquent : hématurie |
|
Troubles généraux et anomalies au site d’administration |
très fréquent : œdème périphérique |
|
Lésions, intoxications et complications liées aux procédures |
fréquent : fractures** |
* L’insuffisance cardiaque inclut l’insuffisance cardiaque congestive, le dysfonctionnement ventriculaire gauche et la diminution de la fraction d’éjection.
** Les fractures incluent l’ostéoporose et toutes les fractures à l’exception des fractures pathologiques.
a Notifications spontanées issues de l’expérience post-commercialisation.
b Alanine aminotransférase augmentée et/ou aspartate aminotransférase augmentée incluent ALT augmentée, AST augmentée et fonction hépatique anormale.
Les effets indésirables de grade 3 selon la CTCAE (version 4.0) survenus chez les patients traités par acétate d’abiratérone ont été les suivants : hypokaliémie (5 %), infection des voies urinaires (2 %), alanine aminotransférase augmentée et/ou aspartate aminotransférase augmentée (4 %), hypertension artérielle (6 %), fractures (2 %), œdème périphérique, insuffisance cardiaque et fibrillation auriculaire (1 % chacun). Une hypertriglycéridémie et une angine de poitrine de grade 3 selon la CTCAE (version 4.0) ont été observées chez moins de 1 % des patients. Une infection des voies urinaires, une alanine aminotransférase augmentée et/ou une aspartate aminotransférase augmentée, une hypokaliémie, une insuffisance cardiaque, une fibrillation auriculaire et des fractures de grade 4 selon la CTCAE (version 4.0) ont été observées chez moins de 1 % des patients.
L’hypertension artérielle et l’hypokaliémie ont été observées à une fréquence plus élevée dans la population hormonosensible (étude 3011). Une hypertension artérielle a été rapportée chez 36,7 % des patients dans la population hormonosensible (étude 3011), comparé à 11,8 % et 20,2 % dans les études 301 et 302, respectivement. Une hypokaliémie a été observée chez 20,4 % des patients dans la population hormonosensible (étude 3011) par rapport à 19,2 % et 14,9 % dans les études 301 et 302, respectivement.
L’incidence et la sévérité des événements indésirables étaient plus élevées dans le sous-groupe de patients ayant un score de performance ECOG2 à l’inclusion et également chez les patients âgés (≥ 75 ans).
Description d’effets indésirables sélectionnés
Effets cardiovasculaires
Les patients présentant une hypertension artérielle non contrôlée, une maladie cardiaque cliniquement significative, telle qu’un infarctus du myocarde ou un événement thrombotique artériel dans les 6 mois précédents, un angor sévère ou instable, une insuffisance cardiaque de classe III ou IV (étude 301) ou une insuffisance cardiaque de classe II à IV (études 3011 et 302) selon la NYHA ou avec une mesure de la fraction d’éjection cardiaque < 50 % ont été exclus des trois études de phase III. Tous les patients inclus (groupe traité par la substance active et groupe placebo) ont reçu simultanément un traitement de suppression androgénique, principalement par des analogues de la LH-RH, qui a été associé à des cas de diabète, d’infarctus du myocarde, d’accident vasculaire cérébral et de mort subite cardiaque. L’incidence des effets indésirables cardiovasculaires dans les études de phase III chez les patients sous acétate d’abiratérone par rapport aux patients sous placebo a été la suivante : fibrillation auriculaire 2,6 % vs 2,0 %, tachycardie 1,9 % vs 1,0 %, angine de poitrine 1,7 % vs 0,8 %, insuffisance cardiaque 0,7 % vs 0,2 % et arythmie 0,7 % vs 0,5 %.
Hépatotoxicité
Des cas d’hépatotoxicité avec une élévation des taux d’ALT, d’AST et de bilirubine totale ont été rapportés chez des patients traités par acétate d’abiratérone. Au cours des études cliniques de phase III, une hépatotoxicité de grades 3 et 4 (par exemple, augmentation du taux d’ALT ou d’AST de > 5 × LSN ou augmentation de la bilirubine de > 1,5 × LSN) a été rapportée chez 6 % des patients traités par acétate d’abiratérone, généralement durant les 3 premiers mois de traitement. Dans l’étude 3011, une hépatotoxicité de grade 3 ou 4 a été observée chez 8,4 % des patients traités par acétate d’abiratérone. Dix patients ayant reçu l’acétate d’abiratérone ont arrêté le traitement en raison d’une hépatotoxicité ; deux présentaient une hépatotoxicité de grade 2, six une hépatotoxicité de grade 3 et deux une hépatotoxicité de grade 4. Aucun patient n’est décédé des suites d’une hépatotoxicité dans l’étude 3011. Au cours des études cliniques de phase III, les patients dont le taux initial d’ALT ou d’AST était élevé se sont révélés plus susceptibles de présenter une augmentation des résultats des tests fonctionnels hépatiques que ceux commençant le traitement avec des valeurs normales. Lorsque des augmentations du taux d’ALT ou d’AST > 5 × LSN ou de la bilirubine > 3 × LSN ont été observées, l’acétate d’abiratérone a été suspendu ou arrêté. Dans deux cas, une élévation importante des résultats des tests fonctionnels hépatiques est survenue (voir rubrique 4.4). Ces deux patients, présentant une fonction hépatique initiale normale, ont présenté une élévation du taux d’ALT ou d’AST de 15 à 40 × LSN et une élévation de la bilirubine de 2 à 6 × LSN. Après arrêt de l’administration du traitement, les valeurs des tests fonctionnels hépatiques de ces deux patients se sont normalisées et un patient a été traité à nouveau, sans récurrence de ces augmentations. Dans l’étude 302, des élévations d’ALT ou d’AST de grade 3 ou 4 ont été observées chez 35 (6,5 %) patients traités par acétate d’abiratérone.
Les élévations du taux d’aminotransférase ont été normalisées chez tous les patients sauf 3 (2 avec de nouvelles métastases hépatiques multiples et 1 avec une augmentation des AST environ 3 semaines après la dernière administration d’acétate d’abiratérone). Au cours des études cliniques de phase III, les arrêts de traitement dus à l’augmentation des ALT et des AST ou à des anomalies de la fonction hépatique ont été rapportés chez 1,1 % des patients traités par acétate d’abiratérone et chez 0,6 % des patients traités par placebo ; aucun décès lié à une toxicité hépatique n’a été rapporté.
Au cours des essais cliniques, le risque d’hépatotoxicité a été atténué par l’exclusion des patients présentant initialement une hépatite ou des anomalies significatives des tests de la fonction hépatique. Dans l’essai 3011, les patients présentant initialement des taux d’ALT et d’AST > 2,5 × LSN, un taux de bilirubine > 1,5 × LSN ou une hépatite virale active ou symptomatique ou une atteinte hépatique chronique, une ascite ou des troubles hémorragiques secondaires à un dysfonctionnement hépatique, ont été exclus. Dans l’essai 301, les patients présentant un taux initial d’ALT et d’AST ≥ 2,5 × LSN en l’absence de métastases hépatiques et > 5 × LSN en présence de métastases hépatiques, ont été exclus. Dans l’essai 302, les patients présentant des métastases hépatiques n’ont pas été éligibles et ceux ayant un taux initial d’ALT et d’AST ≥ 2,5 × LSN ont été exclus. Les anomalies des tests fonctionnels hépatiques apparues chez les patients participant aux essais cliniques ont été activement prises en charge par l’interruption du traitement et la reprise éventuelle de celui-ci uniquement après retour des résultats des tests fonctionnels hépatiques à leur valeur initiale (voir rubrique 4.2). Les patients présentant une élévation du taux d’ALT ou d’AST > 20 × LSN n’ont pas été retraités. La sécurité d’une reprise du traitement chez ces patients n’est pas connue. Le mécanisme de l’hépatotoxicité n’est pas connu.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/.
L’expérience de surdosage chez l’être humain avec l’acétate d’abiratérone est limitée.
Il n’existe pas d’antidote spécifique. En cas de surdosage, l’administration doit être suspendue et des mesures de soutien générales doivent être mises en place, incluant une surveillance de la survenue d’arythmies, d’une hypokaliémie et de signes et symptômes de rétention hydrique. La fonction hépatique doit également être évaluée.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Mécanisme d’action
L’acétate d’abiratérone est transformé in vivo en abiratérone, un inhibiteur de la biosynthèse des androgènes. Plus spécifiquement, l’abiratérone inhibe de manière sélective l’enzyme 17α-hydroxylase/C17,20-lyase (CYP17). Cette enzyme est exprimée et nécessaire lors de la biosynthèse des androgènes au niveau des testicules, des glandes surrénales et des tissus tumoraux prostatiques. Le CYP17 catalyse la conversion de la prégnénolone et de la progestérone en précurseurs de la testostérone, la DHEA et l’androstènedione, respectivement, par 17α-hydroxylation et rupture de la liaison C17,20. L’inhibition du CYP17 entraîne également une augmentation de la production de minéralocorticoïdes par les glandes surrénales (voir rubrique 4.4).
Le cancer de la prostate sensible aux androgènes répond aux traitements qui diminuent les taux d’androgènes. Les traitements suppresseurs des androgènes, tels que les analogues de la LH-RH ou l’orchidectomie, réduisent la production d’androgènes dans les testicules mais n’affectent pas leur production par les glandes surrénales ou dans la tumeur. Administré en même temps que des analogues de la LH-RH (ou que l’orchidectomie), le traitement par acétate d’abiratérone abaisse le taux de testostérone sérique à un niveau indétectable (par les méthodes de dosage commercialisées).
Effets pharmacodynamiques
L’acétate d’abiratérone diminue les taux sériques de testostérone et des autres androgènes à des niveaux inférieurs à ceux atteints par l’utilisation des analogues de la LH-RH seuls ou par l’orchidectomie. Ceci est dû à l’inhibition sélective de l’enzyme CYP17 nécessaire à la biosynthèse des androgènes. Le PSA sert de biomarqueur chez les patients atteints de cancer de la prostate. Lors d’une étude clinique de phase III chez des patients en échec de chimiothérapie contenant des taxanes, 38 % des patients traités par acétate d’abiratérone ont vu leur PSA baisser d’au moins 50 % par rapport à la valeur initiale, contre 10 % pour le groupe placebo.
Efficacité et sécurité clinique
L’efficacité a été établie au cours de trois études cliniques (études 3011, 302 et 301) de phase III, multicentriques, randomisées, contrôlées versus placebo, chez des patients atteints de mHSPC et de mCRPC. L’étude 3011 incluait des patients atteints de mHSPC nouvellement diagnostiqué (au cours des 3 mois précédant la randomisation) et présentant des facteurs pronostiques à haut risque. Le pronostic à haut risque était défini par la présence d’au moins 2 des 3 facteurs de risque suivants : (1) score de Gleason ≥ 8 ; (2) présence d’au moins 3 lésions à la scintigraphie osseuse ; (3) présence de métastase viscérale mesurable (hors atteinte ganglionnaire). Dans le bras actif, l’acétate d’abiratérone était administré à la dose de 1 000 mg par jour en association avec une faible dose de 5 mg de prednisone une fois par jour en complément d’un ADT (analogue de la LH-RH ou orchidectomie), qui était considéré comme le traitement de référence. Les patients du groupe témoin ont reçu un ADT et des placebos à la place de l’acétate d’abiratérone et de la prednisone. Les patients inclus dans l’étude 302 n’avaient pas reçu de chimiothérapie antérieure par docétaxel, alors que les patients inclus dans l’étude 301 avaient déjà reçu du docétaxel. Les patients étaient traités par un analogue de la LH-RH ou avaient précédemment été traités par orchidectomie. Dans le groupe recevant la substance active, l’acétate d’abiratérone a été administré à une dose de 1 000 mg par jour en association avec la prednisone ou la prednisolone à une dose faible de 5 mg, deux fois par jour. Les patients du groupe témoin ont reçu un placebo et de la prednisone ou de la prednisolone à une dose faible de 5 mg, deux fois par jour.
Les modifications du PSA sérique pris isolément ne sont pas toujours prédictives du bénéfice clinique. Ainsi, dans toutes les études, il était recommandé que les patients poursuivent leurs traitements jusqu’à ce que les critères d’arrêt soient remplis pour chaque étude comme spécifié ci-après.
Dans toutes les études, l’utilisation de la spironolactone n’était pas autorisée car la spironolactone se lie aux récepteurs des androgènes et peut augmenter le PSA.
Etude 3011 (patients présentant un mHSPC à haut risque nouvellement diagnostiqué)
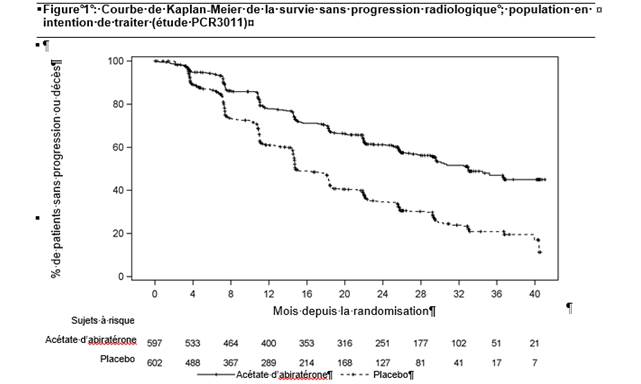
Dans l’étude 3011 (n = 1 199), l’âge médian des patients inclus était de 67 ans. Par origine ethnique, le nombre de patients traités par abiratérone comportait 832 patients caucasiens (69,4 %), 246 patients asiatiques (20,5 %), 25 patients noirs ou afro-américains (2,1 %), 80 patients d’origine autre (6,7 %), 13 patients d’origine inconnue/non rapportée (1,1 %) et 3 patients originaires d’Alaska ou amérindiens (0,3 %). Chez 97 % des patients, le score de performance ECOG était de 0 ou 1. Les patients présentant des métastases cérébrales connues, une hypertension artérielle non contrôlée, une pathologie cardiaque significative ou une insuffisance cardiaque de classe NYHA II à IV étaient exclus. Les patients précédemment traités pour un cancer métastatique de la prostate par un traitement pharmacologique, une radiothérapie ou une chirurgie étaient exclus, excepté ceux ayant reçu moins de 3 mois de traitement par ADT, ou une séance de radiothérapie palliative ou ayant subi une intervention chirurgicale visant à traiter les symptômes résultant de la maladie métastatique. Les co-critères principaux d’évaluation de l’efficacité étaient la survie globale (OS) et la survie sans progression radiologique (rPFS). Le score médian d’évaluation de la douleur à l’inclusion, mesuré à l’aide du questionnaire Brief Pain Inventory Short Form (BPI-SF), était de 2,0 dans le groupe de traitement comme dans le groupe placebo. Outre les co-critères d’évaluation principaux, les bénéfices du traitement ont également été évalués d’après le délai de survenue de complications osseuses (SRE), le délai jusqu’au traitement suivant pour le cancer de la prostate, le délai jusqu’à instauration d’une chimiothérapie, le délai jusqu’à progression de la douleur et le délai jusqu’à progression du PSA. Le traitement a été poursuivi jusqu’à progression de la maladie, retrait du consentement, survenue d’une toxicité inacceptable ou décès du patient.
La survie sans progression radiologique était définie comme le délai entre la randomisation et la survenue d’une progression radiologique ou le décès du patient, toutes causes confondues. La progression radiologique incluait la progression visible à l’imagerie par scintigraphie osseuse (selon les critères modifiés du PCWG2) ou la progression des lésions des tissus mous visible au scanner ou à l’IRM (selon les critères RECIST 1.1).
Une différence significative en termes de rPFS a été observée entre les groupes de traitement (voir tableau 2 et figure 1).
|
Tableau 2 : Analyse stratifiée de la survie sans progression radiologique ; population en intention de traiter (étude PCR 3011) |
||
|
|
AA+P |
Placebo |
|
Sujets randomisés |
597 |
602 |
|
Evénements |
239 (40,0 %) |
354 (58,8 %) |
|
Censurés |
358 (60,0 %) |
248 (41,2 %) |
|
|
|
|
|
Délai de survenue de l’événement (mois) |
|
|
|
Médiane (IC à 95 %) |
33,02 (29,57 ; NE) |
14,78 (14,69 ; 18,27) |
|
Intervalle |
(0,0+ ; 41,0+) |
(0,0+ ; 40,6+) |
|
|
|
|
|
Valeur de pa |
< 0,0001 |
|
|
Rapport de risque (IC à 95 %)b |
0,466 (0,394 ; 0,550) |
|
Remarque : += observation censurée, NE = non évaluable. La progression radiologique et le décès sont pris en compte dans la définition de l’événement rPFS. AA+P = sujets ayant reçu de l’acétate d’abiratérone et de la prednisone.
a La valeur de p est dérivée d’un test du log-rank ajusté sur le statut du score de performance ECOG (0/1 ou 2) et l’atteinte viscérale (présence ou absence).
b Le rapport de risque est calculé à partir d’un modèle à risques proportionnels stratifié. Un rapport de risque < 1 est en faveur de AA+P.
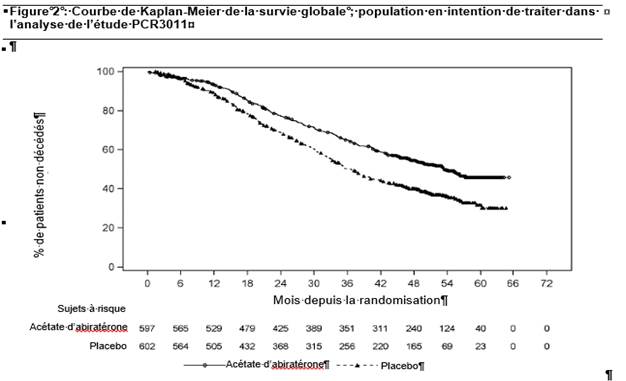
Une amélioration statistiquement significative de l’OS a été observée en faveur du traitement AA+P plus ADT, avec une réduction de 34 % du risque de décès par rapport au groupe placebo plus ADT (RR = 0,66 ; IC à 95 % : 0,56 à 0,78 ; p < 0,0001) (voir tableau 3 et figure 2).
|
Tableau 3 : Survie globale des patients traités par acétate d’abiratérone ou placebo dans l’étude PCR3011 (analyse en intention de traiter) |
||
|
Survie Globale |
Acétate d’abiratérone et prednisolone (N = 597) |
Placebos (N = 602) |
|
Décès (%) |
275 (46 %) |
343 (57 %) |
|
Survie médiane (mois) |
53,3 |
36,5 |
|
(IC à 95 %) |
(48,2 ; NE) |
(33,5 ; 40,0) |
|
Rapport de risque (IC à 95 %)1 |
0,66 (0,56 ; 0,78) |
|
NE = non évaluable
1 Le rapport de risque est dérivé d’un modèle à risques proportionnels stratifié. Un rapport de risque < 1 est en faveur de l’abiratérone associé à la prednisolone.
Les analyses en sous-groupes sont toutes favorables au traitement par acétate d’abiratérone. Au sein des différents sous-groupes préspécifiés, l’effet du traitement par AA+P sur la rPFS et l’OS a été favorable et cohérent avec la population générale de l’étude, excepté pour le sous-groupe de score ECOG 2 pour lequel aucune tendance en termes de bénéfice n’a été observée. Cependant, la faible taille d’échantillon (n = 40) ne permet pas de tirer de conclusion valide de ce résultat.
Outre les améliorations observées au niveau de la survie globale et de la rPFS, le bénéfice d’un traitement par abiratérone vs placebo a été démontré sur tous les critères secondaires d’évaluation définis de façon prospective.
Etude 302 (patients n’ayant pas reçu de chimiothérapie antérieure)
Cette étude a inclus des patients n’ayant pas reçu de chimiothérapie antérieure qui étaient asymptomatiques ou peu symptomatiques et pour lesquels la chimiothérapie n’était pas encore cliniquement indiquée. Un score ne dépassant pas 0– 1 sur l’échelle BPI-SF (Brief Pain Inventory-Short Form) au cours des dernières 24 heures était considéré comme asymptomatique, et un score de 2– 3 était considéré comme peu symptomatique.
Dans l’étude 302, (n = 1 088) l’âge médian des patients inclus était de 71 ans pour les patients traités par acétate d’abiratérone plus prednisone ou prednisolone et de 70 ans pour les patients traités par placebo plus prednisone ou prednisolone. Le nombre de patients traités par acétate d’abiratérone par groupe ethnique comportait 520 patients caucasiens (95,4 %), 15 patients noirs (2,8 %), 4 patients asiatiques (0,7 %) et 6 patients d’autres groupes ethniques (1,1 %). Dans chacun des deux bras, le score de performance à l’échelle de l’Eastern Cooperative Oncology Group (ECOG) était de 0 pour 76 % des patients et de 1 pour 24 % des patients. Cinquante pour cent des patients ne présentaient que des métastases osseuses, 31 % des patients avaient des métastases osseuses et des tissus mous ou des ganglions lymphatiques et 19 % des patients présentaient uniquement des métastases des tissus mous ou des ganglions lymphatiques. Les patients présentant des métastases viscérales ont été exclus. Les co-critères primaires d’efficacité étaient la survie globale et la survie sans progression radiologique (rPFS). En plus de ces co-critères primaires, le bénéfice a également été évalué par le délai jusqu’à l’utilisation des opiacés pour les douleurs cancéreuses, le délai jusqu’à l’instauration d’une chimiothérapie par agent cytotoxique, le délai jusqu’à la détérioration du score de performance à l’échelle ECOG ≥ 1 point et le délai jusqu’à l’augmentation du PSA sur la base des critères PCWG2 (Prostate Cancer Working Group-2). Les traitements à l’étude ont été arrêtés à l’apparition d’une progression clinique sans équivoque. Les traitements pouvaient aussi être arrêtés au moment de la confirmation de la progression radiologique, laissée à la discrétion de l’investigateur.
La survie sans progression radiologique (rPFS) a été évaluée à l’aide d’études d’imagerie séquentielle comme défini par les critères PCWG2 (pour les lésions osseuses) et par les critères RECIST (Response Evaluation Criteria In Solid Tumours) modifiés (pour les lésions des tissus mous). L’analyse de la rPFS était basée sur une évaluation centralisée de la progression radiologique.
Lors de l’analyse planifiée de la rPFS, 401 événements ont été observés ; soit 150 (28 %) patients traités par acétate d’abiratérone et 251 (46 %) patients traités par placebo ayant progressé radiologiquement ou étant décédés. Une différence significative de rPFS entre les groupes de traitement a été observée (voir tableau 4 et figure 3)
|
Tableau 4 Etude 302 : survie sans progression radiologique des patients traités par acétate d’abiratérone ou par placebo en association avec la prednisone ou la prednisolone et des analogues de la LH-RH ou une orchidectomie préalable |
||
|
|
Acétate d’abiratérone (N = 546) |
Placebo (N = 542) |
|
Survie sans progression radiologique (rPFS) |
|
|
|
Progression ou décès |
150 (28 %) |
251 (46 %) |
|
rPFS médiane en mois |
Non atteint |
8,3 |
|
(IC à 95 %) |
(11,66 ; NE) |
(8,12 ; 8,54) |
|
Valeur de p* |
< 0,0001 |
|
|
Rapport de risque** (IC à 95 %)b |
0,425 (0,347 ; 0,522) |
|
NE = non évalué
* La valeur de p est dérivée d’un test du log-rank ajusté sur le statut du score de performance ECOG initial (0 ou 1)
** Un rapport de risque < 1 est en faveur de l’acétate d’abiratérone.
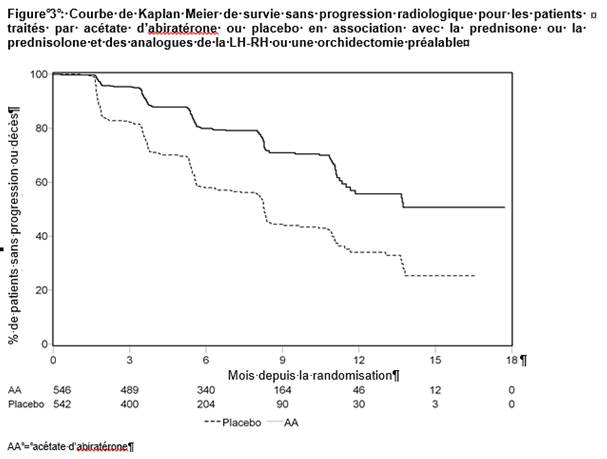
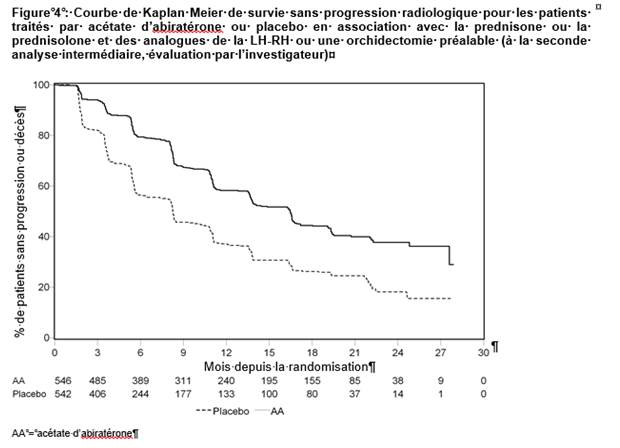
Cependant, des données ont continué à être collectées dans le cadre de la seconde analyse intermédiaire de la survie globale (OS). L’analyse radiologique de la rPFS par l’investigateur, réalisée dans le cadre de l’analyse de suivi de sensibilité, est présentée dans le tableau 5 et la figure 4.
Six cent sept (607) sujets ont eu une progression radiologique ou sont décédés : 271 (50 %) dans le groupe acétate d’abiratérone et 336 (62 %) dans le groupe placebo. Le traitement par acétate d’abiratérone a diminué le risque de progression radiologique ou de décès de 47 % par rapport au placebo (RR = 0,530 ; IC à 95 % : [0,451 ; 0,623], p < 0,0001). La rPFS médiane était de 16,5 mois dans le groupe acétate d’abiratérone et de 8,3 mois dans le groupe placebo.
|
Tableau 5 : Etude 302 : survie sans progression radiologique des patients traités par acétate d’abiratérone ou par placebo en association avec la prednisone ou la prednisolone et des analogues de la LH-RH ou une orchidectomie préalable (à la seconde analyse intermédiaire de l’OS, évaluation par l’investigateur) |
||
|
|
Acétate d’abiratérone (N = 546) |
Placebo (N = 542) |
|
Survie sans progression radiologique (rPFS) |
|
|
|
Progression ou décès |
271 (50 %) |
336 (62 %) |
|
rPFS médiane en mois |
16,5 |
8,3 |
|
(IC à 95 %) |
(13,80 ; 16,79) |
(8,05 ; 9,43) |
|
Valeur de p* |
< 0,0001 |
|
|
Rapport de risque** (IC à 95 %)b |
0,530 (0,451 ; 0,623) |
|
* La valeur de p est dérivée d’un test du log-rank ajusté sur le statut du score de performance ECOG initial (0 ou 1)
** Un rapport de risque < 1 est en faveur de l’acétate d’abiratérone.
Une analyse intermédiaire (AI) planifiée de l’OS a été menée après la survenue de 333 décès. La levée d’aveugle s’est basée sur l’amplitude du bénéfice clinique observé et un traitement par acétate d’abiratérone a été proposé aux patients du groupe placebo. La survie globale était plus longue pour le groupe traité par acétate d’abiratérone que pour celui traité par placebo avec une réduction de 25 % du risque de décès (RR = 0,752 ; IC à 95 % : [0,606 ; 0,934], p = 0,0097), mais les données de survie globale n’étaient pas matures et les résultats intermédiaires n’atteignaient pas le seuil d’arrêt statistiquement significatif prédéfini (voir tableau 4). La survie a continué à être suivie après cette AI.
L’analyse finale planifiée de la survie globale a été menée après l’observation de 741 décès (durée médiane de suivi de 49 mois). Soixante-cinq pour cent des patients traités par acétate d’abiratérone sont décédés (354 sur 546), comparé à 71 % des patients traités par placebo (387 sur 542). Un bénéfice statistiquement significatif en termes de survie globale a été démontré dans le groupe traité par acétate d’abiratérone avec une réduction du risque de décès de 19,4 % (RR = 0,806 ; IC à 95 % : [0,697 ; 0,931], p = 0,0033) et une amélioration dans la médiane de survie globale de 4,4 mois (acétate d’abiratérone : 34,7 mois, placebo : 30,3 mois) (voir tableau 6 et figure 5). Cette amélioration a été démontrée alors que 44 % des patients du groupe placebo avaient reçu un traitement ultérieur par acétate d’abiratérone.
|
Tableau 6 : Etude 302 : Survie globale des patients traités par abiratérone ou par placebo en association avec la prednisone ou la prednisolone et des analogues de la LH-RH ou une orchidectomie préalable |
|||
|
|
Acétate d’abiratérone (N = 546) |
Placebo (N = 542) |
|
|
Analyse intermédiaire de la survie |
|
|
|
|
Décès (%) |
147 (27 %) |
186 (34 %) |
|
|
Survie médiane (mois) |
Non atteint |
27,2 |
|
|
(IC à 95 %) |
(NE ; NE) |
(25,95 ; NE) |
|
|
Valeur de p* |
0,0097 |
||
|
Rapport de risque** (IC à 95 %) |
0,752 (0,606 ; 0,934) |
||
|
Analyse finale de la survie |
|
|
|
|
Décès |
354 (65 %) |
387 (71 %) |
|
|
Survie globale médiane en mois (IC à 95 %) |
34,7 (32,7 ; 36,8) |
30,3 (28,7 ; 33,3) |
|
|
Valeur de p* |
0,0033 |
||
|
Rapport de risque** (IC à 95 %) |
0,806 (0,697 ; 0,931) |
||
NE = non évalué
* La valeur de p est dérivée d’un test du log-rank ajusté sur le statut du score de performance ECOG initial (0 ou 1)
** Un rapport de risque < 1 est en faveur de l’acétate d’abiratérone.
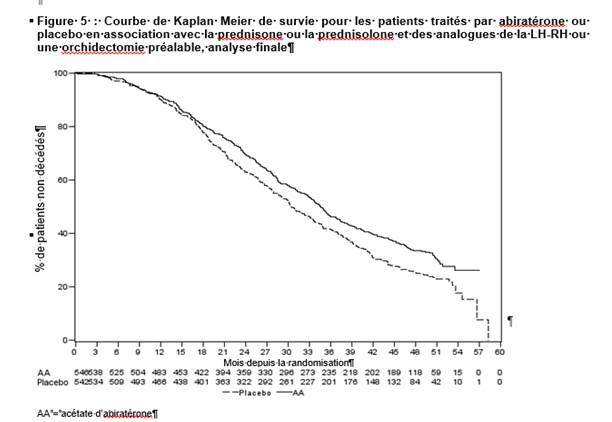
Outre l’observation de l’amélioration de la survie globale et de la rPFS, l’ensemble des critères d’évaluation secondaires était en faveur de l’acétate d’abiratérone par rapport au placebo, comme suit :
Le délai médian jusqu’à progression du PSA, basé sur les critères PCWG2, était de 11,1 mois pour les patients recevant l’acétate d’abiratérone et de 5,6 mois pour les patients recevant le placebo (RR = 0,488 ; IC à 95 % : [0,420 ; 0,568], p < 0,0001). Le délai jusqu’à progression du PSA était approximativement doublé avec le traitement par acétate d’abiratérone (RR = 0,488). La proportion de sujets avec une réponse PSA confirmée était plus élevée dans le groupe acétate d’abiratérone que dans le groupe placebo (62 % vs 24 % ; p < 0,0001). Une augmentation significative du nombre de réponses tumorales complètes et partielles a été observée chez les sujets présentant des lésions des tissus mous mesurables et traités par acétate d’abiratérone.
Délai jusqu’à l’utilisation des opiacés pour les douleurs cancéreuses : lors de l’analyse finale, le délai médian jusqu’à l’utilisation des opiacés pour les douleurs liées au cancer de la prostate était de 33,4 mois pour les patients recevant l’acétate d’abiratérone et de 23,4 mois pour les patients recevant le placebo (RR = 0,721 ; IC à 95 % : [0,614 ; 0,846], p < 0,0001).
Délai jusqu’à l’instauration d’une chimiothérapie par agent cytotoxique : le délai médian jusqu’à l’instauration d’une chimiothérapie par agent cytotoxique était de 25,2 mois pour les patients recevant l’acétate d’abiratérone et de 16,8 mois pour les patients recevant le placebo (RR = 0,580 ; IC à 95 % : [0,487 ; 0,691], p < 0,0001)
Délai jusqu’à la détérioration du score de performance à l’échelle ECOG ≥ 1 point : le délai médian jusqu’à la détérioration du score de performance à l’échelle ECOG ≥ 1 point était de 12,3 mois pour les patients recevant l’acétate d’abiratérone et de 10,9 mois pour les patients recevant le placebo (RR = 0,821 ; IC à 95 % : [0,714 ; 0,943], p = 0,0053).
Les critères d’évaluation de l’étude suivants démontrent un avantage statistiquement significatif en faveur du traitement par acétate d’abiratérone :
Réponse objective : une réponse objective a été définie comme la proportion de sujets avec une maladie mesurable parvenant à une réponse complète ou partielle selon les critères RECIST (la taille initiale des ganglions lymphatiques devait être ≥ 2 cm pour être considérée comme une lésion cible). La proportion des sujets avec une maladie mesurable initiale ayant une réponse objective était de 36 % dans le groupe acétate d’abiratérone et de 16 % dans le groupe placebo (p < 0,0001).
Douleur : le traitement par acétate d’abiratérone a réduit significativement le risque de progression du score moyen de la douleur de 18 % par rapport au placebo (p = 0,0490). Le délai médian jusqu’à la progression était de 26,7 mois dans le groupe acétate d’abiratérone et de 18,4 mois dans le groupe placebo.
Délai jusqu’à la dégradation du FACT-P (score total) : le traitement par acétate d’abiratérone a réduit le risque de dégradation du FACT-P (score total) de 22 % par rapport au placebo (p = 0,0028). Le délai médian jusqu’à la dégradation du FACT-P (score total) était de 12,7 mois dans le groupe acétate d’abiratérone et de 8,3 mois dans le groupe placebo.
Etude 301 (patients ayant reçu une chimiothérapie antérieure)
Les patients inclus dans l’étude 301 avaient déjà été traités par docétaxel. Il n’était pas nécessaire que les patients présentent une progression de la maladie sous docétaxel, étant donné que le traitement avait pu être arrêté suite à la toxicité de la chimiothérapie. Les patients ont été maintenus sous traitement à l’étude jusqu’à l’observation d’une progression du PSA (confirmée par une augmentation de 25 % par rapport à l’état initial/nadir) ainsi que jusqu’à progression radiologique telle que définie au protocole et progression symptomatique ou clinique. Les patients ayant antérieurement reçu un traitement par kétoconazole pour un cancer de la prostate ont été exclus de cette étude. Le critère primaire d’efficacité était la survie globale.
L’âge médian des patients inclus était de 69 ans (intervalle [39 – 95]). Le nombre de patients traités par acétate d’abiratérone par groupe ethnique comportait 737 (93,2 %) patients caucasiens, 28 (3,5 %) patients noirs, 11 (1,4 %) patients asiatiques et 14 (1,8 %) patients d’autres groupes ethniques. Onze pour cent des patients inclus présentaient un score de performance de 2 à l’échelle ECOG, 70 % présentaient des signes radiologiques de progression de la maladie, avec ou sans progression du PSA, 70 % avaient déjà reçu une chimiothérapie par un agent cytotoxique et 30 % en avaient reçu deux. Onze pour cent des patients traités par acétate d’abiratérone présentaient des métastases hépatiques.
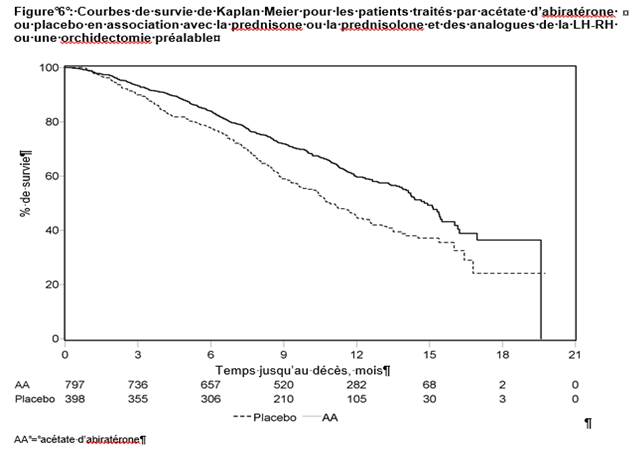
Une analyse programmée, réalisée après survenue de 552 décès, a montré que 42 % (333 sur 797) des patients traités par acétate d’abiratérone contre 55 % (219 sur 398) des patients sous placebo étaient décédés. Une amélioration statistiquement significative de la médiane de survie globale a été observée chez les patients traités par acétate d’abiratérone (voir tableau 7).
|
Tableau 7 : Survie globale des patients traités par abiratérone ou par placebo en association avec la prednisone ou la prednisolone et des analogues de la LH-RH ou une orchidectomie préalable |
||
|
|
Acétate d’abiratérone (N = 797) |
Placebo (N = 398) |
|
Analyse primaire de survie |
|
|
|
Décès (%) |
333 (42 %) |
219 (55 %) |
|
Survie médiane (mois) |
14,8 (14,1 ; 15,4) |
10,9 (10,2 ; 12,0) |
|
(IC à 95 %) |
|
|
|
Valeur de pa |
< 0,0001 |
|
|
Rapport de risque (IC à 95 %)b |
0,646 (0,543 ; 0,768) |
|
|
Analyse de survie mise à jour |
|
|
|
Décès (%) |
501 (63 %) |
274 (69 %) |
|
Survie médiane (mois) |
15,8 (14,8 ; 17,0) |
11,2 (10,4 ; 13,1) |
|
(IC à 95 %) |
|
|
|
Rapport de risque (IC à 95 %)b |
0,740 (0,638 ; 0,859) |
|
a La valeur de p est dérivée d’un test du log-rank ajusté sur le statut du score de performance ECOG (0-1 vs 2), le score de douleur (absent vs présent), le nombre de cures de chimiothérapies antérieures (1 vs. 2), et le type de progression de la pathologie (PSA uniquement vs. radiologique).
b Le rapport de risque est dérivé d’un modèle à risques proportionnels stratifié. Un rapport de risque < 1 est en faveur de l’acétate d’abiratérone.
A chaque évaluation après les premiers mois de traitement, la proportion de patients toujours en vie était plus importante dans le groupe acétate d’abiratérone que dans le groupe recevant le placebo (voir figure 6).
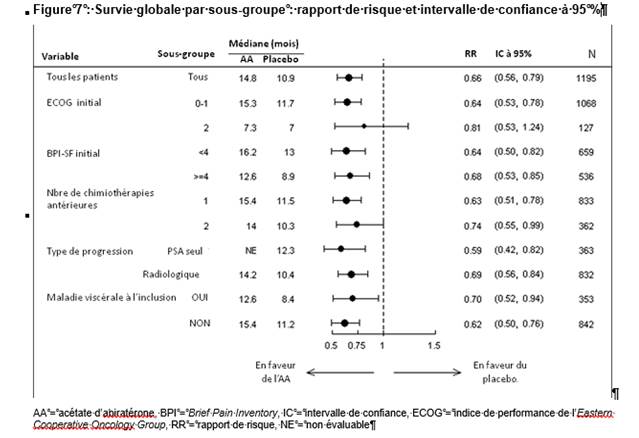
Les analyses de survie par sous-groupe révèlent un bénéfice de survie constant pour le traitement par acétate d’abiratérone (voir figure 7).
Outre l’observation de l’amélioration de la survie globale, l’ensemble des critères d’évaluation secondaires étaient en faveur de l’acétate d’abiratérone et étaient statistiquement significatifs, après ajustements en analyse multivariée, comme suit :
Les patients traités par acétate d’abiratérone présentaient un taux de réponse sur le PSA total (défini comme une baisse ≥ 50 % par rapport à la valeur initiale) significativement plus élevé que ceux sous placebo, 38 % vs 10 %, p < 0,0001.
Le temps médian jusqu’à progression du PSA était de 10,2 mois pour les patients traités par acétate d’abiratérone et de 6,6 mois pour les patients sous placebo (RR = 0,580 ; IC à 95 % : [0,462 ; 0,728], p < 0,0001).
La survie médiane sans progression radiologique était de 5,6 mois pour les patients traités par acétate d’abiratérone et de 3,6 mois pour les patients sous placebo (RR = 0,673 ; IC à 95 % : [0,585 ; 0,776], p < 0,0001).
Douleur
La proportion de patients ayant ressenti un soulagement de la douleur était, d’un point de vue statistique, significativement plus élevée pour le groupe traité par acétate d’abiratérone que pour le groupe placebo (44 % vs 27 %, p = 0,0002). Un patient répondant au soulagement de la douleur était défini comme un patient ayant ressenti une diminution d’au moins 30 % par rapport à la valeur initiale du score de la pire douleur sur l’échelle BPI-SF, au cours des dernières 24 heures, sans augmentation du score d’utilisation des antalgiques, observée lors de deux évaluations consécutives, à quatre semaines d’intervalle. Le soulagement de la douleur a été évalué uniquement chez les patients présentant un score initial de douleur ≥ 4 et avec au moins un score de soulagement de la douleur évalué en cours de traitement (N = 512).
Une plus faible proportion de patients traités par acétate d’abiratérone a ressenti une augmentation de la douleur comparativement aux patients sous placebo à 6 mois (22 % vs 28 %), 12 mois (30 % vs 38 %) et 18 mois (35 % vs 46 %). L’augmentation de la douleur a été définie comme une augmentation ≥ 30 %, par rapport à la valeur initiale, du score de la pire douleur sur l’échelle BPI-SF au cours des 24 heures précédentes, sans baisse du score d’utilisation des analgésiques observée lors de deux visites consécutives ou une augmentation ≥ 30 % du score d’utilisation des analgésiques observée lors de deux visites consécutives. Le temps avant progression de la douleur au 25e percentile était de 7,4 mois pour le groupe traité par acétate d’abiratérone contre 4,7 mois pour le groupe placebo.
Complications osseuses
Une plus faible proportion de patients dans le groupe acétate d’abiratérone a présenté des complications osseuses par rapport au groupe placebo à 6 mois (18 % vs 28 %), 12 mois (30 % vs 40 %) et 18 mois (35 % vs 40 %). Le temps avant la survenue d’une complication osseuse au 25e percentile a été deux fois plus élevé dans le groupe acétate d’abiratérone que celui du groupe témoin : 9,9 mois versus 4,9 mois. Une complication osseuse est définie comme une fracture spontanée, une compression médullaire, une irradiation palliative des os ou une intervention chirurgicale sur les os.
Population pédiatrique
L’Agence européenne des médicaments a accordé une dérogation à l’obligation de soumettre les résultats d’études réalisées avec le produit de référence contenant de l’acétate d’abiratérone dans tous les sous-groupes de la population pédiatrique dans le cancer avancé de la prostate. Voir rubrique 4.2 pour les informations concernant l’usage pédiatrique.
5.2. Propriétés pharmacocinétiques
Suite à l’administration d’acétate d’abiratérone, la pharmacocinétique de l’abiratérone a été étudiée chez des sujets sains, des patients atteints de cancer métastatique de la prostate à un stade avancé et des sujets non atteints de cancer et présentant une insuffisance hépatique ou rénale. L’acétate d’abiratérone est rapidement transformé in vivo en abiratérone, un inhibiteur de la biosynthèse des androgènes (voir rubrique 5.1).
Absorption
Après administration orale d’acétate d’abiratérone à jeun, la concentration plasmatique maximale d’abiratérone est atteinte après environ 2 heures.
Par rapport à une administration à jeun, l’administration d’acétate d’abiratérone avec la nourriture entraîne une augmentation de l’exposition systémique moyenne à l’abiratérone jusqu’à 10 fois (pour l’ASC) et jusqu’à 17 fois (pour la Cmax), en fonction de la teneur en graisses des repas. En raison de la variabilité normale du contenu et de la composition des repas, la prise d’acétate d’abiratérone avec les repas peut entraîner des degrés d’exposition très variables. Ainsi, l’acétate d’abiratérone ne doit pas être pris avec de la nourriture. Les comprimés d’ABIRATERONE TEVA sont à prendre en dose unique, une fois par jour, à jeun. ABIRATERONE TEVA doit être pris au moins deux heures après le repas et aucune nourriture ne doit être ingérée pendant au moins une heure après la prise d’ABIRATERONE TEVA. Les comprimés doivent être avalés entiers avec de l'eau (voir rubrique 4.2).
Distribution
Dans le plasma humain, la fixation protéique de la 14C-abiratérone est de 99,8 %. Le volume de distribution apparent est d’environ 5 630 L, ce qui est évocateur d’une large distribution de l’abiratérone vers les tissus périphériques.
Biotransformation
Après administration orale de gélules de 14C-acétate d’abiratérone, l’acétate d’abiratérone est hydrolysé en abiratérone, elle-même éliminée par plusieurs mécanismes dont la sulfatation, l’hydroxylation et l’oxydation, principalement au niveau du foie. La majorité de la radioactivité circulante (environ 92 %) se trouve sous forme de métabolites de l’abiratérone. Sur 15 métabolites détectables, deux métabolites principaux, le sulfate d’abiratérone et le sulfate de N-oxyde-abiratérone, représentent chacun environ 43 % de la radioactivité totale.
Elimination
D’après les données recueillies chez les sujets sains, la demi-vie plasmatique moyenne de l’abiratérone est d’environ 15 heures. Après administration orale de 1 000 mg de 14C-acétate d’abiratérone, environ 88 % de la dose radioactive est retrouvée dans les selles et environ 5 % dans l’urine. Les principaux composés présents dans les selles sont l’acétate d’abiratérone et l’abiratérone sous forme inchangée (environ 55 % et 22 % de la dose administrée respectivement).
Insuffisance hépatique
La pharmacocinétique de l’acétate d’abiratérone a été étudiée chez des sujets présentant une insuffisance hépatique préexistante légère ou modérée (classes A et B de Child-Pugh, respectivement) et chez des sujets témoins sains. L’exposition systémique à l’abiratérone après administration d’une dose unique de 1 000 mg par voie orale a augmenté d’environ 11 % et 260 % chez les sujets présentant une insuffisance hépatique préexistante légère et modérée, respectivement. La demi-vie moyenne de l’abiratérone est prolongée jusqu’à environ 18 heures chez les sujets présentant une insuffisance hépatique légère et jusqu’à environ 19 heures chez les sujets présentant une insuffisance hépatique modérée.
Dans un autre essai, la pharmacocinétique de l’abiratérone a été étudiée chez des sujets présentant une insuffisance hépatique sévère (classe C de Child-Pugh) préexistante (n = 8) et chez 8 sujets témoins sains ayant une fonction hépatique normale. L’ASC de l’abiratérone a augmenté d’environ 600 % et la fraction libre de médicament a augmenté d’environ 80 % chez les sujets présentant une insuffisance hépatique sévère comparés aux sujets ayant une fonction hépatique normale.
Aucune adaptation posologique n’est nécessaire chez les patients présentant une insuffisance hépatique légère préexistante.
L’utilisation d’acétate d’abiratérone doit être évaluée avec prudence chez les patients présentant une insuffisance hépatique modérée chez lesquels le bénéfice doit être nettement supérieur au risque potentiel (voir rubriques 4.2 et 4.4). L’acétate d’abiratérone ne doit pas être utilisé chez les patients présentant une insuffisance hépatique sévère (voir rubriques 4.2, 4.3 et 4.4).
Pour les patients qui développent une hépatotoxicité en cours de traitement, un arrêt du traitement et une adaptation posologique peuvent être nécessaires (voir rubriques 4.2 et 4.4).
Insuffisance rénale
La pharmacocinétique de l’acétate d’abiratérone a été comparée chez des patients présentant une insuffisance rénale terminale sous hémodialyse stable versus des patients témoins appariés ayant une fonction rénale normale. L’exposition systémique à l’abiratérone après administration d’une dose unique de 1 000 mg par voie orale n’a pas augmenté chez les sujets présentant une insuffisance rénale terminale sous dialyse. L’administration chez des patients présentant une insuffisance rénale, y compris une insuffisance rénale sévère, ne nécessite pas de réduction de la dose (voir rubrique 4.2). Cependant, il n’existe pas d’expérience clinique chez les patients présentant à la fois un cancer de la prostate et une insuffisance rénale sévère. La prudence est recommandée chez ces patients.
5.3. Données de sécurité préclinique
Dans toutes les études de toxicité menées chez l’animal, une baisse significative du taux de testostérone circulante a été observée. En conséquence, une diminution du poids des organes ainsi que des modifications morphologiques et/ou histopathologiques des organes génitaux, des glandes surrénales, de l’hypophyse et des glandes mammaires ont été observées. Toutes ces modifications se sont révélées entièrement ou partiellement réversibles. Les modifications des organes génitaux et des organes sensibles aux androgènes sont conformes à la pharmacologie de l’abiratérone. Toutes les modifications hormonales liées au traitement ont été réversibles ou résolutives après une période de récupération de 4 semaines.
Dans les études de fertilité chez le rat mâle et femelle, l’acétate d’abiratérone a réduit la fertilité ; ceci était complètement réversible en 4 à 16 semaines après l’arrêt de l’acétate d’abiratérone.
Dans une étude de toxicité développementale chez le rat, l’acétate d’abiratérone a affecté la gestation, incluant une diminution de la survie et du poids du fœtus. Des effets sur les organes génitaux externes ont été observés bien que l’acétate d’abiratérone n’ait pas été tératogène.
Dans ces études de fertilité et de toxicité développementale réalisées chez le rat, tous les effets ont été rapportés à l’activité pharmacologique de l’abiratérone.
Outre les modifications des organes génitaux observées lors de toutes les études de toxicité chez l’animal, les données non cliniques issues des études conventionnelles de pharmacologie de sécurité, toxicologie en administration répétée, génotoxicité et cancérogenèse n’ont pas révélé de risque particulier pour l’être humain. Dans une étude de 6 mois chez la souris transgénique (Tg.rasH2), l’acétate d’abiratérone n’était pas carcinogène. Dans une étude de carcinogénicité de 24 mois chez le rat, l’acétate d’abiratérone a augmenté l’incidence des néoplasmes des cellules interstitielles au niveau des testicules. Ce résultat est considéré comme lié à l’action pharmacologique de l’abiratérone et spécifique au rat. L’acétate d’abiratérone n’était pas carcinogène chez la rate.
La substance active, l’abiratérone, présente un risque environnemental pour l’environnement aquatique, notamment pour les poissons.
Lactose monohydraté, laurilsulfate de sodium, croscarmellose sodique, cellulose microcristalline, povidone, stéarate de magnésium, silice colloïdale anhydre.
Pelliculage
Poly(alcool vinylique) (E1203), dioxyde de titane (E171), macrogol (E1521), talc (E553b), oxyde de fer jaune (E172).
2 ans.
6.4. Précautions particulières de conservation
À conserver à une température ne dépassant pas 25 °C.
6.5. Nature et contenu de l'emballage extérieur
Plaquettes en (PVC/PCTFE/PVC-Aluminium) contenant 14, 56, 60 ou 120 comprimés pelliculés.
Plaquettes unitaires prédécoupées (PVC/PCTFE/PVC-Aluminium) contenant 14 × 1, 56 × 1, 60 × 1 ou 120 × 1 comprimés pelliculés.
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
Etant donné son mécanisme d’action, ce médicament peut nuire au développement du fœtus ; ainsi, les femmes enceintes ou susceptibles de l’être ne doivent pas le manipuler sans protection, comme par exemple des gants.
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur. Ce médicament peut induire un risque pour l’environnement aquatique (voir rubrique 5.3).
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
SWENSWEG 5
2031 GA HAARLEM
PAYS-BAS
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 302 543 0 1 : 60 x 1 comprimés sous plaquettes unitaires prédécoupées (PVC/PCTFE/ PVC-Aluminium).
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Liste I
Prescription initiale hospitalière annuelle réservée aux spécialistes en oncologie ou aux médecins compétents en cancérologie.
Renouvellement non restreint.
ANSM - Mis à jour le : 13/12/2023
ABIRATERONE TEVA 500 mg, comprimé pelliculé
Acétate d’abiratérone
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin ou votre pharmacien.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu’est-ce que ABIRATERONE TEVA 500 mg, comprimé pelliculé et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant de prendre ABIRATERONE TEVA 500 mg, comprimé pelliculé ?
3. Comment prendre ABIRATERONE TEVA 500 mg, comprimé pelliculé ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver ABIRATERONE TEVA 500 mg, comprimé pelliculé ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE ABIRATERONE TEVA 500 mg, comprimé pelliculé ET DANS QUELS CAS EST-IL UTILISE ?
ABIRATERONE TEVA contient un médicament appelé acétate d’abiratérone. Il est utilisé chez les hommes adultes pour traiter le cancer de la prostate qui s’est disséminé dans d’autres parties du corps. ABIRATERONE TEVA arrête la production de testostérone par votre corps, ce qui peut ralentir la croissance du cancer de la prostate.
Lorsqu’ABIRATERONE TEVA est prescrit au stade précoce de la maladie répondant encore à un traitement hormonal, il est utilisé en association avec un traitement qui diminue le taux de testostérone (suppression androgénique).
Lors de votre traitement par ce médicament, votre médecin vous prescrira également un autre médicament appelé prednisone ou prednisolone. Cela permettra de réduire vos risques de développer une pression artérielle élevée, d’accumuler une quantité excessive d’eau dans votre corps (rétention hydrique), ou de présenter des taux réduits d’un composant chimique appelé potassium dans votre sang.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT DE PRENDRE ABIRATERONE TEVA 500 mg, comprimé pelliculé ?
Ne prenez JAMAIS ABIRATERONE TEVA 500 mg, comprimé pelliculé
· si vous êtes allergique à l’acétate d’abiratérone ou à l’un des autres composants contenus dans ce médicament, mentionnés dans la rubrique 6 ;
· si vous êtes une femme, surtout si vous êtes enceinte. ABIRATERONE TEVA ne doit être utilisé que chez les patients de sexe masculin ;
· si vous avez une lésion sévère du foie ;
· en association avec du radium (Ra-223) (utilisé pour traiter le cancer de la prostate).
Ne prenez pas ce médicament si l’un des cas ci-dessus vous concerne. En cas de doute, parlez-en à votre médecin ou à votre pharmacien avant de prendre ce médicament.
Avertissements et précautions
Adressez-vous à votre médecin ou pharmacien avant de prendre ce médicament :
· si vous avez des troubles du foie ;
· si on vous a dit que vous aviez une pression artérielle élevée ou une insuffisance cardiaque ou un faible taux sanguin de potassium (un faible taux sanguin de potassium peut augmenter le risque de troubles du rythme cardiaque) ;
· si vous avez eu d’autres problèmes cardiaques ou vasculaires ;
· si vous avez un rythme cardiaque rapide ou irrégulier ;
· si vous êtes essoufflé ;
· si vous avez pris du poids rapidement ;
· si vous avez un gonflement des pieds, des chevilles ou des jambes ;
· si vous avez pris un médicament appelé kétoconazole pour le traitement du cancer de la prostate ;
· au sujet de la nécessité de prendre ce médicament avec de la prednisone ou de la prednisolone ;
· au sujet des effets possibles sur vos os ;
· si vous avez un taux de sucre dans le sang élevé.
Informez votre médecin s’il vous a été dit que vous présentez une maladie cardiaque ou vasculaire, y compris des troubles du rythme cardiaque (arythmie), ou si vous recevez des médicaments pour traiter ces maladies.
Informez votre médecin si vous présentez un jaunissement de la peau ou des yeux, des urines plus foncées, des nausées ou des vomissements sévères, car il pourrait s’agir de signes ou symptômes révélateurs de problèmes hépatiques. Une défaillance des fonctions du foie (appelée insuffisance hépatique aiguë), pouvant être fatale, peut survenir dans de rares cas.
Une diminution des globules rouges, une diminution du désir sexuel (libido), une faiblesse musculaire et/ou des douleurs musculaires peuvent apparaître.
ABIRATERONE TEVA ne doit pas être administré en association avec du radium (Ra-223) en raison d’une possible augmentation du risque de fractures ou de décès. Si vous prévoyez d’utiliser du radium (Ra-223) après un traitement par ABIRATERONE TEVA et prednisone/prednisolone, vous devez attendre 5 jours avant de commencer le traitement avec du radium (Ra-223).
Si vous n’êtes pas sûr que l’un de ces cas vous concerne, parlez-en à votre médecin ou à votre pharmacien avant de prendre ce médicament.
Surveillance des paramètres sanguins
ABIRATERONE TEVA peut affecter votre foie, bien qu’il soit possible que vous ne présentiez pas de symptômes. Lors de votre traitement par ce médicament, votre médecin contrôlera périodiquement votre bilan sanguin afin de rechercher tout effet sur votre foie.
Enfants et adolescents
Ce médicament ne doit pas être utilisé chez les enfants et les adolescents. Si ABIRATERONE TEVA est accidentellement ingéré par un enfant ou un adolescent, allez à l’hôpital immédiatement et prenez la notice avec vous pour la montrer au médecin urgentiste.
Autres médicaments et ABIRATERONE TEVA 500 mg, comprimé pelliculé
Demandez conseil à votre médecin ou à votre pharmacien avant de prendre tout médicament.
Informez votre médecin ou pharmacien si vous prenez, avez récemment pris ou pourriez prendre tout autre médicament. Ceci est important car ABIRATERONE TEVA peut augmenter les effets d’un certain nombre de médicaments, y compris les médicaments pour le cœur, les tranquillisants, certains médicaments contre le diabète, les médicaments à base de plantes (par exemple, millepertuis) et autres. Il est possible que votre médecin veuille modifier la dose de ces médicaments. De plus, certains médicaments peuvent augmenter ou diminuer les effets d’ABIRATERONE TEVA. Ceci peut entraîner des effets indésirables ou ABIRATERONE TEVA pourrait ne pas fonctionner aussi bien qu’il le devrait.
Le traitement par suppression androgénique peut augmenter le risque de troubles du rythme cardiaque. Informez votre médecin si vous prenez des médicaments :
· utilisés pour traiter les troubles du rythme cardiaque (par exemple, quinidine, procaïnamide, amiodarone et sotalol) ;
· connus pour augmenter le risque de troubles du rythme cardiaque (par exemple, méthadone [utilisée comme antidouleur et lors de cures de désintoxication d’une addiction aux opiacés], moxifloxacine [un antibiotique], antipsychotiques [utilisés pour les maladies mentales graves]).
Informez votre médecin si vous prenez l’un des médicaments mentionnés ci-dessus.
ABIRATERONE TEVA 500 mg, comprimé pelliculé avec des aliments
· Ce médicament ne doit pas être pris avec de la nourriture (voir rubrique 3 « Prise du médicament »).
· La prise d’ABIRATERONE TEVA avec de la nourriture peut provoquer des effets indésirables.
ABIRATERONE TEVA ne doit PAS être utilisé chez la femme.
· Ce médicament peut provoquer des malformations chez l’enfant à naître s’il est pris par des femmes enceintes.
· Les femmes enceintes ou susceptibles de l’être doivent porter des gants si elles doivent toucher ou manipuler ABIRATERONE TEVA.
· Si vous avez des rapports sexuels avec une femme susceptible de débuter une grossesse, utilisez un préservatif et une autre méthode de contraception efficace.
· Si vous avez des relations sexuelles avec une femme enceinte, utilisez un préservatif pour protéger l’enfant à naître.
Conduite de véhicules et utilisation de machines
Il est peu probable que ce médicament ait un effet sur votre aptitude à conduire un véhicule et à utiliser des outils ou machines.
ABIRATERONE TEVA 500 mg, comprimé pelliculé contient du lactose et du sodium
ABIRATERONE TEVA contient du lactose (un type de sucre). Si votre médecin vous a informé d’une intolérance à certains sucres, contactez-le avant de prendre ce médicament.
Ce médicament contient moins de 1 mmol (23 mg) de sodium par dose, c.-à-d. qu’il est essentiellement « sans sodium ».
3. COMMENT PRENDRE ABIRATERONE TEVA 500 mg, comprimé pelliculé ?
Combien en prendre
La dose recommandée est de 1 000 mg (deux comprimés) une fois par jour.
Prise du médicament
· Prenez ce médicament par voie orale (par la bouche).
· Ne prenez pas ABIRATERONE TEVA avec de la nourriture. La prise d’ABIRATERONE TEVA avec de la nourriture peut entraîner l’absorption d’une plus grande quantité de médicament par l'organisme que nécessaire, ce qui peut provoquer des effets indésirables.
· Prenez les comprimés d’ABIRATERONE TEVA en dose unique, une fois par jour, à jeun. ABIRATERONE TEVA doit être pris au moins deux heures après un repas et aucune nourriture ne doit être ingérée pendant au moins une heure après la prise d’ABIRATERONE TEVA (voir rubrique 2 : « ABIRATERONE TEVA 500 mg, comprimé pelliculé avec des aliments »).
· Avalez les comprimés entiers avec de l’eau.
· Ne cassez pas les comprimés.
· ABIRATERONE TEVA est pris avec un médicament appelé prednisone ou prednisolone. Prenez la prednisone ou la prednisolone en suivant exactement les indications de votre médecin.
· Vous devez prendre la prednisone ou la prednisolone tous les jours pendant votre traitement par ABIRATERONE TEVA.
· Il est possible que la dose de prednisone ou de prednisolone que vous prenez doive être modifiée en cas de survenue d’une urgence médicale. Votre médecin vous préviendra si vous devez modifier la dose de prednisone ou de prednisolone que vous prenez. N’arrêtez pas de prendre la prednisone ou la prednisolone à moins que votre médecin ne vous le demande.
Votre médecin pourra également vous prescrire d’autres médicaments pendant votre traitement par ABIRATERONE TEVA et la prednisone ou la prednisolone.
Si vous avez pris plus d’ABIRATERONE TEVA 500 mg, comprimé pelliculé que vous n’auriez dû
Si vous avez pris plus d’ABIRATERONE TEVA que vous n’auriez dû, prévenez immédiatement votre médecin ou aller immédiatement à l’hôpital.
Si vous oubliez de prendre ABIRATERONE TEVA 500 mg, comprimé pelliculé
· Si vous oubliez de prendre ABIRATERONE TEVA ou la prednisone ou la prednisolone durant plus d’un jour, contactez votre médecin sans tarder.
Si vous arrêtez de prendre ABIRATERONE TEVA 500 mg, comprimé pelliculé
N’arrêtez pas de prendre ABIRATERONE TEVA ou la prednisone ou la prednisolone, à moins que votre médecin ne vous ait dit de le faire.
Si vous avez d’autres questions sur l’utilisation de ce médicament, demandez plus d’informations à votre médecin ou à votre pharmacien.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Arrêtez de prendre ABIRATERONE TEVA et consultez immédiatement votre médecin si vous ressentez l’un des effets indésirables suivants :
· Faiblesse musculaire, contractions musculaires ou forts battements du cœur (palpitations). Ces derniers peuvent être le signe d’un faible taux de potassium dans votre sang.
Les autres effets indésirables incluent :
Très fréquent (pouvant affecter plus de 1 personne sur 10) :
· Rétention d’eau dans vos jambes ou vos pieds, faible taux sanguin de potassium, augmentation des résultats des tests de la fonction hépatique, pression artérielle élevée, infection des voies urinaires, diarrhée.
Fréquent (pouvant affecter jusqu’à 1 personne sur 10) :
· Taux élevés de graisses dans votre sang, douleur thoracique, rythme cardiaque irrégulier (fibrillation auriculaire), insuffisance cardiaque, rythme cardiaque rapide, infections sévères appelées sepsis, fractures osseuses, indigestion, sang dans les urines, éruption cutanée.
Peu fréquent (pouvant affecter jusqu’à 1 personne sur 100) :
· Troubles des glandes surrénales (en lien avec un déséquilibre des quantités en sel et en eau), rythme cardiaque anormal (arythmie), faiblesse musculaire et/ou douleur musculaire.
Rare (pouvant affecter jusqu’à 1 personne sur 1 000) :
· Irritation du poumon (également appelée alvéolite allergique).
· Défaillance des fonctions du foie (également appelée insuffisance hépatique aiguë).
Fréquence indéterminée (ne peut être estimée sur la base des données disponibles) :
· Crise cardiaque, modifications de l’ECG électrocardiogramme (allongement de l’intervalle QT), et réactions allergiques graves avec difficultés pour avaler ou respirer, gonflement du visage, des lèvres, de la langue ou de la gorge, ou éruption cutanée avec démangeaisons.
Une perte osseuse peut apparaître chez les hommes traités pour un cancer de la prostate. ABIRATERONE TEVA en association avec la prednisone ou la prednisolone peut augmenter la perte osseuse.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou à votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/.
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER ABIRATERONE TEVA 500 mg, comprimé pelliculé ?
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur la boîte et la plaquette après EXP. La date de péremption fait référence au dernier jour de ce mois.
À conserver à une température ne dépassant pas 25 °C.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient ABIRATERONE TEVA 500 mg, comprimé pelliculé
· La substance active est :
Acétate d’abiratérone...................................................................................................... 500 mg
Equivalant à abiratérone............................................................................................... 446,3 mg
Pour un comprimé pelliculé.
· Les autres composants sont :
Lactose monohydraté, laurilsulfate de sodium, croscarmellose sodique, cellulose microcristalline, povidone, stéarate de magnésium et silice colloïdale anhydre.
Le pelliculage contient du poly(alcool vinylique) (E1203), du dioxyde de titane (E171), du macrogol (E1521), du talc (E553b) et de l’oxyde de fer jaune (E172).
Qu’est-ce que ABIRATERONE TEVA 500 mg, comprimé pelliculé et contenu de l’emballage extérieur
ABIRATERONE TEVA, comprimé pélliculé se présente sous la forme de comprimés pelliculés jaunes, de forme oblongue, comportant la mention « A436 » gravée en creux sur une face.
ABIRATERONE TEVA est disponible sous plaquettes de 14, 56, 60 et 120 comprimés pelliculés et sous plaquettes unitaires prédécoupées de 14 × 1, 56 × 1, 60 × 1 et 120 × 1 comprimés pelliculés.
Toutes les présentations peuvent ne pas être commercialisées.
Titulaire de l’autorisation de mise sur le marché
SWENSWEG 5
2031 GA HAARLEM
PAYS-BAS
Exploitant de l’autorisation de mise sur le marché
100-110 ESPLANADE DU GENERAL DE GAULLE
92931 LA DEFENSE CEDEX
3 SAMOKOVSKO SHOSSE STR.
2600 DUPNITSA
BULGARIE
ou
MERCKLE GMBH
GRAF-ARCO-STRASSE 3
89079 ULM, BADEN-WUERTTEMBERG
ALLEMAGNE
ou
TEVA OPERATIONS POLAND SP. Z O.O.
UL. MOGILSKA 80
31-546 KRAKOW
POLOGNE
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Ce médicament est autorisé dans les Etats membres de l’Espace Economique Européen sous les noms suivants : Conformément à la réglementation en vigueur.
[À compléter ultérieurement par le titulaire]
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).