Dernière mise à jour le 02/03/2026
AZELASTINE CHLORHYDRATE/PROPIONATE DE FLUTICASONE EG 137 microgrammes/50 microgrammes, suspension pour pulvérisation nasale
Indications thérapeutiques
La suspension pour pulvérisation nasale d’AZELASTINE CHLORHYDRATE / FLUTICASONE PROPIONATE EG contient deux substances actives : le chlorhydrate d'azélastine et le propionate de fluticasone.
· Le chlorhydrate d'azélastine appartient à un groupe de médicaments appelé anti-histaminiques. Les anti-histaminiques agissent en empêchant les effets de substances comme l'histamine que le corps produit au cours d’une réaction allergique, réduisant ainsi les symptômes de la rhinite allergique.
· Le propionate de fluticasone appartient à un groupe de médicaments appelé corticostéroïdes, qui réduisent l'inflammation.
La suspension pour pulvérisation nasale d’AZELASTINE AZELASTINE CHLORHYDRATE / FLUTICASONE PROPIONATE EG est utilisée pour le traitement symptomatique de la rhinite allergique saisonnière et perannuelle modérée à sévère lorsqu'un traitement par un anti-histaminique ou un corticostéroïde seul par voie intranasale n'est pas considéré comme suffisant.
La rhinite allergique saisonnière et la rhinite allergique perannuelle sont des réactions allergiques à certaines substances, comme les pollens (rhume des foins), les acariens, les moisissures, la poussière ou les animaux domestiques.
La suspension pour pulvérisation nasale d’AZELASTINE AZELASTINE CHLORHYDRATE / FLUTICASONE PROPIONATE EG soulage les symptômes de l’allergie comme l’écoulement nasal, les écoulements rhino-pharyngés, les éternuements, les démangeaisons du nez ou le nez bouché.
Présentations
> 1 flacon en verre brun de 23 g (au moins 120 pulvérisations) avec pompe doseuse avec applicateur nasal polypropylène
Code CIP : 34009 302 765 5 6
Déclaration de commercialisation : 10/04/2024
Cette présentation est agréée aux collectivités
- Prix hors honoraire de dispensation : 8,85 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 9,87 €
- Taux de remboursement :30 %
Service médical rendu (SMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Modéré | Avis du 31/01/2024 | Inscription (CT) | Le service médical rendu par AZELASTINE CHROHYDRATE / FLUTICASONE PROPIONATE EG (azelastine/fluticasone) 137 µg/50 µg, suspension pour pulvérisation nasale est modéré dans l’indication de l’AMM. |
Amélioration du service médical rendu (ASMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprés de la HAS (plus d'informations dans l'aide). Les avis et synthéses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur de l'ASMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| V (Inexistant) | Avis du 31/01/2024 | Inscription (CT) | Cette spécialité est un hybride qui n’apporte pas d’amélioration du service médical rendu (ASMR V) par rapport à la spécialité de référence DYMISTA (azelastine/fluticasone) 137 µg/50 µg, suspension pour pulvérisation nasale déjà inscrite. |
ANSM - Mis à jour le : 10/07/2023
AZELASTINE CHLORHYDRATE / FLUTICASONE PROPIONATE EG 137 microgrammes/50 microgrammes, suspension pour pulvérisation nasale
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Chaque g de suspension contient 1 000 microgrammes de chlorhydrate d’azélastine et 365 microgrammes de propionate de fluticasone.
Une pulvérisation (0,14 g) délivre une dose contenant 137 microgrammes de chlorhydrate d'azélastine (= 125 microgrammes d'azélastine) et 50 microgrammes de propionate de fluticasone.
Excipient à effet notoire :
Une pulvérisation (0,14 g) délivre 0,014 mg de chlorure de benzalkonium.
Pour la liste complète des excipients, voir rubrique 6.1.
Suspension pour pulvérisation nasale.
Suspension homogène blanche.
4.1. Indications thérapeutiques
4.2. Posologie et mode d'administration
Pour un effet thérapeutique optimal, le traitement doit être administré de façon régulière. Eviter tout contact avec les yeux.
Adultes et adolescents (âgés de 12 ans et plus)
Une pulvérisation dans chaque narine deux fois par jour (matin et soir).
Enfants âgés de moins de 12 ans
AZELASTINE CHLORHYDRATE / FLUTICASONE PROPIONATE EG, suspension pour pulvérisation nasale n'est pas recommandé chez les enfants âgés de moins de 12 ans dans la mesure où la sécurité et l'efficacité n'ont pas été établies dans cette tranche d’âge.
Personnes âgées
Aucune adaptation posologique n'est nécessaire dans cette population.
Insuffisance hépatique et rénale
Aucune donnée n'est disponible chez les patients présentant une insuffisance rénale et hépatique.
Durée du traitement
AZELASTINE CHLORHYDRATE / FLUTICASONE PROPIONATE EG, suspension pour pulvérisation nasale est adapté à une utilisation à long terme.
La durée du traitement doit correspondre à la période d'exposition à l'allergène.
Mode d'administration
AZELASTINE CHLORHYDRATE / FLUTICASONE PROPIONATE EG, suspension pour pulvérisation nasale doit être utilisé par voie nasale exclusivement.
Mode d'emploi
Préparation du flacon pulvérisateur :
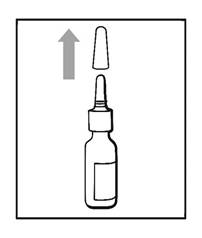
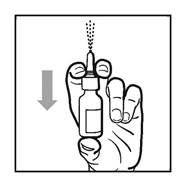
Avant utilisation, le flacon doit être agité doucement pendant environ 5 secondes en le retournant à plusieurs reprises ; puis le capuchon de protection doit être retiré. Avant la première utilisation, il convient d’amorcer le flacon d’AZELASTINE CHLORHYDRATE / FLUTICASONE PROPIONATE EG en actionnant 6 fois la pompe. Si le flacon d’AZELASTINE CHLORHYDRATE / FLUTICASONE PROPIONATE EG n'a pas été utilisé depuis plus de 7 jours, il doit être amorcé une nouvelle fois en appuyant sur la pompe et en la relâchant.
Utilisation du flacon pulvérisateur :
Le flacon pulvérisateur doit être agité doucement avant utilisation, pendant environ 5 secondes, en le retournant à plusieurs reprises, puis le capuchon de protection doit être retiré.
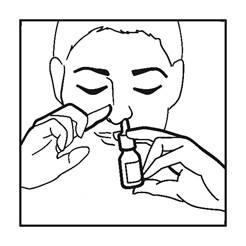
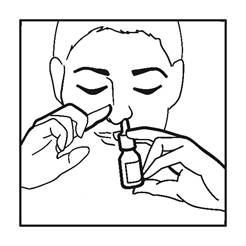
Après s'être mouché, il convient d’administrer une pulvérisation de la suspension dans chaque narine en maintenant la tête penchée vers le bas (voir figure). Après utilisation, l'embout du flacon pulvérisateur doit être essuyé et le capuchon de protection remis en place.
|
|
Hypersensibilité aux substances actives ou à l’un des excipients mentionnés à la rubrique 6.1.
4.4. Mises en garde spéciales et précautions d'emploi
Depuis la mise sur le marché, des interactions médicamenteuses cliniquement significatives ont été rapportées chez des patients recevant du propionate de fluticasone et du ritonavir, entraînant des effets systémiques des corticostéroïdes, notamment un syndrome de Cushing et une inhibition de la fonction surrénalienne. Par conséquent, l'utilisation concomitante de propionate de fluticasone et de ritonavir doit être évitée, sauf si le bénéfice potentiel pour le patient est supérieur au risque d'effets indésirables systémiques des corticostéroïdes (voir rubrique 4.5).
Des effets systémiques peuvent survenir avec les corticostéroïdes administrés par voie nasale, en particulier en cas de prescription à doses élevées pendant des périodes prolongées. Le risque de survenue de ces effets est moins élevé qu'avec les corticostéroïdes oraux et les effets peuvent varier selon les patients et selon les corticostéroïdes utilisés. Les effets systémiques potentiels incluent un syndrome de Cushing, un tableau clinique cushingoïde, une inhibition de la fonction surrénalienne, un retard de croissance chez les enfants et les adolescents, une cataracte, un glaucome et, plus rarement, des effets psychologiques ou comportementaux, notamment hyperactivité psychomotrice, troubles du sommeil, anxiété, dépression ou agressivité (en particulier chez les enfants).
La suspension pour pulvérisation nasale de chlorhydrate d'azélastine/propionate de fluticasone subit un effet de premier passage hépatique important ; par conséquent, l'exposition systémique au propionate de fluticasone administré par voie intranasale risque d’augmenter chez les patients présentant une insuffisance hépatique sévère, ce qui peut entraîner une fréquence plus élevée d’événements indésirables systémiques.
La prudence est de mise lors du traitement de ces patients.
Un traitement à des doses supérieures aux doses recommandées de corticostéroïdes par voie nasale peut entraîner une inhibition de la fonction surrénalienne cliniquement significative. Lorsqu'il est nécessaire d’utiliser des doses supérieures aux doses recommandées, une corticothérapie de supplémentation par voie générale doit être envisagée pendant les périodes de stress ou en cas de chirurgie programmée.
D’une façon générale, la dose de fluticasone intranasal doit être réduite à la dose la plus faible permettant un contrôle efficace des symptômes de rhinite. Des doses supérieures à la dose recommandée (voir rubrique 4.2) n'ont pas été étudiées pour le chlorhydrate d'azélastine/propionate de fluticasone. Comme avec tous les corticostéroïdes par voie nasale, l’exposition systémique totale aux corticostéroïdes doit être prise en compte lors de la prescription concomitante d'autres formes de corticothérapie.
Un retard de croissance a été rapporté chez des enfants recevant des corticostéroïdes administrés par voie nasale aux doses thérapeutiques. Il est recommandé de surveiller régulièrement la croissance des adolescents recevant un traitement prolongé par corticostéroïdes par voie nasale. En cas de retard de croissance, le traitement devra être réévalué afin de réduire, si possible, la dose de corticostéroïde par voie nasale pour atteindre la dose minimale efficace pour le contrôle des symptômes.
Des troubles visuels peuvent être rapportés lors d’une corticothérapie par voie systémique ou locale. Si un patient présente des symptômes tels qu’une vision trouble ou d’autres troubles visuels, il convient d'envisager de l'adresser à un ophtalmologiste afin d'évaluer les causes possibles qui peuvent inclure la cataracte, le glaucome ou des maladies rares telles que la choriorétinopathie séreuse centrale (CRSC) qui ont été rapportés après l'utilisation de corticostéroïdes par voie systémique ou locale.
Une surveillance étroite est justifiée chez les patients présentant des troubles de la vision ou des antécédents de pression intra-oculaire élevée, de glaucome et/ou de cataracte.
En cas de suspicion d’altération de la fonction surrénalienne, la prudence est requise lors du passage d'un traitement par un corticoïde systémique à un traitement par AZELASTINE CHLORHYDRATE / FLUTICASONE PROPIONATE EG, suspension pour pulvérisation nasale.
Chez les patients présentant une tuberculose, un type d’infection non traitée, ou en cas de blessures ou d’interventions chirurgicales récentes au niveau du nez ou de la bouche, les bénéfices éventuels du traitement par AZELASTINE CHLORHYDRATE / FLUTICASONE PROPIONATE EG, suspension pour pulvérisation nasale doivent être mis en balance avec les risques encourus.
Les infections des voies nasales doivent être traitées par un traitement antibactérien ou antifongique, mais ne constituent pas une contre-indication spécifique au traitement par AZELASTINE CHLORHYDRATE / FLUTICASONE PROPIONATE EG, suspension pour pulvérisation nasale.
Excipients
Ce médicament contient 0,014 mg de chlorure de benzalkonium par pulvérisation. Une utilisation à long terme peut provoquer un œdème de la muqueuse nasale.
Ce médicament contient moins de 1 mmol (23 mg) de sodium par pulvérisation, c’est-à-dire qu’il est essentiellement « sans sodium ».
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Dans les conditions normales d’utilisation, les concentrations plasmatiques de propionate de fluticasone après administration intranasale sont faibles, du fait d'un effet de premier passage hépatique important et d'une clairance systémique élevée par l’intermédiaire du cytochrome P450 3A4 dans l'intestin et le foie. Le risque d’interactions médicamenteuses cliniquement significatives liées à la présence de propionate de fluticasone est faible.
Une étude d'interactions médicamenteuses menée chez des sujets sains a révélé que le ritonavir (un inhibiteur très puissant du cytochrome P450 3A4) pouvait fortement augmenter les concentrations plasmatiques de propionate de fluticasone, entraînant une forte réduction des concentrations de cortisol sérique. Depuis la mise sur le marché, des interactions médicamenteuses cliniquement significatives ont été rapportées chez des patients utilisant les spécialités à base de propionate de fluticasone par voies intranasale ou inhalée avec le ritonavir, entraînant des effets systémiques des corticostéroïdes. Il est également prévu que l’administration concomitante d’inhibiteurs du CYP 3A4, y compris de produits contenant du cobicistat, augmente le risque d’effets indésirables systémiques. L’association doit être évitée, sauf si les bénéfices sont supérieurs au risque accru d’effets indésirables systémiques des corticostéroïdes ; dans ce cas, les patients doivent être surveillés en vue de détecter d’éventuels effets indésirables systémiques des corticostéroïdes.
Des études ont révélé que d'autres inhibiteurs du cytochrome P450 3A4 entraînaient des augmentations négligeables (érythromycines) ou faibles (kétoconazole) de l'exposition systémique au propionate de fluticasone sans diminution notable des concentrations de cortisol sérique. Toutefois, la prudence est requise en cas d'administration concomitante d'inhibiteurs puissants du cytochrome P450 3A4 (par exemple, kétoconazole), en raison du risque d'augmentation de l'exposition systémique au propionate de fluticasone.
Chlorhydrate d'azélastine
Aucune étude d'interaction spécifique n'a été menée avec la suspension pour pulvérisation nasale de chlorhydrate d'azélastine. Des études d'interaction à des doses orales élevées ont été réalisées. Cependant, elles ne sont pas pertinentes pour l'azélastine en suspension pour pulvérisation nasale car les doses nasales recommandées entraînent une exposition systémique beaucoup plus faible. Néanmoins, la prudence est de mise lors de l'administration concomitante de chlorhydrate d'azélastine et de sédatifs ou de médicaments agissant sur le système nerveux central en raison du risque d’augmentation de leur effet sédatif. L'alcool peut aussi majorer cet effet (voir rubrique 4.7).
4.6. Fertilité, grossesse et allaitement
Fertilité
Les données concernant l’effet sur la fertilité sont limitées (voir rubrique 5.3).
Grossesse
Les données concernant l'utilisation du chlorhydrate d'azélastine et du propionate de fluticasone chez la femme enceinte sont limitées ou inexistantes. Par conséquent, AZELASTINE CHLORHYDRATE / FLUTICASONE PROPIONATE EG ne doit être utilisé pendant la grossesse que si le bénéfice potentiel l’emporte sur les risques encourus par le fœtus (voir rubrique 5.3).
Allaitement
Le passage du chlorhydrate d'azélastine et de ses métabolites ou celui du propionate de fluticasone et de ses métabolites dans le lait maternel humain n’a pas été étudié. AZELASTINE CHLORHYDRATE / FLUTICASONE PROPIONATE EG ne doit être utilisé pendant l’allaitement que si le bénéfice attendu pour la mère l’emporte sur le risque potentiel encouru par le nouveau-né/le nourrisson.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
AZELASTINE CHLORHYDRATE / FLUTICASONE PROPIONATE EG a une influence mineure sur l’aptitude à conduire des véhicules et à utiliser des machines.
Dans des cas isolés, une fatigue, une lassitude, un épuisement, des sensations vertigineuses ou une faiblesse pouvant être également provoqués par la pathologie elle-même, peuvent survenir pendant l'utilisation d’AZELASTINE CHLORHYDRATE / FLUTICASONE PROPIONATE EG. Dans ces cas, l’aptitude à conduire des véhicules et à utiliser des machines peut être altérée. Cet effet peut être potentialisé par la prise d'alcool.
Une dysgueusie, perception d’un goût désagréable spécifique de la substance, est fréquemment ressentie après administration (souvent en raison d’une inclinaison trop importante de la tête vers l'arrière pendant l'administration).
Les effets indésirables sont énumérés ci-dessous par classe de systèmes d’organes et par fréquence. Les fréquences sont définies comme suit :
Très fréquent (≥ 1/10)
Fréquent (≥ 1/100, < 1/10)
Peu fréquent (≥ 1/1 000, < 1/100)
Rare (≥ 1/10 000, < 1/1 000)
Très rare (< 1/10 000)
Fréquence indéterminée (ne peut être estimée sur la base des données disponibles).
|
Fréquence |
Très fréquent |
Fréquent |
Peu fréquent |
Rare |
Très rare |
Fréquence indéterminée |
|
Classe de systèmes d’organes |
|
|
|
|
|
|
|
Affections du système immunitaire |
|
|
|
|
Hypersensibilité, incluant réactions anaphylactiques, angio-œdème (œdème du visage ou de la langue et rash cutané), bronchospasme |
|
|
Affections du système nerveux |
|
Céphalées, dysgueusie (goût désagréable), odeur désagréable |
|
|
Sensations vertigineuses, somnolence (endormissement, envie de dormir) |
|
|
Affections oculaires* |
|
|
|
|
Glaucome, augmentation de la pression intra-oculaire, cataracte |
Vision trouble (voir également rubrique 4.4) |
|
Affections respiratoires, thoraciques et médiastinales |
Epistaxis |
|
Gêne nasale (incluant irritation nasale, picotement, démangeaisons), éternuement, sécheresse nasale, toux, gorge sèche, gorge irritée |
|
Perforation de la cloison nasale**, érosion muqueuse |
Ulcérations nasales |
|
Affections gastro-intestinales |
|
|
|
Bouche sèche |
Nausées |
|
|
Affections de la peau et du tissu sous-cutané |
|
|
|
|
Rash, prurit, urticaire |
|
|
Troubles généraux et anomalies au site d'administration |
|
|
|
|
Fatigue (lassitude, épuisement), faiblesse (voir rubrique 4.7) |
|
* Un très petit nombre de notifications spontanées ont été identifiées après traitement prolongé par propionate de fluticasone par voie intranasale.
** Une perforation de la cloison nasale a été rapportée après l'utilisation de corticostéroïdes par voie intranasale.
Certains corticostéroïdes par voie nasale peuvent avoir des effets systémiques, en particulier lorsqu'ils sont administrés à des doses élevées pendant des périodes prolongées (voir rubrique 4.4).
Un retard de croissance a été rapporté chez des enfants recevant des corticostéroïdes par voie nasale. Un retard de croissance est également possible chez les adolescents (voir rubrique 4.4).
Dans de rares cas, une ostéoporose a été observée après utilisation prolongée de glucocorticoïdes par voie nasale.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/.
Aucune réaction de surdosage n'est attendue après administration par voie nasale.
Aucune donnée n'est disponible concernant les effets d'un surdosage aigu ou chronique de propionate de fluticasone par voie intranasale.
Aucun effet sur la fonction de l'axe hypothalamo-hypophyso-surrénalien (HHS) n’a été observé lors de l'administration intranasale de 2 milligrammes de propionate de fluticasone (10 fois la dose quotidienne recommandée) deux fois par jour pendant sept jours à des volontaires sains.
L'administration de doses supérieures aux doses recommandées au long cours peut entraîner une inhibition temporaire de la fonction surrénalienne.
Chez ces patients, le traitement par AZELASTINE CHLORHYDRATE / FLUTICASONE PROPIONATE EG doit être poursuivi à une dose suffisante pour contrôler les symptômes ; la fonction surrénalienne peut se rétablir en quelques jours et être vérifiée par le dosage du cortisol plasmatique.
En cas de surdosage suite à une ingestion accidentelle, des perturbations du système nerveux central (incluant somnolence, confusion, coma, tachycardie et hypotension), provoquées par le chlorhydrate d'azélastine, sont attendues, compte tenu des résultats des études menées chez l’animal.
Le traitement de ces troubles doit être symptomatique. Selon la quantité ingérée, un lavage gastrique peut être réalisé. Il n'existe aucun antidote connu.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Mécanisme d’action et effets pharmacodynamiques
La suspension pour pulvérisation nasale d’AZELASTINE CHLORHYDRATE / FLUTICASONE PROPIONATE EG contient du chlorhydrate d'azélastine et du propionate de fluticasone, qui ont des modes d'action différents et exercent des effets synergiques sur l'amélioration des symptômes de la rhinite et de la rhino-conjonctivite allergiques.
Propionate de fluticasone
Le propionate de fluticasone est un corticostéroïde trifluoré de synthèse présentant une affinité très élevée pour le récepteur des glucocorticoïdes et possède une action anti-inflammatoire puissante, environ 3 à 5 fois plus puissante que celle de la dexaméthasone lors des tests de liaison au récepteur humain des glucocorticoïdes et des tests d'expression génique.
Chlorhydrate d'azélastine
L'azélastine, dérivé de la phtalazinone, est décrit comme un anti-allergique d'action prolongée antagoniste sélectif des récepteurs H1, stabilisateur des mastocytes et exerçant des propriétés anti-inflammatoires. Les données d'études in vivo (précliniques) et in vitro ont mis en évidence un effet inhibiteur de l'azélastine sur la synthèse ou la libération des médiateurs connus pour être impliqués dans les réactions allergiques immédiates et retardées tels que les leucotriènes, l'histamine, le facteur d'activation des plaquettes (FAP) et la sérotonine.
Un soulagement des symptômes nasaux d'allergie est observé dans les 15 minutes suivant l'administration.
Suspension pour pulvérisation nasale de chlorhydrate d'azélastine/propionate de fluticasone
Dans 4 études cliniques incluant des adultes et des adolescents présentant une rhinite allergique, une pulvérisation de chlorhydrate d'azélastine/propionate de fluticasone, suspension pour pulvérisation nasale dans chaque narine deux fois par jour a significativement soulagé les symptômes nasaux (incluant rhinorrhée, congestion nasale, éternuements et démangeaisons nasales) par rapport au placebo, au chlorhydrate d'azélastine seul et au propionate de fluticasone seul. Les symptômes oculaires (comprenant démangeaisons, larmoiement/humidification et rougeur des yeux) ont été significativement améliorés ainsi que la qualité de vie des patients (questionnaire RQLQ, Rhinoconjunctivitis Quality of Life) dans les 4 études.
Une amélioration des symptômes (réduction de 50 % de la sévérité des symptômes nasaux) a été obtenue significativement plus tôt (3 jours et plus) avec la suspension pour pulvérisation de chlorhydrate d'azélastine/propionate par rapport à une suspension pour pulvérisation nasale de propionate de fluticasone du commerce. L'effet statistiquement significatif obtenu avec la suspension pour pulvérisation de chlorhydrate d'azélastine/propionate de fluticasone, par rapport à une suspension pour pulvérisation de propionate de fluticasone s'est maintenu dans une étude conduite sur un an chez des patients présentant une rhinite allergique persistante ou une rhinite non allergique/vasomotrice.
Dans une étude en chambre d'exposition aux allergènes du pollen d'ambroisie, le premier soulagement statistiquement significatif des symptômes nasaux a été observé dans les 5 minutes suivant l’administration de chlorhydrate d'azélastine/propionate de fluticasone, suspension pour pulvérisation nasale (par rapport au placebo). Une réduction cliniquement pertinente des scores des symptômes d'au moins 30 % a été rapportée dans les 15 minutes suivant l’administration d’une suspension pour pulvérisation nasale de chlorhydrate d'azélastine/propionate de fluticasone par 60 % des patients.
5.2. Propriétés pharmacocinétiques
Après administration intranasale de deux pulvérisations par narine (548 microgrammes de chlorhydrate d'azélastine et 200 microgrammes de propionate de fluticasone) d’une suspension pour pulvérisation nasale de chlorhydrate d'azélastine/propionate de fluticasone, la concentration plasmatique maximale moyenne (± écart type) (Cmax) a été de 194,5 ± 74,4 pg/mL pour l'azélastine et de 10,3 ± 3,9 pg/mL pour le propionate de fluticasone et l'exposition totale moyenne (ASC) a été de 4 217 ± 2 618 pg/mL*h pour l'azélastine et de 97,7 ± 43,1 pg/mL*h pour le propionate de fluticasone. Le temps médian écoulé pour atteindre la concentration maximale (tmax) après une dose unique a été de 0,5 heure pour l'azélastine et de 1,0 heure pour le propionate de fluticasone.
L'exposition systémique au propionate de fluticasone a été augmentée d'environ 50 % avec la suspension pour pulvérisation nasale de chlorhydrate d'azélastine/propionate de fluticasone par rapport à une suspension pour pulvérisation nasale de propionate de fluticasone du commerce. L’exposition systémique à l’azélastine avec la suspension pour pulvérisation nasale de chlorhydrate d'azélastine et propionate de fluticasone a été équivalente à celle obtenue avec la suspension pour pulvérisation nasale d'azélastine du commerce. Aucune preuve d'interactions pharmacocinétiques entre le chlorhydrate d'azélastine et le propionate de fluticasone n'a été relevée.
Distribution
Le volume de distribution du propionate de fluticasone à l'état d'équilibre est important (environ 318 litres). La liaison aux protéines plasmatiques est de 91 %.
Le volume de distribution de l'azélastine est élevé, se répartissant principalement dans les tissus périphériques. Le taux de liaison aux protéines est de 80– 90 %. La marge thérapeutique de chacun des principes actifs est large, ce qui rend peu probable le risque d’interactions significatives au niveau des récepteurs.
Biotransformation
Le propionate de fluticasone est rapidement éliminé de la circulation systémique, principalement par métabolisation hépatique en un métabolite inactif de l'acide carboxylique, par l'enzyme CYP3A4 du cytochrome P450. Le propionate de fluticasone dégluti est aussi soumis à un effet de premier passage hépatique important. L'azélastine est métabolisée en N-desméthylazélastine par diverses isoenzymes du CYP, principalement CYP3A4, CYP2D6 et CYP2C19.
Elimination
Le taux d’élimination du propionate de fluticasone administré par voie intraveineuse est linéaire pour des doses allant de 250 à 1 000 microgrammes et se caractérise par une clairance plasmatique élevée (Cl = 1,1 L/min). Les concentrations plasmatiques maximales diminuent d'environ 98 % en 3 à 4 heures et seules de faibles concentrations plasmatiques ont été associées à la demi-vie terminale de 7,8 h. La clairance rénale du propionate de fluticasone est négligeable (< 0,2 %) et moins de 5 % sont éliminés sous forme de métabolite de l'acide carboxylique. L’élimination du propionate de fluticasone et de ses métabolites est réalisée par sécrétion biliaire.
Les demi-vies d'élimination plasmatique après administration d'une dose unique d'azélastine sont d'environ 20– 25 heures pour l'azélastine et d'environ 45 heures pour son métabolite actif sur le plan thérapeutique N-desméthylazélastine. L'excrétion se fait principalement par voie fécale. L'excrétion prolongée de petites quantités de la dose dans les fèces semble indiquer qu'un cycle entéro-hépatique pourrait intervenir.
5.3. Données de sécurité préclinique
Propionate de fluticasone
Les résultats des études de toxicologie générale ont été similaires à ceux observés avec d’autres glucocorticoïdes et correspondent aux effets pharmacodynamiques exacerbés. Il est peu probable que ces résultats soient pertinents pour l'être humain, compte-tenu des doses recommandées par voie nasale, qui entraînent une exposition systémique faible. Aucun effet génotoxique n’a été observé avec le propionate de fluticasone dans les tests standards de génotoxicité. Les études d’inhalation conduites pendant deux ans chez le rat et la souris n’ont pas mis en évidence d’augmentation significative de l’incidence de tumeurs liée au traitement.
Des malformations, notamment des fentes palatines et un retard de croissance intra-utérine ont été observées dans les études conduites chez l’animal avec les glucocorticoïdes. Là encore, il est peu probable que cela soit pertinent pour l'être humain, compte-tenu des doses recommandées par voie nasale, qui entraînent une exposition systémique faible (voir rubrique 5.2).
Chlorhydrate d'azélastine
Le chlorhydrate d'azélastine n'a présenté aucun potentiel sensibilisant chez le cobaye. Aucun potentiel génotoxique de l’azélastine n’a été démontré lors des tests réalisés in vitro et in vivo, et aucun potentiel carcinogène n’a été démontré chez le rat ou la souris. Chez le rat mâle et le rat femelle, l'azélastine à des doses orales supérieures à 3 mg/kg/jour a provoqué une diminution dose-dépendante de l'indice de fertilité ; aucune altération liée à la substance n’a été détectée sur les organes reproducteurs des mâles ou des femelles au cours des études de toxicité chronique ; des effets embryotoxiques et tératogènes ont toutefois été observés chez le rat, la souris et le lapin à des doses maternotoxiques (par exemple, malformations squelettiques observées chez le rat et la souris à des doses de 68,6 mg/kg/jour).
Suspension pour pulvérisation nasale de chlorhydrate d'azélastine/propionate de fluticasone
Des études de toxicité intranasale à doses répétées réalisées chez le rat pendant 90 jours maximum et chez le chien pendant 14 jours avec la suspension pour pulvérisation nasale de chlorhydrate d'azélastine et propionate de fluticasone n'ont révélé aucun nouvel effet indésirable par rapport aux substances actives individuelles.
Glycérol, cellulose microcristalline (E460), carmellose sodique (E466), édétate disodique, polysorbate 80 (E433), chlorure de benzalkonium, alcool phényléthylique, eau purifiée.
2 ans.
Durée de conservation en cours d'utilisation (après la première utilisation) : 6 mois.
6.4. Précautions particulières de conservation
Ne pas mettre au réfrigérateur. Ne pas congeler.
6.5. Nature et contenu de l'emballage extérieur
Flacon en verre brun de type I doté d'une pompe doseuse, d'un applicateur nasal en polypropylène (pulvérisateur) et d'un capuchon de protection, contenant 23 g (au moins 120 pulvérisations) de suspension.
Présentations :
1 flacon de 23 g de suspension en flacons de 25 mL (au moins 120 pulvérisations)
Conditionnements multiples contenant 69 g (3 flacons de 23 g) de suspension pour pulvérisation nasale.
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
Pas d’exigences particulières pour l’élimination.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
EG LABO - LABORATOIRES EUROGENERICS
CENTRAL PARK
9-15 RUE MAURICE MALLET
92130 ISSY-LES-MOULINEAUX
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 302 765 5 6 : 23 g (120 pulvérisations) de suspension en flacon (verre brun) avec pompe doseuse.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
Date de première autorisation:{JJ mois AAAA}
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
{JJ mois AAAA}
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Liste I.
ANSM - Mis à jour le : 10/07/2023
Chlorhydrate d’azélastine/Propionate de fluticasone
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin ou votre pharmacien.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que AZELASTINE CHLORHYDRATE / FLUTICASONE PROPIONATE EG 137 microgrammes/50 microgrammes, suspension pour pulvérisation nasale et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d'utiliser AZELASTINE CHLORHYDRATE / FLUTICASONE PROPIONATE EG 137 microgrammes/50 microgrammes, suspension pour pulvérisation nasale ?
3. Comment utiliser AZELASTINE CHLORHYDRATE / FLUTICASONE PROPIONATE EG 137 microgrammes/50 microgrammes, suspension pour pulvérisation nasale ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver AZELASTINE CHLORHYDRATE / FLUTICASONE PROPIONATE EG 137 microgrammes/50 microgrammes, suspension pour pulvérisation nasale ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE AZELASTINE CHLORHYDRATE / FLUTICASONE PROPIONATE EG 137 microgrammes/50 microgrammes, suspension pour pulvérisation nasale ET DANS QUELS CAS EST-IL UTILISE ?
La suspension pour pulvérisation nasale d’AZELASTINE CHLORHYDRATE / FLUTICASONE PROPIONATE EG contient deux substances actives : le chlorhydrate d'azélastine et le propionate de fluticasone.
· Le chlorhydrate d'azélastine appartient à un groupe de médicaments appelé anti-histaminiques. Les anti-histaminiques agissent en empêchant les effets de substances comme l'histamine que le corps produit au cours d’une réaction allergique, réduisant ainsi les symptômes de la rhinite allergique.
· Le propionate de fluticasone appartient à un groupe de médicaments appelé corticostéroïdes, qui réduisent l'inflammation.
La suspension pour pulvérisation nasale d’AZELASTINE AZELASTINE CHLORHYDRATE / FLUTICASONE PROPIONATE EG est utilisée pour le traitement symptomatique de la rhinite allergique saisonnière et perannuelle modérée à sévère lorsqu'un traitement par un anti-histaminique ou un corticostéroïde seul par voie intranasale n'est pas considéré comme suffisant.
La rhinite allergique saisonnière et la rhinite allergique perannuelle sont des réactions allergiques à certaines substances, comme les pollens (rhume des foins), les acariens, les moisissures, la poussière ou les animaux domestiques.
La suspension pour pulvérisation nasale d’AZELASTINE AZELASTINE CHLORHYDRATE / FLUTICASONE PROPIONATE EG soulage les symptômes de l’allergie comme l’écoulement nasal, les écoulements rhino-pharyngés, les éternuements, les démangeaisons du nez ou le nez bouché.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER AZELASTINE CHLORHYDRATE / FLUTICASONE PROPIONATE EG 137 microgrammes/50 microgrammes, suspension pour pulvérisation nasale ?
N’utilisez jamais AZELASTINE CHLORHYDRATE / FLUTICASONE PROPIONATE EG :
· Si vous êtes allergique au chlorhydrate d'azélastine, au propionate de fluticasone ou à l’un des autres composants contenus dans ce médicament, mentionnés dans la rubrique 6.
Avertissements et précautions
Adressez-vous à votre médecin ou pharmacien avant d’utiliser AZELASTINE CHLORHYDRATE / FLUTICASONE PROPIONATE EG :
· Si vous avez récemment subi une opération du nez
· Si vous avez une infection du nez. Les infections des voies nasales doivent être traitées par un traitement antibactérien ou antifongique. Si vous êtes traité(e) pour votre infection du nez, vous pouvez continuer à utiliser AZELASTINE CHLORHYDRATE / FLUTICASONE PROPIONATE EG pour traiter vos allergies.
· Si vous avez la tuberculose ou une infection non traitée.
· Si vous ressentez une modification de votre vision ou si vous avez un antécédent d'élévation de la pression dans les yeux, de glaucome et/ou de cataracte. Si vous êtes dans ce cas, vous serez étroitement surveillé(e) pendant l'utilisation d’AZELASTINE CHLORHYDRATE / FLUTICASONE PROPIONATE EG.
· Si vous présentez des troubles de la fonction des glandes surrénales, la prudence est requise lors du passage d'un traitement par corticoïde par voie générale à un traitement par AZELASTINE CHLORHYDRATE / FLUTICASONE PROPIONATE EG.
· Si vous avez une insuffisance hépatique sévère. Votre risque de présenter des effets indésirables généraux est plus important.
Dans ces situations, votre médecin décidera si vous pouvez utiliser AZELASTINE CHLORHYDRATE / FLUTICASONE PROPIONATE EG.
Il est important que vous preniez votre dose comme indiqué ci-dessous à la rubrique 3 ou en suivant les indications de votre médecin. Le traitement à des doses de corticostéroïdes par voie nasale supérieures aux doses recommandées peut entraîner une inhibition de la fonction surrénalienne, ce qui peut provoquer : perte de poids, fatigue, faiblesse musculaire, hypoglycémie, envies de sel, douleurs articulaires, dépression et coloration foncée de la peau. Si cela se produisait, votre médecin pourrait vous recommander de prendre un autre médicament pendant les périodes de stress ou en cas de chirurgie programmée.
Pour éviter une inhibition de la fonction surrénalienne, votre médecin vous conseillera d'utiliser la dose la plus faible permettant un contrôle efficace de vos symptômes de rhinite.
Les corticostéroïdes par voie nasale (tels qu’AZELASTINE CHLORHYDRATE / FLUTICASONE PROPIONATE EG) peuvent ralentir la croissance des enfants et des adolescents, lorsqu'ils sont pris de façon prolongée. Le médecin vérifiera régulièrement la taille de votre enfant et s'assurera qu'il ou elle prend la dose efficace la plus faible possible.
Contactez votre médecin en cas de vision trouble ou d’autres troubles visuels.
Si vous avez un doute sur le fait que ce qui précède s’applique ou non à votre cas, consultez votre médecin ou votre pharmacien avant d'utiliser AZELASTINE CHLORHYDRATE / FLUTICASONE PROPIONATE EG.
Enfants
Ce médicament n’est pas recommandé chez les enfants âgés de moins de 12 ans.
Autres médicaments et AZELASTINE CHLORHYDRATE / FLUTICASONE PROPIONATE EG
Informez votre médecin ou pharmacien si vous prenez, avez récemment pris ou pourriez prendre tout autre médicament, y compris des médicaments obtenus sans ordonnance.
Certains médicaments peuvent augmenter les effets d’AZELASTINE CHLORHYDRATE / FLUTICASONE PROPIONATE EG et il est possible que votre médecin souhaite vous surveiller attentivement si vous prenez ces médicaments (y compris certains médicaments pour soigner l’infection à VIH : ritonavir, cobicistat et médicaments pour le traitement des infections fongiques : kétoconazole).
AZELASTINE CHLORHYDRATE / FLUTICASONE PROPIONATE EG avec des aliments et boissons
Sans objet.
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin ou pharmacien avant d’utiliser ce médicament.
Conduite de véhicules et utilisation de machines
AZELASTINE CHLORHYDRATE / FLUTICASONE PROPIONATE EG a une influence mineure sur l’aptitude à conduire des véhicules et à utiliser des machines.
Dans de très rares cas, vous pourrez ressentir une fatigue ou des sensations vertigineuses provoquées par la rhinite allergique elle-même ou pendant l'utilisation d’AZELASTINE CHLORHYDRATE / FLUTICASONE PROPIONATE EG. Dans ces situations, il est recommandé de ne pas conduire ou d'utiliser des machines. La prise d'alcool peut également augmenter ces effets.
AZELASTINE CHLORHYDRATE / FLUTICASONE PROPIONATE EG contient du chlorure de benzalkonium
Ce médicament contient 14 microgrammes de chlorure de benzalkonium dans chaque pulvérisation, ce qui est équivalent à 0,014 mg/0,14 g. Le chlorure de benzalkonium peut provoquer des irritations ou un gonflement à l’intérieur du nez, surtout s’il est utilisé sur une longue période.
Si vous ressentez une gêne lors de l'utilisation du flacon pulvérisateur, parlez-en à votre médecin ou à votre pharmacien.
AZELASTINE CHLORHYDRATE / FLUTICASONE PROPIONATE EG contient du sodium
Ce médicament contient moins de 1 mmol (23 mg) de sodium par pulvérisation, c’est-à-dire qu’il est essentiellement « sans sodium ».
3. COMMENT UTILISER AZELASTINE CHLORHYDRATE / FLUTICASONE PROPIONATE EG 137 microgrammes/50 microgrammes, suspension pour pulvérisation nasale ?
Pour un effet thérapeutique optimal, AZELASTINE CHLORHYDRATE / FLUTICASONE PROPIONATE EG doit être administré régulièrement.
Eviter tout contact avec les yeux.
Adultes et adolescents (âgés de 12 ans et plus)
· La dose recommandée est d'une pulvérisation dans chaque narine matin et soir.
Utilisation chez les enfants âgés de moins de 12 ans
· Ce médicament n’est pas recommandé chez les enfants âgés de moins de 12 ans.
Utilisation en cas d’insuffisance rénale ou hépatique
· Aucune donnée n'est disponible chez les patients présentant une insuffisance rénale ou hépatique.
Mode d’administration
Voie nasale.
Veuillez lire attentivement les instructions qui suivent et respecter la prescription.
MODE D’EMPLOI
Préparation du flacon pulvérisateur
1. Agitez doucement le flacon pendant 5 secondes en le retournant plusieurs fois, puis retirez le capuchon de protection (voir figure 1).
Figure 1
|
|
2. Lors de la première utilisation du flacon pulvérisateur, la pompe doit être amorcée en l'actionnant dans le vide.
3. Amorcez la pompe en plaçant deux doigts de chaque côté de la pompe de pulvérisation et en plaçant votre pouce sur le fond du flacon.
4. Appuyez et relâchez la pompe 6 fois jusqu'à ce qu'une fine brume apparaisse (voir figure 2).
5. Votre pompe est désormais amorcée et prête à l'emploi.
Figure 2
|
|
6. Si le flacon pulvérisateur n'a pas été utilisé depuis plus de 7 jours, vous devez de nouveau amorcer la pompe une fois en appuyant sur la pompe et en la relâchant.
Utilisation du flacon pulvérisateur
1. Agitez doucement le flacon pendant 5 secondes en le retournant plusieurs fois, puis retirez le capuchon de protection (voir figure 1).
2. Mouchez-vous pour vider vos narines.
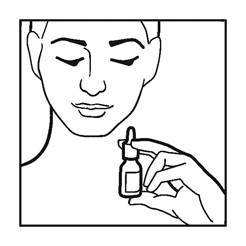
3. Inclinez votre tête vers le bas en direction de vos orteils. N'inclinez pas la tête vers l'arrière.
4. Maintenez le flacon verticalement et insérez délicatement l'embout du flacon dans l’une de vos narines.
5. Fermez l'autre narine avec un doigt, appuyez rapidement sur la pompe en inspirant doucement (voir figure 3).
6. Expirez par la bouche.
Figure 3
|
|
7. Répétez les étapes ci-dessus pour l'autre narine.
8. Inspirez doucement et n'inclinez pas la tête vers l'arrière après administration. Ceci empêche que le médicament ne coule dans votre gorge et ne produise un goût désagréable (voir figure 4).
Figure 4
|
|
9. Après chaque utilisation, essuyez l'embout du flacon pulvérisateur à l'aide d'un mouchoir en papier ou d'un chiffon propre, puis remettez en place le capuchon de protection.
10. Ne percez pas l’embout si la pulvérisation ne s’effectue pas. Nettoyez l’applicateur avec de l’eau.
Il est important que vous preniez la dose prescrite par votre médecin. Vous ne devez utiliser que la quantité recommandée par votre médecin.
Durée du traitement
AZELASTINE CHLORHYDRATE / FLUTICASONE PROPIONATE EG est adapté à une utilisation à long terme. La durée du traitement doit correspondre à la période pendant laquelle vous avez des symptômes d'allergie.
Si vous avez utilisé plus d’AZELASTINE CHLORHYDRATE / FLUTICASONE PROPIONATE EG que vous n’auriez dû
Si vous pulvérisez une trop grande quantité de ce médicament dans votre nez, il est peu probable que vous ayez des problèmes.
Si vous êtes inquiet(ète) ou si vous avez utilisé des doses supérieures à celles recommandées pendant une longue période, contactez votre médecin. Si quelqu'un, en particulier un enfant, boit accidentellement AZELASTINE CHLORHYDRATE / FLUTICASONE PROPIONATE EG, contactez votre médecin ou le service des urgences de l'hôpital le plus proche dès que possible.
Si vous oubliez d’utiliser AZELASTINE CHLORHYDRATE / FLUTICASONE PROPIONATE EG
Si vous arrêtez d’utiliser AZELASTINE CHLORHYDRATE / FLUTICASONE PROPIONATE EG
N'arrêtez pas d'utiliser AZELASTINE CHLORHYDRATE / FLUTICASONE PROPIONATE EG sans en parler à votre médecin, car cela pourrait faire échouer le traitement.
Si vous avez d’autres questions sur l’utilisation de ce médicament, demandez plus d’informations à votre médecin ou à votre pharmacien.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Informez immédiatement votre médecin si vous constatez l’un des symptômes suivants :
· Gonflement du visage, des lèvres, de la langue ou de la gorge, pouvant entraîner des difficultés à avaler et/ou à respirer et apparition soudaine d'une éruption cutanée. Il pourrait s'agir de signes d'une réaction allergique sévère. Remarque : cet effet est très rare.
Très fréquent (pouvant affecter plus de 1 personne sur 10) :
· Saignement de nez
Fréquent (pouvant affecter jusqu'à 1 personne sur 10) :
· Maux de tête
· Goût amer dans la bouche, en particulier si vous inclinez la tête en arrière lors de l'utilisation du flacon pulvérisateur. Ce goût devrait disparaître si vous buvez une boisson sucrée quelques minutes après l’utilisation de ce médicament.
· Odeur désagréable
Peu fréquent (pouvant affecter jusqu'à 1 personne sur 100) :
· Légère irritation à l'intérieur du nez. Cette irritation peut produire un léger picotement, une démangeaison ou des éternuements.
· Sécheresse du nez, toux, sécheresse de la gorge ou irritation de la gorge.
Rare (pouvant affecter jusqu'à 1 personne sur 1 000) :
· Bouche sèche
Très rare (pouvant affecter jusqu'à 1 personne sur 10 000) :
· Sensations vertigineuses ou endormissement
· Cataracte, glaucome ou augmentation de la pression dans les yeux, pouvant entraîner une perte de vision et/ou des yeux rouges et douloureux. Ces effets indésirables ont été rapportés après un traitement prolongé avec des suspensions pour pulvérisation nasale de propionate de fluticasone.
· Lésion de la peau et de la muqueuse du nez
· Nausées, sensation de fatigue, d’épuisement ou de faiblesse
· Eruption cutanée, démangeaisons cutanées ou papules rouges qui démangent sur la peau
· Bronchospasme (rétrécissement des voies aériennes dans les poumons)
Fréquence indéterminée (ne peut être estimée sur la base des données disponibles) :
· Vision trouble
· Plaies (ulcérations) dans le nez
Des effets indésirables systémiques (affectant l’ensemble du corps) peuvent survenir lorsque ce médicament est utilisé à des doses élevées pendant une longue période. Le risque que ces effets surviennent est bien moins élevé avec les corticostéroïdes en suspension pour pulvérisation nasale qu'avec les corticostéroïdes pris par voie orale. Ces effets peuvent varier selon les patients et selon les différentes formulations de corticostéroïdes (voir rubrique 2).
Les corticostéroïdes par voie nasale peuvent affecter la production normale d'hormones dans votre corps, en particulier si vous utilisez des doses élevées pendant une longue période. Chez l'enfant et l'adolescent, cet effet indésirable peut entraîner une croissance moins rapide.
Dans de rares cas, une diminution de la densité de l'os (ostéoporose) a été observée après utilisation prolongée de corticostéroïdes par voie nasale.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou à votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER AZELASTINE CHLORHYDRATE / FLUTICASONE PROPIONATE EG 137 microgrammes/50 microgrammes, suspension pour pulvérisation nasale ?
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur l’étiquette du flacon et la boîte après « EXP ». La date de péremption fait référence au dernier jour de ce mois.
Ne pas mettre au réfrigérateur. Ne pas congeler.
Durée de conservation après 1ère ouverture : éliminer le médicament inutilisé 6 mois après la première ouverture du flacon
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
· Les substances actives sont :
Chaque g de suspension contient 1 000 microgrammes de chlorhydrate d’azélastine et 365 microgrammes de propionate de fluticasone.
Une pulvérisation (0,14 g) délivre une dose contenant 137 microgrammes de chlorhydrate d'azélastine (= 125 microgrammes d'azélastine) et 50 microgrammes de propionate de fluticasone.
· Les autres composants sont : glycérol, cellulose microcristalline, carmellose sodique, édétate disodique, polysorbate 80, chlorure de benzalkonium, alcool phényléthylique et eau purifiée.
La suspension pour pulvérisation nasale d’AZELASTINE CHLORHYDRATE / FLUTICASONE PROPIONATE EG est une suspension homogène blanche.
La suspension pour pulvérisation nasale d’AZELASTINE CHLORHYDRATE / FLUTICASONE PROPIONATE EG se présente dans un flacon en verre brun doté d'une pompe doseuse, d'un applicateur et d'un capuchon de protection.
Le flacon de 25 mL contient 23 g de suspension pour pulvérisation nasale (délivrant au moins 120 pulvérisations).
La suspension pour pulvérisation nasale d’AZELASTINE CHLORHYDRATE / FLUTICASONE PROPIONATE EG se présente en :
Boîtes contenant 1 flacon de 23 g de suspension pour pulvérisation nasale
Conditionnements multiples contenant 3 flacons, contenant chacun 23 g de suspension pour pulvérisation nasale.
Toutes les présentations peuvent ne pas être commercialisées.
Titulaire de l’autorisation de mise sur le marché
EG LABO - LABORATOIRES EUROGENERICS
CENTRAL PARK
9-15 RUE MAURICE MALLET
92130 ISSY-LES-MOULINEAUX
Exploitant de l’autorisation de mise sur le marché
EG LABO - LABORATOIRES EUROGENERICS
CENTRAL PARK
9-15 RUE MAURICE MALLET
92130 ISSY-LES-MOULINEAUX
MARATHONOS AVENUE 95, PIKERMI
ATTIKI, 190 09
GRECE
OU
STADA ARZNEIMITTEL AG
STADASTRAßE 2-18,
61118 BAD VILBEL,
ALLEMAGNE
OU
CLONMEL HEALTHCARE LTD.
3 WATERFORD ROAD, CLONMEL,
CO. TIPPERARY, E91 D768,
IRLANDE
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Ce médicament est autorisé dans les Etats membres de l'Espace Economique Européen sous les noms suivants : Conformément à la réglementation en vigueur.
[à compléter ultérieurement par le titulaire]
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
{mois AAAA}.
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).