Dernière mise à jour le 08/01/2026
EVEROLIMUS TEVA 5 mg, comprimé
Indications thérapeutiques
Classe pharmacothérapeutique : Agents antinéoplasiques, inhibiteurs de protéine kinase - code ATC : L01EG02
Premier groupe d'indications
EVEROLIMUS TEVA est un médicament anticancéreux qui contient une substance active appelée évérolimus. L’évérolimus réduit l’apport de sang à la tumeur et ralentit la croissance et l’extension des cellules cancéreuses.
EVEROLIMUS TEVA est utilisé chez les patients adultes pour traiter :
· le cancer du sein avancé avec récepteurs hormonaux positifs chez les femmes ménopausées chez qui d'autres traitements (appelés « inhibiteurs non-stéroïdiens de l'aromatase ») ne permettent plus de contrôler la maladie. Il est administré avec un médicament appelé exémestane, un inhibiteur stéroïdien de l'aromatase, qui est utilisé dans le traitement hormonal du cancer du sein ;
· des tumeurs avancées appelées tumeurs neuroendocrines d’origine gastrique, intestinale, pulmonaire ou pancréatique. Il est administré si les tumeurs sont inopérables et si elles ne produisent pas d’hormones spécifiques en excès ou d’autres substances naturelles apparentées ;
· le cancer du rein (carcinome rénal avancé) à un stade avancé lorsque d’autres traitements (appelés « thérapie ciblée anti-VEGF ») n’ont pas été efficaces pour arrêter la progression de la maladie.
Second groupe d'indications
EVEROLIMUS TEVA est un médicament antitumoral qui peut empêcher certaines cellules de l’organisme de se développer. Il contient une substance active appelée évérolimus, qui peut réduire la taille des tumeurs rénales appelées angiomyolipomes rénaux et des tumeurs cérébrales appelées astrocytomes sous-épendymaires à cellules géantes (SEGA). Ces tumeurs sont causées par une maladie génétique appelée sclérose tubéreuse de Bourneville (STB).
EVEROLIMUS TEVA est utilisé pour traiter :
· la STB avec angiomyolipome rénal chez les adultes qui ne nécessitent pas d'intervention chirurgicale immédiate ;
· le SEGA associé à une STB chez les adultes et les enfants pour lesquels une intervention chirurgicale n’est pas appropriée.
Présentations
> 30 plaquette(s) prédécoupée(s) unitaire(s) OPA : polyamide orienté aluminium PVC-Aluminium de 1 comprimé(s)
Code CIP : 34009 301 176 3 7
Déclaration de commercialisation : 17/04/2019
Cette présentation est agréée aux collectivités
- Prix hors honoraire de dispensation : 949,12 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 950,14 €
- Taux de remboursement :100%
Service médical rendu (SMR)
Amélioration du service médical rendu (ASMR)
Ce médicament étant un générique, l'ASMR n'a pas été évalué par la commission de la transparence (CT), il est possible de se référer à la /aux spécialité(s) de référence du groupe générique auquel appartient ce médicament (cliquez ici pour aller à la rubrique des groupes génériques)
Autres informations
- Titulaire de l'autorisation : TEVA SANTE
- Conditions de prescription et de délivrance :
- liste I
- médicament nécessitant une surveillance particulière pendant le traitement
- prescription hospitalière
- prescription réservée aux médecins compétents en CANCEROLOGIE
- prescription réservée aux spécialistes et services HEMATOLOGIE
- prescription réservée aux spécialistes et services ONCOLOGIE MEDICALE
- Statut de l'autorisation : Valide
- Type de procédure : Procédure décentralisée
- Code CIS : 6 284 995 7
ANSM - Mis à jour le : 27/09/2024
EVEROLIMUS TEVA 5 mg, comprimé
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Evérolimus.............................................................................................................................. 5 mg
Pour un comprimé.
Excipient à effet notoire : chaque comprimé contient 149 mg de lactose.
Pour la liste complète des excipients, voir rubrique 6.1.
Comprimé oblong, plat, de couleur blanche, à bords biseautés, d’environ 12 mm de long et 5 mm de large, comportant la mention « EV » sur une face et « 5 » sur l’autre face.
4.1. Indications thérapeutiques
Cancer du sein avancé avec récepteurs hormonaux positifs
EVEROLIMUS TEVA est indiqué dans le traitement du cancer du sein avancé avec récepteurs hormonaux positifs, HER2/neu négatif, en association avec l’exémestane, chez les femmes ménopausées sans atteinte viscérale symptomatique dès récidive ou progression de la maladie et précédemment traitées par un inhibiteur non-stéroïdien de l'aromatase.
Tumeurs neuroendocrines d’origine pancréatique
EVEROLIMUS TEVA est indiqué dans le traitement de tumeurs neuroendocrines d’origine pancréatique non résécables ou métastatiques bien ou moyennement différenciées avec progression de la maladie chez l’adulte.
Tumeurs neuroendocrines d’origine gastro-intestinale ou pulmonaire
EVEROLIMUS TEVA est indiqué dans le traitement de tumeurs neuroendocrines d’origine gastro-intestinale ou pulmonaire non résécables ou métastatiques, bien différenciées (Grade 1 ou Grade 2), non fonctionnelles, avec progression de la maladie chez l’adulte (voir rubriques 4.4 et 5.1).
Cancer du rein
EVEROLIMUS TEVA est indiqué dans le traitement du cancer du rein avancé chez les patients dont la maladie a progressé sous ou après une thérapie ciblée anti-VEGF.
Angiomyolipome rénal associé à une sclérose tubéreuse de Bourneville (STB)
EVEROLIMUS TEVA est indiqué dans le traitement des patients adultes atteints d’angiomyolipome rénal associé à une STB présentant un risque de complications (sur la base de facteurs de risque tels que la taille de la tumeur, la présence d'un anévrisme ou la présence de tumeurs multiples ou bilatérales) mais qui ne nécessitent pas d'intervention chirurgicale immédiate.
L'efficacité a été démontrée à partir de l'analyse de la variation de la somme des volumes des angiomyolipomes.
Astrocytome sous-épendymaire à cellules géantes (SEGA) associé à une STB
EVEROLIMUS TEVA est indiqué dans le traitement des patients adultes et pédiatriques présentant un SEGA associé à une STB qui nécessitent une intervention thérapeutique mais qui ne sont pas candidats à une résection chirurgicale.
L’efficacité a été démontrée à partir de l’analyse de la variation du volume du SEGA. D’autres bénéfices cliniques, tels que l’amélioration des symptômes liés à la maladie, n’ont pas été démontrés.
4.2. Posologie et mode d'administration
Cancer du sein/tumeurs neuroendocrines/carcinome à cellules rénales
Le traitement par EVEROLIMUS TEVA doit être instauré et suivi par un médecin ayant l’expérience des traitements anticancéreux.
Pour les différentes posologies, EVEROLIMUS TEVA est disponible en comprimés de 2,5 mg, 5 mg, 7,5 mg et 10 mg.
La dose recommandée d’évérolimus est de 10 mg une fois par jour. Le traitement doit être poursuivi aussi longtemps qu’un bénéfice clinique est observé ou jusqu’à la survenue d’une toxicité inacceptable.
Si une dose est oubliée, le patient ne doit pas prendre une dose supplémentaire, mais prendre la prochaine dose prescrite comme d’habitude.
Ajustement de la posologie en cas d’effets indésirables
La prise en charge d’effets indésirables sévères et/ou mal tolérés suspectés d’être liés au traitement peut nécessiter une réduction de dose et/ou une interruption temporaire du traitement par évérolimus. Pour les effets indésirables de Grade 1, une adaptation de la dose n’est généralement pas nécessaire. S’il est nécessaire de diminuer la posologie, la dose recommandée est de 5 mg par jour et elle ne doit pas être inférieure à 5 mg par jour.
Le tableau 1 résume les recommandations pour l’adaptation de la posologie en cas d’effets indésirables spécifiques (voir également rubrique 4.4).
Tableau 1 Recommandations pour l’adaptation de la posologie d’évérolimus
|
Effet indésirable |
Sévérité1 |
Adaptation de la posologie d’évérolimus |
|
Pneumopathie non infectieuse |
Grade 2 |
Envisager l'interruption du traitement jusqu'à l'amélioration des symptômes à un Grade ≤ 1. Réintroduire le traitement à 5 mg par jour. Arrêter le traitement en l'absence de récupération dans un délai de 4 semaines. |
|
Grade 3 |
Interrompre le traitement jusqu’à la résolution des symptômes à un Grade ≤ 1. Envisager la reprise du traitement à 5 mg par jour. Si une toxicité de Grade 3 réapparaît, envisager l’arrêt du traitement. |
|
|
Grade 4 |
Arrêter le traitement. |
|
|
Stomatite |
Grade 2 |
Interrompre temporairement le traitement jusqu'à rétablissement à un Grade ≤ 1. Réintroduire le traitement à la même dose. En cas de récidive de la stomatite à un Grade 2, interrompre le traitement jusqu'à rétablissement à un Grade ≤ 1. Réintroduire le traitement à 5 mg par jour. |
|
Grade 3 |
Interrompre temporairement le traitement jusqu'à rétablissement à un Grade ≤ 1. Réintroduire le traitement à 5 mg par jour. |
|
|
Grade 4 |
Arrêter le traitement. |
|
|
Autres toxicités non hématologiques (sauf événements métaboliques) |
Grade 2 |
Si la toxicité est tolérable, aucune adaptation de la posologie n'est nécessaire. Si la toxicité devient intolérable, interrompre temporairement le traitement jusqu'à rétablissement à un Grade ≤ 1. Réintroduire le traitement à la même dose. En cas de récidive de la toxicité à un Grade 2, interrompre le traitement jusqu'à rétablissement à un Grade ≤ 1. Réintroduire le traitement à 5 mg par jour. |
|
Grade 3 |
Interrompre temporairement le traitement jusqu'à rétablissement à un Grade ≤ 1. Envisager de réintroduire le traitement à 5 mg par jour. Si une toxicité de Grade 3 réapparaît, envisager l’arrêt du traitement. |
|
|
Grade 4 |
Arrêter le traitement. |
|
|
Evénements métaboliques (par exemple hyperglycémie, dyslipidémie) |
Grade 2 |
Aucune adaptation de la posologie n'est nécessaire. |
|
Grade 3 |
Interrompre temporairement le traitement. Réintroduire le traitement à 5 mg par jour. |
|
|
Grade 4 |
Arrêter le traitement. |
|
|
Thrombopénie |
Grade 2 (< 75, ≥ 50 x 109/L) |
Interrompre temporairement le traitement jusqu'à rétablissement à un Grade ≤ 1 (≥ 75 x 109/L). Réintroduire le traitement à la même dose. |
|
Grade 3 et 4 (< 50 x 109/L) |
Interrompre temporairement le traitement jusqu'à rétablissement à un Grade ≤ 1 (≥ 75 x 109/L). Réintroduire le traitement à 5 mg par jour. |
|
|
Neutropénie |
Grade 2 (≥ 1 x 109/L) |
Aucune adaptation de la posologie n'est nécessaire. |
|
Grade 3 (< 1, ≥ 0,5 x 109/L) |
Interrompre temporairement le traitement jusqu'à rétablissement à un Grade ≤ 2 (≥ 1 x 109/L). Réintroduire le traitement à la même dose. |
|
|
Grade 4 (< 0,5 x 109/L) |
Interrompre temporairement le traitement jusqu'à rétablissement à un Grade ≤ 2 (≥ 1 x 109/L). Réintroduire le traitement à 5 mg par jour. |
|
|
Neutropénie fébrile |
Grade 3 |
Interrompre temporairement le traitement jusqu'à rétablissement à un Grade ≤ 2 (≥ 1,25 x 109/L) et absence de fièvre. Réintroduire le traitement à 5 mg par jour. |
|
Grade 4 |
Arrêter le traitement. |
|
|
1 Grades évalués selon les critères communs de terminologie des événements indésirables (CTCAE, Common Terminology Criteria for Adverse Events), version 3.0, de l’Institut national américain du cancer (NCI, National Cancer Institute) |
||
Populations particulières
Patients âgés (≥ 65 ans)
Aucune adaptation de la posologie n’est nécessaire (voir rubrique 5.2).
Insuffisance rénale
Aucune adaptation de la posologie n’est nécessaire (voir rubrique 5.2).
Insuffisance hépatique
· Insuffisance hépatique légère (classe A de Child-Pugh) – la dose quotidienne recommandée est de 7,5 mg.
· Insuffisance hépatique modérée (classe B de Child-Pugh) – la dose quotidienne recommandée est de 5 mg.
· Insuffisance hépatique sévère (classe C de Child-Pugh) – L’évérolimus n’est recommandé que si le bénéfice attendu est supérieur au risque. Dans ce cas, la dose quotidienne ne devra pas dépasser 2,5 mg.
Une adaptation posologique devra être effectuée si la fonction hépatique du patient (classe de Child-Pugh) change au cours du traitement (voir également rubriques 4.4 et 5.2).
Population pédiatrique
La sécurité et l’efficacité de l’évérolimus chez les enfants âgés de 0 à 18 ans n’ont pas été établies. Aucune donnée n’est disponible.
Angiomyolipome rénal/SEGA
Le traitement par EVEROLIMUS TEVA doit être instauré par un médecin expérimenté dans le traitement des patients présentant une STB et dans le suivi thérapeutique pharmacologique.
Posologie
Angiomyolipome rénal associé à une STB
La dose recommandée est de 10 mg d’évérolimus une fois par jour. Le traitement doit être poursuivi aussi longtemps qu’un bénéfice clinique est observé ou jusqu’à la survenue d’une toxicité inacceptable.
En cas d’oubli d’une dose, le patient ne doit pas prendre une dose supplémentaire, mais prendre la dose suivante habituelle prescrite.
SEGA associé à une STB
Un titrage minutieux peut s’avérer nécessaire pour obtenir un effet thérapeutique optimal. Les doses tolérées et efficaces varient d’un patient à l’autre. Un traitement antiépileptique concomitant peut modifier le métabolisme de l’évérolimus et contribuer à cette variabilité (voir rubrique 4.5).
La posologie est établie individuellement en fonction de la surface corporelle (SC) à l’aide de la formule de Dubois, où le poids (P) est exprimé en kilogrammes et la taille (T) est exprimée en centimètres :
SC = (P0,425 × T0,725) × 0,007184
La dose initiale recommandée d’évérolimus pour le traitement des patients présentant un SEGA est de 4,5 mg/m2. Sur la base des simulations pharmacocinétiques (voir rubrique 5.2), une dose initiale plus élevée de 7 mg/m2 est recommandée chez les patients âgés de 1 an à moins de 3 ans. Différents dosages d’EVEROLIMUS TEVA peuvent être associés pour atteindre la dose souhaitée.
Les concentrations résiduelles d’évérolimus dans le sang total doivent être déterminées au moins 1 semaine après le début du traitement. La posologie doit être adaptée pour atteindre des concentrations résiduelles de 5 à 15 ng/mL. La dose peut être augmentée pour atteindre une concentration résiduelle plus élevée dans l’intervalle cible afin d’obtenir une efficacité optimale, en tenant compte de la tolérance.
La posologie pour chaque patient doit être titrée en augmentant la dose par paliers de 2,5 mg afin d’atteindre la concentration résiduelle cible pour une réponse clinique optimale. L’efficacité, la sécurité, les traitements concomitants et la concentration résiduelle actuelle doivent être pris en compte lors de la planification du titrage de la dose. Le titrage de la dose pour chaque patient peut être basé sur une proportion simple :
Nouvelle dose d’évérolimus = dose actuelle × (concentration cible / concentration actuelle)
Par exemple, la dose actuelle d’un patient basée sur sa surface corporelle (SC) est de 2,5 mg avec une concentration à l’état d’équilibre de 4 ng/mL. Pour atteindre une concentration cible supérieure à la limite inférieure de la Cmin de 5 ng/mL, par exemple 8 ng/mL, la nouvelle dose d’évérolimus devrait être de 5 mg (soit une augmentation de 2,5 mg par rapport à la dose quotidienne actuelle). Dans les cas où la dose modifiée n’est pas un multiple de 2,5 mg, celle-ci doit être arrondie à la concentration supérieure du comprimé disponible.
Les recommandations posologiques pour les patients pédiatriques présentant un SEGA sont les mêmes que pour la population adulte présentant un SEGA, à l’exception des patients âgés de 1 an à moins de 3 ans, et ceux présentant une insuffisance hépatique (voir rubrique « Insuffisance hépatique » ci-dessous et rubrique 5.2).
Le volume du SEGA doit être évalué environ 3 mois après le début du traitement par évérolimus, et les ajustements de dose ultérieurs doivent prendre en compte les variations du volume de SEGA, la concentration résiduelle correspondante et la tolérance.
Une fois qu’une dose stable est atteinte, les concentrations résiduelles doivent être surveillées tous les 3 à 6 mois chez les patients dont la SC évolue ou tous les 6 à 12 mois chez les patients dont la SC est stable, et ce pendant toute la durée du traitement.
Le traitement doit être poursuivi tant qu’un bénéfice clinique est observé ou jusqu’à la survenue d’une toxicité inacceptable.
En cas d’oubli d’une dose, le patient ne doit pas prendre de dose supplémentaire, mais prendre la dose suivante habituelle prescrite.
Ajustements de dose en raison d’effets indésirables
La prise en charge d’effets indésirables suspectés sévères et/ou intolérables peut nécessiter une réduction de la dose et/ou une interruption temporaire du traitement par évérolimus. Une adaptation posologique n’est généralement pas nécessaire pour les effets indésirables de Grade 1. Si une réduction de la dose est nécessaire, la dose recommandée est environ 50 % plus faible que la dose quotidienne précédemment administrée. En cas de réductions de dose en dessous de la concentration la plus faible disponible, une administration un jour sur deux doit être envisagée.
Le tableau 2 récapitule les recommandations d’adaptation posologique en cas d’effets indésirables spécifiques (voir également rubrique 4.4).
Tableau 2 Recommandations relatives à l'adaptation de la posologie d’évérolimus
|
Effet indésirable |
Sévérité1 |
Adaptation de la posologie d’évérolimus |
|
Pneumopathie non infectieuse |
Grade 2 |
Envisager l'interruption du traitement jusqu'à l'amélioration des symptômes à un Grade ≤ 1. Réintroduire l’évérolimus à une dose environ 50 % plus faible que la dose quotidienne précédemment administrée. Arrêter le traitement en l'absence de récupération dans un délai de 4 semaines. |
|
Grade 3 |
Interrompre l’évérolimus jusqu’à la résolution des symptômes à un Grade ≤ 1. Envisager la reprise de l’évérolimus à une dose environ 50 % plus faible que la dose quotidienne précédemment administrée. Si une toxicité de Grade 3 réapparaît, envisager l’arrêt du traitement. |
|
|
Grade 4 |
Arrêter l’évérolimus. |
|
|
Stomatite |
Grade 2 |
Interrompre temporairement le traitement jusqu'à rétablissement à un Grade ≤ 1. Réintroduire l’évérolimus à la même dose. En cas de récidive de la stomatite à un Grade 2, interrompre le traitement jusqu'à rétablissement à un Grade ≤ 1. Réintroduire l’évérolimus à une dose environ 50 % plus faible que la dose quotidienne précédemment administrée. |
|
Grade 3 |
Interrompre temporairement le traitement jusqu'à rétablissement à un Grade ̤≤ 1. Réintroduire l’évérolimus à une dose environ 50 % plus faible que la dose quotidienne précédemment administrée. |
|
|
Grade 4 |
Arrêter l’évérolimus. |
|
|
Autres toxicités non hématologiques (sauf événements métaboliques) |
Grade 2 |
Si la toxicité est tolérable, aucune adaptation posologique n'est nécessaire. Si la toxicité devient intolérable, interrompre temporairement le traitement jusqu'à rétablissement à un Grade ≤ 1. Réintroduire l’évérolimus à la même dose. En cas de récidive de la toxicité à un Grade 2, interrompre l’évérolimus jusqu'à rétablissement à un Grade ≤ 1. Réintroduire l’évérolimus à une dose environ 50 % plus faible que la dose quotidienne précédemment administrée. |
|
Grade 3 |
Interrompre temporairement le traitement jusqu'à rétablissement à un Grade ≤ 1. Envisager la reprise de l’évérolimus à une dose environ 50 % plus faible que la dose quotidienne précédemment administrée. Si une toxicité de Grade 3 réapparaît, envisager l’arrêt du traitement. |
|
|
Grade 4 |
Arrêter l’évérolimus. |
|
|
Evénements métaboliques (par exemple, hyperglycémie, dyslipidémie) |
Grade 2 |
Aucune adaptation posologique n'est nécessaire. |
|
Grade 3 |
Interrompre temporairement le traitement. Réintroduire l’évérolimus à une dose environ 50 % plus faible que la dose quotidienne précédemment administrée. |
|
|
Grade 4 |
Arrêter l’évérolimus. |
|
|
Thrombopénie |
Grade 2 (< 75, ≥ 50 × 109/L) |
Interrompre temporairement le traitement jusqu'à rétablissement à un Grade ≤ 1 (≥ 75 × 109/L). Réintroduire l’évérolimus à la même dose. |
|
Grades 3 et 4 (< 50 × 109/L) |
Interrompre temporairement le traitement jusqu'à rétablissement à un Grade ≤ 1 (≥ 75 × 109/L). Réintroduire l’évérolimus à une dose environ 50% plus faible que la dose quotidienne précédemment administrée. |
|
|
Neutropénie |
Grade 2 (≥1 × 109/L) |
Aucune adaptation posologique n'est nécessaire. |
|
Grade 3 (< 1, ≥ 0,5 × 109/L) |
Interrompre temporairement le traitement jusqu'à rétablissement à un Grade ≤ 2 (≥ 1 × 109/L). Réintroduire l’évérolimus à la même dose. |
|
|
Grade 4 (<0.5 × 109/l) |
Interrompre temporairement le traitement jusqu'à rétablissement à un Grade ≤ 2 (≥ 1 × 109/L). Réintroduire l’évérolimus à une dose environ 50 % plus faible que la dose quotidienne précédemment administrée. |
|
|
Neutropénie fébrile |
Grade 3 |
Interrompre temporairement le traitement jusqu'à rétablissement à un Grade ≤ 2 (≥ 1,25 × 109/L) et absence de fièvre. Réintroduire l’évérolimus à une dose environ 50 % plus faible que la dose quotidienne précédemment administrée. |
|
Grade 4 |
Arrêter l’évérolimus. |
|
|
1 Grades évalués selon l’échelle de classification clinique internationale CTCAE (Common Terminology Criteria for Adverse Events) v3.0 de l’Institut National du Cancer (NCI) |
||
Suivi thérapeutique
Le suivi thérapeutique des concentrations sanguines d’évérolimus à l’aide d’une technique de dosage validé est nécessaire chez les patients traités pour un SEGA. Les concentrations résiduelles doivent être déterminées au moins 1 semaine après l’administration de la dose initiale, après toute modification de dose ou de forme pharmaceutique, après l’instauration ou la modification de la co-administration d’inhibiteurs du CYP3A4 (voir rubriques 4.4 et 4.5) ou après toute modification du statut hépatique (Child-Pugh) (voir « Insuffisance hépatique » ci-dessous et rubrique 5.2). Les concentrations résiduelles doivent être déterminées 2 à 4 semaines après le début ou la modification de la co-administration d’inducteurs du CYP3A4 (voir rubriques 4.4 et 4.5) étant donné que le temps de dégradation naturelle des enzymes induites doit être pris en compte.
Le suivi thérapeutique des concentrations sanguines d’évérolimus, à l’aide d’une technique de dosage validée, est une option à envisager chez les patients traités pour un angiomyolipome rénal associé à une STB (voir rubrique 5.1) après l’instauration ou la modification de la co-administration d’inducteurs ou d’inhibiteurs du CYP3A4 (voir rubriques 4.4 et 4.5) ou après toute modification du statut hépatique (Child-Pugh) (voir rubrique « Insuffisance hépatique » ci-dessous et rubrique 5.2).
Dans la mesure du possible, la même technique de dosage et le même laboratoire doivent être retenus pour le suivi thérapeutique tout au long du traitement.
Populations particulières
Personnes âgées
Aucune adaptation posologique n’est nécessaire (voir rubrique 5.2).
Insuffisance rénale
Aucune adaptation posologique n’est nécessaire (voir rubrique 5.2).
Insuffisance hépatique
· Patients présentant un angiomyolipome rénal associé à une STB :
o Insuffisance hépatique légère (classe A de Child-Pugh) : la dose recommandée est de 7,5 mg par jour.
o Insuffisance hépatique modérée (classe B de Child-Pugh) : la dose recommandée est de 5 mg par jour.
o Insuffisance hépatique sévère (classe C de Child-Pugh) : l’évérolimus est uniquement recommandé si le bénéfice attendu est supérieur au risque. Dans ce cas, une dose de 2,5 mg par jour ne doit pas être dépassée (voir rubriques 4.4 et 5.2).
Des ajustements de dose devront être effectués en cas de modification du statut hépatique du patient (classe de Child-Pugh) au cours du traitement.
· Patients présentant un SEGA associé à une STB :
o Patients âgés de < 18 ans :
L’évérolimus n’est pas recommandé chez les patients âgés de < 18 ans présentant un SEGA et une insuffisance hépatique.
o Patients âgés de ≥ 18 ans :
§ Insuffisance hépatique légère (classe A de Child-Pugh) : 75 % de la dose initiale recommandée calculée en fonction de la SC (arrondie au dosage le plus proche)
§ Insuffisance hépatique modérée (classe B de Child-Pugh) : 50 % de la dose initiale recommandée calculée en fonction de la SC (arrondie au dosage le plus proche)
§ Insuffisance hépatique sévère (classe C de Child-Pugh) : l’évérolimus est uniquement recommandé si le bénéfice attendu est supérieur au risque. Dans ce cas, la dose ne doit pas dépasser 25 % de la dose calculée en fonction de la SC (arrondie au dosage le plus proche).
Les concentrations résiduelles d’évérolimus dans le sang total doivent être déterminées au moins 1 semaine après toute modification du statut hépatique (Child-Pugh).
Population pédiatrique
· La sécurité et l'efficacité de l’évérolimus chez les enfants âgés de 0 à 18 ans présentant un angiomyolipome rénal associé à une STB en l'absence de SEGA n'ont pas été établies. Aucune donnée n'est disponible.
· La sécurité, l’efficacité et le profil pharmacocinétique de l’évérolimus chez les enfants âgés de moins de 1 an atteints d’une STB et présentant un SEGA n’ont pas été établis. Aucune donnée n’est disponible (voir rubriques 5.1 et 5.2).
Les résultats des études cliniques n’ont pas démontré d’impact de l’évérolimus sur la croissance ni sur le développement pubertaire.
Mode d’administration
EVEROLIMUS TEVA doit être pris par voie orale une fois par jour à la même heure chaque jour, avec ou sans aliments de façon constante (voir rubrique 5.2). Les comprimés doivent être avalés entiers avec un verre d’eau. Les comprimés ne doivent être ni mâchés ni écrasés.
Angiomyolipome rénal/SEGA
Pour les patients atteints d’une STB et présentant un SEGA incapables d’avaler des comprimés, le ou les comprimés peuvent être complètement dissous dans un verre contenant environ 30 mL d’eau en agitant doucement jusqu’à ce que le ou les comprimés soient totalement désintégrés (environ 8,5 minutes), immédiatement avant de boire le contenu du verre. Après l’ingestion de la dispersion, tout résidu doit être dissous à nouveau dans le même volume d’eau et être avalé.
4.4. Mises en garde spéciales et précautions d'emploi
La pneumopathie non infectieuse est un effet de classe des dérivés de la rapamycine, y compris l’évérolimus.
Cancer du sein/tumeurs neuroendocrines/carcinome à cellules rénales
Des pneumopathies non infectieuses (y compris maladie pulmonaire interstitielle) ont été fréquemment rapportées chez des patients traités par évérolimus (voir rubrique 4.8).
Angiomyolipome rénal/SEGA
Des pneumopathies non infectieuses (y compris maladie pulmonaire interstitielle) ont été décrites très fréquemment chez les patients recevant l’évérolimus pour un cancer du rein avancé (voir rubrique 4.8).
Certains cas ont été sévères et, en de rares occasions, une issue fatale a été observée. Le diagnostic de pneumopathie non infectieuse doit être envisagé chez les patients présentant des signes et symptômes respiratoires non spécifiques tels qu’hypoxie, épanchement pleural, toux ou dyspnée et lorsqu’une étiologie infectieuse, néoplasique ou toute autre cause non médicamenteuse ont été exclues par les investigations appropriées.
Les infections opportunistes telles que la pneumonie à Pneumocystis jirovecii (carinii) (PPJ, PPC) devraient être exclues dans le cadre du diagnostic différentiel de pneumopathie non infectieuse (voir « Infections » ci-dessous). Il convient de recommander aux patients de signaler sans attendre tout symptôme respiratoire nouveau ou qui s’aggrave.
Chez les patients qui développent des modifications radiologiques évoquant une pneumopathie non infectieuse sans symptôme ou accompagnées de symptômes mineurs, le traitement par évérolimus peut être poursuivi sans modification de la posologie.
Cancer du sein/tumeurs neuroendocrines/carcinome à cellules rénales
En présence d’une symptomatologie modérée (Grade 2) ou sévère (Grade 3), l’administration de corticoïdes peut être indiquée jusqu’à résolution des symptômes cliniques.
Angiomyolipome rénal/SEGA
En présence d’une symptomatologie modérée, l’interruption du traitement doit être envisagée jusqu’à l’amélioration des symptômes. L’utilisation de corticoïdes peut être indiquée. Le traitement par évérolimus peut être réintroduit à une dose quotidienne environ 50 % plus faible que la dose précédemment administrée.
Dans les cas où les symptômes de pneumopathie non infectieuse sont sévères, le traitement par évérolimus doit être arrêté et l’utilisation de corticoïdes peut être indiquée jusqu’à la résolution des symptômes cliniques. Le traitement par évérolimus peut être réinstauré à une dose quotidienne environ 50 % plus faible que la dose précédemment administrée, en fonction des circonstances cliniques individuelles.
Chez les patients qui nécessitent l’utilisation de corticoïdes pour le traitement d’une pneumopathie non infectieuse, une prophylaxie de la PPJ/PPC peut être envisagée.
Infections
L’évérolimus possède des propriétés immunosuppressives et il peut prédisposer les patients aux infections bactériennes, fongiques, virales ou à protozoaires, comprenant les infections par des agents pathogènes opportunistes (voir rubrique 4.8). Des infections localisées et systémiques, incluant des pneumonies, d’autres infections bactériennes, des infections fongiques invasives telles qu’aspergillose, candidose ou PPJ/PPC et des infections virales, notamment des cas de réactivation du virus de l’hépatite B, ont été décrites chez des patients traités par évérolimus.
Cancer du sein/tumeurs neuroendocrines/carcinome à cellules rénales
Certaines de ces infections ont été sévères (conduisant par exemple à une septicémie, une insuffisance respiratoire ou hépatique) et parfois d’issue fatale.
Angiomyolipome rénal/SEGA
Certaines de ces infections ont été sévères (conduisant par exemple à une septicémie [y compris choc septique], une insuffisance respiratoire ou hépatique) et parfois d’issue fatale chez des patients adultes et pédiatriques (voir rubrique 4.8).
Les médecins et les patients doivent être conscients du risque accru d’infection associé à la prise d’évérolimus. Les infections préexistantes doivent être traitées de manière appropriée et la guérison complète doit être obtenue avant l’instauration d’un traitement par évérolimus. Au cours d’un traitement par évérolimus, il convient d’être vigilant aux signes et symptômes d’infection : si une infection est diagnostiquée, un traitement approprié doit être instauré dans les plus brefs délais et l’arrêt temporaire ou définitif de l’évérolimus doit être envisagé.
Si le diagnostic d’une infection fongique systémique invasive est établi, le traitement par évérolimus doit être arrêté immédiatement et définitivement, et le patient doit être traité par un traitement antifongique approprié.
Des cas de PPJ/PPC, dont certains d’issue fatale, ont été rapportés chez des patients qui recevaient de l’évérolimus. La PPJ/PPC peut être associée à l'utilisation concomitante de corticoïdes ou d'autres agents immunosuppresseurs. Une prophylaxie des PPJ/PPC doit être envisagée lorsque l'utilisation concomitante de corticoïdes ou d'autres agents immunosuppresseurs est nécessaire.
Réactions d’hypersensibilité
Des réactions d’hypersensibilité se manifestant par des symptômes comprenant, de façon non exhaustive, anaphylaxie, dyspnée, bouffée congestive, douleur thoracique ou angiœdème (par exemple, gonflement des voies respiratoires ou de la langue avec ou sans difficultés respiratoires) ont été observées avec l’évérolimus (voir rubrique 4.3).
Utilisation concomitante avec des inhibiteurs de l’enzyme de conversion de l’angiotensine (ECA)
Les patients traités de manière concomitante par des inhibiteurs de l’ECA (par exemple, ramipril) peuvent être plus à risque de développer un angiœdème (par exemple, gonflement des voies respiratoires ou de la langue, avec ou sans difficultés respiratoires) (voir rubrique 4.5).
Stomatite
La stomatite, incluant ulcérations buccales et mucite, est l’effet indésirable le plus fréquemment rapporté chez des patients traités par évérolimus (voir rubrique 4.8). La stomatite apparaît le plus souvent au cours des 8 premières semaines de traitement. Une étude en simple bras chez des patientes ménopausées atteintes d’un cancer du sein traitées par évérolimus et exémestane a montré qu’une solution buvable de corticoïdes sans alcool, administrée en bain de bouche pendant les 8 premières semaines de traitement, pouvait diminuer l’incidence et la sévérité des stomatites (voir rubrique 5.1). La prise en charge des stomatites peut ainsi inclure l’utilisation prophylactique (chez les adultes) et/ou thérapeutique de traitements topiques, comme une solution buvable de corticoïdes sans alcool utilisée en bain de bouche. Cependant, les produits à base d’alcool, d’eau oxygénée, d’iode ou de dérivés du thym doivent être évités car ils peuvent exacerber l’affection. La surveillance et le traitement des infections fongiques sont recommandés, particulièrement chez les patients ayant été traités par des médicaments à base de stéroïdes. Les agents antifongiques ne doivent pas être utilisés, sauf si une infection fongique a été diagnostiquée (voir rubrique 4.5).
Angiomyolipome rénal/SEGA
Hémorragie
Des cas graves d’hémorragie, dont certains d’issue fatale, ont été rapportés chez des patients traités par évérolimus en oncologie. Aucun cas grave d’hémorragie rénale n’a été rapporté dans le cadre d’une STB.
La prudence est recommandée chez les patients prenant de l’évérolimus, en particulier en cas d’utilisation concomitante avec des substances actives connues pour modifier la fonction plaquettaire ou pouvant augmenter le risque d’hémorragie, ainsi que chez les patients présentant des antécédents de troubles de la coagulation. Les professionnels de santé et les patients doivent prêter attention aux signes et symptômes de saignement tout au long du traitement, en particulier en cas de facteurs de risques hémorragiques combinés.
Evénements liés à l’insuffisance rénale
Des cas d’insuffisance rénale (y compris insuffisance rénale aiguë) dont certains d’issue fatale, ont été observés chez des patients traités par évérolimus (voir rubrique 4.8). La fonction rénale doit être surveillée particulièrement lorsque les patients présentent des facteurs de risques associés qui pourraient davantage altérer leur fonction rénale.
Analyses biologiques et surveillance
Fonction rénale
Des augmentations de la créatininémie, généralement légères, et de la protéinurie ont été rapportées (voir rubrique 4.8). Il est recommandé de surveiller la fonction rénale, notamment l’urémie, la protéinurie ou la créatininémie, avant le début du traitement par évérolimus et régulièrement par la suite.
Glycémie
Des cas d’hyperglycémie ont été rapportés (voir rubrique 4.8). La glycémie à jeun doit être contrôlée avant le début du traitement par évérolimus et régulièrement par la suite. Une surveillance plus fréquente est recommandée quand l’évérolimus est co-administré avec des médicaments pouvant induire une hyperglycémie. Dans la mesure du possible, la glycémie doit être équilibrée de façon optimale avant l’instauration du traitement par évérolimus.
Lipémie
Des cas de dyslipidémie (incluant des cas d’hypercholestérolémie et d’hypertriglycéridémie) ont été rapportés. Il est recommandé de surveiller la cholestérolémie et la triglycéridémie avant le début du traitement par évérolimus et de manière régulière par la suite, et de mettre en place un traitement approprié.
Paramètres hématologiques
Des diminutions de l’hémoglobine, des lymphocytes, des neutrophiles et des plaquettes ont été observées (voir rubrique 4.8). La numération-formule sanguine doit être contrôlée avant l’instauration du traitement par évérolimus et régulièrement par la suite.
Cancer du sein/tumeurs neuroendocrines/carcinome à cellules rénales
Tumeurs carcinoïdes fonctionnelles
Dans un essai randomisé, en double aveugle et multicentrique, réalisé chez des patients présentant des tumeurs carcinoïdes fonctionnelles, l’évérolimus en association avec l’octréotide retard a été comparé au placebo associé à l’octréotide retard. L’étude n’a pas satisfait le critère d’efficacité principal (survie sans progression [SSP]) et l’analyse intermédiaire de la survie globale (SG) était numériquement en faveur du bras placebo associé à l’octréotide retard. En conséquence, la sécurité et l’efficacité de l’évérolimus chez les patients atteints de tumeurs carcinoïdes fonctionnelles n’ont pas été établies.
Facteurs pronostiques des tumeurs neuroendocrines d’origine gastro-intestinale ou pulmonaire
Chez les patients atteints de tumeurs neuroendocrines d’origine gastro-intestinale ou pulmonaire non fonctionnelles et présentant des facteurs de bon pronostic au diagnostic (par exemple, site tumoral primitif localisé à l’iléon et valeurs normales de la chromogranine A ou absence d’atteinte osseuse), une évaluation individuelle du rapport bénéfice/risque doit être réalisée avant de débuter le traitement par évérolimus. Des preuves limitées de bénéfice en termes de SSP ont été rapportées dans le sous-groupe de patients chez lesquels le site tumoral primitif était l’iléon (voir rubrique 5.1).
Interactions
L’administration concomitante avec des inhibiteurs et des inducteurs du CYP3A4 et/ou de la glycoprotéine P (PgP), qui agit comme pompe d’efflux de nombreux médicaments, doit être évitée (voir rubrique 4.5). Si l’administration concomitante avec un inhibiteur ou un inducteur modéré du CYP3A4 et/ou de la PgP ne peut être évitée, l'état clinique du patient doit être étroitement surveillé.
Cancer du sein/tumeurs neuroendocrines/carcinome à cellules rénales
Des ajustements de dose peuvent être envisagés en fonction de l’ASC prévisible (voir rubrique 4.5).
Angiomyolipome rénal/SEGA
Une surveillance des concentrations résiduelles d’évérolimus et des ajustements de dose d’évérolimus peuvent être nécessaires (voir rubrique 4.5).
Le traitement concomitant avec des inhibiteurs puissants du CYP3A4/de la PgP entraîne une augmentation considérable de la concentration plasmatique de l’évérolimus (voir rubrique 4.5). Il n’y a pas actuellement de données suffisantes pour permettre des recommandations posologiques dans cette situation. Ainsi, le traitement concomitant par évérolimus avec des inhibiteurs puissants n’est pas recommandé.
La prudence est requise lorsque l’évérolimus est pris en association avec des substrats du CYP3A4 à marge thérapeutique étroite administrés par voie orale, en raison du risque d’interactions médicamenteuses.
Cancer du sein/tumeurs neuroendocrines/carcinome à cellules rénales
Si l’évérolimus est pris en association avec des substrats du CYP3A4 à marge thérapeutique étroite administrés par voie orale (par exemple, pimozide, terfénadine, astémizole, cisapride, quinidine ou dérivés de l'ergot de seigle), le patient doit être surveillé à la recherche des effets indésirables décrits dans les informations sur le produit du substrat du CYP3A4 administré par voie orale (voir rubrique 4.5).
Angiomyolipome rénal/SEGA
Si l’évérolimus est pris en association avec des substrats du CYP3A4 à marge thérapeutique étroite administrés par voie orale (par exemple, pimozide, terfénadine, astémizole, cisapride, quinidine, dérivés de l'ergot de seigle ou carbamazépine), le patient doit être surveillé à la recherche des effets indésirables décrits dans les informations sur le produit du substrat du CYP3A4 administré par voie orale (voir rubrique 4.5).
Insuffisance hépatique
Cancer du sein/tumeurs neuroendocrines/carcinome à cellules rénales
L’exposition à l’évérolimus a été augmentée chez les patients présentant une insuffisance hépatique légère (classe A de Child-Pugh), modérée (classe B de Child-Pugh) et sévère (classe C de Child-Pugh) (voir rubrique 5.2).
L’utilisation d’EVEROLIMUS TEVA est uniquement recommandée chez les patients présentant une insuffisance hépatique sévère (classe C de Child-Pugh) si le bénéfice potentiel est supérieur au risque (voir rubriques 4.2 et 5.2).
Aucune donnée clinique d’efficacité ou de sécurité n’est actuellement disponible pour étayer des recommandations d’adaptation de posologie pour la prise en charge des effets indésirables chez les patients présentant une insuffisance hépatique.
Angiomyolipome rénal/SEGA
L’utilisation de l’évérolimus n’est pas recommandée chez les patients :
· âgés de ≥ 18 ans et présentant une insuffisance hépatique sévère concomitante (classe C de Child-Pugh) sauf si le bénéfice potentiel est supérieur au risque (voir rubriques 4.2 et 5.2) ;
· âgés de < 18 ans présentant un SEGA et une insuffisance hépatique concomitante (classes A, B et C de Child-Pugh) (voir rubriques 4.2 et 5.2).
Vaccinations
L’utilisation de vaccins vivants doit être évitée au cours du traitement par évérolimus (voir rubrique 4.5).
Angiomyolipome rénal/SEGA
Pour les patients pédiatriques présentant un SEGA qui ne nécessitent pas de traitement immédiat, il est conseillé d’effectuer le programme complet de vaccination infantile avant le début du traitement conformément aux recommandations thérapeutiques locales.
Complications de la cicatrisation des plaies
Une altération de la cicatrisation des plaies est un effet de la classe des dérivés de la rapamycine, y compris l’évérolimus. La prudence est donc requise avec l’utilisation d’évérolimus dans la phase péri-opératoire.
Complications de la radiothérapie
Des réactions graves et sévères aux radiations (telles que œsophagite radique, pneumopathie radique et lésion cutanée radique), y compris des cas mortels, ont été rapportés lorsque l’évérolimus était pris pendant, ou peu après, une radiothérapie. La prudence est donc requise quant à la potentialisation des toxicités radio-induites chez les patients prenant de l’évérolimus peu de temps après une radiothérapie.
De plus, un phénomène de rappel (PR) a été rapporté chez des patients prenant de l’évérolimus qui avaient préalablement reçu une radiothérapie. Dans le cas d’un PR, l’interruption ou l’arrêt du traitement par évérolimus doit être envisagé.
Excipient
Lactose
Les patients présentant une intolérance au galactose, un déficit total en lactase ou un syndrome de malabsorption du glucose et du galactose (maladies héréditaires rares) ne doivent pas prendre ce médicament.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Les interactions connues et théoriques avec des inhibiteurs et des inducteurs sélectifs du CYP3A4 et de la PgP sont décrites dans le tableau 3 ci-dessous.
Inhibiteurs du CYP3A4 et de la PgP susceptibles d’augmenter les concentrations d’évérolimus
Les substances qui sont des inhibiteurs du CYP3A4 ou de la PgP peuvent augmenter les concentrations sanguines de l’évérolimus en diminuant le métabolisme ou l’efflux de l’évérolimus des cellules intestinales.
Inducteurs du CYP3A4 et de la PgP susceptibles de diminuer les concentrations d’évérolimus
Les substances qui sont des inducteurs du CYP3A4 ou de la PgP peuvent diminuer les concentrations sanguines de l’évérolimus en augmentant le métabolisme ou l’efflux de l’évérolimus des cellules intestinales.
Tableau 3 Effets des autres substances actives sur l’évérolimus
|
Substance active par interaction |
Interaction – Modifications de l’ASC et/ou de la Cmax de l’évérolimus Rapport des moyennes géométriques (intervalle observé) |
Recommandations pour l’administration concomitante |
|
Inhibiteurs puissants du CYP3A4 et/ou de la PgP |
||
|
Kétoconazole |
ASC ↑15,3 fois (intervalle 11,2-22,5) Cmax ↑4,1 fois (intervalle 2,6-7,0) |
L’administration concomitante d’évérolimus avec des inhibiteurs puissants n’est pas recommandée. |
|
Itraconazole, posaconazole, voriconazole |
Non étudiée, une augmentation importante des concentrations de l’évérolimus est attendue. |
|
|
Télithromycine, clarithromycine |
||
|
Néfazodone |
||
|
Ritonavir, atazanavir, saquinavir, darunavir, indinavir, nelfinavir |
||
|
Inhibiteurs modérés du CYP3A4 et/ou de la PgP |
||
|
Erythromycine |
ASC ↑4,4 fois (intervalle 2,0-12,6) Cmax ↑2.0 fois (intervalle 0,9-3,5) |
Utilisation avec prudence quand l’administration concomitante avec des inhibiteurs modérés du CYP3A4 ou de la PgP ne peut être évitée. Cancer du sein/tumeurs neuroendocrines/carcinome à cellules rénales Si l’administration concomitante avec un inhibiteur modéré du CYP3A4 ou de la PgP est requise, une réduction de dose à 5 mg par jour ou 2,5 mg par jour peut être envisagée. Toutefois, il n’y a pas de données cliniques suffisantes sur l’ajustement de dose. En raison de la variabilité entre les sujets, les ajustements de dose recommandés peuvent ne pas être optimaux pour tous les individus, une surveillance étroite des effets indésirables est donc recommandée (voir rubriques 4.2 et 4.4). Si l’inhibiteur modéré est arrêté, envisager une période d’élimination d’au moins 2 à 3 jours (temps moyen d’élimination des inhibiteurs modérés les plus utilisés) avant de reprendre la dose d’évérolimus utilisée avant l’instauration du traitement concomitant. Pour les patients présentant un angiomyolipome rénal associé à une STB Voir également « Suivi thérapeutique » dans la rubrique 4.2 Angiomyolipome rénal/SEGA Pour les patients présentant un SEGA associé à une STB Si les patients nécessitent une co-administration avec un inhibiteur modéré du CYP3A4 ou de la PgP, réduire la dose quotidienne d’environ 50 %. Une réduction supplémentaire de la dose peut s’avérer nécessaire pour prendre en charge les effets indésirables (voir rubriques 4.2 et 4.4). Les concentrations résiduelles d’évérolimus doivent être déterminées au moins 1 semaine après l’ajout d’un inhibiteur modéré du CYP3A4 ou de la PgP. Si le traitement par l’inhibiteur modéré est arrêté, envisager une période d’élimination d’au moins 2 à 3 jours (temps d’élimination moyen des inhibiteurs modérés les plus fréquemment utilisés) avant que la dose d'évérolimus ne soit ramenée à celle utilisée avant l’instauration de la co-administration. La concentration résiduelle d’évérolimus doit être déterminée au moins 1 semaine plus tard (voir rubriques 4.2 et 4.4). |
|
Imatinib |
ASC ↑ 3,7 fois Cmax ↑ 2,2 fois |
|
|
Vérapamil |
ASC ↑3,5 fois (intervalle 2,2-6,3) Cmax ↑2,3 fois (intervalle 1,3-3,8) |
|
|
Ciclosporine orale |
ASC ↑2,7 fois (intervalle 1,5-4,7) Cmax ↑1,8 fois (intervalle 1,3-2,6) |
|
|
Cannabidiol (inhibiteur de la PgP) |
ASC ↑2,5 fois Cmax ↑2,5 fois |
|
|
Fluconazole |
Non étudiée. Exposition accrue attendue. |
|
|
Diltiazem |
||
|
Dronédarone |
Non étudiée. Exposition accrue attendue |
|
|
Amprénavir, fosamprénavir |
Non étudiée. Exposition accrue attendue. |
|
|
Jus de pamplemousse ou autres aliments ayant un effet sur le CYP3A4 et/ou la PgP |
Non étudiée. Exposition accrue attendue (variation élevée des effets). |
L’association doit être évitée. |
|
Inducteurs puissants et modérés du CYP3A4 et/ou de la PgP |
||
|
Rifampicine |
ASC ↓63 % (intervalle 0-80 %) Cmax ↓58 % (intervalle 10-70 %) |
Eviter l’utilisation concomitante avec les inducteurs puissants du CYP3A4. Cancer du sein/tumeurs neuroendocrines/carcinome à cellules rénales Si une administration concomitante avec un inducteur puissant du CYP3A4 est requise, une augmentation de la dose d’évérolimus de 10 mg à 20 mg par jour doit être envisagée en utilisant une augmentation par paliers de 5 mg ou moins le 4e jour et le 8e jour suivant l’instauration du traitement par l’inducteur. Il est prévu que cette dose d’évérolimus permette d’ajuster l’ASC à l’intervalle observé sans inducteurs. Toutefois, il n’existe aucune donnée clinique disponible avec cet ajustement de dose. Lorsque le traitement par l’inducteur est arrêté, envisager une période d’élimination d’au moins 3 à 5 jours (temps raisonnable pour une levée significative de l’induction enzymatique), avant de reprendre la dose d’évérolimus utilisée avant l’instauration du traitement concomitant. Pour les patients présentant un angiomyolipome rénal associé à une STB Voir également « Suivi thérapeutique » dans la rubrique 4.2. Angiomyolipome rénal/SEGA Pour les patients présentant un SEGA associé à une STB Les patients recevant de façon concomitante des inducteurs puissants du CYP3A4 peuvent nécessiter une augmentation de la dose d'évérolimus pour atteindre la même exposition que les patients ne prenant pas d'inducteurs puissants. La dose doit être titrée pour atteindre des concentrations résiduelles de 5 à 15 ng/mL. Si les concentrations sont inférieures à 5 ng/mL, la dose quotidienne peut être augmentée de 2,5 mg toutes les 2 semaines, en contrôlant la concentration résiduelle et en évaluant la tolérance avant d’augmenter la dose. L’ajout d’un autre inducteur puissant du CYP3A4 peut ne pas nécessiter d’ajustement posologique supplémentaire. Evaluer la concentration résiduelle d’évérolimus 2 semaines après l’instauration de l’inducteur supplémentaire. Ajuster la dose par paliers de 2,5 mg, si nécessaire, pour maintenir la concentration résiduelle cible. L’arrêt de l’un des inducteurs puissants du CYP3A4 peut ne pas nécessiter d’ajustement posologique supplémentaire. Evaluer la concentration résiduelle d’évérolimus 2 semaines après l’arrêt de l’un des inducteurs puissants du CYP3A4. Si tous les inducteurs puissants sont arrêtés, envisager une période de sevrage d’au moins 3 à 5 jours (temps raisonnable pour une levée significative de l’induction enzymatique), avant de reprendre la dose d’évérolimus utilisée avant le début de la co-administration. Les concentrations résiduelles d’évérolimus doivent être déterminées 2 à 4 semaines plus tard car il convient de prendre en compte le temps de dégradation naturelle des enzymes induites (voir rubriques 4.2 et 4.4). |
|
Dexaméthasone |
Non étudiée. Diminution de l’exposition attendue. |
|
|
Antiépileptiques (par exemple, carbamazépine, phénobarbital, phénytoïne) |
Non étudiée. Diminution de l’exposition attendue. |
|
|
Efavirenz, névirapine |
Non étudiée. Diminution de l’exposition attendue. |
|
|
Millepertuis (Hypericum Perforatum) |
Non étudiée. Diminution importante de l’exposition attendue. |
Les préparations contenant du millepertuis ne doivent pas être utilisées pendant un traitement par évérolimus. |
Substances actives dont la concentration plasmatique peut être altérée par l’évérolimus
En fonction des résultats des études in vitro, au vu des concentrations systémiques obtenues avec des doses de 10 mg par jour par voie orale, l’inhibition de la PgP, du CYP3A4 et du CYP2D6 est peu probable. Toutefois, l’inhibition du CYP3A4 et de la PgP dans l’intestin ne peut être exclue. Une étude d'interaction chez des sujets sains a montré que l'administration concomitante d'une dose orale de midazolam, un substrat sensible du CYP3A, avec l'évérolimus entraînait une augmentation de 25 % de la Cmax du midazolam et une augmentation de 30 % de l’ASC(0-inf) du midazolam. Cet effet est susceptible d’être dû à l’inhibition du CYP3A4 intestinal par l’évérolimus. L’évérolimus peut donc modifier la biodisponibilité des substrats du CYP3A4 administrés en association par voie orale. Toutefois, un effet cliniquement pertinent sur l'exposition aux substrats du CYP3A4 administrés par voie systémique n'est pas attendu (voir rubrique 4.4).
Cancer du sein/tumeurs neuroendocrines/carcinome à cellules rénales
L’administration concomitante d’évérolimus et d’octréotide retard a augmenté la Cmin de l’octréotide avec un rapport des moyennes géométriques (évérolimus/placebo) de 1,47. Un effet cliniquement significatif sur l’efficacité de l’évérolimus chez les patients atteints de tumeurs neuroendocrines avancées n’a pas pu être établi.
L'administration concomitante d'évérolimus et d'exémestane a augmenté la Cmin et la C2h de l'exémestane de 45 % et 64 %, respectivement. En revanche, les taux correspondants d'œstradiol à l'état d'équilibre (4 semaines) n'ont pas été différents entre les deux groupes de traitement. Aucune augmentation des effets indésirables liés à l'exémestane n'a été observée chez les patientes atteintes d'un cancer du sein avancé avec récepteurs hormonaux positifs recevant l'association. L'augmentation des taux d'exémestane ne devrait pas avoir d'impact sur l'efficacité ou la sécurité.
Angiomyolipome rénal/SEGA
Au cours de l’étude EXIST-3 (étude CRAD001M2304), l’évérolimus a augmenté d’environ 10 % les concentrations pré-dose des antiépileptiques carbamazépine, clobazam et du métabolite du clobazam, le N-desméthylclobazam. L’augmentation des concentrations pré-dose de ces antiépileptiques peut ne pas être cliniquement significative, mais des ajustements posologiques peuvent être envisagés pour les antiépileptiques ayant une marge thérapeutique étroite, tels que la carbamazépine. L’évérolimus n’a eu aucun impact sur les concentrations pré-dose des antiépileptiques qui sont des substrats du CYP3A4 (clonazépam, diazépam, felbamate et zonisamide).
Utilisation concomitante avec des inhibiteurs de l’ECA
Les patients traités de manière concomitante par des inhibiteurs de l’ECA (par exemple, ramipril) peuvent être plus à risque de développer un angiœdème (voir rubrique 4.4).
Vaccinations
La réponse immunitaire à la vaccination peut être affectée. Ainsi, la vaccination au cours d’un traitement par évérolimus peut être moins efficace. L’utilisation de vaccins vivants doit être évitée pendant le traitement par évérolimus (voir rubrique 4.4). Exemples de vaccins vivants : vaccin antigrippal intranasal, vaccin contre la rougeole, vaccin contre les oreillons, vaccin anti-rubéolique, vaccin antipoliomyélitique oral, vaccin BCG (bacille de Calmette et Guérin), vaccin antiamarile, vaccin contre la varicelle et vaccin antityphoïdique TY21a.
Radiothérapie
Des cas de potentialisation des toxicités radio-induites ont été rapportés chez des patients recevant l’évérolimus (voir rubriques 4.4 et 4.8).
4.6. Fertilité, grossesse et allaitement
Femmes en âge de procréer/Contraception chez les hommes et les femmes
Les femmes en âge de procréer doivent utiliser une méthode contraceptive hautement efficace (par exemple, méthode contraceptive hormonale ne contenant pas d’œstrogène administrée par voie orale, injectable ou implantable, contraceptifs à base de progestérone, hystérectomie, ligature des trompes, abstinence complète, méthodes barrières, dispositif intra-utérin [DIU], et/ou stérilisation de la femme/de l’homme) pendant le traitement par évérolimus et jusqu’à 8 semaines après l’arrêt du traitement. Il n’y a pas lieu d’interdire aux patients masculins de procréer.
Grossesse
Il n'existe pas de données suffisamment pertinentes concernant l'utilisation de l’évérolimus chez la femme enceinte. Les études effectuées chez l'animal ont mis en évidence une toxicité sur la reproduction, incluant une toxicité embryonnaire et fœtale (voir rubrique 5.3). Le risque potentiel en clinique n’est pas connu.
L’évérolimus n’est pas recommandé chez la femme enceinte et chez la femme en âge de procréer sans méthode contraceptive.
Allaitement
On ne sait pas si l’évérolimus est excrété dans le lait maternel humain. Cependant, les études chez le rat ont montré que l’évérolimus et/ou ses métabolites passaient facilement dans le lait (voir rubrique 5.3). Par conséquent, les femmes traitées par évérolimus ne doivent pas allaiter pendant le traitement et pendant les 2 semaines qui suivent la prise de la dernière dose.
Cancer du sein/tumeurs neuroendocrines/carcinome à cellules rénales
Fertilité
La possibilité que l’évérolimus provoque une stérilité chez les patients hommes et femmes est inconnue ; néanmoins, on a observé une aménorrhée (aménorrhée secondaire et autres irrégularités menstruelles) et un déséquilibre associé du rapport hormone lutéinisante (LH)/hormone folliculostimulante (FSH) chez les femmes. Les observations non cliniques indiquent que le traitement par évérolimus peut diminuer la fertilité masculine et féminine (voir rubrique 5.3).
Angiomyolipome rénal/SEGA
Fertilité
La possibilité que l’évérolimus provoque une stérilité chez les patients hommes et femmes est inconnue, mais une aménorrhée secondaire et un déséquilibre du rapport hormones lutéinisantes (LH)/hormones folliculo-stimulantes (FSH) ont été observés chez des patientes (voir également rubrique 5.3 pour les observations précliniques sur les systèmes reproductifs masculin et féminin). Les observations non cliniques indiquent que le traitement par évérolimus peut diminuer la fertilité masculine et féminine (voir rubrique 5.3).
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Cancer du sein/tumeurs neuroendocrines/carcinome à cellules rénales
Résumé du profil de sécurité
Le profil de sécurité est issu des données regroupées de 2 879 patients traités par évérolimus dans onze études cliniques, incluant cinq études de phase III randomisées, en double aveugle, contrôlées contre placebo et six études en ouvert de phase I et de phase II, liées aux indications approuvées.
Les effets indésirables les plus fréquents (incidence ≥ 1/10) issus des données regroupées de sécurité étaient (par ordre décroissant) : stomatite, rash, fatigue, diarrhée, infections, nausées, diminution de l’appétit, anémie, dysgueusie, pneumopathie, œdème périphérique, hyperglycémie, asthénie, prurit, perte de poids, hypercholestérolémie, épistaxis, toux et céphalées.
Les effets indésirables de Grades 3-4 les plus fréquents (fréquence ≥ 1/100 à < 1/10) ont été : stomatite, anémie, hyperglycémie, infections, fatigue, diarrhée, pneumopathie, asthénie, thrombopénie, neutropénie, dyspnée, protéinurie, lymphopénie, hémorragie, hypophosphatémie, rash, hypertension, pneumonie, alanine aminotransférase (ALAT) augmentée, aspartate aminotransférase (ASAT) augmentée et diabète. Les grades suivent la classification CTCAE version 3.0 et 4.03.
Tableau listant les effets indésirables
Le tableau 4 présente les catégories de fréquence d’effets indésirables rapportés lors d’analyses regroupées pour la prise en compte de la sécurité. Les effets indésirables sont présentés selon les classes de systèmes d’organes et les catégories de fréquence MedDRA. Les catégories de fréquence sont définies selon la convention suivante : très fréquent (≥ 1/10) ; fréquent (≥ 1/100, < 1/10) ; peu fréquent (≥ 1/1 000, < 1/100) ; rare (≥ 1/10 000, < 1/1 000) ; très rare (< 1/10 000) ; fréquence indéterminée (ne peut être estimée sur la base des données disponibles). Au sein de chaque groupe de fréquence, les effets indésirables sont présentés suivant un ordre décroissant de gravité.
Tableau 4 Effets indésirables rapportés dans les études cliniques
|
Infections et infestations |
|
|
Très fréquent |
Infectionsa,* |
|
Affections hématologiques et du système lymphatique |
|
|
Très fréquent |
Anémie |
|
Fréquent |
Thrombopénie, neutropénie, leucopénie, lymphopénie |
|
Peu fréquent |
Pancytopénie |
|
Rare |
Erythroblastopénie |
|
Affections du système immunitaire |
|
|
Peu fréquent |
Hypersensibilité |
|
Troubles du métabolisme et de la nutrition |
|
|
Très fréquent |
Diminution de l’appétit, hyperglycémie, hypercholestérolémie |
|
Fréquent |
Hypertriglycéridémie, hypophosphatémie, diabète, hyperlipidémie, hypokaliémie, déshydratation, hypocalcémie |
|
Affections psychiatriques |
|
|
Fréquent |
Insomnie |
|
Affections du système nerveux |
|
|
Très fréquent |
Dysgueusie, céphalées |
|
Peu fréquent |
Agueusie |
|
Affections oculaires |
|
|
Fréquent |
Œdème de la paupière |
|
Peu fréquent |
Conjonctivite |
|
Affections cardiaques |
|
|
Peu fréquent |
Insuffisance cardiaque congestive |
|
Affections vasculaires |
|
|
Fréquent |
Hémorragieb, hypertension |
|
Peu fréquent |
Bouffées vasomotrices, thrombose veineuse profonde |
|
Affections respiratoires, thoraciques et médiastinales |
|
|
Très fréquent |
Pneumopathiec, épistaxis, toux |
|
Fréquent |
Dyspnée |
|
Peu fréquent |
Hémoptysie, embolie pulmonaire |
|
Rare |
Syndrome de détresse respiratoire aiguë |
|
Affections gastro-intestinales |
|
|
Très fréquent |
Stomatited, diarrhée, nausées |
|
Fréquent |
Vomissements, sécheresse buccale, douleur abdominale, inflammation muqueuse, douleur buccale, dyspepsie, dysphagie |
|
Affections hépatobiliaires |
|
|
Fréquent |
Aspartate aminotransférase augmentée, alanine aminotransférase augmentée |
|
Affections de la peau et du tissu sous-cutané |
|
|
Très fréquent |
Rash, prurit |
|
Fréquent |
Sécheresse cutanée, altération des ongles, alopécie légère, acné, érythème, onychoclasie, érythrodysesthésie palmo-plantaire, exfoliation cutanée, lésion cutanée |
|
Rare |
Angiœdème* |
|
Affections musculo-squelettiques et systémiques |
|
|
Fréquent |
Arthralgie |
|
Affections du rein et des voies urinaires |
|
|
Fréquent |
Protéinurie*, créatinine sanguine augmentée, insuffisance rénale* |
|
Peu fréquent |
Augmentation des mictions diurnes, insuffisance rénale aiguë* |
|
Affections des organes de reproduction et du sein |
|
|
Fréquent |
Irrégularités menstruellese |
|
Peu fréquent |
Aménorrhéee * |
|
Troubles généraux et anomalies au site d’administration |
|
|
Très fréquent |
Fatigue, asthénie, œdème périphérique |
|
Fréquent |
Fièvre |
|
Peu fréquent |
Douleur thoracique non cardiaque, altération de la cicatrisation des plaies |
|
Investigations |
|
|
Très fréquent |
Perte de poids |
|
Lésions, intoxications et complications liées aux procédures |
|
|
Fréquence indéterminée |
Phénomène de rappel, potentialisation des toxicités radio-induitesf |
|
* Voir également la sous-rubrique « Description de certains effets indésirables » a Inclut tous les effets de la classe de systèmes d’organes « infections et infestations » y compris (fréquent) pneumonie, infection des voies urinaires ; (peu fréquent) bronchite, zona, sepsis, abcès et cas isolés d'infections opportunistes [par exemple : aspergillose, candidose, PPJ/PPC et hépatite B (voir également rubrique 4.4)] et (rare) myocardite virale b Inclut différents événements hémorragiques de différents sites non cités individuellement c Inclut (très fréquent) pneumopathie, (fréquent) pneumopathie interstitielle diffuse, infiltration pulmonaire et (rare) hémorragie alvéolaire pulmonaire, toxicité pulmonaire et alvéolite d Inclut (très fréquent) stomatite, (fréquent) stomatite aphteuse, ulcération buccale et de la langue et (peu fréquent) glossodynie, glossite e Fréquence fondée sur le nombre de femmes âgées de 10 à 55 ans dans les données regroupées f Effet indésirable identifié au cours de l’expérience post-commercialisation |
|
Description de certains effets indésirables
Dans les cas rapportés au cours des études cliniques et spontanément après la commercialisation, l’évérolimus a été associé à des cas graves de réactivation d’hépatite B, dont certains d’issue fatale. La réactivation d’infections est un effet attendu pendant les phases d’immunosuppression.
Dans les cas rapportés au cours des études cliniques et spontanément après la commercialisation, l’évérolimus a été associé à des événements d’insuffisance rénale (dont certains d’issue fatale) et de protéinurie. La surveillance de la fonction rénale est recommandée (voir rubrique 4.4).
Dans les cas rapportés au cours des études cliniques et spontanément après la commercialisation, l’évérolimus a été associé à des cas d’aménorrhée (aménorrhée secondaire et autres irrégularités menstruelles).
Dans les cas rapportés au cours des études cliniques et spontanément après la commercialisation, l’évérolimus a été associé à des cas de PPJ/PPC, dont certains d’issue fatale (voir rubrique 4.4).
Dans les cas rapportés au cours des études cliniques et spontanément après la commercialisation, des cas d’angiœdème ont été rapportés avec et sans utilisation concomitante d’inhibiteurs de l’ECA (voir rubrique 4.4).
Patients âgés
Lors du regroupement des données de sécurité, 37 % des patients traités par évérolimus avaient ≥ 65 ans. Le nombre de patients ayant présenté un effet indésirable entraînant l’arrêt du médicament était supérieur chez les patients ≥ 65 ans (20 % versus 13 %). Les effets indésirables les plus fréquents entraînant l’arrêt du médicament étaient la pneumopathie (y compris pneumopathie interstitielle diffuse), la stomatite, la fatigue et la dyspnée.
Angiomyolipome rénal/SEGA
Résumé du profil de sécurité
Trois études pivots de phase III, randomisées, en double aveugle et contrôlées contre placebo, incluant des périodes de traitement en double aveugle et en ouvert, et une étude de phase II non randomisée, en ouvert et à bras unique ont permis d'établir le profil de sécurité de l’évérolimus (n = 612, dont 409 patients âgés de moins de 18 ans ; durée médiane d’exposition de 36,8 mois [intervalle : 0,5 à 83,2]).
· EXIST-3 (CRAD001M2304) : il s’agissait d’un essai de phase III, randomisé, en double aveugle, contrôlé, comparant le traitement d'appoint d'une exposition faible ou élevée à l'évérolimus (concentration résiduelle basse [CRB] comprise entre 3 et 7 ng/mL [n = 117] et concentration résiduelle haute [CRH] comprise entre 9 et 15 ng/mL [n = 130]) versus placebo (n = 119), chez des patients présentant une STB et des crises épileptiques partielles pharmacorésistantes recevant 1 à 3 antiépileptiques. La durée médiane de la période en double aveugle était de 18 semaines. La durée médiane d’exposition cumulée à l'évérolimus (361 patients ayant pris au moins une dose d’évérolimus) était de 30,4 mois (intervalle : 0,5 à 48,8).
· EXIST-2 (CRAD001M2302) : il s'agissait d'un essai de phase III, randomisé, en double aveugle, contrôlé, de l'évérolimus (n = 79) versus placebo (n = 39) chez des patients présentant soit une STB plus angiomyolipome rénal (n = 113) soit une lymphangioléiomyomatose (LAM) sporadique plus angiomyolipome rénal (n = 5). La durée médiane du traitement à l’étude en aveugle était de 48,1 semaines (intervalle : 2 à 115) chez les patients ayant reçu l'évérolimus et de 45,0 semaines (intervalle : 9 à 115) chez ceux ayant reçu le placebo. La durée médiane d’exposition cumulée à l'évérolimus (112 patients ayant pris au moins une dose d’évérolimus) était de 46,9 mois (intervalle : 0,5 à 63,9).
· EXIST-1 (CRAD001M2301) : il s'agissait d'un essai de phase III, randomisé, en double aveugle, contrôlé, de l'évérolimus (n = 78) versus placebo (n = 39) chez des patients atteints d’une STB et présentant un SEGA, tous âges confondus. La durée médiane du traitement à l'étude en aveugle était de 52,2 semaines (intervalle : 24 à 89) chez les patients ayant reçu l'évérolimus et de 46,6 semaines (intervalle : 14 à 88) chez ceux ayant reçu le placebo. La durée médiane d’exposition cumulée à l'évérolimus (111 patients ayant pris au moins une dose d’évérolimus) était de 47,1 mois (intervalle : 1,9 à 58,3).
· CRAD001C2485 : il s’agissait d’une étude de phase II, prospective, en ouvert, à bras unique portant sur l’évérolimus chez des patients présentant un SEGA (n = 28). La durée médiane d’exposition était de 67,8 mois (intervalle : 4,7 à 83,2).
Les événements indésirables considérés comme associés à l’utilisation de l'évérolimus (effets indésirables), basés sur une revue ainsi qu’une évaluation médicale de tous les événements indésirables rapportés au cours des études susmentionnées, sont décrits ci-dessous.
Les effets indésirables les plus fréquents (incidence ≥ 1/10) issus des données de sécurité combinées sont (par ordre décroissant) : stomatite, fièvre, rhinopharyngite, diarrhée, infection des voies respiratoires supérieures, vomissements, toux, rash, céphalées, aménorrhée, acné, pneumonie, infection des voies urinaires, sinusite, irrégularités menstruelles, pharyngite, diminution de l’appétit, fatigue, hypercholestérolémie et hypertension.
Les effets indésirables de Grade 3-4 les plus fréquents (incidence ≥ 1 %) ont été la pneumonie, la stomatite, l’aménorrhée, la neutropénie, la fièvre, les irrégularités menstruelles, l’hypophosphatémie, la diarrhée et la cellulite. Les grades suivent la classification CTCAE versions 3.0 et 4.03.
Tableau listant les effets indésirables
Le tableau 5 présente l’incidence des effets indésirables sur la base des données combinées des patients recevant l’évérolimus dans les trois études portant sur la STB (y compris la phase en double aveugle et la phase d’extension en ouvert, le cas échéant). Les effets indésirables sont répertoriés selon la classe de systèmes d’organes MedDRA. Les catégories de fréquence sont définies selon la convention suivante : très fréquent (≥ 1/10) ; fréquent (≥ 1/100, < 1/10) ; peu fréquent (≥ 1/1 000, < 1/100) ; rare (≥ 1/10 000, < 1/1 000 ; très rare (< 1/10 000) ; fréquence indéterminée (ne peut être estimée sur la base des données disponibles). Au sein de chaque groupe de fréquence, les effets indésirables sont présentés par ordre décroissant de gravité.
Tableau 5 Effets indésirables rapportés dans les études de la STB
|
Infections et infestations |
|
|
Très fréquent |
Rhinopharyngite, infection des voies respiratoires supérieures, pneumoniea, infection des voies urinaires, sinusite, pharyngite |
|
Fréquent |
Otite moyenne, cellulite, pharyngite streptococcique, gastroentérite virale, gingivite |
|
Peu fréquent |
Zona, sepsis, bronchite virale |
|
Affections hématologiques et du système lymphatique |
|
|
Fréquent |
Anémie, neutropénie, leucopénie, thrombopénie, lymphopénie |
|
Affections du système immunitaire |
|
|
Fréquent |
Hypersensibilité |
|
Troubles du métabolisme et de la nutrition |
|
|
Très fréquent |
Diminution de l’appétit, hypercholestérolémie |
|
Fréquent |
Hypertriglycéridémie, hyperlipidémie, hypophosphatémie, hyperglycémie |
|
Affections psychiatriques |
|
|
Fréquent |
Insomnie, agressivité, irritabilité |
|
Affections du système nerveux |
|
|
Très fréquent |
Céphalées |
|
Peu fréquent |
Dysgueusie |
|
Affections vasculaires |
|
|
Très fréquent |
Hypertension |
|
Fréquent |
Lymphœdème |
|
Affections respiratoires, thoraciques et médiastinales |
|
|
Très fréquent |
Toux |
|
Fréquent |
Epistaxis, pneumopathie |
|
Affections gastro-intestinales |
|
|
Très fréquent |
Stomatiteb, diarrhée, vomissements |
|
Fréquent |
Constipation, nausées, douleur abdominale, flatulences, douleur buccale, gastrite |
|
Affections de la peau et du tissu sous-cutané |
|
|
Très fréquent |
Rashc, acné |
|
Fréquent |
Sécheresse cutanée, dermatite acnéiforme, prurit, alopécie |
|
Peu fréquent |
Angiœdème |
|
Affections musculo-squelettiques et systémiques |
|
|
Peu fréquent |
Rhabdomyolyse |
|
Affections du rein et des voies urinaires |
|
|
Fréquent |
Protéinurie |
|
Affections des organes de reproduction et du sein |
|
|
Très fréquent |
Aménorrhéed, irrégularités menstruellesd |
|
Fréquent |
Ménorragie, kyste ovarien, hémorragie vaginale |
|
Peu fréquent |
Menstruation retardéed |
|
Troubles généraux et anomalies au site d’administration |
|
|
Très fréquent |
Fièvre, fatigue |
|
Investigations |
|
|
Fréquent |
Lactate déshydrogénase sanguine augmentée, LH sanguine augmentée, perte de poids |
|
Peu fréquent |
Hormone folliculostimulante sanguine augmentée |
|
Lésion, intoxication et complications liées aux procédures |
|
|
Fréquence indéterminéee |
Phénomène de rappel, potentialisation des toxicités radio-induites |
|
a Inclut PPJ/PPC b Inclut (très fréquent) stomatite, ulcération buccale, ulcération aphteuse ; (fréquent), ulcération de la langue, ulcération des lèvres et (peu fréquent) douleur gingivale, glossite c Inclut (très fréquent) rash ; (fréquent) rash érythémateux, érythème et (peu fréquent) rash généralisé, rash maculopapuleux, rash maculeux d Fréquence fondée sur le nombre de femmes âgées de 10 à 55 ans pendant le traitement issu des données combinées e Effet indésirable identifié au cours de l’expérience post-commercialisation. |
|
Description d’effets indésirables sélectionnés
Dans les études cliniques, l’évérolimus a été associé à des cas graves de réactivation de l’hépatite B, notamment des cas d’issue fatale. La réactivation de l’infection est une réaction attendue pendant les périodes d’immunosuppression.
Dans les études cliniques et les notifications spontanées après commercialisation, l’évérolimus a été associé à des cas d’insuffisance rénale (y compris d’issue fatale), de protéinurie et d'augmentation de la créatininémie. Une surveillance de la fonction rénale est recommandée (voir rubrique 4.4).
Dans les études cliniques, l’évérolimus a été associé à des événements hémorragiques. En de rares occasions, des cas d’issue fatale ont été observés en oncologie (voir rubrique 4.4). Aucun cas grave d’hémorragie rénale n’a été rapporté dans le cadre d’une STB.
Dans les études cliniques et les notifications spontanées après commercialisation, l’évérolimus a été associé à des cas de PPJ/PPC, dont certains ont été d’issue fatale (voir rubrique 4.4).
Les autres effets indésirables pertinents observés dans les études cliniques en oncologie et les notifications spontanées après commercialisation ont été une insuffisance cardiaque, une embolie pulmonaire, une thrombose veineuse profonde, une altération de la cicatrisation des plaies et une hyperglycémie.
Dans les études cliniques et les notifications spontanées après commercialisation, des angiœdèmes ont été rapportés avec et sans utilisation concomitante d’inhibiteurs de l’ECA (voir rubrique 4.4).
Population pédiatrique
Dans l’étude pivot de phase II, 22 des 28 patients présentant un SEGA étaient âgés de moins de 18 ans et dans l’étude pivot de phase III, 101 des 117 patients présentant un SEGA étaient âgés de moins de 18 ans. Dans l’étude pivot de phase III chez des patients présentant une STB et des crises épileptiques pharmacorésistantes, 299 des 366 patients étudiés étaient âgés de moins de 18 ans.
Dans l’ensemble, le type, la fréquence et la sévérité des effets indésirables observés chez les enfants et les adolescents ont généralement été les mêmes que ceux observés chez les adultes, à l’exception des infections qui ont été rapportées avec une fréquence et une sévérité plus élevées chez les enfants de âgés de moins de 6 ans. Au total, 49 patients sur 137 (36 %) âgés de moins de 6 ans ont présenté des infections de Grade 3/4, contre 53 des 272 patients (19 %) âgés de 6 à < 18 ans et 27 des 203 patients (13 %) âgés de ≥ 18 ans. Deux cas d’issue fatale dus à une infection ont été rapportés chez 409 patients âgés de < 18 ans recevant de l’évérolimus.
Personnes âgées
Lors de la mutualisation des données de sécurité en oncologie, 37 % des patients traités par évérolimus étaient âgés de ≥ 65 ans. Le nombre de patients suivis en oncologie ayant présenté un effet indésirable ayant entraîné l’arrêt du traitement par évérolimus était plus élevé chez les patients âgés de ≥ 65 ans (20 % versus 13 %). Les effets indésirables les plus fréquents ayant entraîné l’arrêt du traitement étaient la pneumopathie (y compris la pneumopathie interstitielle), la fatigue, la dyspnée et la stomatite.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr.
Cancer du sein/tumeurs neuroendocrines/carcinome à cellules rénales
Les cas rapportés de surdosage chez l’être humain sont très limités. Des doses uniques allant jusqu’à 70 mg ont été administrées avec une tolérance aiguë acceptable. Des mesures générales de soutien doivent être mises en place dans tous les cas de surdosage.
Les cas rapportés de surdosage chez l’être humain sont très limités. Des doses uniques allant jusqu’à 70 mg ont été administrées avec une tolérance aiguë acceptable dans la population adulte.
Il est primordial de déterminer les concentrations sanguines d’évérolimus en cas de suspicion de surdosage. Des mesures générales de soutien doivent être mises en place dans tous les cas de surdosage. L’évérolimus n’est pas considéré comme dialysable à un quelconque degré (moins de 10 % ont été éliminés en 6 heures d’hémodialyse).
Population pédiatrique
Un nombre limité de patients pédiatriques ont été exposés à des doses supérieures à 10 mg/m2/jour. Aucun signe de toxicité aiguë n’a été rapporté dans ces cas.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : Agents antinéoplasiques, inhibiteurs de protéine kinase, code ATC : L01EG02.
Cancer du sein/tumeurs neuroendocrines/carcinome à cellules rénales
Mécanisme d’action
L’évérolimus est un inhibiteur sélectif de la cible de la rapamycine chez les mammifères mTOR (mammalian target of rapamycin). mTOR est une sérine-thréonine kinase importante dont l’activité est connue comme étant dérégulée dans de nombreux cas de cancers humains. L’évérolimus se lie à la protéine intracellulaire FKBP-12 formant un complexe qui inhibe l’activité du mTOR complex-1 (mTORC1). L’inhibition du mTORC1 dont la voie de signalisation interfère avec la traduction et la synthèse de protéines par réduction de l’activité de la protéine kinase ribosomale S6 (S6K1) et avec la protéine 4EBP-1 se liant au facteur d’élongation 4 (eucaryotic elongation factor) qui régule les protéines impliquées dans le cycle cellulaire, l’angiogenèse et la glycolyse. On pense que S6K1 phosphoryle le domaine fonctionnel d’activation 1 du récepteur aux œstrogènes, responsable d'une activation du récepteur indépendante du ligand.
L’évérolimus réduit les taux du facteur de croissance de l’endothélium vasculaire (VEGF) qui potentialise le processus d’angiogenèse tumoral. L’évérolimus est un inhibiteur puissant de la croissance et de la prolifération des cellules tumorales, des cellules endothéliales, des fibroblastes et des cellules musculaires lisses vasculaires et il a été montré qu’il réduisait la glycolyse des cellules tumorales in vitro et in vivo.
Efficacité et sécurité clinique
Cancer du sein avancé avec récepteurs hormonaux positifs
BOLERO-2 (étude CRAD001Y2301) est une étude de phase III, multicentrique, randomisée, en double aveugle de l’évérolimus + exémestane versus placebo + exémestane conduite chez des femmes ménopausées atteintes d'un cancer du sein avancé avec récepteurs aux œstrogènes positifs, HER2/neu négatif, présentant une récidive ou une progression de la maladie après un traitement antérieur par létrozole ou anastrozole. La randomisation a été stratifiée en fonction de la sensibilité documentée à l'hormonothérapie antérieure et en fonction de la présence de métastases viscérales. La sensibilité à l'hormonothérapie antérieure a été définie comme (1) un bénéfice clinique documenté (réponse complète [RC], réponse partielle [RP], stabilisation de la maladie ≥ 24 semaines) après au moins une hormonothérapie antérieure au stade avancé ou (2) au moins 24 mois d'hormonothérapie adjuvante avant la récidive.
Le critère d'évaluation principal de l'étude était la survie sans progression (SSP) évaluée selon les critères RECIST (Response Evaluation Criteria in Solid Tumors), sur la base de l'évaluation de l'investigateur (radiologie locale). Les analyses de confirmation de la SSP se sont basées sur une évaluation radiologique centralisée indépendante.
Les critères d'évaluation secondaires étaient la survie globale (SG), le taux de réponse objective, le taux de bénéfice clinique, la sécurité, la modification de la qualité de vie (QdV) et le délai de détérioration de l'indice de performance (PS, Performance Status) ECOG (Eastern Cooperative Oncology Group).
Au total, 724 patientes ont été randomisées selon un rapport de 2/1 pour recevoir l'association évérolimus (10 mg par jour) + exémestane (25 mg par jour) (n = 485) ou l'association placebo + exémestane (25 mg par jour) (n = 239). Au moment de l’analyse finale de la SG, la durée médiane du traitement par évérolimus était de 24,0 semaines (intervalle 1,0-199,1 semaines). La durée médiane du traitement par exémestane était plus longue dans le bras évérolimus + exémestane avec 29,5 semaines (1,0-199,1), contre 14,1 semaines (1,0-156,0) dans le bras placebo + exémestane.
Les résultats d'efficacité pour le critère d’évaluation principal ont été obtenus à partir de l'analyse finale de la SSP (voir tableau 6 et figure 1). Les patientes du groupe placebo + exémestane ne sont pas passées à l’évérolimus au moment de la progression de la maladie.
Tableau 6 Résultats d'efficacité de BOLERO-2
|
Analyse |
Evérolimusa n = 485 |
Placeboa n = 239 |
Rapport de risque |
Valeur de p |
|
|
Médiane de survie sans progression (mois) (IC à 95 %) |
|||||
|
Evaluation radiologique de l'investigateur |
7,8 (6,9 à 8,5) |
3,2 (2,8 à 4,1) |
0,45 (0,38 à 0,54) |
< 0,0001 |
|
|
Evaluation radiologique indépendante |
11,0 (9,7 à 15,0) |
4,1 (2,9 à 5,6) |
0,38 (0,31 à 0,48) |
< 0,0001 |
|
|
Survie globale médiane (mois) (IC à 95 %) |
|
||||
|
Survie globale médiane |
31,0 (28,0 – 34,6) |
26,6 (22,6 – 33,1) |
0,89 (0,73 – 1,10) |
0,1426 |
|
|
Meilleure réponse globale (%) (IC à 95 %) |
|
||||
|
Taux de réponse objectiveb |
12,6 % (9,8 à 15,9) |
1,7 % (0,5 à 4,2) |
n/ad |
< 0,0001e |
|
|
Taux de bénéfice cliniquec |
51,3 % (46,8 à 55,9) |
26,4 % (20,9 à 32,4) |
n/ad |
< 0,0001e |
|
|
a Plus exémestane b Taux de réponse objective = proportion de patientes avec une réponse complète ou partielle c Taux de bénéfice clinique = proportion de patientes avec une réponse complète ou partielle ou une stabilisation de la maladie ≥ 24 semaines d Sans objet e La valeur de p est obtenue à partir du test exact de Cochran-Mantel-Haenszel en utilisant une version stratifiée du test de permutation de Cochran-Armitage. |
|
||||
Figure 1 BOLERO-2 – Courbes de Kaplan-Meier de la survie sans progression (évaluation radiologique de l'investigateur)
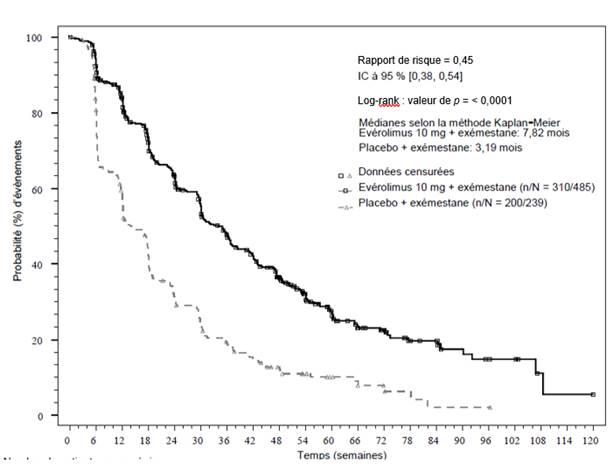
|
Nombre de patientes encore à risque |
||||||||||||||||||||||
|
Temps (semaines) |
0 |
6 |
12 |
18 |
24 |
30 |
36 |
42 |
48 |
54 |
60 |
66 |
72 |
78 |
84 |
90 |
96 |
102 |
108 |
114 |
120 |
|
|
Evérolimus |
485 |
436 |
366 |
304 |
257 |
221 |
185 |
158 |
124 |
91 |
66 |
50 |
35 |
24 |
22 |
13 |
10 |
8 |
2 |
1 |
0 |
|
|
Placebo |
239 |
190 |
132 |
96 |
67 |
50 |
39 |
30 |
21 |
15 |
10 |
8 |
5 |
3 |
1 |
1 |
1 |
0 |
0 |
0 |
0 |
|
L'effet estimé du traitement sur la SSP a été confirmé par une analyse en sous-groupes de la SSP, évaluée par l'investigateur. Pour tous les sous-groupes analysés (âge, sensibilité à un précédent traitement hormonal, nombre d’organes atteints, statut des lésions uniquement osseuses lors de l’inclusion et présence de métastases viscérales, et selon les sous-groupes pronostiques et démographiques majeurs), un bénéfice en faveur du traitement évérolimus + exémestane a été observé avec un rapport de risque (RR) estimé compris entre 0,25 et 0,60 versus placebo + exémestane.
Aucune différence en termes de délai de détérioration des scores des domaines fonctionnels globaux du QLQ-C30 ≥ 5 % n’a été observée entre les deux bras.
BOLERO-6 (étude CRAD001Y2201), une étude de phase II, en ouvert, triple-bras, randomisée, d’évérolimus en association avec de l’exémestane versus évérolimus en monothérapie versus capécitabine dans le traitement des femmes ménopausées atteintes d’un cancer du sein localement avancé, récidivant, ou métastatique après récidive ou progression sous létrozole ou anastrozole, avec récepteurs hormonaux positifs et HER2/neu négatif.
L’objectif principal de l’étude était d’estimer le RR de la SSP pour le traitement évérolimus + exémestane versus évérolimus en monothérapie. L’objectif secondaire clé était d’estimer le RR de la SSP pour le traitement évérolimus + exémestane versus capécitabine.
Les autres critères secondaires incluaient l’évaluation de la SG, le taux de réponse objective, le taux de bénéfice clinique, la sécurité, le délai de détérioration de l'indice de performance ECOG, le délai de détérioration de la QdV, et la satisfaction au traitement (Treatment Satisfaction Questionnaire for Medication, TSQM). Aucune comparaison statistique formelle n’a été prévue.
Au total, 309 patients ont été randomisés suivant un ratio de 1/1/1 pour l’association d’évérolimus (10 mg par jour) + exémestane (25 mg par jour) (n = 104), évérolimus en monothérapie (10 mg par jour) (n = 103), ou capécitabine (dose de 1 250 mg/m2 deux fois par jour pendant 2 semaines suivie d’une semaine de repos, par cycle de 3 semaines) (n = 102). Au moment du gel des données, la durée moyenne du traitement était de 27,5 semaines (intervalle 2,0– 165,7) dans le bras évérolimus + exémestane, 20 semaines (1,3– 145,0) dans le bras évérolimus, et 26,7 semaines (1,4– 177,1) dans le bras capécitabine.
Le résultat de l’analyse finale de la SSP avec 154 événements de SSP observés, basé sur une évaluation locale par les investigateurs, a montré un RR estimé de 0,74 (IC à 90 % : 0,57 ; 0,97) en faveur du bras évérolimus + exémestane par rapport au bras évérolimus. La SSP médiane était respectivement de 8,4 mois (IC à 90 % : 6,6 ; 9,7) et de 6,8 mois (IC à 90 % : 5,5 ; 7,2).
Figure 2 BOLERO-6 – Courbes de Kaplan-Meier de la survie sans progression (évaluation radiologique de l'investigateur)
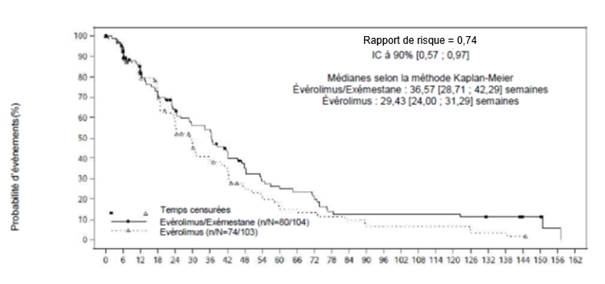
Nombre de patientes encore à risque Temps (semaines)
|
Temps (semaines) |
0 |
6 |
12 |
18 |
24 |
30 |
36 |
42 |
48 |
54 |
60 |
66 |
72 |
78 |
84 |
90 |
96 |
102 |
108 |
114 |
120 |
126 |
132 |
138 |
144 |
150 |
156 |
162 |
|
Evérolimus/Exémestane |
104 |
91 |
80 |
66 |
57 |
49 |
47 |
35 |
28 |
23 |
21 |
19 |
17 |
11 |
10 |
10 |
10 |
10 |
10 |
10 |
10 |
9 |
7 |
7 |
4 |
4 |
1 |
0 |
|
Evérolimus |
103 |
87 |
69 |
60 |
46 |
33 |
27 |
23 |
15 |
13 |
10 |
9 |
8 |
7 |
6 |
4 |
4 |
4 |
4 |
4 |
4 |
2 |
2 |
2 |
1 |
0 |
0 |
0 |
Concernant le critère d’évaluation secondaire clé relatif à la SSP, basé sur un nombre total de 148 événements de SSP observés, le RR estimé était de 1,26 (IC à 90 % : 0,96 ; 1,66) en faveur de la capécitabine par rapport au bras évérolimus + exémestane en association.
Les résultats du critère d’évaluation secondaire de SG n’étaient pas cohérents avec les résultats observés sur le critère d’évaluation principal de la SSP, avec une tendance observée en faveur du bras évérolimus en monothérapie. Le RR estimé était de 1,27 (IC à 90 % : 0,95 ; 1,70) concernant la comparaison de la SG dans le bras évérolimus en monothérapie par rapport au bras évérolimus+exémestane. Le RR estimé pour la comparaison de la SG dans le bras évérolimus + exémestane en association par rapport au bras capécitabine était de 1,33 (IC à 90 % : 0,99 ; 1,79).
Tumeurs neuroendocrines d’origine pancréatique (pNET) avancées
RADIANT-3 (étude CRAD001C2324), une étude de phase III, multicentrique, randomisée, en double aveugle de l’évérolimus + meilleur traitement de soutien (BSC, best supportive care) versus placebo + BSC chez des patients atteints de pNET avancées, a démontré un bénéfice clinique statistiquement significatif sous évérolimus versus placebo avec un allongement de 2,4 fois de la survie sans progression (SSP) médiane (11,04 mois versus 4,6 mois) (RR : 0,35 ; IC à 95 % : 0,27 ; 0,45 ; p < 0,0001) (voir tableau 7 et figure 3).
L'étude RADIANT-3 a été menée chez des patients atteints de pNET avancées bien et moyennement différenciées dont la maladie avait progressé au cours des 12 mois précédents. Le traitement par analogues de la somatostatine était autorisé dans le cadre du BSC.
Le critère d'évaluation principal de l'étude était la SSP évaluée au moyen des critères d’évaluation de la réponse dans les tumeurs solides (RECIST, Response Evaluation Criteria in Solid Tumors).
Après progression radiologique documentée, la levée de l'aveugle pour les patients concernés pouvait être faite par l'investigateur. Les patients randomisés dans le groupe placebo pouvaient alors recevoir de l’évérolimus en ouvert.
Les critères d'évaluation secondaires étaient la sécurité, le taux de réponse objective, la durée de la réponse et la survie globale (SG).
Au total, 410 patients ont été randomisés selon un rapport de 1/1 pour recevoir soit de l’évérolimus 10 mg/jour (n = 207) soit le placebo (n = 203). Les caractéristiques démographiques étaient bien équilibrées (âge médian : 58 ans, hommes : 55 %, caucasiens : 78,5 %). Cinquante-huit pour cent des patients des deux groupes avaient reçu un traitement systémique antérieur. La durée médiane du traitement en aveugle était de 37,8 semaines (intervalle : 1,1– 129,9 semaines) pour les patients ayant reçu l’évérolimus et de 16,1 semaines (intervalle : 0,4– 147,0 semaines) pour ceux ayant reçu le placebo.
Suite à une progression de la maladie ou après levée de l'aveugle, 172 des 203 patients (84,7 %) initialement randomisés dans le bras placebo sont passés à l’évérolimus en ouvert. La durée médiane de traitement en ouvert était de 47,7 semaines pour l’ensemble des patients : 67,1 semaines chez les 53 patients randomisés dans le bras évérolimus qui ont ensuite reçu de l’évérolimus en ouvert et 44,1 semaines chez les 172 patients randomisés dans le bras placebo qui ont ensuite reçu de l’évérolimus en ouvert.
Tableau 7 RADIANT-3 – Résultats en termes d’efficacité
|
Population |
Evérolimus n = 207 |
Placebo n = 203 |
Rapport de risque (IC à 95 %) |
Valeur de p |
|
Survie sans progression médiane (mois) (IC à 95 %) |
||||
|
Evaluation radiologique de l'investigateur |
11,04 (8,41 ; 13,86) |
4,60 (3,06 ; 5,39) |
0,35 (0,27 ; 0,45) |
< 0,0001 |
|
Evaluation radiologique Indépendante |
13,67 (11,17 ; 18,79) |
5,68 (5,39 ; 8,31) |
0,38 (0,28 ; 0,51) |
< 0,0001 |
|
Survie globale médiane (mois) (IC à 95 %) |
||||
|
Survie globale médiane |
44,02 (35,61 ; 51,75) |
37,68 (29,14 ; 45,77) |
0,94 (0,73 ; 1,20) |
0,300 |
Figure 3 RADIANT-3 – Courbes de Kaplan-Meier de la survie sans progression (évaluation radiologique de l’investigateur)
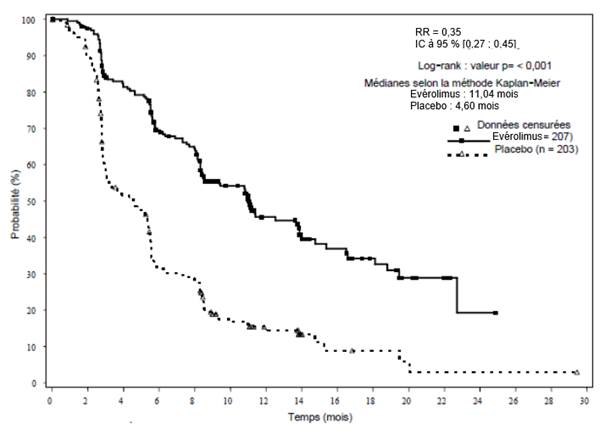
|
Nombre de patients encore à risque |
||||||||||||||||
|
Evérolimus |
207 |
189 |
153 |
126 |
114 |
80 |
49 |
36 |
28 |
21 |
10 |
6 |
2 |
0 |
0 |
0 |
|
Placebo |
203 |
117 |
98 |
59 |
52 |
24 |
16 |
7 |
4 |
3 |
2 |
1 |
1 |
1 |
1 |
0 |
Tumeurs neuroendocrines d’origine gastro-intestinale ou pulmonaire avancées
RADIANT-4 (étude CRAD001T2302), une étude de phase III, multicentrique, randomisée, en double aveugle évaluant l’évérolimus + meilleur traitement de soutien (BSC, best supportive care) versus placebo + BSC a été menée chez des patients atteints de tumeurs neuroendocrines d’origine gastro-intestinale ou pulmonaire avancées, bien différenciées (Grade 1 ou Grade 2), non fonctionnelles, sans syndrome carcinoïde antérieur ou en cours.
Le critère d’évaluation principal de l’étude était la survie sans progression (SSP) sur la base d’une évaluation radiologique indépendante selon les critères d’évaluation de la réponse dans les tumeurs solides (RECIST, Response Evaluation Criteria in Solid Tumors). Une analyse complémentaire de la SSP était basée sur l’évaluation locale par l’investigateur. Les critères d’évaluation secondaires comprenaient la survie globale (SG), le taux de réponse global, le taux de contrôle de la maladie, la sécurité, la modification de la qualité de vie (FACT-G) et le délai de détérioration de l’indice de performance de l’Organisation mondiale de la santé (IP OMS).
Au total, 302 patients ont été randomisés selon un rapport de 2/1 pour recevoir soit l’évérolimus (10 mg par jour) (n = 205) soit le placebo (n = 97). Les caractéristiques démographiques et les caractéristiques de la maladie étaient dans l’ensemble équilibrées (âge médian de 63 ans [intervalle 22 à 86], 76 % de caucasiens, utilisation antérieure d’analogues de la somatostatine [ASS]). La durée médiane du traitement en aveugle était de 40,4 semaines pour les patients recevant de l’évérolimus et de 19,6 semaines pour ceux recevant le placebo. Après l’analyse principale de la SSP, 6 patients du bras placebo ont bénéficié d’un cross over vers le groupe en ouvert évérolimus.
Les résultats d’efficacité pour le critère d’évaluation principal SSP (évaluation radiologique indépendante) ont été obtenus à partir de l’analyse finale de la SSP (voir tableau 8 et figure 4). Les résultats d’efficacité pour la SSP (évaluation radiologique par l’investigateur) ont été obtenus à partir de l’analyse finale de la SG (voir tableau 8).
Tableau 8 RADIANT-4 – Résultats en termes de survie sans progression
|
Population |
Evérolimus n = 205 |
Placebo n = 97 |
Rapport de risque (IC à 95 %) |
Valeur de pa |
|
Survie sans progression médiane (mois) (IC à 95 %) |
||||
|
Evaluation radiologique indépendante |
11,01 (9,2 ; 13,3) |
3,91 (3,6 ; 7,4) |
0,48 (0,35 ; 0,67) |
< 0,001 |
|
Evaluation radiologique de l’investigateur |
14,39 (11,24 ; 17,97) |
5,45 (3,71 ; 7,39) |
0,40 (0,29 ; 0,55) |
< 0,001 |
|
a Valeur de p d’après un test du log-rank stratifié unilatéral |
||||
Figure 4 RADIANT-4 – Courbes de Kaplan-Meier de la survie sans progression (revue radiologique indépendante)
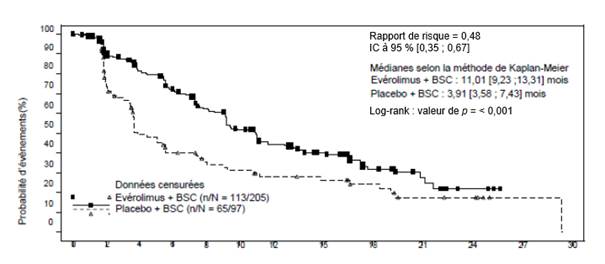
Nombre de patients encore à risque Temps (mois)
|
Temps (mois) |
0 |
2 |
4 |
6 |
8 |
10 |
12 |
15 |
18 |
21 |
24 |
27 |
30 |
|
Evérolimus |
205 |
168 |
145 |
124 |
101 |
81 |
65 |
52 |
26 |
10 |
3 |
0 |
0 |
|
Placebo |
97 |
65 |
39 |
30 |
24 |
21 |
17 |
15 |
11 |
6 |
5 |
1 |
0 |
Dans les analyses complémentaires, un effet positif du traitement a été observé dans tous les sous-groupes à l’exception du sous-groupe de patients chez lesquels le site tumoral primitif était l’iléon (iléon : RR = 1,22 [IC à 95 % : 0,56 à 2,65] ; hors iléon : RR = 0,34 [IC à 95 % : 0,22 à 0,54] ; poumon : RR = 0,43 [IC à 95 % : 0,24 à 0,79]) (voir figure 5).
Figure 5 RADIANT-4 – Résultats en termes de survie sans progression par sous-groupes de patients prédéfinis (évaluation radiologique indépendante)
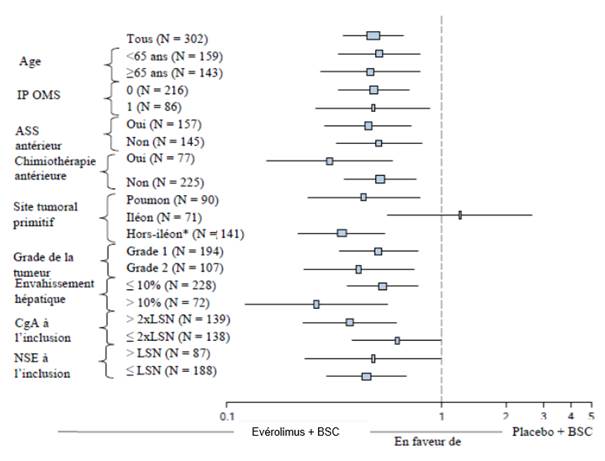 * Hors-iléon : estomac, colon, rectum, appendice, cæcum, duodénum, jéjunum, carcinome d’origine primitive inconnue et autres origines gastro-intestinales
* Hors-iléon : estomac, colon, rectum, appendice, cæcum, duodénum, jéjunum, carcinome d’origine primitive inconnue et autres origines gastro-intestinales
LSN : limite supérieure de la normale
CgA : chromogranine A
NSE : énolase neurono-spécifique
Rapport de risque (IC à 95 %) d’après le modèle de Cox stratifié
L’analyse finale de la survie globale (SG) n’a pas montré de différence statistiquement significative entre les patients ayant reçu l’évérolimus ou le placebo pendant la période de traitement en aveugle de l’étude (RR = 0,90 [IC à 95 % : 0,66 à 1,22]).
Aucune différence du délai de détérioration définitive de l’indice de performance de l’OMS (RR = 1,02 ; [IC à 95 % : 0,65 ; 1,61]) ni du délai de détérioration définitive de la qualité de vie (score FACT-G total RR = 0,74 ; [IC à 95 % : 0,50 ; 1,10]) n’a été observée entre les deux bras.
Carcinome à cellules rénales avancé
RECORD-1 (étude CRAD001C2240), une étude de phase III, multicentrique, internationale, randomisée, en double aveugle comparant l’évérolimus 10 mg/jour au placebo, administrés tous les deux en association avec le meilleur traitement de soutien a été menée chez des patients ayant un carcinome à cellules rénales métastatique dont la maladie avait progressé sous ou après un traitement par un VEGFR-TKI (inhibiteur de la tyrosine kinase du récepteur du facteur de croissance de l’endothélium vasculaire [sunitinib, sorafénib ou sunitinib + sorafénib]). Un traitement antérieur par le bévacizumab et l’interféron-α était également autorisé. Les patients ont été stratifiés en fonction du score pronostique du Memorial Sloan-Kettering Cancer Center (MSKCC) (groupes à risque faible versus intermédiaire versus élevé) et des traitements anticancéreux antérieurs (1 versus 2 VEGFR-TKI).
Le critère d’évaluation principal était la survie sans progression, documentée selon les critères d’évaluation de la réponse dans les tumeurs solides (RECIST, Response Evaluation Criteria in Solid Tumors) et évaluée en aveugle par un comité d’évaluation centralisé indépendant. Les critères d’évaluation secondaires étaient la sécurité, le taux de réponse tumorale objective, la survie globale, les symptômes liés à la maladie et la qualité de vie. Après documentation d’une progression radiologique, l’aveugle pouvait être levé par l’investigateur : les patients randomisés dans le groupe placebo ont pu alors recevoir l’évérolimus 10 mg/jour en ouvert. Le comité indépendant de surveillance a recommandé d’arrêter cet essai au moment de la deuxième analyse intermédiaire car le critère d’évaluation principal avait été atteint.
Au total, 416 patients ont été randomisés selon un rapport de 2/1 pour recevoir l’évérolimus (n = 277) ou le placebo (n = 139). Les caractéristiques démographiques étaient équilibrées (âge médian combiné [61 ans ; intervalle 27– 85], hommes : 78 %, caucasiens : 88 %, nombre de traitements antérieurs par un VEGFR-TKI [1– 74 %, 2– 26 %]). La durée médiane du traitement en aveugle était de 141 jours (intervalle : 19– 451 jours) pour les patients ayant reçu l’évérolimus et de 60 jours (intervalle : 21– 295 jours) pour ceux ayant reçu le placebo.
L’évérolimus s’est révélé supérieur au placebo sur le critère d’évaluation principal de survie sans progression, avec une réduction statistiquement significative de 67 % du risque de progression ou de décès (voir tableau 9 et figure 6).
Tableau 9 RECORD-1 – Résultats en termes de survie sans progression
|
Population |
n |
Evérolimus n = 277 |
Placebo n = 139 |
Rapport de risque (IC à 95 %) |
Valeur de p |
|
Survie sans progression médiane (mois) (IC à 95 %) |
|||||
|
Analyse principale |
|||||
|
Tous les patients (évaluation centrale indépendante en aveugle) |
416 |
4,9 (4,0– 5,5) |
1,9 (1,8– 1,9) |
0,33 (0,25– 0,43) |
< 0,0001a |
|
Analyses de confirmation/de sensibilité |
|||||
|
Tous les patients (évaluation locale par l’investigateur) |
416 |
5,5 (4,6– 5,8) |
1,9 (1,8– 2,2) |
0,32 (0,25– 0,41) |
< 0,0001a |
|
Score pronostique MSKCC (revue centralisée indépendante en aveugle) |
|||||
|
Risque faible |
120 |
5,8 (4,0– 7,4) |
1,9 (1,9– 2,8) |
0,31 (0,19– 0,50) |
< 0,0001 |
|
Risque intermédiaire |
235 |
4,5 (3,8– 5,5) |
1,8 (1,8– 1,9) |
0,32 (0,22– 0,44) |
< 0,0001 |
|
Risque élevé |
61 |
3,6 (1,9– 4,6) |
1,8 (1,8– 3,6) |
0,44 (0,22– 0,85) |
0,007 |
|
a Test du log-rank stratifié |
|||||
Figure 6 RECORD-1 – Courbes de Kaplan-Meier de la survie sans progression (revue centralisée indépendante)
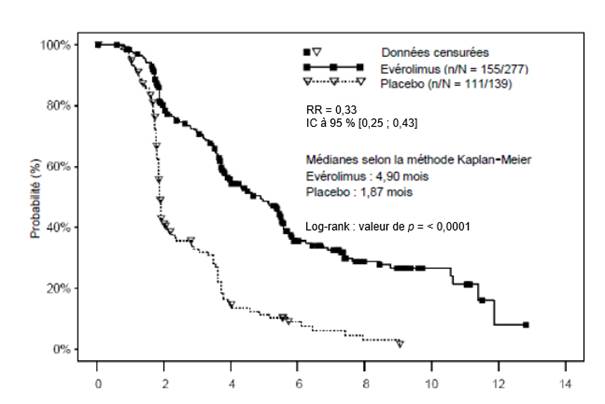
Nombre de patients encore à risque Temps (mois)
|
Temps (mois) |
0 |
2 |
4 |
6 |
8 |
10 |
12 |
14 |
|
Evérolimus |
277 |
192 |
115 |
51 |
26 |
10 |
1 |
0 |
|
Placebo |
139 |
47 |
15 |
6 |
2 |
0 |
0 |
0 |
Les taux de survie sans progression à 6 mois étaient de 36 % dans le groupe évérolimus contre 9 % dans le groupe placebo.
Des réponses tumorales objectives confirmées ont été observées chez 5 patients (2 %) traités par l’évérolimus et chez aucun patient recevant le placebo. Ainsi, le bénéfice en termes de survie sans progression concerne essentiellement la population présentant une stabilisation de la maladie (correspondant à 67 % du groupe de traitement par évérolimus).
Aucune différence statistiquement significative entre les traitements n’a été observée sur la survie globale (rapport de risque : 0,87 ; intervalle de confiance [0,65– 1,17] ; p = 0,177). Le passage vers le traitement par évérolimus en ouvert après progression de la maladie chez les patients qui avaient été assignés au groupe placebo a constitué un facteur de confusion pour la détection d’une différence entre les traitements en termes de survie globale.
Angiomyolipome rénal/SEGA
Mécanisme d’action
L’évérolimus est un inhibiteur sélectif de mTOR (mammalian target of rapamycin cible de la rapamycine chez les mammifères). mTOR est une sérine-thréonine kinase clé, dont l’activité est connue comme étant dérégulée dans de nombreux cas de cancers humains. L’évérolimus se lie à la protéine intracellulaire FKBP-12 formant un complexe qui inhibe l’activité du mTOR complex-1 (mTORC1). L’inhibition de la voie de signalisation mTORC1 interfère avec la traduction et la synthèse de protéines en réduisant l’activité de la protéine kinase ribosomale S6 (S6K1) et de la protéine 4EBP-1 se liant au facteur d’élongation 4 (eucaryotic elongation factor) qui régulent les protéines impliquées dans le cycle cellulaire, l’angiogenèse et la glycolyse. L’évérolimus peut réduire les taux du facteur de croissance de l’endothélium vasculaire (VEGF). Chez les patients présentant une STB, le traitement par évérolimus augmente les taux de VEGF-A et diminue les taux de VEGF-D. L’évérolimus est un puissant inhibiteur de la croissance et de la prolifération des cellules tumorales, des cellules endothéliales, des fibroblastes et des cellules musculaires lisses vasculaires et il a été démontré qu’il réduisait la glycolyse dans les tumeurs solides in vitro et in vivo.
Les gènes suppresseurs de tumeurs tuberin-sclerosis complexes 1 et 2 (TSC1, TSC2) sont les deux principaux régulateurs de la signalisation mTORC1. La perte de TSC1 ou de TSC2 entraîne des taux élevés de rheb-GTP, une GTPase de la superfamille Ras, qui interagit avec le complexe mTORC1 pour provoquer son activation. L’activation de mTORC1 induit une cascade de signalisation des kinases en aval, incluant l’activation des kinases S6. Dans la STB, les mutations d’inactivation sur le gène TSC1 ou TSC2 entraînent la formation d’hamartomes dans tout l’organisme.
Efficacité et sécurité clinique
Angiomyolipome rénal associé à une STB
EXIST-2 (étude CRAD001M2302), une étude de phase III, randomisée et contrôlée, a été menée afin d’évaluer l’efficacité et la sécurité de l’évérolimus chez des patients atteints d’une STB plus angiomyolipome rénal. La présence d'au moins un angiomyolipome de ≥ 3 cm de diamètre le plus long à la TDM/IRM (sur la base d'une évaluation radiologique locale) était nécessaire pour l'inclusion dans l'étude.
Le critère d'efficacité principal était le taux de réponse de l'angiomyolipome sur la base d'une analyse radiologique centralisée indépendante. L'analyse a été stratifiée en fonction de l'utilisation d’antiépileptiques inducteurs enzymatiques lors de la randomisation (oui/non).
Les principaux critères d’évaluation secondaires ont inclus le temps avant progression de l'angiomyolipome et le taux de réponse des lésions cutanées.
Au total, 118 patients ont été randomisés, 79 pour recevoir l’évérolimus 10 mg par jour et 39 pour recevoir le placebo. L'âge médian était de 31 ans (intervalle : 18 à 61 ans ; 46,6 % étaient âgés de < 30 ans au moment du recrutement), 33,9 % étaient de sexe masculin et 89,0 % étaient caucasiens. Parmi les patients recrutés, 83,1 % présentaient des angiomyolipomes ≥ 4 cm (28,8 % ≥ 8 cm), 78,0 % présentaient des angiomyolipomes bilatéraux et 39,0 % avaient bénéficié précédemment d'une embolisation rénale/néphrectomie ; 96,6 % des patients présentaient des lésions cutanées à l'inclusion et 44,1 % des SEGA cibles (au moins un SEGA ≥ 1 cm dans son diamètre le plus long).
Les résultats ont révélé que l’objectif principal lié à la meilleure réponse globale de l’angiomyolipome avait été atteint avec des taux de meilleure réponse globale de 41,8 % (IC à 95 % : 30,8 ; 53,4) dans le bras évérolimus contre 0 % (IC à 95 % : 0,0 ; 9,0) dans le bras placebo (p < 0,0001) (tableau 10).
Les patients ayant initialement reçu le placebo ont eu la possibilité de passer dans le bras évérolimus en cas de progression de l’angiomyolipome et dès que l’efficacité de l’évérolimus était démontrée supérieure au placebo. Lors de l’analyse finale (4 ans après la randomisation du dernier patient), la durée médiane d’exposition à l’évérolimus a été de 204,1 semaines (intervalle : 2 à 278). Le taux de meilleure réponse globale de l’angiomyolipome a atteint 58,0 % (IC à 95 % : 48,3 ; 67,3), avec un taux de stabilisation de la maladie de 30,4 % (tableau 10).
Parmi les patients traités par évérolimus au cours de l’étude, aucun cas de néphrectomie liée à un angiomyolipome n’a été rapporté et un seul cas d’embolisation rénale a été observé.
Tableau 10 EXIST-2 Réponse de l'angiomyolipome
|
|
Analyse principale3 |
Analyse finale4 |
||
|
|
Evérolimus n = 79 |
Placebo n = 39 |
Valeur de p |
Evérolimus n = 112 |
|
Analyse principale |
|
|
|
|
|
Taux de réponse de l'angiomyolipome1,2 - % |
41,8 |
0 |
< 0,0001 |
58,0 |
|
IC à 95 % |
30,8 ; 53,4 |
0,0 ; 9,0 |
|
48,3 ; 67,3 |
|
Meilleure réponse globale de l'angiomyolipome - % |
|
|
|
|
|
Réponse |
41,8 |
0 |
|
58,0 |
|
Stabilisation de la maladie |
40,5 |
79,5 |
|
30,4 |
|
Progression |
1,3 |
5,1 |
|
0,9 |
|
Non évaluable |
16,5 |
15,4 |
|
10,7 |
|
1 Selon l'analyse radiologique centralisée indépendante. 2 Les réponses de l'angiomyolipome ont été confirmées par une imagerie de contrôle. La réponse a été définie comme : réduction ≥ 50 % de la somme des volumes des angiomyolipomes par rapport à la somme initiale, plus absence d'un nouvel angiomyolipome de ≥ 1,0 cm de diamètre le plus long, plus absence d'augmentation du volume du rein > 20 % par rapport au nadir, plus absence de saignement lié à l'angiomyolipome de Grade ≥ 2. 3 Analyse principale pour la période en double aveugle. 4 L’analyse finale inclut les patients qui sont passés du bras placebo au bras évérolimus ; la durée médiane d’exposition à l’évérolimus a été de 204,1 semaines. |
||||
Des effets cohérents du traitement sur le taux de réponse de l’angiomyolipome ont été observés dans tous les sous-groupes évalués (c’est-à-dire utilisation d’antiépileptiques inducteurs enzymatiques versus non-utilisation d’antiépileptiques inducteurs enzymatiques, sexe, âge et origine ethnique) lors de l’analyse principale de l’efficacité.
Dans l’analyse finale, la diminution du volume de l’angiomyolipome a été améliorée par un traitement à plus long terme par évérolimus. Aux Semaines 12, 96 et 192, des diminutions de volume ≥ 30 % ont été observées chez 75,0 %, 80,6 % et 85,2 % des patients traités, respectivement. De même, aux mêmes temps d’évaluation, des diminutions de volume ≥ 50 % ont été observées chez 44,2 %, 63,3 % et 68,9 % des patients traités, respectivement.
Le temps médian avant progression de l'angiomyolipome a été de 11,4 mois dans le bras placebo et n'a pas été atteint dans le bras évérolimus (RR 0,08 ; IC à 95 % : 0,02 ; 0,37 ; p < 0,0001). Des progressions ont été observées chez 3,8 % des patients dans le bras évérolimus contre 20,5 % dans le bras placebo. Les taux d’absence de progression estimés à 6 mois ont été de 98,4 % pour le bras évérolimus et de 83,4 % pour le bras placebo. Lors de l’analyse finale, le temps médian avant progression de l’angiomyolipome n’a pas été atteint. Des progressions d’angiomyolipome ont été observées chez 14,3 % des patients. Les taux d’absence de progression de l’angiomyolipome estimés à 24 mois et 48 mois étaient de 91,6 % et 83,1 %, respectivement.
Lors de l’analyse principale, des taux de réponse des lésions cutanées de 26,0 % (IC à 95 % : 16,6 ; 37,2) pour le bras évérolimus et de 0 % (IC à 95 % : 0,0 ; 9,5) pour le bras placebo ont été observés (p = 0,0002). Lors de l’analyse finale, le taux de réponse des lésions cutanées avait augmenté jusqu’à 68,2 % (IC à 95 % : 58,5 ; 76,9), un patient ayant rapporté une réponse clinique complète confirmée des lésions cutanées et aucun patient n’ayant présenté de progression de la maladie comme meilleure réponse.
Dans une analyse exploratoire des patients atteints d’une STB avec angiomyolipome et présentant également un SEGA, le taux de réponse des SEGA (proportion de patients présentant une diminution des volumes des lésions cibles ≥ 50 % par rapport au volume initial en l’absence de progression) a été de 10,3 % dans le bras évérolimus lors de l’analyse principale (contre aucune réponse rapportée chez les 13 patients randomisés dans le bras placebo ayant présenté une lésion SEGA à l’inclusion) et a atteint 48,0 % dans l’analyse finale.
Une analyse de sous-groupes post-hoc de l’étude EXIST-2 (étude CRAD001M2302) effectuée lors de l’analyse principale a démontré que le taux de réponse de l’angiomyolipome était réduit en dessous du seuil de 5 ng/mL (tableau 11).
Tableau 11 EXIST-2 - Taux de réponse de l’angiomyolipome selon la Cmin/temps moyen, à l’analyse principale
|
Cmin/temps moyen |
Nombre de patients |
Taux de réponse |
Intervalle de confiance à 95 % |
|
≤ 5 ng/mL |
20 |
0,300 |
0,099 ; 0,501 |
|
> 5 ng/mL |
42 |
0,524 |
0,373 ; 0,675 |
|
Différence1 |
|
-0,224 |
-0,475 ; 0,027 |
|
1 La différence est « ≤ 5 ng/mL » moins « >5 ng/mL » |
|||
SEGA associé à une STB
Etude de phase III chez des patients présentant un SEGA
EXIST-1 (étude CRAD001M2301), une étude de phase III, multicentrique, randomisée, en double aveugle, portant sur l’évérolimus versus placebo, a été menée chez des patients présentant un SEGA, tous âges confondus. Les patients ont été randomisés selon un rapport de 2/1 pour recevoir soit l’évérolimus, soit un placebo correspondant. La présence d'au moins une lésion SEGA de ≥ 1,0 cm de diamètre le plus long à l’IRM (sur la base d'une évaluation radiologique locale) était nécessaire pour l'inclusion dans l'étude. De plus, une confirmation radiologique de la progression des SEGA, la présence d’une nouvelle lésion SEGA ≥ 1 cm dans son diamètre le plus long ou l’apparition ou l’aggravation d’une hydrocéphalie étaient requises pour l’inclusion dans l’étude.
Le critère d'efficacité principal était le taux de réponse des SEGA sur la base d'une analyse radiologique centralisée indépendante. L'analyse a été stratifiée en fonction de l'utilisation d’antiépileptiques inducteurs enzymatiques lors de la randomisation (oui/non).
Les principaux critères d’évaluation secondaires, par ordre hiérarchique d’évaluation, ont inclus la variation absolue de la fréquence totale des événements convulsifs à l’EEG sur 24 heures entre l’inclusion et la Semaine 24, le temps avant progression des SEGA et le taux de réponse des lésions cutanées.
Au total, 117 patients ont été randomisés, 78 pour recevoir l’évérolimus et 39 pour recevoir le placebo. Les deux bras de traitement étaient globalement bien équilibrés en ce qui concerne les caractéristiques démographiques et pathologiques initiales ainsi que les traitements anti-SEGA antérieurs. Dans la population totale, 57,3 % des patients étaient de sexe masculin et 93,2 % étaient caucasiens. L'âge médian de la population totale était de 9,5 ans (intervalle d’âge pour le bras évérolimus : 1,0 à 23,9 ; intervalle d’âge pour le bras placebo : 0,8 à 26,6), 69,2 % des patients étaient âgés de 3 à < 18 ans et 17,1 % étaient âgés de < 3 ans au moment du recrutement.
Parmi les patients recrutés, 79,5 % présentaient des SEGA bilatéraux, 42,7 % présentaient au moins 2 lésions SEGA cibles, 25,6 % présentaient un retard de croissance, 9,4 % présentaient des signes d’atteinte parenchymateuse profonde, 6,8 % présentaient des signes radiologiques d’hydrocéphalie et 6,8 % avaient bénéficié précédemment d'une résection chirurgicale de SEGA. 94,0 % des patients présentaient des lésions cutanées à l'inclusion et 37,6 % des lésions cibles d’angiomyolipomes rénaux (au moins un angiomyolipome ≥ 1 cm dans son diamètre le plus long).
La durée médiane du traitement de l’étude en aveugle était de 9,6 mois (intervalle : 5,5 à 18,1) pour les patients recevant l’évérolimus et de 8,3 mois (intervalle : 3,2 à 18,3) pour ceux recevant le placebo.
Les résultats ont révélé que l’évérolimus était supérieur au placebo pour le critère principal de meilleure réponse globale des SEGA (p < 0,0001). Les taux de réponse ont été de 34,6 % (IC à 95 % : 24,2 ; 46,2) dans le bras évérolimus contre 0 % (IC à 95 % : 0,0 ; 9,0) dans le bras placebo (tableau 12). De plus, les 8 patients du bras évérolimus qui présentaient des signes radiologiques d’hydrocéphalie à l’inclusion ont présenté une diminution du volume des ventricules.
Une fois la supériorité du traitement par évérolimus par rapport au placebo démontrée, les patients recevant initialement le placebo ont eu la possibilité de passer dans le bras évérolimus en cas de progression des SEGA. Tous les patients ayant reçu au moins une dose d’évérolimus ont été suivis jusqu’à l’arrêt du médicament ou la fin de l’étude. Au moment de l’analyse finale, la durée médiane d’exposition parmi tous ces patients était de 204,9 semaines (intervalle : 8,1 à 253,7). Lors de l’analyse finale, le taux de meilleure réponse globale des SEGA a augmenté jusqu’à 57,7 % (IC à 95 % : 47,9 ; 67,0).
Aucune intervention chirurgicale pour les SEGA n’a été nécessaire au cours de l’étude.
Tableau 12 EXIST-1 Réponse des SEGA
|
|
Analyse principale3 |
Analyse finale4 |
||
|
|
Evérolimus |
Placebo |
Valeur de p |
Evérolimus |
|
|
N = 78 |
N = 39 |
|
N = 111 |
|
Taux de réponse des SEGA1,2 (%) |
34,6 |
0 |
< 0,0001 |
57,7 |
|
IC à 95 % |
24,2 ; 46,2 |
0,0 ; 9,0 |
|
47,9 ; 67,0 |
|
Meilleure réponse globale des SEGA (%) |
|
|
|
|
|
Réponse |
34,6 |
0 |
|
57,7 |
|
Stabilisation de la maladie |
62,8 |
92,3 |
|
39,6 |
|
Progression |
0 |
7,7 |
|
0 |
|
Non évaluable |
2,6 |
0 |
|
2,7 |
1 Selon l’analyse radiologique centralisée indépendante.
2 Les réponses des SEGA ont été confirmées par une imagerie de contrôle. La réponse a été définie comme : réduction ≥ 50 % de la somme des volumes des SEGA par rapport à la somme initiale, plus absence d’aggravation irréfutable de lésions SEGA non cibles, plus absence d’un nouveau SEGA ≥ 1 cm dans son diamètre le plus long, plus aucune apparition ou aggravation d’une hydrocéphalie.
3 Analyse principale pour la période en double aveugle.
4 L’analyse finale inclut les patients du bras placebo qui sont passés dans l’autre bras ; durée médiane de l’exposition à l’évérolimus de 204,9 semaines.
Des effets cohérents du traitement ont été observés dans tous les sous-groupes évalués (c’est-à-dire utilisation d’antiépileptiques inducteurs enzymatiques versus non-utilisation d’antiépileptiques inducteurs enzymatiques, sexe et âge) lors de l’analyse principale.
Pendant la période en double aveugle, la diminution du volume du SEGA a été nette au cours des 12 premières semaines de traitement par évérolimus : diminution du volume ≥ 50 % chez 29,7 % (22/74) des patients et ≥ 30 % chez 73,0 % (54/74) des patients. Des diminutions de volume se sont maintenues à la Semaine 24, 41,9 % (31/74) des patients ont présenté des diminutions ≥ 50 % et 78,4 % (58/74) des patients ont présenté des diminutions du volume du SEGA ≥ 30 %.
Dans la population de l’étude traitée par évérolimus (N = 111), incluant les patients issus du bras placebo, la réponse tumorale apparue dès 12 semaines de traitement par évérolimus s’est maintenue aux temps d’évaluation ultérieurs. La proportion de patients ayant obtenu une diminution du volume du SEGA d’au moins 50 % était de 45,9 % (45/98) et 62,1 % (41/66) aux Semaines 96 et 192 après le début du traitement par évérolimus. De même, la proportion des patients ayant obtenu une diminution du volume du SEGA d’au moins 30 % était de 71,4 % (70/98) et de 77,3 % (51/66) aux Semaines 96 et 192 après le début du traitement par évérolimus.
L’analyse du premier critère d’évaluation secondaire principal, la modification de la fréquence des crises convulsives, n’a pas permis de tirer de conclusion ; par conséquent, malgré le fait que des résultats positifs aient été observés pour les deux critères d’évaluation secondaires suivants (temps avant progression des SEGA et taux de réponse des lésions cutanées), ces résultats n’ont pas pu être formellement déclarés comme étant statistiquement significatifs.
Le temps médian avant progression des SEGA, sur la base d’une analyse radiologique centralisée, n'a été atteint dans aucun des bras de traitement. Des progressions ont été observées uniquement dans le bras placebo (15,4 % ; p = 0,0002). Les taux sans progression estimés à 6 mois ont été de 100,0 % pour le bras évérolimus et de 85,7 % pour le bras placebo. Le suivi à long terme des patients randomisés dans le bras évérolimus et des patients randomisés dans le bras placebo passés ensuite dans le bras évérolimus a révélé des réponses durables.
Au moment de l’analyse principale, l’évérolimus a démontré des améliorations cliniquement pertinentes de la réponse des lésions cutanées (p = 0,0004), avec des taux de réponse de 41,7 % (IC à 95 % : 30,2 ; 53,9) pour le bras évérolimus et de 10,5 % (IC à 95 % : 2,9 ; 24,8) pour le bras placebo. Lors de l’analyse finale, le taux de réponse des lésions cutanées a augmenté jusqu’à 58,1 % (IC à 95 % : 48,1 ; 67,7).
Etude de phase II chez des patients présentant un SEGA
Une étude de phase II prospective, en ouvert, à bras unique (étude CRAD001C2485) a été menée pour évaluer la sécurité et l’efficacité de l’évérolimus chez les patients présentant un SEGA. Une confirmation radiologique de la progression du SEGA était requise pour l’inclusion dans l’étude.
Le critère d’efficacité principal était la variation du volume du SEGA pendant la phase de traitement principale de 6 mois, telle qu’évaluée par une analyse radiologique centralisée indépendante. Après la phase de traitement principale, les patients pouvaient être recrutés dans une phase d’extension au cours de laquelle le volume du SEGA était évalué tous les 6 mois.
Au total, 28 patients ont reçu un traitement par évérolimus ; l’âge médian était de 11 ans (intervalle : 3 à 34 ans), 61 % des patients étaient de sexe masculin et 86 % étaient caucasiens. Treize patients (46 %) présentaient un SEGA secondaire plus petit, dont 12 dans le ventricule controlatéral.
Le volume du SEGA primaire était réduit au Mois 6 par rapport à l’inclusion (p < 0,001 [voir tableau 13]). Aucun patient n’a développé de nouvelles lésions, d’aggravation de l’hydrocéphalie ou d’augmentation de la pression intracrânienne, et aucun patient n’a nécessité une résection chirurgicale ou un autre traitement du SEGA.
Tableau 13 Modification du volume du SEGA primaire dans le temps
|
Volume du SEGA (cm3) |
Analyse centralisée indépendante |
|
|
|
|
||
|
|
Inclusion n = 28 |
Mois 6 n = 27 |
Mois 12 n = 26 |
Mois 24 n = 24 |
Mois 36 n = 23 |
Mois 48 n = 24 |
Mois 60 n = 23 |
|
Volume de la tumeur primaire |
|||||||
|
Moyenne (écart type) |
2,45 (2,813) |
1,33 (1,497) |
1,26 (1,526) |
1,19 (1,042) |
1,26 (1,298) |
1,16 (0,961) |
1,24 (0,959) |
|
Médiane |
1,74 |
0,93 |
0,84 |
0,94 |
1,12 |
1,02 |
1,17 |
|
Intervalle |
0,49 – 14, 23 |
0,31 – 7,9 8 |
0,29 – 8,1 8 |
0,20 – 4,6 3 |
0,22 – 6,5 2 |
0,18 – 4,1 9 |
0,21 – 4,3 9 |
|
Diminution par rapport à l’inclusion |
|||||||
|
Moyenne (écart type) |
|
1,19 (1,433) |
1,07 (1,276) |
1,25 (1,994) |
1,41 (1,814) |
1,43 (2,267) |
1,44 (2,230) |
|
Médiane |
|
0,83 |
0,85 |
0,71 |
0,71 |
0,83 |
0,50 |
|
Intervalle |
|
0,06 – 6,2 5 |
0,02 – 6,0 5 |
-0,55 – 9,6 0 |
0,15 – 7,7 1 |
0,00 – 10 96 |
-0,74 – 9,8 4 |
|
Réduction en pourcentage par rapport à l’inclusion, n (%) |
|||||||
|
≥ 50 % |
|
9 (33,3) |
9 (34,6) |
12 (50,0) |
10 (43,5) |
14 (58,3) |
12 (52,2) |
|
≥ 30 % |
|
21 (77,8) |
20 (76,9) |
19 (79,2) |
18 (78,3) |
19 (79,2) |
14 (60,9) |
|
> 0 % |
|
27 (100,0) |
26 (100,0) |
23 (95,8) |
23 (100,0) |
23 (95,8) |
21 (91,3) |
|
Pas de modification |
|
0 |
0 |
0 |
0 |
1 (4,2) |
0 |
|
Augmentation |
|
0 |
0 |
1 (4,2) |
0 |
0 |
2 (8,7) |
La robustesse et la cohérence de l’analyse principale ont été corroborées par :
· la variation du volume du SEGA primaire selon l’évaluation de l’investigateur local (p < 0,001), 75,0 % et 39,3 % des patients présentant des diminutions ≥ 30 % et ≥ 50 %, respectivement ;
· la variation du volume total du SEGA selon une analyse centralisée indépendante (p < 0,001) ou l’évaluation de l’investigateur local (p < 0,001).
Un patient a rempli les critères prédéfinis de succès du traitement (diminution > 75 % du volume du SEGA) et le traitement à l’étude a été temporairement arrêté. Toutefois, une nouvelle croissance du SEGA a été observée lors de l’évaluation suivante à 4,5 mois et le traitement a été réinstauré.
Le suivi à long terme jusqu’à une durée médiane de 67,8 mois (intervalle : 4,7 à 83,2) a démontré une efficacité prolongée.
Autres études
La stomatite est l’effet indésirable le plus fréquemment rapporté chez les patients traités par évérolimus (voir rubriques 4.4 et 4.8). Dans une étude post-autorisation à bras unique chez les femmes ménopausées atteintes d’un cancer du sein avancé (N = 92), un traitement local avec une solution buvable de dexaméthasone 0,5 mg/5 mL sans alcool a été administré en bain de bouche (4 fois par jour pendant les 8 premières semaines de traitement) à partir de l’instauration du traitement par évérolimus (10 mg/jour) plus exémestane (25 mg/jour) pour réduire l’incidence et la sévérité des stomatites. L’incidence des stomatites de Grade ≥ 2 après 8 semaines de traitement était de 2,4 % (n = 2/85 patients évaluables), ce qui était inférieur à l’incidence historiquement rapportée. L’incidence des stomatites de Grade 1 était de 18,8 % (n = 16/85) et aucun cas de stomatite de Grade 3 ou 4 n’a été rapporté. Le profil de sécurité global était cohérent avec celui qui avait été établi pour l’évérolimus en oncologie et dans la sclérose tubéreuse de Bourneville (STB), à l’exception d’une légère augmentation de la fréquence des candidoses buccales rapportées chez 2,2 % (n = 2/92) des patients.
Cancer du sein/tumeurs neuroendocrines/carcinome à cellules rénales
Population pédiatrique
L’Agence européenne des médicaments a accordé une dérogation à l’obligation de soumettre les résultats d’études réalisées avec le médicament de référence dans tous les sous-groupes de la population pédiatrique atteints de tumeurs neuroendocrines d’origine pancréatique, de tumeurs neuroendocrines d’origine thoracique et de cancers du rein (voir rubrique 4.2 pour les informations concernant l’usage pédiatrique).
Angiomyolipome rénal/SEGA
Population pédiatrique
L’Agence européenne des médicaments a accordé une dérogation à l'obligation de soumettre les résultats d'études réalisées avec le médicament de référence dans tous les sous-groupes de la population pédiatrique atteints d’angiomyolipome (voir rubrique 4.2 pour les informations concernant l’usage pédiatrique).
5.2. Propriétés pharmacocinétiques
Chez les patients ayant des tumeurs solides avancées, les concentrations maximales (Cmax) d’évérolimus sont atteintes à une durée médiane de 1 heure après l’administration quotidienne d’une dose orale de 5 à 10 mg à jeun ou avec un repas léger sans matières grasses. La Cmax est proportionnelle à la dose entre 5 mg et 10 mg. L’évérolimus est un substrat et un inhibiteur modéré de la PgP.
Effet des aliments
Cancer du sein/tumeurs neuroendocrines/carcinome à cellules rénales
Chez des volontaires sains, l’exposition systémique à l’évérolimus 10 mg (mesurée par l’ASC) est diminuée de 22 % et le pic plasmatique de la Cmax est diminué de 54 % lorsque le médicament est pris avec un repas riche en graisses. Avec un repas léger, faible en matières grasses, l’ASC est diminuée de 32 % et la Cmax est diminuée de 42 %. Les aliments n’ont toutefois pas eu d’effet apparent sur la concentration en fonction du temps au cours de la phase post-absorption.
Angiomyolipome rénal/SEGA
Chez des volontaires sains, l’exposition systémique à l’évérolimus 10 mg en comprimés (mesurée par l’ASC) est diminuée de 22 % et le pic sanguin de la Cmax est diminué de 54 % lorsque le médicament est pris avec un repas riche en graisses. Avec un repas léger, faible en matières grasses, l’ASC est diminuée de 32 % et la Cmax est diminuée de 42 %.
Chez des volontaires sains traités par une dose unique de 9 mg (3 × 3 mg) d’évérolimus en comprimés dispersibles en suspension, un repas riche en graisses diminue l’ASC de 11,7 % et le pic sanguin de la Cmax de 59,8 %. Un repas léger, faible en matières grasses, diminue l’ASC de 29,5 % et la Cmax de 50,2 %.
Les aliments n’ont toutefois pas eu d’effet apparent sur la concentration en fonction du temps au cours de la phase post-absorption 24 heures après l’administration de l’une ou l’autre des formes pharmaceutiques.
Distribution
Le rapport sang-plasma de l’évérolimus, qui est dépendant de la concentration sur l’intervalle de 5 à 5 000 ng/mL, est de 17 % à 73 %. Environ 20 % de la concentration de l’évérolimus dans le sang total est retrouvée dans le compartiment plasmatique chez les patients cancéreux recevant de l’évérolimus 10 mg par jour. La liaison aux protéines plasmatiques est d’environ 74 % chez les sujets sains et chez les patients présentant une insuffisance hépatique modérée. Chez les patients ayant des tumeurs solides à un stade avancé, le volume de distribution Vd était de 191 L dans le compartiment central apparent et de 517 L dans le compartiment périphérique apparent.
Angiomyolipome rénal/SEGA
Des études non cliniques chez le rat indiquent ce qui suit :
· Assimilation rapide de l’évérolimus dans le cerveau suivie d’un efflux lent.
· Les métabolites radioactifs de l’évérolimus [3H] ne traversent pas de manière significative la barrière hémato-encéphalique.
· Pénétration cérébrale de l’évérolimus dépendante de la dose, ce qui est cohérent avec l’hypothèse de saturation des pompes à efflux présentes dans les cellules endothéliales des capillaires cérébraux.
· La co-administration de la ciclosporine, un inhibiteur de la P-gp, renforce l’exposition à l’évérolimus dans le cortex cérébral, ce qui est cohérent avec l’inhibition de la P-gp au niveau de la barrière hémato-encéphalique.
Il n’existe pas de données cliniques sur la distribution de l’évérolimus dans le cerveau humain. Des données non cliniques chez le rat ont démontré une distribution dans le cerveau suite à l’administration par voies intraveineuse et orale.
Biotransformation
L’évérolimus est un substrat du CYP3A4 et de la PgP. Après administration orale, l’évérolimus est le composé principal circulant dans le sang chez l’être humain. Six métabolites principaux de l’évérolimus ont été identifiés dans le sang chez l’être humain, incluant trois métabolites monohydroxylés, deux produits à cycle ouvert formés par hydrolyse et un conjugué phosphatidylcholine de l’évérolimus. Ces métabolites ont également été identifiés chez les espèces animales utilisées dans les études de toxicité et ils ont présenté une activité 100 fois plus faible environ que celle de l’évérolimus lui-même. Par conséquent, l’évérolimus est considéré comme responsable de la majorité de l’activité pharmacologique globale.
Elimination
La valeur moyenne de la clairance orale (CL/F) de l’évérolimus chez des patients ayant des tumeurs solides de stade avancé recevant 10 mg par jour était de 24,5 L/h. La valeur moyenne de la demi-vie d’élimination était approximativement de 30 heures.
Il n’a pas été mené d’études d’excrétions spécifiques chez les patients cancéreux, mais des données issues d’études menées chez des patients transplantés sont disponibles. Après administration d’une dose unique d’évérolimus radiomarqué en association avec la ciclosporine, 80 % de la radioactivité ont été retrouvés dans les fèces et 5 % ont été excrétés dans les urines. La molécule mère n’a pas été détectée dans les urines ou dans les fèces.
Pharmacocinétique à l’état d’équilibre
Après l’administration d’évérolimus chez des patients ayant des tumeurs solides de stade avancé, l’ASC0-τ a été dose-proportionnelle dans l’intervalle posologique de 5 mg à 10 mg par jour. L’état d’équilibre a été atteint en deux semaines. La Cmax est proportionnelle à la dose entre 5 mg et 10 mg. Le tmax est atteint 1 à 2 heures après l’administration. Il a été observé une corrélation significative entre l’ASC0-τ et la concentration résiduelle avant administration à l’état d’équilibre.
Populations particulières
Insuffisance hépatique
La sécurité, la tolérance et la pharmacocinétique de l’évérolimus ont été évaluées dans deux études avec administration d’évérolimus en comprimé à dose unique par voie orale chez 8 et 34 sujets adultes présentant une altération de la fonction hépatique par rapport à des sujets présentant une fonction hépatique normale.
Dans la première étude, l’ASC moyenne de l’évérolimus chez 8 sujets présentant une insuffisance hépatique modérée (classe B de Child-Pugh) était deux fois plus importante que celle retrouvée chez les 8 sujets présentant une fonction hépatique normale.
Dans la seconde étude réalisée chez 34 sujets présentant différents degrés d’altération de la fonction hépatique, une augmentation de l’exposition (c.-à-d., ASC0-inf) de 1,6 fois, 3,3 fois et 3,6 fois a été observée chez les sujets présentant une insuffisance hépatique respectivement légère (classe A de Child-Pugh), modérée (classe B de Child-Pugh) et sévère (classe C de Child-Pugh) par rapport aux sujets normaux.
Les simulations de pharmacocinétique en administration répétée viennent à l’appui des recommandations posologiques chez les sujets présentant une insuffisance hépatique déterminée selon leur statut Child-Pugh.
A partir des résultats de ces deux études, une adaptation de la posologie est recommandée chez les patients présentant une insuffisance hépatique (voir rubriques 4.2 et 4.4).
Insuffisance rénale
Dans une analyse de pharmacocinétique de population chez 170 patients ayant des tumeurs solides de stade avancé, aucun effet significatif de la clairance de la créatinine (25-178 mL/min) n’a été observé sur la CL/F de l’évérolimus.
Une insuffisance rénale post-transplantation (clairance de la créatinine comprise entre 11 mL/min et 107 mL/min) n’a pas eu d’effet sur la pharmacocinétique de l’évérolimus chez des patients transplantés.
Angiomyolipome rénal/SEGA
Population pédiatrique
Chez les patients présentant un SEGA, la Cmin de l’évérolimus a été approximativement proportionnelle à la dose dans l’intervalle de dose allant de 1,35 mg/m2 à 14,4 mg/m2.
Chez les patients présentant un SEGA, la moyenne géométrique des valeurs de la Cmin normalisées en fonction de la dose en mg/m2 chez les patients âgés de < 10 ans et les patients âgés de 10 à 18 ans a été plus faible de 54 % et 40 %, respectivement, à celle observée chez les adultes (> 18 ans), ce qui suggère que la clairance de l’évérolimus a été plus élevée chez les patients plus jeunes. Des données limitées chez des patients âgés de < 3 ans (n = 13) indiquent que la clairance normalisée rapportée à la SC est environ 2 fois plus élevée chez les patients avec une faible SC (SC de 0,556 m2) que chez les adultes. Par conséquent, il est attendu que l’état d’équilibre puisse être atteint plus tôt chez les patients âgés de < 3 ans (voir rubrique 4.2 pour les recommandations posologiques).
La pharmacocinétique de l’évérolimus n’a pas été étudiée chez les patients âgés de moins de 1 an. Toutefois, il est rapporté que l’activité du CYP3A4 est réduite à la naissance et augmente pendant la première année de vie, ce qui peut affecter la clairance dans cette population de patients.
Une analyse pharmacocinétique de population incluant 111 patients présentant un SEGA âgés de 1,0 à 27,4 ans (dont 18 patients âgés de 1 an à moins de 3 ans ayant une SC de 0,42 m2 à 0,74 m2) a révélé que la clairance normalisée rapportée à la SC était en général plus élevée chez les patients plus jeunes. Les simulations à partir d’un modèle de pharmacocinétique de population ont révélé qu’une dose initiale de 7 mg/m2 était nécessaire pour atteindre une Cmin dans l’intervalle de 5 à 15 ng/mL chez les patients âgés de moins de 3 ans.
Une dose initiale plus élevée de 7 mg/m2 est donc recommandée chez les patients présentant un SEGA âgés de 1 an à moins de 3 ans (voir rubrique 4.2).
Patients âgés
Dans une analyse pharmacocinétique de population chez des patients cancéreux, aucun effet significatif de l’âge (27 à 85 ans) sur la clairance orale de l’évérolimus n’a été observé.
Groupe ethnique
La clairance orale (CL/F) est similaire chez les patients cancéreux japonais et caucasiens présentant une fonction hépatique comparable. Selon une analyse de pharmacocinétique de population, la CL/F est supérieure de 20 % en moyenne chez les patients transplantés noirs.
5.3. Données de sécurité préclinique
L’évérolimus a semblé exacerber spontanément des pathologies préexistantes (myocardite chronique chez le rat, infection du plasma et du cœur par le virus Coxsackie chez le singe, infestation coccidienne du tractus gastro-intestinal chez le cochon nain, lésions cutanées chez la souris et le singe). Ces effets ont été généralement observés à des niveaux d’exposition systémique équivalents ou supérieurs aux niveaux d’exposition thérapeutique, à l’exception des effets observés chez le rat, qui se sont produits à des niveaux inférieurs à l’exposition thérapeutique en raison d’une distribution tissulaire élevée.
Cancer du sein/tumeurs neuroendocrines/carcinome à cellules rénales
Au cours d’une étude de fertilité chez le rat mâle, la morphologie testiculaire a été affectée à des doses de 0,5 mg/kg et plus et la motilité et le nombre de spermatozoïdes et le taux plasmatique de testostérone ont été diminués à la dose de 5 mg/kg, ce qui a entraîné une diminution de la fertilité des mâles. Ces altérations ont été réversibles.
Angiomyolipome rénal/SEGA
Au cours d’une étude de fertilité chez le rat mâle, la morphologie testiculaire a été affectée à des doses de 0,5 mg/kg et plus et la motilité et le nombre de spermatozoïdes et le taux plasmatique de testostérone ont été diminués à la dose de 5 mg/kg, correspondant aux niveaux d’exposition thérapeutique, ce qui a entraîné une diminution de la fertilité des mâles. Ces altérations ont été réversibles.
Au cours des études portant sur la fonction de reproduction réalisées chez l’animal, la fertilité des femelles n’a pas été affectée. Cependant, chez le rat femelle, les doses orales d’évérolimus ≥ 0,1 mg/kg (environ 4 % de l’ASC0-24h des patients recevant 10 mg par jour) ont entraîné une augmentation des pertes pré-implantatoires.
L’évérolimus a traversé la barrière placentaire et s’est avéré toxique pour le fœtus. Chez le rat, l’évérolimus a provoqué une embryo/fœtotoxicité se manifestant par une mortalité et une réduction du poids fœtal à un niveau d’exposition systémique inférieur au niveau thérapeutique. L’incidence de modifications et de malformations du squelette (fente sternale, par exemple) a été augmentée aux doses de 0,3 mg/kg et 0,9 mg/kg. Chez le lapin, l’embryotoxicité s’est manifestée par une augmentation des résorptions tardives.
Angiomyolipome rénal/SEGA
Au cours des études de toxicologie chez le rat juvénile, la toxicité systémique a inclus une diminution du gain pondéral, de la consommation alimentaire et un retard de l’atteinte de certains repères développementaux, avec une récupération totale ou partielle après l’arrêt du traitement. A l’exception possible d’une anomalie du cristallin spécifique au rat (à laquelle les jeunes animaux ont semblé être plus prédisposés), il semble qu’il n’y ait pas de différence significative en matière de sensibilité des jeunes animaux aux effets indésirables de l’évérolimus par rapport aux animaux adultes. Une étude de toxicologie chez le singe juvénile n’a pas mis en évidence de toxicité pertinente.
Les études de génotoxicité évaluant les critères d’évaluation de la génotoxicité pertinents n’ont pas mis en évidence d’activité clastogène ou mutagène. L’administration d’évérolimus pendant des durées allant jusqu’à 2 ans n’a pas indiqué de potentiel oncogène chez la souris et le rat jusqu’aux doses les plus élevées, correspondant respectivement à 3,9 et 0,2 fois l’exposition clinique estimée.
30 mois
6.4. Précautions particulières de conservation
A conserver dans l’emballage d’origine, à l’abri de la lumière.
Ne pas conserver au-dessus de 25 °C.
6.5. Nature et contenu de l'emballage extérieur
Plaquettes en OPA/Alu/PVC - Aluminium contenant 10, 30, 30 × 1, 50 × 1, 60 ou 90 comprimés.
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
100-110 ESPLANADE DU GENERAL DE GAULLE
92931 PARIS LA DÉFENSE CEDEX
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 301 176 2 0 : 30 comprimés sous plaquette(s) (OPA/Aluminium/PVC/Aluminium).
· 34009 301 176 3 7 : 30 x 1 comprimés sous plaquette(s) prédécoupée(s) unitaire(s) (OPA/Aluminium/PVC/Aluminium).
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Liste I.
Médicament nécessitant une surveillance particulière pendant le traitement.
Médicament soumis à prescription hospitalière.
Prescription réservée aux spécialistes et services en cancérologie, en hématologie et en oncologie médicale.
ANSM - Mis à jour le : 27/09/2024
EVEROLIMUS TEVA 5 mg, comprimé
Evérolimus
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin ou votre pharmacien.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que EVEROLIMUS TEVA 5 mg, comprimé et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant de prendre EVEROLIMUS TEVA 5 mg, comprimé ?
3. Comment prendre EVEROLIMUS TEVA 5 mg, comprimé ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver EVEROLIMUS TEVA 5 mg, comprimé ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE EVEROLIMUS TEVA 5 mg, comprimé ET DANS QUELS CAS EST-IL UTILISE ?
Classe pharmacothérapeutique : Agents antinéoplasiques, inhibiteurs de protéine kinase - code ATC : L01EG02
Premier groupe d'indications
EVEROLIMUS TEVA est un médicament anticancéreux qui contient une substance active appelée évérolimus. L’évérolimus réduit l’apport de sang à la tumeur et ralentit la croissance et l’extension des cellules cancéreuses.
EVEROLIMUS TEVA est utilisé chez les patients adultes pour traiter :
· le cancer du sein avancé avec récepteurs hormonaux positifs chez les femmes ménopausées chez qui d'autres traitements (appelés « inhibiteurs non-stéroïdiens de l'aromatase ») ne permettent plus de contrôler la maladie. Il est administré avec un médicament appelé exémestane, un inhibiteur stéroïdien de l'aromatase, qui est utilisé dans le traitement hormonal du cancer du sein ;
· des tumeurs avancées appelées tumeurs neuroendocrines d’origine gastrique, intestinale, pulmonaire ou pancréatique. Il est administré si les tumeurs sont inopérables et si elles ne produisent pas d’hormones spécifiques en excès ou d’autres substances naturelles apparentées ;
· le cancer du rein (carcinome rénal avancé) à un stade avancé lorsque d’autres traitements (appelés « thérapie ciblée anti-VEGF ») n’ont pas été efficaces pour arrêter la progression de la maladie.
Second groupe d'indications
EVEROLIMUS TEVA est un médicament antitumoral qui peut empêcher certaines cellules de l’organisme de se développer. Il contient une substance active appelée évérolimus, qui peut réduire la taille des tumeurs rénales appelées angiomyolipomes rénaux et des tumeurs cérébrales appelées astrocytomes sous-épendymaires à cellules géantes (SEGA). Ces tumeurs sont causées par une maladie génétique appelée sclérose tubéreuse de Bourneville (STB).
EVEROLIMUS TEVA est utilisé pour traiter :
· la STB avec angiomyolipome rénal chez les adultes qui ne nécessitent pas d'intervention chirurgicale immédiate ;
· le SEGA associé à une STB chez les adultes et les enfants pour lesquels une intervention chirurgicale n’est pas appropriée.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT DE PRENDRE EVEROLIMUS TEVA 5 mg, comprimé ?
Cancer du sein/tumeurs neuroendocrines/carcinome à cellules rénalesCancer du sein/tumeurs neuroendocrines/carcinome à cellules rénales
EVEROLIMUS TEVA ne vous sera prescrit que par un médecin ayant l’expérience des traitements anticancéreux.
Respectez attentivement les instructions du médecin. Elles peuvent être différentes des informations générales présentées dans cette notice.
Angiomyolipome rénal/SEGA
Si vous êtes traité(e) pour une STB avec angiomyolipome rénal, EVEROLIMUS TEVA ne vous sera prescrit que par un médecin ayant l’expérience du traitement de la STB.
Si vous êtes traité(e) pour un SEGA associé à une STB, EVEROLIMUS TEVA ne vous sera prescrit que par un médecin ayant l’expérience du traitement des SEGA et pouvant pratiquer des analyses de sang destinées à mesurer la quantité d’évérolimus dans votre sang.
Respectez attentivement les instructions du médecin. Elles peuvent être différentes des informations générales présentées dans cette notice.
Si vous avez des questions sur EVEROLIMUS TEVA ou concernant la raison pour laquelle ce médicament vous a été prescrit, veuillez consulter votre médecin.
Ne prenez JAMAIS EVEROLIMUS TEVA 5 mg, comprimé
· si vous êtes allergique à l’évérolimus, à des substances apparentées telles que le sirolimus ou le temsirolimus, ou à l’un des autres composants contenus dans ce médicament, mentionnés dans la rubrique 6.
Si vous avez eu des réactions allergiques précédemment ou si vous pensez que vous pouvez être allergique, demandez conseil à votre médecin.
Avertissements et précautions
Adressez-vous à votre médecin avant de prendre EVEROLIMUS TEVA
· si vous avez des problèmes de foie ou si vous avez eu dans le passé une maladie qui aurait pu atteindre votre foie.
Cancer du sein/tumeurs neuroendocrines/carcinome à cellules rénales
Dans ce cas, il sera peut-être nécessaire de vous prescrire une dose différente d’EVEROLIMUS TEVA.
Angiomyolipome rénal/SEGA
Dans ce cas, il sera peut-être nécessaire de vous prescrire une dose différente d’EVEROLIMUS TEVA ou d’arrêter le traitement pour une courte période ou définitivement.
· si vous êtes diabétique (taux élevé de sucre dans le sang). EVEROLIMUS TEVA peut augmenter le taux sanguin de glucose et aggraver le diabète. Cela peut nécessiter un traitement par insuline et/ou par antidiabétiques oraux. Si vous constatez que vous avez une sensation de soif excessive ou que vous urinez de façon plus fréquente, parlez-en à votre médecin ;
· si vous devez être vacciné(e) pendant le traitement par EVEROLIMUS TEVA, car cette vaccination pourrait être moins efficace ;
Angiomyolipome rénal/SEGA
Pour les enfants atteints de SEGA, il est important d’avoir une discussion avec le médecin concernant le programme de vaccination infantile avant le traitement par EVEROLIMUS TEVA.
· si vous avez un taux élevé de cholestérol. EVEROLIMUS TEVA peut augmenter le cholestérol et/ou les autres graisses dans le sang ;
· si vous avez récemment subi une intervention chirurgicale majeure ou si la plaie n’est pas encore cicatrisée après la chirurgie. EVEROLIMUS TEVA peut augmenter le risque de problèmes liés à la cicatrisation des plaies ;
· si vous avez une infection. Il peut être nécessaire de traiter l’infection avant l’instauration du traitement par EVEROLIMUS TEVA ;
· si vous avez eu précédemment une hépatite B, car cette infection peut apparaître à nouveau au cours d’un traitement par EVEROLIMUS TEVA (voir rubrique 4 « Quels sont les effets indésirables éventuels ? ») ;
· si vous avez reçu ou allez recevoir une radiothérapie.
EVEROLIMUS TEVA peut également :
· affaiblir votre système immunitaire. Ainsi, vous pouvez vous trouver exposé(e) au risque de contracter une infection pendant que vous prenez votre traitement par EVEROLIMUS TEVA. Si vous avez de la fièvre, ou tout autre signe d’infection, consultez votre médecin. Certaines infections peuvent être sévères et peuvent avoir des conséquences fatales chez les adultes et chez les enfants ;
· avoir un effet sur votre fonction rénale. En conséquence, votre médecin surveillera votre fonction rénale au cours de votre traitement par EVEROLIMUS TEVA ;
· provoquer essoufflement, toux et fièvre (voir rubrique 4 « Quels sont les effets indésirables éventuels ? ») ;
Cancer du sein/tumeurs neuroendocrines/carcinome à cellules rénales
· provoquer des ulcérations buccales et des lésions buccales. Votre médecin devra peut-être arrêter ou suspendre votre traitement par EVEROLIMUS TEVA. Vous pourriez avoir besoin d’un traitement à base de bains de bouche, de gels ou d’autres produits. Certains bains de bouche et gels peuvent aggraver les ulcérations, aussi, n’essayez aucun traitement sans avoir au préalable consulté votre médecin. Votre médecin pourrait prescrire à nouveau le traitement par EVEROLIMUS TEVA à la même dose ou à une dose plus faible ;
Angiomyolipome rénal/SEGA
· provoquer des aphtes (ulcérations buccales) ;
· provoquer des complications de la radiothérapie. Des complications sévères de la radiothérapie (tels que essoufflement, nausées, diarrhée, rashs cutanés et douleur dans la bouche, les gencives et la gorge), y compris des cas mortels, ont été observés chez certains patients qui prenaient de l’évérolimus en même temps que la radiothérapie ou qui prenaient de l’évérolimus peu de temps après avoir reçu une radiothérapie. De plus, des phénomènes dits de rappel (comprenant rougeur cutanée ou inflammation pulmonaire au niveau d’un site précédemment irradié) ont été rapportés chez des patients ayant préalablement reçu une radiothérapie. Informez votre médecin si vous prévoyez de recevoir une radiothérapie prochainement, ou si vous avez déjà reçu une radiothérapie.
Si vous ressentez ces symptômes, veuillez-en informer immédiatement votre médecin.
Vous effectuerez des analyses de sang avant et régulièrement pendant le traitement. Elles permettront de contrôler le taux de cellules sanguines (globules blancs, globules rouges et plaquettes) dans votre organisme pour savoir si EVEROLIMUS TEVA a des effets indésirables sur ces cellules. Des analyses de sang seront également pratiquées pour surveiller vos fonctions rénale (taux de créatinine, d’urée sanguine ou de protéines urinaires), hépatique (taux de transaminases) et votre taux de sucre dans le sang (glycémie) et de lipides dans le sang parce qu’ils peuvent, eux aussi, être modifiés par EVEROLIMUS TEVA.
Angiomyolipome rénal/SEGA
Si vous recevez EVEROLIMUS TEVA pour le traitement d'un SEGA associé à une STB, des analyses de sang à intervalles réguliers sont également nécessaires pour mesurer la quantité d’évérolimus dans votre sang, car cela aidera votre médecin à déterminer la dose d’EVEROLIMUS TEVA que vous devez prendre.
Enfants et adolescents
Cancer du sein/tumeurs neuroendocrines/carcinome à cellules rénales
EVEROLIMUS TEVA ne doit PAS être utilisé chez l’enfant ou l’adolescent (âgé de moins de 18 ans).
Angiomyolipome rénal/SEGA
EVEROLIMUS TEVA peut être utilisé chez les enfants et les adolescents présentant un SEGA associé à une STB.
EVEROLIMUS TEVA NE doit PAS être utilisé chez les enfants ou les adolescents présentant une STB et un angiomyolipome rénal en l'absence de SEGA, car il n’a pas été étudié chez ces patients.
Autres médicaments et EVEROLIMUS TEVA 5 mg, comprimé
EVEROLIMUS TEVA peut interférer avec certains autres médicaments. Si vous prenez d’autres médicaments en même temps qu’EVEROLIMUS TEVA, il sera peut-être nécessaire que votre médecin modifie la dose d’EVEROLIMUS TEVA ou des autres médicaments.
Informez votre médecin ou pharmacien si vous prenez, avez récemment pris ou pourriez prendre tout autre médicament.
Les médicaments suivants peuvent augmenter le risque d’effets indésirables avec EVEROLIMUS TEVA :
· le kétoconazole, l’itraconazole, le voriconazole ou le fluconazole et les autres antifongiques utilisés pour traiter les infections fongiques ;
· la clarithromycine, la télithromycine ou l’érythromycine, antibiotiques utilisés pour traiter des infections bactériennes ;
· le ritonavir et d’autres médicaments utilisés dans le traitement de l’infection par le VIH/SIDA ;
· le vérapamil ou le diltiazem utilisés pour traiter les affections cardiaques ou la pression artérielle élevée ;
· la dronédarone, un médicament utilisé pour aider à réguler les battements de votre cœur ;
· la ciclosporine, un médicament utilisé pour empêcher l’organisme de rejeter les organes transplantés ;
· le cannabidiol (utilisé entre autres pour le traitement des convulsions) ;
· l’imatinib, utilisé pour inhiber la croissance de cellules anormales ;
· les inhibiteurs de l’enzyme de conversion de l’angiotensine (ECA) (tels que ramipril) utilisés pour traiter une pression artérielle élevée ou d’autres problèmes cardiovasculaires ;
· la néfazodone, utilisée pour traiter la dépression.
Les médicaments suivants peuvent réduire l’efficacité d’EVEROLIMUS TEVA :
· la rifampicine, utilisée pour traiter la tuberculose (TB) ;
· l’éfavirenz ou la névirapine, utilisés dans le traitement de l’infection par le VIH/SIDA ;
· le millepertuis (Hypericum perforatum), un produit à base de plante utilisé pour traiter la dépression et d’autres affections ;
· la dexaméthasone, un corticoïde utilisé pour traiter de nombreux types d’affections, incluant les troubles inflammatoires ou immunitaires ;
· la phénytoïne, la carbamazépine ou le phénobarbital et les autres antiépileptiques utilisés pour faire cesser les convulsions ou les crises d’épilepsie.
Tous les médicaments listés ci-dessus doivent être évités pendant le traitement par EVEROLIMUS TEVA. Si vous prenez l’un de ces médicaments, votre médecin le remplacera peut-être par un autre ou pourra modifier la dose d’EVEROLIMUS TEVA.
Angiomyolipome rénal/SEGA
Si vous prenez un médicament antiépileptique et que la dose du médicament antiépileptique est modifiée (augmentation ou diminution), une modification de la dose d’EVEROLIMUS TEVA pourra être nécessaire. Cette décision sera prise par votre médecin. Si la dose de votre médicament antiépileptique est modifiée, veuillez en informer votre médecin.
EVEROLIMUS TEVA 5 mg, comprimé avec des aliments et boissons
Evitez de consommer du pamplemousse ou du jus de pamplemousse pendant le traitement par EVEROLIMUS TEVA. Cela peut augmenter la quantité d’évérolimus dans le sang, potentiellement à un niveau dangereux.
Grossesse, allaitement et fertilité
Grossesse
EVEROLIMUS TEVA peut nuire au fœtus et son utilisation pendant la grossesse n’est pas recommandée. Si vous êtes enceinte ou si vous pensez l’être, informez votre médecin.
Cancer du sein/tumeurs neuroendocrines/carcinome à cellules rénales
Votre médecin vous indiquera si vous devez prendre ce médicament pendant votre grossesse.
Les femmes susceptibles de débuter une grossesse doivent utiliser une méthode contraceptive hautement efficace pendant le traitement et jusqu’à 8 semaines après l’arrêt du traitement. Si, malgré ces mesures, vous pensez que vous pouvez être enceinte, demandez conseil à votre médecin avant de reprendre EVEROLIMUS TEVA.
Allaitement
EVEROLIMUS TEVA peut nuire au nourrisson allaité. Vous ne devez PAS allaiter pendant le traitement et pendant les 2 semaines qui suivent la prise de la dernière dose d’EVEROLIMUS TEVA. Si vous allaitez, informez-en votre médecin.
Fertilité
L’évérolimus peut avoir un effet sur la fertilité masculine et féminine. Prévenez votre médecin si vous souhaitez avoir des enfants.
Cancer du sein/tumeurs neuroendocrines/carcinome à cellules rénales
Une absence des règles (aménorrhée) a été observée chez certaines patientes recevant de l’évérolimus.
Conduite de véhicules et utilisation de machines
Si vous vous sentez fatigué(e) de façon inhabituelle (la fatigue est un effet indésirable très fréquent), faites attention quand vous conduisez des véhicules et utilisez des machines.
EVEROLIMUS TEVA 5 mg, comprimé contient du lactose
Si votre médecin vous a informé(e) d’une intolérance à certains sucres, contactez-le avant de prendre ce médicament.
3. COMMENT PRENDRE Evérolimus Teva 5 mg, comprimé ?
Cancer du sein/tumeurs neuroendocrines/carcinome à cellules rénales
La dose recommandée est de 10 mg en une prise par jour. Votre médecin vous dira combien de comprimés d’EVEROLIMUS TEVA vous devez prendre.
Si vous avez des problèmes au foie, votre médecin pourra vous faire débuter le traitement à une dose plus faible d’EVEROLIMUS TEVA (2,5, 5 ou 7,5 mg par jour).
Angiomyolipome rénal/SEGA
Si vous recevez EVEROLIMUS TEVA pour le traitement d'une STB avec angiomyolipome rénal, la dose habituelle est de 10 mg, à prendre une fois par jour.
Une dose plus élevée ou plus faible peut être recommandée par votre médecin en fonction de vos besoins individuels en matière de traitement, par exemple si vous avez des problèmes au foie ou si vous prenez certains autres médicaments en plus d’EVEROLIMUS TEVA.
Si vous recevez EVEROLIMUS TEVA pour le traitement d'une STB avec SEGA, votre médecin déterminera la dose d’EVEROLIMUS TEVA que vous devez prendre en fonction :
· de votre âge ;
· de votre taille ;
· de l’état de votre foie ;
· des autres médicaments que vous prenez.
Vous effectuerez des analyses de sang pendant le traitement par EVEROLIMUS TEVA. Cela permet de mesurer la quantité d’évérolimus dans votre sang et de déterminer la dose quotidienne optimale pour vous.
Si vous présentez certains effets indésirables au cours de votre traitement par EVEROLIMUS TEVA (voir rubrique 4), votre médecin pourra réduire la dose de votre traitement ou arrêter votre traitement pendant une courte durée ou définitivement.
Prenez EVEROLIMUS TEVA une fois par jour, au même moment de la journée tous les jours.
Vous pouvez prendre les comprimés avec ou sans aliment, mais vous devez le faire de la même manière chaque jour.
Avalez le(s) comprimé(s) entier(s) avec un verre d’eau. Les comprimés ne doivent PAS être mâchés ou écrasés.
Angiomyolipome rénal/SEGA
Si vous prenez EVEROLIMUS TEVA pour le traitement d’une STB avec SEGA et si vous ne pouvez pas avaler les comprimés, vous pouvez les dissoudre dans un verre d’eau :
· Mettez le nombre nécessaire de comprimés dans un verre d’eau (environ 30 mL).
· Remuez doucement le contenu du verre jusqu’à ce que les comprimés soient dissous (environ 8,5 minutes), puis buvez immédiatement le contenu du verre.
· Remplissez à nouveau le verre avec la même quantité d’eau (environ 30 mL), remuez doucement le reste du contenu et buvez-le entièrement pour vous assurer que vous avez reçu la dose complète d’EVEROLIMUS TEVA.
· Si nécessaire, buvez davantage d’eau pour éliminer tout résidu dans votre bouche.
Informations spécifiques pour les aidants
Il est conseillé aux aidants d’éviter tout contact avec les suspensions des comprimés d’EVEROLIMUS TEVA. Lavez-vous les mains soigneusement avant et après la préparation de la suspension.
Si vous avez pris plus d’EVEROLIMUS TEVA 5 mg, comprimé que vous n’auriez dû
Si vous avez pris trop d’EVEROLIMUS TEVA, ou si une autre personne a pris accidentellement vos comprimés, consultez immédiatement votre médecin ou rendez-vous immédiatement à l’hôpital. Un traitement médical d’urgence pourra être nécessaire.
Montrez la boîte de comprimés et cette notice pour que le médecin sache ce que vous avez pris.
Si vous oubliez de prendre EVEROLIMUS TEVA 5 mg, comprimé
Si vous oubliez de prendre une dose, prenez la dose suivante comme prévu. Ne prenez PAS de dose double pour compenser les comprimés que vous avez oublié de prendre.
Si vous arrêtez de prendre EVEROLIMUS TEVA 5 mg, comprimé
Vous ne devez PAS arrêter de prendre EVEROLIMUS TEVA sans l’avis de votre médecin.
Si vous avez d’autres questions sur l’utilisation de ce médicament, demandez plus d’informations à votre médecin ou à votre pharmacien.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Cancer du sein/tumeurs neuroendocrines/carcinome à cellules rénales
ARRÊTEZ de prendre EVEROLIMUS TEVA et demandez immédiatement l’aide d’un médecin si vous présentez l’un des signes de réaction allergique suivants :
· difficulté à respirer ou à avaler ;
· gonflement du visage, des lèvres, de la langue ou de la gorge ;
· démangeaisons sévères de la peau, avec éruption ou bosses rouges.
Les effets indésirables graves d’EVEROLIMUS TEVA incluent :
Très fréquent (pouvant affecter plus de 1 personne sur 10)
· augmentation de la température, frissons (signe d’une infection) ;
· fièvre, toux, difficulté à respirer, respiration sifflante (signes d’une inflammation des poumons, également connue sous le nom de pneumopathie).
Fréquent (pouvant affecter jusqu’à 1 personne sur 10)
· soif excessive, émission d’urine importante, augmentation de l’appétit avec perte de poids, fatigue (signes d’un diabète) ;
· saignement (hémorragie), par exemple dans la paroi intestinale ;
· diminution importante de l’émission d’urine (signe d’une insuffisance rénale).
Peu fréquent (pouvant affecter jusqu’à 1 personne sur 100)
· fièvre, éruption cutanée, douleur et inflammation des articulations, ainsi que fatigue, perte d’appétit, nausées, jaunisse (jaunissement de la peau), douleur dans la partie haute de l’abdomen du côté droit, selles pâles, urine foncée (peuvent être des signes de réactivation d’une hépatite B) ;
· essoufflement, difficulté à respirer en position allongée, gonflement des pieds ou des jambes (signes d’une insuffisance cardiaque) ;
· gonflement et/ou douleur dans l’une des jambes, souvent dans le mollet, rougeur ou peau chaude dans la zone affectée (signes d’un blocage d’un vaisseau sanguin (veine) dans les jambes dû à un caillot de sang) ;
· survenue soudaine d’un essoufflement, douleur dans la poitrine ou crachat de sang (signes potentiels d’une embolie pulmonaire, une maladie qui survient lorsqu’une ou plusieurs artères de vos poumons sont bloquées) ;
· diminution importante de l’émission d’urine, gonflement des jambes, sensation de confusion, douleur dans le dos (signes d’une insuffisance rénale soudaine) ;
· éruption cutanée, démangeaisons, urticaire, difficulté à respirer ou à avaler, sensations vertigineuses (signes d’une réaction allergique grave, également connue sous le nom d’hypersensibilité).
Rare (pouvant affecter jusqu’à 1 personne sur 1 000)
· essoufflement ou respiration rapide (signes d’un syndrome de détresse respiratoire aiguë).
Si vous présentez l’un de ces effets indésirables, prévenez immédiatement votre médecin car ils peuvent mettre votre vie en danger.
Les autres effets indésirables éventuels d’EVEROLIMUS TEVA incluent :
Très fréquent (pouvant affecter plus de 1 personne sur 10)
· taux élevé de sucre dans le sang (hyperglycémie) ;
· perte d’appétit ;
· altération du goût (dysgueusie) ;
· maux de tête ;
· saignement du nez (épistaxis) ;
· toux ;
· ulcérations de la bouche ;
· estomac dérangé incluant une sensation de mal au cœur (nausées) ou diarrhée ;
· éruption cutanée ;
· démangeaisons (prurit) ;
· sensation de faiblesse ou fatigue ;
· fatigue, essoufflement, sensations vertigineuses, pâleur cutanée, signes d’un taux faible de globules rouges (anémie) ;
· gonflement des bras, mains, pieds, chevilles ou d’une autre partie du corps (signes d’un œdème) ;
· perte de poids ;
· taux élevé de lipides (graisses) dans le sang (hypercholestérolémie).
Fréquent (pouvant affecter jusqu’à 1 personne sur 10)
· saignements spontanés ou bleus (signes d’un taux faible de plaquettes, également connu sous le nom de thrombopénie) ;
· essoufflement (dyspnée) ;
· soif, faible émission d’urine, urine foncée, peau rouge et sèche, irritabilité (signes de déshydratation) ;
· troubles du sommeil (insomnies) ;
· maux de tête, sensations vertigineuses (signe d’une pression artérielle élevée, également connue sous le nom d’hypertension) ;
· fièvre, maux de gorge ou ulcérations de la bouche dus à des infections (signes d’un taux faible de globules blancs, leucopénie, lymphopénie et/ou neutropénie) ;
· fièvre ;
· inflammation de la paroi intérieure de la bouche, de l’estomac, de l’intestin ;
· sècheresse buccale ;
· brûlures d’estomac (dyspepsie) ;
· être malade (vomissements) ;
· difficulté à avaler (dysphagie) ;
· douleur abdominale ;
· acné ;
· éruption cutanée et douleur sur les paumes des mains et les plantes des pieds (syndrome mains-pieds) ;
· rougeur de la peau (érythème) ;
· douleur articulaire ;
· douleur buccale ;
· troubles menstruels tels que règles irrégulières ;
· taux élevé de lipides (graisses) dans le sang (hyperlipémie, triglycérides augmentés) ;
· taux faible de potassium dans le sang (hypokaliémie) ;
· taux faible de phosphate dans le sang (hypophosphatémie) ;
· taux faible de calcium dans le sang (hypocalcémie) ;
· sécheresse cutanée, desquamation, lésions cutanées ;
· anomalies des ongles, ongles cassants ;
· légère perte des cheveux ;
· résultats anormaux des tests sanguins de la fonction hépatique (augmentation de l’alanine et de l’aspartate aminotransférase) ;
· résultats anormaux des tests sanguins de la fonction rénale (augmentation de la créatinine) ;
· gonflement de la paupière ;
· protéines dans les urines.
Peu fréquent (pouvant affecter jusqu’à 1 personne sur 100)
· faiblesse, saignements spontanés ou bleus et infections fréquentes avec des signes tels que fièvre, frissons, maux de gorge ou ulcérations de la bouche (signes d’un taux faible de cellules dans le sang, également connu sous le nom de pancytopénie) ;
· perte des sensations du goût (agueusie) ;
· crachat de sang (hémoptysie) ;
· troubles menstruels tels qu'absence de règles (aménorrhée) ;
· émission d’urine plus fréquente pendant la journée ;
· douleur dans la poitrine ;
· cicatrisation des plaies anormale ;
· bouffées de chaleur ;
· écoulement oculaire avec démangeaisons et rougeurs, yeux roses ou rouges (conjonctivite).
Rare (pouvant affecter jusqu’à 1 personne sur 1 000)
· fatigue, essoufflement, sensations vertigineuses, pâleur cutanée (signes d’un taux faible de globules rouges dans le sang, éventuellement dû à un type d’anémie appelée érythroblastopénie) ;
· gonflement du visage, autour des yeux, de la bouche et à l’intérieur de la bouche et/ou de la gorge, ainsi que de la langue et difficulté à respirer ou avaler (également connu sous le nom d’angiœdème), pouvant être des signes d’une réaction allergique.
Fréquence indéterminée (ne peut être estimée sur la base des données disponibles)
· réaction au niveau d’un site précédemment irradié, par exemple rougeur cutanée ou inflammation pulmonaire (appelée phénomène de rappel) ;
· aggravation des effets indésirables de la radiothérapie.
Si ces effets indésirables deviennent sévères, informez votre médecin et/ou pharmacien. La plupart des effets indésirables sont légers à modérés et disparaissent généralement si votre traitement est interrompu pendant quelques jours.
Angiomyolipome rénal/SEGA
ARRETEZ de prendre EVEROLIMUS TEVA et demandez immédiatement l’aide d’un médecin si vous ou votre enfant présentez l’un des signes de réaction allergique suivants :
· difficultés à respirer ou à avaler ;
· gonflement du visage, des lèvres, de la langue ou de la gorge (signe d’œdème de Quincke) ;
· démangeaisons sévères de la peau, avec éruption cutanée ou bosses rouges.
Les effets indésirables graves d’EVEROLIMUS TEVA incluent :
Très fréquent (pouvant affecter plus de 1 personne sur 10)
· Fièvre, toux, difficultés à respirer, respiration sifflante (signes d’une inflammation des poumons due à une infection, également connue sous le nom de pneumonie).
Fréquent (pouvant affecter jusqu’à 1 personne sur 10)
· Gonflement, sensation de pesanteur ou d'oppression, douleur, mobilité réduite de certaines parties du corps (ce phénomène peut se produire dans n’importe quelle zone du corps et peut être le signe d’une accumulation anormale de liquide dans les tissus mous en raison d'une obstruction dans le système lymphatique, également connu sous le nom de lymphœdème).
· Eruption cutanée, démangeaisons, urticaire, difficulté à respirer ou à avaler, sensations vertigineuses (signes d’une réaction allergique grave, également connue sous le nom d’hypersensibilité).
· Fièvre, toux, difficultés à respirer, respiration sifflante (signes d’une inflammation des poumons, également connue sous le nom de pneumopathie).
Peu fréquent (pouvant affecter jusqu’à 1 personne sur 100)
· Eruption de petites cloques remplies de liquide, apparaissant sur une peau rougie (signes d’une infection virale potentiellement sévère, également connue sous le nom de zona).
· Fièvre, frissons, accélération de la respiration et du rythme cardiaque, éruption cutanée et possible confusion et désorientation (signes d’une infection grave, également connue sous le nom de sepsis).
Si vous présentez l’un de ces effets indésirables, prévenez immédiatement votre médecin car ils peuvent mettre votre vie en danger.
Les autres effets indésirables éventuels d’EVEROLIMUS TEVA incluent :
Très fréquent (pouvant affecter plus de 1 personne sur 10)
· Infections des voies respiratoires supérieures
· Maux de gorge et nez qui coule (rhinopharyngite)
· Maux de tête, tension au niveau des yeux, du nez ou des joues (signes d’une inflammation des sinus et des fosses nasales, également connue sous le nom de sinusite)
· Infection des voies urinaires
· Taux élevé de lipides (graisses) dans le sang (hypercholestérolémie)
· Appétit diminué
· Maux de tête
· Toux
· Aphtes
· Diarrhée
· Etre malade (vomissements)
· Acné
· Eruption cutanée
· Sensation de fatigue
· Fièvre
· Troubles menstruels tels qu'absence de règles (aménorrhée) ou règles irrégulières
· Maux de gorge (pharyngite)
· Maux de tête, sensations vertigineuses, signes d’une pression artérielle élevée (hypertension)
Fréquent (pouvant affecter jusqu’à 1 personne sur 10)
· Infection de l’oreille moyenne
· Gencives gonflées et qui saignent (signes d’une inflammation des gencives, également connue sous le nom de gingivite)
· Inflammation de la peau (cellulite)
· Taux élevé de lipides (graisses) dans le sang (hyperlipidémie, triglycérides augmentés)
· Faible taux de phosphate dans le sang (hypophosphatémie)
· Taux élevé de sucre dans le sang (hyperglycémie)
· Fatigue, essoufflement, sensations vertigineuses, pâleur cutanée (signes d’un faible taux de globules rouges, également connu sous le nom d’anémie)
· Fièvre, maux de gorge ou aphtes dus à des infections (signes d’un faible taux de globules blancs, également connu sous le nom de leucopénie, lymphopénie ou neutropénie)
· Saignements spontanés ou ecchymoses (« bleus ») (signes d’un faible taux de plaquettes, également connu sous le nom de thrombopénie)
· Douleur buccale
· Saignements de nez (épistaxis)
· Estomac dérangé incluant une sensation de mal au cœur (nausées)
· Douleurs abdominales
· Douleurs intenses dans le bas-ventre et le pelvis qui peuvent être fortes, accompagnées de règles irrégulières (kystes ovariens)
· Quantité excessive de gaz dans les intestins (flatulences)
· Constipation
· Douleurs abdominales, nausées, vomissements, diarrhée, gonflement et ballonnement de l’abdomen (signes d’une inflammation de la paroi de l’estomac, également connue sous le nom de gastrite ou gastroentérite virale)
· Sécheresse cutanée, démangeaisons (prurit)
· Affection inflammatoire de la peau caractérisée par des rougeurs, des démangeaisons, des kystes remplis de liquide et suintants qui finissent par peler, crouter ou durcir (dermatite acnéiforme)
· Perte de cheveux (alopécie)
· Présence de protéines dans les urines
· Troubles menstruels tels que règles abondantes (ménorragie) ou saignements vaginaux
· Troubles du sommeil (insomnie)
· Irritabilité
· Agressivité
· Taux élevé d'une enzyme appelée lactate deshydrogénase sanguine, qui donne des informations sur la santé de certains organes
· Taux élevé de l’hormone qui déclenche l’ovulation (hormone lutéinisante sanguine augmentée)
· Perte de poids
Peu fréquent (pouvant affecter jusqu’à 1 personne sur 100)
· Spasmes musculaires, fièvre, urines rouge-brun pouvant être les symptômes d'une affection musculaire (rhabdomyolyse)
· Toux avec mucus, douleur dans la poitrine, fièvre (signes d’une inflammation des voies respiratoires, également connue sous le nom de bronchite virale)
· Troubles du goût (dysgueusie)
· Troubles menstruels tels que retard de règles
· Taux élevé d’une hormone féminine de la reproduction (hormone folliculostimulante sanguine augmentée)
Fréquence indéterminée (ne peut être estimée sur la base des données disponibles)
· Réaction au niveau d’un site précédemment irradié, par exemple rougeur cutanée ou inflammation pulmonaire (phénomène de rappel)
· Aggravation des effets indésirables de la radiothérapie
Si ces effets indésirables deviennent sévères, informez votre médecin et/ou pharmacien. La plupart des effets indésirables sont légers à modérés et disparaissent généralement si votre traitement est interrompu pendant quelques jours.
Les effets indésirables suivants ont été rapportés chez des patients prenant de l’évérolimus pour des affections autres que la STB :
· Troubles rénaux : la modification de la fréquence des mictions ou l'absence de mictions peuvent être des symptômes d'insuffisance rénale et ont été observés chez certains patients ayant reçu l’évérolimus. Les autres symptômes peuvent inclure une altération des tests de la fonction rénale (augmentation de la créatinine).
· Symptômes d'insuffisance cardiaque tels qu'essoufflement, difficultés à respirer en position allongée, gonflement des pieds ou des jambes.
· Blocage ou obstruction d'un vaisseau sanguin (veine) dans la jambe (thrombose veineuse profonde). Les symptômes peuvent être un gonflement et/ou une douleur dans l'une de vos jambes, généralement au niveau du mollet, une rougeur ou une peau chaude au niveau de la zone affectée.
· Problèmes de cicatrisation des plaies.
· Taux élevés de sucre dans le sang (hyperglycémie).
Une réactivation de l’hépatite B a été observée chez certains patients prenant de l’évérolimus. Informez votre médecin si vous présentez des symptômes d’hépatite B pendant le traitement par évérolimus. Les premiers symptômes peuvent être une fièvre, une éruption cutanée, des douleurs articulaires et une inflammation. Les autres symptômes peuvent être de la fatigue, une perte d’appétit, des nausées, une jaunisse (coloration jaune de la peau) et des douleurs dans la partie supérieure droite de l’abdomen. Des selles pâles ou des urines foncées peuvent également être des signes d’hépatite.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER EVEROLIMUS Teva 5 mg, comprimé ?
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur la boîte et la plaquette. La date de péremption fait référence au dernier jour de ce mois.
A conserver dans l’emballage d’origine, à l’abri de la lumière.
Ne pas conserver au-dessus de 25 °C.
Ouvrir la plaquette juste avant de prendre les comprimés. N’utilisez pas ce médicament si vous remarquez que l’emballage est endommagé ou a été ouvert.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient EVEROLIMUS TEVA 5 mg, comprimé
· La substance active est :
Evérolimus........................................................................................................................ 5 mg
Pour un comprimé.
· Les autres composants sont :
Butylhydroxytoluène (E321), hypromellose, lactose monohydraté, lactose, crospovidone et stéarate de magnésium.
Qu’est-ce que EVEROLIMUS TEVA 5 mg, comprimé et contenu de l’emballage extérieur
EVEROLIMUS TEVA 5 mg, comprimé se présente sous forme de comprimés oblongs, plats, de couleur blanche, à bords biseautés, d’environ 12 mm de long et 5 mm de large, comportant la mention « EV » sur une face et « 5 » sur l’autre face.
EVEROLIMUS TEVA est disponible en boîtes de 10, 30, 30 × 1, 50 × 1, 60 ou 90 comprimés sous plaquettes.
Toutes les présentations peuvent ne pas être commercialisées.
Titulaire de l’autorisation de mise sur le marché
100-110 ESPLANADE DU GENERAL DE GAULLE
92931 PARIS LA DÉFENSE CEDEX
Exploitant de l’autorisation de mise sur le marché
100-110 ESPLANADE DU GENERAL DE GAULLE
92931 PARIS LA DÉFENSE CEDEX
TEVA GYOGYSZERGYAR ZRT.
PALLAGI UT 13,
DEBRECEN
4042
HONGRIE
ou
TEVA OPERATIONS POLAND SP. Z.O.O
UL. MOGILSKA 80.
KRAKÓW
31-546
POLOGNE
ou
MERCKLE GMBH
LUDWIG-MERCKLE-STRASSE 3, BLAUBEUREN
BADEN-WUERTTEMBERG
89143
ALLEMAGNE
ou
PLIVA HRVATSKA D.O.O. (PLIVA CROATIA LTD.)
PRILAZ BARUNA FILIPOVIĆA 25
ZAGREB
10000
CROATIE
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Ce médicament est autorisé dans les Etats membres de l'Espace Economique Européen et au Royaume-Uni (Irlande du Nord) sous les noms suivants : Conformément à la réglementation en vigueur.
[à compléter ultérieurement par le titulaire]
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).