Dernière mise à jour le 01/12/2025
MOVIPREP ORANGE, poudre pour solution buvable
Indications thérapeutiques
Classe pharmacothérapeutique - code ATC : A06AD.
MOVIPREP ORANGE est un laxatif osmotique aromatisé à l’orange. La boîte contient quatre sachets : deux grands sachets (sachet A) et deux petits sachets (sachet B). Vous devez utiliser les quatre sachets pour un traitement.
MOVIPREP ORANGE est indiqué chez l’adulte dans le lavage intestinal préalablement à tout examen nécessitant un intestin propre (par exemple : exploration endoscopique ou radiologique).
MOVIPREP ORANGE agit en vidant vos intestins de leur contenu, vous devez donc vous attendre à des selles liquides.
Composition en substances actives
-
Poudre pour sachet A ( Composition pour un sachet )
- > macrogol 3350 100 g
- > sulfate de sodium anhydre 7,500 g
- > chlorure de sodium 2,691 g
- > chlorure de potassium 1,015 g
-
Poudre pour sachet B ( Composition pour un sachet )
- > acide ascorbique 4,700 g
- > ascorbate de sodium 5,900 g
Présentations
> 1 sachet A papier polyéthylène basse densité (PEBD) aluminium surpoché de 112 g + 1 sachet B papier polyéthylène basse densité (PEBD) aluminium surpoché de 11 g
Code CIP : 34009 302 382 5 7
Déclaration de commercialisation : 01/07/2022
Cette présentation est agréée aux collectivités
- Prix hors honoraire de dispensation : 7,62 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 8,64 €
- Taux de remboursement :65 %
Service médical rendu (SMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Important | Avis du 19/01/2022 | Inscription (CT) | Le service médical rendu par MOVIPREP Orange, poudre pour solution buvable (macrogol et acide ascorbique) est important dans l’indication de l’AMM. |
Amélioration du service médical rendu (ASMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprés de la HAS (plus d'informations dans l'aide). Les avis et synthéses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur de l'ASMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| V (Inexistant) | Avis du 19/01/2022 | Inscription (CT) | Cette spécialité est un complément de gamme qui n’apportent pas d’amélioration du service médical rendu (ASMR V) par rapport à la spécialité MOVIPREP, poudre pour solution buvable. |
ANSM - Mis à jour le : 27/03/2025
MOVIPREP ORANGE, poudre pour solution buvable
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Les composants de MOVIPREP ORANGE sont contenus dans deux sachets séparés.
Le sachet A contient les substances actives suivantes :
Macrogol 3350........................................................................................................................ 100 g
Sulfate de sodium anhydre................................................................................................... 7,500 g
Chlorure de sodium.............................................................................................................. 2,691 g
Chlorure de potassium.......................................................................................................... 1,015 g
Le sachet B contient les substances actives suivantes :
Acide ascorbique................................................................................................................. 4,700 g
Ascorbate de sodium........................................................................................................... 5,900 g
La concentration en électrolytes, après dissolution des deux sachets dans un litre d’eau, est la suivante :
Sodium.......................................................... 181,6 mmol/L (dont au plus 56,2 mmol est absorbable)
Sulfate ......................................................................................................................... 52,8 mmol/L
Chlorure........................................................................................................................ 59,8 mmol/L
Potassium.................................................................................................................... 14,2 mmol/L
Ascorbate..................................................................................................................... 56,5 mmol/L
Excipients à effet notoire : chaque sachet A contient 0,175 g d’aspartame et 0,120 g de dextrose.
Pour la liste complète des excipients, voir rubrique 6.1.
Sachet A : poudre blanche à jaunâtre.
Sachet B : poudre blanche à marron clair.
4.1. Indications thérapeutiques
4.2. Posologie et mode d'administration
Adultes et personnes âgées
La préparation consiste à boire deux litres de solution de MOVIPREP ORANGE. Il est fortement recommandé de boire également, en plus, un litre de liquide clair incluant eau, soupe claire, jus de fruit sans pulpe, boisson non alcoolisée, thé et/ou café sans lait.
Un litre de MOVIPREP ORANGE consiste à dissoudre ensemble un sachet A et un sachet B dans de l’eau pour obtenir un litre de solution. Cette solution reconstituée doit être bue sur une période d’une à deux heures. Répéter la même opération pour obtenir un 2ème litre de MOVIPREP ORANGE et finir la préparation.
Cette préparation peut être prise soit en deux fois, soit en prise unique et le moment de la prise dépend des conditions de l’examen, avec ou sans anesthésie générale, comme décrit ci-après :
Pour les examens se déroulant sous anesthésie générale :
1. En deux fois : un litre de MOVIPREP ORANGE ingéré la veille au soir de l’examen et un litre de MOVIPREP ORANGE ingéré tôt dans la matinée le jour de l’examen. Assurez-vous que la prise de MOVIPREP ORANGE et de tout autre liquide clair soit arrêtée au moins deux heures avant le début de l’examen.
2. En prise unique : deux litres de MOVIPREP ORANGE ingérés la veille au soir de l’examen ou deux litres de MOVIPREP ORANGE le matin de l’examen. Assurez-vous que la prise de MOVIPREP ORANGE et de tout autre liquide clair soit arrêtée au moins deux heures avant le début de l’examen.
Pour les examens se déroulant sans anesthésie générale :
1. En deux fois : un litre de MOVIPREP ORANGE ingéré la veille au soir de l’examen et un litre de MOVIPREP ORANGE ingéré tôt dans la matinée le jour de l’examen. Assurez-vous que la prise de MOVIPREP ORANGE et de tout autre liquide clair soit arrêtée au moins une heure avant le début de l’examen.
2. En prise unique : deux litres de MOVIPREP ORANGE ingérés la veille au soir de l’examen ou deux litres de MOVIPREP ORANGE le matin de l’examen. Assurez-vous que la prise de MOVIPREP ORANGE soit arrêtée au moins deux heures avant le début de l’examen. Assurez-vous que la prise de tout autre liquide clair soit arrêtée au moins une heure avant le début de l’examen.
Les patients doivent être conseillés sur le moment approprié pour se rendre au centre d’examen.
Aucune nourriture solide ne doit être ingérée à compter du début de la préparation jusqu’à la fin de l’examen.
Population pédiatrique
Aucune étude n’a été effectuée au sein de la population pédiatrique.
MOVIPREP ORANGE n’est donc pas recommandé chez les enfants de moins de 18 ans.
Mode d’administration
La voie d’administration est orale. Le litre de MOVIPREP ORANGE est obtenu en dissolvant dans l’eau un sachet A et un sachet B pour obtenir un litre de solution reconstituée.
Précautions à prendre avant la manipulation ou l’administration du médicament.
Pour les instructions concernant la reconstitution du médicament avant administration, voir la rubrique 6.6.
Ne pas utiliser chez les patients ayant des antécédents ou suspicions de :
· Hypersensibilité aux substances actives ou à l’un des excipients mentionnés à la rubrique 6.1,
· Occlusion ou perforation gastro-intestinale,
· Troubles de la vidange gastrique (gastroparésie),
· Iléus,
· Phénylcétonurie (en raison de la présence d’aspartame),
· Déficit en glucose-6-phosphate déshydrogénase (en raison de la présence d’ascorbate),
· Mégacôlon toxique, dans les formes sévères d’inflammation du tractus intestinal, y compris dans la maladie de Crohn et la recto-colite hémorragique.
Ne pas utiliser chez des patients inconscients.
4.4. Mises en garde spéciales et précautions d'emploi
La diarrhée est un effet attendu de l’utilisation de MOVIPREP ORANGE.
MOVIPREP ORANGE doit être administré avec précaution chez les patients fragiles ou ceux présentant des troubles cliniques sévères tels que :
· Troubles de la déglutition ou tendance à l’inhalation ou à la régurgitation,
· Troubles de la vigilance,
· Insuffisance rénale sévère (clairance de la créatinine < 30 mL/min),
· Insuffisance cardiaque (NYHA grade III ou IV),
· Patients à risque d’arythmie, par exemple ceux traités pour une maladie cardiovasculaire ou ceux avec une maladie thyroïdienne,
· Déshydratation,
· Poussées sévères de maladie inflammatoire intestinale.
Si le patient présente une déshydratation, celle-ci devra être corrigée avant l’utilisation de MOVIPREP ORANGE.
Le liquide contenu dans MOVIPREP ORANGE après reconstitution avec de l’eau ne remplace pas un apport hydrique régulier. Un apport hydrique suffisant doit être maintenu.
Les patients présentant des troubles de la vigilance, les patients sujets aux inhalations ou régurgitations doivent être surveillés attentivement durant l’administration, et plus particulièrement encore si celle-ci se fait par sonde naso-gastrique.
Chez les patients ayant des troubles de déglutition, qui ont besoin d’ajouter un épaississant aux solutions pour permettre un apport adéquat, les interactions doivent être prises en compte, voir rubrique 4.5.
L’apparition de symptômes suggérant une arythmie ou des variations hydro-électrolytiques (par exemple : œdème, dyspnée, profonde asthénie, insuffisance cardiaque) doit conduire à vérifier les électrolytes plasmatiques, contrôler l’ECG et traiter toute anomalie éventuelle de façon appropriée.
Pour les patients fragiles et déficients, les patients à l’état de santé précaire, ceux souffrant d’insuffisance rénale sévère, d’arythmie et ceux présentant un risque de déséquilibre électrolytique, le médecin devra envisager un traitement électrolytique avant et après la prise de MOVIPREP ORANGE ainsi qu’un contrôle de la fonction rénale et de l’ECG le cas échéant.
Des cas de convulsions associées à l'utilisation de macrogol 3350 avec des électrolytes pour la préparation colique ont été observés chez des patients, avec ou sans antécédents de convulsions. Ces cas étaient principalement associés à des anomalies électrolytiques telles qu'une hyponatrémie sévère (voir section 4.8). Utiliser avec précaution chez les patients ayant des antécédents de convulsions, un risque accru de convulsions ou un risque de déséquilibre électrolytique. En cas de symptômes neurologiques, les déséquilibres hydriques et électrolytiques doivent être corrigés.
De rares cas d’arythmies graves, y compris la fibrillation auriculaire, associés à l’utilisation de laxatifs osmotiques pour la préparation colique ont été rapportés. Elles surviennent principalement chez les patients présentant des facteurs de risque cardiaque et des troubles électrolytiques sous-jacents.
Si les patients présentent des symptômes tels que ballonnement sévère, distension abdominale, douleur abdominale ou autre réaction rendant la poursuite du traitement difficile, la prise de MOVIPREP ORANGE peut être ralentie ou temporairement arrêtée et les patients devront consulter leur médecin.
Colite ischémique
La pharmacovigilance a fait apparaître que des cas de colite ischémique, dont certains graves, ont été rapportés chez des patients traités par macrogol dans le cadre d’une préparation intestinale. Le macrogol devrait être utilisé avec prudence chez les patients présentant des facteurs de risque de colite ischémique connus ou en cas d’utilisation concomitante de laxatifs stimulants (tels que le bisacodyl ou le picosulfate de sodium). Les patients présentant une soudaine douleur abdominale, une hémorragie rectale ou d’autres symptômes de colite ischémique devraient faire l’objet d’une évaluation rapide.
Des cas de rupture œsophagienne (syndrome de Boerhaave) associés à des vomissements excessifs après la prise (voir section 4.8) de macrogol 3350 avec des électrolytes pour la préparation colique ont été signalés après commercialisation, principalement chez des patients âgés. Conseiller aux patients d'arrêter l'administration et de consulter immédiatement un médecin en cas de vomissements incoercibles suivis de douleurs thoraciques, cervicales et abdominales, de dysphagie, d'hématémèse ou de dyspnée.
La totalité de la préparation contient 363,2 mmol (8,4 g) de sodium, équivalent à 420% de la dose journalière maximale recommandée par l’OMS de 2 g de sodium pour un adulte (La totalité de la préparation consiste en 2 litres de MOVIPREP ORANGE). A prendre en compte chez les patients qui contrôlent leur apport en sodium. Seule une partie du sodium (jusqu’à 112,4 mmol (2,6 g) par préparation) est absorbée.
La totalité de la préparation contient 28,4 mmol (1,1 g) de potassium (La totalité de la préparation consiste en 2 litres de MOVIPREP ORANGE). A prendre en compte chez les patients avec une fonction rénale diminuée ou qui contrôlent leur apport en potassium.
Ce médicament contient de l’aspartame qui est une source de phénylalanine. Peut-être nocif chez les patients atteints d’une phénylcétonurie.
Les patients présentant un syndrome de malabsorption du glucose et du galactose (maladie héréditaire rare) ne doivent pas prendre ce médicament.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
MOVIPREP ORANGE peut potentiellement interagir avec les épaississants alimentaires à base d'amidon. La substance active macrogol neutralise l'effet épaississant de l'amidon, menant à la liquéfaction des préparations devant rester épaissies pour les personnes ayant des troubles de déglutition.
4.6. Fertilité, grossesse et allaitement
Grossesse
Il n’y a pas de données sur l’utilisation de MOVIPREP ORANGE pendant la grossesse.
MOVIPREP ORANGE doit être utilisé uniquement si le médecin considère que c’est essentiel.
Allaitement
Il n’y a pas de données sur l’utilisation de MOVIPREP ORANGE pendant l’allaitement.
MOVIPREP ORANGE doit être utilisé uniquement si le médecin considère que c’est essentiel.
Fertilité
Il n’y a pas de données concernant l’effet de MOVIPREP ORANGE sur la fertilité.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
MOVIPREP ORANGE n’a aucun effet sur l’aptitude à conduire des véhicules et à utiliser des machines.
La diarrhée est un effet attendu de la préparation colique. En raison de la nature de l’examen, des effets indésirables apparaissent chez la majorité des patients durant la procédure de lavage intestinal. Bien que ces effets varient selon les préparations, des nausées, des vomissements, des ballonnements, des douleurs abdominales, une irritation anale et des troubles du sommeil ont fréquemment lieu chez les patients effectuant une préparation intestinale. Une déshydratation peut survenir en cas de diarrhée et/ou vomissements.
Tout comme les autres produits contenant du macrogol, des réactions allergiques incluant les symptômes suivants : rash, urticaire, prurit, dyspnée, œdème de Quincke et anaphylaxie, sont possibles.
Des informations concernant les effets indésirables et provenant des essais cliniques sont disponibles à partir d’une population de 825 patients traités avec MOVIPREP. De plus, les effets indésirables rapportés depuis la commercialisation du produit sont inclus.
La fréquence des effets indésirables de MOVIPREP ORANGE est définie selon la convention suivante :
Très fréquent (≥ 1/10) ;
Fréquent (≥ 1/100, < 1/10) ;
Peu fréquent (≥ 1/1 000, < 1/100) ;
Rare (≥ 1/10 000, < 1/1 000) ;
Très rare (< 1/10 000) ;
|
Classe de système d’organes |
Fréquence |
Effets indésirables |
|
Affections du système immunitaire |
Fréquence indéterminée |
Réaction allergique incluant réaction anaphylactique, dyspnée et réactions cutanées (voir ci-dessous) |
|
Troubles du métabolisme et de la nutrition |
Fréquence indéterminée |
Troubles électrolytiques incluant une diminution des taux plasmatiques de bicarbonate, hypercalcémie, hypocalcémie, hypophosphatémie, hypokaliémie et hyponatrémie et diminution ou augmentation de la chlorémie. Déshydratation |
|
Affections psychiatriques |
Fréquent |
Troubles du sommeil |
|
Affections du système nerveux |
Fréquent |
Vertiges, maux de tête |
|
Fréquence indéterminée |
Convulsions associées à une hyponatrémie sévère, convulsion |
|
|
Affections cardiaques |
Fréquence indéterminée |
Augmentation transitoire de la pression artérielle Arythmie, palpitations |
|
Affections gastro-intestinales |
Très fréquent |
Douleurs abdominales, nausées, distension abdominale, inconfort anal |
|
Fréquent |
Vomissements, dyspepsie |
|
|
Peu fréquent |
Dysphagie |
|
|
Fréquence indéterminée |
Rupture œsophagienne (syndrome de Boerhaave), flatulence, efforts de vomissements type haut-le-cœur |
|
|
Affections hépatobiliaires |
Peu fréquent |
Tests anormaux de la fonction hépatique |
|
Affections de la peau et du tissu sous-cutané |
Fréquence indéterminée |
Réactions allergiques de type cutané incluant angioœdème, urticaire, prurit, rash, érythème |
|
Troubles généraux et troubles liés à la voie d’administration |
Très fréquent |
Malaise, fièvre |
|
Fréquent |
Frissons, sensation de soif, sensation de faim |
|
|
Peu fréquent |
Inconfort |
Fréquence indéterminée (ne peut être estimée sur la base des données disponibles).
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/.
En cas de surdosage important et accidentel avec diarrhée sévère, des mesures conservatrices sont habituellement suffisantes ; des quantités abondantes de liquides, notamment de jus de fruits, devront être données. Dans les rares cas de surdosage entraînant un déséquilibre métabolique sévère, une réhydratation par voie intraveineuse peut être effectuée.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : Laxatif osmotique, code ATC : A06AD.
L’administration orale de solutions électrolytiques de lavage à base de macrogol provoque une diarrhée modérée et entraîne une vidange rapide du contenu colique.
Le macrogol 3350, le sulfate de sodium et les doses élevées d’acide ascorbique exercent une action osmotique intestinale, à l’origine de l’effet laxatif.
Le macrogol 3350 augmente le volume des selles ; ce qui stimule la motricité colique via des processus neuromusculaires.
La conséquence physiologique est une accélération du péristaltisme colique des selles ramollies.
La composition en électrolytes de la solution alliée à la prise complémentaire de liquide clair est là pour éviter des variations cliniques significatives du sodium, du potassium ou de l’eau et limiter ainsi le risque de déshydratation.
5.2. Propriétés pharmacocinétiques
L’acide ascorbique est principalement absorbé au niveau de l’intestin grêle par un mécanisme saturable de transport actif sodium-dépendant. Il existe une relation inverse entre la dose ingérée et le pourcentage de la dose absorbée. Pour des doses orales ingérées de 30 à 180 mg, environ 70 à 85 % de la dose est absorbée. Après ingestion d’une dose d’acide ascorbique allant jusqu’à 12 g, seulement 2 g sont absorbés.
Après l’ingestion de doses élevées d’acide ascorbique et dès que les concentrations plasmatiques excèdent 14 mg/litre, ce dernier est principalement éliminé dans les urines sous forme inchangée.
5.3. Données de sécurité préclinique
Aucune étude de toxicité sur la reproduction, de génotoxicité ou de carcinogénicité n’a été réalisée avec ce produit.
Dans les études de toxicité sur la reproduction réalisées avec du macrogol 3350 + électrolytes, aucun effet embryotoxique ou tératogène n’a été observé chez les rats à des niveaux de doses maternelles 14 fois supérieures à la dose maximale recommandée de MOVIPREP ORANGE chez l’Homme. Des effets indirects sur le développement embryo-fœtal, tels que la diminution du poids du fœtus et du placenta, diminution de la viabilité du fœtus, allongement des membres inférieurs, hyperflexion des membres et avortement, ont été observés chez le lapin à une dose maternelle 0,7 fois supérieure à la dose maximale recommandée de MOVIPREP ORANGE chez l’Homme. Le lapin est une espèce sensible aux effets des substances actives gastro-intestinales.
Les études ont été conduites en condition exagérée avec l’administration de doses de volume élevé qui ne sont pas cliniquement pertinentes. Ces résultats pourraient être la conséquence d’un effet indirect du macrogol 3350 + électrolytes liée à un mauvais état général de la mère et ayant comme conséquence une réponse pharmacodynamique exagérée chez le lapin. Il n’y avait aucun signe évocateur d’un effet tératogène.
Sachets : 3 ans.
Solution reconstituée : 24 heures.
6.4. Précautions particulières de conservation
Sachets : A conserver à une température ne dépassant pas 25°C.
Solution reconstituée : A conserver à une température ne dépassant 25°C ou au réfrigérateur. Garder la solution dans un conditionnement fermé.
6.5. Nature et contenu de l'emballage extérieur
112 g de poudre dans le sachet A (Papier/PEBD/Aluminium/PEBD).
11 g de poudre dans le sachet B (Papier/PEBD/Aluminium/PEBD).
Les deux sachets (A+B) sont contenus dans un sac transparent. La boîte contient 1 traitement composé de deux sacs servant à réaliser la préparation.
Il existe des conditionnements de 1, 10, 40, 80, 160, 320 boîtes. Présentation hospitalière en conditionnement de 40 traitements. Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
La reconstitution de MOVIPREP ORANGE dans l’eau peut prendre 5 minutes. Elle peut être optimisée par addition en premier lieu de la poudre dans le récipient suivie par l’ajout d’eau. Le patient doit attendre la dissolution complète de la poudre avant de boire la solution.
Après reconstitution dans l’eau, MOVIPREP ORANGE peut être utilisé immédiatement ou peut être mis au frais avant utilisation.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
ANTONIO VIVALDISTRAAT 150
1083HP AMSTERDAM
PAYS-BAS
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 302 382 5 7 : 1 boite contenant 2 sacs avec pour chacun 1 sachet(s) papier polyéthylène basse densité (PEBD) aluminium de poudre A de 112 g et 1 sachet(s) papier polyéthylène basse densité (PEBD) aluminium de poudre B de 11 g.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Liste I.
ANSM - Mis à jour le : 27/03/2025
MOVIPREP ORANGE, poudre pour solution buvable
Macrogol 3350, sulfate de sodium anhydre, chlorure de sodium, chlorure de potassium
Acide ascorbique et ascorbate de sodium
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin ou votre pharmacien.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que MOVIPREP ORANGE, poudre pour solution buvable et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant de prendre MOVIPREP ORANGE, poudre pour solution buvable ?
3. Comment prendre MOVIPREP ORANGE, poudre pour solution buvable ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver MOVIPREP ORANGE, poudre pour solution buvable ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE MOVIPREP ORANGE, poudre pour solution buvable ET DANS QUELS CAS EST-IL UTILISE ?
Classe pharmacothérapeutique - code ATC : A06AD.
MOVIPREP ORANGE est un laxatif osmotique aromatisé à l’orange. La boîte contient quatre sachets : deux grands sachets (sachet A) et deux petits sachets (sachet B). Vous devez utiliser les quatre sachets pour un traitement.
MOVIPREP ORANGE est indiqué chez l’adulte dans le lavage intestinal préalablement à tout examen nécessitant un intestin propre (par exemple : exploration endoscopique ou radiologique).
MOVIPREP ORANGE agit en vidant vos intestins de leur contenu, vous devez donc vous attendre à des selles liquides.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT DE PRENDRE MOVIPREP ORANGE, poudre pour solution buvable ?
Ne prenez jamais MOVIPREP ORANGE, poudre pour solution buvable :
· Si vous êtes allergique (hypersensible) aux substances actives ou à l’un des autres composants contenus dans MOVIPREP ORANGE (mentionnés à la rubrique 6).
· Si vous souffrez d’une occlusion intestinale.
· Si vous souffrez d’une perforation intestinale.
· Si vous avez un trouble de la vidange gastrique.
· Si vous présentez une paralysie intestinale (apparaît souvent après une chirurgie abdominale).
· Si vous êtes atteints d’une phénylcétonurie (incapacité héréditaire à utiliser un acide aminé spécifique). MOVIPREP ORANGE est une source de phénylalanine.
· Si votre corps ne produit pas assez de glucose-6-phosphate déshydrogénase.
· Si vous êtes en situation de mégacôlon toxique (complication sévère de la colite aiguë).
Avertissements et précautions
Adressez-vous à votre médecin ou pharmacien avant de prendre MOVIPREP ORANGE, poudre pour solution buvable.
Si vous êtes fragiles ou souffrez de défaillance clinique sévère, vous devez être attentif à la liste des effets indésirables possibles listés à la rubrique 4. Contactez votre médecin ou pharmacien si vous êtes concerné.
Avant de prendre MOVIPREP ORANGE, prévenez votre médecin ou votre pharmacien si vous présentez un des troubles suivants :
· Une tendance à régurgiter les boissons, les aliments ou l’acide de l’estomac, ou si vous avez des troubles de déglutition (voir aussi MOVIPREP ORANGE, poudre pour solution buvable avec des aliments et boissons).
· Maladie rénale.
· Si vous souffrez d'insuffisance cardiaque, de graves problèmes rénaux ou prenez des médicaments pour la pression artérielle.
· Insuffisance cardiaque ou une maladie cardiaque comme une pression artérielle élevée, des battements de cœur irréguliers ou des palpitations.
· Maladie thyroïdienne.
· Déshydratation.
· Poussées sévères d’une maladie inflammatoire de l’intestin (maladie de Crohn ou rectocolite hémorragique).
· Si vous souffrez d'épilepsie ou avez des antécédents de convulsions.
MOVIPREP ORANGE ne doit pas être administré sans surveillance médicale chez les patients présentant des troubles de la vigilance.
Si vous ressentez soudainement une douleur abdominale ou êtes victime d’une hémorragie rectale tandis que vous prenez MOVIPREP ORANGE pour la préparation intestinale, contactez votre médecin ou demandez immédiatement un avis médical.
Si vous avez des vomissements (de sang) suivis de douleurs soudaines à la poitrine, au cou ou à l'abdomen, des difficultés à avaler ou à respirer en prenant MOVIPREP ORANGE, arrêtez le médicament et contactez rapidement votre médecin.
Enfants et adolescents
MOVIPREP ORANGE n’est pas recommandé chez les enfants de moins de 18 ans.
Autres médicaments et MOVIPREP ORANGE, poudre pour solution buvable
Informez votre médecin ou votre pharmacien si vous prenez, avez récemment pris ou pourriez prendre tout autre médicament.
Si vous prenez d’autres médicaments par voie orale (par exemple, une pilule contraceptive), vous ne devez pas les prendre une heure avant, pendant et une heure après l’ingestion de MOVIPREP ORANGE, car ils peuvent être éliminés plus rapidement du tractus digestif et ne plus exercer leur effet thérapeutique.
Si vous prenez des contraceptifs oraux, vous devrez peut-être utiliser des formes supplémentaires de contraception (par exemple des préservatifs) pour éviter une grossesse.
MOVIPREP ORANGE, poudre pour solution buvable avec des aliments et boissons
Ne prenez plus de nourriture solide à partir du moment où vous débutez la prise de MOVIPREP ORANGE jusqu’à la fin de l’examen.
Si vous avez recours à des épaississants pour faciliter l’ingestion des liquides, MOVIPREP ORANGE peut contrer l’effet de l’épaississant et l’empêcher d’agir.
Pendant la période où vous prenez MOVIPREP ORANGE, vous devez continuer à boire beaucoup de liquide. Le liquide contenu dans MOVIPREP ORANGE après reconstitution ne remplace pas votre apport hydrique habituel. Un apport hydrique suffisant doit être maintenu
Il n’y a pas de données sur l’utilisation de MOVIPREP ORANGE pendant la grossesse et l’allaitement. MOVIPREP ORANGE doit être utilisé uniquement si votre médecin considère que c’est essentiel.
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin ou votre pharmacien avant de prendre ce médicament.
Conduite de véhicules et utilisation de machines
MOVIPREP ORANGE n’affecte pas votre capacité à conduire ou à utiliser des machines.
MOVIPREP ORANGE, poudre pour solution buvable contient du sodium, du potassium et une source de phénylalanine
La totalité de la préparation contient 8,4 g de sodium (composant principal du sel de cuisine/table). (La préparation consiste en deux litres de MOVIPREP ORANGE). Ceci équivaut à 420% de la dose journalière maximale recommandée de sodium pour un adulte.
A prendre en compte chez les patients qui contrôlent leur apport alimentaire en sodium. Seule une partie du sodium (jusqu’à 2,6 g par préparation) est absorbée.
La totalité de la préparation contient 1,1 g de potassium. (La préparation consiste en deux litres de MOVIPREP ORANGE). A prendre en compte chez les patients insuffisants rénaux ou chez les patients contrôlant leur apport alimentaire en potassium.
Ce médicament contient une source de phénylalanine, qui peut être dangereux pour les sujets atteints de phénylcétonurie.
Si votre médecin vous a informé(e) d’une intolérance à certains sucres, contactez-le avant de prendre ce médicament.
3. COMMENT PRENDRE MOVIPREP ORANGE, poudre pour solution buvable ?
La dose recommandée est de 2 litres de solution à préparer de la manière suivante :
La boîte renferme deux sacs transparents et chaque sac contient deux sachets : un sachet A et un sachet B. Chaque paire de sachets (sachet A et sachet B) est à dissoudre dans de l’eau afin d’obtenir un litre de solution. L’ensemble permettra ainsi de reconstituer deux litres de solution MOVIPREP ORANGE.
Avant de prendre MOVIPREP ORANGE, lisez attentivement les instructions suivantes.
Vous devez savoir :
· Quand prendre MOVIPREP ORANGE ?
· Comment préparer MOVIPREP ORANGE ?
· Comment prendre MOVIPREP ORANGE ?
· Ce à quoi vous devez vous attendre avec MOVIPREP ORANGE
Quand prendre MOVIPREP ORANGE ?
Prenez toujours ce médicament comme décrit dans cette notice ou comme votre médecin vous l’a indiqué. Vérifiez avec votre médecin si vous n’êtes pas sûr. Votre traitement avec MOVIPREP ORANGE doit être complètement achevé avant l’examen.
Cette préparation peut être prise soit en deux fois, soit en prise unique comme décrit ci-après :
Pour les examens qui nécessitent de vous endormir (sous anesthésie générale) :
1. En deux fois : un litre de MOVIPREP ORANGE ingéré la veille au soir de l’examen et un litre de MOVIPREP ORANGE ingéré tôt dans la matinée le jour de l’examen. Assurez-vous que la prise de MOVIPREP ORANGE et de tout autre liquide clair soit arrêtée au moins deux heures avant le début de l’examen.
2. En prise unique : deux litres de MOVIPREP ORANGE ingérés la veille au soir de l’examen ou deux litres de MOVIPREP ORANGE le matin de l’examen. Assurez-vous que la prise de MOVIPREP ORANGE et de tout autre liquide clair soit arrêtée au moins deux heures avant le début de l’examen.
Pour les examens qui ne nécessitent pas de vous endormir (sans anesthésie générale) :
1. En deux fois : un litre de MOVIPREP ORANGE ingéré la veille au soir de l’examen et un litre de MOVIPREP ORANGE ingéré tôt dans la matinée le jour de l’examen. Assurez-vous que la prise de MOVIPREP ORANGE et de tout autre liquide clair soit arrêtée au moins une heure avant le début de l’examen.
2. En prise unique : deux litres de MOVIPREP ORANGE ingérés la veille au soir de l’examen ou deux litres de MOVIPREP ORANGE le matin de l’examen. Assurez-vous que la prise de MOVIPREP ORANGE soit arrêtée au moins deux heures avant le début de l’examen. Assurez-vous que la prise de tout autre liquide clair soit arrêtée au moins une heure avant le début de l’examen.
Important : Ne mangez pas d’aliments solides depuis le moment où vous prenez MOVIPREP ORANGE et jusqu’à la fin de l’examen.
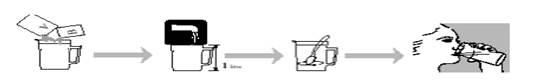
Comment préparer MOVIPREP ORANGE ?
· Ouvrir un sac transparent et retirer les sachets A et B.
· Verser à la fois 1 sachet A et 1 sachet B dans un récipient gradué pouvant contenir 1 litre.
· Compléter avec de l’eau jusqu’à la marque du 1 L du récipient. Il faut ensuite mélanger jusqu’à dissolution complète de la poudre (cela peut prendre jusqu’à 5 minutes).
Comment prendre MOVIPREP ORANGE ?
Cette solution reconstituée doit être bue sur une période d’une à deux heures. Il est conseillé de boire un verre de solution toutes les 10 ou 15 minutes.
Le moment venu, préparez et buvez le second litre de MOVIPREP ORANGE en utilisant les sachets A et B du sac restant.
Pendant la prise du traitement, il est recommandé de boire un litre supplémentaire de liquide clair afin de prévenir toute sensation de soif ou d’être déshydraté. De l’eau, de la soupe claire, du jus de fruit (sans pulpe), des boissons non alcoolisées, thé et/ou café (sans lait) peuvent être consommés. Les liquides clairs peuvent être pris au plus tard jusqu’à deux heures avant l’examen se déroulant sous anesthésie générale et jusqu’à une heure avant l’examen se déroulant sans anesthésie générale.
Ce à quoi vous devez vous attendre avec MOVIPREP ORANGE
Quand vous commencez à boire la préparation, il est important que vous restiez à proximité des toilettes. A un moment donné, vous commencerez à évacuer des selles plus ou moins liquides. Ceci est normal et indique que la préparation est en train d’agir. L’évacuation s’arrêtera peu de temps après avoir fini de boire la préparation.
Si vous suivez ces instructions, votre intestin sera propre et cela favorisera le succès de l’examen. Laissez suffisamment de temps s’écouler entre votre dernier verre de liquide et l’heure du rendez-vous au centre d’examen.
Si vous avez pris plus de MOVIPREP ORANGE, poudre pour solution buvable que vous n’auriez dû
Si vous prenez plus de MOVIPREP ORANGE que ce qui était requis, vous risquez de présenter une diarrhée excessive pouvant conduire à une déshydratation. Buvez alors une quantité importante de liquide, notamment des jus de fruits. Si vous êtes inquiet, contactez votre médecin ou votre pharmacien.
Si vous oubliez de prendre MOVIPREP ORANGE, poudre pour solution buvable
MOVIPREP ORANGE en une fois le matin de l’examen, il est important que vous ayez fini de prendre la totalité de la préparation MOVIPREP ORANGE au moins deux heures avant l’examen.
Si vous avez d’autres questions sur l’utilisation de ce médicament, contactez votre médecin ou votre pharmacien.
Si vous arrêtez de prendre MOVIPREP ORANGE, poudre pour solution buvable
Sans objet.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
La diarrhée est un effet attendu lors de l’utilisation de MOVIPREP ORANGE.
Si vous présentez un des effets indésirables suivants, arrêtez la prise de MOVIPREP ORANGE et contactez immédiatement votre médecin :
· Eruption cutanée (rash) ou démangeaison.
· Gonflement du visage, des chevilles ou d’autres parties de votre corps.
· Palpitations.
· Fatigue extrême.
· Essoufflement.
Ils sont les signes d’une réaction allergique sévère.
Arrêtez de prendre MOVIPREP ORANGE et contactez immédiatement un médecin si vous remarquez l'un des effets secondaires suivants :
· Convulsion.
Si vous ne présentez pas de selles dans les 6 heures suivant la première prise de MOVIPREP ORANGE, arrêtez les prises et contactez immédiatement votre médecin.
Autres effets indésirables rapportés :
Très fréquemment (pouvant affecter plus de 1 patient sur 10) : douleur abdominale, distension abdominale, fatigue, malaise général (sensation de ne pas se sentir bien), douleur anale, nausées et fièvre.
Fréquemment (pouvant affecter jusqu’à 1 patient sur 10) : sensation de faim, troubles du sommeil, vertiges, maux de tête, vomissements, indigestion, sensation de soif et frissons.
Peu fréquemment (pouvant affecter jusqu’à 1 patient sur 100) : inconfort, difficulté à avaler et modification des paramètres de la fonction hépatique.
Les effets indésirables suivants ont été parfois rapportés mais leur fréquence est inconnue car elle ne peut pas être estimée à partir des données disponibles : flatulences (gaz), augmentation transitoire de la pression artérielle, battements du cœur irréguliers ou palpitations, déshydratation, haut-le-cœur (pouvant aller jusqu’au vomissement), rupture œsophagienne due à des vomissements, très faibles taux de sodium dans le sang pouvant se compliquer de convulsions, et modification des taux d’électrolytes sanguins tels que diminution des bicarbonates, augmentation ou diminution du calcium, augmentation ou diminution du chlore, diminution du phosphate. Les taux de potassium et sodium dans le sang peuvent aussi diminuer.
Ces réactions ont lieu habituellement uniquement durant la prise du traitement. Si celles-ci persistent, consultez votre médecin.
Les réactions allergiques peuvent entraîner une éruption cutanée, des démangeaisons, des rougeurs de la peau et urticaire, des gonflements des mains, pieds ou chevilles, des maux de tête, des palpitations et un essoufflement.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet: https://signalement.social-sante.gouv.fr/
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER MOVIPREP ORANGE, poudre pour solution buvable ?
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur le conditionnement extérieur après ’’EXP’’. Les dates de péremption des différents sachets peuvent différer entre elles. La date de péremption fait référence au dernier jour de ce mois.
A conserver à une température ne dépassant pas 25°C.
Après reconstitution, à conserver dans un récipient fermé 24 heures à une température ne dépassant pas 25°C ou au réfrigérateur (entre 2° et 8°C).
Toute solution non utilisée dans le délai de 24 heures après la reconstitution devra être éliminée.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures permettront de protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient MOVIPREP ORANGE, poudre pour solution buvable
· Le sachet A contient les substances actives suivantes :
Macrogol 3350.................................................................................................................. 100 g
Sulfate de sodium anhydre............................................................................................. 7,500 g
Chlorure de sodium........................................................................................................ 2,691 g
Chlorure de potassium.................................................................................................... 1,015 g
· Le sachet B contient les substances actives suivantes :
Acide ascorbique........................................................................................................... 4,700 g
Ascorbate de sodium..................................................................................................... 5,900 g
· La concentration en électrolytes après dissolution d’un sachet A et d’un sachet B dans un litre d’eau :
Sodium.................................................... 181,6 mmol/L (dont au plus 56,2 mmol est absorbable)
Sulfate.................................................................................................................... 52,8 mmol/L
Chlorure.................................................................................................................. 59,8 mmol/L
Potassium.............................................................................................................. 14,2 mmol/L
Ascorbate............................................................................................................... 56,5 mmol/L
· Les autres composants sont :
Arôme orange (substances et préparations aromatisantes naturelles, maltodextrine, dextrose), aspartame (E951) et acésulfame potassium (E950) comme édulcorants. Pour plus d’informations, reportez-vous à la rubrique 2.
Qu’est-ce que MOVIPREP ORANGE, poudre pour solution buvable et contenu de l’emballage extérieur
Ce médicament se présente sous forme d’une boîte contenant deux sacs transparents qui contiennent chacun un sachet A et un sachet B. Un sachet A et un sachet B doivent être dissous ensemble dans un litre d’eau.
Il existe des conditionnements de 1, 10, 40, 80, 160 et 320 boîtes et une présentation hospitalière de 40 boîtes.
Toutes les présentations peuvent ne pas être commercialisées.
Titulaire de l’autorisation de mise sur le marché
ANTONIO VIVALDISTRAAT 150
1083HP AMSTERDAM
PAYS-BAS
Exploitant de l’autorisation de mise sur le marché
NORGINE SAS
23 RUE FRANCOIS JACOB
92500 RUEIL-MALMAISON
ANTONIO VIVALDISTRAAT 150
1083 HP AMSTERDAM
PAYS-BAS
ou
SOPHARTEX
21 RUE DU PRESSOIR
28500 VERNOUILLET
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Ce médicament est autorisé dans les Etats membres de l'Espace Economique Européen et au Royaume-Uni (Irlande du Nord) sous les noms suivants : Conformément à la réglementation en vigueur.
[À compléter ultérieurement par le titulaire]
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).
Les informations suivantes sont exclusivement destinées à des professionnels de santé.
MOVIPREP ORANGE doit être administré avec précaution chez les patients fragiles ou ceux présentant des troubles cliniques sévères tels que :
· Troubles de la déglutition ou tendance à l’inhalation ou à la régurgitation,
· Troubles de la vigilance,
· Insuffisance rénale sévère (clairance de la créatinine < 30 mL/min),
· Insuffisance cardiaque (NYHA de grade III ou IV),
· Patients à risque d’arythmie ; par exemple ceux traités pour une maladie cardiovasculaire ou ceux avec une maladie thyroïdienne,
· Déshydratation,
· Poussées sévères de maladie inflammatoire intestinale.
Une déshydratation ou des anomalies du bilan électrolytique doivent être corrigées avant l’utilisation de MOVIPREP ORANGE.
Les patients présentant des troubles de la vigilance, les patients sujets aux inhalations ou régurgitations doivent être surveillés attentivement durant l’administration et plus particulièrement encore si celle-ci se fait par sonde naso-gastrique.
MOVIPREP ORANGE ne doit pas être administré à des patients inconscients.