Dernière mise à jour le 02/02/2026
NICORETTESKIN 10 mg/16 heures, dispositif transdermique
Indications thérapeutiques
NICORETTESKIN 10 mg/16 heures, dispositif transdermique appartient à la gamme de médicaments destinés à vous aider à arrêter de fumer.
Ce médicament est indiqué dans le traitement de la dépendance tabagique afin de soulager les symptômes du sevrage nicotinique chez les sujets désireux d'arrêter de fumer.
Présentations
> 7 sachet(s) papier polytéréphtalate (PET) aluminium copolymère d'acrilonitrile ou copolymère de cyclooléfines coextrudé de 1 dispositif(s)
Code CIP : 396 503-4 ou 34009 396 503 4 0
Déclaration de commercialisation : 17/10/2018
Cette présentation est agréée aux collectivités
- Prix hors honoraire de dispensation : 5,82 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 6,84 €
- Taux de remboursement :65%
> 28 sachet(s) papier polytéréphtalate (PET) aluminium copolymère d'acrilonitrile ou copolymère de cyclooléfines coextrudé de 1 dispositif(s)
Code CIP : 396 505-7 ou 34009 396 505 7 9
Déclaration de commercialisation : 01/09/2010
Cette présentation est agréée aux collectivités
- Prix hors honoraire de dispensation : 23,09 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 24,11 €
- Taux de remboursement :65%
Documents de bon usage du médicament
- Arrêt de la consommation de tabac : du dépistage individuel au maintien de l’abstinence en premier recours
Auteur : Haute autorité de santé
Type : Recommandation de bonne pratique
Date de mise à jour :Novembre 2014
Service médical rendu (SMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Important | Avis du 25/07/2018 | Inscription (CT) | La Commission considère que le service médical rendu par cette spécialité est important dans l’indication de l’AMM. |
| Important | Avis du 24/01/2018 | Inscription (CT) | Le service médical rendu de ces spécialités est important dans les indications de l'AMM. |
| Important | Avis du 05/05/2010 | Inscription (CT) | Le service médical rendu par ces spécialités est important dans les indications de l’AMM. |
Amélioration du service médical rendu (ASMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprés de la HAS (plus d'informations dans l'aide). Les avis et synthéses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur de l'ASMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| V (Inexistant) | Avis du 25/07/2018 | Inscription (CT) | Ces spécialités n’apportent pas d’amélioration du service médical rendu (ASMR V) dans la stratégie du sevrage tabagique. |
| V (Inexistant) | Avis du 24/01/2018 | Inscription (CT) | Ces spécialités n’apportent pas d’amélioration du service médical rendu (ASMR V) dans la stratégie du sevrage tabagique. |
| V (Inexistant) | Avis du 05/05/2010 | Inscription (CT) | Absence d’amélioration du service médical rendu (ASMR V). |
ANSM - Mis à jour le : 06/10/2025
NICORETTESKIN 10 mg/16 heures, dispositif transdermique
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Nicotine............................................................................................................................. 15,75 mg
Pour un dispositif transdermique de 9 cm2.
Un dispositif transdermique délivre 10 mg de nicotine pendant 16 heures.
Pour la liste complète des excipients, voir rubrique 6.1.
Dispositif transdermique semi-transparent, beige, constitué d'une couche externe, d'une couche source de nicotine, d'une couche adhésive et d'une feuille de protection détachable siliconée et aluminisée.
4.1. Indications thérapeutiques
4.2. Posologie et mode d'administration
Réservé à l'adulte et à l'enfant de plus de 15 ans.
Posologie
Ce médicament peut être utilisé en monothérapie ou en association avec les formes orales de substituts nicotiniques telles que les gommes à mâcher médicamenteuses NICORETTE 2 mg, l'inhaleur NICORETTE 10 mg, les comprimés à sucer NICORETTE 2 mg, les comprimés sublinguaux NICORETTE MICROTAB 2 mg ou NICORETTESPRAY 1 mg/dose, solution pour pulvérisation buccale.
En cas d'association, il est conseillé aux patients de prendre un avis auprès d'un professionnel de santé.
Les dispositifs transdermiques NICORETTESKIN sont disponibles sous trois dosages: 10 mg/16 heures, 15 mg/16 heures et 25 mg/16 heures.
Monothérapie
Le traitement imite les fluctuations de nicotine durant la journée chez le fumeur, sans administration de nicotine la nuit. L'administration de nicotine la journée par le dispositif transdermique ne provoque pas les troubles du sommeil parfois constatés lors d'une administration de nicotine pendant la nuit.
· Il est recommandé aux fumeurs fortement dépendants (score au test de Fagerström ≥ 7) de commencer avec le dispositif transdermique 25 mg/16 heures. Un dispositif transdermique sera appliqué quotidiennement le matin et retiré le soir, pendant 8 semaines.
Une réduction des doses est ensuite initiée. Un dispositif transdermique de 15 mg/16 heures est utilisé quotidiennement pendant 2 semaines, puis un dispositif transdermique 10 mg/16 heures pendant également 2 semaines.
· Il est recommandé aux fumeurs moyennement dépendants (score au test de Fagerström 5 et 6), de commencer par l'étape 2 avec le dispositif transdermique 15 mg/16 heures.
o Si l'arrêt du tabac est obtenu la première semaine avec le dosage 15 mg/16 heures, un dispositif transdermique sera appliqué quotidiennement le matin et retiré le soir, pendant 8 semaines puis un dispositif transdermique de 10 mg/16 heures sera appliqué pendant 4 semaines.
o Si après 1-7 jours d'utilisation du dispositif transdermique 15 mg/16 heures, les signes de manque persistent, il est recommandé d'utiliser un dispositif transdermique 25 mg/16 heures et de poursuivre le traitement selon le schéma des patients fortement dépendants (voir « fumeurs fortement dépendants »).
· Il est recommandé aux fumeurs faiblement dépendants (score au test de Fagerström 3 et 4) de commencer par l'étape 2 avec le dispositif transdermique 15 mg/16 heures appliqué quotidiennement pendant 8 semaines et de poursuivre par un dispositif transdermique 10 mg/16 heures appliqué pendant 4 semaines.
|
Fumeurs fortement dépendants |
Fumeurs moyennement dépendants |
Fumeurs faiblement dépendants |
|||||||
|
(test de Fagerström ≥ 7) |
(test de Fagerström 5-6) |
(test de Fagerström 3-4) |
|||||||
|
Etape 1 |
NICORETTESKIN 25 mg/16 heures |
8 premières semaines |
|||||||
|
Etape 2 |
NICORETTESKIN 15 mg/16 heures |
2 semaines suivantes |
Etape 2 |
NICORETTESKIN 15 mg/16heures |
8 premières semaines (NB: si le tabagisme persiste ou s'il y a une forte consommation de formes orales de substituts, se reporter dès la première semaine sur l'étape 1 du schéma « fumeurs fortement dépendants ») |
Etape 2 |
NICORETTESKIN 15 mg/16 heures |
8 premières semaines |
|
|
Etape 3 |
NICORETTESKIN 10 mg/16 heures |
2 dernières semaines |
Etape 3 |
NICORETTESKIN 10 mg/16 heures |
4 semaines suivantes |
Etape 3 |
NICORETTESKIN 10 mg/16 heures |
4 semaines suivantes |
|
Dans l'étude CEASE, étude multicentrique, randomisée, contrôlée versus placebo, réalisée en double aveugle auprès de 3575 fumeurs fumant plus de 14 cigarettes par jour (score moyen au test de Fagerström de 5,6 ± 2,1), il a été demontré un effet dose significatif avec des taux de succès à 1 an de 9,9 % (placebo), 12,7 % (patch 15 mg) et 15,7 % (patch 25 mg) (placebo vs 15 mg, p < 0,05; 25 mg vs 15 mg, p < 0,03; 25 mg vs placebo, p < 0,001). Le bénéfice d'utilisation de NICORETTESKIN 25 mg/16 heures, comparé à NICORETTESKIN 15 mg /16 heures, a été une augmentation de 23 % d'abstinence à 1 an.
L'ensemble du traitement doit durer au moins 3 mois.
La durée du traitement peut cependant varier en fonction de la réponse individuelle.
Il est recommandé de ne pas utiliser les dispositifs transdermiques au-delà de 6 mois. Certains "ex-fumeurs" peuvent cependant nécessiter une durée de traitement plus longue afin d'éviter la rechute.
En association :
Les fumeurs fortement dépendants qui, malgré une monothérapie bien conduite, continuent de ressentir des envies irrépressibles de fumer ou les personnes qui ont échoué en monothérapie peuvent associer les dispositifs transdermiques NICORETTESKIN avec une forme orale agissant plus rapidement sur les symptômes du sevrage: les gommes à mâcher médicamenteuses NICORETTE 2 mg, l'inhaleur NICORETTE 10 mg, les comprimés à sucer NICORETTE 2 mg, les comprimés sublinguaux NICORETTE MICROTAB 2 mg ou NICORETTESPRAY 1 mg/dose, solution pour pulvérisation buccale.
L'association des dispositifs transdermiques avec les formes orales NICORETTE a donné des résultats supérieurs à ceux obtenus pour chacun des traitements pris séparément.
Les fumeurs doivent suivre les mêmes posologies recommandées pour le dispositif transdermique et pour la forme orale choisie qu’en monothérapie. Pour la posologie de la forme orale choisie, le fumeur doit se reporter à l’information produit de chaque forme orale.
En cas d’association, les fumeurs ne doivent utiliser qu’une forme orale à la fois sur une période de 24 heures
Mode d’administration
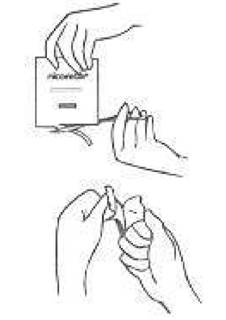
1. Se laver les mains avant d'appliquer le dispositif transdermique.
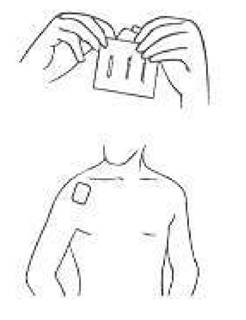
2. Ouvrir le sachet avec des ciseaux comme indiqué. Appliquer le dispositif transdermique immédiatement après ouverture sur une surface de peau sèche, sans lésion cutanée et où la pilosité est rare (hanche, partie supérieure du bras ou poitrine).
3. Retirer autant que possible une partie de la feuille en aluminium. Eviter le plus possible de toucher la surface collante du dispositif transdermique avec les doigts.
4. Appliquer la partie collante avec les doigts et retirer la partie restante de feuille aluminium.
5. Presser fermement le dispositif transdermique sur la peau avec les doigts.
6. Frotter fermement avec les doigts sur les bords pour que le dispositif transdermique colle correctement.
Le dispositif transdermique doit être appliqué sur une partie saine de la peau le matin au lever, et retiré le soir au coucher, soit environ 16 heures plus tard.
Le site d'application devra être changé chaque jour en évitant si possible de replacer le dispositif transdermique au même endroit pendant quelques jours.
Au cours de la manipulation, éviter le contact avec les yeux, le nez et se laver les mains après application.
· Hypersensibilité à la substance active ou à l’un des excipients mentionnés à la rubrique 6.1.
· Non-fumeur ou fumeur occasionnel.
· Affection cutanée pouvant gêner l'utilisation d'un dispositif transdermique.
4.4. Mises en garde spéciales et précautions d'emploi
Le dispositif NICORETTESKIN ne doit pas être utilisé par les non-fumeurs.
· Les fumeurs dépendants présentant un antécédent récent d’infarctus du myocarde, d’angor instable ou s’aggravant, notamment d'angor de Prinzmetal, d'arythmies cardiaques sévères, d'hypertensions instables ou d'accident vasculaire cérébral doivent être encouragés à arrêter de fumer sans traitement de substitution (une aide psychologique par exemple). En cas d'échec, le dispositif NICORETTESKIN peut être envisagé. Cependant, en raison du nombre limité de données sur ce groupe de patients, cela ne peut intervenir que sous surveillance médicale étroite.
· Diabète : il est recommandé aux patients souffrant de diabète de surveiller plus étroitement leur glycémie lorsqu'ils arrêtent de fumer et qu'une thérapie de remplacement de la nicotine est mise en place car la libération de catécholamines induite par la réduction des apports de nicotine peut affecter le métabolisme des glucides.
· Réactions allergiques : sensibilité aux œdèmes de Quincke et à l'urticaire.
Une évaluation du rapport bénéfice/risque doit être faite par un professionnel de santé qualifié pour les patients présentant les pathologies suivantes :
· Insuffisance rénale et hépatique : utiliser avec précaution chez les patients souffrant d'insuffisance hépatique modérée à sévère et/ou d'insuffisance rénale sévère car la clairance de la nicotine et de ses métabolites peut être réduite, ce qui peut augmenter le risque d'effets indésirables.
· Phéochromocytome et hyperthyroïdie non contrôlée : utiliser avec précaution chez les patients souffrant d'hyperthyroïdie non contrôlée ou de phéochromocytome car la nicotine provoque la libération de catécholamines.
· Troubles gastro-intestinaux : chez les patients souffrant d'œsophagite ou d'ulcères gastriques ou peptiques, l'ingestion de nicotine peut exacerber les symptômes, et les traitements oraux de remplacement de la nicotine doivent être utilisés avec précaution.
· Convulsions : utiliser avec précaution chez les sujets sous traitement anticonvulsivant ou ayant des antécédents d'épilepsie car des cas de convulsions ont été rapportés en association avec la nicotine (voir rubrique 4.8).
Danger pour les jeunes enfants : les doses de nicotine tolérées par les fumeurs adultes et adolescents peuvent provoquer une intoxication sévère, voire mortelle, chez les jeunes enfants. Ne pas laisser les produits contenant de la nicotine à un endroit où ils pourraient être utilisés inadéquatement, manipulés ou ingérés par des enfants (voir rubrique 4.9).
Transfert de dépendance : un transfert de dépendance peut apparaître, mais à la fois moins nocif et plus facile à combattre que la dépendance au tabac.
Arrêt du tabac : les hydrocarbures aromatiques polycycliques présents dans la fumée du tabac provoquent le métabolisme des médicaments métabolisés par le CYP 1A2 (et éventuellement par le CYP 1A1). L'arrêt du tabac peut provoquer le ralentissement du métabolisme de ces médicaments, et par conséquent une augmentation de leur concentration dans le sang. Cela peut avoir une importance clinique pour les produits dont la marge thérapeutique est étroite, par exemple la théophylline, la tacrine, la clozapine et le ropinirole.
Le dispositif doit être retiré avant de pratiquer une IRM pour prévenir les risques de brûlures.
Après utilisation, il est recommandé de plier le dispositif transdermique sur lui-même avant de le jeter.
Précautions d'emploi
En cas de réaction cutanée sévère ou persistante, il est recommandé d'arrêter le traitement et d'utiliser une autre forme pharmaceutique.
En cas d’association de NICORETTESKIN avec une forme orale, les mises en garde et précautions d’emploi sont celles de chaque traitement utilisé séparément.
Pour les mises en garde et précautions d’emploi des formes orales, se référer au Résumé des Caractéristiques du Produit (RCP) de chaque médicament.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Associations à prendre en compte
+ Médicaments à risque lors du sevrage tabagique (clozapine, méthadone, ropinirole, théophylline)
Risque de surdosage lors du remplacement du tabac par le traitement substitutif.
4.6. Fertilité, grossesse et allaitement
Grossesse
2. Le tabagisme chez la femme enceinte peut être à l'origine d'un retard de croissance intra-utérin, de mort fœtale in utero, d'une prématurité, d'une hypotrophie néonatale, qui semblent corrélés à l'importance de l'imprégnation tabagique ainsi qu'à la période de la grossesse car ces effets s'observent lorsque l'imprégnation tabagique se poursuit pendant le 3ème trimestre.
La nicotine apportée par les traitements de substitution n'est pas dépourvue d'effets délétères sur le fœtus, comme en témoigne le retentissement hémodynamique observé. On ne dispose cependant d'aucune étude épidémiologique précisant l'impact réel de la nicotine apportée par les traitements de substitution sur le fœtus ou le nouveau-né.
Par conséquent,
· chez la femme enceinte, il convient de toujours recommander un arrêt complet de la consommation de tabac, sans traitement de substitution à la nicotine, car l’effet sur la circulation sanguine est dose-dépendant et que la nicotine passe au niveau du fœtus et affecte ses mouvements respiratoires et sa circulation.
· en cas d'échec face à une patiente fortement dépendante, le sevrage tabagique par ce médicament est possible. En effet, le risque encouru pour le fœtus, en cas de poursuite du tabagisme durant la grossesse, est vraisemblablement supérieur à celui attendu lors d'un traitement de substitution nicotinique, puisque se surajoute avec le tabac l'exposition aux hydrocarbures polycycliques et à l'oxyde de carbone, et puisque l'exposition à la nicotine apportée par le traitement de substitution est inférieure ou n'est pas supérieure à celle liée à la consommation tabagique.
L'objectif est de parvenir à l'arrêt complet du tabac, voire des traitements de substitution, avant le 3ème trimestre de la grossesse. L'arrêt du tabac, avec ou sans traitement de substitution, ne doit pas s'envisager de façon isolée mais s'inscrire dans le cadre d'une prise en charge globale, prenant en compte le contexte psycho-social et les autres dépendances éventuellement associées. Il peut être souhaitable de faire appel à une consultation spécialisée dans le sevrage tabagique.
En cas d'échec partiel ou complet du sevrage, la poursuite du traitement par un substitut nicotinique après le 6ème mois de grossesse ne peut s'envisager qu'au cas par cas. Il convient de garder présent à l'esprit les effets propres de la nicotine, qui pourraient retentir sur le fœtus, notamment lorsqu'il est proche du terme.
Allaitement
La nicotine passe librement dans le lait maternel dans des quantités pouvant affecter l’enfant même à des doses thérapeutiques.
NICORETTESKIN doit donc être évité pendant l’allaitement.
Lorsque le sevrage tabagique a échoué, l’utilisation des patchs NICORETTESKIN, par une femme allaitante fumeuse devra seulement être initiée sur avis médical.
En cas de dépendance tabagique sévère, le recours à l’allaitement artificiel doit être envisagé chaque fois que possible.
Compte-tenu de la constance des concentrations avec cette forme de substitution, l’utilisation des formes orales doit être préférée à celle des dispositifs transdermiques.
Fertilité
Chez les femmes, le tabagisme retarde les délais de conception, diminue les taux de réussite de fécondation in-vitro, et augmente significativement le risque d’infertilité.
Chez les hommes, le tabagisme réduit la production de spermatozoïdes, augmente le stress oxydatif, et l’altération de l’ADN. Les spermatozoïdes des fumeurs ont des capacités de fécondation réduite.
La contribution spécifique de la nicotine sur ces effets chez l’être humain n’est pas connue.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
NICORETTESKIN n’a aucun effet ou un effet négligeable sur l’aptitude à conduire des véhicules et à utiliser des machines.
Effets liés à l’arrêt du tabac
Les sujets dont les habitudes de consommation de tabac sont modifiées, de quelque façon que ce soit, sont susceptibles de souffrir d'un syndrome de sevrage nicotinique associé, qui comprend un ou plusieurs effets émotionnels ou cognitifs parmi les suivants : dysphorie ou humeur dépressive ; insomnie ; irritabilité, frustration ou colère ; anxiété ; problèmes de concentration, agitation ou impatience. Des effets physiques peuvent également se manifester : baisse de la fréquence cardiaque , augmentation de l'appétit ou prise de poids, étourdissements ou symptômes de présyncope, toux, constipation, ulcération buccale, saignements gingivaux ou rhinopharyngite. De plus, le besoin de nicotine associé à l'envie irrésistible de fumer est également reconnu comme étant un symptôme cliniquement significatif.
Effets indésirables
Ces effets sont principalement dose-dépendants et apparaissent au début du traitement.
Des réactions allergiques (dont des symptômes d’anaphylaxie) surviennent rarement au cours de l’utilisation des dispositifs transdermiques NICORETTESKIN.
Environ 20% des utilisateurs présentent des réactions cutanées locales légères au cours des premières semaines de traitement.
Les effets indésirables suivants ont été rapportés lors d’essais cliniques et dans le cadre de la surveillance post-commercialisation et sont présentés dans le tableau ci-dessous selon les classes de systèmes d’organes. Les fréquences sont présentées selon la convention suivante :
Très fréquent ≥ 1/10
Fréquent ≥ 1/100 et < 1/10
Peu fréquent ≥ 1/1 000 et < 1/100
Rare ≥ 1/10 000 et < 1/1 000
Très rare < 1/10 000
Fréquence indéterminée (ne pouvant être estimée sur la base des données disponibles)
Les effets indésirables sont classés par fréquence établie sur 1) l’incidence lors d’essais cliniques ou lors d’études épidémiologiques, si disponibles, ou 2) quand l’incidence ne peut être estimée la fréquence est dite « indéterminée ».
|
Classe de systèmes d’organes |
|
|
Catégories de fréquence |
Terminologie |
|
Affections cardiaques |
|
|
Peu fréquent |
Palpitations |
|
Peu fréquent |
Tachycardie |
|
Très rare |
Fibrillation atriale réversible |
|
Affections gastro-intestinales |
|
|
Fréquence indéterminée |
Inconfort gastro-intestinal |
|
Fréquent |
Nausée |
|
Fréquent |
Vomissements |
|
Fréquent |
Troubles digestifs |
|
Troubles généraux et anomalies au site d’administration |
|
|
Peu fréquent |
Asthénie |
|
Peu fréquent |
Douleur et gêne thoracique |
|
Peu fréquent |
Malaise |
|
Peu fréquent |
Réactions au site d’application |
|
Affections du système immunitaire |
|
|
Fréquence indéterminée |
Réaction anaphylactique |
|
Peu fréquent |
Hypersensibilité |
|
Affections musculo-squelettiques et du tissu conjonctif |
|
|
Peu fréquent |
Myalgie |
|
Peu fréquent |
Fatigue |
|
Affections psychiatriques |
|
|
Peu fréquent |
Rêves anormaux |
|
Affections respiratoires, thoraciques et médiastinales |
|
|
Peu fréquent |
Dyspnée |
|
Affections de la peau et du tissu sous-cutané |
|
|
Fréquence indéterminée |
Angioœdeme |
|
Fréquent |
Erythème |
|
Peu fréquent |
Hyperhidrose |
|
Fréquent |
Rash |
|
Fréquent |
Urticaire |
|
Très fréquent |
Prurit |
|
Affections vasculaires |
|
|
Peu fréquent |
Flush |
|
Peu fréquent |
Hypertension |
|
Affections du système nerveux |
|
|
Fréquent |
Céphalées |
|
Peu fréquent |
Paresthésie* |
|
Fréquent |
Etourdissements |
|
Fréquence indéterminée |
Convulsions** |
|
* Pouvant diffuser au-delà du site d’application. Cet effet est en grande majorité modéré et régresse spontanément et rapidement après retrait du dispositif. ** Des cas de convulsions ont été rapportés chez des sujets prenant un traitement anticonvulsivant ou ayant des antécédents d'épilepsie. |
|
Cependant, certains symptômes, notamment des étourdissements, des céphalées et une insomnie peuvent être associés au syndrome du sevrage tabagique. Une augmentation de la fréquence d'aphtes buccaux peut être observée après l'arrêt du tabagisme, mais la relation de causalité n'est pas clairement établie.
Les effets indésirables survenant lors de l’association de NICORETTESKIN avec une forme orale de substitut nicotinique ne diffèrent de ceux de chaque traitement seul qu’en termes d’effets indésirables locaux liés aux formes pharmaceutiques. La fréquence de ces effets indésirables est comparable à celle mentionnée dans le RCP de chaque spécialité respective.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr.
La toxicité aiguë ou chronique de la nicotine chez l’homme dépend essentiellement du mode et de la voie d’administration.
Cette toxicité dépend aussi de la tolérance du patient à la nicotine qui peut être différente entre fumeurs et non-fumeurs.
La dose létale minimale de la nicotine serait de 40 à 60 mg chez l’adulte.
Les doses de nicotine tolérées par les sujets fumeurs lors du traitement peuvent entraîner une intoxication aiguë pouvant être fatale chez les jeunes enfants. Toute suspicion d’intoxication à la nicotine chez un enfant doit être considérée comme une urgence médicale et traitée immédiatement.
Les symptômes de surdosage sont ceux d'une intoxication aiguë à la nicotine incluant nausées, vomissements, hyper salivation, douleurs abdominales, diarrhée, sueurs, céphalées, étourdissement, diminution de l'acuité auditive et faiblesse générale. A doses élevées, peuvent apparaître une hypotension, un pouls faible et irrégulier, une gêne respiratoire, une prostration, un collapsus cardiovasculaire et des convulsions.
Conduite à tenir en cas de surdosage :
L'administration de nicotine doit être interrompue immédiatement et un traitement symptomatique sera instauré.
Retirer le patch et rincer le site d’application avec de l’eau.
Ventilation assistée et oxygénothérapie seront entreprises si nécessaire.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
La nicotine est un agoniste des récepteurs nicotiniques de l’acétylcholine présents dans le système nerveux central et le système nerveux périphérique.
L'arrêt brutal de la consommation de tabac après un usage journalier et prolongé entraîne un syndrome de sevrage comprenant au moins quatre des symptômes suivants : dysphorie ou humeur dépressive, insomnie, irritabilité, sentiment de frustration ou de colère, anxiété, difficulté de concentration, agitation ou impatience, ralentissement du rythme cardiaque, augmentation de l'appétit, augmentation du poids. La sensation du besoin impérieux de nicotine est considérée comme un symptôme clinique à part entière du syndrome de sevrage.
Les études cliniques ont montré que les produits de substitution nicotinique peuvent aider les fumeurs à s'abstenir de fumer ou à réduire leur consommation de tabac en diminuant les symptômes de sevrage.
Les effets néfastes de la poursuite de l'intoxication tabagique chez les patients coronariens et/ou des patients ayant des antécédents d'accident vasculaire cérébral ont été clairement démontrés. Des études réalisées chez ces patients ont démontré l'absence d'effet délétère des substituts nicotiniques.
5.2. Propriétés pharmacocinétiques
Il est exprimé sur tous les dispositifs transdermiques, la quantité moyenne de nicotine libérée sur 16 heures.
La nicotine est libérée par le dispositif transdermique et absorbée à travers la peau. La vasodilatation liée à une température ambiante élevée et à l’exercice physique entraîne une augmentation de l’absorption, tandis que la vasoconstriction liée aux médicaments vasoconstricteurs entraîne une diminution de l’absorption.
Les pics moyens de concentrations plasmatiques calculées sont compris dans les mêmes fourchettes de valeurs que celles effectivement mesurées, à savoir 11 ng/ml pour le patch de 10 mg et 24 ng/ml pour celui de 25 mg. L'interpolation donne une valeur de 15 ng/ml pour le patch de 15 mg.
La concentration plasmatique maximale est atteinte environ 9 heures (tmax) après administration de la dose. Le pic plasmatique est atteint dans l'après-midi ou la soirée lorsque le risque de rechute est le plus élevé.
Les concentrations plasmatiques de nicotine sont proportionnelles aux trois dosages des patchs.
En cas de dosage multiple (c’est-à-dire un dispositif transdermique porté pendant 16 heures toutes les 24 heures), il n'y a pas d'accumulation de nicotine dans le corps, car l’application pendant 16 heures permet à la concentration plasmatique de nicotine de retourner à la valeur de base avant le prochain intervalle de dose.
La biodisponibilité de la nicotine absorbée est proche de 100%.
Distribution
Le volume de distribution de la nicotine après administration I.V. est d'environ 2 à 3 L/kg.
La liaison de la nicotine aux protéines plasmatiques est inférieure à 5 %, les modifications de la liaison de la nicotine causées par la prise éventuelle de médicaments concomitants ou l'altération des protéines plasmatiques due à des états pathologiques, n'auront vraisemblablement pas d'effet significatif sur la cinétique de la nicotine.
Biotransformation
La principale voie d'élimination de la nicotine est hépatique. Deux voies marginales d’élimination, le cerveau et les poumons participent également au métabolisme de la nicotine. Plus de 20 métabolites de la nicotine ont été identifiés. Ils sont tous considérés comme moins actifs que le composé parent.
La cotinine, principal métabolite de la nicotine dans le plasma, a une demi-vie de 14 à 20 heures.
Elimination
La clairance plasmatique moyenne est d’environ 66,6 à 90,0 litres par heure et la demi-vie d’élimination est d’environ 2 à 3 heures.
Les principaux métabolites urinaires de la nicotine sont la cotinine (10-12 % de la dose) et la trans-3-hydroxycotinine (28-37 % de la dose). Environ 10-15 % de la nicotine est éliminée inchangée dans les urines. Ce taux peut augmenter jusqu’à 23% en cas de filtration glomérulaire importante ou d’acidification des urines (pH <5).
Populations spécifiques
Insuffisance rénale
Une diminution progressive de la clairance totale et non-rénale de la nicotine est observée en fonction de la sévérité de l’insuffisance rénale. Chez les sujets insuffisants rénaux sévères, la clairance de la nicotine est en moyenne réduite de 50 % comparativement aux sujets normo-rénaux. Chez les sujets hémodialysés, une surexposition systémique très marquée en nicotine est observée. En effet, les concentrations plasmatiques en nicotine sont multipliées par 4 à 5 (voir rubrique 4.4).
Insuffisance hépatique
Chez les fumeurs présentant une insuffisance hépatique légère (score Child-Pugh 5), les propriétés pharmacocinétiques de la nicotine ne sont pas affectées. Cependant chez les fumeurs présentant une insuffisance hépatique modérée (score Child-Pugh 7), les clairances totales et non rénales sont réduites de 40-50% en moyenne, ce qui se traduit par une exposition systémique doublée en nicotine chez ces sujets.
Il n’y a pas de donnée chez les fumeurs présentant une insuffisance hépatique sévère (score de Child-Pugh supérieur à 7).
Sujets âgés
Chez les sujets âgés entre 65 et 76 ans, une diminution statistiquement significative de la clairance totale (-23%), du volume de distribution à l’état stationnaire (-17%) de la nicotine et de la clairance rénale de la cotinine (-18%) a été observée comparativement aux adultes plus jeunes. Cependant, l’augmentation de l’exposition systémique en nicotine qui en résulte est modérée (entre 20 et 25%).
5.3. Données de sécurité préclinique
Les essais de génotoxicité in vitro sur la nicotine ont principalement produit des résultats négatifs. Des résultats contradictoires existent dans les essais aux concentrations élevées de nicotine.
Les essais de génotoxicité in vivo ont donné des résultats négatifs.
Les expériences sur les animaux indiquent que l'exposition à la nicotine entraîne un poids réduit à la naissance, une diminution de la taille des portées et une baisse du taux de survie de la progéniture.
Les résultats des essais de carcinogénèse ne montrent pas clairement d'effet oncogène de la nicotine.
Matrice Acrylate
Solution adhésive de copolymère acrylique, hydroxyde de potassium, croscarmellose sodique, acétylacétonate d’aluminium.
Feuille de protection détachable
Pellicule de téréphthalate de polyéthylène (PET) aluminisée sur 1 face et siliconée sur les 2 faces.
Chaque dispositif transdermique est emballé dans un sachet-dose laminé thermoscellé constitué soit de papier, de PET, d’aluminium et d’un copolymère acrylonitrile, soit de papier, de PET, d’aluminium et de copolymère cyclo-oléfine coextrudé.
3 ans.
6.4. Précautions particulières de conservation
A conserver à une température ne dépassant pas 25°C.
6.5. Nature et contenu de l'emballage extérieur
Dispositif transdermique en sachet (Papier/PET/Aluminium/Copolymère acrylonitrile ou copolymère cyclo-oléfine coextrudé) ; boîte de 7, 14 ou 28.
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
41 rue Camille Desmoulins
92130 ISSY-LES-MOULINEAUX
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· CIP 34009 396 503 4 0 : dispositif transdermique en sachet (Papier/PET/Aluminium/ Copolymère acrylonitrile ou copolymère cyclo-oléfine coextrudé). Boîte de 7.
· CIP 34009 396 504 0 1 : dispositif transdermique en sachet (Papier/PET /Aluminium/ Copolymère acrylonitrile ou copolymère cyclo-oléfine coextrudé). Boîte de 14.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Médicament non soumis à prescription médicale.
ANSM - Mis à jour le : 06/10/2025
NICORETTESKIN 10 mg/16 heures, dispositif transdermique
Nicotine
Vous devez toujours utiliser ce médicament en suivant scrupuleusement les informations fournies dans cette notice ou par votre médecin, ou votre pharmacien.
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Adressez-vous à votre pharmacien pour tout conseil ou information.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
· Vous devez vous adresser à votre médecin si vous ne ressentez aucune amélioration ou si vous vous sentez moins bien.
1. Qu'est-ce que NICORETTESKIN 10 mg/16 heures, dispositif transdermique et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d'utiliser NICORETTESKIN 10 mg/16 heures, dispositif transdermique ?
3. Comment utiliser NICORETTESKIN 10 mg/16 heures, dispositif transdermique ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver NICORETTESKIN 10 mg/16 heures, dispositif transdermique ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE NICORETTESKIN 10 mg/16 heures, dispositif transdermique ET DANS QUELS CAS EST-IL UTILISE ?
NICORETTESKIN 10 mg/16 heures, dispositif transdermique appartient à la gamme de médicaments destinés à vous aider à arrêter de fumer.
Ce médicament est indiqué dans le traitement de la dépendance tabagique afin de soulager les symptômes du sevrage nicotinique chez les sujets désireux d'arrêter de fumer.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER NICORETTESKIN 10 mg/16 heures, dispositif transdermique ?
N’utilisez jamais NICORETTESKIN 10 mg/16 heures, dispositif transdermique :
· si vous êtes allergique à la nicotine ou à l'un des autres composants contenus dans ce médicament, mentionnés à la rubrique 6.
· si vous ne fumez pas ou si vous êtes un fumeur occasionnel,
· si vous souffrez d'une affection de la peau pouvant gêner l'utilisation d'un système transdermique.
EN CAS DE DOUTE, IL EST INDISPENSABLE DE DEMANDER L'AVIS DE VOTRE MEDECIN OU DE VOTRE PHARMACIEN
Avertissements et précautions
Adressez-vous à votre médecin ou pharmacien avant d’utiliser NICORETTESKIN 10 mg/16 heures, dispositif transdermique.
Afin de réussir à arrêter de fumer, l'arrêt complet du tabac est indispensable.
Lisez attentivement les conseils d'éducation sanitaire.
Certaines maladies nécessitent un examen ainsi qu'un suivi médical avant d'utiliser ce médicament.
Ainsi, il est indispensable de consulter votre médecin avant d'utiliser ce médicament si vous présentez :
· des antécédents récents (< 3 mois) de crise cardiaque ou d'accident vasculaire cérébral,
· une douleur thoracique (angine de poitrine instable), ou une angine de poitrine stable,
· un problème cardiaque affectant votre fréquence ou votre rythme cardiaque,
· une hypertension artérielle qui n'est pas contrôlée par les médicaments,
· des antécédents de réactions allergiques s'étant manifestés par un gonflement des lèvres, du visage et de la gorge (œdème de Quincke) ou des éruptions cutanées associées à des démangeaisons (urticaire). Il arrive que l'utilisation d'une TRN déclenche ce type de réaction,
· une insuffisance hépatique sévère ou modérée,
· une insuffisance rénale sévère,
· un diabète,
· une hyperthyroïdie,
· une tumeur de la glande surrénale (phéochromocytome),
· un ulcère de l'estomac ou du duodénum en évolution,
· une affection chronique de la gorge,
· de l’asthme,
· des antécédents d’épilepsie ou de convulsions.
Il est impératif de tenir le dispositif transdermique hors de portée des enfants avant et après utilisation.
En effet, la dose thérapeutique destinée à l'adulte pourrait provoquer une intoxication grave voire mortelle chez l'enfant.
Certains signes traduisent un sous-dosage. Si vous ressentez, malgré le traitement, une sensation de "manque" comme notamment :
· besoin impérieux de fumer,
· irritabilité, troubles du sommeil,
· agitation ou impatience,
· difficulté de concentration,
Consultez votre médecin ou votre pharmacien. En effet, il est peut-être nécessaire de modifier la posologie du médicament.
Certains signes peuvent traduire un surdosage. En cas d'apparition de signes de surdosage, tels que :
· nausées, douleurs abdominales, diarrhée,
· hypersalivation,
· sueurs, céphalées, étourdissements, baisse de l'audition,
· faiblesse générale,
Il est impératif d'adapter le traitement en vous aidant de l'avis de votre médecin ou de votre pharmacien.
En cas d'association du dispositif transdermique NICORETTESKIN avec les formes orales de substituts nicotiniques telles que les gommes à mâcher médicamenteuses NICORETTE 2 mg, l'inhaleur NICORETTE 10 mg, les comprimés à sucer NICORETTE 2 mg, les comprimés sublinguaux NICORETTE MICROTAB 2 mg ou NICORETTESPRAY 1 mg/dose, solution pour pulvérisation buccale, référez-vous à la notice de chacun de ces médicaments pour connaître les mises en garde et précautions d’emploi.
EN CAS DE DOUTE NE PAS HESITER A DEMANDER L'AVIS DE VOTRE MEDECIN OU DE VOTRE PHARMACIEN.
Enfants et adolescents
Sans objet.
Autres médicaments et NICORETTESKIN 10 mg/16 heures, dispositif transdermique
Informez votre médecin ou pharmacien si vous prenez, avez récemment pris ou pourriez prendre tout autre médicament. Cela est particulièrement important si vous prenez des médicaments qui contiennent de la clozapine (un antipsychotique), de la méthadone (un traitement de substitution aux opiacés), du ropinirole (un traitement de la maladie de Parkinson) ou de la théophylline (utilisé dans le traitement de l’asthme).
NICORETTESKIN 10 mg/16 heures, dispositif transdermique avec des aliments et boissons
Sans objet.
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin ou pharmacien avant de prendre ce médicament.
Grossesse
Il est important d'arrêter de fumer pendant votre grossesse car cela peut ralentir la croissance de votre bébé. Cela peut également entraîner un accouchement prématuré ou des morts fœtales tardives. Il est conseillé d'arrêter de fumer sans utiliser de médicaments contenant de la nicotine.
Si vous ne parvenez pas à arrêter de fumer sans traitement de substitution nicotinique, NICORETTESKIN peut être utilisé après avoir consulté le professionnel de santé qui suit votre grossesse, votre médecin de famille, ou un médecin d'un centre spécialisé dans l'aide aux personnes souhaitant arrêter de fumer.
Allaitement
Si vous fumez beaucoup et que vous n'envisagez pas d'arrêter de fumer, vous ne devez pas allaiter votre enfant, mais avoir recours à l'allaitement artificiel. L'utilisation de ce médicament est déconseillée pendant l'allaitement car la nicotine passe dans le lait maternel et peut affecter votre enfant.
Cependant, si vous désirez vous arrêter de fumer et allaiter votre enfant, prenez l'avis de votre médecin ou d'un médecin au sein d'un centre spécialisé dans le sevrage tabagique.
Conduite de véhicules et utilisation de machines
NICORETTESKIN 10 mg/16 heures, dispositif transdermique n’a aucun effet ou un effet négligeable sur l'aptitude à conduire des véhicules et à utiliser des machines.
3. COMMENT UTILISER NICORETTESKIN 10 mg/16 heures, dispositif transdermique ?
Réservé à l'adulte et à l'enfant de plus de 15 ans.
Posologie
Trois tailles de dispositifs transdermiques sont disponibles : 9; 13,5; 22,5 cm2, correspondant à 3 dosages différents: 10 mg/16 heures, 15 mg/16 heures, 25 mg/16 heures.
Le dispositif transdermique doit être appliqué sur une partie saine de la peau le matin au lever, et retiré le soir au coucher, soit environ 16 h plus tard. Le traitement imite les fluctuations de nicotine durant la journée chez le fumeur, sans administration de nicotine la nuit. L'administration de nicotine la journée par le dispositif transdermique ne provoque pas les troubles du sommeil constatés lors d'une administration de nicotine pendant la nuit.
· Il est recommandé aux fumeurs fortement dépendants (score au test de Fagerström ≥ 7) de commencer avec le dispositif transdermique 25 mg/16 heures. Un dispositif transdermique sera appliqué quotidiennement le matin et retiré le soir, pendant 8 semaines.
· Une réduction des doses est ensuite initiée. Un dispositif transdermique de 15 mg/16 heures est utilisé quotidiennement pendant 2 semaines, puis un dispositif transdermique 10 mg/16 heures pendant également 2 semaines.
· Il est recommandé aux fumeurs moyennement dépendants (score au test de Fagerström 5 et 6), de commencer par l'étape 2 avec le dispositif transdermique 15 mg/16 heures.
o Si l'arrêt du tabac est obtenu la première semaine avec le dosage 15 mg/16 heures, un dispositif transdermique sera appliqué quotidiennement le matin et retiré le soir, pendant 8 semaines puis un dispositif transdermique de 10 mg/16 heures sera appliqué pendant 4 semaines.
o Si après 1-7 jours d'utilisation du dispositif transdermique 15 mg/16 heures, les signes de manque persistent, il est recommandé d'utiliser un dispositif transdermique 25 mg/16 heures et de poursuivre le traitement selon le schéma des patients fortement dépendants (voir « fumeurs fortement dépendants »).
· Il est recommandé aux fumeurs faiblement dépendants (score au test de Fagerström 3 et 4) de commencer par l'étape 2 avec le dispositif transdermique 15 mg/16 heures appliqué quotidiennement pendant 8 semaines et de poursuivre par un dispositif transdermique 10 mg/16 heures appliqué pendant 4 semaines.
Fumeurs fortement à faiblement dépendants
|
Fumeurs fortement dépendants |
Fumeurs moyennement dépendants |
Fumeurs faiblement dépendants |
||||||
|
(test de Fagerström ≥ 7) |
(test de Fagerström 5 - 6) |
(test de Fagerström 3-4) |
||||||
|
Dispositif transdermique |
Durée |
Dispositif transdermique |
Durée |
Dispositif transdermique |
Durée |
|||
|
Etape 1 |
NICORETTESKIN 25 mg/16 heures |
8 premières semaines |
||||||
|
Etape 2 |
NICORETTESKIN 15 mg/16 heures |
2 semaines suivantes |
Etape 2 |
NICORETTESKIN 15 mg/16 heures |
8 premières semaines (NB: si le tabagisme persiste ou s'il y a une forte consommation de formes orales de substituts, se reporter dès la première semaine à l'étape 1 du schéma « fumeurs fortement dépendants ») |
Etape 2 |
NICORETTESKIN 15 mg/16 heures |
8 premières semaines |
|
Etape 3 |
NICORETTESKIN 10 mg/16 heures |
2 dernières semaines |
Etape 3 |
NICORETTESKIN 10 mg/16 heures |
4 semaines suivantes |
Etape 3 |
NICORETTESKIN 10 mg/16 heures |
4 semaines suivantes |
L'ensemble du traitement doit durer au moins 3 mois.
La durée du traitement peut cependant varier en fonction de la réponse individuelle.
Il est recommandé de ne pas utiliser les dispositifs transdermiques au-delà de 6 mois. Certains "ex-fumeurs" peuvent cependant nécessiter une durée de traitement plus longue afin d'éviter la rechute.
Si pendant votre traitement, vous continuez de ressentir des envies irrépressibles de fumer ou si votre traitement a échoué, DEMANDEZ CONSEIL A VOTRE MEDECIN OU VOTRE PHARMACIEN.
Il pourra vous conseiller d'associer les dispositifs transdermiques NICORETTESKIN à des formes orales de substitution (gommes à mâcher médicamenteuses NICORETTE 2 mg, inhaleur NICORETTE 10 mg, comprimés à sucer NICORETTE 2 mg, comprimés sublinguaux NICORETTE MICROTAB 2 mg ou NICORETTESPRAY 1 mg/dose, solution pour pulvérisation buccale).
En cas d’association de NICORETTESKIN avec une forme orale de substitution, la posologie à suivre est la même que lorsque ces médicaments sont utilisés seuls en monothérapie. Pour la posologie de la forme orale, consultez la notice du médicament choisi.
En cas d’association, n’utilisez qu’une forme orale à la fois sur une période de 24 heures.
Mode d'administration
· Lavez-vous les mains avant d'appliquer le dispositif transdermique.
· Ouvrez le sachet à l'aide d'une paire de ciseaux et sortez le dispositif transdermique.
· Appliquez le dispositif transdermique immédiatement après ouverture sur une surface de peau sèche, sans lésion cutanée et où la pilosité est rare (hanche, partie supérieure du bras ou poitrine).
· Retirez autant que possible une partie de la feuille en aluminium. Evitez le plus possible de toucher la surface collante du dispositif transdermique avec les doigts.
· Appliquez la partie collante avec les doigts et retirez la partie restante de feuille aluminium.
· Pressez fermement le dispositif transdermique sur la peau avec les doigts.
· Frottez fermement avec les doigts sur les bords pour que le dispositif transdermique colle correctement.
· Le dispositif transdermique doit être appliqué le matin et retiré au moment du coucher, soit environ 16 heures plus tard.
· Le site d'application devra être changé chaque jour en évitant si possible de replacer le dispositif transdermique au même endroit pendant quelques jours.
· Il est indispensable de plier le dispositif transdermique sur lui-même après utilisation avant de le jeter dans un endroit sûr.
· Tout dispositif transdermique utilisé ou non doit être tenu hors de la portée des enfants.
· Au cours de la manipulation, éviter le contact avec les yeux, le nez et se laver les mains après application.
· Ne pas couper le dispositif transdermique.
· En cas de bain de mer ou de piscine prolongé, vous avez 2 possibilités :
o Avant le bain, retirez le dispositif transdermique et replacez-le immédiatement sur son support. Il pourra être recollé sur une peau bien séchée.
o Recouvrez le dispositif transdermique d'un pansement adhésif étanche pendant la durée du bain.
· En cas de douche courte, le dispositif transdermique peut être maintenu en place en évitant de diriger le jet de la douche dessus.
|
|
|
Durée du traitement
|
La durée d'utilisation est limitée à 6 mois. |
En cas de persistance de la sensation de manque ou en cas de difficulté à arrêter ce médicament, consultez votre médecin.
Si vous avez utilisé plus de NICORETTESKIN 10 mg/16 heures, dispositif transdermique que vous n’auriez dû
Consultez immédiatement votre médecin ou votre pharmacien.
En cas de surdosage accidentel ou si un enfant a sucé ou s'est appliqué un dispositif transdermique CONTACTEZ UN MEDECIN OU UN SERVICE D'URGENCE.
Une intoxication grave peut survenir et se manifester par une hypotension, un pouls faible et irrégulier, une gêne respiratoire, une prostration, un collapsus cardiovasculaire et des convulsions.
Si vous oubliez d’utiliser NICORETTESKIN 10 mg/16 heures, dispositif transdermique
Si vous arrêtez d’utiliser NICORETTESKIN 10 mg/16 heures, dispositif transdermique
Sans objet.
Si vous avez d’autres questions sur l’utilisation de ce médicament, demandez plus d’informations à votre médecin ou à votre pharmacien.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Très fréquent : affecte plus de 10 utilisateurs sur 100
- démangeaisons (prurit).
Fréquent : affecte de 1 à 10 utilisateurs sur 100
- éruptions et urticaire,
- nausées et vomissements,
- troubles digestifs,
- rougeur de la peau,
- maux de tête,
- étourdissements.
Peu fréquent : affecte de 1 à 10 utilisateurs sur 1000
- palpitations (sensation inhabituelle à vos battements cardiaques), ou rythme cardiaque rapide (tachycardie),
- rêves anormaux,
- transpiration excessive, bouffées de chaleur,
- fatigue, malaise, douleur/gêne au niveau du thorax, respiration difficile (dyspnée),
- réaction au site d’application,
- réactions allergiques,
- hypertension,
- douleur dans les muscles,
- sensation de fourmillement pouvant diffuser autour du site d’application.
Très rare : affecte moins de 1 utilisateur sur 10 000
- Troubles du rythme cardiaque.
Fréquence indéterminée : ne peut être estimée sur la base des données disponibles
- douleur/gêne dans le ventre,
- réaction allergique comprenant le gonflement du visage et de la bouche (œdème de Quincke),
- convulsions.
Des étourdissements, des maux de tête, des troubles du sommeil, des aphtes buccaux peuvent être liés à l'arrêt du tabac et non à votre traitement.
En cas d'association du dispositif transdermique NICORETTESKIN avec les formes orales de substituts nicotiniques NICORETTE (les gommes à mâcher médicamenteuses NICORETTE 2 mg, l’inhaleur NICORETTE 10 mg, les comprimés à sucer NICORETTE 2 mg, les comprimés sublinguaux NICORETTE MICROTAB 2 mg ou NICORETTESPRAY 1 mg/dose, solution pour pulvérisation buccale), référez-vous à la notice de chacun de ces médicaments.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance. Site internet : https://signalement.social-sante.gouv.fr.
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER NICORETTESKIN 10 mg/16 heures, dispositif transdermique ?
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur la boite et le sachet. La date de péremption fait référence au dernier jour de ce mois.
A conserver à une température ne dépassant pas 25°C.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient NICORETTESKIN 10 mg/16 heures, dispositif transdermique
· La substance active est :
Nicotine....................................................................................................................... 15,75 mg
Pour un dispositif transdermique de 9 cm2.
Un dispositif transdermique délivre 10 mg de nicotine pendant 16 heures.
· Les autres composants sont :
Triglycérides à chaîne moyenne, copolymère basique de méthacrylate de butyle, pellicule de téréphtalate de polyéthylène (PET).
Matrice Acrylate
Solution adhésive de copolymère acrylique, hydroxyde de potassium, croscarmellose sodique, acétylacétonate d’aluminium.
Feuille de protection détachable
Pellicule de téréphthalate de polyéthylène (PET) aluminisée sur 1 face et siliconée sur les 2 faces.
Chaque dispositif transdermique est emballé dans un sachet-dose laminé thermoscellé.
Dispositif transdermique (boîte de 7,14 ou 28).
Dispositif transdermique semi-transparent, beige, constitué d'une couche externe, d'une couche source de nicotine, d'une couche adhésive et d'une feuille de protection détachable siliconée et aluminisée.
Toutes les présentations peuvent ne pas être commercialisées.
Titulaire de l’autorisation de mise sur le marché
41 rue Camille Desmoulins
92130 ISSY-LES-MOULINEAUX
Exploitant de l’autorisation de mise sur le marché
41 RUE CAMILLE DESMOULINS
91230 ISSY-LES-MOULINEAUX
LTS LOHMANN THERAPIE-SYSTEME AG (LTS)
LOHMANNSTR. 2
56626 ANDERNACH
ALLEMAGNE
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Sans objet.
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).
Conseils d’éducation sanitaire :
|
S'arrêter de fumer le plus tôt possible entraîne des bénéfices immédiats pour la santé. Il n'est jamais trop tard pour arrêter de fumer même si on a fumé longtemps et beaucoup. |
Dès que vous arrêterez de fumer :
· Vous n’absorberez plus les substances irritantes et toxiques de la cigarette,
· Vous pourrez constater certaines améliorations : disparition progressive des maux de tête, de la toux, de l’irritation de la gorge, des essoufflements,
· Vous aurez souvent la satisfaction de retrouver un meilleur sommeil, la saveur des aliments, les odeurs et d’améliorer vos performances physiques,
· Vous diminuerez vos risques de développer un cancer du poumon ou une maladie cardiovasculaire.
Qu'est-ce que la dépendance tabagique ?
La dépendance au tabac est double :
· Dépendance psychologique :
Fumer une cigarette entraîne un rituel de gestes automatiques et répétitifs associé à des circonstances particulières (plaisir, réponse au stress, stimulation intellectuelle, soutien pour le moral, besoin du geste de convivialité). Il s’agit de la dépendance psychologique et comportementale.
· Dépendance physique :
Le besoin de l’organisme en nicotine est dû aux effets de cette substance sur le système nerveux. Il s’agit de la dépendance physique. La non-satisfaction de ce besoin entraîne une sensation de manque (voir description dans le chapitre "Comment surmonter votre dépendance physique ?").
Les substituts nicotiniques visent à traiter cette dépendance.
Comment surmonter votre dépendance psychologique ?
· L’arrêt complet du tabac est nécessaire pour augmenter vos chances de succès, mais de plus :
o Choisissez un jour J dans la période qui vous paraît la plus favorable.
o Jetez votre dernier paquet de cigarettes, votre briquet et rangez vos cendriers.
o Dans un couple de fumeurs, il est préférable que la tentative d’arrêt soit faite en même temps par les deux conjoints.
· Prévenez vos proches et vos collègues de travail que vous cessez de fumer. Demandez-leur de respecter votre décision (ne pas fumer près de vous, ne plus vous proposer de cigarettes).
· Préparez-vous à faire face au désir de fumer. Il peut survenir brutalement et de manière intense surtout pendant les premières semaines après l’arrêt du tabac, mais ne dure pas plus de 3 ou 4 minutes.
Vous devez prévoir ce que vous ferez dans ce cas-là et agir très vite pour ne pas "craquer" comme par exemple :
o boire un grand verre d’eau,
o mâcher un chewing-gum,
o compter jusqu’à 100,
o faire quelques respirations profondes,
o sortir de la pièce,
o changer d’activité...
· Evitez les situations associées à la prise de cigarettes (café, apéritif, ), évitez les tentations (installez-vous avec les non-fumeurs).
· Trouvez des compensations à la cigarette (loisirs, sport, activité culturelle...).
Comment surmonter votre dépendance physique ?
Si vous êtes dépendant à la nicotine, le succès de votre démarche peut nécessiter l’utilisation de substituts nicotiniques.
Afin d’évaluer votre niveau de dépendance, le test de Fagerström vous est proposé.
|
Combien de temps après votre réveil fumez-vous votre première cigarette ? |
|
|
· dans les 5 minutes : 3 |
|
|
· de 6 à 30 minutes : 2 |
|
|
· de 31 à 60 minutes : 1 |
|
|
· après 60 minutes : 0 |
|
|
Trouvez-vous difficile de ne pas fumer dans les endroits où c’est interdit ? |
|
|
· oui : 1 |
|
|
· non : 0 |
|
|
A quelle cigarette de la journée vous serait-il le plus difficile de renoncer ? |
|
|
· la première : 1 |
|
|
· une autre : 0 |
|
|
Combien de cigarettes fumez-vous par jour ? |
|
|
· 10 ou moins : 0 |
|
|
· 11 à 20 : 1 |
|
|
· 21 à 30 : 2 |
|
|
· 31 ou plus : 3 |
|
|
Fumez-vous à un rythme plus soutenu le matin que l’après-midi ? |
|
|
· oui : 1 |
|
|
· non : 0 |
|
|
Fumez-vous lorsque vous êtes si malade que vous devez rester au lit presque toute la journée ? |
|
|
· oui : 1 |
|
|
· non : 0 |
|
|
TOTAL DES POINTS |
|
score de 0 à 2 : vous n’êtes pas dépendant à la nicotine.
Vous pouvez arrêter de fumer sans avoir besoin de substitut nicotinique.
Si toutefois vous redoutez cet arrêt, prenez conseil auprès de votre pharmacien ou de votre médecin.
score de 3 à 4 : vous êtes faiblement dépendant à la nicotine.
score de 5 à 6 : vous êtes moyennement dépendant à la nicotine.
L’utilisation de substituts nicotiniques va augmenter vos chances de réussite.
Prenez conseil auprès de votre pharmacien ou de votre médecin afin qu’il vous aide à choisir le traitement le plus adapté à votre cas.
score de 7 à 10 : vous êtes fortement ou très fortement dépendant à la nicotine.
L’utilisation de substituts nicotiniques est recommandée pour vous aider à surmonter cette dépendance à la nicotine. Ce traitement doit être utilisé à dose suffisante et adaptée.
Prenez conseil auprès de votre pharmacien ou de votre médecin, éventuellement dans le cadre d’une consultation spécialisée d’aide au sevrage tabagique.
Les troubles liés au sevrage peuvent persister longtemps et la durée du traitement devra être suffisante, le plus souvent d’un à trois mois.
Si vous ressentez, malgré le traitement, une sensation de « manque » persistante comme notamment :
· besoin impérieux de fumer,
· irritabilité, troubles du sommeil,
· agitation ou impatience,
· difficulté de concentration,
Prenez l’avis de votre médecin ou votre pharmacien car une adaptation des doses peut être nécessaire.
· Le soutien des professionnels de santé
L’accompagnement, les conseils, le suivi que peuvent vous apporter votre médecin ou votre pharmacien seront précieux pendant les six premiers mois de votre arrêt du tabac. Vous pouvez aussi recourir à une consultation spécialisée d’aide au sevrage tabagique, en particulier si vous avez déjà échoué.
· Le soutien psychologique
Arrêter de fumer nécessite un environnement familial et social favorable. Si vous craignez que les difficultés soient trop importantes, un soutien psychologique ou un traitement temporaire peut vous aider.
· La diététique
Dans les mois qui suivent l’arrêt du tabac, vous constaterez peut-être une prise de poids modérée.
Si vous avez des inquiétudes dans ce domaine, vous pouvez vous adresser à un professionnel de santé qui saura vous conseiller.
Vous avez recommencé à fumer, pourquoi ?
Considérez cette rechute comme un accident de parcours, comme un événement normal qui permet d’apprendre : la rechute n’est pas un échec.
Analysez les raisons pour lesquelles vous avez repris le tabac.
· A cause de la dépendance physique
Celle-ci peut avoir été mal prise en compte ou bien réapparaître au bout de plusieurs mois, à l'occasion, par exemple, de séjours prolongés dans des atmosphères enfumées.
· A cause d'une prise de poids jugée excessive
Il sera sans doute nécessaire de modifier un peu vos habitudes alimentaires avant votre prochaine tentative d'arrêt du tabac.
· A cause d'une baisse de motivation, à cause d'un événement douloureux ou d'une période difficile, à cause de difficultés psychologiques apparues à l'arrêt du tabac (dépression, anxiété ), à cause d'une situation très tentante. Comprenez la raison de cette rechute pour la prévenir si possible lors de votre prochaine tentative.
Dans tous les cas, n’hésitez pas à demander conseil auprès d’un professionnel de santé ou à recourir à une consultation spécialisée d’aide au sevrage tabagique.
|
Si vous avez recommencé à fumer, ne vous découragez pas, l'expérience montre que vos chances de succès augmentent après une ou plusieurs tentatives d'arrêt. |