Dernière mise à jour le 01/12/2025
FLUANXOL 4 %, solution buvable
Présentations
> 1 flacon(s) en verre jaune(brun) de 10 ml avec seringue(s) doseuse pour administration orale en polypropylène polyéthylène
Code CIP : 316 555-2 ou 34009 316 555 2 7
Déclaration de commercialisation : 19/04/1976
Cette présentation est agréée aux collectivités
- Prix hors honoraire de dispensation : 5,34 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 6,36 €
- Taux de remboursement :65%
Service médical rendu (SMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Important | Avis du 25/01/2017 | Renouvellement d'inscription (CT) | Le service médical rendu par FLUANXOL solution buvable reste important dans : • le traitement des états psychotiques aigus et chroniques, • le traitement de courte durée des états d'agitation et d'agressivité au cours des états psychotiques aigus et chroniques. Le service médical rendu par FLUANXOL LP solution injectable IM reste important dans le traitement au long cours des états psychotiques chroniques. |
Amélioration du service médical rendu (ASMR)
Pas d'ASMR disponible pour ce médicament (plus d'informations dans l'aide )
ANSM - Mis à jour le : 17/04/2025
FLUANXOL 4 %, solution buvable
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Dichlorhydrate de flupentixol.................................................................................................. 4,67 g
Quantité correspondant en flupentixol base à.......................................................................... 4,00 g
Pour 100 ml.
Excipient à effet notoire : Contient 300 mg d'éthanol par ml.
Pour la liste complète des excipients, voir rubrique 6.1.
Solution buvable.
4.1. Indications thérapeutiques
Etats psychotiques aigus.
Etats psychotiques chroniques (schizophrénies, délires chroniques non schizophréniques : délires paranoïaques, psychoses hallucinatoires chroniques).
Traitement de courte durée des états d'agitation et d'agressivité au cours des états psychotiques aigus et chroniques (schizophrénies, délires chroniques non schizophréniques : délires paranoïaques, psychoses hallucinatoires chroniques).
4.2. Posologie et mode d'administration
Posologie
Chez l'adulte
Posologie strictement individuelle en fonction du tableau clinique :
· effet antipsychotique associé à un effet stimulant et désinhibiteur sans effet anxiogène : de 20 à 80 mg/jour en 1 à 2 prises,
· effet antidélirant et anti-hallucinatoire associé à un effet sédatif : de 80 à 200 mg/jour.
Mise en route du traitement : dose de départ en moyenne de 20 à 40 mg/jour, puis augmentation par paliers de 20 à 40 mg tous les 3 à 4 jours, enfin modulations de ± 10 mg pour rechercher la posologie la plus adéquate.
Chez les sujets âgés, les patients épileptiques
Posologie réduite à la moitié ou au quart de la posologie mentionnée ci-dessus.
Population pédiatrique
Sans objet.
Mode d’administration
Voie orale.
1. Appuyer sur le bouchon et dévisser.
2. Placer la seringue doseuse pour administration orale dans l’orifice du système d’adaptation.
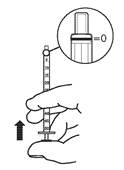
3. Renverser le flacon et la seringue doseuse pour administration orale puis aspirer la solution buvable. Le volume aspiré dans la seringue doseuse pour administration orale doit être légèrement supérieur à celui prescrit.
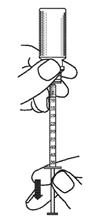
4. Appuyer sur le piston de la seringue doseuse pour administration orale afin d’éliminer le surplus de solution et d’obtenir la dose exacte prescrite.
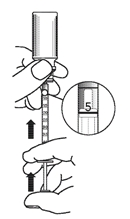
5. Retourner le flacon et la seringue doseuse pour administration orale avant de séparer la seringue à usage oral du flacon.
Refermer le flacon.
6. Verser le contenu de la seringue doseuse pour administration orale dans votre boisson (un verre d’eau, de jus d’orange ou de pomme), mélanger brièvement et boire la totalité.
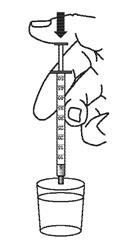
7. Laver la seringue doseuse pour administration orale à l’eau.
Ce médicament est contre-indiqué dans les situations suivantes :
· Hypersensibilité à la substance active ou à l’un des excipients mentionnés à la rubrique 6.1,
· risque de glaucome par fermeture de l’angle,
· risque de rétention urinaire lié à des troubles urétro-prostatiques,
· troubles de la conscience quelle qu’en soit la cause (par exemple intoxication à l’alcool, aux barbituriques ou aux opiacés), coma,
· en association avec un dopaminergique hors parkinson (cabergoline, quinagolide), le citalopram, l’escitalopram, l’hydroxyzine, la dompéridone, la pipéraquine (voir rubrique 4.5).
4.4. Mises en garde spéciales et précautions d'emploi
En cas d’hyperthermie inexpliquée, il est impératif de suspendre le traitement, car ce signe peut être l’un des éléments du syndrome malin décrit avec les neuroleptiques (pâleur, hyperthermie, troubles végétatifs, altération de la conscience, rigidité musculaire).
Les signes de dysfonctionnement végétatif, tels que sudation et instabilité artérielle, peuvent précéder l’apparition de l’hyperthermie et constituer, par conséquent, des signes d’appel précoces.
Bien que cet effet des neuroleptiques puisse avoir une origine idiosyncrasique, certains facteurs de risque semblent y prédisposer, tels que la déshydratation ou des atteintes organiques cérébrales.
Les symptômes peuvent persister pendant plus d’une semaine après l’arrêt des neuroleptiques oraux et légèrement plus longtemps lorsqu’ils sont associés aux formes LP de ces médicaments.
Une surveillance chez les patients épileptiques et les sujets présentant d’autres facteurs prédisposants (atteinte cérébrale) peut être conseillée en raison de la possibilité d’abaissement du seuil épileptogène.
Le flupentixol n’est pas recommandé chez les patients excités ou délirants aux doses allant jusqu’à 25 mg/jour car son effet stimulant peut conduire à une exagération de ces caractéristiques. Si le patient a précédemment été traité avec des tranquillisants ou des neuroleptiques avec un effet sédatif, ils doivent être arrêtés progressivement.
Le flupentixol doit également être utilisé avec prudence :
· chez les sujets âgés en raison de leur importante sensibilité (sédation et hypotension),
· chez les patients ayant une affection cardio-vasculaire grave, en raison des modifications hémodynamiques, en particulier l’hypotension,
· chez les patients ayant une insuffisance rénale ou hépatique, en raison du risque de surdosage,
· chez les parkinsoniens nécessitant impérativement un traitement neuroleptique.
Allongement de l’intervalle QT
Le flupentixol peut provoquer un allongement de l’espace QT. Cet effet, connu pour potentialiser le risque de survenue de troubles du rythme ventriculaire graves, notamment à type de torsades de pointes, est majoré par l’existence d’une bradycardie, d’une hypokaliémie, d’un QT long congénital ou acquis (association à un médicament augmentant l’intervalle QT) (voir rubrique 4.8).
Il convient donc lorsque la situation clinique le permet, de s’assurer avant toute administration, de l’absence de facteurs pouvant favoriser la survenue de ce trouble du rythme :
· bradycardie inférieure à 55 battements par minute,
· hypokaliémie,
· allongement congénital de l’intervalle QT,
· traitement en cours par un médicament susceptible d’entraîner une bradycardie marquée (< 55 battements par minute), une hypokaliémie, un ralentissement de la conduction intracardiaque, un allongement de l’intervalle QT (voir rubrique 4.5).
Hormis les situations d’urgence, il est recommandé d’effectuer un ECG dans le bilan initial des patients devant être traités au long cours par un neuroleptique.
Des cas d’hyperglycémie ou d’intolérance au glucose et la survenue ou l’exacerbation d’un diabète ont été rapportés chez des patients traités par des antipsychotiques (voir rubrique 4.8).
Les patients traités par FLUANXOL doivent faire l’objet d’une surveillance clinique et biologique conforme aux recommandations sur le suivi cardio-métabolique en vigueur. Il est recommandé de porter une attention particulière aux patients diabétiques ou ayant des facteurs de risque de diabète et de réajuster éventuellement le traitement antidiabétique.
Des cas de thromboembolie veineuse (TEV) ont été rapportés avec les antipsychotiques. Etant donné que les patients traités par antipsychotiques présentent souvent des facteurs de risque acquis de TEV, tous les facteurs de risque de survenue de TEV doivent être identifiés avant et au cours du traitement par FLUANXOL et des mesures préventives doivent être prises le cas échéant.
Personnes âgées
Accident vasculaire cérébral
Dans des études cliniques randomisées versus placebo réalisées chez des patients âgés atteints de démence et traités avec certains antipsychotiques atypiques, il a été observé un risque plus élevé d’accident vasculaire cérébral comparé au placebo. Le mécanisme d’une telle augmentation de risque n’est pas connu. Une élévation du risque avec d’autres antipsychotiques ou chez d’autres populations de patients ne peut être exclue. Ce médicament doit être utilisé avec prudence chez les patients présentant des facteurs de risque d’accident vasculaire cérébral.
Augmentation de la mortalité chez les patients âgés atteints de démence
Les résultats de deux études observationnelles menées chez un grand nombre de patients ont montré que les patients âgés atteints de démence et traités par antipsychotiques présentent une faible augmentation du risque de mortalité comparés à ceux qui ne sont pas traités. Les données disponibles sont insuffisantes pour établir une estimation précise de ce risque et la cause de cette augmentation est inconnue.
FLUANXOL n’est pas indiqué dans le traitement des troubles du comportement liés à la démence.
Liées aux excipients
L’utilisation de ce médicament est dangereuse chez les sujets alcooliques et doit être prise en compte chez les femmes enceintes ou allaitant, les enfants et les groupes à haut risque tels que les insuffisants hépatiques ou les épileptiques.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Médicaments sédatifs
Il faut prendre en compte le fait que de nombreux médicaments ou substances peuvent additionner leurs effets dépresseurs du système nerveux central et contribuer à diminuer la vigilance. Il s’agit des dérivés morphiniques (analgésiques, antitussifs et traitements de substitution), des neuroleptiques, des barbituriques, des benzodiazépines, des anxiolytiques autres que les benzodiazépines (par exemple, le méprobamate), des hypnotiques, des antidépresseurs sédatifs (amitriptyline, doxépine, miansérine, mirtazapine, trimipramine), des antihistaminiques H1 sédatifs, des antihypertenseurs centraux, du baclofène et du thalidomide.
Médicaments susceptibles de donner des torsades de pointes
Ce trouble du rythme cardiaque grave peut être provoqué par un certain nombre de médicaments, antiarythmiques ou non. L’hypokaliémie (cf. médicaments hypokaliémiants) est un facteur favorisant, de même que la bradycardie (cf. médicaments bradycardisants) ou un allongement préexistant de l’intervalle QT, congénital ou acquis.
Les médicaments à l’origine de cet effet indésirable sont notamment des antiarythmiques de classe Ia et III, et certains neuroleptiques. D’autres molécules n’appartenant pas à ces classes sont également en cause.
Pour le dolasétron, l’érythromycine, la spiramycine et la vincamine, seules les formes administrées par voie intraveineuse sont concernées par cette interaction.
L’utilisation d’un médicament torsadogène avec un autre médicament torsadogène est contre-indiquée en règle générale.
Toutefois certains d’entre eux, en raison de leur caractère incontournable, font exception à la règle, en étant seulement déconseillés avec les autres torsadogènes. Il s’agit de la méthadone, des antiparasitaires (chloroquine, halofantrine, luméfantrine, pentamidine) et des neuroleptiques.
Cependant, le citalopram, l’escitalopram, la dompéridone, l’hydroxyzine et la pipéraquine ne suivent pas cet assouplissement, et sont contre-indiqués avec tous les torsadogènes.
Médicaments atropiniques
Il faut prendre en compte le fait que les substances atropiniques peuvent additionner leurs effets indésirables et entraîner plus facilement une rétention urinaire, une poussée aiguë de glaucome, une constipation, une sécheresse de la bouche, etc
Les divers médicaments atropiniques sont représentés par les antidépresseurs imipraminiques, la plupart des antihistaminiques H1 atropiniques, les antiparkinsoniens anticholinergiques, les antispasmodiques atropiniques, le disopyramide, les neuroleptiques phénothiaziniques ainsi que la clozapine.
Médicaments à l’origine d’une hypotension orthostatique
Outre les antihypertenseurs, de nombreux médicaments peuvent entraîner une hypotension orthostatique. C’est le cas notamment des dérivés nitrés, des inhibiteurs de la phosphodiestérase de type 5, des alpha-bloquants à visée urologique, des antidépresseurs imipraminiques et des neuroleptiques phénothiaziniques, des agonistes dopaminergiques et de la lévodopa. Leur utilisation conjointe risque donc de majorer la fréquence et l’intensité de cet effet indésirable. Se reporter aux interactions propres à chaque classe, avec les niveaux de contrainte correspondants.
Associations contre-indiquées
+ Dopaminergiques hors parkinson (cabergoline, quinagolide)
Antagonisme réciproque de l’agoniste dopaminergique et des neuroleptiques.
+ Citalopram, escitalopram
Risque majoré de troubles du rythme ventriculaire, notamment de torsades de pointes.
+ Hydroxyzine
Risque majoré de troubles du rythme ventriculaire, notamment de torsades de pointes.
+ Dompéridone
Risque majoré de troubles du rythme ventriculaire, notamment de torsades de pointes.
+ Pipéraquine
Risque majoré de troubles du rythme ventriculaire, notamment de torsades de pointes.
Associations déconseillées
+ Alcool (boisson ou excipient)
Majoration par l’alcool de l’effet sédatif des neuroleptiques.
L’altération de la vigilance peut rendre dangereuses la conduite de véhicules et l’utilisation de machines.
Eviter la prise de boissons alcoolisées et de médicaments contenant de l’alcool.
+ Lévodopa
Antagonisme réciproque de la lévodopa et des neuroleptiques.
Chez le patient parkinsonien, utiliser les doses minimales efficaces de chacun des deux médicaments.
+ Antiparkinsoniens dopaminergiques (amantadine, apomorphine, bromocriptine, entacapone, lisuride, pergolide, piribédil, pramipexole, rasagiline, ropinirole, rotigotine, sélégiline, tolcapone)
Antagonisme réciproque de l’agoniste dopaminergique et des neuroleptiques.
Le dopaminergique peut provoquer ou aggraver les troubles psychotiques. En cas de nécessité d’un traitement par neuroleptiques chez le patient parkinsonien traité par dopaminergiques, ces derniers doivent être diminués progressivement jusqu’à l’arrêt (leur arrêt brutal expose à un risque de « syndrome malin des neuroleptiques »).
+ Antiparasitaires susceptibles de donner des torsades de pointes (chloroquine, halofantrine, luméfantrine, pentamidine)
Risque majoré de troubles du rythme ventriculaire, notamment de torsades de pointes.
Si cela est possible, interrompre l’un des deux traitements. Si l’association ne peut être évitée, contrôle préalable du QT et surveillance ECG monitorée.
+ Hydroxychloroquine
Risque majoré de troubles du rythme ventriculaire, notamment de torsades de pointes.
+ Méthadone
Risque majoré de troubles du rythme ventriculaire, notamment de torsades de pointes.
+ Autres neuroleptiques susceptibles de donner des torsades de pointes (amisulpride, chlorpromazine, cyamémazine, dropéridol, fluphénazine, halopéridol, lévomépromazine, pimozide, pipampérone, pipotiazine, sulpiride, sultopride, tiapride, zuclopenthixol)
Risque majoré de troubles du rythme ventriculaire, notamment de torsades de pointes.
+ Autres médicaments susceptibles de donner des torsades de pointes (amiodarone, arsénieux, diphémanil, disopyramide, dolasetron IV, dronedarone, érythromycine IV, hydroquinidine, mequitazine, mizolastine, moxifloxacine, prucalopride, quinidine, sotalol, spiramycine IV, toremifène, vandétanib, vincamine IV)
Risque majoré de troubles du rythme ventriculaire, notamment de torsades de pointes.
+ Sodium (oxybate de)
Majoration de la dépression centrale. L'altération de la vigilance peut rendre dangereuses la conduite de véhicules et l'utilisation de machines.
Associations faisant l'objet de précautions d’emploi
+ Bêta-bloquants dans l’insuffisance cardiaque (bisoprolol, carvédilol, métoprolol, nébivolol)
Effet vasodilatateur et risque d’hypotension, notamment orthostatique (effet additif).
Et, risque majoré de troubles du rythme ventriculaire, notamment de torsades de pointes.
Surveillance clinique et électrocardiographique.
+ Bradycardisants
Risque majoré de troubles du rythme ventriculaire, notamment de torsades de pointes.
Surveillance clinique et électrocardiographique.
+ Hypokaliémiants
Risque majoré de troubles du rythme ventriculaire, notamment de torsades de pointes.
Corriger toute hypokaliémie avant d’administrer le produit et réaliser une surveillance clinique, électrolytique et électrocardiographique.
+ Anagrélide
Risque majoré de troubles du rythme ventriculaire, notamment de torsades de pointes.
Surveillance clinique et électrocardiographique pendant l'association.
+ Azithromycine, clarithromycine, roxithromycine
Risque majoré de troubles du rythme ventriculaire, notamment de torsades de pointes.
Surveillance clinique et électrocardiographique pendant l'association.
+ Ciprofloxacine, lévofloxacine, norfloxacine
Risque majoré de troubles du rythme ventriculaire, notamment de torsades de pointes.
Surveillance clinique et électrocardiographique pendant l'association.
+ Ondansétron
Risque majoré de troubles du rythme ventriculaire, notamment de torsades de pointes.
+ Lithium
Risque d’apparition de signes neuropsychiques évocateurs d’un syndrome malin des neuroleptiques ou d’une intoxication au lithium.
Surveillance clinique et biologique régulière, notamment en début d'association.
Associations à prendre en compte
+ Médicaments abaissant la pression artérielle
Risque de majoration d’une hypotension, notamment orthostatique.
+ Autres médicaments atropiniques
Addition des effets indésirables atropiniques à type de rétention urinaire, constipation, sécheresse de la bouche.
+ Autres médicaments sédatifs
Majoration de la dépression centrale.
L’altération de la vigilance peut rendre dangereuses la conduite de véhicules et l’utilisation de machines.
+ Dapoxétine
Risque de majoration des effets indésirables, notamment à type de vertiges ou de syncopes.
+ Orlistat
Risque d’échec thérapeutique en cas de traitement concomitant par orlistat.
4.6. Fertilité, grossesse et allaitement
Grossesse
Les études chez l’animal ont montré une toxicité pour la reproduction (voir section 5.3).
Le maintien d’un bon équilibre psychique maternel est souhaitable tout au long de la grossesse pour éviter toute décompensation. Si une prise en charge médicamenteuse est nécessaire pour assurer cet équilibre, elle doit être instituée ou poursuivie à dose efficace tout au long de la grossesse.
Les données cliniques sont insuffisantes pour conclure.
Il est préférable d’éviter d’utiliser le FLUANXOL au cours de la grossesse quel qu’en soit le terme. S'il s'avère indispensable de prescrire un traitement par le FLUANXOL au cours de la grossesse, les nouveau-nés doivent être étroitement surveillés.
En effet, les nouveau-nés exposés aux antipsychotiques (dont FLUANXOL) pendant le troisième trimestre de la grossesse, présentent un risque d’événements indésirables incluant des symptômes extrapyramidaux et/ou des symptômes de sevrage, pouvant varier en termes de sévérité et de durée après la naissance. Les réactions suivantes ont été rapportées : agitation, hypertonie, hypotonie, tremblements, somnolence anormale, détresse respiratoire, troubles de l’alimentation.
Allaitement
L’allaitement est déconseillé pendant la durée du traitement.
Fertilité
FLUANXOL peut entrainer une hyperprolactinémie et des troubles de la fonction de la reproduction pouvant avoir un impact sur la fertilité féminine et/ou masculine (voir rubrique 4.8).
Dans des études précliniques chez le rat, le flupentixol a affecté le taux de grossesse des femelles.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
L’attention est attirée notamment chez les conducteurs de véhicules et les utilisateurs de machines sur les risques de somnolence attachés à l’emploi de ce médicament.
La majorité des effets indésirables sont dose-dépendants. La fréquence et la sévérité de ces effets sont plus prononcées en début de traitement et s’estompent par la suite.
Des effets extrapyramidaux peuvent avoir lieu, surtout en début de traitement. Dans la plupart des cas, ces effets indésirables peuvent être contrôlés de façon satisfaisante en diminuant la posologie et/ou en administrant des antiparkinsoniens anticholinergiques.
L’utilisation d’antiparkinsoniens anticholinergiques n’est pas recommandée en prophylaxie de routine.
Les médicaments antiparkinsoniens n’ont pas d’action sur les dyskinésies tardives et peuvent provoquer leur aggravation. Il est recommandé de diminuer la posologie ou, lorsque c’est possible, d’interrompre le traitement par le flupentixol.
Les fréquences des effets indésirables ci-dessous sont indéterminées (ne peuvent être estimées sur la base des données disponibles issues des essais cliniques, des données de la littérature et des notifications spontanées).
|
Affections hématologiques et du système lymphatique |
Leucopénie, neutropénie, agranulocytose, thrombocytopénie. |
|
Affections du système immunitaire |
Hypersensibilité, réaction anaphylactique. |
|
Affections endocriniennes |
Hyperprolactinémie. |
|
Troubles du métabolisme et de la nutrition |
Augmentation ou diminution de l’appétit, prise de poids, hyperglycémie, intolérance au glucose. |
|
Affections psychiatriques |
Confusion, diminution de la libido, insomnie, dépression, agitation, nervosité. |
|
Affections du système nerveux |
Céphalée, convulsion, akathisie, dyskinésie, dyskinésie tardive, dystonie, syndrome extrapyramidal ou parkinsonisme (à type de tremblements, hyperkinésie, hypokinésie), trouble de l’élocution, somnolence, sensation vertigineuse, syndrome malin des neuroleptiques. |
|
Affections oculaires |
Crise oculogyre, trouble de l’accommodation, troubles visuels. |
|
Affections cardiaques |
Allongement de l’espace QT, arrêt cardiaque, mort subite inexpliquée, tachycardie ventriculaire, torsades de pointes. |
|
Affections vasculaires |
Hypotension, thromboembolie veineuse (voir rubrique 4.4). |
|
Affections respiratoires, thoraciques et médiastinales |
Dyspnée. |
|
Affections gastro-intestinales |
Douleur abdominale, nausées, vomissement, diarrhée, constipation, hypersalivation, bouche sèche. |
|
Affections hépatobiliaires |
Anomalie du bilan hépatique, ictère, hépatite. |
|
Affections de la peau et du tissu sous-cutané |
Prurit, hyperhidrose, réaction de photosensibilité, éruptions cutanées telles que rash, érythème, dermites bulleuses. |
|
Affections musculo-squelettiques et systémiques |
Rigidité musculaire, torticolis, trismus, myalgie. |
|
Affections du rein et des voies urinaires |
Rétention urinaire, trouble de la miction. |
|
Affections gravidiques, puerpérales et périnatales |
Syndrome de sevrage néonatal (voir rubrique 4.6). |
|
Affections des organes de reproduction et du sein |
Gynécomastie, galactorrhée, trouble de l’éjaculation, trouble de l’érection, aménorrhée. |
|
Troubles généraux et anomalies au site d’administration |
Asthénie, fièvre, malaise. |
L’arrêt brutal du flupentixol peut être accompagné de symptômes de sevrage. Les symptômes les plus fréquents sont : nausée, vomissement, anorexie, diarrhée, rhinorrhée, sueur, myalgies, paresthésies, insomnie, impatience, anxiété et agitation. Les patients peuvent aussi présenter des vertiges, une sensation alternée de chaud et de froid et des tremblements.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/.
Symptômes :
Somnolence, coma, symptômes extrapyramidaux, convulsions, choc, hyperthermie/hypothermie.
Des modifications de l’ECG, un allongement de l’espace QT, des torsades de pointes, un arrêt cardiaque et des arythmies ventriculaires ont été rapportés en cas de surdosage en association avec des médicaments connus pour leur effet cardiaque.
Traitement :
En cas d’ingestion orale, un lavage gastrique doit être instauré le plus rapidement possible et peut être suivi d’une administration de charbon activé.
Une surveillance cardiorespiratoire doit être instaurée.
Ne pas utiliser l’adrénaline car la stimulation des récepteurs ß-adrénergiques peut entraîner une hypotension.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : antipsychotique - dérivé Thioxanthène, code ATC : N05AF01.
Neuroleptique incisif de la série des thioxanthènes, le flupentixol est un puissant inhibiteur de la stimulation de l’activité adénylcyclasique par la dopamine au niveau du corps strié.
Cliniquement, l’activité du flupentixol se caractérise par :
· un effet anti-psychotique et anti-hallucinatoire,
· une action sur l’inhibition,
· un effet sédatif à doses élevées,
· des propriétés anticholinergiques.
5.2. Propriétés pharmacocinétiques
La concentration sérique maximale est atteinte entre 3 et 8 heures après l’ingestion.
Le temps de demi-vie sérique est d’environ 24 heures chez l’adulte, impliquant un rythme d’administration de 1 à 2 prises par jour.
L’élimination est essentiellement hépatique.
Le flupentixol est dégradé par sulfoxydation et désalkylation.
L’excrétion biliaire importante traduit une circulation entéro-hépatique intense.
L’excrétion fécale est 4 à 5 fois supérieure à l’élimination urinaire.
5.3. Données de sécurité préclinique
Dans des études de fertilité chez les rats, le flupentixol a affecté le taux de grossesse des femelles. Les études de reproduction chez les souris, les rats et les lapins n’ont pas mis en évidence d’effets tératogènes.
Chez le rat et le lapin, des augmentations des pertes post-implantatoires, du taux de résorptions, ou des avortements occasionnels étaient observés à doses maternotoxiques (2,5 à 4 fois supérieures à la dose thérapeutique maximale de 200 mg en se basant sur la surface corporelle).
Chez le rat, une étude mettait en évidence un effet embryolétal à doses non maternotoxiques et inférieures à la dose thérapeutique maximale de 200 mg (en se basant sur la surface corporelle).
Ethanol à 96 % v/v, eau purifiée.
Sans objet.
Avant ouverture : 12 mois.
Après ouverture, la solution buvable doit être utilisée dans les 15 jours.
6.4. Précautions particulières de conservation
A conserver à une température ne dépassant pas 25°C.
A conserver dans son emballage d’origine à l’abri de la lumière.
6.5. Nature et contenu de l'emballage extérieur
10 ml en flacon (verre jaune) muni d’une seringue doseuse pour administration orale en polypropylène/ polyéthylène avec joint silicone, graduée en 5 mg (de 5 mg à 50 mg).
6.6. Précautions particulières d’élimination et de manipulation
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
LUNDBECK SAS
TOUR W, 102 TERRASSE BOIELDIEU
92800 PUTEAUX
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 316 555 2 7 : 10 ml en flacon (verre jaune) muni d’une seringue doseuse pour administration orale en polypropylène/ polyéthylène avec joint silicone, graduée en 5 mg (de 5 mg à 50 mg).
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Sans objet.
Liste I
ANSM - Mis à jour le : 17/04/2025
FLUANXOL 4 %, solution buvable
Flupentixol
Veuillez lire attentivement cette notice avant de prendre ce médicament car elle contient des informations importantes pour vous.
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin ou votre pharmacien.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que FLUANXOL 4 %, solution buvable et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant de prendre FLUANXOL 4 %, solution buvable ?
3. Comment prendre FLUANXOL 4 %, solution buvable ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver FLUANXOL 4 %, solution buvable ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE FLUANXOL 4 %, solution buvable ET DANS QUELS CAS EST-IL UTILISE ?
Classe pharmacothérapeutique : antipsychotique – dérivé Thioxanthène - code ATC : N05AF01.
FLUANXOL 4 %, solution buvable est utilisé dans le traitement de certains troubles du comportement.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT DE PRENDRE FLUANXOL 4 %, solution buvable ?
Ne prenez jamais FLUANXOL 4 %, solution buvable :
· si vous êtes allergique au flupentixol ou à l’un des autres composants contenus dans ce médicament, mentionnés dans la rubrique 6,
· si vous avez une pression excessive dans l’œil (glaucome),
· si vous avez un risque de rétention urinaire lié à des troubles urétro-prostatiques,
· en cas de dépression du système nerveux central,
· en association avec :
o certains médicaments agissant sur le système nerveux central : cabergoline, quinagolide
o de la dompéridone (utilisée dans le soulagement des nausées et vomissements, sensations de ballonnements, gênes ou régurgitations gastriques)
o du citalopram, de l’escitalopram (utilisés pour traiter la dépression)
o de l’hydroxyzine (utilisés pour traiter l’anxiété, l’urticaire et certaines insomnies chez l’enfant) (voir rubrique « Autres médicaments et FLUANXOL 4 %, solution buvable »)
o de la pipéraquine (médicament indiqué dans le traitement des accès de paludisme non compliqués)
EN CAS DE DOUTE, IL EST INDISPENSABLE DE DEMANDER L’AVIS DE VOTRE MEDECIN OU DE VOTRE PHARMACIEN.
Avertissements et précautions
Adressez-vous à votre médecin ou pharmacien avant de prendre FLUANXOL 4 %, solution buvable.
· une forte fièvre, une raideur inhabituelle des muscles et un trouble de votre conscience, en particulier s’ils sont accompagnés de sueurs et d’un rythme cardiaque rapide, peuvent être les signes d’une complication rare appelée syndrome malin des neuroleptiques qui a été rapportée lors de l’utilisation de différents antipsychotiques. Ceci est une urgence : contactez immédiatement votre médecin ;
· avertissez votre médecin si vous êtes épileptique ou avez fait des convulsions soit récemment soit dans le passé, ceci pouvant imposer des précautions d’utilisation de FLUANXOL ;
· si vous avez une fonction hépatique ou rénale diminuée ou si vous avez présenté par le passé une atteinte grave du foie, votre médecin devra peut-être réajuster votre traitement ou effectuer une surveillance biologique ;
· avertissez votre médecin en cas d’antécédents de maladie du cœur ;
· si vous ou un membre de votre famille avez des antécédents de formation de caillots sanguins (par exemple phlébites), puisque ce type de traitement a été associé à la formation de caillots sanguins.
Des précautions particulières doivent être prises :
· si vous avez des facteurs de risque d’accident vasculaire cérébral ;
· si vous avez des antécédents de troubles cardiaques ;
· si vous utilisez d’autres médicaments antipsychotiques ;
· si vous êtes plus excité ou hyperactif par rapport à d’habitude, car ce médicament peut accroître ces sensations ;
· si vous êtes diabétique ou que vous présentez des facteurs de risque de diabète, vous devrez surveiller très attentivement votre glycémie (taux de sucre dans le sang) pendant le traitement et votre médecin devra peut-être réajuster votre traitement.
Votre médecin pourra être amené à vous faire pratiquer un électrocardiogramme.
Enfants
Sans objet.
Autres médicaments et FLUANXOL 4 %, solution buvable
Ce médicament ne doit pas être utilisé avec certains médicaments agissant sur le système nerveux central (cabergoline, quinagolide), la dompéridone, l’hydroxyzine et la pipéraquine (voir rubrique « Ne prenez jamais FLUANXOL 4 %, solution buvable »).
Ce médicament doit être évité avec :
· l’alcool ou des médicaments contenant de l’alcool,
· certains médicaments utilisés pour le traitement de la maladie de Parkinson (amantadine, apomorphine, bromocriptine, entacapone, lévodopa, lisuride, pergolide, piribédil, pramipexole, rasagiline, ropinirole, sélégiline),
· certains médicaments antiparasitaires (chloroquine, halofantrine, luméfantrine, pentamidine),
· l’hydroxychloroquine
· avec la méthadone utilisée dans le sevrage aux opiacés,
· certains médicaments agissant sur le système nerveux central (amisulpride, chlorpromazine, cyamémazine, dropéridol, fluphénazine, halopéridol, lévomépromazine, pimozide, pipampérone, pipotiazine, sulpiride, sultopride, tiapride, zuclopenthixol),
· autres traitements (amiodarone, arsénieux, diphémanil, disopyramide, dolasétron administré dans une veine, dronedarone, érythromycine administré dans une veine, hydroquinidine, méquitazine, mizolastine, moxifloxacine, prucalopride, quinidine, sotalol, spiramycine administré dans une veine, torémifène, vandétanib, vincamine administrée dans une veine),
· l’oxybate de sodium utilisé dans le traitement de la narcolepsie.
Informez votre médecin ou pharmacien si vous prenez, avez récemment pris ou pourriez prendre tout autre médicament, y compris un médicament obtenu sans ordonnance.
FLUANXOL 4 %, solution buvable avec des aliments, boissons et de l’alcool
Vous ne devez pas prendre d’alcool (ou d’autres toxiques) avec ce type de traitement.
Grossesse et allaitement
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin avant de prendre ce médicament.
Grossesse
Il est préférable de ne pas utiliser ce médicament pendant la grossesse. Si vous découvrez que vous êtes enceinte, consultez votre médecin, lui seul peut juger de la nécessité de poursuivre le traitement.
Les symptômes suivants peuvent apparaître chez les nouveau-nés dont les mères ont pris FLUANXOL durant le dernier trimestre de la grossesse (les 3 derniers mois) : tremblements, raideur et/ou faiblesse musculaire, endormissement excessif, agitation, problème de respiration et difficultés à s’alimenter. Si votre bébé développe l’un de ces symptômes, vous devez contacter votre médecin.
Allaitement
L’allaitement est déconseillé pendant la durée du traitement.
Conduite de véhicules et utilisation de machines
L’attention est attirée notamment chez les conducteurs de véhicules et les utilisateurs de machines sur les risques de somnolence attachés à l’emploi de ce médicament.
FLUANXOL 4 %, solution buvable contient de l’éthanol.
Ce médicament contient 300 mg d’alcool (éthanol 96%) dans chaque ml, ce qui équivaut à 35,6 % v/v. La quantité contenue dans 1 ml de ce médicament est équivalente à 8 ml de bière ou 3 ml de vin.
La quantité d'alcool contenue dans ce médicament n'est pas susceptible d'avoir un effet chez les adultes.
L'alcool contenu dans ce médicament peut modifier les effets d'autres médicaments. Parlez-en à votre médecin ou à votre pharmacien si vous prenez d'autres médicaments.
Si vous êtes enceinte ou que vous allaitez, parlez-en à votre médecin ou à votre pharmacien avant de prendre ce médicament.
Si vous êtes dépendant à l'alcool, parlez-en à votre médecin ou à votre pharmacien avant de prendre ce médicament.
L’utilisation de ce médicament est dangereuse chez les sujets alcooliques et doit être prise en compte chez les femmes enceintes ou allaitant, les enfants et les groupes à haut risque tels que les insuffisants hépatiques ou les épileptiques.
3. COMMENT PRENDRE FLUANXOL 4 %, solution buvable ?
Posologie
Respectez toujours la posologie indiquée par votre médecin.
N’utilisez que la seringue à usage orale graduée jointe dans l’emballage.
En cas d’incertitude, consultez votre médecin ou votre pharmacien.
SE CONFORMER STRICTEMENT A L’ORDONNANCE DE VOTRE MEDECIN.
Mode et voie d’administration
La seringue doseuse pour administration orale est graduée en 5 mg de 5 à 50 mg. Vous obtiendrez la dose prescrite par votre médecin en suivant les consignes suivantes :
1. Appuyer sur le bouchon et dévisser.
2. Placer la seringue doseuse pour administration orale dans l’orifice du système d’adaptation.
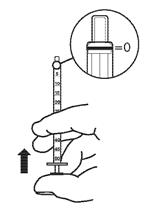
3. Renverser le flacon et la seringue doseuse pour administration orale puis aspirer la solution buvable. Le volume aspiré dans la seringue doseuse pour administration orale doit être légèrement supérieur à celui prescrit.
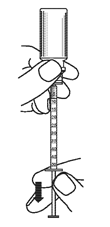
4. Appuyer sur le piston de la seringue doseuse pour administration orale afin d’éliminer le surplus de solution et d’obtenir la dose exacte prescrite.
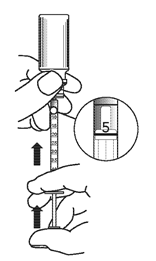
5. Retourner le flacon et la seringue doseuse pour administration orale avant de séparer la seringue à usage oral du flacon. Refermer le flacon.
6. Verser le contenu de la seringue doseuse pour administration orale dans votre boisson (un verre d’eau, de jus d’orange ou de pomme), mélanger brièvement et boire la totalité.
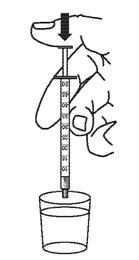
7. Laver la seringue doseuse pour administration orale à l’eau.
Si vous avez pris plus de FLUANXOL 4 %, solution buvable que vous n’auriez dû
Avertissez immédiatement votre médecin.
Les symptômes en cas de surdosage peuvent inclure :
· somnolence,
· perte de connaissance,
· mouvements anormaux,
· rigidité musculaire,
· convulsions,
· tension artérielle faible, pouls faible, fréquence cardiaque rapide, pâleur, agitation,
· température corporelle élevée ou diminuée,
· modifications du rythme cardiaque : battements cardiaques irréguliers ou lents.
Si vous oubliez de prendre FLUANXOL 4 %, solution buvable
Sans objet.
Si vous arrêtez de prendre FLUANXOL 4 %, solution buvable
Sans objet.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Comme tous les médicaments, ce médicament peut provoquer des effets indésirables, mais ils ne surviennent pas systématiquement chez tout le monde.
Si vous ressentez l’un des effets indésirables suivants, vous devez contacter votre médecin ou aller immédiatement à l’hôpital :
· Mouvements anormaux de la bouche et de la langue, ce sont peut-être les premiers signes d’une maladie appelée dyskinésie tardive.
· Forte fièvre, raideur inhabituelle des muscles et trouble de la conscience accompagnés de sueurs et d’un rythme cardiaque rapide ; ces symptômes peuvent être les signes d’une maladie rare appelée syndrome malin des neuroleptiques, également rapportée au cours de l’utilisation d’autres neuroleptiques.
· Un jaunissement de la peau et du blanc de l’œil sont les signes d’un mauvais fonctionnement du foie (signes d’une maladie appelée jaunisse).
Les effets indésirables suivants sont plus prononcés en début de traitement et la plupart s’estompent habituellement au cours du traitement.
· Diminution du taux de plaquettes sanguines (thrombocytopénie), diminution du taux de globules blancs pouvant être très sévère (neutropénie, leucopénie, agranulocytose).
· Réaction allergique (hypersensibilité), réaction allergique aiguë systémique avec une chute de la pression sanguine (réaction anaphylactique).
· Augmentation du taux de prolactine sanguin.
· Augmentation ou diminution de l’appétit, prise de poids, augmentation du taux de glucose sanguin, intolérance au glucose.
· Confusion, diminution de la libido, difficultés à s’endormir (insomnie), dépression et agitation, nervosité.
· Maux de tête, convulsion, incapacité à rester assis ou debout tranquillement (akathisie), mouvements saccadés (dyskinésie), torsions ou mouvements répétitifs ou positions anormales dus à des contractions musculaires prolongées (dystonie), syndrome extrapyramidal (parkinsonisme) se manifestant par des mouvements involontaires (hyperkinésie), mouvements ralentis ou diminués (hypokinésie), des tremblements, troubles de la parole, envie de dormir (somnolence), sensation vertigineuse.
· Mouvements anormaux des yeux (crise oculogyre), difficultés à regarder les objets de près (troubles de l’accommodation), troubles de la vue.
· Trouble du rythme cardiaque (irrégulier ou lent, modifications de l’ECG), pouvant entraîner le décès (voir rubrique « Avertissements et précautions »), accélération du rythme cardiaque (tachycardie).
· Diminution de la pression sanguine (hypotension), caillots sanguins veineux (phlébites) surtout dans les jambes (les symptômes incluent gonflement, douleur et rougeur des jambes), pouvant circuler dans les vaisseaux sanguins vers les poumons et entraîner une douleur dans la poitrine accompagnée de difficultés à respirer. Si vous remarquez un de ces symptômes, consultez immédiatement votre médecin.
· Difficultés à respirer ou respiration douloureuse (dyspnée).
· Douleurs abdominales, nausées, vomissement, diarrhée, constipation, augmentation de la sécrétion salivaire, bouche sèche.
· Modifications des fonctions hépatiques, jaunisse, hépatite.
· Réaction cutanée due à une sensibilité à la lumière (réaction de photosensibilité), éruption cutanée (rash, rougeur cutanée (érythème), lésions bulleuses), démangeaisons (prurit), augmentation de la transpiration (hyperhidrose).
· Rigidité musculaire, torticolis, raideur du cou, incapacité à ouvrir la bouche (trismus), douleurs musculaires (myalgies).
· Difficultés voire incapacité à uriner (troubles de la miction voire rétention urinaire).
· Augmentation du volume des seins chez l’homme (gynécomastie), écoulement de lait en dehors de la période de lactation (galactorrhée), troubles sexuels (retard à l’éjaculation, problèmes d’érection), disparition des règles (aménorrhée).
· Fatigue, fièvre, sensation de malaise.
Chez les patients âgés atteints de démence, une faible augmentation du nombre de décès a été rapportée chez les patients prenant des antipsychotiques comparés à ceux n’en prenant pas.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/.
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER FLUANXOL 4 %, solution buvable ?
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur la boîte. La date de péremption fait référence au dernier jour de ce mois.
A conserver à une température ne dépassant pas 25°C.
A conserver dans son emballage d’origine à l’abri de la lumière.
Après ouverture du flacon, le médicament doit être conservé pendant 15 jours maximum.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient FLUANXOL 4 %, solution buvable
· La substance active est :
Dichlorhydrate de flupentixol.................................................................................................. 4,67 g
Quantité correspondant en flupentixol base à.......................................................................... 4,00 g
Pour 100 ml.
· Les autres composants sont :
Ethanol à 96 % v/v, eau purifiée.
Qu’est-ce que FLUANXOL 4 %, solution buvable et contenu de l’emballage extérieur
Ce médicament se présente sous forme de solution buvable. Flacon de 10 ml.
Titulaire de l’autorisation de mise sur le marché
LUNDBECK SAS
TOUR W, 102 TERRASSE BOIELDIEU
92800 PUTEAUX
Exploitant de l’autorisation de mise sur le marché
LUNDBECK SAS
TOUR W, 102 TERRASSE BOIELDIEU
92800 PUTEAUX
H. LUNDBECK A/S
OTTILIAVEJ 9
2500 VALBY
DANEMARK
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Sans objet.
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).