Dernière mise à jour le 06/11/2025
SOFTACORT 3,35 mg/ml, collyre en solution en récipient unidose
Indications thérapeutiques
Classe pharmacothérapeutique : Anti-inflammatoires – Corticoïdes non associés
Code ATC : S01BA02
Ce médicament est un collyre en solution en récipient unidose qui contient une substance appelée hydrocortisone. Cette substance est un corticoïde qui empêche le développement de symptômes inflammatoires.
Il est utilisé pour traiter les états allergiques ou inflammatoires modérés de la partie superficielle de l’œil (conjonctive).
L’œil ne doit pas être infecté (voir « N’utilisez jamais SOFTACORT 3,35 mg/ml, collyre en solution en récipient unidose »).
Présentations
> 30 récipient(s) unidose(s) polyéthylène basse densité (PEBD) de 0,4 ml
Code CIP : 34009 300 956 4 5
Déclaration de commercialisation : 10/04/2018
Cette présentation est agréée aux collectivités
Service médical rendu (SMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Important | Avis du 22/03/2023 | Inscription (CT) | Le service médical rendu par SOFTACORT 3,35 mg/ml, collyre en solution en récipient unidose, est important dans l’indication de l’AMM. |
| Important | Avis du 10/01/2018 | Inscription (CT) | Le service médical rendu par SOFTACORT est important dans l’indication de l’AMM. |
Amélioration du service médical rendu (ASMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprés de la HAS (plus d'informations dans l'aide). Les avis et synthéses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur de l'ASMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| V (Inexistant) | Avis du 22/03/2023 | Inscription (CT) | Compte tenu : • du faible niveau de preuve de la démonstration de l’efficacité de SOFTACORT (hydrocortisone), • de l’absence de comparaison aux autres corticoïdes en collyre, • de la tolérance de l’hydrocortisone imposant, comme pour les autres corticoïdes, une utilisation de courte durée avec une diminution progressive des doses, la Commission considère que SOFTACORT 3,35 mg/ml, collyre en solution en récipient unidose n’apporte pas d’amélioration du service médical rendu (ASMR V) dans la stratégie thérapeutique actuelle qui comprend les autres collyres à base de corticoïdes. |
| V (Inexistant) | Avis du 10/01/2018 | Inscription (CT) | La Commission considère que SOFTACORT n’apporte pas d’amélioration du service médical rendu (ASMR V) dans la stratégie thérapeutique actuelle qui comprend les autres collyres à base de corticoïdes. |
ANSM - Mis à jour le : 22/11/2023
SOFTACORT 3,35 mg/ml, collyre en solution en récipient unidose
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Phosphate sodique d’hydrocortisone................................................................................... 3,35 mg
Pour 1 ml de collyre en solution.
Une goutte contient environ 0,12 mg de phosphate sodique d’hydrocortisone.
Pour la liste complète des excipients, voir rubrique 6.1.
Collyre en solution en récipient unidose.
La solution est quasiment limpide, incolore à légèrement jaune, pratiquement exempte de particules.
pH : 6,9 - 7,5
Osmolalité : 280-320 mosmol/kg
4.1. Indications thérapeutiques
Traitement des pathologies conjonctivales modérées et non infectieuses d’origine allergique ou inflammatoire.
4.2. Posologie et mode d'administration
Posologie
La posologie recommandée est de 2 gouttes 2 à 4 fois par jour dans l’œil affecté.
La durée du traitement varie habituellement de quelques jours à 14 jours au maximum. Une diminution progressive jusqu’à une administration tous les deux jours est recommandée afin d’éviter une rechute.
En cas de réponse insuffisante, un corticoïde plus puissant doit être utilisé.
Population pédiatrique
La sécurité et l’efficacité dans la population pédiatrique n’ont pas été établies. Voir rubrique 4.4.
Personnes âgées
Aucun ajustement posologique n’est nécessaire chez les personnes âgées.
Mode d’administration
Voie ophtalmique.
Une unidose contient une quantité suffisante de collyre pour traiter les deux yeux.
A usage unique seulement.
Ce médicament est une solution stérile qui ne contient pas de conservateur. La solution contenue dans le récipient unidose doit être administrée immédiatement après son ouverture dans l’un ou les yeux atteints (voir rubrique 6.3).
Les patients doivent être informés :
· d’éviter tout contact entre l’embout de l’unidose et l’œil ou la paupière,
· d’utiliser le collyre en solution immédiatement après la première ouverture du récipient unidose et de jeter le récipient unidose après utilisation.
L’occlusion naso-lacrymale par la compression du canal lacrymal pendant une minute peut permettre de réduire l’absorption systémique.
En cas d’utilisation de plusieurs collyres en solution, les instillations doivent être espacées d’au moins 5 minutes.
· Hypersensibilité à la substance active ou à l'un des excipients mentionnés à la rubrique 6.1.
· Hypertension oculaire connue liée à l’administration de glucocorticoïdes et autre forme d’hypertension oculaire.
· Infection aiguë par le virus Herpes simplex ou la plupart des autres infections cornéennes virales au stade de l’ulcération (sauf en cas d’association avec une chimiothérapie antivirale spécifique au virus de l’herpès), conjonctivite avec kératite ulcéreuse dès le stade initial (test positif à la fluorescéine).
· Tuberculose oculaire.
· Mycose oculaire.
· Infection oculaire purulente aiguë, conjonctive purulente ou blépharite purulente, orgelet ou infection par le virus de l’herpès susceptibles d’être masqués ou aggravés par l’administration de médicaments anti-inflammatoires.
4.4. Mises en garde spéciales et précautions d'emploi
Les corticoïdes à usage local ne doivent jamais être administrés en présence d’un œil rouge non diagnostiqué.
Ce médicament n’est pas recommandé pour le traitement de la kératite herpétique, mais il peut être utilisé si nécessaire uniquement en association avec un traitement antiviral et sous la supervision étroite d’un ophtalmologiste.
Un amincissement pathologique de la cornée et de la sclère peut accroître le risque de perforation lors de l’utilisation de corticoïdes locaux.
Une infection fongique doit être suspectée en cas d’ulcération cornéenne quand un corticoïde est ou a été utilisé pendant une période prolongée.
Les patients traités par un collyre à base d’hydrocortisone doivent faire l’objet d’un suivi fréquent. Il a été montré que l’utilisation prolongée de corticoïdes peut causer une hypertension oculaire ou un glaucome en particulier chez les patients présentant des antécédents d’augmentation de la PIO liée à l’administration de corticoïdes ou présentant une PIO élevée préexistant ou un glaucome, (voir rubriques 4.3. et 4.8) et le développement d’une cataracte, notamment chez les enfants et les personnes âgées.
L’utilisation de corticoïdes peut également provoquer des infections oculaires opportunistes liées à la suppression de la réponse de l’hôte ou au retardement de la cicatrisation. De plus, les corticoïdes à usage local administrés par voie ophtalmique peuvent favoriser, aggraver ou masquer les signes et symptômes d’infections oculaires opportunistes.
Il convient d'éviter le port de lentilles de contact pendant le traitement par un collyre contenant des corticoïdes.
Troubles visuels
Des troubles visuels peuvent apparaitre lors d’une corticothérapie par voie systémique ou locale. En cas de vision floue ou d’apparition de tout autre symptôme visuel apparaissant au cours d’une corticothérapie, un examen ophtalmologique est requis à la recherche notamment d’une cataracte, d’un glaucome, ou d’une lésion plus rare telle qu’une choriorétinopathie séreuse centrale, décrits avec l’administration de corticostéroïdes par voie systémique ou locale.
Ce médicament contient 0,227 mg de phosphates par goutte (voir rubrique 4.8).
Population pédiatrique
Chez l'enfant, un traitement continu de longue durée par les corticoïdes peut produire une insuffisance surrénalienne (voir rubrique 4.2).
Chez l’enfant, l’hypertension oculaire liée à l’utilisation de corticoïdes topiques est plus fréquente, plus sévère et plus rapide que celle rapportée chez l’adulte.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Aucune étude d’interaction n’a été réalisée.
Une augmentation du risque d'effets secondaires systémiques est attendu en cas de traitement concomitant (ou traitement en association) avec des inhibiteurs du CYP3A, y compris les produits contenant du cobicistat. L’association doit être évitée sauf si le bénéfice est supérieur au risque accru d'effets secondaires systémiques liés aux corticoïdes, auquel cas les patients doivent être surveillés pour les effets secondaires systémiques liés à l’utilisation de corticoïdes.
4.6. Fertilité, grossesse et allaitement
Grossesse
Il n’existe que peu ou pas de données sur l’utilisation de SOFTACORT chez la femme enceinte. Les corticoïdes traversent le placenta. Les études chez l'animal ont mis en évidence une toxicité sur la reproduction avec la formation de fentes palatines (voir rubrique 5.3). La pertinence clinique de ces observations est inconnue. Après administration de corticoïdes par voie systémique à des doses plus élevées, des effets sur le fœtus/nouveau-né ont été rapportés (retard de croissance intra-utérine, inhibition de la fonction corticosurrénale). Néanmoins, ces effets n’ont pas été rapportés lors d’un usage par voie ophtalmique.
L’utilisation de SOFTACORT n’est pas recommandée au cours de la grossesse, sauf en cas de nécessité absolue.
Allaitement
Les glucocorticoïdes administrés de façon systémique sont excrétés dans le lait maternel et peuvent provoquer un arrêt de la croissance ou de la production de corticoïdes endogènes ou peuvent avoir d'autres effets indésirables.
On ignore si SOFTACORT est excrété dans le lait maternel.
Un risque pour les nouveau-nés / nourrissons ne peut être exclu.
Fertilité
Il n'existe aucune donnée concernant un effet potentiel du phosphate sodique d’hydrocortisone 3,35 mg/ml sur la fertilité.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Aucune étude sur l’effet de ce médicament sur la capacité à conduire et à utiliser des machines n’a été réalisée.
Une vision trouble temporaire ou d’autres perturbations de la vue peuvent avoir un effet sur l’aptitude à conduire des véhicules et à utiliser des machines. Si une vision trouble apparaît, le patient doit attendre jusqu'à ce que sa vision soit revenue à la normale avant de conduire des véhicules ou d’utiliser des machines.
4.8. Effets indésirables
Liste des effets indésirables :
Les effets indésirables sont classés selon les catégories de fréquence suivantes : très fréquent (≥ 1/10) ; fréquent (≥ 1/100, < 1/10) ; peu fréquent (≥ 1/1 000, < 1/100) ; rare (≥ 1/10 000, < 1/1 000) ; très rare (< 1/10 000) ; fréquence indéterminée (ne peut être estimée sur la base des données disponibles).
Hydrocortisone
Affections oculaires :
· Fréquence indéterminée : Brûlures*, picotements*.
Effets de la classe des corticoïdes
Les effets indésirables suivants n’ont pas été observés avec l’hydrocortisone, mais sont survenus avec d’autres corticoïdes à usage local.
Affections oculaires :
· Fréquence indéterminée : Réactions allergiques et d’hypersensibilité, retard de cicatrisation, cataracte capsulaire postérieure*, infections opportunistes (infection par le virus Herpes simplex, infections fongiques, voir rubrique 4.4), glaucome*, mydriase, ptosis, uvéite induite par les corticoïdes, variations de l’épaisseur de la cornée*, kératopathie cristalline, vision floue (voir rubrique 4.4).
* voir rubrique « Description de certains effets indésirables »
Quelques cas rares de calcification cornéenne ont été signalés en association avec l’utilisation de gouttes contenant des phosphates chez certains patients atteints de cornées gravement endommagées.
Description de certains effets indésirables :
Une sensation de brûlure et des picotements peuvent apparaître immédiatement après l'instillation. Ces manifestations sont généralement modérées, de courte durée et n’ont aucune conséquence.
Il a été montré que l’utilisation prolongée de corticoïdes peut causer une hypertension oculaire ou un glaucome (en particulier chez les patients présentant des antécédents d’augmentation de la pression intra-oculaire suite à la prise de corticoïdes ou présentant une pression intra-oculaire élevée préexistante ou un glaucome, ou des antécédents familiaux de PIO élevée ou de glaucome) ou également la formation d’une cataracte. Les enfants et les patients âgés peuvent être particulièrement sensibles à l’augmentation de la pression intra-oculaire induite par les corticoïdes (voir rubrique 4.4).
L’augmentation de la pression intra-oculaire induite par un traitement topique corticoïde a été généralement observée au cours des 2 premières semaines de traitement (voir rubrique 4.4.).
Les diabétiques sont également plus susceptibles de développer une cataracte sous-capsulaire suite à l’administration de corticoïde topique.
Dans les maladies provoquant un amincissement de la cornée, l’utilisation topique de corticoïdes peut conduire dans certains cas à une perforation (voir rubrique 4.4).
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/.
En cas de surdosage lors d’une administration locale, avec irritation oculaire prolongée, il convient de rincer l’œil ou les yeux à l’eau stérile.
Un surdosage prolongé peut entraîner une hypertension oculaire. Dans ce cas, il est nécessaire d’interrompre le traitement.
La symptomatologie due à une ingestion accidentelle n'est pas connue. Néanmoins, comme avec d'autres corticoïdes, le médecin peut envisager un lavage d'estomac ou le déclenchement de vomissements.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : ANTI-INFLAMMATOIRES – Corticoïdes non associés, code ATC : S01BA02.
Mécanisme d’action
L’hydrocortisone ou cortisol est un glucocorticoïde sécrété par les glandes surrénales et doté d’une activité antiinflammatoire capable de déclencher la sécrétion et d’induire la synthèse d’un inhibiteur spécifique de la PLA2 (lipocortine), ce qui bloque la cascade de l'acide arachidonique et la formation de facteurs phlogogéniques, tels que les prostaglandines, les thromboxanes, et les leucotriènes (SRS-A). Ce mécanisme d’action explique les propriétés anti-inflammatoires et anti-allergiques de l’hydrocortisone.
5.2. Propriétés pharmacocinétiques
Une étude pharmacocinétique menée chez le lapin avec SOFTACORT a démontré que, après administration, l’hydrocortisone se propage rapidement dans l’humeur aqueuse, la cornée et la conjonctive. La pénétration de l’hydrocortisone est la plus élevée dans la cornée, puis dans la conjonctive, et est très faible dans l’humeur aqueuse. Il a également été observé un faible passage de l’hydrocortisone dans la circulation systémique (< 2 % de la dose instillée).
5.3. Données de sécurité préclinique
L’administration répétée d’hydrocortisone sur une période prolongée par voie systémique chez l’animal a entraîné une diminution de la prise de poids, une augmentation de la néoglucogenèse et de l’hyperglycémie, une thymolyse et une hypertension oculaire.
Toxicité sur la reproduction
Chez la souris, il a été démontré que l’hydrocortisone administrée par voie ophtalmique entraîne des résorptions fœtales et la formation de fentes palatines. Chez le lapin, l’administration d’hydrocortisone par voie ophtalmique a entraîné des résorptions fœtales et des anomalies multiples affectant la tête et l’abdomen.
De plus, une inhibition de la croissance intra-utérine et des altérations du développement fonctionnel du système nerveux central ont été rapportées suite à l’administration de corticoïdes chez l’animal au cours de la gestation.
Phosphate disodique dodécahydraté, phosphate monosodique monohydraté, chlorure de sodium, édétate disodique, acide chlorhydrique (pour ajustement du pH), eau pour préparations injectables.
L’incompatibilité avec d’autres médicaments n’a pas été étudiée.
2 ans dans l’emballage extérieur.
Après la première ouverture du sachet : utiliser les récipients unidose dans un délai d’un mois.
Après ouverture du récipient unidose : utiliser immédiatement et jeter le récipient unidose après utilisation.
La stérilité ne pouvant pas être maintenue après l'ouverture du récipient unidose, tout contenu restant doit être jeté immédiatement après l'administration.
6.4. Précautions particulières de conservation
A conserver à une température ne dépassant pas 25°C.
Conserver les récipients unidose dans le sachet, à l'abri de la lumière.
Pour les conditions de conservation du médicament après première ouverture, voir la rubrique 6.3.
6.5. Nature et contenu de l'emballage extérieur
10 récipients unidose (PEBD) contenant 0,4 ml de collyre en solution conditionnés dans un sachet composé de quatre couches de papier/polyéthylène/aluminium/copolymère d’éthylène.
La boîte contient 10 (1 x 10), 20 (2 x 10), 30 (3 x 10) ou 60 (6 x 10) récipients unidose.
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
LABORATOIRES THEA
12, rue Louis Blériot
63017 Clermont-Ferrand Cedex 2
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 300 956 1 4 : 10 récipient(s) unidose(s) (PEBD) de 0,4 ml.
· 34009 300 956 3 8 : 20 récipient(s) unidose(s) (PEBD) de 0,4 ml.
· 34009 300 956 4 5 : 30 récipient(s) unidose(s) (PEBD) de 0,4 ml.
· 34009 300 956 5 2 : 60 récipient(s) unidose(s) (PEBD) de 0,4 ml.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Sans objet
Liste I
ANSM - Mis à jour le : 22/11/2023
Dénomination du médicament
SOFTACORT 3,35 mg/ml, collyre en solution en récipient unidose
Phosphate sodique d’hydrocortisone
Encadré
Veuillez lire attentivement cette notice avant d’utiliser ce médicament car elle contient des informations importantes pour vous.
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin, votre pharmacien ou votre infirmier/ère.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, votre pharmacien ou votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
Que contient cette notice ?
1. Qu'est-ce que SOFTACORT 3,35 mg/ml, collyre en solution en récipient unidose et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d'utiliser SOFTACORT 3,35 mg/ml, collyre en solution en récipient unidose ?
3. Comment utiliser SOFTACORT 3,35 mg/ml, collyre en solution en récipient unidose ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver SOFTACORT 3,35 mg/ml, collyre en solution en récipient unidose ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE SOFTACORT 3,35 mg/ml, collyre en solution en récipient unidose ET DANS QUELS CAS EST-IL UTILISE ?
Classe pharmacothérapeutique : Anti-inflammatoires – Corticoïdes non associés
Code ATC : S01BA02
Ce médicament est un collyre en solution en récipient unidose qui contient une substance appelée hydrocortisone. Cette substance est un corticoïde qui empêche le développement de symptômes inflammatoires.
Il est utilisé pour traiter les états allergiques ou inflammatoires modérés de la partie superficielle de l’œil (conjonctive).
L’œil ne doit pas être infecté (voir « N’utilisez jamais SOFTACORT 3,35 mg/ml, collyre en solution en récipient unidose »).
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER SOFTACORT 3,35 mg/ml, collyre en solution en récipient unidose?
N’utilisez jamais SOFTACORT 3,35 mg/ml, collyre en solution en récipient unidose
· si vous êtes allergique (hypersensible) à la substance active (hydrocortisone) ou à l’un des autres composants contenus dans ce médicament, mentionnés dans la rubrique 6.
· si vous avez une pression élevée dans l’œil (hypertension intraoculaire), causée par les glucocorticoïdes (une famille de corticoïdes), ou par toute autre cause.
· si vous avez une infection aiguë causée par le virus de l’herpès et par la plupart des autres infections virales au stade de l’ulcération (sauf si l'infection est traitée avec un traitement anti-infectieux pour le virus de l'herpès).
· si vous avez une conjonctivite avec une inflammation ulcérative de la cornée (kératite), même au stade initial.
· si vous avez une infection de l’œil causée par des bactéries (infection purulente aiguë, conjonctivite, blépharite ou orgelet).
· si vous avez une infection de l’œil causée par des champignons (mycose oculaire).
· si vous avez une infection bactérienne appelée tuberculose qui affecte votre œil (tuberculose oculaire).
Avertissements et précautions
Adressez-vous à votre médecin, pharmacien ou infirmier/ère avant d’utiliser ce médicament.
· N’utilisez pas ce médicament si vous avez un œil rouge dont la cause n’est pas connue.
· Si vous avez une infection virale de l’œil (herpès), n’utilisez ce médicament que si l’infection est traitée par un médicament antiinfectieux. Une surveillance étroite de vos yeux est nécessaire.
· Si vous avez une maladie qui entraîne un amincissement de la partie externe de votre œil (cornée et sclère), vous pouvez être exposé(e) à un risque plus élevé de perforation causée par l’utilisation de corticoïdes à usage local administrés dans l’œil.
· Si vous utilisez ou avez déjà utilisé un corticoïde pendant une période prolongée et avez une lésion oculaire (ulcère cornéen), une infection fongique doit être suspectée.
· Une surveillance étroite régulière de vos yeux est nécessaire au cours du traitement. Une utilisation prolongée de corticoïdes a montré une augmentation de la pression dans l’œil et l’apparition de glaucome, en particulier chez les patients qui ont déjà présenté une pression intra-oculaire élevée par le passé ou qui ont le risque de développer ce type de problème lors de l’utilisation d’un traitement corticoïde à usage local (voir rubrique « Quels sont les effets indésirables éventuels ? ») et provoque une opacification du cristallin (cataracte), en particulier chez les enfants et les personnes âgées.
· L’utilisation de corticoïdes peut provoquer des infections oculaires opportunistes. De plus, les corticoïdes à usage local administrés par voie ophtalmique peuvent favoriser, aggraver ou masquer les signes et symptômes d’infections oculaires opportunistes.
· Vous devez éviter de porter des lentilles de contact au cours du traitement par ce médicament.
· Contactez votre médecin en cas de vision floue ou d’autres troubles visuels.
Enfants
Il n’y a pas de données connues de sécurité et d’efficacité chez l’enfant.
Chez l’enfant, le traitement continu à long terme avec des corticoïdes peut entraîner une insuffisance surrénalienne.
Chez l’enfant, l'augmentation de la pression oculaire se produit plus fréquemment, plus sévèrement et plus rapidement que chez l’adulte.
Autres médicaments et SOFTACORT 3,35 mg/ml, collyre en solution en récipient unidose
Informez votre médecin ou pharmacien si vous utilisez, avez récemment utilisé ou pourriez utiliser tout autre médicament y compris les médicaments obtenus sans ordonnance.
Certains médicaments peuvent augmenter les effets de SOFTACORT et votre médecin peut souhaiter vous surveiller attentivement si vous prenez ces médicaments (y compris certains médicaments contre le VIH: ritonavir, cobicistat).
SOFTACORT 3,35 mg/ml, collyre en solution en récipient unidose avec des aliments et boissons
Sans objet.
Grossesse et allaitement
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin ou pharmacien avant de prendre ce médicament.
· L’utilisation de ce médicament au cours de la grossesse n’est pas recommandée sauf si elle est jugée nécessaire par votre médecin et sous stricte surveillance.
· On ne sait pas si ce médicament passe dans le lait maternel. Votre médecin décidera si vous pouvez utiliser ce médicament pendant l'allaitement ou non.
Conduite de véhicules et utilisation de machines
Une vision trouble temporaire ou d’autres perturbations de la vue peuvent avoir un effet sur l’aptitude à conduire des véhicules et à utiliser des machines. Vous ne devez pas conduire de véhicules ou utiliser de machines jusqu’à ce que votre vue soit redevenue normale.
SOFTACORT 3,35 mg/ml, collyre en solution en récipient unidose contient des phosphates.
Ce médicament contient 0,227 mg de phosphates par goutte.
3. COMMENT UTILISER SOFTACORT 3,35 mg/ml, collyre en solution en récipient unidose ?
Posologie
Veillez à toujours utiliser ce médicament en suivant exactement les indications de votre médecin ou pharmacien. Vérifiez auprès de votre médecin ou pharmacien en cas de doute.
La posologie recommandée est de 2 gouttes dans l’œil ou les yeux à traiter, 2 à 4 fois par jour, selon ce que votre médecin vous a prescrit. Une réduction progressive de la dose est recommandée afin d’éviter une rechute. La durée du traitement varie habituellement de quelques jours à 14 jours au maximum.
La même dose doit être utilisée chez l’adulte et la personne âgée.
Utilisation chez les enfants
L'efficacité et la sécurité chez l’enfant n'ont pas été établies.
Comment utiliser le collyre
Ce médicament doit être administré dans l’œil.
Veuillez suivre les instructions suivantes lors de l’utilisation de ce collyre :
1. Lavez-vous les mains et asseyez-vous ou installez-vous confortablement.
2. Ouvrez le sachet contenant les 10 récipients unidose. Inscrivez la date de première ouverture sur le sachet.
3. Détachez un seul récipient unidose de la plaquette.
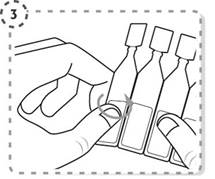
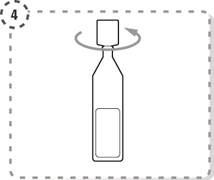
4. Tournez l’extrémité du récipient unidose pour l’ouvrir comme indiqué. Ne touchez pas l’embout du récipient après l’avoir ouvert.
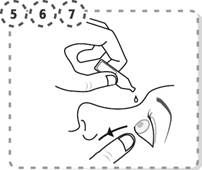
5. Avec vos doigts abaissez doucement la paupière inférieure de l’œil à traiter.
6. Approchez l’embout du récipient unidose de votre œil sans le toucher.
7. Pressez légèrement le récipient unidose afin de faire tomber deux gouttes dans votre œil, puis relâchez la paupière inférieure.
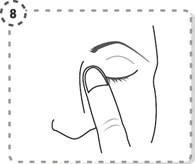
8. Appuyez légèrement avec votre doigt sur le coin interne de l'œil à traiter (proche du nez) pendant une minute tout en gardant l’œil fermé.
9. Répétez cette procédure dans l'autre œil si cela vous a été prescrit par votre médecin. Chaque récipient unidose contient assez de solution pour les deux yeux.
10. Jetez le récipient unidose immédiatement après l’administration. Ne pas le garder pour une utilisation ultérieure.
11. Remettez les récipients unidose non ouverts dans le sachet. Rangez le sachet ouvert dans sa boîte. Les récipients non ouverts doivent être utilisés dans le mois suivant l’ouverture du sachet.
Si vous utilisez un autre médicament qui doit être administré dans votre œil, vous devez attendre au moins 5 minutes entre l’administration de Softacort et celle de l’autre médicament.
Si vous avez utilisé plus de SOFTACORT 3,35 mg/ml, collyre en solution en récipient unidose que vous n’auriez dû
Rincez votre œil avec de l’eau stérile si vous avez instillé trop de médicament et que vous ressentez une irritation prolongée.
Contacter immédiatement votre docteur ou votre pharmacien.
Si vous oubliez d’utiliser SOFTACORT 3,35 mg/ml, collyre en solution en récipient unidose
Ne prenez pas de dose double pour compenser la dose que vous avez oublié de prendre.
Si vous arrêtez d’utiliser SOFTACORT 3,35 mg/ml, collyre en solution en récipient unidose
N’arrêtez pas brutalement votre traitement. Demandez toujours l’avis de votre médecin si vous envisagez d’arrêter votre traitement.
Si vous avez d’autres questions sur l’utilisation de ce médicament, demandez plus d’informations à votre médecin, à votre pharmacien ou à votre infirmier/ère.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Comme tous les médicaments, ce médicament peut provoquer des effets indésirables, mais ils ne surviennent pas systématiquement chez tout le monde.
Fréquence indéterminée : ne peut être estimée sur la base des données disponibles
· gêne temporaire dans l’œil (brûlure, picotements) après l’instillation.
Les effets indésirables suivants ont été rapportés avec des médicaments de la même famille (corticoïdes) utilisés dans le traitement des maladies oculaires.
Fréquence indéterminée : ne peut être estimée sur la base des données disponibles
· réactions allergiques,
· retard de cicatrisation,
· opacification du cristallin (cataracte capsulaire postérieure),
· infections opportunistes (virales telles que l’herpès, ou fongiques),
· augmentation de la pression dans votre œil (glaucome),
· dilatation de la pupille (mydriase),
· affaissement de la paupière (ptosis),
· inflammation à l’intérieur de votre oeil (uvéite),
· modifications de l’épaisseur de la partie antérieure de l’œil (cornée),
· inflammation de la cornée (kératopathie cristalline),
· vision floue.
Si vous souffrez de dommages sévères de la cornée (couche transparente située à l’avant de l’oeil) les phosphates peuvent causer, dans de très rares cas, des troubles de la vision en raison de l’accumulation de calcium pendant le traitement (nuage).
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, à votre pharmacien ou à votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet: https://signalement.social-sante.gouv.fr/
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER SOFTACORT 3,35 mg/ml, collyre en solution en récipient unidose ?
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur la boîte, le sachet et le récipient unidose après EXP. La date de péremption fait référence au dernier jour de ce mois.
A conserver à une température ne dépassant pas 25°C.
Après ouverture du sachet : utiliser les récipients unidose dans le mois suivant la première ouverture du sachet.
Conserver les récipients unidose dans le sachet, à l'abri de la lumière.
Inscrivez la date de première ouverture sur le sachet.
Après ouverture du récipient unidose : utiliser immédiatement et jeter le récipient unidose après utilisation.
Étant donné que la stérilité ne peut pas être maintenue après l'ouverture du récipient unidose, tout contenu restant doit être jeté immédiatement après l'administration.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient SOFTACORT 3,35 mg/ml, collyre en solution en récipient unidose
· La substance active est :
Phosphate sodique d’hydrocortisone................................................................................... 3,35 mg
Pour 1 ml de collyre en solution.
· Les autres composants sont : phosphate disodique dodécahydraté, phosphate monosodique monohydraté, chlorure de sodium, édétate disodique, acide chlorhydrique (pour ajustement du pH), eau pour préparations injectables.
Ce médicament se présente sous forme de collyre en solution en récipient unidose.
La solution est pratiquement limpide, incolore à légèrement jaune, pratiquement exempte de particules, conditionnée dans un sachet de 10 unités, chaque récipient unidose contenant 0,4 ml de solution.
La boîte contient 10 (1 x 10), 20 (2 x 10), 30 (3 x 10) ou 60 (6 x 10) récipients unidose.
Toutes les présentations peuvent ne pas être commercialisées.
Titulaire de l’autorisation de mise sur le marché
LABORATOIRES THEA
12, rue Louis Blériot
63017 Clermont-Ferrand Cedex 2
Exploitant de l’autorisation de mise sur le marché
THEA PHARMA
12 RUE LOUIS BLERIOT
ZI du brezet
63100 CLERMONT-FERRAND
LABORATOIRES UNITHER
1 RUE DE L’ARQUERIE
50200 COUTANCES
ou
LABORATOIRES THEA
12, RUE LOUIS BLERIOT
63017 CLERMONT-FERRAND CEDEX 2
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Ce médicament est autorisé dans les Etats membres de l'Espace Economique Européen sous les noms suivants : Conformément à la réglementation en vigueur.
[À compléter ultérieurement par le titulaire]
La dernière date à laquelle cette notice a été révisée est :
[À compléter ultérieurement par le titulaire]
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).