Dernière mise à jour le 01/12/2025
VARILRIX, poudre et solvant pour solution injectable en seringue préremplie. Vaccin varicelleux (vivant)
Indications thérapeutiques
Classe pharmacothérapeutique : Vaccins viraux, Vaccins contre varicelle-zona, code ATC : J07BK01.
VARILRIX est un vaccin qui peut être utilisé chez les sujets âgés de 12 mois et plus afin de les protéger de la varicelle. Dans certaines circonstances, VARILRIX peut également être administré aux nourrissons à partir de 9 mois.
Une vaccination dans les 3 jours suivant l’exposition à un patient ayant la varicelle peut aider à éviter la varicelle ou à diminuer la sévérité de la maladie.
Comment agit VARILRIX
Lorsqu’une personne est vaccinée avec VARILRIX, le système immunitaire (le système de défense naturelle de l’organisme) fabrique des anticorps pour protéger la personne contre l’infection par le virus de la varicelle.
VARILRIX contient des virus atténués qui sont très peu susceptibles de provoquer la varicelle chez des sujets en bonne santé.
Comme pour tous les vaccins, VARILRIX peut ne pas protéger complètement tous les sujets vaccinés.
Présentations
> 1 flacon(s) en verre - 1 seringue(s) préremplie(s) en verre de 0,5 ml avec 2 aiguille(s)
Code CIP : 362 772-2 ou 34009 362 772 2 9
Déclaration de commercialisation : 17/06/2004
Cette présentation est agréée aux collectivités
- Prix hors honoraire de dispensation : 36,64 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 37,66 €
- Taux de remboursement :65%
- Adulte à partir de 18 ans qui présentent une éruption dans les 3 jours suivant une exposition au virus
- Etudiants qui entrent en première année des études médicales et paramédicales
- Enfants qui sont candidats à une greffe d'organe solide (vaccination dans les 6 mois précédant de la greffe)
- Adolescents de 12 à 18 ans
- Femmes en âge de procréer, notamment celles qui ont un projet de grossesse
- Femmes dans les suites d'une première grossesse, sous couvert d'une contraception efficace ; JOURNAL OFFICIEL ; 23/09/04
Documents de bon usage du médicament
- Actualisation des recommandations et obligations vaccinales des professionnels (Volet 2/2 : coqueluche, grippe saisonnière, hépatite A, rougeole, oreillons, rubéole varicelle)
Auteur : Haute autorité de santé
Type : Recommandation vaccinale
Date de mise à jour :Juillet 2023
Service médical rendu (SMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Important | Avis du 10/07/2019 | Renouvellement d'inscription (CT) | Le service médical rendu par VARILIX reste important dans les populations recommandées dans le calendrier vaccinal en vigueur. |
Amélioration du service médical rendu (ASMR)
Pas d'ASMR disponible pour ce médicament (plus d'informations dans l'aide )
ANSM - Mis à jour le : 10/10/2025
VARILRIX, poudre et solvant pour solution injectable en seringue préremplie
Vaccin varicelleux (vivant)
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Après reconstitution, une dose (0,5 mL) contient :
Virus de la varicelle1 souche OKA (vivant, atténué)............................................ au minimum 103.3 UFP2
1 produit sur cellules diploïdes humaines (MRC-5)
2 unités formant plages
Ce vaccin contient des traces de néomycine (voir rubrique 4.3).
Excipients à effet notoire :
Ce vaccin contient 6 mg de sorbitol par dose.
Ce vaccin contient 331 microgrammes de phénylalanine par dose (voir rubrique 4.4).
Pour la liste complète des excipients, voir rubrique 6.1.
Poudre et solvant pour solution injectable en seringue préremplie.
Avant reconstitution, la poudre est de couleur légèrement crème à légèrement jaune ou rosé et le solvant est un liquide limpide et incolore.
4.1. Indications thérapeutiques
VARILRIX est indiqué pour l’immunisation active contre la varicelle :
· Chez les sujets sains âgés de 9 à 11 mois (voir rubrique 5.1), dans des circonstances particulières;
· Chez les sujets sains à partir de l’âge de 12 mois (voir rubrique 5.1) ;
· En prophylaxie post-exposition, en cas d’administration à des sujets sains « réceptifs » exposés à la varicelle dans les 72 heures suivant le contact (voir rubriques 4.4 et 5.1) ;
· Chez les sujets à haut risque de varicelle sévère (voir rubriques 4.3, 4.4 et 5.1).
L’utilisation de VARILRIX doit être basée sur les recommandations officielles.
4.2. Posologie et mode d'administration
Le calendrier de vaccination pour VARILRIX doit être basé sur les recommandations officielles.
Sujets sains
Nourrissons âgés de 9 mois à 11 mois (inclus)
Les nourrissons âgés de 9 à 11 mois (inclus) doivent recevoir deux doses de VARILRIX afin d’assurer une protection optimale contre la varicelle (voir rubrique 5.1). La deuxième dose doit être administrée après un intervalle minimum de 3 mois.
Enfants à partir de l’âge de 12 mois, adolescents et adultes
Les enfants âgés de 12 mois et plus, ainsi que les adolescents et les adultes doivent recevoir deux doses de VARILRIX afin d’assurer une protection optimale contre la varicelle (voir rubrique 5.1). La deuxième dose doit généralement être administrée au moins 6 semaines après la première dose.
En aucun cas l'intervalle entre les doses ne doit être inférieur à 4 semaines.
Sujets à haut risque de varicelle sévère
Les sujets à haut risque de varicelle sévère peuvent bénéficier d’un rappel de vaccination selon le schéma à 2 doses (voir rubrique 5.1). Un dosage périodique des anticorps dirigés contre la varicelle après l’immunisation peut être indiqué afin d’identifier les sujets qui pourraient bénéficier d’un rappel de vaccination. En aucun cas l'intervalle entre les doses ne doit être inférieur à 4 semaines.
Autre population pédiatrique
La sécurité et l’efficacité de VARILRIX chez les nourrissons âgés de moins de 9 mois n’ont pas été établies. Aucune donnée n’est disponible.
Interchangeabilité
· Une dose unique de VARILRIX peut être administrée aux sujets ayant déjà reçu une dose unique d’un autre vaccin varicelleux.
· Une dose unique de VARILRIX peut être administrée suivie d’une dose unique d’un autre vaccin varicelleux.
Mode d’administration
VARILRIX doit être injecté par voie sous-cutanée (SC) ou intramusculaire (IM) dans la région deltoïdienne ou dans la région antérolatérale de la cuisse.
VARILRIX doit être administré par voie sous-cutanée chez les sujets ayant un trouble hémostatique (par exemple une thrombocytopénie ou un trouble de la coagulation).
Pour les instructions concernant la reconstitution du médicament avant administration, voir la rubrique 6.6.
VARILRIX est contre-indiqué chez les sujets ayant un déficit sévère de l’immunité humorale ou cellulaire (primaire ou acquis) tel que (voir aussi rubrique 4.4) :
· sujets en états de déficit immunitaire avec un nombre total de lymphocytes inférieur à 1 200 par mm3 ;
· sujets présentant d’autres signes d’absence d’immunité cellulaire compétente (par exemple les patients ayant une leucémie, un lymphome, une dyscrasie sanguine, une infection par le VIH avec des manifestations cliniques) ;
· sujets actuellement ou récemment sous traitement immunosuppresseur (y compris de fortes doses de corticostéroïdes). VARILRIX n'est pas contre-indiqué chez les sujets recevant des corticostéroïdes par voie locale ou par voie parentérale à faible dose (par exemple, pour la prophylaxie de l’asthme ou en traitement substitutif) ;
· déficit immunitaire combiné sévère ;
· agammaglobulinémie ;
· SIDA ou infection symptomatique due au VIH ou avec un taux âge-dépendant de lymphocytes T CD4+ chez les enfants de moins de 12 mois : CD4 + < 25% ; enfants de 12 à 35 mois : CD4 + < 20% ; enfants de 36 à 59 mois : CD4 + < 15%.
Hypersensibilité à la substance active ou à l’un des excipients mentionnés à la rubrique 6.1 ou à la néomycine.
Cependant, un antécédent de dermatite de contact à la néomycine n’est pas une contre-indication.
VARILRIX est contre-indiqué chez les sujets ayant présenté des signes d’hypersensibilité après une précédente administration d’un vaccin contre la varicelle.
Grossesse. De plus, une grossesse doit être évitée dans le mois suivant la vaccination (voir rubrique 4.6).
4.4. Mises en garde spéciales et précautions d'emploi
Afin d'améliorer la traçabilité des médicaments biologiques, le nom et le numéro de lot du produit administré doivent être clairement enregistrés.
Comme pour les autres vaccins, l’administration de VARILRIX doit être différée chez les sujets souffrant d’une maladie fébrile sévère aiguë. Cependant, la présence d’une infection bénigne comme un rhume, ne devrait pas entraîner le report de la vaccination.
Une syncope (évanouissement) peut survenir après toute vaccination, voire même avant, en particulier chez les adolescents, comme réaction psychogène à l’injection avec une aiguille. Ceci peut s’accompagner de plusieurs signes neurologiques comme un trouble transitoire de la vision, des paresthésies et des mouvements tonico-cloniques des membres durant la phase de récupération. Il est important que des mesures soient mises en place afin d’éviter des blessures en cas d’évanouissement.
Comme pour tous les vaccins injectables, il est recommandé de toujours disposer d'un traitement médical approprié et d'assurer une surveillance pour le cas rare où surviendrait une réaction anaphylactique suivant l'administration du vaccin.
Attendre l’évaporation de l’alcool ou d’autres agents désinfectants appliqués sur la peau avant toute injection du vaccin, car ils peuvent inactiver les virus atténués du vaccin.
Une protection limitée contre la varicelle peut être obtenue par la vaccination jusqu’à 72 heures après une exposition naturelle à la maladie (voir rubrique 5.1).
Comme pour tout vaccin, une réponse immunitaire protectrice peut ne pas être obtenue chez tous les sujets vaccinés.
Comme avec d’autres vaccins varicelleux, des cas de varicelle peuvent survenir chez des sujets antérieurement vaccinés par VARILRIX. Ces varicelles sont habituellement peu sévères, avec un nombre plus faible de lésions et une fièvre moins importante comparées à celles observées chez les sujets non vaccinés.
Transmission
Il a été montré que la transmission du virus vaccinal OKA de la varicelle survient à un taux très faible dans l’entourage non immunisé du sujet vacciné présentant une éruption cutanée. La transmission du virus vaccinal OKA de la varicelle d’un sujet vacciné qui ne présente pas d’éruption cutanée dans l’entourage non immunisé ne peut être exclue.
Comparé aux sujets sains vaccinés, les patients atteints de leucémie sont plus susceptibles de développer une éruption papulo-vésiculaire (voir aussi rubrique 4.8). Dans ces cas également, l’évolution de la maladie dans l’entourage était faible.
Les sujets vaccinés, même ceux qui ne développent pas une éruption de type varicelle, doivent éviter dans la mesure du possible, d'avoir des contacts proches avec des sujets à haut risque "réceptifs" à la varicelle, jusqu’à 6 semaines après la vaccination. S'il s'avère impossible au sujet vacciné d'éviter tout contact avec des sujets à haut risque "réceptifs" à la varicelle, le risque potentiel de transmission du virus vaccinal varicelleux doit être évalué, par rapport au risque d'acquérir et de transmettre le virus sauvage de la varicelle.
Sont considérés comme sujets à haut risque "réceptifs" à la varicelle :
· les sujets immunodéprimés (voir rubriques 4.3 et 4.4),
· les femmes enceintes sans antécédent documenté de varicelle ou sérologie indiquant une infection antérieure,
· les nouveau-nés de mères sans antécédent documenté de varicelle ou sérologie indiquant une infection antérieure.
La nature bénigne de l’éruption cutanée dans l’entourage en bonne santé indique que le virus reste atténué après passage par des hôtes humains.
Sujets à haut risque de varicelle sévère
On ne dispose que de données limitées provenant des essais cliniques avec VARILRIX (formulation à +4 °C) chez les sujets à haut risque de varicelle sévère.
La vaccination peut être envisagée chez les patients présentant de certains déficits immunitaires chez qui les bénéfices présentant attendus sont supérieurs aux risques (par exemple sujets infectés par le VIH asymptomatiques, déficits en sous-classe d'IgG, neutropénie congénitale, maladie granulomateuse chronique, déficits en complément).
Les patients immunodéprimés ne présentant pas de contre-indication à cette vaccination (voir rubrique 4.3) peuvent ne pas répondre aussi bien que les sujets immunocompétents, par conséquent, certains de ces patients peuvent contracter la varicelle en cas de contact, malgré l'administration appropriée du vaccin. Ces patients doivent être attentivement surveillés, afin de détecter tout signe de varicelle.
En raison du risque potentiel de diminution de la réponse vaccinale et/ou de maladie disséminée, il convient de prendre en compte l'intervalle de temps entre la vaccination par VARILRIX et le traitement immunosuppresseur (voir rubrique 4.3).
Si la vaccination est envisagée chez les sujets à haut risque de varicelle sévère, les recommandations sont les suivantes :
· la chimiothérapie d’entretien doit être suspendue une semaine avant et une semaine après la vaccination des patients en phase aigüe de leucémie. Les patients sous radiothérapie ne doivent normalement pas être vaccinés pendant la phase de traitement. Généralement, les patients sont vaccinés lorsqu’ils sont en rémission hématologique complète de leur maladie.
· le nombre total de lymphocytes doit être au moins de 1 200 par mm3 ou il n’existe aucun autre signe d’absence d’immunité cellulaire compétente.
· la vaccination doit être effectuée quelques semaines avant l’administration d’un traitement immunosuppresseur pour les patients subissant une transplantation d’organe (par exemple, une greffe de rein).
Quelques rares cas de varicelle disséminée avec atteinte des organes internes suite à la vaccination avec un virus vaccinal OKA existent, principalement chez les sujets immunodéprimés.
VARILRIX ne doit pas être administré par voie intravasculaire ou par voie intradermique.
Encéphalite
Des cas d’encéphalite ont été signalés suite à l’administration post-commercialisation de vaccins varicelleux vivants atténués. Dans quelques cas, des issues fatales ont été observées, en particulier chez les patients immunodéprimés (voir la rubrique 4.3). Il convient d’indiquer aux personnes vaccinées ou à leurs parents de consulter rapidement un médecin en cas de symptômes évocateurs d’une encéphalite après la vaccination, tels qu’une perte ou une diminution du niveau de conscience, des convulsions ou une ataxie accompagnée de fièvre et de maux de tête.
Teneur en phénylalanine
Le vaccin contient 331 microgrammes de phénylalanine par dose. La phénylalanine peut être dangereuse pour les personnes atteintes de phénylcétonurie (PCU).
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Chez les sujets ayant reçu des immunoglobulines ou une transfusion sanguine, la vaccination devra être reportée d’au moins 3 mois, en raison du risque d’échec vaccinal dû aux anticorps dirigés contre la varicelle, acquis de façon passive.
La prise de salicylé doit être évitée dans les 6 semaines suivant la vaccination contre la varicelle, un syndrome de Reye ayant été rapporté suite à la prise de salicylés lors d’une varicelle naturelle.
Utilisation avec d’autres vaccins
Sujets sains
Des études cliniques sur des vaccins contenant le virus de la varicelle soutiennent l’administration concomitante de VARILRIX avec l’un des vaccins monovalents ou combinés suivants : vaccin rougeole-oreillon-rubéole (ROR), vaccin diphtérie-tétanos-coqueluche acellulaire (DTCa), vaccin diphtérie-tétanos-coqueluche acellulaire à teneur réduite en antigènes (dTca), vaccin Haemophilus influenzae de type b (Hib), vaccin poliomyélitique inactivé (IPV), vaccin hépatite B (HepB), vaccin hexavalent (DTCa-HepB-IPV/Hib), vaccin hépatite A (HepA), vaccin méningococcique du groupe B (Bexsero), vaccin conjugué méningococcique du groupe C (MenC), vaccin conjugué méningococcique des groupes A, C, W et Y (MenACWY) et vaccin conjugué pneumococcique (VPC).
Les différents vaccins injectables doivent toujours être administrés en des sites d’injection différents.
Si le vaccin contre la rougeole n’est pas administré en même temps que VARILRIX, un intervalle d’au moins un mois doit être respecté entre l'administration de ces vaccins car le vaccin contre la rougeole peut entraîner une suppression à court terme de la réponse immunitaire cellulaire.
Sujets à haut risque de varicelle sévère
VARILRIX ne doit pas être administré en même temps que d’autres vaccins vivants atténués. Les vaccins inactivés peuvent être administrés à tout moment par rapport à VARILRIX, étant donné qu'aucune contre-indication spécifique n'a été établie. Cependant, les différents vaccins injectables doivent toujours être administrés en des sites d’injection différents.
4.6. Fertilité, grossesse et allaitement
Grossesse
Les femmes enceintes ne doivent pas être vaccinées avec VARILRIX.
Toutefois, aucun effet délétère sur le fœtus n'a été documenté après l'administration chez la femme enceinte de vaccins contre la varicelle.
Femmes en âge de procréer
Toute grossesse doit être évitée dans le mois suivant la vaccination. Il convient de conseiller aux femmes ayant l’intention de débuter une grossesse de différer leur projet.
Il n’y a pas de données concernant l’utilisation du vaccin chez les femmes qui allaitent.
En raison du risque théorique de transmission de la souche virale du vaccin de la mère à l’enfant, VARILRIX n’est généralement pas recommandé pour les femmes qui allaitent (voir aussi rubrique 4.4). La vaccination des femmes exposées n’ayant pas d’antécédent de varicelle ou dont on sait qu’elles sont séronégatives devra être évaluée au cas par cas.
Fertilité
Aucune donnée disponible.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Aucune étude sur les effets de VARILRIX sur l’aptitude à conduire des véhicules et à utiliser des machines n’a été réalisée.
VARILRIX n’a aucun effet ou qu’un effet négligeable sur l’aptitude à conduire des véhicules et à utiliser des machines.
Cependant, certains effets mentionnés dans la rubrique 4.8 « Effets indésirables » peuvent affecter temporairement l'aptitude à conduire des véhicules et à utiliser des machines.
Données des essais cliniques
Sujets sains
Plus de 7 900 sujets ont participé à des essais cliniques évaluant le profil de réactogénicité du vaccin administré par voie sous-cutanée, seul ou de manière concomitante avec d’autres vaccins.
Le profil de sécurité présenté ci-dessous est basé sur un total de 5 369 doses de VARILRIX administré seul à des nourrissons, enfants, adolescents et adultes.
Les effets indésirables rapportés sont listés selon les fréquences suivantes :
Très fréquent (≥ 1/10)
Fréquent (≥ 1/100 à < 1/10)
Peu fréquent (≥ 1/1 000 à < 1/100)
Rare (≥ 1/10 000 à < 1/1 000)
Très rare (< 1/10 000)
Au sein de chaque groupe de fréquence, les effets indésirables sont présentés par ordre décroissant de gravité.
|
Classes de systèmes d’organes* |
Fréquence |
Effets indésirables |
|
Infections et infestations |
Peu fréquent |
Infection des voies respiratoires supérieures, pharyngite |
|
Affections hématologiques et du système lymphatique |
Peu fréquent |
Lymphadénopathie |
|
Affections psychiatriques |
Peu fréquent |
Irritabilité |
|
Affections du système nerveux |
Peu fréquent |
Céphalées, somnolence |
|
Affections oculaires |
Rare |
Conjonctivite |
|
Affections respiratoires, thoraciques et médiastinales |
Peu fréquent |
Toux, rhinite |
|
Affections gastro-intestinales |
Peu fréquent |
Vomissements, nausées |
|
Rare |
Diarrhée, douleur abdominale |
|
|
Affections de la peau et du tissu sous-cutané |
Fréquent |
Eruption cutanée |
|
Peu fréquent |
Eruption virale, prurit |
|
|
Rare |
Urticaire |
|
|
Affections musculo-squelettiques et systémiques |
Peu fréquent |
Arthralgie, myalgie |
|
Troubles généraux et anomalies au site d’administration |
Très fréquent |
Douleur, érythème |
|
Fréquent |
Pyrexie (température orale/axillaire ≥ 37,5 °C ou température rectale ≥ 38,0 °C), gonflement au site d’injection |
|
|
Peu fréquent |
Pyrexie (température orale/axillaire > 39,0 °C ou température rectale > 39,5 °C), fatigue, malaise |
* Selon la terminologie MedDRA (Dictionnaire Médical des Affaires Règlementaires)
Un gonflement au site d’injection et une pyrexie ont été très fréquemment rapportés lors d’essais cliniques conduits chez les adolescents et les adultes. Le gonflement au site d’injection a aussi été rapporté très fréquemment après la deuxième dose chez les enfants de moins de 13 ans.
Une tendance à une incidence plus élevée de la douleur, d’un érythème et du gonflement au site d’injection a été observée après la seconde dose comparée à la première dose.
Aucune différence n'a été observée au niveau du profil de réactogénicité, entre les sujets initialement séropositifs et les sujets initialement séronégatifs.
Dans un essai clinique, 328 enfants âgés de 11 à 21 mois ont reçu le vaccin combiné contre la rougeole, les oreillons, la rubéole et la varicelle de GlaxoSmithKline (GSK) (contenant la même souche de varicelle que VARILRIX) soit par voie sous-cutanée soit par voie intramusculaire. Un profil de sécurité comparable a été observé pour les deux voies d’administration.
Sujets à haut risque de varicelle sévère
On ne dispose que de données limitées issues des essais cliniques chez les sujets à haut risque de varicelle sévère. Cependant, les réactions associées aux vaccins (principalement des éruptions papulo-vésiculaires et une pyrexie) sont généralement bénignes. Comme pour les sujets sains, les érythèmes, gonflements et douleur au site d’injection sont bénins et transitoires.
Données post-commercialisation
Les effets indésirables supplémentaires suivants ont été identifiés dans de rares occasions pendant la surveillance post-commercialisation. Parce qu’ils ont été rapportés de manière volontaire à partir d’une population de taille inconnue, une estimation exacte de leur fréquence ne peut être donnée.
|
Classes de systèmes d’organes* |
Effets indésirables |
|
Infections et infestations |
Zona |
|
Affections hématologiques et du système lymphatique |
Thrombocytopénie |
|
Affections du système immunitaire |
Réaction anaphylactique, hypersensibilité |
|
Affections du système nerveux |
Encéphalite, accident vasculaire cérébral, convulsion, cérébellite, symptômes de type cérébelleux (incluant une perturbation transitoire de la marche et une ataxie transitoire) |
|
Affections vasculaires |
Vascularite (incluant le purpura de Henoch-Schönlein et le syndrome de Kawasaki) |
|
Affections de la peau et du tissu sous-cutané |
Erythème polymorphe |
* Selon la terminologie MedDRA (Dictionnaire Médical des Affaires Règlementaires)
Voir la description de certains effets indésirables.
Description de certains effets indésirables
Des cas d’encéphalite ont été observés suite à la vaccination par des vaccins varicelleux vivants atténués. Une issue fatale a été signalée dans quelques cas, notamment chez des personnes immunodéprimées (voir la rubrique 4.4).
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/.
Des cas d’administration accidentelle d’une dose supérieure à la dose recommandée de VARILRIX ont été rapportés. Parmi ces cas, les évènements indésirables suivants ont été rapportés : léthargie et convulsions. Dans les autres cas rapportés comme des surdosages, aucun évènement indésirable n’a été associé.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : Vaccins viraux, Vaccins contre varicelle-zona, code ATC : J07BK01.
Mécanisme d’action
VARILRIX produit une infection varicelleuse atténuée cliniquement inapparente chez les sujets « réceptifs ».
La présence d’anticorps est considérée comme une preuve de protection, cependant, il n’y a pas de limite de protection établie pour la varicelle.
Effets pharmacodynamiques
Efficacité et efficacité sur le terrain
L’efficacité des vaccins Oka contre la varicelle de GlaxoSmithKline (GSK) dans la prévention de la varicelle confirmée (par Polymerase Chain Reaction (PCR) ou suite à l’exposition à un cas de varicelle) a été évaluée dans un large essai clinique randomisé mené dans plusieurs pays, utilisant le vaccin combiné rougeole - oreillons - rubéole de GSK (Priorix) comme témoin actif. Cet essai a été conduit en Europe où la vaccination généralisée contre la varicelle n’était pas appliquée à cette époque. Les enfants âgés de 12 à 22 mois ont reçu une dose de VARILRIX ou deux doses du vaccin combiné rougeole-oreillons-rubéole-varicelle de GSK (Priorix-Tetra) à six semaines d’intervalle. L’efficacité du vaccin contre une varicelle confirmée quelle que soit la sévérité et contre une varicelle confirmée modérée ou sévère a été démontrée après une première période de suivi de 2 ans (durée médiane de 3,2 ans). La persistance de l’efficacité a été observée dans la même étude après des périodes de suivi à long terme de 6 ans (durée médiane de 6,4 ans) et de 10 ans (durée médiane de 9,8 ans). Les données sont présentées dans le tableau ci-dessous.
|
Groupe |
Période de suivi |
Efficacité contre une varicelle confirmée, quelle que soit la sévérité |
Efficacité contre une varicelle confirmée modérée ou sévère |
|
Vaccin monovalent contre la varicelle (Oka) de GSK (VARILRIX) 1 dose N = 2 487 |
Suivi à 2 ans |
65,4% (IC 97,5% : 57,2 ; 72,1) |
90,7% (IC 97,5% : 85,9 ; 93,9) |
|
Suivi à 6 ans(1) |
67,0% (IC 95% : 61,8 ; 71,4) |
90,3% (IC 95% : 86,9 ; 92,8) |
|
|
Suivi à 10 ans(1) |
67,2% (IC 95% : 62,3 ; 71,5) |
89,5% (IC 95% : 86,1 ; 92,1) |
|
|
Vaccin combiné rougeole, oreillons, rubéole et varicelle (Oka) de GSK (Priorix-Tetra) 2 doses N = 2 489 |
Suivi à 2 ans |
94,9% (IC 97,5% : 92,4 ; 96,6) |
99,5% (IC 97,5% : 97,5 ; 99,9) |
|
Suivi à 6 ans(1) |
95,0% (IC 95% : 93,6 ; 96,2) |
99,0% (IC 95% : 97,7 ; 99,6) |
|
|
Suivi à 10 ans(1) |
95,4% (IC 95% : 94,0 ; 96,4) |
99,1% (IC 95% : 97,9 ; 99,6) |
N = nombre de sujets recrutés et vaccinés
(1) analyse descriptive
Dans les essais cliniques, la majorité des sujets vaccinés qui ont ensuite été exposés au virus de type sauvage ont été soit complètement protégés contre la varicelle clinique soit ont développé une forme plus légère de la maladie (c'est-à-dire : nombre réduit de vésicules, absence de fièvre).
Les données d’efficacité issues d’observations dans différents contextes (épidémies, études cas-témoins, études observationnelles, bases de données, modèles) suggèrent un niveau de protection plus élevé et une diminution de la survenue des cas de varicelle après deux doses de vaccin comparé à une seule dose.
L’impact d’une dose de VARILRIX dans la réduction des hospitalisations liées à la varicelle et des visites ambulatoires chez les enfants était respectivement de 81% et 87% dans l’ensemble.
Prophylaxie Post-Exposition
Les données publiées sur la prévention de la varicelle à la suite de l’exposition au virus de la varicelle sont limitées.
Dans une étude randomisée, en double aveugle, contrôlée versus placebo incluant 42 enfants âgés de 12 mois à 13 ans, 22 enfants ont reçu une dose de VARILRIX et 20 enfants ont reçu une dose de placebo dans les 3 jours suivant l’exposition. Des pourcentages similaires (41% et 45% respectivement) d’enfants ont contracté la varicelle, mais le risque de développer une forme modérée à sévère de la maladie était 8 fois plus élevé dans le groupe placebo comparé au groupe vacciné (risque relatif = 8,0 ; IC 95% :1,2 ; 51,5 ; P=0,003).
Dans une étude contrôlée incluant 33 enfants âgés de 12 mois à 12 ans, 15 sujets ont reçu le vaccin contre la varicelle (13 sujets ont reçu VARILRIX et 2 sujets ont reçu un autre vaccin contre la varicelle contenant la souche Oka) jusqu’à 5 jours après l’exposition et 18 sujets n’ont pas été vaccinés. En considérant les 12 enfants vaccinés dans les 3 jours après l’exposition, l’efficacité vaccinale était de 44% (IC 95% : -1 ; 69) dans la prévention de toute forme de la maladie et de 77% (IC 95% : 14 ; 94) dans la prévention des formes modérées ou sévères de la maladie.
Dans une étude de cohorte prospective (avec des taux d’attaque historiques comme témoins), 67 enfants, adolescents ou adultes ont reçu le vaccin contre la varicelle (55 sujets ont reçu VARILRIX et 12 sujets ont reçu un autre vaccin contre la varicelle contenant la souche Oka) dans les 5 jours suivant l’exposition. L’efficacité vaccinale était de 62,3% (IC 95% : 47,8 ; 74,9) dans la prévention de toute forme de la maladie et de 79,4% (IC 95% : 66,4 ; 88,9) dans la prévention des formes modérées et sévères de la maladie.
Sujets à haut risque de varicelle sévère
Les patients souffrant de leucémie, les patients sous traitement immunosuppresseur (y compris la corticothérapie) pour une tumeur solide maligne, pour des maladies chroniques graves (telles que l’insuffisance rénale chronique, les maladies auto-immunes, les maladies du collagène, l’asthme bronchique sévère) ou suite à une transplantation d’organe, sont prédisposés à une varicelle naturelle sévère. La vaccination avec la souche Oka a démontré une réduction des complications de la varicelle chez ces patients.
Réponse immunitaire après administration par voie sous-cutanée
Sujets sains
Chez les enfants âgés de 11 mois à 21 mois, le taux de séroconversion mesuré par ELISA 6 semaines après la vaccination était de 89,6% après une dose de vaccin et de 100% après la seconde dose de vaccin.
Chez les enfants âgés de 9 mois à 12 ans, le taux de séroconversion global, mesuré par immunofluorescence indirecte (IFA) 6 semaines après la vaccination était > 98% après une dose de vaccin.
Chez les enfants âgés de 9 mois à 6 ans, le taux de séroconversion mesuré par IFA 6 semaines après la vaccination était de 100% après une seconde dose de vaccin. Une augmentation importante des titres en anticorps a été observée suite à l’administration d’une seconde dose (augmentation de la moyenne géométrique des titres de 5 à 26 fois).
Chez les sujets âgés de 13 ans et plus, le taux de séroconversion mesuré par IFA 6 semaines après la vaccination était de 100% après la seconde dose de vaccin. Un an après la vaccination, tous les sujets testés étaient toujours séropositifs.
Sujets à haut risque de varicelle sévère
Des données limitées issues des essais cliniques ont montré une immunogénicité chez les sujets à haut risque de varicelle sévère.
Réponse immunitaire après administration par voie intramusculaire
L’immunogénicité de VARILRIX administré par voie intramusculaire est basée sur une étude comparative dans laquelle 283 enfants en bonne santé âgés de 11 à 21 mois ont reçu le vaccin combiné contre la rougeole, les oreillons, la rubéole et la varicelle de GSK (contenant la même souche de varicelle que VARILRIX) soit par voie sous-cutanée soit par voie intramusculaire. Une immunogénicité comparable a été démontrée pour les deux voies d’administration.
5.2. Propriétés pharmacocinétiques
L’évaluation des propriétés pharmacocinétiques n’est pas requise pour les vaccins.
5.3. Données de sécurité préclinique
Acides aminés (contenant de la phénylalanine).
Lactose anhydre
Sorbitol (E 420)
Mannitol (E 421)
Solvant
Eau pour préparations injectables.
2 ans.
Après reconstitution, il est recommandé d’injecter le vaccin le plus tôt possible.
Cependant, il a été démontré que le vaccin reconstitué peut être conservé jusqu’à 90 minutes à température ambiante (25 °C) et jusqu’à 8 heures au réfrigérateur (entre 2 °C et 8 °C). S'il n'est pas utilisé dans les délais et conditions de conservation recommandés, le vaccin reconstitué doit être jeté.
6.4. Précautions particulières de conservation
Pour les conditions de conservation du médicament après reconstitution, voir la rubrique 6.3.
6.5. Nature et contenu de l'emballage extérieur
Poudre en flacon unidose en verre (verre de type I) muni d’un bouchon (caoutchouc bromobutyl).
0,5 mL de solvant en seringue préremplie (verre de type I) munie d’un bouchon piston (caoutchouc bromobutyl), avec ou sans aiguilles séparées dans les boîtes suivantes :
· avec 1 aiguille séparée : boîte de 1 ou 10.
· avec 2 aiguilles séparées : boîte de 1 ou 10.
· sans aiguille : boîte de 1 ou 10.
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
Le solvant et le vaccin reconstitué doivent être inspectés visuellement. La couleur du vaccin reconstitué peut varier de pêche clair à rose en raison de variations mineures de pH. Il peut contenir des particules translucides liées au produit. Ceci est normal et n’altère pas l’activité du vaccin.
Ne pas administrer si le vaccin présente une autre coloration ou contient d'autres particules.
Le vaccin doit être reconstitué en ajoutant la totalité du contenu en solvant de la seringue préremplie au flacon contenant la poudre.
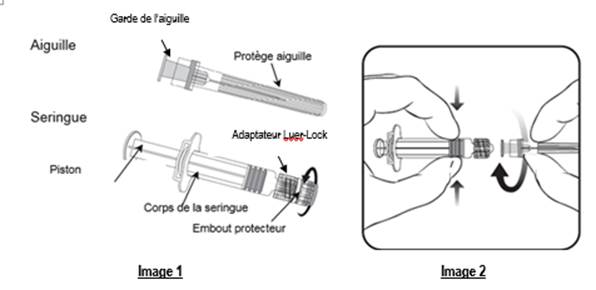
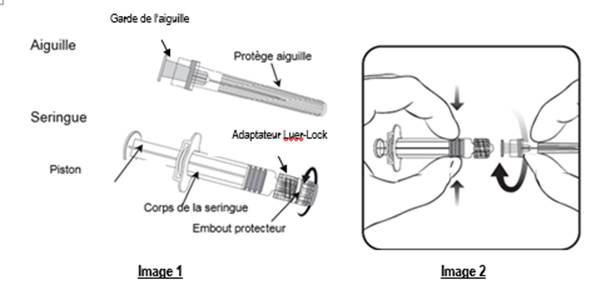
Pour fixer l’aiguille à la seringue, lire attentivement les instructions illustrées par les images 1 et 2. Cependant, la seringue fournie avec VARILRIX peut être légèrement différente (sans filetage) de la seringue de l’illustration.
Dans ce cas, l'aiguille doit être fixée sans visser.
Toujours tenir la seringue par le corps, et non par le piston ou l’adaptateur Luer-Lock (LLA), et maintenir l’aiguille dans l’axe de la seringue (comme illustré dans l’image 2). Si vous ne respectez pas ces consignes, le LLA risque de se déformer et d’occasionner une fuite.
Lors de l’assemblage de la seringue, si le LLA se détache, une nouvelle dose de vaccin (nouvelle seringue et nouveau flacon) doit être utilisée.
1. Dévisser l’embout protecteur de la seringue en le tournant dans le sens inverse des aiguilles d’une montre (comme illustré dans l’image 1).
Veuillez suivre les étapes ci-dessous, que le LLA tourne ou pas autour de l’axe de la seringue :
2. Fixer l’aiguille sur la seringue en connectant doucement la garde de l’aiguille sur le LLA et tourner d’un quart de tour dans le sens des aiguilles d’une montre jusqu’à sentir un blocage (comme illustré dans l’image 2).
3. Retirer le protège aiguille, ce qui peut être difficile.
4. Ajouter le solvant à la poudre. Le mélange doit être bien agité, jusqu’à ce que la poudre soit complètement dissoute dans le solvant.
5. Prélever la totalité du contenu du flacon.
6. Une nouvelle aiguille doit être utilisée pour administrer le vaccin. Dévisser l’aiguille du corps de la seringue et fixer l’aiguille d’injection en répétant l’étape 2 ci-dessus.
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
23 RUE FRANCOIS JACOB
92500 RUEIL-MALMAISON
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 362 772 2 9 : Poudre en flacon (verre, type I) muni d’un bouchon (bromobutyl) et recouvert d’une capsule flip-off (aluminium) + solvant en seringue préremplie (verre type I) munie d’un bouchon piston (bromobutyl) + 2 aiguilles. Boîte de 1.
· 34009 301 283 8 1 : Poudre en flacon (verre, type I) muni d’un bouchon (bromobutyl) et recouvert d’une capsule flip-off (aluminium) + solvant en seringue préremplie (verre type I) munie d’un bouchon piston (bromobutyl) sans aiguille. Boîte de 1.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Liste I
ANSM - Mis à jour le : 10/10/2025
VARILRIX, poudre et solvant pour solution injectable en seringue préremplie
Vaccin varicelleux (vivant)
Veuillez lire attentivement cette notice avant que vous ou votre enfant receviez ce médicament car elle contient des informations importantes pour vous.
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin, votre pharmacien ou votre infirmier/ère.
· Ce vaccin a été personnellement prescrit pour vous ou votre enfant. Ne le donnez pas à d’autres personnes.
· Si vous ou votre enfant ressentez un quelconque effet indésirable, parlez-en à votre médecin, votre pharmacien ou votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que VARILRIX, poudre et solvant pour solution injectable en seringue préremplie et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant que vous ou votre enfant receviez VARILRIX, poudre et solvant pour solution injectable en seringue préremplie ?
3. Comment utiliser VARILRIX, poudre et solvant pour solution injectable en seringue préremplie ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver VARILRIX, poudre et solvant pour solution injectable en seringue préremplie ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE VARILRIX, poudre et solvant pour solution injectable en seringue préremplie ET DANS QUELS CAS EST-IL UTILISE ?
Classe pharmacothérapeutique : Vaccins viraux, Vaccins contre varicelle-zona, code ATC : J07BK01.
VARILRIX est un vaccin qui peut être utilisé chez les sujets âgés de 12 mois et plus afin de les protéger de la varicelle. Dans certaines circonstances, VARILRIX peut également être administré aux nourrissons à partir de 9 mois.
Une vaccination dans les 3 jours suivant l’exposition à un patient ayant la varicelle peut aider à éviter la varicelle ou à diminuer la sévérité de la maladie.
Comment agit VARILRIX
Lorsqu’une personne est vaccinée avec VARILRIX, le système immunitaire (le système de défense naturelle de l’organisme) fabrique des anticorps pour protéger la personne contre l’infection par le virus de la varicelle.
VARILRIX contient des virus atténués qui sont très peu susceptibles de provoquer la varicelle chez des sujets en bonne santé.
Comme pour tous les vaccins, VARILRIX peut ne pas protéger complètement tous les sujets vaccinés.
Votre vaccination ou celle de votre enfant dépendra de vos (ses) niveaux de défense immunitaire. Voir rubrique 2 « Avertissements et précautions ».
· si vous ou votre enfant êtes allergique à l’un des composants de ce vaccin (mentionnés dans la rubrique 6). Les signes d’une réaction allergique peuvent inclure une éruption cutanée avec démangeaisons, un essoufflement et un gonflement du visage ou de la langue.
· si vous ou votre enfant présentez une allergie connue à la néomycine (un antibiotique). Une dermatite de contact connue (éruption cutanée survenant lorsque la peau est en contact direct avec des allergènes tels que la néomycine) ne devrait pas être une raison pour ne pas être vacciné, mais parlez-en d’abord à votre médecin.
· si vous ou votre enfant avez déjà eu une réaction allergique à un vaccin contre la varicelle.
· si vous êtes enceinte. Par ailleurs, une grossesse doit être évitée pendant le mois suivant la vaccination.
Avertissements et précautions
Adressez-vous à votre médecin, pharmacien ou infirmier/ère avant que vous ou votre enfant receviez VARILRIX
· si vous ou votre enfant avez une infection sévère avec une température élevée. Il peut être nécessaire de reporter la vaccination jusqu’à la guérison. Une infection bénigne comme un rhume ne devrait pas nécessiter le report de la vaccination, mais parlez-en d'abord à votre médecin.
· si vous ou votre enfant avez un système immunitaire affaibli dû à des maladies (par exemple, une infection par le VIH) et/ou à des traitements, ou allez commencer un médicament qui affaiblit le système immunitaire. Vous ou votre enfant devez être étroitement surveillés car la réponse vaccinale peut ne pas être suffisante pour assurer une protection contre la maladie (voir rubrique 2 " N'utilisez jamais VARILRIX ").
· si vous avez des problèmes de saignements ou si vous avez des bleus facilement.
Un évanouissement peut survenir (surtout chez les adolescents) après, voire même avant, toute injection avec une aiguille. Aussi parlez-en à votre médecin ou infirmier/ère si vous ou votre enfant vous êtes évanoui lors d’une précédente injection.
Comme tout autre vaccin, VARILRIX peut ne pas vous protéger complètement, vous ou votre enfant, contre la varicelle. Cependant, les sujets qui ont été vaccinés et attrapent la varicelle présentent généralement une forme très légère de la maladie, comparés à ceux qui n’ont pas été vaccinés.
Dans de rares cas, les virus atténués peuvent être transmis d’une personne vaccinée à d’autres personnes. Cela se produit généralement quand la personne vaccinée présente des boutons ou des vésicules. Les personnes en bonne santé qui sont infectées de cette manière ne développent généralement qu’une légère éruption cutanée, qui n’est pas dangereuse.
Une fois vacciné, vous ou votre enfant devrez essayer d’éviter pendant une période allant jusqu'à 6 semaines après la vaccination, dans la mesure du possible, d’avoir des contacts proches avec les personnes suivantes :
· les personnes dont le système immunitaire est affaibli ;
· les femmes enceintes n’ayant pas eu la varicelle ou n’ayant pas été vaccinées contre la varicelle ;
· les nouveau-nés de mères n’ayant pas eu la varicelle ou n’ayant pas été vaccinées contre la varicelle.
Autres médicaments et VARILRIX
Informez votre médecin ou pharmacien si vous ou votre enfant prenez, avez récemment pris ou pourriez prendre tout autre médicament et/ou vaccin.
Informez votre médecin si vous ou votre enfant devez réaliser un test cutané pour une éventuelle tuberculose. Si ce test est réalisé dans les 6 semaines après avoir reçu VARILRIX, le résultat peut ne pas être fiable.
La vaccination doit être reportée d'au moins 3 mois si vous ou votre enfant avez reçu une transfusion sanguine ou des anticorps humains (immunoglobulines).
L’utilisation d’aspirine ou d’autres salicylés (une substance présente dans certains médicaments, utilisée pour faire baisser la fièvre et soulager la douleur) doit être évitée durant les 6 semaines suivant la vaccination par VARILRIX car cela pourrait entraîner une maladie grave appelée Syndrome de Reye qui peut affecter tous les organes.
VARILRIX peut être administré en même temps que d’autres vaccins. Un site d’injection différent sera utilisé pour chaque vaccin.
VARILRIX ne doit pas être administré aux femmes enceintes.
Si vous êtes enceinte ou si vous allaitez, si vous pensez être enceinte ou planifiez d’être enceinte, demandez conseil à votre médecin ou pharmacien avant de prendre ce vaccin. Il est également important de ne pas être enceinte dans le mois suivant la vaccination. Durant cette période, vous devez utiliser un moyen de contraception efficace pour éviter d'être enceinte.
Informez votre médecin si vous allaitez ou si vous avez l'intention d'allaiter votre enfant. Votre médecin décidera si vous devez recevoir VARILRIX.
Conduite de véhicules et utilisation de machines
VARILRIX n’a aucun effet ou qu’un effet négligeable sur l’aptitude à conduire des véhicules et à utiliser des machines. Cependant, certains effets mentionnés dans la rubrique 4 « Quels sont les effets indésirables éventuels » peuvent affecter temporairement l'aptitude à conduire des véhicules et à utiliser des machines.
VARILRIX contient du sorbitol et de la phénylalanine
Ce vaccin contient 6 mg de sorbitol par dose.
Ce vaccin contient 331 microgrammes de phénylalanine par dose. La phénylalanine peut être dangereuse pour les personnes atteintes de phénylcétonurie (PCU), une maladie génétique rare caractérisée par l’accumulation de phénylalanine ne pouvant être éliminée correctement.
3. COMMENT UTILISER VARILRIX, poudre et solvant pour solution injectable en seringue préremplie ?
Les sujets âgés de 12 mois et plus doivent recevoir 2 doses de VARILRIX à au moins 6 semaines d’intervalle. L’intervalle entre la première et la seconde dose ne doit pas être inférieur à 4 semaines.
Dans certaines circonstances, la première dose de VARILRIX peut être administrée aux nourrissons âgés de 9 à 11 mois. Dans ces cas, deux doses sont nécessaires et doivent être administrées à au moins 3 mois d'intervalle.
Les sujets présentant un risque de développer une varicelle sévère comme par exemple ceux recevant un traitement contre le cancer, peuvent recevoir des doses supplémentaires. L’intervalle entre les doses ne doit pas être inférieur à 4 semaines.
La date de la vaccination et le nombre de doses seront déterminés par votre médecin sur la base des recommandations officielles applicables.
Si vous ou votre enfant avez reçu plus de VARILRIX que vous ou votre enfant n’auriez dû
Un surdosage est très peu probable car le vaccin est fourni dans un flacon à dose unique et est administré par un médecin ou un(e) infirmier/ère. Peu de cas d’administration accidentelle ont été rapportés et seulement pour certains d’entre eux, une somnolence anormale et des convulsions (crises) ont été rapportées.
Si vous pensez que vous ou votre enfant avez oublié une dose de VARILRIX
Adressez-vous à votre médecin qui décidera si une dose est nécessaire et quand il faudra l’administrer.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Les effets indésirables suivants peuvent survenir avec ce vaccin :
· Très fréquents (ils peuvent concerner plus d’une personne sur 10) :
o douleur et rougeur au site d’injection
· Fréquents (ils peuvent concerner jusqu’à 1 personne sur 10) :
o éruption cutanée (boutons et/ou vésicules)
o gonflement au site d’injection*
o fièvre à 38 °C ou plus (rectale)*
· Peu fréquents (ils peuvent concerner jusqu’à 1 personne sur 100) :
o infection des voies respiratoires supérieures
o maux de gorge et difficulté pour avaler (pharyngite)
o gonflement des glandes lymphatiques
o irritabilité
o maux de tête
o sensation de somnolence
o toux
o nez qui démange, nez qui coule ou nez bouché, éternuement (rhinite)
o envie de vomir (nausées)
o vomissements
o éruption cutanée de type varicelle
o démangeaisons
o douleurs articulaires
o douleurs musculaires
o fièvre supérieure à 39,5 °C (rectale)
o manque d’énergie (fatigue)
o sensation de malaise général
· Rares (ils peuvent concerner jusqu’à 1 personne sur 1 000) :
o inflammation de l’œil (conjonctivite)
o douleurs au ventre
o diarrhée
o éruption cutanée avec démangeaisons et bosses (urticaire)
* Un gonflement au site d’injection et de la fièvre peuvent survenir très fréquemment chez les adolescents et les adultes. Un gonflement peut également survenir très fréquemment après la seconde dose chez les enfants âgés de moins de 13 ans.
Les effets indésirables suivants ont été signalés à plusieurs occasions lors de l’utilisation en routine de VARILRIX :
o infection ou inflammation du cerveau (encéphalite) observée suite à la vaccination par des vaccins varicelleux vivants atténués. Cette affection a été d’issue fatale dans plusieurs cas, notamment chez des personnes dont le système immunitaire est affaibli (comme indiqué à la rubrique 2, VARILRIX ne doit pas être utilisé chez les patients dont le système immunitaire est affaibli). Consultez immédiatement un médecin si vous ou votre enfant présentez une perte ou une diminution du niveau de conscience, des convulsions ou une perte de contrôle des mouvements corporels, accompagnée de fièvre et de maux de tête, car il peut s’agir des signes d’une infection ou d’une inflammation du cerveau. Informez votre médecin ou votre pharmacien que vous ou votre enfant avez reçu un vaccin varicelleux vivant atténué.
o infection ou inflammation de la moelle épinière et des nerfs périphériques entraînant une difficulté temporaire à marcher (instabilité) et/ou une perte temporaire du contrôle des mouvements corporels.
o accident vasculaire cérébral (lésions cérébrales causées par une interruption de son apport sanguin).
o convulsions ou crises.
o zona.
o petits points de saignements ou formation de bleus plus facilement que d’habitude en raison d’une baisse d’un type de cellules sanguines appelées plaquettes.
o réactions allergiques. Eruptions cutanées pouvant être accompagnées de démangeaisons ou de vésicules, d’un gonflement des yeux et du visage, d’une difficulté à respirer ou à avaler, d’une chute soudaine de la pression sanguine et d’une perte de conscience. De telles réactions peuvent survenir avant que vous ne quittiez le cabinet médical. Cependant, si vous ou votre enfant présentez l’un de ces symptômes, vous devez contacter un médecin en urgence.
o inflammation, rétrécissement ou obstruction des vaisseaux sanguins. Cela peut inclure des saignements inhabituels ou des bleus sous la peau (purpura de Henoch-Schönlein) ou de la fièvre qui dure plus de cinq jours, associée à une éruption cutanée sur le tronc parfois suivie d'une perte des couches superficielles de la peau des mains et des doigts, des rougeurs au niveau des yeux, des lèvres, de la gorge et de la langue (maladie de Kawasaki).
o érythème polymorphe (les symptômes sont des boutons rouges souvent accompagnés de démangeaisons, similaires à l’éruption cutanée de la rougeole, qui commence sur les membres puis s’étend parfois au visage et au reste du corps).
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, votre pharmacien, ou à votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/.
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER VARILRIX, poudre et solvant pour solution injectable en seringue préremplie ?
Tenir ce médicament hors de la vue et de la portée des enfants.
A conserver et transporter réfrigéré (entre 2 °C et 8 °C).
A conserver dans l’emballage d'origine, à l’abri de la lumière.
Après reconstitution, le vaccin doit être administré immédiatement. Si cela n'est pas possible, le vaccin reconstitué peut être conservé jusqu'à 90 minutes à température ambiante (25 °C) ou jusqu'à 8 heures au réfrigérateur (entre 2 °C et 8 °C). S'il n'est pas utilisé dans les délais et conditions de conservation recommandés, le vaccin reconstitué doit être jeté.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient VARILRIX, poudre et solvant pour solution injectable en seringue préremplie
· La substance active est :
le virus de la varicelle vivant atténué (souche OKA, produit sur cellules diploïdes humaines MRC-5). Chaque dose de 0,5 mL de vaccin reconstitué contient au minimum 103.3 UFP (Unités formant plages) de virus de la varicelle.
· Les autres composants sont :
Poudre : acides aminés (contenant de la phénylalanine), lactose anhydre, sorbitol (E 420), mannitol (E 421).
Solvant : eau pour préparations injectables.
VARILRIX se présente sous forme de poudre et de solvant pour solution injectable (poudre en flacon pour 1 dose et solvant en seringue préremplie (0,5 mL)) avec ou sans aiguilles séparées dans les boîtes suivantes :
· avec 1 aiguille séparée : boîte de 1 ou 10.
· avec 2 aiguilles séparées : boîte de 1 ou 10.
· sans aiguille : boîte de 1 ou 10.
VARILRIX se présente sous forme de poudre légèrement crème à légèrement jaune ou rosé et d'un solvant limpide et incolore (eau pour préparations injectables) pour la reconstitution du vaccin.
Toutes les présentations peuvent ne pas être commercialisées.
Titulaire de l’autorisation de mise sur le marché
23, RUE FRANCOIS JACOB
92500 RUEIL-MALMAISON
Exploitant de l’autorisation de mise sur le marché
23, RUE FRANCOIS JACOB
92500 RUEIL-MALMAISON
GLAXOSMITHKLINE BIOLOGICALS S.A.
RUE DE L’INSTITUT, 89
B-1330 RIXENSART
Belgique
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Ce médicament est autorisé dans les Etats membres de l'Espace Economique Européen sous les noms suivants :
|
Etat Membre |
Nom |
|
Autriche, Belgique, Chypre, République tchèque, Danemark, Estonie, Finlande, France, Allemagne, Grèce, Hongrie, Islande, Italie, Luxembourg, Malte, Norvège, Pologne, Portugal, Roumanie, Suède |
VARILRIX |
|
Lettonie |
Varilrix pulveris un ķīdinātājs injekciju ķīduma pagatavoanai pilnļircē |
|
Lituanie |
Varilrix milteliai ir tirpiklis injekciniam tirpalui upildytame virkte |
|
Espagne |
VARILRIX polvo y disolvente para solución inyectable en jeringa precargada |
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
Des informations détaillées sur ce vaccin sont disponibles sur le site Internet de l’ANSM (France).
Les informations suivantes sont destinées exclusivement aux professionnels de santé :
Comme pour tous les vaccins injectables, il est recommandé de toujours disposer d'un traitement médical approprié et d'assurer une surveillance pour le cas rare où surviendrait une réaction anaphylactique suivant l'administration du vaccin.
Attendre l’évaporation de l’alcool ou d’autres agents désinfectants appliqués sur la peau avant toute injection du vaccin, car ils peuvent inactiver les virus atténués du vaccin.
VARILRIX ne doit pas être administré par voie intravasculaire ou par voie intradermique.
En l’absence d’études de compatibilité, ce médicament ne doit pas être mélangé avec d’autres médicaments.
Le solvant et le vaccin reconstitué doivent être inspectés visuellement. La couleur du vaccin reconstitué peut varier de pêche clair à rose en raison de variations mineures de pH. Il peut contenir des particules translucides liées au produit. Ceci est normal et n’altère pas l’activité du vaccin.
Ne pas administrer si le vaccin présente une autre coloration ou contient d'autres particules.
Le vaccin doit être reconstitué en ajoutant la totalité du contenu en solvant de la seringue préremplie au flacon contenant la poudre.
Pour fixer l’aiguille à la seringue, lire attentivement les instructions illustrées par les images 1 et 2. Cependant, la seringue fournie avec VARILRIX peut être légèrement différente (sans filetage) de la seringue de l’illustration.
Dans ce cas, l'aiguille doit être fixée sans visser.
|
|
Toujours tenir la seringue par le corps, et non par le piston ou l’adaptateur Luer-Lock (LLA), et maintenir l’aiguille dans l’axe de la seringue (comme illustré dans l’image 2). Si vous ne respectez pas ces consignes, le LLA risque de se déformer et d’occasionner une fuite.
Lors de l’assemblage de la seringue, si le LLA se détache, une nouvelle dose de vaccin (nouvelle seringue et nouveau flacon) doit être utilisée.
1. Dévisser l’embout protecteur de la seringue en le tournant dans le sens inverse des aiguilles d’une montre (comme illustré dans l’image 1).
Veuillez suivre les étapes ci-dessous, que le LLA tourne ou pas autour de l’axe de la seringue :
2. Fixer l’aiguille sur la seringue en connectant doucement la garde de l’aiguille sur le LLA et tourner d’un quart de tour dans le sens des aiguilles d’une montre jusqu’à sentir un blocage (comme illustré dans l’image 2).
3. Retirer le protège aiguille, ce qui peut être difficile.
4. Ajouter le solvant à la poudre. Le mélange doit être bien agité, jusqu’à ce que la poudre soit complètement dissoute dans le solvant.
5. Prélever la totalité du contenu du flacon.
6. Une nouvelle aiguille doit être utilisée pour administrer le vaccin. Dévisser l’aiguille du corps de la seringue et fixer l’aiguille d’injection en répétant l’étape 2 ci-dessus.
Après reconstitution, il est recommandé d’injecter le vaccin le plus tôt possible.
Cependant, il a été démontré que le vaccin reconstitué peut être conservé jusqu’à 90 minutes à température ambiante (25 °C) et jusqu’à 8 heures au réfrigérateur (entre 2 °C et 8 °C). S'il n'est pas utilisé dans les délais et conditions de conservation recommandés, le vaccin reconstitué doit être jeté.
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.