Dernière mise à jour le 08/01/2026
ACTISKENAN 1 mg, comprimé orodispersible
Indications thérapeutiques
Classe pharmacothérapeutique : Analgésiques Opioïdes - code ATC : N02AA01
La substance active de ACTISKENAN est la morphine, qui appartient à un groupe de médicaments appelés analgésiques (antidouleurs) forts, de la famille des opioïdes.
Ce médicament vous a été prescrit par votre médecin pour soulager des douleurs sévères qui ne peuvent être correctement traitées que par des opioïdes.
Présentations
> 14 plaquettes prédécoupées unitaires polyamide aluminium PVC-Aluminium polytéréphtalate (PET) de 1 comprimé
Code CIP : 34009 302 333 1 3
Déclaration de commercialisation : 11/07/2022
Cette présentation est agréée aux collectivités
- Prix hors honoraire de dispensation : 1,95 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 2,97 €
- Taux de remboursement :65 %
Documents de bon usage du médicament
- Prévenir le risque de surdose d’opioïdes
Auteur : Haute autorité de santé
Type : Fiche Bon Usage du Médicament
Date de mise à jour :Avril 2023
Service médical rendu (SMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Important | Avis du 13/10/2021 | Inscription (CT) | Le service médical rendu par ACTISKENAN 1 mg, 2,5 mg, 5 mg, 10 mg, 20 mg et 30 mg, comprimé orodispersible (sulfate de morphine) est important : • dans les douleurs intenses et/ou rebelles aux antalgiques de niveau plus faible, des douleurs sévères d’origine cancéreuse, des douleurs aiguës sévères non cancéreuses (douleurs post-opératoires), et des douleurs chroniques sévères d’origine neuropathiques . • dans la prise en charge des douleurs intenses et/ou rebelles rencontrées dans l’arthrose du genou ou de la hanche et dans la lombalgie chronique, comme traitement de dernier recours, à un stade où les solutions chirurgicales sont envisagées et chez des patients non candidats (refus ou contre-indication) à une chirurgie de remplacement prothétique (coxarthrose ou gonarthrose), pour une durée la plus courte possible du fait du risque d’effet indésirable grave et de l’absence de données à long terme. La place de cette classe thérapeutique doit être la plus réduite possible, après échec des autres mesures médicamenteuses et du traitement physique recommandés dans ces indications. |
| Insuffisant | Avis du 13/10/2021 | Inscription (CT) | Le service médical rendu par ACTISKENAN 1 mg, 2,5 mg, 5 mg, 10 mg, 20 mg et 30 mg, comprimé orodispersible (sulfate de morphine) est insuffisant dans les douleurs intenses et/ou rebelles rencontrées dans toutes les autres situations de douleurs chroniques non cancéreuses et non neuropathiques, notamment dans les rhumatismes inflammatoires chroniques, représentés principalement par la polyarthrite rhumatoïde et la spondylarthrite. |
Amélioration du service médical rendu (ASMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprés de la HAS (plus d'informations dans l'aide). Les avis et synthéses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur de l'ASMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| V (Inexistant) | Avis du 13/10/2021 | Inscription (CT) | Ces spécialités sont des compléments de gamme qui n’apportent pas d’amélioration du service médical rendu (ASMR V) par rapport à aux présentations déjà inscrites. |
Autres informations
- Titulaire de l'autorisation : ETHYPHARM
- Conditions de prescription et de délivrance :
- prescription en toutes lettres sur ordonnance sécurisée
- prescription limitée à 4 semaines
- stupéfiants
- Statut de l'autorisation : Valide
- Type de procédure : Procédure décentralisée
- Code CIS : 6 246 954 9
ANSM - Mis à jour le : 14/05/2025
ACTISKENAN 1 mg, comprimé orodispersible
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Sulfate de morphine................................................................................................................. 1 mg
Correspondant à 0,75 mg de morphine
Pour un comprimé orodispersible
Excipients à effet notoire :
Chaque comprimé orodispersible contient :
· De l’alcool benzylique (0,1 microgramme/comprimé orodispersible)
· Des sulfites (3,5 nanogrammes/comprimé orodispersible)
Pour la liste complète des excipients, voir rubrique 6.1.
Comprimé orodispersible.
Comprimé blanc, rond, convexe, de 5 mm de diamètre, portant la mention « 1 » gravée sur une face et lisse sur l’autre face.
4.1. Indications thérapeutiques
Douleurs sévères qui ne peuvent être correctement traitées que par des opioïdes.
4.2. Posologie et mode d'administration
Objectifs et arrêt du traitement
Avant l’instauration du traitement par ACTISKENAN, une stratégie thérapeutique comprenant la durée du traitement et les objectifs du traitement, ainsi qu’un plan pour la fin du traitement, doivent être convenus avec le patient, conformément aux lignes directrices relatives à la prise en charge de la douleur. Pendant le traitement, des contacts fréquents doivent avoir lieu entre le médecin et le patient afin d’évaluer la nécessité de poursuivre le traitement, d’envisager l’arrêt du traitement et d’ajuster les doses si nécessaire. Lorsqu’un patient n’a plus besoin de traitement par ACTISKENAN, il est conseillé de réduire la dose progressivement pour éviter les symptômes de sevrage. En l’absence d’un contrôle adéquat de la douleur, la possibilité d’hyperalgésie, de tolérance et de progression de la maladie sous-jacente doit être envisagée (voir rubrique 4.4).
Posologie
ACTISKENAN doit être administré de la manière suivante :
|
Population |
Dose initiale |
|
Adultes et adolescents de plus de 16 ans |
10-20 mg de sulfate de morphine toutes les 4 à 6 heures |
La dose doit ensuite être ajustée avec précaution, chaque jour si nécessaire, afin de soulager la douleur.
Les patients recevant déjà des opioïdes peuvent commencer le traitement à des doses plus élevées en fonction de leur expérience précédente.
Dans le cadre d’un ajustement posologique, ACTISKENAN doit être pris à horaire fixe (toutes les 4 à 6 heures).
L’objectif est de trouver pour chaque patient une dose permettant de maintenir une analgésie suffisante avec des effets indésirables acceptables.
La dose peut être augmentée sous surveillance médicale en fonction de l’intensité de la douleur, de la sensibilité du patient et de ses besoins antérieurs en analgésiques.
Durée du traitement
Ce médicament ne doit pas être utilisé plus longtemps que nécessaire.
Si un traitement au long cours est jugé nécessaire en raison de la nature et de la sévérité de la maladie, la prescription doit être relayée par des analgésiques à libération prolongée. La dose journalière totale doit rester la même.
Si le patient a besoin de plus de deux prises par jour dans le traitement d’accès douloureux, cela signifie généralement que la dose d’analgésique à libération prolongée doit être augmentée.
ACTISKENAN peut être pris au cours ou en dehors des repas.
Correspondance entre les différentes voies d’administration
La posologie de la morphine varie selon la voie d’administration.
Le passage d’une forme pharmaceutique de morphine à une autre doit tenir compte des facteurs de conversion afin de maintenir la même quantité de morphine disponible.
La dose doit être divisée par 3 lors du passage d’une forme orale à une forme intraveineuse, et par 2 lors du passage à une forme sous-cutanée.
Populations particulières
Sujets âgés
Une réduction de la dose peut être conseillée chez le sujet âgé (par exemple 2,5-5 mg toutes les 4 à 6 heures).
Patients atteints d’insuffisance hépatique ou rénale
Chez les patients insuffisants hépatiques ou rénaux, ACTISKENAN doit être administré avec une prudence particulière.
Patients chez lesquels on suspecte un ralentissement du transit intestinal
En cas de suspicion de ralentissement du transit intestinal, ACTISKENAN doit être administré avec une prudence particulière.
Population pédiatrique
|
Population |
Dose initiale |
|
Adolescents de 13 à 16 ans (40-60 kg) |
5-20 mg de sulfate de morphine (correspondant à environ 0,1-0,5 mg/kg) toutes les 4 à 6 heures |
|
Enfants de 6 à 12 ans (18-40 kg) |
5-10 mg de sulfate de morphine (correspondant à environ 0,1-0,5 mg/kg) toutes les 4 à 6 heures |
|
Enfants de 1 à 5 ans (9-18 kg) |
2,5-5 mg de sulfate de morphine (correspondant à environ 0,1-0,5 mg/kg) toutes les 4 à 6 heures |
|
Enfants de > 6 mois (6-9 kg) |
1 mg de sulfate de morphine (correspondant à environ 0,1-0,2 mg/kg) toutes les 4 à 6 heures |
ACTISKENAN est contre-indiqué chez les enfants âgés de moins de 6 mois (voir rubrique 4.3).
Mode d’administration
Voie orale.
Le comprimé se dissout rapidement dans la bouche et est ensuite avalé.
Pour les populations particulières telles que les enfants ou les patients qui ont des difficultés à avaler, il est possible de placer le comprimé dans une cuillère et d’ajouter une petite quantité d’eau jusqu’à ce qu’il soit suffisamment dissous pour être ingéré. Ce mode d’administration doit être utilisé chez les enfants âgés de moins de 6 ans.
· Hypersensibilité à la substance active ou à l’un des excipients mentionnés à la rubrique 6.1,
· Enfants de moins de 6 mois,
· Dépression respiratoire sévère avec hypoxie et/ou hypercapnie (en l’absence de ventilation artificielle),
· Asthme bronchique sévère,
· Bronchopneumopathie chronique obstructive sévère,
· En aigu : traumatisme crânien et hypertension intracrânienne en l’absence de ventilation contrôlée,
· Épilepsie non contrôlée,
· Maladie hépatique aigüe,
· Abdomen aigu,
· Iléus paralytique,
· Ralentissement de la vidange gastrique,
· Association avec des agonistes-antagonistes opioïdes (p. ex. buprénorphine, nalbuphine, pentazocine), des agonistes opioïdes partiels (p. ex. naltrexone, nalméfène), l’oxybate de sodium,
· Association avec les inhibiteurs de la monoamine-oxydase ou dans les deux semaines suivant l’arrêt de ces médicaments.
4.4. Mises en garde spéciales et précautions d'emploi
· Dépendance aux opioïdes, antécédents de toxicomanie,
· Altération de la fonction respiratoire,
· Dépression respiratoire (voir ci-après),
· Apnée du sommeil,
· Cœur pulmonaire,
· Traumatisme crânien, lésions intracrâniennes, affections associées à une augmentation de la pression intracrânienne, en l’absence de ventilation,
· Altération de la conscience,
· Hypotension accompagnée d’une hypovolémie,
· Hyperplasie prostatique avec stase vésicale (risque de rupture de la vessie en raison de la rétention urinaire),
· Rétrécissement des voies urinaires ou coliques néphrétiques,
· Troubles des voies biliaires,
· Maladie intestinale obstructive et inflammatoire,
· Constipation,
· Phéochromocytome,
· Insuffisance corticosurrénalienne,
· Pancréatite,
· Altération sévère de la fonction rénale,
· Altération sévère de la fonction hépatique,
· Hypothyroïdie,
· Troubles épileptiques ou prédisposition aux convulsions,
Dépression respiratoire
Le principal risque en cas de surdosage en opioïdes est la dépression respiratoire.
Troubles respiratoires liés au sommeil
Les opioïdes peuvent provoquer des troubles respiratoires liés au sommeil, notamment l’apnée centrale du sommeil (ACS) et l’hypoxémie liée au sommeil. L’utilisation d’opioïdes augmente le risque d’ACS de façon dose-dépendante. Chez les patients souffrant d’ACS, il convient d’envisager une diminution de la dose totale d’opioïdes.
Risque lié à l’utilisation concomitante de sédatifs tels que les benzodiazépines ou les médicaments apparentés
L’utilisation concomitante de ACTISKENAN et de médicaments sédatifs tels que les benzodiazépines ou les médicaments apparentés peut entraîner une sédation, une dépression respiratoire, un coma et le décès. En raison de ces risques, la prescription concomitante avec ces médicaments sédatifs doit être réservée aux patients pour lesquels il n’existe pas d’autres options thérapeutiques. Si la décision de prescrire ACTISKENAN de manière concomitante avec des médicaments sédatifs est prise, il convient d’utiliser la dose efficace la plus faible, et la durée du traitement doit être aussi courte que possible.
Les patients doivent faire l’objet d’une surveillance étroite afin de détecter tout signe et symptôme de dépression respiratoire et de sédation. À cet égard, il est fortement recommandé d’informer les patients et leurs aidants des symptômes à surveiller (voir rubrique 4.5).
La morphine présente un risque d’abus similaire à celui des autres agonistes opioïdes forts et doit être utilisée avec précaution chez les patients présentant des antécédents d’alcoolisme ou de toxicomanie.
Trouble lié à l’utilisation d’opioïdes (abus et dépendance)
La tolérance et la dépendance physique et/ou psychologique peuvent se développer à la suite de l’administration répétée d’opioïdes tels que ACTISKENAN.
L’utilisation répétée de ACTISKENAN peut entraîner un trouble lié à l’utilisation d’opioïdes (TUO). Une dose plus élevée et une durée plus longue du traitement par opioïdes peuvent augmenter le risque de développer un TUO. L’abus ou le mésusage intentionnelle de ACTISKENAN peut entraîner un surdosage et/ou le décès. Le risque de développer un TUO est accru chez les patients ayant des antécédents personnels ou familiaux (parents ou frères et sœurs) de troubles liés à la consommation de substances (y compris ceux liés à la consommation abusive d’alcool), chez les fumeurs actifs ou chez les patients ayant des antécédents personnels de troubles de la santé mentale (par ex. dépression majeure, anxiété et troubles de la personnalité).
Avant l’instauration du traitement par ACTISKENAN et pendant le traitement, les objectifs du traitement et un plan d’arrêt doivent être convenus avec le patient (voir rubrique 4.2). Avant et pendant le traitement, le patient doit également être informé des risques et des signes de TUO. En cas d’apparition de ces signes, il convient de conseiller aux patients de contacter leur médecin.
Les patients devront faire l’objet d’une surveillance pour détecter les signes de consommation excessive de médicaments (par exemple, demandes de renouvellement prématurées), comprenant notamment l’examen des opioïdes et des médicaments psychoactifs concomitants (comme les benzodiazépines). Pour les patients présentant des signes et des symptômes de TUO, il convient d’envisager une consultation avec un spécialiste en toxicomanie.
L’usage détourné des formes orales par injection parentérale peut entraîner des événements indésirables graves pouvant être fatals.
Réactions indésirables cutanées graves (SCAR)
Une pustulose exanthématique aiguë généralisée (PEAG), pouvant mettre la vie du patient en danger ou lui être fatale, a été rapportée dans le cadre de traitements à base de morphine. La plupart de ces réactions sont survenues au cours des 10 premiers jours de traitement. Les patients doivent être informés au sujet des signes et symptômes de la PEAG et consulter un médecin s’ils présentent de tels symptômes.
Si des signes ou symptômes évoquant l’une de ces réactions cutanées apparaissent, la morphine doit être arrêtée et un traitement de substitution doit être envisagé.
Syndrome thoracique aigu (STA) chez les patients présentant une drépanocytose
En raison d’une possible association entre le STA et l’utilisation de morphine chez les patients drépanocytaires recevant un traitement par morphine lors d’une crise vaso-occlusive, les patients concernés doivent faire l’objet d’une surveillance étroite visant à détecter les symptômes de STA.
Affections hépatobiliaires
La morphine peut provoquer un dysfonctionnement et un spasme du sphincter d’Oddi, ce qui augmente la pression intrabiliaire et le risque de symptômes des voies biliaires et de pancréatite.
Utilisation en pré et postopératoire
ACTISKENAN doit être utilisé avec précaution en pré et postopératoire en raison du risque accru d’iléus ou de dépression respiratoire pendant la période postopératoire par rapport aux patients non opérés. En raison de l’effet analgésique de la morphine, des complications intra-abdominales graves telles qu’une perforation intestinale peuvent être masquées.
Les patients devant faire l’objet d’autres procédures visant à soulager la douleur (p. ex. bloc nerveux) ne doivent pas recevoir ACTISKENAN dans les 4 heures précédant l’intervention. Si le traitement par ACTISKENAN est indiqué, la dose doit être ajustée en fonction des nouveaux besoins postopératoires.
Hyperalgésie
Une hyperalgésie ne répondant pas à une nouvelle augmentation de la dose de morphine peut survenir, notamment à des doses élevées. Une réduction de la dose de morphine ou un changement d’opioïde peut s’avérer nécessaire.
Insuffisance surrénalienne
Les analgésiques opioïdes peuvent entraîner une insuffisance surrénalienne réversible nécessitant une surveillance et un traitement de substitution par glucocorticoïdes. Une insuffisance surrénalienne peut se manifester par les symptômes suivants : nausées, vomissements, perte d’appétit, fatigue, faiblesse, étourdissements ou hypotension.
Diminution des hormones sexuelles et augmentation de la prolactine
Les opioïdes, comme la morphine, peuvent avoir une action pharmacologique sur l’axe hypothalamo-hypophysaire ou gonadique.
L’utilisation à long terme d’analgésiques opioïdes peut être associée à une diminution des niveaux d’hormones sexuelles et à une augmentation de la prolactine. Les symptômes incluent : diminution de la libido, impuissance ou aménorrhée.
Utilisation concomitante avec la rifampicine
Les concentrations plasmatiques de morphine peuvent être réduites par la rifampicine. Il convient de surveiller l’effet analgésique de la morphine et d’ajuster les doses de morphine pendant et après le traitement par rifampicine.
Traitement antiplaquettaire par inhibiteur du P2Y12 par voie orale
Une réduction de l’efficacité du traitement par inhibiteur du P2Y12 a été observée, dès le premier jour de traitement concomitant par inhibiteur du P2Y12 et morphine (voir rubrique 4.5).
Excipients
Ce médicament contient 0,1 microgramme d’alcool benzylique par comprimé orodispersible.
L’alcool benzylique peut provoquer des réactions allergiques.
Ce médicament ne doit pas être utilisé pendant plus d’une semaine chez les jeunes enfants (moins de 3 ans).
Les quantités élevées doivent être utilisées avec prudence et en cas de nécessité uniquement, en particulier chez les femmes enceintes ou allaitantes et chez les personnes atteintes d’insuffisance hépatique ou rénale en raison du risque d’accumulation et de toxicité d’alcool benzylique (acidose métabolique).
Ce médicament contient des sulfites.
Les sulfites peuvent, dans de rares cas, provoquer des réactions d’hypersensibilité sévères et des bronchospasmes.
Ce médicament contient moins de 1 mmol (23 mg) de sodium par comprimé orodispersible, c’est-à-dire qu’il est essentiellement « sans sodium ».
Ce médicament contient de la morphine qui est inscrite sur la liste des substances dopantes. Son utilisation peut entraîner des résultats positifs aux tests antidopage.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Il s’agit notamment des autres opioïdes (analgésiques, antitussifs et traitements de substitution), des neuroleptiques, des anxiolytiques, des sédatifs et des hypnotiques (y compris les benzodiazépines), des anxiolytiques autres que les benzodiazépines (p. ex. le méprobamate), des antiépileptiques (y compris les gabapentinoïdes, p. ex. la gabapentine ou la prégabaline), des anesthésiques généraux (y compris les barbituriques), des antipsychotiques (y compris les phénothiazines), des antidépresseurs sédatifs (p. ex. l’amitriptyline, la doxépine, la miansérine, la mirtazapine, la trimipramine), des antihistaminiques H1 sédatifs, des myorelaxants (p. ex. le baclofène), du thalidomide, des antihypertenseurs centraux, des antiémétiques à action centrale et de l’alcool. Des effets d’interaction entraînant une dépression respiratoire, une hypotension, une sédation profonde ou un coma peuvent se produire si ces médicaments sont pris en combinaison avec les doses habituelles de morphine.
Associations contre-indiquées
+ Morphiniques agonistes-antagonistes (p. ex. buprénorphine, nalbuphine, pentazocine)
Les analgésiques agonistes/antagonistes opioïdes mixtes ne doivent pas être administrés chez un patient qui a reçu un traitement par analgésique agoniste opioïde pur en raison d’une diminution de l’effet analgésique par blocage compétitif des récepteurs, avec risque d’apparition d’un syndrome de sevrage.
+ Morphiniques antagonistes partiels (p. ex. naltrexone, nalméfène)
Risque de diminution de l’effet analgésique.
+ Oxybate de sodium
Risque majoré de dépression respiratoire, pouvant être fatale en cas de surdosage.
+ Inhibiteurs de la monoamine-oxydase
Les IMAO interagissent avec les analgésiques morphiniques, produisant une excitation ou une dépression du SNC avec des crises hypertensives ou hypotensives. La morphine ne doit pas être co-administrée avec des inhibiteurs de la monoamine-oxydase ou dans les deux semaines suivant l’arrêt de ces médicaments.
+ Alcool (boisson ou excipient)
Majoration par l’alcool de l’effet sédatif des analgésiques opioïdes.
L’altération de la vigilance peut rendre dangereuses la conduite de véhicules et l’utilisation de machines.
L’alcool pouvant renforcer les effets pharmacodynamiques de ACTISKENAN, la prise concomitante d’alcool ou de médicaments contenant de l’alcool et de ACTISKENAN doit être évitée.
+ Sédatifs tels que les benzodiazépines ou les médicaments apparentés
L’utilisation concomitante d’opioïdes et de médicaments sédatifs tels que les benzodiazépines ou les médicaments apparentés augmente le risque de sédation, de dépression respiratoire, de coma et de décès en raison de l’effet cumulatif dépresseur du SNC. Il convient de limiter tant la dose que la durée de l’association (voir rubrique 4.4).
Associations faisant l'objet de précautions d’emploi
+ Rifampicine
Les concentrations plasmatiques et l’efficacité de la morphine et de son métabolite actif peuvent être réduites par la rifampicine (voir rubrique 4.4). Une surveillance clinique et un ajustement éventuel de la posologie de morphine sont conseillés pendant le traitement par rifampicine et après son arrêt.
+ Autres analgésiques morphiniques agonistes (alfentanil, codéine, dextromoramide, dihydrocodéine, fentanyl, hydromorphone, oxycodone, péthidine, phénopéridine, rémifentanil, sufentanil, tapentadol, tramadol)
Risque majoré de dépression respiratoire, pouvant être fatale en cas de surdosage.
+ Antitussifs morphine-like (p. ex. dextrométhorphane, noscapine, pholcodine)
Risque majoré de dépression respiratoire, pouvant être fatale en cas de surdosage.
+ Antitussifs morphiniques vrais (p. ex. codéine, éthylmorphine)
Risque majoré de dépression respiratoire, pouvant être fatale en cas de surdosage.
+ Barbituriques (p. ex. allobarbital, amobarbital, bartal, butalbital, butobarbital, hexobarbital, méthylphénobarbital, phénobarbital, primidone, secbutabarbital, sécobarbital, thiopental, vinbarbital, vinylbital)
Risque majoré de dépression respiratoire, pouvant être fatale en cas de surdosage.
+ Autres médicaments sédatifs
Majoration de la dépression centrale. L’altération de la vigilance peut rendre dangereuses la conduite de véhicules et l’utilisation de machines.
+ Médicaments anticholinergiques
Les médicaments qui bloquent l’action de l’acétylcholine, comme l’atropine, les antihistaminiques, les antiparkinsoniens et les antiémétiques, peuvent interagir avec la morphine et potentialiser les effets indésirables anticholinergiques. Risque important d’akinésie colique, avec constipation sévère.
+ Inhibiteurs du P2Y12
Une exposition retardée et réduite au traitement antiplaquettaire par inhibiteur du P2Y12 par voie orale a été observée chez des patients atteints d’un syndrome coronarien aigu traités par morphine. Cette interaction peut être liée à une diminution de la motilité gastro-intestinale et s’applique aux autres opioïdes. Même si les conséquences cliniques ne sont pas connues, les données indiquent une réduction potentielle de l’efficacité des inhibiteurs du P2Y12 chez les patients co-traités avec la morphine et un inhibiteur du P2Y12 (voir rubrique 4.4). Chez les patients atteints d’un syndrome coronarien aigu, chez qui la morphine ne peut être retirée et pour lesquels une inhibition rapide du P2Y12 est jugée cruciale, l’utilisation d’un inhibiteur du P2Y12 par voie parentérale peut être envisagée.
+ Ritonavir
Bien que l’on ne dispose pas de données pharmacocinétiques concernant l’utilisation concomitante du ritonavir avec la morphine, le ritonavir induit les enzymes hépatiques responsables de la glucuronoconjugaison de la morphine, et est susceptible de diminuer les concentrations plasmatiques de morphine.
+ Cimétidine
La cimétidine inhibe le métabolisme de la morphine.
4.6. Fertilité, grossesse et allaitement
Il n’y a pas de données suffisantes dans l’espèce humaine pour permettre d’évaluer un risque tératogène potentiel. Il a été fait état d’un lien possible avec une incidence accrue d’hernies inguinales. La morphine franchit la barrière placentaire. Les études effectuées chez l’animal ont montré un risque de toxicité chez les petits pendant toute la durée de la gestation (voir rubrique 5.3). La morphine ne doit donc être utilisée pendant la grossesse que si le bénéfice pour la mère l’emporte clairement sur le risque pour l’enfant.
Compte tenu des propriétés mutagènes de la morphine, celle-ci ne doit pas être administrée aux hommes et aux femmes en âge de procréer en l’absence de contraception efficace.
Les nouveau-nés dont la mère a reçu des analgésiques opioïdes en cours de grossesse doivent faire l’objet d’une surveillance afin de détecter les signes d’un syndrome de sevrage (abstinence) néonatal. Le traitement peut inclure l’utilisation d’un opioïde et des soins de support.
Accouchement
La morphine peut prolonger ou raccourcir la durée de l’accouchement. Les nouveau-nés dont la mère a reçu des analgésiques opioïdes lors de l’accouchement doivent faire l’objet d’une surveillance afin de détecter les signes d’une dépression respiratoire ou d’un syndrome de sevrage et (si nécessaire), ils doivent être traités avec un antagoniste opioïde spécifique.
Allaitement
La morphine est excrétée dans le lait maternel, où elle atteint des concentrations supérieures à celles retrouvées dans le plasma maternel. Dans la mesure où des concentrations cliniquement pertinentes peuvent être atteintes chez l’enfant allaité, l’allaitement n’est pas conseillé.
Fertilité
Il ressort des études effectuées chez l’animal que la morphine peut réduire la fertilité (voir rubrique 5.3).
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Lorsque le traitement est stabilisé, la conduite n’est pas formellement interdite.
Les effets indésirables les plus fréquents de la morphine aux doses habituelles sont les nausées, les vomissements, la confusion, la constipation et la somnolence. En cas d’administration chronique, les nausées et vomissements sont inhabituels avec la morphine mais si de tels événements se produisent, les comprimés orodispersibles peuvent facilement être combinés avec un antiémétique si nécessaire. La constipation en revanche ne cède pas à la poursuite du traitement. Tous ces effets sont prévisibles et nécessitent d’être traités. La constipation peut être traitée avec des laxatifs appropriés.
La fréquence des effets indésirables est définie conformément à la convention suivante :
Très fréquent (³1/10), fréquent (³1/100, <1/10), peu fréquent (³1/1 000, <1/100), rare (³1/10 000, <1/1 000), très rare (<1/10 000), fréquence indéterminée (ne peut être estimée sur la base des données disponibles).
|
Classes de systèmes d’organes |
Très fréquent |
Fréquent |
Peu fréquent |
Rare |
Très rare |
Fréquence indéterminée |
|
Affections du système immunitaire |
|
Hypersensibilité |
|
|
Réaction anaphylactique Réaction anaphylactoïde |
|
|
Affections endocriniennes |
|
|
|
|
Syndrome de sécrétion inappropriée d’ADH (SIADH) (symptôme : hyponatrémie) |
|
|
Troubles du métabolisme et de la nutrition |
|
Appétit diminué |
|
|
|
|
|
Affections psychiatriques |
Humeur modifiée, principalement euphorie mais également dysphorie |
Confusion Insomnie Changements dans l’activité (principalement activité diminuée, mais également hyperactivité ou agitation) Troubles de la pensée Troubles cognitifs (p. ex. hallucinations) |
|
|
Diminution de la libido |
Pharmaco-dépendance (voir rubrique 4.4) Cauchemars (plus spécialement chez le sujet âgé) |
|
Affections du système nerveux |
|
Sensation vertigineuse Céphalées Contractions musculaires involontaires Somnolence Dysgueusie |
Convulsions Hypertonie Myoclonies (en cas de surdosage ou d’augmentation trop rapide des doses chez les sujets âgés ou insuffisants rénaux) Paresthésie Syncope |
|
Tremblements |
Sédation (dose-dépendante) Augmentation de la pression intracrânienne, qu’il convient de traiter dans un premier temps Allodynie Hyperalgésie (voir rubrique 4.4) Étourdissements |
|
Affections oculaires |
Myosis |
|
|
Nystagmus Vision trouble Vision double (diplopie) |
|
|
|
Affections de l’oreille et du labyrinthe |
|
|
Vertige |
|
|
|
|
Affections cardiaques |
|
|
Palpitations Bradycardie Tachycardie |
|
|
Insuffisance cardiaque |
|
Affections vasculaires |
|
|
Bouffées vasomotrices au visage Hypotension Hypertension |
|
|
Bouffées de chaleur |
|
Affections respiratoires, thoraciques et médiastinales |
|
|
Bronchospasme Œdème pulmonaire Dépression respiratoire (avec au maximum apnée) |
|
Dyspnée |
Réflexe de toux diminué Œdème pulmonaire non cardiogénique après augmentation rapide de la dose Syndrome d’apnée centrale du sommeil |
|
Affections gastro-intestinales |
Constipation Nausées |
Douleurs abdominales Bouche sèche Vomissements (notamment à l’instauration du traitement) Dyspepsie |
Iléus paralytique |
Pancréatite (y compris exacerbation de pancréatite) |
Occlusion intestinale Maladie dentaire, mais aucun lien de causalité avec le traitement par morphine ne peut être établi. |
|
|
Affections hépatobiliaires |
|
|
|
Colique biliaire |
|
Spasme du sphincter d’Oddi |
|
Affections de la peau et du tissu sous-cutané |
|
Rash Hyperhidrose Urticaire Prurit |
|
|
|
Pustulose exanthématique aiguë généralisée (PEAG) |
|
Affections musculosquelettiques, du tissu conjonctif et des os |
|
|
|
|
Spasmes musculaires Rigidité musculaire |
|
|
Affections du rein et des voies urinaires |
|
Rétention urinaire (notamment en cas d’adénome prostatique ou de sténose urétrale) |
|
|
Colique néphrétique |
Spasme urétéral Dysurie |
|
Affections des organes de reproduction et du sein |
|
|
|
|
Aménorrhée Dysfonction érectile |
|
|
Troubles généraux et anomalies au site d’administration |
|
Asthénie Fatigue Malaise |
Œdème périphérique |
|
Frissons |
Tolérance au médicament Syndrome de sevrage (abstinence) Syndrome de sevrage (abstinence) néonatal |
|
Investigations |
|
|
Elévation des Enzymes hépatiques |
|
|
|
Description d’effets indésirables particuliers
L’utilisation répétée de ACTISKENAN peut entraîner une pharmacodépendance, même à des doses thérapeutiques. Le risque de pharmacodépendance peut varier en fonction des facteurs de risque individuels du patient, de la posologie et de la durée du traitement par opioïdes (voir rubrique 4.4).
Syndrome de sevrage (abstinence) :
L’interruption soudaine de l’administration d’opioïdes ou l’administration d’antagonistes opioïdes peut précipiter un syndrome de sevrage. Ce syndrome peut également survenir entre deux doses. Pour la prise en charge, voir la rubrique 4.4.
Les symptômes physiologiques du sevrage sont notamment les suivants : courbatures, tremblements, syndrome des jambes sans repos, diarrhée, colique abdominale, nausées, symptômes semblables à ceux de la grippe, tachycardie et mydriase. Les symptômes psychologiques comprennent : humeur dysphorique, anxiété et irritabilité. Dans le cadre de la pharmacodépendance, un « état de manque » est souvent présent.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr.
Symptômes
Les doses toxiques varient considérablement d’une personne à l’autre, une seule dose pouvant conduire à une intoxication alors que les utilisateurs réguliers peuvent supporter des doses élevées.
Les signes d’une toxicité et d’un surdosage en morphine sont : pupilles en tête d’épingle (myosis), flaccidité des muscles squelettiques, bradycardie, hypotension, hypothermie, dépression respiratoire, pneumopathie d’inhalation, somnolence et dépression du système nerveux central pouvant évoluer vers un état de stupeur ou de coma. Le décès peut survenir des suites d’une insuffisance respiratoire. Une insuffisance circulatoire et un coma profond peuvent survenir dans les cas plus sévères.
Un surdosage peut être fatal. Une rhabdomyolyse évoluant vers une insuffisance rénale a été rapportée dans le cadre d’un surdosage en opioïde.
Une leucoencéphalopathie toxique a été observée en cas de surdosage en morphine.
Traitement d’un surdosage en morphine
Les premières mesures doivent consister à libérer les voies respiratoires et initier une ventilation assistée ou contrôlée.
Les antagonistes opioïdes purs sont des antidotes spécifiques contre les effets d’un surdosage en opioïdes. D’autres mesures de support doivent être utilisées selon les besoins.
Chez les patients inconscients en arrêt respiratoire, une ventilation, une intubation et l’administration intraveineuse d’un antagoniste opioïde (p. ex. 0,4-2 mg de naloxone en IV) sont indiquées.
Si l’insuffisance respiratoire persiste, la dose doit être répétée 1 à 3 fois à trois minutes d’intervalle jusqu’à ce que la fréquence respiratoire soit normalisée et que le patient réponde aux stimuli douloureux.
Une surveillance stricte (au moins 24 heures) est nécessaire car l’effet de l’antagoniste opioïde est plus court que celui de la morphine, et il faut donc s’attendre à une résurgence de l’insuffisance respiratoire.
La dose de l’antagoniste opioïde chez l’enfant est de 0,01 mg par kg de poids corporel par dose.
Des mesures visant à prévenir le risque d’hypothermie et d’hypovolémie peuvent également être nécessaires.
La naloxone ne doit pas être administrée en l’absence de dépression respiratoire ou circulatoire cliniquement significative secondaire à un surdosage en morphine. La naloxone doit être administrée avec précaution chez les personnes présentant une dépendance physique connue ou suspectée à la morphine. Dans ces cas, une inversion brutale ou complète des effets de l’opioïde peut favoriser l’apparition d’un syndrome de sevrage aigu.
L’administration par voie orale de charbon actif (50 g pour les adultes, 1 g/kg pour les enfants) peut être envisagée en cas d’ingestion d’une quantité importante moins d’une heure auparavant, à condition de pouvoir protéger les voies respiratoires.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Mécanisme d’action
La morphine agit comme un agoniste au niveau des récepteurs aux opiacés dans le SNC, en particulier les récepteurs mu et, dans une moindre mesure, les récepteurs kappa. On pense que les récepteurs mu interviennent dans l’analgésie supraspinale, la dépression respiratoire et l’euphorie et que les récepteurs kappa sont impliqués dans l’analgésie spinale, le myosis et la sédation.
Effets pharmacodynamiques
Système nerveux central
Les principales actions d’intérêt thérapeutique de la morphine sont l’analgésie et la sédation (somnolence et anxiolyse).
La morphine produit une dépression respiratoire par action directe sur les centres respiratoires du tronc cérébral.
La morphine a un effet dépresseur sur le réflexe de toux en agissant directement sur le centre de la toux dans le bulbe rachidien. Des effets antitussifs peuvent se manifester avec des doses inférieures à celles qui sont généralement requises pour obtenir l’analgésie.
La morphine provoque un myosis, même dans l’obscurité totale. Un myosis en tête d’épingle est un signe de surdosage en opioïde mais n’est pas pathognomonique (p. ex., une lésion pontique d’origine hémorragique ou ischémique peut provoquer le même symptôme). Une mydriase importante plutôt qu’un myosis peut être observée en cas d’hypoxie dans le cadre d’un surdosage en morphine.
Lors d’une utilisation prolongée de morphine, la sensibilité du SNC à la morphine diminue. Ce phénomène d’accoutumance peut être tel que le patient peut nécessiter et supporter des doses élevées de morphine qui pourraient être toxiques si elles étaient directement utilisées pour la première fois en raison de la dépression respiratoire produite.
En raison de l’effet euphorisant de la morphine, il y a un risque d’addiction (voir également la rubrique 4.4).
Muscles lisses gastro-intestinaux et autres
La morphine provoque une réduction de la motilité associée à une augmentation du tonus des muscles lisses dans l’antre de l’estomac et dans le duodénum. La digestion des aliments dans l’intestin grêle est retardée, et les contractions propulsives diminuent. Les ondes péristaltiques propulsives dans le côlon diminuent, alors que le tonus augmente jusqu’au spasme, entraînant la constipation.
La morphine augmente généralement le tonus des muscles lisses, en particulier au niveau des sphincters du tractus gastro-intestinal et des voies biliaires.
La morphine peut provoquer un spasme du sphincter d’Oddi, entraînant une élévation de la pression intrabiliaire.
Système cardiovasculaire
La morphine peut entraîner la libération d’histamine associée ou non à une vasodilatation périphérique. Les manifestations de la libération d’histamine et/ou de la vasodilatation périphérique sont notamment les suivantes : prurit, bouffées vasomotrices, rougeur oculaire, sueurs et/ou hypotension orthostatique.
Système endocrinien
Les opioïdes peuvent affecter les axes hypothalamo-hypophyso-surrénalien et hypothalamo-hypophyso-gonadique, entraînant respectivement une insuffisance surrénalienne ou un hypogonadisme (voir rubrique 4.4).
Autres effets pharmacologiques
Les études in vitro et celles conduites chez l’animal indiquent que les opioïdes naturels, comme la morphine, ont différents effets sur le système immunitaire ; la pertinence clinique de cette observation n’est pas établie.
5.2. Propriétés pharmacocinétiques
La morphine est absorbée relativement rapidement après administration orale, principalement au niveau de la partie supérieure de l’intestin grêle et aussi un peu au niveau de l’estomac. Le faible niveau de biodisponibilité absolue (20 % - 40 %) est dû à un effet de premier passage important. Environ 20 à 35 % de la morphine circulante se lie aux protéines plasmatiques, de préférence à la fraction albumine.
Distribution
Le volume de distribution de la morphine est établi à 1,0 – 4,7 L/kg après une administration unique de 4 – 10 mg par voie IV. Des concentrations tissulaires importantes sont retrouvées au niveau du foie, du rein, du tractus gastro-intestinal et des muscles. La morphine franchit la barrière hémato-encéphalique.
Biotransformation
La morphine est principalement métabolisée dans le foie, mais également dans l’épithélium intestinal. La première étape est la glucuronoconjugaison du groupe hydroxyle phénolique par UDP-glucuronyl-transférase hépatique et la N-déméthylation. Les principaux métabolites sont d’abord le morphine-3-glucuronide et, dans une moindre mesure, le morphine-6-glucuronide. Des sulfoconjugués et des métabolites oxydatifs tels que la normorphine, le N-oxyde de morphine et une morphine 2-hydroxylée sont également produits. La demi-vie des glucuronides est significativement plus longue que celle de la morphine libre. Le morphine-6-glucuronide est biologiquement actif. Il est possible que l’effet prolongé observé chez les patients atteints d’insuffisance rénale soit dû à ce métabolite.
Élimination
Environ 80 % de la morphine administrée est retrouvée dans l’urine après administration orale ou parentérale (10 % sous forme de morphine inchangée, 4 % sous forme de normorphine et 65 % sous forme de glucuronides, avec un ratio morphine-3-glucuronide/morphine-6-glucuronide de 10/1). La demi-vie d’élimination de la morphine est sujette à des fluctuations interindividuelles importantes. En moyenne, elle est comprise entre 1,7 et 4,5 heures après administration parentérale, avec parfois des valeurs situées autour de 9 heures. Environ 10 % des glucuronides de la morphine sont excrétés par la bile avec les fèces.
5.3. Données de sécurité préclinique
Les données non cliniques issues des études conventionnelles de pharmacologie de sécurité et de toxicologie en administration répétée n’ont pas révélé de risque particulier pour l’espèce humaine.
Des effets ont été observés chez l’animal au niveau de la génotoxicité et des fonctions de reproduction et de développement.
Potentiel mutagène et tumorigène
Les résultats des tests de mutagénicité sont clairement positifs, indiquant que la morphine a un effet clastogène et que cet effet a un impact sur les gamètes. La morphine doit donc être considérée comme une substance mutagène et on peut supposer que cet effet est également applicable à l’espèce humaine.
Aucune étude à long terme n’a été conduite chez l’animal sur le potentiel tumorigène de la morphine.
Toxicité sur la reproduction
Les études effectuées chez l’animal ont montré un risque de toxicité chez les petits pendant toute la durée de la gestation (malformations du SNC, retard de croissance, atrophie testiculaire, modifications au niveau des systèmes neurotransmetteurs et des profils comportementaux, dépendance).
Chez les rats mâles, une diminution de la fertilité et des dommages chromosomiques dans les gamètes ont été signalés.
Hydroxypropylcellulose
Cellulose microcristalline
Crospovidone type A
Acésulfame potassique
Arôme orange (comprenant de l’alcool benzylique, du sodium et des sulfites)
Dioxyde de silice
Stéarate de magnésium
36 mois
6.4. Précautions particulières de conservation
À conserver dans l’emballage d’origine à l’abri de la lumière.
6.5. Nature et contenu de l'emballage extérieur
Plaquette prédécoupée unitaire (Polyamide/Aluminium/PVC/Aluminium-PET)
Boîtes contenant 12, 14, 16, 20, 50, 56 et 100 comprimés orodispersibles.
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
194 BUREAUX DE LA COLLINE
BATIMENT D
92213 SAINT CLOUD CEDEX
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 302 333 1 3 : 14 comprimés sous plaquettes prédécoupées unitaires (Polyamide/Aluminium/PVC/Aluminium/PET).
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
A compléter ultérieurement par le titulaire
10. DATE DE MISE A JOUR DU TEXTE
A compléter ultérieurement par le titulaire
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Stupéfiant
Prescription sur ordonnances sécurisées.
Prescription limitée à 28 jours
ANSM - Mis à jour le : 14/05/2025
ACTISKENAN 1 mg, comprimé orodispersible
Sulfate de morphine
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin ou votre pharmacien.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que ACTISKENAN 1 mg, comprimé orodispersible et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant de prendre ACTISKENAN 1 mg, comprimé orodispersible ?
3. Comment prendre ACTISKENAN 1 mg, comprimé orodispersible ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver ACTISKENAN 1 mg, comprimé orodispersible ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE ACTISKENAN 1 mg, comprimé orodispersible ET DANS QUELS CAS EST-IL UTILISE ?
Classe pharmacothérapeutique : Analgésiques Opioïdes - code ATC : N02AA01
La substance active de ACTISKENAN est la morphine, qui appartient à un groupe de médicaments appelés analgésiques (antidouleurs) forts, de la famille des opioïdes.
Ce médicament vous a été prescrit par votre médecin pour soulager des douleurs sévères qui ne peuvent être correctement traitées que par des opioïdes.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT DE PRENDRE ACTISKENAN 1 mg, comprimé orodispersible?
Ne prenez jamais ACTISKENAN 1 mg, comprimé orodispersible :
· Si vous êtes allergique à la morphine ou à l’un des autres composants contenus dans ce médicament, mentionnés dans la rubrique 6.
· Si le patient est un enfant de moins de 6 mois (voir la rubrique « Enfants »).
· Si vous avez des problèmes respiratoires, tels qu’une maladie obstructive des voies respiratoires ou une dépression respiratoire. Votre médecin vous en aura informé. Ces problèmes peuvent se manifester par les symptômes suivants : essoufflement, toux ou respiration plus lente ou plus faible que d’habitude.
· Si vous souffrez d’asthme bronchique sévère.
· Si vous avez un traumatisme crânien provoquant des maux de tête sévères ou une sensation de mal être. En effet, ce médicament peut aggraver ces symptômes ou masquer l’ampleur du traumatisme crânien.
· Si vous souffrez d’épilepsie non contrôlée.
· Si vous souffrez d’une maladie hépatique d’apparition récente.
· Si vous souffrez d’une maladie dans laquelle l’intestin grêle ne fonctionne pas correctement (iléus paralytique), si votre estomac se vide plus lentement qu’il ne le devrait (ralentissement de la vidange gastrique) ou si vous souffrez d’une douleur aiguë soudaine dans l’abdomen.
· Si vous prenez des médicaments contenant de la buprénorphine, de la nalbuphine et de la pentazocine (substances ayant des propriétés similaires à celles de la morphine et susceptibles d’atténuer les effets de la morphine) ainsi que des médicaments contenant de la naltrexone, du nalméfène et de l’oxybate de sodium.
· Si vous prenez un médicament appartenant au groupe des inhibiteurs de la monoamine-oxydase, utilisé comme antidépresseur (comme la tranylcypromine, la phénelzine, l’isocarboxazide, le moclobémide et le linézolide), ou si vous avez pris ce type de médicament au cours des deux dernières semaines.
Avertissements et précautions
Tolérance, dépendance et addiction
Ce médicament contient de la morphine, qui est un opioïde. L’utilisation répétée d’opioïdes peut entraîner une diminution de l’efficacité du médicament (vous vous y habituez, ce que l’on appelle la tolérance). L’utilisation répétée de ACTISKENAN peut également entraîner une dépendance, des abus et une addiction, qui peuvent aboutir à un surdosage potentiellement mortel. Le risque de ces effets indésirables peut augmenter avec une dose plus élevée et une durée d’utilisation plus longue.
La dépendance ou l’addiction peut vous donner l’impression que vous ne contrôlez plus la quantité de médicament que vous devez prendre ou la fréquence à laquelle vous devez le prendre.
Le risque de développer une dépendance ou une addiction varie d’une personne à l’autre. Vous pouvez présenter un risque plus élevé de développer une dépendance ou une addiction à ACTISKENAN:
· si vous ou un membre de votre famille avez déjà consommé de façon abusive ou été dépendant(e) à l’alcool, à des médicaments sur ordonnance ou à des substances illicites («addiction»);
· si vous fumez;
· si vous avez déjà présenté des troubles de l’humeur (dépression, anxiété ou trouble de la personnalité) ou avez été traité(e) par un psychiatre pour d’autres maladies mentales.
Si vous remarquez l’un des signes suivants lors de la prise de ACTISKENAN, il pourrait s’agir d’un signe que vous êtes devenu(e) dépendant(e) ou addict(e);
· vous devez prendre le médicament pendant une durée plus longue que celle indiquée par votre médecin;
· vous devez prendre une dose supérieure à la dose recommandée;
· vous utilisez le médicament pour des raisons autres que celles qui vous ont été prescrites, par exemple «pour rester calme» ou «pour vous aider à dormir»;
· vous avez tenté à plusieurs reprises et sans succès d’arrêter ou de contrôler l’utilisation de ce médicament;
· lorsque vous arrêtez de prendre le médicament, vous vous sentez mal, et vous vous sentez mieux lorsque vous reprenez le médicament («effets de sevrage»).
Si vous remarquez l’un de ces signes, parlez-en à votre médecin pour discuter de la meilleure approche de traitement pour vous, y compris le moment opportun pour arrêter et la façon d’arrêter en toute sécurité (voir rubrique 3, «Si vous arrêtez de prendre ACTISKENAN»).
Adressez-vous à votre médecin ou pharmacien avant de prendre ACTISKENAN 1 mg, comprimé orodispersible, en particulier :
· Si vous êtes dépendant(e) aux opioïdes ou si vous avez des antécédents de toxicomanie.
· Si vous avez des problèmes respiratoires, tels qu’une altération de la fonction respiratoire ou une diminution de la capacité respiratoire. Ces problèmes peuvent se manifester par un essoufflement et de la toux.
· Si vous souffrez d’un problème cardiaque sévère après une maladie pulmonaire de longue durée (cœur pulmonaire).
· Si vous avez des maux de tête sévères ou des sensations vertigineuses, car ces symptômes peuvent indiquer que la pression à l’intérieur de votre crâne a augmenté.
· Si vous présentez un traumatisme crânien ou des lésions intracrâniennes.
· Si vous avez des troubles de la conscience.
· Si vous avez une pression artérielle basse (hypotension), associée à un faible volume de sang circulant (hypovolémie).
· Si vous avez des problèmes au niveau de la prostate.
· Si vous présentez un rétrécissement des voies urinaires ou des coliques néphrétiques.
· Si vous avez des problèmes au niveau de la vésicule biliaire.
· Si vous avez une occlusion intestinale ou une maladie intestinale inflammatoire.
· Si vous avez une tumeur au niveau des glandes surrénales.
· Si vous présentez une faiblesse, de la fatigue, un manque d’appétit, des nausées, des vomissements ou une pression artérielle basse. Ces symptômes peuvent traduire une baisse de la production de l’hormone cortisol par les glandes surrénales, et vous pourriez avoir besoin de prendre un supplément hormonal.
· Si vous souffrez d’une inflammation du pancréas (pouvant provoquer des douleurs sévères au niveau de l’abdomen et du dos).
· Si vous souffrez d’hypothyroïdie (insuffisance de sécrétion de la glande thyroïde) ou de problèmes rénaux ou hépatiques de longue durée, car vous pourriez avoir besoin d’une dose plus faible.
· Si vous souffrez actuellement ou avez souffert par le passé d’épilepsie ou de crises convulsives.
· Si vous souffrez de drépanocytose et que vous prenez de la morphine, votre médecin vous surveillera attentivement en raison d’une possible association avec le syndrome thoracique aigu.
ACTISKENAN doit être utilisé avec précaution avant et après une intervention chirurgicale (risque accru de paralysie intestinale ou de dépression respiratoire).
Adressez-vous à votre médecin ou à votre pharmacien si vous présentez l’un des symptômes suivants pendant votre traitement par ACTISKENAN :
· Augmentation de la sensibilité à la douleur malgré la prise de doses croissantes (hyperalgésie). Votre médecin décidera si vous devez changer de dose ou d’analgésique (antidouleur) fort (voir rubrique 2) ;
· Faiblesse, fatigue, manque d’appétit, nausées, vomissements ou pression artérielle basse. Ces symptômes peuvent indiquer que les glandes surrénales produisent trop peu d’hormone cortisol et que vous devez prendre un supplément hormonal ;
· Perte de libido, impuissance, arrêt des règles. Ces symptômes peuvent être dus à une diminution de la production d’hormones sexuelles ;
· Le risque le plus important associé au surdosage en opioïdes est une respiration lente et peu profonde (dépression respiratoire) ;
· La constipation est fréquente sous morphine. Si vous aviez des troubles du transit intestinal avant le traitement, parlez-en à votre médecin.
Des cas de pustulose exanthématique aiguë généralisée (PEAG) ont été rapportés dans le cadre de traitements par ACTISKENAN. Les symptômes surviennent généralement au cours des 10 premiers jours de traitement. Informez votre médecin si vous avez déjà développé une éruption cutanée grave ou une desquamation de la peau, des cloques et/ou des plaies dans la bouche après avoir pris de ACTISKENAN ou d’autres opioïdes. Arrêtez d’utiliser ACTISKENAN et consultez immédiatement un médecin si vous remarquez l’un des symptômes suivants: cloques, peau squameuse étendue ou boutons remplis de pus, ainsi que fièvre.
Troubles respiratoires liés au sommeil
ACTISKENAN peut provoquer des troubles respiratoires liés au sommeil tels que l’apnée du sommeil (pauses respiratoires pendant le sommeil) et l’hypoxémie liée au sommeil (faible taux d’oxygène dans le sang). Les symptômes associés peuvent inclure des pauses respiratoires pendant le sommeil, des réveils nocturnes dus à l’essoufflement, des difficultés à rester endormi(e) ou une somnolence excessive pendant la journée. Si vous ou une autre personne remarquez ces symptômes, contactez votre médecin. Une réduction de la dose peut être envisagée par votre médecin.
Vous devez prendre les comprimés par voie orale exclusivement. Ces comprimés ne doivent jamais être dispersés et injectés car cela pourrait entraîner des effets indésirables graves pouvant être fatals.
Personnes âgées
Ce médicament doit être utilisé avec précaution chez le sujet âgé (voir la rubrique « Comment prendre ACTISKENAN »).
Enfants
Ne donnez pas ce médicament à un enfant de moins de 6 mois (voir la rubrique « Ne prenez jamais ACTISKENAN»).
Autres médicaments et ACTISKENAN 1 mg, comprimé orodispersible
Informez votre médecin si vous prenez, avez récemment pris ou pourriez prendre tout autre médicament et en particulier les médicaments mentionnés ci-dessous :
· De la rifampicine pour traiter, par exemple, la tuberculose. Elle peut réduire l’effet de la morphine ;
· L’utilisation concomitante de ACTISKENAN et de sédatifs tels que les benzodiazépines ou les médicaments apparentés augmente le risque de somnolence, de difficultés respiratoires (dépression respiratoire) et de coma, et peut engager le pronostic vital. C’est pourquoi une utilisation concomitante ne doit être envisagée que s’il n’existe pas d’autres options thérapeutiques. Toutefois, si votre médecin vous prescrit ACTISKENAN en association avec des médicaments sédatifs, il doit veiller à limiter la dose et la durée du traitement concomitant. Informez votre médecin de tous les sédatifs que vous prenez et suivez strictement ses recommandations posologiques. Il pourrait s’avérer utile d’informer vos amis ou votre famille afin que ceux-ci connaissent les signes et symptômes énumérés ci-dessus. Prenez contact avec votre médecin si vous présentez de tels symptômes ;
· Des médicaments qui ont un effet central, c’est-à-dire de ralentissement sur la fonction cérébrale ou l’alcool, qui peuvent augmenter les effets indésirables de la morphine ;
· Des médicaments pour aider à dormir ou à rester calme (par exemple les benzodiazépines, les tranquillisants, les hypnotiques ou les sédatifs) ;
· Des anesthésiques généraux ;
· Des médicaments pour traiter les troubles psychiatriques (tels que les phénothiazines) ;
· Des médicaments pour traiter la dépression ;
· Des myorelaxants, car la morphine peut en augmenter l’effet ;
· Des médicaments pour traiter l’hypertension artérielle ;
· De la gabapentine ou de la prégabaline pour le traitement de l’épilepsie et des douleurs dues à des problèmes nerveux (douleurs neuropathiques) ;
· De la buprénorphine, de la nalbuphine ou de la pentazocine, ainsi que de la naltrexone, du nalméfène et de l’oxybate de sodium. N’associez pas ACTISKENAN avec ces médicaments. En cas de doute, adressez-vous à votre médecin ;
· D’autres antidouleurs forts ;
· Des médicaments pour traiter la dépression, appelés « inhibiteurs de la monoamine-oxydase » (IMAO), ou dans les deux semaines suivant l’arrêt de ces médicaments (voir rubrique 2, « Ne prenez jamais ACTISKENAN») ;
· Des médicaments utilisés pour prévenir ou soulager les symptômes d’une allergie (antihistaminiques) ;
· Des médicaments pour traiter la maladie de Parkinson ;
· Certains types de médicaments pour vous empêcher d’être nauséeux ;
· Certains médicaments utilisés pour traiter les caillots sanguins (p. ex. clopidogrel, prasugrel, ticagrélor) peuvent avoir un effet retardé et diminué lorsqu’ils sont pris avec la morphine ;
· Du ritonavir pour traiter le VIH ;
· De la cimétidine pour traiter les ulcères gastriques, l’indigestion ou les brûlures d’estomac.
ACTISKENAN 1 mg, comprimé orodispersible avec de l’alcool
Ne buvez pas d’alcool et ne prenez pas de médicaments contenant de l’alcool pendant votre traitement par ce médicament.
La consommation d’alcool pendant le traitement par ce médicament peut vous rendre plus somnolent(e) ou augmenter la probabilité d’effets indésirables graves tels qu’une respiration superficielle avec un risque d’arrêt respiratoire et de perte de connaissance.
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin ou pharmacien avant de prendre ce médicament.
Grossesse
Dans la mesure du possible, ce médicament ne doit pas être utilisé si vous êtes enceinte ou que vous allaitez, sauf si votre médecin estime que cela est absolument nécessaire et considère que le bénéfice pour vous est significativement supérieur au risque pour l’enfant.
Les hommes et les femmes en âge de procréer doivent utiliser une contraception fiable pendant le traitement par ACTISKENAN.
Si ACTISKENAN est utilisé à long terme pendant une grossesse, il existe un risque que le nouveau-né présente des symptômes de sevrage (abstinence) qui devront être traités par un médecin.
Les symptômes de sevrage (abstinence) chez les bébés dont la mère a utilisé ACTISKENAN pendant la grossesse peuvent être notamment les suivants : pleurs aigus, irritabilité et agitation, tremblements, difficultés d’alimentation et sueurs.
Allaitement
Vous ne devez pas allaiter pendant votre traitement par ce médicament car la morphine passe dans le lait maternel.
Conduite de véhicules et utilisation de machines
ACTISKENAN peut provoquer un certain nombre d’effets indésirables tels qu’une somnolence, pouvant affecter votre aptitude à conduire des véhicules et à utiliser des machines (voir la rubrique 4 pour consulter la liste complète des effets indésirables). Ces effets sont généralement plus marqués au début du traitement ou lors d’une augmentation de la dose. Si vous présentez ce type de symptômes, vous ne devez pas conduire de véhicules ni utiliser de machines.
ACTISKENAN 1 mg, comprimé orodispersible contient de l’alcool benzylique, du sodium et des sulfites
Ce médicament contient 0,1 microgramme d’alcool benzylique par comprimé orodispersible.
L’alcool benzylique peut provoquer des réactions allergiques.
Ne pas utiliser pendant plus d’une semaine chez les jeunes enfants (moins de 3 ans), sauf avis contraire de votre médecin ou de votre pharmacien.
Demandez conseil à votre médecin ou à votre pharmacien si vous êtes enceinte ou si vous allaitez. De grandes quantités d’alcool benzylique peuvent s’accumuler dans votre corps et entraîner des effets secondaires (appelés « acidose métabolique »).
Demandez conseil à votre médecin ou à votre pharmacien si vous souffrez d’une maladie du foie ou du rein. De grandes quantités d’alcool benzylique peuvent s’accumuler dans votre corps et entraîner des effets secondaires (appelés « acidose métabolique »).
Ce médicament contient moins de 1 mmol (23 mg) de sodium par comprimé orodispersible, c’est-à-dire qu’il est essentiellement « sans sodium ».
Les sulfites peuvent, dans de rares cas, provoquer des réactions d’hypersensibilité sévères et des bronchospasmes.
Ce médicament contient de la morphine qui est inscrite sur la liste des substances dopantes. Son utilisation peut entraîner des résultats positifs aux tests antidopage
3. COMMENT PRENDRE ACTISKENAN 1 mg, comprimé orodispersible?
La dose dépendra de l’intensité de la douleur et de vos besoins antérieurs en analgésiques.
Lors du traitement de douleurs chroniques, il est préférable de suivre un horaire d’administration fixe.
Utilisation chez les adultes et les adolescents de plus de 16 ans
La dose initiale habituelle est de 10-20 mg toutes les 4 à 6 heures. Votre médecin décidera du nombre de comprimés orodispersibles que vous devez prendre.
Si votre douleur persiste malgré la prise de ces comprimés, parlez-en à votre médecin.
Ne dépassez pas la dose recommandée par votre médecin. Vérifiez auprès de votre médecin ou de votre pharmacien en cas de doute.
Utilisation chez les sujets âgés (plus de 65 ans)
Une réduction de la dose est recommandée chez le sujet âgé (par exemple 2,5-5 mg toutes les 4 à 6 heures).
Utilisation chez les patients présentant des problèmes hépatiques ou rénaux
Ce médicament doit être administré avec une prudence particulière chez les patients qui présentent des problèmes hépatiques ou rénaux.
Patients chez lesquels on suspecte un ralentissement du transit intestinal
Ce médicament doit être administré avec une prudence particulière en cas de suspicion de ralentissement du transit intestinal.
Utilisation chez les enfants et les adolescents
Utilisation chez les adolescents : de 13 à 16 ans (40-60 kg)
La dose initiale habituelle est de 5-20 mg toutes les 4 à 6 heures.
Utilisation chez les enfants :
De 6 à 12 ans (18-40 kg)
La dose initiale habituelle est de 5-10 mg toutes les 4 à 6 heures.
De 1 à 5 ans (9-18 kg)
La dose initiale habituelle est de 2,5-5 mg toutes les 4 à 6 heures.
De plus de 6 mois (6-9 kg)
La dose initiale habituelle est de 1 mg toutes les 4 à 6 heures.
Mode d’administration
· Voie orale.
· Placez le comprimé orodispersible dans la bouche. Il va fondre rapidement et pourra ensuite être avalé.
· Il est également possible de placer le comprimé orodispersible dans une cuillère avec une petite quantité d’eau avant de le donner à votre enfant ou à une personne qui a des difficultés à avaler. Il va rapidement fondre suffisamment pour pouvoir être avalé plus facilement. Ce mode d’administration doit être utilisé chez les enfants âgés de moins de 6 ans.
Instructions pour l’ouverture
Ce médicament se présente sous plaquettes prédécoupées unitaires avec fermeture de sécurité enfant et opercule pelable.
|
|
Ne poussez pas le comprimé pour le faire sortir à travers l’opercule. |
|
|
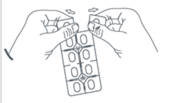
Détachez une seule dose en suivant la ligne de prédécoupage. |
|
|
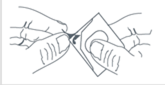
Retirez l’opercule de la plaquette pour retirer le comprimé orodispersible. |
Durée du traitement
Ne prenez pas ce médicament plus longtemps que nécessaire.
Toute modification ou interruption du traitement doit être effectuée selon les recommandations de votre médecin (voir la rubrique « Si vous arrêtez de prendre ACTISKENAN»).
Si vous avez pris plus de ACTISKENAN 1 mg, comprimé orodispersible que vous n’auriez dû
Consultez immédiatement votre médecin ou un hôpital car vous pourriez avoir besoin d’une prise en charge hospitalière en urgence. Un surdosage peut avoir des conséquences graves et peut être mortel.
Pensez à prendre cette notice et les comprimés orodispersibles restants pour les montrer au médecin que vous consultez.
Les personnes ayant pris une dose trop importante peuvent présenter un rétrécissement des pupilles, une forte somnolence, une diminution de la fréquence cardiaque, une baisse de la pression artérielle, une chute de la température corporelle ou une pneumopathie causée par l’inhalation de vomissements ou de matières étrangères (les symptômes peuvent comprendre un essoufflement, de la toux et de la fièvre).
Les personnes ayant pris une dose trop importante peuvent également présenter des difficultés respiratoires entraînant une perte de connaissance ou même le décès et/ou souffrir d’un trouble cérébral (appelé toxico-encéphalopathie).
Dans les cas plus graves, une insuffisance circulatoire peut survenir et conduire à un coma profond.
Des lésions allant jusqu’à la destruction musculaire peuvent survenir (pouvant évoluer vers une insuffisance rénale).
Vous ne devez en aucun cas vous trouver dans des situations nécessitant une attention accrue, telles que la conduite de véhicules.
En cas de surdosage, les mesures suivantes sont recommandées en attendant l’arrivée d’un médecin : maintenir le patient éveillé, surveiller sa fonction respiratoire et l’aider à respirer si nécessaire.
Si vous oubliez de prendre ACTISKENAN 1 mg, comprimé orodispersible
Si vous avez pris une dose trop faible de ACTISKENAN ou que vous avez oublié de prendre votre médicament, le soulagement de votre douleur sera insuffisant voire nul.
Ne prenez pas de dose double pour compenser la dose que vous avez oublié de prendre.
Ne prenez pas deux doses en moins de 4 heures.
Continuez le traitement selon les recommandations que vous avez reçues.
Si vous arrêtez de prendre ACTISKENAN 1 mg, comprimé orodispersible
N’arrêtez pas votre traitement par ACTISKENAN sans l’accord de votre médecin.
Si vous souhaitez arrêter votre traitement par ACTISKENAN, demandez à votre médecin comment réduire progressivement la dose afin d’éviter l’apparition de symptômes d’abstinence (sevrage).
Les symptômes du sevrage peuvent comprendre les effets suivants : courbatures, tremblements, diarrhée, douleurs abdominales, nausée, symptômes semblables à ceux de la grippe, accélération des battements cardiaques et pupilles dilatées. Les symptômes psychologiques comprennent un sentiment intense d’insatisfaction, de l’anxiété et de l’irritabilité.
Si vous avez d’autres questions sur l’utilisation de ce médicament, demandez plus d’informations à votre médecin ou à votre pharmacien.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Réaction cutanée sévère accompagnée de cloques, d’une peau squameuse étendue, de boutons remplis de pus, ainsi que de fièvre. Il peut s’agir d’une maladie appelée pustulose exanthématique aiguë généralisée (PEAG).
L’effet indésirable le plus grave (peu fréquent) est un phénomène se manifestant par une respiration plus lente ou plus faible que d’habitude (dépression respiratoire). Prévenez immédiatement votre médecin si vous présentez cet effet indésirable.
Ce médicament peut provoquer des réactions allergiques (la fréquence des réactions allergiques graves est inconnue). Prévenez immédiatement votre médecin si vous présentez soudainement une respiration sifflante, des difficultés pour respirer, des sensations vertigineuses, un gonflement au niveau des paupières, du visage ou des lèvres, une éruption cutanée ou des démangeaisons, en particulier sur l’ensemble du corps.
Les effets indésirables les plus fréquents de la morphine sont les nausées, les vomissements, la confusion, la constipation et la somnolence.
Il y a un risque d’addiction ou de dépendance à ce médicament.
Chez les patients traités par morphine, les effets indésirables suivants ont été rapportés :
Très fréquents : peuvent concerner plus de 1 personne sur 10
· modifications de l’humeur, principalement exaltation (euphorie), mais également mécontentement (dysphorie),
· contraction pupillaire (rétrécissement de la pupille),
· constipation (votre médecin peut vous prescrire un laxatif dans ce cas),
· nausées, qui s’arrêtent après un certain temps.
Fréquents : peuvent concerner jusqu’à 1 personne sur 10
· hypersensibilité,
· troubles de la pensée,
· confusion, difficultés pour dormir,
· changements d’humeur (généralement activité réduite, mais également activité augmentée ou hyperexcitabilité),
· hallucinations,
· sensations vertigineuses, maux de tête,
· contractions musculaires involontaires,
· somnolence,
· modification du goût,
· vomissements,
· douleurs abdominales,
· bouche sèche,
· perte d’appétit,
· éruption cutanée, urticaire ou démangeaisons,
· transpiration excessive,
· difficultés pour uriner (notamment en cas d’hypertrophie de la prostate ou de sténose urétrale),
· sensation de faiblesse inhabituelle,
· sensation de malaise général, fatigue.
Peu fréquents : peuvent concerner jusqu’à 1 personne sur 100
· crises épileptiques ou convulsives,
· raideur musculaire inhabituelle, spasmes musculaires,
· évanouissement/perte temporaire de connaissance (syncope),
· sensation de picotements ou d’engourdissement dans les membres (paresthésie),
· sensation vertigineuse ou de « tête qui tourne » (vertige),
· battements cardiaques rapides ou irréguliers (palpitations), accélération du pouls, ralentissement du pouls,
· bouffées vasomotrices au visage (rougeurs du visage),
· pression artérielle faible, pression artérielle élevée,
· œdème pulmonaire (accumulation de liquide dans les tissus et les espaces interstitiels des poumons), respiration lente et superficielle (dépression respiratoire), gêne respiratoire (bronchospasme),
· maladie dans laquelle les intestins ne fonctionnent pas correctement (iléus),
· élévation des enzymes hépatiques (mise en évidence par une analyse de sang),
· gonflement au niveau des mains, des chevilles ou des pieds.
Rares : peuvent concerner jusqu’à 1 personne sur 1 000
· élévation des enzymes pancréatiques, inflammation du pancréas (pancréatite),
· douleur sourde dans la partie médiane et supérieure droite de l’abdomen (colique biliaire).
Très rares : peuvent concerner jusqu’à 1 personne sur 10 000
· production excessive d’une hormone antidiurétique entraînant une rétention hydrique, se traduisant par un faible taux de sodium dans le sang, une apathie, une fatigue ou une confusion,
· diminution de la libido,
· tremblements musculaires,
· vision trouble, vision double et tremblements oculaires,
· difficultés pour respirer,
· occlusion intestinale,
· maladies dentaires, mais aucun lien de causalité avec le traitement par morphine ne peut être établi,
· crampes musculaires, augmentation de la tension musculaire,
· douleur aiguë dans le bas du dos qui irradie vers le flanc, pouvant être provoquée par des calculs rénaux,
· dysfonction érectile,
· absence des règles,
· frissons.
Fréquence indéterminée : ne peut être estimée sur la base de données disponibles
· réaction allergique sévère (réactions anaphylactiques, réactions anaphylactoïdes),
· cauchemars (plus spécialement chez le sujet âgé),
· sédation,
· augmentation de la pression intracrânienne,
· douleur déclenchée par un stimulus qui est normalement indolore (allodynie),
· augmentation de la sensibilité à la douleur (hyperalgésie – voir également la rubrique 2),
· apnée du sommeil (pauses respiratoires pendant le sommeil),
· étourdissements,
· insuffisance cardiaque,
· bouffées de chaleur (sensation de chaleur subite),
· réflexe de toux diminué,
· accumulation d’eau dans les poumons après une augmentation rapide de la dose (œdème pulmonaire),
· tolérance au médicament (phénomène qui se produit lorsque vous ne répondez plus au médicament aussi bien qu’au début du traitement et que vous devez prendre une dose plus élevée pour obtenir le même effet),
· symptômes de sevrage ou dépendance,
· symptômes de sevrage chez les bébés dont la mère a utilisé ACTISKENAN pendant la grossesse (voir rubrique 2 « Grossesse, allaitement et fertilité »),
En cas d’arrêt brutal de ce médicament, un syndrome de sevrage peut apparaître, avec les symptômes suivants : anxiété, irritabilité, frissons, dilatation des pupilles, bouffées de chaleur, sueurs, larmoiement, écoulement nasal, nausée, vomissements, douleurs abdominales, diarrhée, douleurs articulaires.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, votre pharmacien ou à votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr.
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER ACTISKENAN 1 mg, comprimé orodispersible ?
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur la plaquette et l’emballage. La date de péremption fait référence au dernier jour de ce mois.
À conserver dans l’emballage d’origine à l’abri de la lumière.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient ACTISKENAN 1 mg, comprimé orodispersible
· La substance active est :
Sulfate de morphine........................................................................................................... 1 mg
Pour un comprimé orodispersible
· Les autres composants sont :
mannitol, hydroxypropylcellulose, cellulose microcristalline, crospovidone type A, acésulfame potassique, arôme orange (contenant de l’alcool benzylique, du sodium et des sulfites), dioxyde de silice, stéarate de magnésium.
Qu’est-ce que ACTISKENAN 1 mg, comprimé orodispersible et contenu de l’emballage extérieur
ACTISKENAN est disponible en boîtes de 12, 14, 16, 20, 50, 56 et 100 comprimés orodispersibles.
Toutes les présentations peuvent ne pas être commercialisées.
Titulaire de l’autorisation de mise sur le marché
194 BUREAUX DE LA COLLINE
BATIMENT D
92213 SAINT CLOUD CEDEX
Exploitant de l’autorisation de mise sur le marché
LABORATOIRES ETHYPHARM
179 BUREAUX DE LA COLLINE
92210 SAINT CLOUD
CHEMIN DE LA POUDRIERE
76120 LE GRAND QUEVILLY
Ou
ETHYPHARM
ZONE INDUSTRIELLE DE SAINT ARNOULT
28170 CHATEAUNEUF EN THYMERAIS
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Ce médicament est autorisé dans les Etats membres de l'Espace Economique Européen sous les noms suivants : Conformément à la réglementation en vigueur.
[À compléter ultérieurement par le titulaire]
La dernière date à laquelle cette notice a été révisée est :
A compléter ultérieurement par le titulaire
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).