Dernière mise à jour le 02/02/2026
DIERGOSPRAY 4 mg/ml, solution pour pulvérisation nasale
Indications thérapeutiques
Classe pharmacothérapeutique : Alcaloïdes de l’ergot - code ATC : N02CA01
DIERGOSPRAY contient une substance appelée mésilate de dihydroergotamine.
DIERGOSPRAY appartient à la classe de médicaments connue sous le nom d'alcaloïdes de l'ergot de seigle. Il agit sur des récepteurs spécifiques (appelés récepteurs 5HT), qui seraient impliqués dans la crise de migraine. DIERGOSPRAY peut alors diminuer la sévérité d'une crise de migraine.
DIERGOSPRAY est destiné au traitement de la crise de migraine avec ou sans aura (troubles de la vue qui chez certains patients précèdent la crise de migraine).
Présentations
> 1 flacon(s) en verre brun de 1 ml avec dispositif pulvérisateur (PULVADOZ) polypropylène
Code CIP : 347 382-2 ou 34009 347 382 2 7
Déclaration de commercialisation : 10/04/2000
Cette présentation est agréée aux collectivités
- Prix hors honoraire de dispensation : 4,51 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 5,53 €
- Taux de remboursement :30%
Service médical rendu (SMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Modéré | Avis du 17/06/2015 | Renouvellement d'inscription (CT) | Le service médical rendu par DIERGOSPRAY et DIHYDROERGOTAMINE AMDIPHARM reste modéré dans les indications de l’AMM. |
Amélioration du service médical rendu (ASMR)
Pas d'ASMR disponible pour ce médicament (plus d'informations dans l'aide )
ANSM - Mis à jour le : 05/11/2025
DIERGOSPRAY 4 mg/ml, solution pour pulvérisation nasale
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Mésilate de dihydroergotamine.............................................................................................. 4,0 mg
Pour 1 ml de solution pour pulvérisation nasale.
1 dose délivre 0,5 mg de mésilate de dihydroergotamine.
Pour la liste complète des excipients, voir rubrique 6.1.
Solution pour pulvérisation nasale.
DIERGOSPRAY solution pour pulvérisation nasale est une solution pour application locale utilisant un dispositif pulvérisateur.
La solution est claire, incolore à légèrement jaune, marron-jaune ou vert-jaune.
4.1. Indications thérapeutiques
Traitement des crises de migraine avec ou sans aura.
4.2. Posologie et mode d'administration
Posologie
Une pulvérisation (0,5 mg) de DIERGOSPRAY solution pour pulvérisation nasale dans chaque narine dès l’apparition de la céphalée migraineuse.
Quinze minutes plus tard, chez les patients pour qui la première dose de DIERGOSPRAY solution pour pulvérisation nasale (1 mg) n’a pas été suffisante, une nouvelle pulvérisation (0,5 mg) peut être administrée dans chaque narine, aboutissant à une dose totale de quatre pulvérisations (2,0 mg) par crise.
Les recommandations suivantes doivent être observées :
La dose maximale de DIERGOSPRAY solution pour pulvérisation nasale à ne pas dépasser par 24h est de 2 mg (= 4 pulvérisations) et la dose maximale à ne pas dépasser par semaine est de 8 mg (= 16 pulvérisations).
Après le traitement d’une crise de migraine par DIERGOSPRAY solution pour pulvérisation nasale, un intervalle d’au moins 24 heures doit être respecté avant le traitement d’une nouvelle crise par la dihydroergotamine (en pulvérisation nasale ou sous forme injectable) ou par tout autre médicament contenant de l’ergotamine, du sumatriptan ou un autre agoniste des récepteurs de la 5-hydroxytryptamine 1.
Après le traitement d’une seule crise de migraine dans les conditions décrites ci-dessus (1 mg ou 2 mg respectivement), le pulvérisateur et la solution pour pulvérisation doivent être jetés.
Sujets âgés
L’utilisation de DIERGOSPRAY solution pour pulvérisation nasale n’est pas recommandée chez les patients de plus de 65 ans en absence de données d’efficacité et de sécurité d’emploi.
Insuffisance hépatique
La prudence est recommandée chez les patients présentant une insuffisance hépatique légère à modérée, en particulier chez les patients présentant une hépatite cholestatique (voir rubriques 4.4 et 5.2). DIERGOSPRAY solution pour pulvérisation nasale est contre-indiqué chez les patients présentant une insuffisance hépatique sévère (voir rubrique 4.3).
Population pédiatrique
L’utilisation de DIERGOSPRAY solution pour pulvérisation nasale n’est pas recommandée chez les patients de moins de 16 ans en absence de données d’efficacité et de sécurité d’emploi.
Mode d’administration
Instructions d’utilisation
La solution pour pulvérisation nasale doit être préparée juste avant son utilisation (c’est-à-dire dès l’apparition de la céphalée migraineuse). Une fois le dispositif pulvérisateur assemblé, il doit être utilisé dans les 8 heures.
1. Soulever un bord de la capsule bleue sans la détacher du collier métallique.
2. Enlever la capsule et le collier métallique. La capsule bleue et le collier métallique doivent s’enlever d’une seule pièce. Si la capsule bleue s’arrache, retirer le collier métallique en prenant extrêmement garde aux rebords qui peuvent être tranchants.
3. Enlever avec soin le bouchon en caoutchouc du flacon.
4. Enlever délicatement le capuchon protecteur de la partie inférieure du dispositif de pulvérisation.
5. Insérer la pompe du pulvérisateur nasal dans le flacon ouvert et la fixer dans le sens des aiguilles d’une montre.
6. Tout en maintenant le flacon en position verticale, enlever délicatement le capuchon protecteur bleu de l’embout nasal.
7. Le pulvérisateur doit être amorcé avant la première utilisation : tenir le pulvérisateur nasal en position verticale et appuyer fermement vers le bas 4 fois. L’amorçage s’accompagne normalement de projection d’un peu de liquide.
8. Maintenir le pulvérisateur en position verticale, introduire l’embout dans une narine et pulvériser une fois. Faire la deuxième pulvérisation dans l’autre narine. Inspirer fortement par le nez plusieurs fois pour éviter que la solution ne s’écoule des narines. Eviter de se moucher immédiatement après les pulvérisations.
Replacer le capuchon protecteur bleu et garder le pulvérisateur à portée de la main au cas où il devrait être réutilisé. Il est inutile de réamorcer la pompe.
· Conditions prédisposant à des réactions angiospastiques : insuffisance coronaire (en particulier angor instable ou spastique), états infectieux sévères (septicémie), choc, maladie vasculaire oblitérante, maladies vasculaires périphériques telles que syndrome de Raynaud, antécédents d’accident ischémique transitoire ou de souffrance cérébrale ou d’hypertension artérielle mal contrôlée.
· Artérite temporale.
· Traitement de la migraine familiale hémiplégique.
· Traitement de la migraine basilaire.
· Grossesse et allaitement (voir rubrique 4.6).
· Patients présentant une insuffisance hépatique sévère.
· Patients traités simultanément par inhibiteurs puissants du CYP 3A comme les antibiotiques de type macrolides, les inhibiteurs de la protéase du VIH, les antifongiques azolés et autres médicaments (voir rubrique 4.5).
· Patients traités simultanément par les vasoconstricteurs périphériques y compris ceux contenant des dérivés de l’ergot de seigle, le sumatriptan et les autres agonistes des récepteurs à la 5-hydroxytryptamine1 (5-HT1) (voir rubrique 4.5).
4.4. Mises en garde spéciales et précautions d'emploi
La dihydroergotamine peut avoir des effets indésirables graves, appelés fibrose, notamment une fibrose rétropéritonéale, cardiaque, pulmonaire et pleurale et un ergotisme (y compris des cas graves de constriction des vaisseaux sanguins périphériques) pouvant être mortels.
Les patients ayant des antécédents de fibrose liée à des médicaments, telle qu’une fibrose rétropéritonéale et pleurale, doivent être suivis avec attention.
L'utilisation prolongée de dihydroergotamine ou d'autres dérivés de l'ergot de seigle doit être évitée car elle peut entraîner une dépendance.
L’usage journalier chronique de DIERGOSPRAY solution pour pulvérisation nasale ou son emploi au-delà des doses recommandées doit être évité car il peut entraîner un vasospasme.
L’abus chronique de DIERGOSPRAY solution pour pulvérisation nasale peut causer des céphalées de rebond. Si cette situation est suspectée, le traitement doit être suspendu.
Dans de rares cas, des spasmes vasculaires peuvent être observés, particulièrement dans les membres inférieurs. Si des signes et des symptômes de spasmes vasculaires apparaissent, DIERGOSPRAY solution pour pulvérisation nasale doit être arrêté et un traitement par vasodilatateurs périphériques doit être instauré (voir rubrique 4.9).
Il convient d’informer le patient des doses maximales de DIERGOSPRAY solution pour pulvérisation nasale à ne pas dépasser et de lui signaler quels sont les premiers symptômes d’un surdosage : paresthésie (par ex. engourdissement, fourmillements) au niveau des doigts et des orteils, nausées et vomissements sans rapport avec la migraine, symptômes d’ischémie myocardique et douleurs précordiales. Dès l’apparition de symptômes de surdosage, le traitement doit être interrompu et le patient doit aussitôt consulter son médecin.
Une surveillance particulière est recommandée chez les patients souffrant de rhinite, de congestion nasale et de rhinite allergique ainsi que chez les patients atteints d’insuffisance hépatique légère à modérée et plus spécialement en cas d’hépatite cholestatique.
Note : la solution contenue dans le flacon en verre teinté est réservée à la voie nasale et ne doit pas être injectée.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Inhibiteurs puissants du CYP3A4
L’administration concomitante d’inhibiteurs puissants du cytochrome P450 3A (CYP3A) et de DIERGOSPRAY solution pour pulvérisation nasale est contre-indiquée. Les inhibiteurs puissants du CYP 3A incluent : antibiotiques de type macrolide (ex. érythromycine, troléandomycine, clarithromycine, telithromycine) et tétracycline, les inhibiteurs de la protéase du VIH(ex. ritonavir, indinavir, nelfinavir, fosamprénavir, amprénavir, atazanavir), les inhibiteurs de la transcriptase inverse (ex. delavirdine, éfavirenz), les antifongiques dérivés de l’imidazole (ex. kétokonazole, micanazole) dérivés triazoles (ex. itraconazole, voriconazole, posaconazole) (voir rubrique 4.3). L’administration concomitante peut entraîner une élévation de l’exposition à la dihydroergotamine et à une toxicité de l’ergot (vasospasme, ischémie et possible nécrose des extrémités et autres tissus).
Vasoconstricteurs
L’utilisation concomitante de vasoconstricteurs incluant les produits contenant de l’ergotamine, les alcaloïdes de l’ergot de seigle, et de sympathomimétiques est contre-indiquée puisqu’elle peut aggraver la vasoconstriction, provoquer une ischémie et une possible nécrose des extrémités et d’autres tissus (voir rubrique 4.3).
Compte tenu des propriétés vasoconstrictrices de la dihydroergotamine, l’utilisation de nicotine (par exemple : tabagisme important, traitement de substitution avec la nicotine) doit se faire avec précaution.
DIERGOSPRAY solution pour pulvérisation nasale doit être pris au moins 24 heures avant ou 6 heures après le sumatriptan, l'almotriptan, le rizatriptan et le zolmitriptan. De plus, l'utilisation concomitante avec l'élétriptan, le frovatriptan ou le naratriptan doit être éloignée d'au moins 24 heures en raison du risque accru de vasoconstriction.
Inhibiteurs faibles à modérés du CYP3A4
Des inhibiteurs faibles à modérés du CYP3A4 tels que le jus de pamplemousse, le saquinavir, la cimétidine, le métronidazole, la quinupristine/dalfopristine, le clotrimazole, le fluconazole, la néfazodone, la fluoxétine, la fluvoxamine et le zileuton peuvent également augmenter l'exposition à l'ergotamine et une prudence est recommandée en cas d’utilisation concomitante.
Il n'y a pas d'autres interactions pharmacocinétiques connues avec d'autres isoenzymes P450.
Bien que l’association aux β-bloquants (par exemple le propranolol) soit généralement bien tolérée, la prudence est requise chez les patients atteints de troubles de la circulation périphérique.
4.6. Fertilité, grossesse et allaitement
Grossesse
L’utilisation de DIERGOSPRAY solution pour pulvérisation nasale est contre-indiquée pendant la grossesse.
L’expérience clinique avec la dihydroergotamine par voie parentérale suggère qu’en raison de son activité utéro-tonique et des effets vasoconstricteurs sur le placenta et le cordon ombilical, la dihydroergotamine puisse être néfaste pour le fœtus.
Les études chez l’animal ont démontré une reprotoxicité (voir rubrique 5.3).
Il est probable que la dihydroergotamine soit excrétée dans le lait maternel. L’utilisation de DIERGOSPRAY solution pour pulvérisation nasale est donc contre-indiquée chez la femme allaitante.
Fertilité
Aucune donnée de l'effet de la dihydroergotamine sur la fertilité chez l'être humain n'est disponible. Chez le rat, aucun effet sur la fertilité masculine et féminine n'a été observé après l'administration intranasale et orale de dihydroergotamine à des doses supérieures à la dose quotidienne maximale recommandée chez l'Homme.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Les effets indésirables les plus fréquemment rapportés sont : rhinite, nausées et vomissements, dysgueusies, réactions dose-dépendantes au site d’application (par exemple obstruction nasale, rhinorrhée), diarrhée, pharyngite, sensations vertigineuses et flush.
La classification selon la fréquence utilise la convention suivante : très fréquents (≥1/10), fréquents (≥1/100 à <1/10), peu fréquents (≥1/1000 à <1/100), rares (≥1/10000 à <1/1000), fréquence indéterminée (ne peut être estimée avec les données disponibles).
Dans chaque groupe de fréquence, les effets indésirables sont présentés en ordre décroissant de sévérité.
|
Affections du système immunitaire |
|
|
Rares : |
Réactions d’hypersensibilité (rash cutané, œdème de la face, urticaire, dyspnée) |
|
Affections du système nerveux |
|
|
Peu fréquents : |
Paresthésie/hyposthésie, sensations vertigineuses, dysgueusie |
|
Affections cardiaques |
|
|
Rares : |
Symptômes d’ischémie myocardique |
|
Affections vasculaires |
|
|
Peu fréquents : |
Flush |
|
Rares : |
Spasme artériel (particulièrement dans les extrémités inférieures) (voir rubriques 4.4 et 4.9) |
|
Affections respiratoires, thoraciques et mediastinales |
|
|
Peu fréquents : |
Congestion nasale, rhinite |
|
Rares : |
Pharyngite, dyspnée |
|
Indéterminée : |
Epistaxis |
|
Affections musculo-squelettiques et du tissu sous-cutané |
|
|
Indéterminée : |
Spasmes musculaires |
|
Affections gastro-intestinales |
|
|
Peu fréquents : |
Nausées, vomissements |
|
Rares : |
Diarrhée |
|
Indéterminée : |
Douleur abdominale |
|
Troubles généraux et anomalies au site d’administration |
|
|
Peu fréquents : |
Réactions au site d’administration |
|
Rares : |
Douleur thoracique |
L’ergotisme peut survenir chez certains patients qui ont pris de la dihydroergotamine par voie orale de façon continue pendant des années. Le développement de changements fibrotiques, en particulier de la plèvre et du rétropéritoine, a été observé. Des cas de changements fibrotiques des valves cardiaques ont été rapportés (voir rubrique 4.4). L'utilisation chronique peut entraîner une dépendance (voir rubrique 4.4).
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr
Symptômes
Aucun cas de surdosage avec DIERGOSPRAY solution pour pulvérisation nasale n’a été rapporté. On peut cependant s’attendre à ce que les symptômes soient semblables à ceux observés après une ingestion d’une dose orale excessive : nausées, vomissements, maux de tête, tachycardie, vertiges, signes et symptômes périphériques de vasospasme (par exemple engourdissement, fourmillements et douleurs dans les extrémités), symptômes d’ischémie myocardique, douleur thoracique et coma. Il est à noter que la survenue de symptômes angiospastiques peut être retardée de 24 heures par rapport à l’administration.
Prise en charge
Après arrêt de son utilisation, le traitement du surdosage est symptomatique et requiert une surveillance étroite du système cardio-vasculaire.
En cas de réactions angiospastiques intenses, il est recommandé de procéder à l’administration intraveineuse d’un vasodilatateur périphérique (comme le nitroprussiate, la phentolamine, ou la dihydralazine), à l’application locale de chaleur sur les endroits atteints ainsi qu’un traitement préventif des lésions tissulaires. En cas de spasme coronarien, il faut débuter un traitement adapté tel que l’administration de nitroglycérine.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : Alcaloïdes de l’ergot, code ATC : N02CA01
Mécanisme d’action
La dihydroergotamine présente une affinité moyenne à élevée pour divers sous-types de récepteurs sérotoninergiques. Elle possède une activité agoniste particulièrement puissante au niveau des récepteurs 5-HT1D, qui est supposée sous-tendre son efficacité antimigraineuse.
Cette activité agoniste entraîne une diminution de la fonction des neurones en rapport avec la 5-HT et, de ce fait, il y a un effet sur des éléments de la vascularisation crânienne et/ou elle prévient l’inflammation neurogène et la stimulation des récepteurs nociceptifs qui en résulte.
L’administration de DIERGOSPRAY solution pour pulvérisation nasale a un début d’action rapide. Lors des crises de migraines d’intensité légère à sévère, DIERGOSPRAY solution pour pulvérisation nasale atténue les maux de tête et les symptômes associés tels que la phonophobie et la photophobie.
5.2. Propriétés pharmacocinétiques
Après administration nasale, la dihydroergotamine est rapidement absorbée (Tmax d’environ 45 min). Sa biodisponibilité absolue est d’environ 43 ± 24 %.
Distribution
La liaison de la dihydroergotamine aux protéines plasmatiques est de 93 % ; son volume apparent de distribution est d’environ 800 litres à l’état d’équilibre.
Biotransformation
70 à 80 % des concentrations plasmatiques représentent la substance inchangée, indiquant un métabolisme de la dihydroergotamine plus faible par voie nasale que par voie orale.
Élimination
La clairance corporelle totale est d’environ 1,5 litres/min. reflétant principalement la clairance hépatique. L’élimination plasmatique est biphasique avec une demi-vie terminale d’environ 10 heures. L’excrétion se fait essentiellement par les fèces via la bile. Après administration nasale, l’excrétion urinaire de la substance mère et des métabolites est d’environ 2 %.
5.3. Données de sécurité préclinique
À des doses orales allant jusqu’à 30 mg/kg par jour, la dihydroergotamine n’était pas tératogène chez les rats et les lapins gravides et n’avait aucun effet sur le développement périnatal ou postnatal chez le rat et le lapin. L'administration orale de 5 mg/kg par jour à des singes gravides n'était pas tératogène. Cependant, après une administration intraveineuse et nasale, une toxicité développementale (diminution du poids corporel du fœtus et/ou une ossification squelettique retardée) a été observée chez des animaux expérimentaux. Cette observation a été attribuée à une diminution du débit sanguin utéro-placentaire résultant d'une vasoconstriction prolongée des vaisseaux utérins et/ou d'une augmentation du tonus du myomètre induite par la dihydroergotamine.
Génotoxicité
Les tests de mutagénicité in vitro ont donné des résultats contradictoires. Les modèles in vivo n'ont montré aucun signe d'activité mutagène de la dihydroergotamine qui est donc considéré comme dépourvu de potentiel génotoxique.
Carcinogénicité
Des études de carcinogénicité chez le rat (administration intranasale de 0,08, 0,24 ou 0,8 mg par jour) et chez la souris (administration sous-cutanée avec 0,5, 1,5 ou 5 mg/kg par jour) ont permis de conclure que la dihydroergotamine n’avait aucun effet carcinogène.
Une incidence accrue de fibrosarcomes au site d'injection dans l'étude chez la souris (à 5 mg/kg par jour) a été considérée comme liée au mode d'administration (par voie sous-cutanée) sans pertinence pour l'utilisation intermittente chez l'homme.
Caféine anhydre, glucose anhydre, eau purifiée.
2 ans.
Après ouverture du flacon, la solution a une durée d’utilisation de 8 heures.
6.4. Précautions particulières de conservation
A conserver à une température ne dépassant pas 25°C.
6.5. Nature et contenu de l'emballage extérieur
DIERGOSPRAY solution pour pulvérisation nasale est disponible en boîte contenant 1 ml de solution en flacon de 3,5 ml (verre brun de type I) avec un dispositif pulvérisateur constitué d’une pompe et d’un tube plongeur, conditionnés dans une pochette en plastique. Le flacon est fermé par un bouchon en caoutchouc scellé au moyen d’un couvercle bleu, fixé sur un collier métallique.
Après amorçage du dispositif pulvérisateur, DIERGOSPRAY solution pour pulvérisation nasale contient au moins quatre doses de solution calibrées à 0,125 ml chacune.
Boîte de 1, 2 ou 6 flacons/dispositifs pulvérisateurs.
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
Pas d’exigences particulières.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
UNIT 17, NORTHWOOD HOUSE
NORTHWOOD CRESCENT
NORTHWOOD
DUBLIN 9 D09 V504
IRLANDE
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 347 382- 2 7 : 1 ml en flacon (verre brun) avec dispositif pulvérisateur (Polypropylène)
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[À compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[À compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Liste II
ANSM - Mis à jour le : 05/11/2025
DIERGOSPRAY 4 mg/ml, solution pour pulvérisation nasale
Mésilate de dihydroergotamine
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin ou votre pharmacien.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que DIERGOSPRAY 4 mg/ml, solution pour pulvérisation nasale et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant de prendre DIERGOSPRAY 4 mg/ml, solution pour pulvérisation nasale ?
3. Comment prendre DIERGOSPRAY 4 mg/ml, solution pour pulvérisation nasale ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver DIERGOSPRAY 4 mg/ml, solution pour pulvérisation nasale ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE DIERGOSPRAY 4 mg/ml, solution pour pulvérisation nasale ET DANS QUELS CAS EST-IL UTILISE ?
Classe pharmacothérapeutique : Alcaloïdes de l’ergot - code ATC : N02CA01
DIERGOSPRAY contient une substance appelée mésilate de dihydroergotamine.
DIERGOSPRAY appartient à la classe de médicaments connue sous le nom d'alcaloïdes de l'ergot de seigle. Il agit sur des récepteurs spécifiques (appelés récepteurs 5HT), qui seraient impliqués dans la crise de migraine. DIERGOSPRAY peut alors diminuer la sévérité d'une crise de migraine.
DIERGOSPRAY est destiné au traitement de la crise de migraine avec ou sans aura (troubles de la vue qui chez certains patients précèdent la crise de migraine).
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT DE PRENDRE DIERGOSPRAY 4 mg/ml, solution pour pulvérisation nasale ?
Ne prenez jamais DIERGOSPRAY 4 mg/ml, solution pour pulvérisation nasale :
· Si vous êtes allergique au mésilate de dihydroergotamine ou à l'un des autres composants contenus dans DIERGOSPRAY, mentionnés dans la rubrique 6;
· Si vous avez une migraine associée à une perte transitoire de l'usage d'une moitié de votre corps (appelée migraine familiale hémiplégique), ou une migraine accompagnée de vertiges, vision double (appelée migraine basilaire).
· Si vous souffrez d'une inflammation d'une artère sur le côté de la tête (artérite temporale).
· Si vous avez certaines maladies du cœur (angine de poitrine non contrôlée) ou des vaisseaux sanguins (y compris un syndrome de Raynaud), une hypertension mal contrôlée, des antécédents de souffrance cérébrale ou d'accident ischémique transitoire, états infectieux sévères, choc.
· Si vous allaitez, si vous êtes enceinte ou si vous envisagez de l'être (voir plus bas).
· Si vous avez une affection grave du foie.
· Si vous êtes traité pour une infection par certains antibiotiques (par exemple : érythromycine, troléandomycine ou clarithromycine).
· Si vous avez été traité par d'autres médicaments vasoconstricteurs périphériques et qui sont utilisés pour traiter la migraine comme le sumatriptan, naratriptan ou zolmitriptan, ou d'autres dérivés de l'ergot de seigle
· Si vous êtes traité pour le SIDA/VIH par des médicaments antiviraux inhibiteurs de la protéase (ritonavir, indinavir, nelfinavir).
· Si vous avez été traité par des médicaments antifongiques azolés par exemple : kétoconazole, itraconazole ou voriconazole.
Si vous êtes concerné par l'une de ces situations, prévenez votre médecin avant de prendre DIERGOSPRAY.
Avertissements et précautions
Adressez-vous à votre médecin ou, pharmacien avant de prendre DIERGOSPRAY 4 mg/ml, solution pour pulvérisation nasale.
· Si vous avez une obstruction nasale, une inflammation aiguë ou chronique de la muqueuse nasale (rhinite) ou une rhinite d'origine allergique.
· Si vous avez un épaississement de la membrane qui tapisse les poumons et les parois de la cavité pleurale (fibrose pleurale) ou un épaississement du tissu retropéritonéal qui peut occasionner une obstruction des voies urinaires (fibrose rétropéritonéale) causée par d'autres médicaments.
· Si vous avez une maladie légère à modérée du foie, spécialement une hépatite cholestasique. Votre médecin pourra réduire les doses.
· Si vous utilisez DIERGOSPRAY pour une durée prolongée.
Si vous êtes concerné par l'une de ces situations, prévenez votre médecin avant de prendre DIERGOSPRAY.
Ce médicament ne doit en aucun cas être utilisé pour prévenir les crises de migraine. Il est exclusivement destiné au traitement de la crise de migraine.
L'abus de DIERGOSPRAY peut provoquer :
· des maux de tête chroniques quotidiens quand vous arrêtez son utilisation ;
· des spasmes vasculaires des mains et/ou pieds avec des symptômes comme par exemple : sensation de froid, engourdissement et fourmillement, paralysie, spasmes musculaires, pâleur, douleur et perte de force.
Si vous présentez un de ces symptômes, arrêtez de prendre votre médicament et contactez votre médecin immédiatement.
Enfants et adolescents
Ce médicament ne doit pas être pris chez l’enfant de moins de 16 ans car l'efficacité et la sécurité d'emploi n'ont pas été démontrées.
Autres médicaments et DIERGOSPRAY 4 mg/ml, solution pour pulvérisation nasale
Informez votre médecin ou pharmacien si vous prenez, avez récemment pris ou pourriez prendre tout autre médicament.
Ne prenez pas DIERGOSPRAY 4 mg/ml, solution pour pulvérisation nasale si vous prenez un des médicaments suivants :
· antibiotiques comme par exemple : tétracycline, érythromycine, troléandomycine,clarithromycine, télithromycine, josamycine, métronidazole, et quinupristine-dalfopristine ;
· médicaments antiviraux inhibiteurs de la protéase pour traiter le SIDA/VIH comme par exemple : ritonavir, indinavir, fosamprénavir, nelfinavir, delavirdine ou éfavirenz ;
· médicaments antifongiques azolés (par exemple : kétoconazole, itraconazole, voriconazole, posaconazole, clotrimazole, fluconazole) ;
· prendre au moins 24 heures avant ou 6 heures après le sumatriptan, l'almotriptan, le rizatriptan et le zolmitriptan. De plus, l'utilisation concomitante avec l'élétriptan, le frovatriptan ou le naratriptan doit être éloignée d'au moins 24 heures.
· d'autres médicaments à base d'ergotamine ou dérivés de l'ergot de seigle,
· traitement antidépresseur comme la fluoxétine, la fluvoxamine et la néfazodone.
· Β-bloquants comme le propranolol (médicament utilisé pour prévenir les crises de migraines ou pour traiter l’hypertension artérielle).
Si vous êtes un gros fumeur ou si vous prenez un substitut nicotinique, parlez-en à votre médecin avant de prendre ce médicament.
DIERGOSPRAY 4 mg/ml, solution pour pulvérisation nasale avec des aliments, boissons et de l’alcool
La prise concomitante de DIERGOSPRAY avec du jus de pamplemousse peut accroitre les effets due à une exposition accrue à la dihydroergotamine.
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin ou pharmacien avant de prendre ce médicament.
Grossesse
N'utilisez pas DIERGOSPRAY si vous êtes enceinte. L'utilisation de ce médicament pendant la grossesse peut occasionner des lésions sévères au fœtus. Prévenez votre médecin si vous pensez être enceinte.
Allaitement
N'utilisez pas DIERGOSPRAY si vous allaitez. Prévenez votre médecin si vous allaitez.
Conduite de véhicules et utilisation de machines
En cas de vertiges ou de troubles de la vision lors de l'utilisation de ce médicament, vous ne devez pas conduire des véhicules ni utiliser des machines.
3. COMMENT PRENDRE DIERGOSPRAY 4 mg/ml, solution pour pulvérisation nasale ?
Vous devez utiliser une pulvérisation (0,5 mg = 1 dose) dans chaque narine dès l'apparition des maux de tête.
Quinze minutes plus tard, si la première administration n'a pas été suffisante, une nouvelle pulvérisation peut être administrée dans une ou dans chaque narine.
Utilisation chez les sujets âgés
L’utilisation de DIERGOSPRAY n’est pas recommandée chez les patients de plus de 65 ans en absence de données d’efficacité et de sécurité d’emploi.
Utilisation chez les patients présentant une insuffisance hépatique
Informez votre médecin si vous souffrez d’une maladie du foie. Votre médecin voudra peut-être vous faire des prises de sang régulièrement pour surveiller votre fonction hépatique. L’utilisation de ce médicament n'est pas recommandée chez les patients présentant des problèmes hépatiques graves.
Utilisation chez les enfants et les adolescents
L’utilisation de DIERGOSPRAY solution pour pulvérisation nasale n’est pas recommandée chez les patients de moins de 16 ans en absence de données d’efficacité et de sécurité d’emploi.
Les recommandations suivantes doivent être prises en compte :
· Pour une crise de migraine n'utilisez pas plus de 2 pulvérisations par narine (4 doses).
· N'utilisez pas DIERGOSPRAY pour traiter une autre crise dans les 24 heures qui suivent.
· La dose maximale à ne pas dépasser par 24 heures est de 2 pulvérisations par narine (soit 4 doses) et la dose totale administrée sur une période d'une semaine ne doit pas dépasser 8 pulvérisations par narine (soit 16 doses).
· Si vous n'utilisez pas les 4 doses du dispositif une fois la crise traitée, le dispositif doit être jeté. Il ne peut pas servir pour une nouvelle crise.
· Ne pas utiliser une injection de dihydroergotamine ou d'autre produit contenant de l'ergotamine ou d'autres traitements pour la migraine par exemple sumatriptan, zolmitriptan, naratriptan ou rizatriptan dans les 24 heures suivant l'utilisation de DIERGOSPRAY.
· Ne pas utiliser DIERGOSPRAY dans les 6 heures suivant l'utilisation d'un triptan (sumatriptan, zolmitriptan, élétriptan, almotriptan, frovatriptan).
Ne pas utiliser une dose supérieure ou plus fréquemment que celle recommandée par votre médecin. Si votre crise de migraine ne s'améliore pas ou s'aggrave, consultez votre médecin.
La solution contenue dans le flacon est réservée à la voie intranasale. Elle ne doit pas être injectée, ni prise par voie orale.
Comment préparer votre spray nasal
Ne préparez le dispositif que lorsque vous ressentez les premiers symptômes de la crise. Une fois que le dispositif a été préparé il doit être utilisé dans les 8 heures qui suivent.
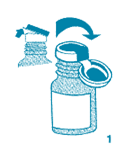
1. Soulever un bord de la capsule bleue sans la détacher du collier métallique.
2. Puis enlever la capsule et le collier métallique. La capsule bleue et le collier métallique doivent s'enlever d'une seule pièce. Si la capsule bleue s'arrache, retirer le collier métallique en prenant extrêmement garde aux rebords qui peuvent être tranchants.
3. Enlever avec soin le bouchon de caoutchouc du flacon.
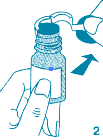
4. Ouvrir la pochette en plastique, enlever délicatement le dispositif de pulvérisation et insérer la pompe du pulvérisateur nasal dans le flacon ouvert et la fixer en tournant dans le sens des aiguilles d'une montre.
Comment utiliser votre spray nasal
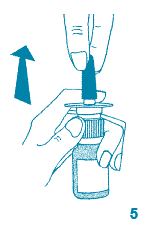
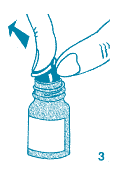
5. Tout en maintenant le flacon en position verticale, enlever délicatement le capuchon protecteur bleu de l'embout nasal.
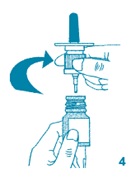
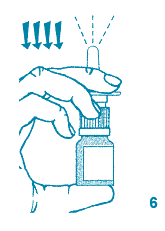
6. Le pulvérisateur doit être amorcé avant la première utilisation : tenir le pulvérisateur nasal en position verticale et appuyer fermement vers le bas 4 fois. L'amorçage s'accompagne normalement de projection d'un peu de liquide.
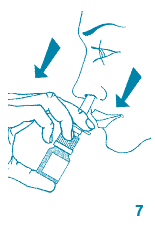
7. Maintenir le pulvérisateur en position verticale, introduire l'embout dans une narine et pulvériser une fois. Faire la deuxième pulvérisation dans l'autre narine. Inspirer fortement par le nez à plusieurs reprises pour éviter que la solution s'écoule des narines. Eviter de se moucher immédiatement après avoir fait les pulvérisations.
Replacer le capuchon protecteur bleu sur l'embout et garder le pulvérisateur à portée de la main pour le cas où il devrait être réutilise. Il est inutile de réamorcer la pompe.
Si vous avez pris plus de DIERGOSPRAY mg/ml, solution pour pulvérisation nasale que vous n'auriez dû
Consultez immédiatement votre médecin, si vous avez accidentellement pris une dose supérieure à celle qui vous a été prescrite ou si vous ressentez, après la prise, l'un des symptômes suivants : engourdissements et picotements des doigts et orteils, nausées, vomissements, maux de tête ou douleur dans la poitrine.
Si vous avez d'autres questions sur l'utilisation de ce médicament, demandez plus d'informations à votre médecin ou à votre pharmacien.
Si vous oubliez de prendre DIERGOSPRAY mg/ml, solution pour pulvérisation nasale
Sans objet.
Si vous arrêtez de prendre DIERGOSPRAY mg/ml, solution pour pulvérisation nasale
Sans objet.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Certains effets indésirables peuvent être graves :
· douleurs thoraciques,
· symptômes de spasme vasculaire des mains et/ou pieds avec des symptômes comme par exemple : sensation de froid, engourdissement et fourmillement, paralysies, spasmes musculaires, douleur et perte de force,
· réactions allergiques (hypersensibilité) comme éruption cutanée, gonflement de la face, urticaire, difficulté respiratoire.
· symptômes de douleurs thoracique, étourdissements, transpiration, essoufflement et toux. Ceux-ci pourraient être des signes d'une crise cardiaque.
· Essoufflement
Si vous présentez un de ces symptômes, arrêtez de prendre votre médicament et contactez votre médecin immédiatement.
Autres effets indésirables possibles :
Peu fréquents (concernent jusqu'à 1 personne sur 100) :
· éternuements,
· congestion du nez ou nez bouché (rhinite),
· accès de rougeur de la peau (sensation de chaud),
· nausées ou vomissements,
· vertiges,
· engourdissements et picotements des doigts et des orteils,
· diminution de la sensibilité de la peau,
· altération du goût,
· sensation de brûlures et de piqûre,
· contraction soudaine et involontaire d’un muscle, ou d’un groupe de muscles
Rares (concernent jusqu'à 1 personne sur 1000) :
· diarrhée,
· irritation de la gorge
Fréquence indéterminée (ne peut être estimée sur la base des données disponibles) :
· saignement du nez,
· spasmes musculaires,
· douleur abdominale.
Si un des effets indésirables s'aggrave ou si vous remarquez des effets indésirables non mentionnés dans cette notice, veuillez en informer votre médecin ou pharmacien.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER DIERGOSPRAY 4 mg/ml, solution pour pulvérisation nasale ?
Tenir ce médicament hors de la vue et de la portée des enfants.
Ne pas utiliser après la date de péremption figurant sur la boîte. La date d'expiration fait référence au dernier jour du mois.
A conserver à une température ne dépassant pas 25°C.
Après ouverture du flacon, la solution a une durée d'utilisation de 8 heures.
Les médicaments ne doivent pas être jetés au tout à l'égout ou avec les ordures ménagères. Demandez à votre pharmacien ce qu'il faut faire des médicaments inutilisés. Ces mesures permettront de protéger l'environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient DIERGOSPRAY 4 mg/ml, solution pour pulvérisation nasale
· La substance active est :
Mésilate de dihydroergotamine................................................................................................ 4 mg
Pour 1 ml de solution pour pulvérisation nasale.
Une dose délivre 0,5 mg de mésilate de dihydroergotamine.
· Les autres composants sont : caféine anhydre, glucose anhydre, eau purifiée.
Ce médicament se présente sous la forme d’une solution claire, incolore à légèrement jaune, marron-jaune ou vert-jaune.
Boîte de 1, 2 ou 6 flacons.
Toutes les présentations peuvent ne pas être commercialisées.
Titulaire de l’autorisation de mise sur le marché
UNIT 17, NORTHWOOD HOUSE
NORTHWOOD CRESCENT
NORTHWOOD
DUBLIN 9 D09 V504
IRLANDE
Exploitant de l’autorisation de mise sur le marché
CENTRE DE SPECIALITES PHARMACEUTIQUES
76 AVENUE DU MIDI
63802 COURNON D'AUVERGNE
Via B Quaranta 12
Milano 20141
ITALIE
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Ce médicament est autorisé dans les Etats membres de l'Espace Economique Européen sous les noms suivants : Conformément à la réglementation en vigueur.
[À compléter ultérieurement par le titulaire]
La dernière date à laquelle cette notice a été révisée est :
[À compléter ultérieurement par le titulaire]
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).