Dernière mise à jour le 01/12/2025
SMOFKABIVEN E, émulsion pour perfusion
Indications thérapeutiques
SMOFKABIVEN E est une émulsion destinée à être perfusée goutte-à-goutte dans une veine (perfusion intraveineuse). Ce produit contient des acides aminés (composés utilisés par l’organisme afin de construire les protéines), du glucose (glucides), des lipides (graisses) et des sels (électrolytes) dans une poche en plastique et peut être donné à des adultes et des enfants à partir de 2 ans.
Un professionnel de santé vous administrera SMOFKABIVEN E si d'autres formes d'alimentation n'ont pas été suffisantes ou n'ont pas agi.
Composition en substances actives
-
Compartiment 1 : solution d'AA et d'électrolytes ( Composition pour 1000 ml )
- > alanine 14 g
- > arginine 12 g
- > glycine 11 g
- > histidine 3 g
- > isoleucine 5 g
- > leucine 7,4 g
- lysine6,6 g
- sous forme de : lysine (acétate de)9,3 g
- > méthionine 4,3 g
- > phénylalanine 5,1 g
- > proline 11,2 g
- > sérine 6,5 g
- > taurine 1 g
- > thréonine 4,4 g
- > tryptophane L 2 g
- > tyrosine 0,4 g
- > valine 6,2 g
- chlorure de calcium anhydre0,56 g
- sous forme de : calcium (chlorure de) dihydraté0,74 g
- sous forme de : glycérophosphate de sodium
- sous forme de : magnésium (sulfate de) heptahydraté2,47 g
- sous forme de : sodium (acétate de) trihydraté5,62 g
- sous forme de : sulfate de zinc heptahydraté0,023 g
- glucose anhydre420 g
- sous forme de : glucose monohydraté462 g
- > huile de soja raffinée 60 g
- > triglycérides à chaîne moyenne 60 g
- > huile d'olive raffinée 50 g
- > huile de poisson riche en acides oméga-3 30 g
Présentations
> 4 poche(s) à 3 compartiments (BIOFINE) poly(propylène-co-éthylène) SEBS : styrène-éthylène-butylène-styrène SIS : styrène-isoprène-styrène suremballée(s)/surpochée(s) de 986 ml
Code CIP : 392 807-9 ou 34009 392 807 9 0
Déclaration de commercialisation : 09/09/2009
Cette présentation est agréée aux collectivités
- Prix hors honoraire de dispensation : 96,83 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 97,85 €
- Taux de remboursement :65%
> 4 poche(s) à 3 compartiments (BIOFINE) poly(propylène-co-éthylène) SEBS : styrène-éthylène-butylène-styrène SIS : styrène-isoprène-styrène suremballée(s)/surpochée(s) de 1477 ml
Code CIP : 392 809-1 ou 34009 392 809 1 2
Déclaration de commercialisation : 09/09/2009
Cette présentation est agréée aux collectivités
- Prix hors honoraire de dispensation : 112,90 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 113,92 €
- Taux de remboursement :65%
> 4 poche(s) à 3 compartiments (BIOFINE) poly(propylène-co-éthylène) SEBS : styrène-éthylène-butylène-styrène SIS : styrène-isoprène-styrène suremballée(s)/surpochée(s) de 1970 ml
Code CIP : 392 812-2 ou 34009 392 812 2 3
Déclaration de commercialisation : 09/09/2009
Cette présentation est agréée aux collectivités
- Prix hors honoraire de dispensation : 123,92 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 124,94 €
- Taux de remboursement :65%
> 3 poche(s) à 3 compartiments (BIOFINE) poly(propylène-co-éthylène) SEBS : styrène-éthylène-butylène-styrène SIS : styrène-isoprène-styrène suremballée(s)/surpochée(s) de 2463 ml
Code CIP : 392 815-1 ou 34009 392 815 1 3
Déclaration de commercialisation : 09/09/2009
Cette présentation est agréée aux collectivités
> 6 poche(s) à 3 compartiments (BIOFINE) poly(propylène-co-éthylène) SEBS : styrène-éthylène-butylène-styrène SIS : styrène-isoprène-styrène suremballée(s)/surpochée(s) de 493 ml
Code CIP : 217 877-1 ou 34009 217 877 1 9
Déclaration de commercialisation : 22/04/2013
Cette présentation est agréée aux collectivités
- Prix hors honoraire de dispensation : 100,97 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 101,99 €
- Taux de remboursement :65%
Service médical rendu (SMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Important | Avis du 19/10/2016 | Renouvellement d'inscription (CT) | Le service médical rendu par SMOFKABIVEN E reste important dans l’indication de l’AMM. |
Amélioration du service médical rendu (ASMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprés de la HAS (plus d'informations dans l'aide). Les avis et synthéses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur de l'ASMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| V (Inexistant) | Avis du 05/09/2012 | Inscription (CT) | Cette spécialité n'apporte pas d'amélioration du service médical rendu (ASMR V) par rapport aux autres mélanges ternaires pour nutrition parentérale. Il s'agit d'un complément de gamme. |
| V (Inexistant) | Avis du 23/03/2011 | Inscription (CT) | Absence d'amélioration du service médical rendu (ASMR V) par rapport aux autres mélanges ternaires pour nutrition parentérale. |
| V (Inexistant) | Avis du 08/07/2009 | Inscription (CT) | Absence d'amélioration du service médical rendu (ASMR V) par rapport aux autres mélanges ternaires pour nutrition parentérale. |
ANSM - Mis à jour le : 14/02/2023
SMOFKABIVEN E, émulsion pour perfusion
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
SmofKabiven E se présente sous la forme d’une poche à trois compartiments. Chacune des poches disponibles contient les volumes suivants selon sa contenance :
|
|
493 ml |
986 ml |
1477 ml |
1970 ml |
2463 ml |
Pour 1000 ml |
|
Solution d’acides aminés |
250 ml |
500 ml |
750 ml |
1000 ml |
1250 ml |
508 ml |
|
Glucose à 42% |
149 ml |
298 ml |
446 ml |
595 ml |
744 ml |
302 ml |
|
Émulsion lipidique |
94 ml |
188 ml |
281 ml |
375 ml |
469 ml |
190 ml |
Ce qui correspond aux compositions totales suivantes :
|
Substances actives |
493 ml |
986 ml |
1477 ml |
1970 ml |
2463 ml |
Pour 1000 ml |
|
Alanine |
3,5 g |
7,0 g |
10,5 g |
14,0 g |
17,5 g |
7,1 g |
|
Arginine |
3,0 g |
6,0 g |
9,0 g |
12,0 g |
15,0 g |
6,1 g |
|
Glycine |
2,8 g |
5,5 g |
8,2 g |
11,0 g |
13,8 g |
5,6 g |
|
Histidine |
0,8 g |
1,5 g |
2,2 g |
3,0 g |
3,7 g |
1,5 g |
|
Isoleucine |
1,3 g |
2,5 g |
3,8 g |
5,0 g |
6,2 g |
2,5 g |
|
Leucine |
1,9 g |
3,7 g |
5,6 g |
7,4 g |
9,4 g |
3,8 g |
|
Lysine (sous forme d’acétate) |
1,7 g |
3,3 g |
5,0 g |
6,6 g |
8,4 g |
3,4 g |
|
Méthionine |
1,1 g |
2,2 g |
3,2 g |
4,3 g |
5,4 g |
2,2 g |
|
Phénylalanine |
1,3 g |
2,6 g |
3,8 g |
5,1 g |
6,4 g |
2,6 g |
|
Proline |
2,8 g |
5,6 g |
8,4 g |
11,2 g |
14,0 g |
5,7 g |
|
Sérine |
1,6 g |
3,2 g |
4,9 g |
6,5 g |
8,1 g |
3,3 g |
|
Taurine |
0,25 g |
0,50 g |
0,75 g |
1,0 g |
1,2 g |
0,5 g |
|
Thréonine |
1,1 g |
2,2 g |
3,3 g |
4,4 g |
5,4 g |
2,2 g |
|
Tryptophane |
0,5 g |
1,0 g |
1,5 g |
2,0 g |
2,5 g |
1,0 g |
|
Tyrosine |
0,10 g |
0,20 g |
0,30 g |
0,40 g |
0,49 g |
0,20 g |
|
Valine |
1,6 g |
3,1 g |
4,6 g |
6,2 g |
7,6 g |
3,1 g |
|
Chlorure de calcium (sous forme dihydratée) |
0,14 g |
0,28 g |
0,42 g |
0,56 g |
0,69 g |
0,28 g |
|
Glycérophosphate de sodium (sous forme hydratée) |
1,1 g |
2,1 g |
3,1 g |
4,2 g |
5,2 g |
2,1 g |
|
Sulfate de magnésium (sous forme heptahydratée) |
0,30 g |
0,60 g |
0,90 g |
1,2 g |
1,5 g |
0,61 g |
|
Chlorure de potassium |
1,1 g |
2,2 g |
3,4 g |
4,5 g |
5,7 g |
2,3 g |
|
Acétate de sodium (sous forme trihydratée) |
0,9 g |
1,7 g |
2,6 g |
3,4 g |
4,2 g |
1,7 g |
|
Sulfate de zinc (sous forme heptahydratée) |
0,0033 g |
0,0065 g |
0,0097g |
0,013 g |
0,016 g |
0,0066 g |
|
Glucose (sous forme monohydratée) |
63 g |
125 g |
187 g |
250 g |
313 g |
127 g |
|
Huile de soja raffinée |
5,6 g |
11,3 g |
16,9 g |
22,5 g |
28,1 g |
11,4 g |
|
Triglycérides à chaîne moyenne |
5,6 g |
11,3 g |
16,9 g |
22,5 g |
28,1 g |
11,4 g |
|
Huile d’olive raffinée |
4,7 g |
9,4 g |
14,1 g |
18,8 g |
23,4 g |
9,5 g |
|
Huile de poisson riche en acides gras oméga-3 |
2,8 g |
5,6 g |
8,4 g |
11,3 g |
14,0 g |
5,7 g |
Correspondant à
|
|
493 ml |
986 ml |
1477 ml |
1970 ml |
2463 ml |
Pour 1000 ml |
|
Acides aminés |
25 g |
50 g |
75 g |
100 g |
125 g |
51 g |
|
Azote |
4 g |
8 g |
12 g |
16 g |
20 g |
8 g |
|
Électrolytes |
|
|
|
|
|
|
|
· sodium |
20 mmol |
40 mmol |
60 mmol |
80 mmol |
100 mmol |
41 mmol |
|
· potassium |
15 mmol |
30 mmol |
45 mmol |
60 mmol |
74 mmol |
30 mmol |
|
· magnésium |
2,5 mmol |
5,0 mmol |
7,5 mmol |
10 mmol |
12 mmol |
5,1 mmol |
|
· calcium |
1,3 mmol |
2,5 mmol |
3,8 mmol |
5,0 mmol |
6,2 mmol |
2,5 mmol |
|
· phosphate1) |
6 mmol |
12 mmol |
19 mmol |
25 mmol |
31 mmol |
13 mmol |
|
· zinc |
0,02 mmol |
0,04 mmol |
0,06 mmol |
0,08 mmol |
0,1 mmol |
0,04 mmol |
|
· sulfate |
2,5 mmol |
5,0 mmol |
7,5 mmol |
10 mmol |
13 mmol |
5,1 mmol |
|
· chlorure |
18 mmol |
35 mmol |
52 mmol |
70 mmol |
89 mmol |
36 mmol |
|
· acétate |
52 mmol |
104 mmol |
157 mmol |
209 mmol |
261 mmol |
106 mmol |
|
Glucides |
|
|
|
|
|
|
|
· Glucose (anhydre) |
63 g |
125 g |
187 g |
250 g |
313 g |
127 g |
|
Lipides |
19 g |
38 g |
56 g |
75 g |
94 g |
38 g |
|
Apport calorique |
|
|
|
|
|
|
|
· total (environ) |
550 kcal 2,3 MJ |
1100 kcal 4,6 MJ |
1600 kcal 6,7 MJ |
2200 kcal 9,2 MJ |
2700 kcal 11,3 MJ |
1100 kcal 4,6 MJ |
|
· non-protéique (environ) |
450 kcal 1,9 MJ |
900 kcal 3,8 MJ |
1300 kcal 5,4 MJ |
1800 kcal 7,5 MJ |
2200 kcal 9,2 MJ |
900 kcal 3,8 MJ |
1) Apporté par l’émulsion lipidique et la solution d'acides aminés.
Pour la liste complète des excipients, voir rubrique 6.1.
Les solutions de glucose et d’acides d’aminés sont limpides, incolores à légèrement jaunes et dépourvues de particules. L’émulsion lipidique est blanche et homogène.
Osmolalité : environ 1800 mosmol/kg d’eau
Osmolarité : environ 1500 mosmol/l
pH (après mélange) : environ 5,6
4.1. Indications thérapeutiques
4.2. Posologie et mode d'administration
L’aspect du produit après le mélange des 3 compartiments est une émulsion blanche.
La capacité du patient à éliminer les lipides et à métaboliser l’azote et le glucose, ainsi que ses besoins nutritionnels doivent déterminer la posologie et le débit de perfusion (voir rubrique 4.4).
La posologie est individuelle et doit être adaptée en fonction de l’état clinique du patient, de son poids, de ses besoins nutritionnels et énergétiques et être ajustée selon les apports oraux ou entéraux.
Les besoins azotés pour le maintien de la masse protéique de l’organisme dépendent de l’état du patient (par exemple état nutritionnel et degré de stress catabolique ou d’anabolisme).
Adultes
Les besoins sont de 0,6 à 0,9 g d’acides aminés/kg/jour (0,10 à 0,15 g d’azote/kg/jour) quand l’état nutritionnel est normal ou en présence d'un léger stress catabolique. Chez les patients en état de stress métabolique modéré à élevé avec ou sans malnutrition, les besoins sont de l'ordre de 0,9 à 1,6 g d’acides aminés/kg/jour (0,15 à 0,25 g d’azote/kg/jour). Les besoins azotés peuvent même être plus importants dans certaines situations très particulières (par exemple brûlures ou anabolisme important).
Posologie
La posologie est de 13 à 31 ml de SMOFKABIVEN E /kg/jour ce qui correspond à 0,6 à 1,6 g d’acides aminés/kg/jour (0,10 à 0,25 g d’azote/kg/jour) et 14 à 35 kcal/kg/jour d’énergie totale (12 à 27 kcal/kg/jour d’énergie non-protéique). Ces apports couvrent les besoins de la majorité des patients. Chez les patients obèses, la dose doit être déterminée en fonction du poids idéal estimé.
Débit de perfusion
Le débit maximal de perfusion est de 0,25 g/kg/h pour le glucose, 0,1 g/kg/h pour les acides aminés et 0,15 g/kg/h pour les lipides.
Le débit de perfusion ne doit pas excéder 2,0 ml/kg/heure (correspondant à 0,10 g d’acides aminés, 0,25 g de glucose, et 0,08 g de lipides/kg/h). La durée recommandée de perfusion est de 14 à 24 heures.
Posologie maximale journalière
La posologie maximale journalière varie en fonction de l’état clinique du patient et peut même changer d’un jour à l’autre. La posologie maximale journalière recommandée est de 35 ml/kg/jour.
La dose maximale quotidienne recommandée de 35 ml/kg/jour apporte 1,8 g d’acides aminés/kg/jour (correspondant à 0,28 g d’azote/kg/jour), 4,5 g de glucose/kg/jour, 1,33 g de lipides/kg/jour et une énergie totale de 39 kcal/kg/jour (correspondant à 31 kcal/kg/jour d’énergie non-protéique).
Population pédiatrique
Enfants (de 2 à 11 ans)
Posologie
La dose, pouvant aller jusqu’à 35 ml/kg/jour, doit être régulièrement ajustée en fonction des besoins de l’enfant qui varient davantage que ceux des adultes.
Débit de perfusion
Le débit de perfusion maximal recommandé est de 2,4 ml/kg/h (correspondant à 0,12 g d’acides aminés/kg/h, 0,30 g de glucose/kg/h et 0,09 g de lipides/kg/h). A ce débit maximal de perfusion, l’administration ne doit pas durer plus de 14 heures et 30 minutes, sauf dans des cas exceptionnels sous surveillance particulière.
La durée recommandée de perfusion est de 12 à 24 heures.
Posologie maximale journalière
La posologie maximale journalière varie en fonction de l’état clinique du patient et peut même changer d’un jour à l’autre. La posologie maximale journalière recommandée est de 35 ml/kg/jour.
La dose maximale quotidienne recommandée de 35 ml/kg/jour apporte 1,8 g d’acides aminés/kg/jour (correspondant à 0,28 g d’azote/kg/jour) 4,5 g de glucose/kg/jour, 1,33 g de lipides/kg/jour et une énergie totale de 39 kcal/kg/jour (correspondant à 31 kcal/kg/jour d’énergie non-protéique).
Adolescents (de 12 à 18 ans)
Pour les adolescents, SMOFKABIVEN E peut être utilisé comme chez les adultes.
Mode d’administration
En perfusion intraveineuse par voie centrale.
Les cinq présentations de SMOFKABIVEN E sont destinées aux patients dont les besoins nutritionnels sont élevés, modérément augmentés ou de base. Pour apporter une nutrition parentérale complète, des oligo-éléments, des vitamines et éventuellement des électrolytes (en prenant en compte les électrolytes déjà contenus dans SMOFKABIVEN E) doivent être ajoutés à SMOFKABIVEN E en fonction des besoins du patient
Pour les instructions concernant la reconstitution du médicament avant administration, voir la rubrique 6.6.
· Hyperlipidémie sévère
· Insuffisance hépatique sévère
· Troubles sévères de la coagulation sanguine
· Anomalies congénitales du métabolisme des acides aminés
· Insuffisance rénale sévère sans possibilité d’hémofiltration ou de dialyse
· Choc aigu
· Hyperglycémie non-contrôlée
· Taux sérique pathologiquement élevé de l’un des électrolytes contenus dans SMOFKABIVEN E
· Contre-indications générales d’un traitement par perfusion : œdème pulmonaire aigu, hyperhydratation et insuffisance cardiaque décompensée
· Syndrome hémophagocytaire
· État instable (par exemple état post-traumatique sévère, diabète décompensé, phase aiguë d’infarctus du myocarde, accident vasculaire cérébral, embolie, acidose métabolique, sepsis sévère, déshydratation hypotonique et coma hyperosmolaire).
· Nourrissons et enfants de moins de 2 ans
4.4. Mises en garde spéciales et précautions d'emploi
SMOFKABIVEN E doit être administré avec prudence en cas d’altération du métabolisme des lipides, qui peut survenir chez un patient présentant une insuffisance rénale, un diabète, une pancréatite, une altération de la fonction hépatique, une hypothyroïdie ou un sepsis.
Ce médicament contient de l’huile de graine de soja, de l’huile de poisson et des phospholipides d’œuf, ce qui peut provoquer dans de rares cas des réactions allergiques. Des réactions d’allergie croisées ont été observées entre le soja et l’arachide.
Afin d’éviter les risques liés à une perfusion trop rapide, il est recommandé de réaliser une perfusion continue et bien contrôlée, si possible au moyen d’une pompe volumétrique.
Les troubles de l’équilibre hydroélectrolytique (par exemple taux sériques anormalement élevés ou bas des électrolytes) doivent être corrigés avant le début de la perfusion.
SMOFKABIVEN E doit être administré avec prudence chez les patients présentant une tendance à la rétention d’électrolytes. Une surveillance clinique particulière est nécessaire au début de toute perfusion intraveineuse. La perfusion doit être arrêtée en cas de signe anormal.
En raison de l’accroissement du risque d’infection associé à l'utilisation d'une veine centrale, des précautions strictes d'asepsie doivent être prises afin d'éviter toute contamination pendant l'insertion et la manipulation du cathéter.
Il est également nécessaire de surveiller la glycémie, l’ionogramme et l’osmolarité ainsi que le bilan liquidien, l’équilibre acido-basique et les explorations fonctionnelles hépatiques.
La formule sanguine et la coagulation doivent être surveillées quand des lipides sont administrés pendant une longue durée.
Les apports en phosphate et en potassium doivent être soigneusement contrôlés chez les insuffisants rénaux afin de prévenir une hyperphosphatémie et une hyperkaliémie.
La quantité de chacun des électrolytes à ajouter dépend de l’état clinique du patient et des résultats d’un contrôle fréquent des taux sériques.
La nutrition parentérale doit être réalisée avec prudence en cas d'acidose lactique, d'oxygénation cellulaire insuffisante ou d'augmentation de l'osmolarité sérique.
Tout signe ou symptôme de réaction anaphylactique (notamment fièvre, frissons, éruption ou dyspnée) doit entraîner l’arrêt immédiat de la perfusion.
En raison de sa teneur en lipides, SMOFKABIVEN E peut interférer avec certains examens biologiques (notamment bilirubine, lactate déshydrogénase, saturation en oxygène, hémoglobinémie) si le sang est prélevé avant que les lipides administrés aient été éliminés de façon adéquate de la circulation sanguine. Les lipides sont éliminés après une période sans apport de lipides de 5 à 6 h chez la plupart des patients.
Une perfusion intraveineuse d’acides aminés s’accompagne d’une augmentation de l’excrétion urinaire d’oligo-éléments, notamment de cuivre et de zinc. Cela doit être pris en compte pour la détermination de la dose d’oligo-éléments, notamment au cours d'une nutrition intraveineuse de longue durée. La teneur en zinc contenue dans SMOFKABIVEN E doit être prise en compte.
Chez les patients dénutris, l’instauration d’une nutrition parentérale peut précipiter des déséquilibres liquidiens entraînant un œdème pulmonaire et une insuffisance cardiaque congestive ainsi qu’une diminution de la concentration sérique du potassium, du phosphore, du magnésium et des vitamines hydrosolubles. Ces modifications peuvent apparaître en 24 à 48 heures, et une instauration prudente et lente de la nutrition parentérale est donc recommandée chez ces patients, ainsi qu’une surveillance étroite et une adaptation adéquate des liquides, électrolytes, minéraux et vitamines.
SMOFKABIVEN E ne doit pas être administré en même temps que du sang dans le même dispositif de perfusion en raison d’un risque de pseudoagglutination.
Une administration d’insuline peut être nécessaire chez les patients hyperglycémiques
Population pédiatrique
En raison de la composition de la solution d’acides aminés de SMOFKABIVEN E, celui-ci ne doit pas être administré chez le nouveau-né et l’enfant de moins de deux ans. Il n’existe pas d’expérience clinique de l’utilisation de SMOFKABIVEN E chez l’enfant âgé de 2 à 18 ans.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
L’héparine administrée à dose clinique peut induire une libération transitoire de lipoprotéine lipase dans la circulation. Il peut en résulter une augmentation initiale de la lipolyse plasmatique suivie d’une diminution transitoire de l’élimination des triglycérides.
L’huile de graines de soja contient naturellement de la vitamine K1. La concentration de cette vitamine dans SMOFKABIVEN E est cependant si faible qu’elle ne devrait pas significativement influencer le processus de la coagulation chez les patients traités par un dérivé coumarinique.
4.6. Fertilité, grossesse et allaitement
Il n’existe pas de donnée concernant l’exposition de femmes enceintes ou qui allaitent à SMOFKABIVEN E. Aucune étude de toxicité pour la reproduction chez l’animal n’est disponible. La nutrition parentérale peut devenir nécessaire au cours de la grossesse et de l’allaitement. SMOFKABIVEN E ne doit être administré à une femme enceinte ou qui allaite qu’après une étude approfondie de la situation.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
|
|
Fréquent ≥ 1/100 à < 1/10 |
Peu fréquent ≥ 1/1 000 à < 1/100 |
Rare ≥ 1/10 000 à < 1/1 000 |
|
Affections cardiaques |
|
|
Tachycardie |
|
Affections respiratoires, thoraciques et médiastinales |
|
|
Dyspnée |
|
Affections gastro-intestinales |
|
Perte d’appétit, nausées, vomissements |
|
|
Troubles du métabolisme et de la nutrition |
|
Taux plasmatiques élevés d'enzymes hépatiques |
|
|
Affections vasculaires |
|
|
Hypotension, hypertension |
|
Troubles généraux et anomalies au site d’administration |
Légère augmentation de la température corporelle |
Frissons, sensations vertigineuses, céphalées |
Réactions d’hypersensibilité (ex. réactions anaphylactiques ou anaphylactoïdes, éruption cutanée, urticaire, bouffées vasomotrices, céphalées), sensation de chaleur ou de froid, pâleur, cyanose, douleurs cervicales, dorsales, osseuses, thoraciques et lombaires. |
En cas de survenue de l’un de ces effets indésirables au cours de la perfusion de SMOFKABIVEN E, celle-ci doit être interrompue ou, si nécessaire, poursuivie à une dose plus faible.
Syndrome de surcharge graisseuse
Une altération de la capacité à éliminer les triglycérides peut aboutir à un syndrome de surcharge graisseuse, qui peut être dû à un surdosage. Des signes de surcharge métabolique doivent être recherchés. La cause peut être génétique (différences métaboliques interindividuelles), ou le métabolisme lipidique peut être altéré par une affection en cours ou antérieure. Ce syndrome peut également apparaître au cours d'une hypertriglycéridémie sévère, même au débit de perfusion recommandé, et en association à une modification subite de l’état clinique du patient, par exemple une altération de la fonction rénale ou une infection. Le syndrome de surcharge graisseuse se caractérise par les manifestations suivantes : hyperlipémie, fièvre, infiltration graisseuse, hépatomégalie avec ou sans ictère, splénomégalie, anémie, leucopénie, thrombocytopénie, troubles de la coagulation, hémolyse et réticulocytose, anomalies des explorations fonctionnelles hépatiques et coma. Ces troubles disparaissent habituellement à l’arrêt de la perfusion de l'émulsion lipidique.
Perfusion excessive d’acides aminés
Comme avec les autres solutions d’acides aminés, le contenu en acides aminés de SMOFKABIVEN E peut induire des effets indésirables si le débit de perfusion excède celui recommandé. Ces effets sont des nausées, des vomissements, des frissons et une sudation. Une perfusion d'acides aminés peut également induire une augmentation de la température corporelle. Un accroissement du taux de métabolites azotés (par exemple créatinine, urée) peut survenir en cas d’altération de la fonction rénale.
Perfusion excessive de glucose
Une hyperglycémie survient en cas de dépassement des capacités d'élimination du glucose du patient.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr.
Voir rubrique 4.8, « Syndrome de surcharge graisseuse », « Perfusion excessive d’acides aminés » et « Perfusion excessive de glucose ».
La perfusion doit être ralentie ou arrêtée en cas de manifestation de surdosage en lipides ou en acides aminés. Il n’existe aucun antidote spécifique du surdosage. La prise en charge d'urgence doit reposer sur des mesures générales de soutien, avec une surveillance particulière de la fonction respiratoire et du système cardiovasculaire. Une surveillance étroite des paramètres biochimiques est indispensable et les anomalies constatées doivent être traitées de façon adéquate.
Si une hyperglycémie survient, elle doit être traitée en fonction de l’état clinique du patient par administration appropriée d’insuline et/ou adaptation du taux de perfusion.
De plus, un surdosage peut être à l'origine d'une surcharge liquidienne, de déséquilibres électrolytiques et d'une hyperosmolalité.
Dans certains cas rares et graves, une hémodialyse, une hémofiltration ou une hémodiafiltration peuvent être envisagées.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : solutions pour nutrition parentérale, code ATC : B05BA10.
Émulsion lipidique
L’émulsion lipidique de SMOFKABIVEN E se compose de SMOFLIPID. La taille des particules et les propriétés biologiques sont similaires à celles des chylomicrons endogènes. Les composants de SMOFLIPID (huile de graines de soja, triglycérides à chaîne moyenne, huile d’olive et huile de poisson) possèdent leurs propres propriétés pharmacodynamiques, à l’exception de leur teneur en énergie.
L’huile de graine de soja est riche en acides gras essentiels. L’acide linoléique (acide gras oméga-6) est le plus abondant (environ 55 à 60%). L’acide alpha-linolénique (acide gras oméga-3) représente environ 8% de ces acides gras. Ce constituant du produit apporte la quantité nécessaire en acide gras essentiels.
Les acides gras à chaîne moyenne sont rapidement oxydés et apportent à l'organisme de l'énergie sous forme immédiatement disponible.
L’huile d’olive apporte de l’énergie sous la forme d’acides gras mono-insaturés, qui sont beaucoup moins sujets à une peroxydation que la quantité correspondante d’acides gras poly-insaturés.
L’huile de poisson se caractérise par sa teneur élevée en acide eicosapentaénoïque (EPA) et en acide docosahexaénoïque (DHA). Le DHA est une composante structurelle importante des membranes cellulaires, tandis que l’EPA est un précurseur d'eicosanoïdes tels que les prostaglandines, les thromboxanes et les leucotriènes.
Deux études cliniques ont été réalisées sur des patients recevant une nutrition parentérale à domicile au long cours. Leur objectif principal était de démontrer la bonne tolérance du traitement. L’efficacité était l’objectif secondaire de l’une des études portant sur la population pédiatrique. Cette étude divisait la population pédiatrique en 2 groupes : de 1 mois à moins de 2 ans et de 2 à 11 ans. Ces 2 études montrent que la tolérance de SMOFLIPID est la même que celle du comparateur (Intralipide 20 %). L’efficacité dans une population pédiatrique a été évaluée par la recherche d’une augmentation du poids, une mesure de l’indice de masse corporelle, les taux de pré-albuminémie et de RBP plasmatique ainsi que par le profil en acide gras. Après 4 semaines de traitement, aucune différence n’a été observée entre ces deux groupes à l’exception du profil en acide gras. Une augmentation des acides gras oméga 3 dans les lipoprotéines plasmatiques et dans les phospholipides des globules rouges, reflet de la composition de l’émulsion lipidique perfusée, a été observée chez les patients recevant SMOFLIPID.
Acides aminés et électrolytes
Les acides aminés, constituants des protéines de l’alimentation habituelle, sont utilisés pour la synthèse du tissu protéique, et leur éventuel excédent est dirigé vers diverses voies métaboliques. Des études ont montré qu’une perfusion d’acides aminés exerçait un effet thermogène.
Glucose
Le glucose ne devrait exercer aucun effet pharmacodynamique, à l’exception de sa contribution au maintien ou à la restauration d’un état nutritionnel normal.
5.2. Propriétés pharmacocinétiques
Les taux d’élimination de chacun des triglycérides présents dans SMOFLIPID sont différents, mais SMOFLIPID, à titre de mélange, est éliminé plus rapidement que les triglycérides à chaîne longue (TCL). Sur l'ensemble des composants, le taux d'élimination le plus lent est celui de l'huile d'olive (légèrement plus lent que celui des TCL), le plus rapide étant celui des triglycérides à chaîne moyenne (TCM). Le taux d’élimination de l’huile de poisson mélangée à des TCL est identique à celui des TCL seuls.
Acides aminés et électrolytes
Les propriétés pharmacocinétiques des acides aminés et des électrolytes perfusés ou apportés par l’alimentation habituelle sont quasiment identiques. Cependant, les acides aminés provenant des protéines alimentaires passent tout d’abord par la veine porte puis dans la circulation systémique, tandis que les acides aminés perfusés passent directement dans la circulation systémique.
Glucose
Les propriétés pharmacocinétiques du glucose perfusé ou apporté par l’alimentation habituelle sont quasiment identiques.
5.3. Données de sécurité préclinique
Une étude chez le cobaye (test de maximalisation) a montré qu'une émulsion d'huile de poisson possédait un potentiel modéré de sensibilisation cutanée. Une étude de l’antigénicité systémique n’a révélé aucun signe de potentiel anaphylactique de l’huile de poisson.
Une inflammation transitoire légère a été observée après administration intra-artérielle, paraveineuse ou sous-cutanée lors d’une étude de la tolérance locale avec SMOFLIPID chez le lapin. Une inflammation transitoire modérée et une nécrose tissulaire ont été observées chez certains animaux, après administration intramusculaire.
Ce médicament ne peut être mélangé qu'avec des solutions nutritionnelles dont la compatibilité a été documentée, voir section 6.6.
2 ans
Durée de conservation après mélange des compartiments
La stabilité physico-chimique dans la poche à trois compartiments après mélange a été démontrée pendant 48 heures à 20-25°C. Toutefois du point de vue microbiologique, le produit doit être utilisé immédiatement. En cas d’utilisation non-immédiate, les durées et conditions de conservation avant utilisation relèvent de la seule responsabilité de l’utilisateur et ne devraient pas dépasser 24 heures à une température comprise entre 2°C et 8°C , sauf si les mélanges ont été effectués en conditions d'asepsie dûment contrôlées et validées.
Durée de conservation après mélange avec des additifs
La stabilité physicochimique dans la poche à trois compartiments après mélange avec des additifs (voir section 6.6) a été démontrée pendant 8 jours, c'est-à-dire 6 jours à 2°-8°C suivis de 48 heures à 20-25°C, incluant la durée d'administration. Du point de vue microbiologique, le produit doit être utilisé immédiatement quand un ajout a été effectué. En cas d’utilisation non-immédiate, les durées et conditions de conservation avant administration relèvent de la seule responsabilité de l’utilisateur et ne devraient pas dépasser 24 heures à une température comprise entre 2°C et 8°C sauf si les mélanges ont été effectués en conditions d'asepsie dûment contrôlées et validées.
6.4. Précautions particulières de conservation
Pour les conditions de conservation du médicament après mélange des compartiments de la poche, voir la rubrique 6.3.
Pour les conditions de conservation du médicament après mélange avec des additifs, voir la rubrique 6.3.
6.5. Nature et contenu de l'emballage extérieur
Le conditionnement se compose d’une poche multi-compartiment et d’un suremballage. La poche est divisée en trois compartiments par des soudures pelables. Un absorbeur d’oxygène est placé entre la poche et le suremballage. Le matériau constitutif de la poche est en polymère multicouches en polymère Biofine.
Le film Biofine de la poche est en poly (propylène-co-éthylène) ; caoutchouc synthétique poly [styrène-bloc-(butylène-co-éthylène)] (SEBS) et caoutchouc synthétique poly (styrène-bloc-isoprène) SIS. Les sites de perfusion et de supplémentation sont en polypropylène et en caoutchouc synthétique poly [styrène-bloc-(butylène-co-éthylène)] (SEBS) munis de bouchons synthétiques en polyisoprène (sans latex). Le site condamné, utilisé uniquement lors de la fabrication, est en polypropylène muni d’un bouchon synthétique en polyisoprène (sans latex).
Tailles de conditionnement :
Boîte de 1 ou 6 poches de 493 ml
Boîte de 1 ou 4 poches de 986 ml
Boîte de 1 ou 4 poches de 1477 ml
Boîte de 1 ou 4 poches de 1970 ml.
Boîte de 1 ou 3 poches de 2463 ml (poche Biofine
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
Précautions particulières de manipulation
Ne pas utiliser si le conditionnement est endommagé. N’utiliser que si les solutions d'acides aminés et de glucose sont limpides et incolores ou légèrement jaunes et si l’émulsion lipidique est blanche et homogène. Les contenus des trois compartiments doivent être mélangés avant administration, et avant tout ajout par le site de supplémentation.
Après séparation des soudures pelables, la poche doit être retournée plusieurs fois afin d’assurer un mélange homogène, dépourvu de tout aspect de séparation de phase.
Compatibilité
Intervalle de compatibilité : stable pendant 8 jours, c'est-à-dire 6 jours de stockage à 2-8°C suivis de 48 heures à 20-25°C
1 inclut les quantités de tous les produits.
2 les ajouts de Glycophos peuvent être doublés avec une stabilité de 7 jours, c'est-à-dire 6 jours à 2-8°C suivis de 24 heures à 20-25°C
Pour les médicaments cités, avant de prescrire, se référer aux informations de prescription approuvées au niveau national.
La compatibilité avec d’autres additifs et la durée de conservation de divers mélanges seront communiquées sur demande.
Tout ajout doit être effectué de façon aseptique.
A usage unique exclusivement. Tout mélange restant après une perfusion doit être jeté.
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
5, PLACE DU MARIVEL
92316 SEVRES CEDEX
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 217 876 5 8 : 493 ml en poche à 3 compartiments (BIOFINE) ; boîte de 1
· 34009 217 877 1 9 : 493 ml en poche à 3 compartiments (BIOFINE) ; boîte de 6
· 34009 392 806 2 2 : 986 ml en poche à 3 compartiments (BIOFINE) ; boîte de 1
· 34009 392 807 9 0 : 986 ml en poche à 3 compartiments (BIOFINE) ; boîte de 4
· 34009 392 808 5 1 : 1477 ml en poche à 3 compartiments (BIOFINE) ; boîte de 1
· 34009 392 809 1 2 : 1477 ml en poche à 3 compartiments (BIOFINE) ; boîte de 4
· 34009 392 811 6 2 : 1970ml en poche à 3 compartiments (BIOFINE) ; boîte de 1
· 34009 392 812 2 3 : 1970 ml en poche à 3 compartiments (BIOFINE) ; boîte de 4
· 34009 392 813 9 1 : 2463 ml en poche à 3 compartiments (BIOFINE) ; boîte de 1
· 34009 392 815 1 3 : 2463 ml en poche à 3 compartiments (BIOFINE) ; boîte de 3
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Liste I.
ANSM - Mis à jour le : 14/02/2023
SMOFKABIVEN E, émulsion pour perfusion
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin, votre pharmacien ou votre infirmier/ère.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, à votre pharmacien ou à votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que SMOFKABIVEN E, émulsion pour perfusion et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d'utiliser SMOFKABIVEN E, émulsion pour perfusion ?
3. Comment utiliser SMOFKABIVEN E, émulsion pour perfusion ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver SMOFKABIVEN E, émulsion pour perfusion ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE SMOFKABIVEN E, émulsion pour perfusion ET DANS QUELS CAS EST-IL UTILISE ?
SMOFKABIVEN E est une émulsion destinée à être perfusée goutte-à-goutte dans une veine (perfusion intraveineuse). Ce produit contient des acides aminés (composés utilisés par l’organisme afin de construire les protéines), du glucose (glucides), des lipides (graisses) et des sels (électrolytes) dans une poche en plastique et peut être donné à des adultes et des enfants à partir de 2 ans.
Un professionnel de santé vous administrera SMOFKABIVEN E si d'autres formes d'alimentation n'ont pas été suffisantes ou n'ont pas agi.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER SMOFKABIVEN E, émulsion pour perfusion ?
N’utilisez jamais SMOFKABIVEN E, émulsion pour perfusion :
· si vous êtes allergique (hypersensible) aux substances actives ou à l’un des autres composants contenus dans ce médicament, mentionnés dans la rubrique 6;
· si vous êtes allergique au poisson ou à l’œuf ;
· si vous êtes allergique à l'arachide ou au soja. SMOFKABIVEN E contient de l’huile de soja ;
· si le taux de graisse dans votre sang est trop élevé (hyperlipidémie) ;
· si vous avez une maladie grave du foie ;
· si vous avez des troubles de la coagulation sanguine ;
· si votre organisme utilise mal les acides aminés ;
· si vous avez une maladie grave des reins sans possibilité de dialyse ;
· si vous êtes en état de choc aigu ;
· si vous avez trop de sucre dans votre sang (hyperglycémie) et si cette situation n’est pas contrôlée ;
· si la concentration des sels (électrolytes) inclus dans SmofKabiven E est élevée dans votre sang ;
· si vous avez du liquide dans les poumons (œdème pulmonaire aigu) ;
· si vous avez trop de liquide dans votre organisme (hyperhydratation) ;
· si vous avez une insuffisance cardiaque non traitée ;
· si vous avez une anomalie de la coagulation sanguine appelée syndrome hémophagocytaire ;
· si vous êtes dans un état instable, par exemple après un traumatisme grave ou en cas de diabète non contrôlé, de crise cardiaque aiguë, d’accident vasculaire cérébral, de caillot sanguin, d'acidose métabolique (troubles résultant d'une trop grande quantité d'acides dans le sang), d'infection grave (sepsis sévère) ou de coma ou si votre organisme ne contient pas assez de liquide (déshydratation hypotonique).
· Chez le nourrisson et l’enfant de moins de 2 ans
Avertissements et précautions
Adressez-vous à votre médecin, à votre pharmacien ou à votre infirmier/ère avant d’utiliser SMOFKABIVEN E, émulsion pour perfusion si vous avez l’un des problèmes suivants :
· troubles rénaux
· diabète
· pancréatite (inflammation du pancréas)
· troubles hépatiques
· hypothyroïdie (problèmes thyroïdiens)
· sepsis (infection grave).
Prévenez immédiatement le professionnel de santé si vous ressentez l’un des troubles suivants pendant la perfusion : fièvre, éruption, gonflement, difficulté à respirer, frissons, sueurs, nausées ou vomissements, car il peut s’agir de manifestations d’une réaction allergique ou de signes indiquant que vous avez reçu une trop grande quantité de SMOFKABIVEN E.
Votre médecin contrôlera régulièrement votre formule sanguine afin de vérifier votre fonction hépatique et les autres éléments du sang.
Enfants et adolescents
SMOFKABIVEN E ne doit pas être utilisé chez le nourrisson ni chez l’enfant de moins de deux ans. SMOFKABIVEN E peut être donné aux enfants entre 2 et 18 ans.
Autres médicaments et SMOFKABIVEN E, émulsion pour perfusion
Informez votre médecin ou pharmacien si vous utilisez, avez récemment utilisé ou pourriez utiliser tout autre médicament.
SMOFKABIVEN E, émulsion pour perfusion avec des aliments, boissons et de l’alcool
Sans objet.
Grossesse et allaitement
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin ou pharmacien avant de prendre ce médicament.
Il n’existe aucune donnée sur l’administration de SMOFKABIVEN E au cours de la grossesse ou de l’allaitement. SMOFKABIVEN E ne doit donc être administré à une femme enceinte ou qui allaite que si le médecin le juge nécessaire. L’utilisation de SMOFKABIVEN E pendant la grossesse ou l’allaitement ne doit être envisagée que sur les conseils de votre médecin.
Conduite de véhicules et utilisation de machines
Sans objet.
SMOFKABIVEN E, émulsion pour perfusion contient <{nommer le/les excipient (s)}>
Sans objet.
3. COMMENT UTILISER SMOFKABIVEN E, émulsion pour perfusion ?
Posologie
Votre médecin décidera de la dose vous convenant en fonction de votre poids et de l’état de vos fonctions.
Mode d’administration
SMOFKABIVEN E vous sera administré par un professionnel de santé.
Si vous avez utilisé plus de SMOFKABIVEN E, émulsion pour perfusion que vous n’auriez dû
Consultez immédiatement votre médecin ou votre pharmacien.
Il est peu probable que vous receviez une quantité trop élevée de SMOFKABIVEN E, car il vous sera administré par un professionnel de santé.
Si vous oubliez d’utiliser SMOFKABIVEN E, émulsion pour perfusion
Si vous arrêtez d’utiliser SMOFKABIVEN E, émulsion pour perfusion
Sans objet.
Si vous avez d’autres questions sur l’utilisation de ce médicament, demandez plus d’informations à votre médecin, à votre pharmacien ou à votre infirmier/ère.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Fréquent (plus d’un patient sur 100) : légère augmentation de la température corporelle.
Peu fréquent (moins d’un patient sur 100 mais plus d’un patient sur 1 000) : concentration sanguine (plasma) élevée de composés provenant du foie, manque d’appétit, nausées, vomissements, frissons, étourdissements et maux de tête.
Rare (moins d’un patient sur 1 000 mais plus d’un patient sur 10 000) : pression artérielle basse ou élevée, difficulté à respirer, battements rapides du cœur (tachycardie). Réactions d’hypersensibilité (pouvant se traduire par des symptômes tels que gonflement, fièvre, diminution de la pression artérielle, éruption cutanée, urticaire (plaques rouges en relief), bouffées de chaleur, maux de tête). Sensations de chaleur et de froid. Pâleur. Légère coloration bleue des lèvres et de la peau en raison d’un taux trop bas d’oxygène dans le sang. Douleurs au niveau du cou, du dos, des os, de la poitrine et des lombaires
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, à votre pharmacien ou à votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr.
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER SMOFKABIVEN E, émulsion pour perfusion ?
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur la poche et sur l’étiquette de la boîte après EXP. La date de péremption fait référence au dernier jour de ce mois.
N’utilisez pas ce médicament si vous remarquez des signes visibles de détérioration
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient SMOFKABIVEN E, émulsion pour perfusion
· Les substances actives sont (pour 1000 ml) :
Alanine.............................................................................................................................. 7,1 g
Arginine............................................................................................................................. 6,1 g
Glycine.............................................................................................................................. 5,6 g
Histidine............................................................................................................................ 1,5 g
Isoleucine.......................................................................................................................... 2,5 g
Leucine.............................................................................................................................. 3,8 g
Lysine (sous forme d’acétate)............................................................................................. 3,4 g
Méthionine......................................................................................................................... 2,2 g
Phenylalanine..................................................................................................................... 2,6 g
Proline............................................................................................................................... 5,7 g
Sérine................................................................................................................................ 3,3 g
Taurine.............................................................................................................................. 0,5 g
Thréonine........................................................................................................................... 2,2 g
Tryptophane...................................................................................................................... 1,0 g
Tyrosine........................................................................................................................... 0,20 g
Valine................................................................................................................................ 3,1 g
Chlorure de calcium (sous forme dihydratée)..................................................................... 0,28 g
Glycérophosphate de sodium (sous forme hydratée)........................................................... 2,1 g
Sulfate de magnésium (sous forme heptahydratée)............................................................. 0,61g
Chlorure de potassium....................................................................................................... 2,3 g
Acétate de sodium (sous forme trihydratée)........................................................................ 1,7 g
Sulfate de zinc (sous forme heptahydratée).................................................................... 0,0066 g
Glucose (sous forme monohydratée).................................................................................. 127 g
Huile de soja, raffinée....................................................................................................... 11,4 g
Triglycérides à chaîne moyenne......................................................................................... 11,4 g
Huile d’olive, raffinée.......................................................................................................... 9,5 g
Huile de poisson, riche en acides gras oméga-3.................................................................. 5,7 g
· Les autres composants sont :
Glycérol, phospholipides d’œuf purifiés, tout-rac-a-tocophérol, hydroxyde de sodium (pour ajustement du pH), oléate de sodium, acide acétique (pour ajustement du pH), acide chlorhydrique (pour ajustement du pH) et eau pour préparations injectables.
Qu’est-ce que SMOFKABIVEN E, émulsion pour perfusion et contenu de l’emballage extérieur
Ce médicament se présente sous forme d'une émulsion pour perfusion, Les solutions de glucose et d’acides d’aminés sont limpides, incolores ou légèrement jaunes et dépourvues de particules, L’émulsion lipidique est blanche et homogène.
Poches de 493 ml (boîte de 1 et 6) 986 ml (boîtes de 1 et 4) ; 1477 ml (boîtes de 1 et 4) ; 1970 ml (boîtes de 1 et 4) ; 2463 ml (boîtes de 1 et 3).
Toutes les présentations peuvent ne pas être commercialisées.
Titulaire de l’autorisation de mise sur le marché
5, place du Marivel
92316 Sèvres Cedex
Exploitant de l’autorisation de mise sur le marché
FRESENIUS KABI FRANCE
5, place du Marivel
92316 Sèvres Cedex
RAPSGATAN 7
751 74 UPPSALA
SuEDE
ou
FRESENIUS KABI AUSTRIA GmbH
Hafnerstrasse 36
8055 graz
Autriche
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Ce médicament est autorisé dans les Etats membres de l'Espace Economique Européen sous les noms suivants : Conformément à la réglementation en vigueur.
[À compléter ultérieurement par le titulaire]
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
< {MM/AAAA}>< {mois AAAA}.>
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).
Les informations suivantes sont destinées exclusivement aux professionnels de santé:
Mises en garde et précautions d’emploi
Afin d’éviter les risques liés à une perfusion trop rapide, il est recommandé de réaliser une perfusion continue et bien contrôlée, si possible au moyen d’une pompe volumétrique.
En raison de l’accroissement du risque d’infection associé à l'utilisation d'une veine centrale, des précautions strictes d'asepsie doivent être prises afin d'éviter toute contamination, particulièrement pendant l'insertion et la manipulation du cathéter.
Les taux sériques de glucose, d’électrolytes et l’osmolarité, de même que l’équilibre hydrique, l’équilibre acido-basique, les paramètres de la fonction hépatique et des enzymes doivent être surveillés.
Tout signe ou symptôme de réaction anaphylactique (notamment fièvre, frissons, éruption ou dyspnée) doit entraîner l’arrêt immédiat de la perfusion.
SMOFKABIVEN E ne doit pas être administré en même temps que du sang dans le même dispositif de perfusion en raison d’un risque de pseudoagglutination.
Mode d’administration
En perfusion intraveineuse par voie centrale.
Afin d’apporter une nutrition parentérale complète, des oligo-éléments, des vitamines et éventuellement des électrolytes (en prenant en compte les électrolytes déjà contenu dans SMOFKABIVEN E) doivent être ajoutés à SMOFKABIVEN E en fonction des besoins du patient.
Posologie
Adultes
La posologie est de 13 à 31 ml de SMOFKABIVEN E /kg/jour ce qui correspond à 0,6 à 1,6 g d’acides aminés/kg/jour (0,10 à 0,25 g d’azote/kg/jour) et 14 à 35 kcal/kg/jour d’énergie totale (12 à 27 kcal/kg/jour d’énergie non protéique).
Débit de perfusion
Le débit maximal de perfusion est de 0,25 g/kg/h pour le glucose, 0,1 g/kg/h pour les acides aminés et 0,15 g/kg/h pour les lipides.
Le débit de perfusion ne doit pas excéder 2,0 ml/kg/heure (correspondant à 0,10 g d’acides aminés, 0,25 g de glucose, et 0,08 g de lipides/kg/h). La durée recommandée de perfusion est de 14 à 24 heures.
Posologie maximale journalière
La posologie maximale journalière varie en fonction de l’état clinique du patient et peut même changer d’un jour à l’autre. La posologie maximale journalière recommandée est de 35 ml/kg/jour.
Population pédiatrique
Enfants (de 2 à 11 ans)
Posologie :
La dose, pouvant aller jusqu’à 35 ml/kg/jour, doit être régulièrement ajustée en fonction des besoins de l’enfant qui varient davantage que ceux des adultes.
Débit de perfusion :
Le débit de perfusion maximal recommandé est de 2,4 ml/kg/h (correspondant à 0,12 g d’acides aminés/kg/h, 0,30 g de glucose/kg/h et 0,09 g de lipides/kg/h). A ce débit maximal de perfusion, l’administration ne doit pas durer plus de 14 heures et 30 minutes, sauf dans des cas exceptionnels sous surveillance particulière.
La durée recommandée de perfusion est de 12 à 24 heures.
Posologie maximale journalière :
La posologie maximale journalière varie en fonction de l’état clinique du patient et peut même changer d’un jour à l’autre. La posologie maximale journalière recommandée est de 35 ml/kg/jour.
Adolescents (de 12 à 18 ans)
Pour les adolescents, SMOFKABIVEN peut être utilisé comme chez les adultes.
Précautions particulières d’utilisation
Ne pas utiliser si le conditionnement est endommagé,
N’utiliser que si les solutions d'acides aminés et de glucose sont limpides et incolores ou légèrement jaunes et si l’émulsion lipidique est blanche et homogène, Les contenus des trois compartiments doivent être mélangés avant l’administration, et avant tout ajout par le site de supplémentation.
Après séparation des soudures pelables, la poche doit être retournée plusieurs fois afin d’assurer un mélange homogène dépourvu de tout aspect de séparation de phase.
A usage unique exclusivement, Toute solution inutilisée restant après perfusion doit être jetée.
Compatibilité
Intervalle de compatibilité stable pendant 8 jours, c'est-à-dire 6 jours de stockage à 2-8°C suivis de 48 heures à 20-25°C
|
|
Unités |
Quantité maximale totale |
||||
|
Taille de la poche SmofKabiven |
ml |
493 |
986 |
1477 |
1970 |
2463 |
|
Additif |
|
Volume |
||||
|
Dipeptiven |
ml |
0-100 |
0 - 300 |
0 - 300 |
0 - 300 |
0 - 300 |
|
Suppliven |
ml |
0 - 10 |
0 - 10 |
0 - 10 |
0 - 10 |
0 - 10 |
|
Soluvit |
flacon |
0 - 1 |
0 - 1 |
0 - 1 |
0 - 1 |
0 - 1 |
|
Vitalipide Adultes/Enfants |
ml |
0 - 10 |
0 - 10 |
0 - 10 |
0 - 10 |
0 - 10 |
|
Electrolytes1 |
|
Quantité par poche |
||||
|
Sodium |
mmol |
≤ 75 |
≤ 150 |
≤ 225 |
≤ 300 |
≤ 375 |
|
Potassium |
mmol |
≤ 75 |
≤ 150 |
≤ 225 |
≤ 300 |
≤ 375 |
|
Calcium |
mmol |
≤ 2.5 |
≤ 5 |
≤ 7.5 |
≤ 10 |
≤ 12.5 |
|
Magnésium |
mmol |
≤ 2.5 |
≤ 5 |
≤ 7.5 |
≤ 10 |
≤ 12.5 |
|
Phosphate inorganique (Addiphos) OU Phosphate organique (Glycophos)2 |
mmol |
≤ 7.5 |
≤ 15 |
≤ 22.5 |
≤ 30 |
≤ 37.5 |
|
Zinc |
mmol |
≤ 0.1 |
≤ 0.2 |
≤ 0.25 |
≤ 0.3 |
≤ 0.35 |
|
Sélénium |
µmol |
≤ 1 |
≤ 1 |
≤ 1 |
≤ 1 |
≤ 1.15 |
1 inclut les quantités de tous les produits.
2 les ajouts de Glycophos peuvent être doublés avec une stabilité de 7 jours, c'est-à-dire 6 jours à 2-8°C suivis de 24 heures à 20-25°C
Remarque : ce tableau est destiné à indiquer la compatibilité. Il ne s'agit pas de recommandations posologiques.
Pour les médicaments cités, avant de prescrire, se référer aux informations de prescription approuvées au niveau national.
La compatibilité avec d’autres additifs et la durée de conservation de divers mélanges seront communiquées sur demande.
Les ajouts doivent être effectués de façon aseptique.
Durée de conservation après mélange des compartiments
La stabilité chimique et physique dans la poche à trois compartiments après mélange a été démontrée pendant 48 heures à 20-25°C, Pour des raisons de sécurité microbiologique, le produit doit être utilisé immédiatement, En cas d’utilisation non immédiate, la durée et les conditions de conservation avant administration relèvent de la responsabilité de l’utilisateur et ne doivent normalement pas excéder 24 heures à 2-8°C, sauf si les mélanges ont été effectués en conditions d'asepsie dûment contrôlées et validées.
Durée de conservation après mélange avec des additifs
La stabilité physicochimique dans la poche à trois compartiments après mélange avec des additifs (voir section 6.6) a été démontrée pendant 8 jours, c'est-à-dire 6 jours à 2°-8°C suivis de 48 heures à 20-25°C, incluant la durée d'administration. Pour des raisons de sécurité microbiologique, le produit doit être utilisé immédiatement quand un ajout a été effectué, En cas d’utilisation non immédiate, la durée et les conditions de conservation avant administration relèvent de la responsabilité de l’utilisateur et ne doivent normalement pas excéder 24 heures à 2-8°C, sauf si les mélanges ont été effectués en conditions d'asepsie dûment contrôlées et validées.
Instructions d’utilisation de SmofKabiven E
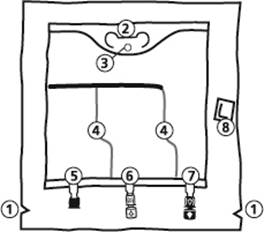
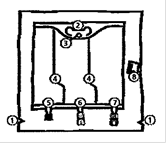
La poche BIOFINE
|
Poche de 986 ml, 1477 ml, 1970 ml, 2463 ml
|
Poche de 493 ml
|
1) Encoches pour ouverture du suremballage
2) Poignée
3) Orifice de suspension de la poche
4) Soudures pelables
5) Site condamné (utilisé uniquement lors de la fabrication)
6) Site de supplémentation
7) Site de perfusion
8) Absorbeur d’oxygène
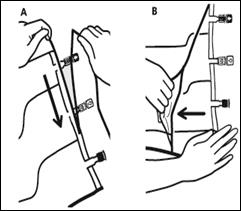
1. Retrait du suremballage
|
|
Pour retirer le suremballage, tenir la poche horizontalement et déchirer les encoches proches des sites de supplémentation et de perfusion (A). Retirer le suremballage et le jeter avec l’absorbeur d’oxygène (B). |
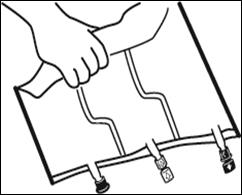
2. Reconstitution du mélange
|
|
Placer la poche sur une surface plane. |
|
|
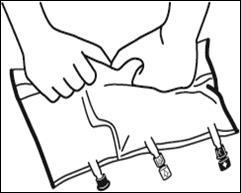
Faire rouler la poche doucement sur elle-même à partir de la poignée en direction des sites, en commençant avec la main droite et en exerçant une pression constante avec la main gauche jusqu'à rupture des soudures verticales. Les soudures verticales s’ouvrent sous la pression des fluides.
|
|
|
Le mélange peut également être effectué avant le retrait du suremballage.
Remarque : les solutions se mélangent facilement, bien que la soudure horizontale reste fermée |
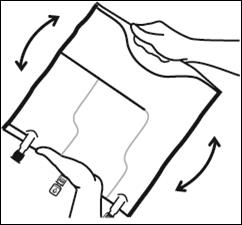
|
|
Mélanger le contenu des 3 compartiments en retournant la poche plusieurs fois de bas en haut jusqu'à ce que les solutions soient complètement mélangées. |
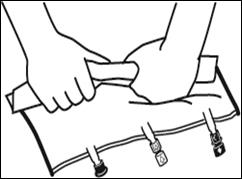
3. Supplémentation et perfusion
|
|
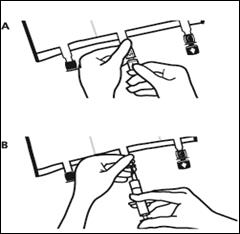
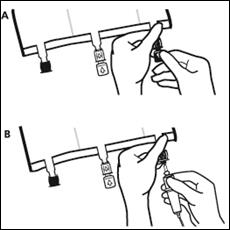
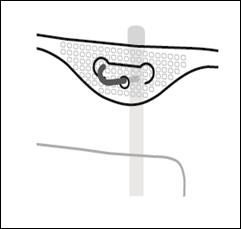
Placer la poche sur une surface plane. Juste avant d’injecter les additifs, rompre le Twist Off (flèche vers la poche) du site blanc de supplémentation (A). Remarque : la membrane à l’intérieur du site de supplémentation est stérile. · Maintenir la base du site de supplémentation. Introduire l’aiguille, injecter les additifs (dont la compatibilité a été vérifiée) au centre du site de supplémentation (B). · Homogénéiser le mélange, entre chaque supplémentation, en retournant la poche plusieurs fois. Utiliser des seringues avec des aiguilles Gauge 18-23 et de 40 mm de longueur maximum. |
|
|
· Juste avant la mise en place du perfuseur, rompre le Twist Off (flèche vers le bas) du site bleu de perfusion (A). · Remarque : la membrane à l’intérieur du site de supplémentation est stérile. · Utiliser une tubulure de perfusion sans prise d’air ou fermer la prise d’air dans le cas contraire. · Maintenir la base du site de perfusion · Percuter à l’aide du trocart le site de perfusion. Le trocart doit être complètement enfoncé pour sécuriser sa mise en place. |
Remarque : La partie intérieure du site de perfusion est stérile.
4. Suspension de la poche
|
|
Suspendre la poche par l’orifice situé sous la poignée. |