Dernière mise à jour le 01/12/2025
TRANXENE 20 mg/2 ml, lyophilisat et solution pour usage parentéral
Présentations
> 5 flacon(s) en verre brun - 5 ampoule(s) en verre de 2 ml
Code CIP : 324 301-6 ou 34009 324 301 6 1
Déclaration de commercialisation : 19/02/1982
Cette présentation est agréée aux collectivités
- Prix hors honoraire de dispensation : 12,60 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 13,62 €
- Taux de remboursement :65%
Documents de bon usage du médicament
- Quelle place pour les benzodiazépines dans l’anxiété ?
Auteur : Haute autorité de santé
Type : Fiche Bon Usage du Médicament
Date de mise à jour :Juillet 2018
- Arrêt des benzodiazépines et médicaments apparentés : démarche du médecin traitant en ambulatoire
Auteur : Haute autorité de santé
Type : Fiche mémo
Date de mise à jour :Juin 2015
Service médical rendu (SMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Insuffisant | Avis du 12/06/2024 | Réévaluation SMR | Le service médical rendu de TRANXENE (clorazépate dipotassique) 20 mg/2 mL, solution injectable, est insuffisant pour justifier d’une prise en charge par la solidarité nationale dans la prémédication à certaines explorations fonctionnelles chez l’adulte, et au regard des alternatives disponibles. |
| Faible | Avis du 03/04/2019 | Inscription (CT) | Le service médical rendu de TRANXENE 20 mg/2 ml, lyophilisat et solution pour usage parentéral est faible dans la prémédication à certaines explorations fonctionnelles. |
| Important | Avis du 03/04/2019 | Inscription (CT) | Le service médical rendu par TRANXENE 20 mg/2 ml, lyophilisat et solution pour usage parentéral est important dans les urgences neuro-psychiatriques : • crise d’angoisse paroxystique • crise d’agitation • prévention et/ou traitement du delirium tremens et des autres manifestations du sevrage alcoolique : • Prévention du delirium tremens ainsi que prévention et/ou traitement des autres manifestations du sevrage alcoolique seulement lorsque la voie orale est impossible, • Traitement du delirium tremens, en unité de soins intensifs ou de réanimation ou dans les structures disposant de tous les moyens de réanimation. |
| Faible | Avis du 29/06/2016 | Renouvellement d'inscription (CT) | Le service médical rendu de TRANXENE lyophilisat et solution pour usage parentéral reste faible dans la Prémédication à certaines explorations fonctionnelles |
| Important | Avis du 29/06/2016 | Renouvellement d'inscription (CT) | Le service médical rendu de TRANXENE lyophilisat et solution pour usage parentéral reste important dans : •Traitement symptomatique des manifestations anxieuses sévères et/ou invalidantes •Prévention et traitement du delirium tremens et des autres manifestations du sevrage alcoolique •Urgences neuro-psychiatriques •Tétanos, en unité de soins intensifs ou de réanimation ou dans les structures disposant de tous les moyens de réanimation |
Amélioration du service médical rendu (ASMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprés de la HAS (plus d'informations dans l'aide). Les avis et synthéses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur de l'ASMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| V (Inexistant) | Avis du 03/04/2019 | Inscription (CT) | Cette présentation est un complément de gamme qui n’apporte pas d’amélioration du service médical rendu (ASMR V) par rapport aux présentations déjà inscrites. |
Autres informations
- Titulaire de l'autorisation : NEURAXPHARM France
- Conditions de prescription et de délivrance :
- liste I
- prescription limitée à 12 semaines
- Statut de l'autorisation : Valide
- Type de procédure : Procédure nationale
- Code CIS : 6 241 610 5
ANSM - Mis à jour le : 22/10/2025
TRANXENE 20 mg/2 ml, lyophilisat et solution pour usage parentéral
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Lyophilisat :
Clorazépate dipotassique....................................................................................................... 20 mg
Pour un flacon
Excipient à effet notoire : Ce médicament contient 17 mg de potassium par flacon de 20 mg/2 ml de solution reconstituée.
Pour la liste complète des excipients, voir rubrique 6.1.
Lyophilisat et solution pour usage parentéral.
4.1. Indications thérapeutiques
· Urgences neuro-psychiatriques :
o crise d’angoisse paroxystique,
o crise d’agitation,
o prévention et/ou traitement du delirium tremens et des autres manifestations du sevrage alcoolique :
§ prévention du delirium tremens ainsi que prévention et/ou traitement des autres manifestations du sevrage alcoolique seulement lorsque la voie orale est impossible,
§ traitement du delirium tremens, en unité de soins intensifs ou de réanimation ou dans les structures disposant de tous les moyens de réanimation.
· Prémédication à certaines explorations fonctionnelles.
4.2. Posologie et mode d'administration
Posologie
Dans tous les cas, le traitement sera initié à la dose efficace la plus faible.
· Crise d’agitation/crise d’angoisse paroxystique : 20 à 200 mg par jour en IM ou IV puis relais par des formes orales si nécessaire.
· Prévention du delirium tremens ainsi que prévention et/ou traitement des autres manifestations du sevrage alcoolique seulement lorsque la voie orale est impossible : 50 à 100 mg sur 24 heures, si possible à la seringue électrique. Une surveillance clinique attentive est nécessaire.
· Traitement du delirium tremens, en unité de soins intensifs ou de réanimation ou dans les structures disposant de tous les moyens de réanimation : 50 à 100 mg toutes les 3 ou 4 heures, sans dépasser la dose journalière de 800 mg. Une surveillance en continu des paramètres vitaux, de la fonction respiratoire et du niveau de conscience est indispensable. En fonction de la réponse clinique, dès que possible diminuer les doses et passer à la voie orale.
· Prémédication à certaines explorations fonctionnelles : 20 à 50 mg par jour en IM ou en IV, un quart d'heure à une demi-heure avant l'examen.
· Chez le sujet âgé, l’insuffisant rénal ou l’insuffisant hépatique : il est recommandé de réduire la posologie initiale, de moitié par exemple.
Durée
Le traitement doit être aussi bref que possible.
En cas de relais par la voie orale, l'indication sera réévaluée régulièrement.
Mode d’administration
Voie intramusculaire ou intraveineuse lente ou perfusion.
En raison du risque d'apnée en cas d'injection intraveineuse rapide, l'injection intraveineuse doit être lente et faite dans une grosse veine (voir rubrique 4.8).
Les injections intramusculaires doivent être profondes.
Il est nécessaire de disposer d'un matériel de réanimation respiratoire.
Eviter les mélanges dans la même seringue.
Utiliser le solvant spécifique à cette forme pharmaceutique.
Ce médicament ne doit jamais être utilisé dans les situations suivantes :
· hypersensibilité à la substance active ou à l'un des excipients mentionnés à la rubrique 6.1,
· insuffisance respiratoire sévère,
· syndrome d'apnée du sommeil,
· insuffisance hépatique sévère, aiguë ou chronique (risque de survenue d'une encéphalopathie),
· myasthénie.
4.4. Mises en garde spéciales et précautions d'emploi
TOLERANCE PHARMACOLOGIQUE
L'effet anxiolytique des benzodiazépines et apparentés peut diminuer progressivement malgré l’utilisation de la même dose en cas d’administration durant plusieurs semaines.
DEPENDANCE
Tout traitement par les benzodiazépines et apparentés, et plus particulièrement en cas d'utilisation prolongée, peut entraîner un état de pharmacodépendance physique et psychique.
Divers facteurs semblent favoriser la survenue de la dépendance :
· durée du traitement,
· dose,
· antécédents d'autres dépendances médicamenteuses ou non, y compris alcoolique.
Une pharmacodépendance peut survenir à doses thérapeutiques et/ou chez des patients sans facteur de risque individualisé.
Cet état peut entraîner à l'arrêt du traitement un phénomène de sevrage.
Certains symptômes sont fréquents et d'apparence banale : insomnie, céphalées, anxiété importante, myalgies, tension musculaire, irritabilité.
D'autres symptômes sont plus rares : agitation voire épisode confusionnel, paresthésies des extrémités, hyperréactivité à la lumière, au bruit, et au contact physique, dépersonnalisation, déréalisation, phénomènes hallucinatoires, convulsions.
Les symptômes du sevrage peuvent se manifester dans les jours qui suivent l'arrêt du traitement. Pour les benzodiazépines à durée d’action brève, et surtout si elles sont données à doses élevées, les symptômes peuvent même se manifester dans l’intervalle qui sépare deux prises ; ceci n’a pas été observé avec le clorazépate dipotassique compte-tenu de sa longue demi-vie (voir rubrique 5.2.).
L’association de plusieurs benzodiazépines risque, quelle qu’en soit l’indication anxiolytique ou hypnotique, d’accroître le risque de pharmacodépendance.
Des cas d'abus ont également été rapportés.
PHENOMENE DE REBOND
Ce syndrome transitoire peut se manifester sous la forme d'une exacerbation de l’anxiété qui avait motivé le traitement par les benzodiazépines et apparentés.
AMNESIE ET ALTERATIONS DES FONCTIONS PSYCHOMOTRICES
Une amnésie antérograde ainsi que des altérations des fonctions psychomotrices sont susceptibles d'apparaître dans les heures qui suivent la prise.
TROUBLES DU COMPORTEMENT ET TROUBLES PARADOXAUX
Chez certains sujets, les benzodiazépines et produits apparentés peuvent entraîner un syndrome associant à des degrés divers une altération de l'état de conscience et des troubles du comportement et de la mémoire.
Peuvent être observés :
· aggravation de l'insomnie, cauchemars, agitation, nervosité,
· idées délirantes, hallucinations, état confuso-onirique, symptômes de type psychotique,
· désinhibition avec impulsivité, colère,
· euphorie, irritabilité,
· amnésie antérograde,
· suggestibilité.
Ce syndrome peut s'accompagner de troubles potentiellement dangereux pour le patient ou pour autrui, à type de :
· comportement inhabituel pour le patient,
· comportement auto- ou hétéro-agressif, notamment si l'entourage tente d'entraver l'activité du patient,
· conduites automatiques avec amnésie post-événementielle.
Ces manifestations imposent l'arrêt du traitement. Elles sont plus fréquemment observées chez les enfants et les sujets âgés.
RISQUE D’ACCUMULATION
Les benzodiazépines et apparentés (comme tous les médicaments) persistent dans l'organisme pour une période de l'ordre de 5 demi-vies (voir rubrique 5.2).
Chez des personnes âgées ou souffrant d'insuffisance rénale ou hépatique, la demi-vie peut s'allonger considérablement. Lors de prises répétées, le médicament ou ses métabolites atteignent le plateau d'équilibre beaucoup plus tard et à un niveau beaucoup plus élevé. Ce n'est qu'après l'obtention d'un plateau d'équilibre qu'il est possible d'évaluer à la fois l'efficacité et la sécurité du médicament.
Une adaptation posologique peut être nécessaire (voir rubrique 4.2).
RISQUE D’UTILISATION CONCOMITANTE DES BENZODIAZEPINES AVEC LES OPIOÏDES
L’utilisation concomitante de benzodiazépines, y compris le clorazépate dipotassique, et d’opioïdes peut entrainer une sédation, une dépression respiratoire, un coma et un décès. En raison de ces risques, la prescription concomitante d’opioïdes et de benzodiazépines doit être réservée aux patients pour lesquels les alternatives thérapeutiques sont inadéquates.
Si la décision est prise de prescrire de façon concomitante du clorazépate dipotassique et des opioïdes, la dose efficace la plus faible doit être prescrite pour une durée la plus courte possible et le patient doit être étroitement suivi pour tout signe et symptôme de dépression respiratoire et de sédation (voir rubrique 4.5).
SUJET AGE
Les benzodiazépines et produits apparentés doivent être utilisés avec prudence chez le sujet âgé, en raison du risque de sédation, de sensations ébrieuses et/ou d’effet myorelaxant qui peuvent favoriser les chutes, avec des conséquences souvent graves dans cette population. Une diminution de la posologie est recommandée.
Précautions d'emploi
Ce médicament contient moins de 1 mmol (39 mg) de potassium par flacon de 20 mg/2mL de solution reconstituée, c’est-à-dire qu’il est essentiellement « sans potassium ».
Néanmoins, ce médicament contenant 17 mg de potassium par flacon de 20 mg/2 ml de solution reconstituée, il est à prendre en compte chez les patients insuffisants rénaux ou chez les patients contrôlant leur apport alimentaire en potassium, pour des doses supérieures à 40 mg de solution reconstituée.
Du fait de sa concentration en potassium, ce médicament peut causer des douleurs au site d’injection.
La plus grande prudence est recommandée en cas d'antécédents d'alcoolisme ou d'autres dépendances, médicamenteuses ou non (voir rubrique 4.5.)
IDEE SUICIDAIRE/TENTATIVE DE SUICIDE/SUICIDE ET DEPRESSION
Certaines études épidémiologiques montrent une augmentation de l’incidence des idées suicidaires, des tentatives de suicide et des suicides chez les patients dépressifs ou non, et traités par des benzodiazépines et autres hypnotiques, y compris le clorazépate dipotassique. Cependant, le lien de causalité n’a pas été établi.
CHEZ LE SUJET PRESENTANT UN EPISODE DEPRESSIF MAJEUR OU UNE ANXIETE ASSOCIEE A UNE DEPRESSION
Les benzodiazépines et apparentés ne doivent pas être prescrits seuls car ils laissent la dépression évoluer pour son propre compte avec persistance ou majoration du risque suicidaire.
MODALITES D’ARRET PROGRESSIF DU TRAITEMENT
Elles doivent être énoncées au patient de façon précise.
Outre la nécessité de décroissance progressive des doses, les patients devront être avertis de la possibilité d'un phénomène de rebond, afin de minimiser l'anxiété qui pourrait découler des symptômes liés à cette interruption, même progressive.
Le patient doit être prévenu du caractère éventuellement inconfortable de cette phase.
SUJET AGE, INSUFFISANT RENAL OU HEPATIQUE
Le risque d’accumulation conduit à réduire la posologie, de moitié par exemple (cf. Mises en garde).
INSUFFISANT RESPIRATOIRE
Chez l'insuffisant respiratoire, il convient de prendre en compte l'effet dépresseur des benzodiazépines et apparentés (d'autant que l'anxiété et l'agitation peuvent constituer des signes d'appel d'une décompensation de la fonction respiratoire qui justifie le passage en unité de soins intensifs).
La prise d’alcool ou de produits en contenant est déconseillée (voir rubrique 4.5).
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
+ Alcool (boisson ou excipient)
Majoration par l'alcool de l'effet sédatif de ces substances. L'altération de la vigilance peut rendre dangereuses la conduite de véhicules et l'utilisation de machines.
Eviter la prise de boissons alcoolisées et de médicaments contenant de l'alcool.
+ Oxybate de sodium
Majoration de la dépression centrale. L’altération de la vigilance peut rendre dangereuses la conduite de véhicules et l’utilisation de machines.
Associations à prendre en compte
+ Autres médicaments sédatifs : dérivés morphiniques (analgésiques, antitussifs et traitements de substitution) ; neuroleptiques ; barbituriques ; autres benzodiazépines ; anxiolytiques autres que les benzodiazépines (par exemple méprobamate) ; hypnotiques ; antidépresseurs sédatifs (amitriptyline, doxépine, miansérine, mirtazapine, trimipramine) ; antihistaminiques H1 sédatifs ; antihypertenseurs centraux ; baclofène ; thalidomide.
Majoration de la dépression centrale. L'altération de la vigilance peut rendre dangereuses la conduite de véhicules et l'utilisation de machines.
+ Opioïdes
L’utilisation concomitante de benzodiazépines et d’opioïdes augmente le risque de sédation, de dépression respiratoire, de coma et de décès en raison de l’addition des effets dépresseurs du système nerveux central. Les doses et la durée du traitement concomitant par des benzodiazépines et des opioïdes doivent être limitées (voir rubrique 4.4).
+ Barbituriques
Risque majoré de sédation et de dépression respiratoire pouvant entraîner coma et décès, notamment chez le sujet âgé. Il convient de limiter autant que possible les doses et la durée de l’association.
+ Buprénorphine
Avec la buprénorphine utilisée en traitement de substitution : risque majoré de dépression respiratoire, pouvant être fatale.
Evaluer attentivement le rapport bénéfice/risque de cette association. Informer le patient de la nécessité de respecter les doses prescrites.
+ Clozapine
Risque accru de collapsus avec arrêt respiratoire et/ou cardiaque.
+ Morphiniques
Risque majoré de sédation et de dépression respiratoire pouvant entraîner coma et décès, notamment chez le sujet âgé. Il convient de limiter autant que possible les doses et la durée de l’association.
4.6. Fertilité, grossesse et allaitement
Grossesse
De nombreuses données issues d’études de cohorte n’ont pas mis en évidence la survenue d’effets malformatifs lors d’une exposition aux benzodiazépines au cours du 1er trimestre de la grossesse. Cependant, dans certaines études épidémiologiques cas-témoins, une augmentation de la survenue de fentes labio-palatines a été observée avec les benzodiazépines. Selon ces données, l’incidence des fentes labio-palatines chez les nouveau-nés serait inférieure à 2/1000 après exposition aux benzodiazépines au cours de la grossesse alors que le taux attendu dans la population générale est de 1/1000.
En cas de prise de benzodiazépines à fortes doses aux 2ème et/ou 3ème trimestres de grossesse une diminution des mouvements actifs fœtaux et une variabilité du rythme cardiaque fœtal ont été décrits. Un traitement en fin de grossesse par benzodiazépines même à faibles doses, peut être responsable chez le nouveau-né de signes d'imprégnation tels qu'hypotonie axiale, troubles de la succion entraînant une faible prise de poids. Ces signes sont réversibles, mais peuvent durer 1 à 3 semaines en fonction de la demi-vie de la benzodiazépine prescrite. A doses élevées, une dépression respiratoire ou des apnées, et une hypothermie peuvent apparaître chez le nouveau-né. Par ailleurs, un syndrome de sevrage néo-natal est possible, même en l'absence de signes d'imprégnation. Il est caractérisé notamment par une hyperexcitabilité, une agitation et des trémulations du nouveau-né survenant à distance de l'accouchement. Le délai de survenue dépend de la demi-vie d'élimination du médicament et peut être important quand celle-ci est longue.
Compte tenu de ces données, par mesure de prudence, l'utilisation de clorazépate est déconseillée au cours de la grossesse quel qu'en soit le terme.
En cas de prescription de clorazépate à une femme en âge de procréer, celle-ci devrait être avertie de la nécessité de contacter son médecin si une grossesse est envisagée ou débutée afin qu’il réévalue l’intérêt du traitement.
En fin de grossesse, s'il s'avère réellement nécessaire d'instaurer un traitement par clorazépate, éviter de prescrire des doses élevées et tenir compte, pour la surveillance du nouveau-né, des effets précédemment décrits.
Allaitement
L'utilisation de ce médicament pendant l’allaitement est déconseillée.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
L'association avec d'autres médicaments sédatifs doit être déconseillée ou prise en compte en cas de conduite automobile ou d'utilisation de machines (voir rubrique 4.5).
Si la durée de sommeil est insuffisante, le risque d’altération de la vigilance est encore accru.
Les effets indésirables sont classés par fréquence d’apparition en utilisant la règle suivante : très fréquent (≥ 1/10), fréquent (≥ 1/100 à < 1/10), peu fréquent (≥ 1/1000 à < 1/100), rare (≥ 1/10 000 à < 1/1000), très rare (< 1/10 000), indéterminée (ne peut être estimée sur la base des données disponibles).
Ils sont en rapport avec la dose ingérée et la sensibilité individuelle du patient.
Affections psychiatriques
· Fréquent : dépendance physique et psychique, même à doses thérapeutiques avec syndrome de sevrage ou de rebond à l'arrêt du traitement.
· Peu fréquent : agitation, irritabilité, confusion, modifications de la libido.
· Indéterminée :
o troubles du comportement et troubles paradoxaux, modifications de la conscience, agressivité, hallucinations, état confuso-onirique.
o insomnie, cauchemars, tension.
Affections du système nerveux
· Très fréquent : baisse de vigilance voire somnolence (particulièrement chez le sujet âgé).
· Fréquent : sensations ébrieuses.
· Peu fréquent : hypotonie musculaire, troubles de l’attention.
· Indéterminée :
o troubles cognitifs tels que troubles de la mémoire (amnésie antérograde), qui peuvent survenir aux doses thérapeutiques, le risque augmentant proportionnellement à la dose, troubles de la parole.
o céphalées, ataxie.
Affections de la peau et du tissu sous-cutané
· Peu fréquent : éruptions cutanées, prurigineuses ou non.
Troubles généraux et anomalies au site d’administration
· Fréquent : asthénie.
· Indéterminée :
o chute, risque d'apnée en cas d'injection intraveineuse rapide.
Affections oculaires
· Indéterminée : diplopie.
Affections du système immunitaire
· Peu fréquent : réactions d’hypersensibilité.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr.
Le pronostic vital peut être menacé, notamment dans les cas de polyintoxication impliquant d'autres dépresseurs du système nerveux central (y compris l'alcool).
En cas de prise massive, les signes de surdosage se manifestent principalement par une dépression du SNC pouvant aller de la somnolence jusqu'au coma, selon la quantité ingérée.
Les cas bénins se manifestent par des signes de confusion mentale, une léthargie.
Les cas plus sérieux se manifestent par une ataxie, une hypotonie, une hypotension, une dépression respiratoire, exceptionnellement un décès.
En cas de surdosage oral antérieur à 1 heure, l'induction de vomissement sera pratiquée si le patient est conscient ou, à défaut, un lavage gastrique avec protection des voies aériennes. Passé ce délai, l'administration de charbon activé peut permettre de réduire l'absorption.
Une surveillance particulière des fonctions cardio-respiratoires en milieu spécialisé est recommandée.
L'administration de flumazénil peut être utile pour le diagnostic et/ou le traitement d'un surdosage intentionnel ou accidentel en benzodiazépines.
L'antagonisme par le flumazénil de l'effet des benzodiazépines peut favoriser l'apparition de troubles neurologiques (convulsions), notamment chez le patient épileptique.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : ANXIOLYTIQUES, code ATC : N05BA05 (N : système nerveux central).
Le clorazépate appartient à la classe des 1-4 benzodiazépines et a une activité pharmacodynamique qualitativement semblable à celle des autres composés de cette classe :
· myorelaxante,
· anxiolytique,
· sédative,
· hypnotique,
· anticonvulsivante,
· amnésiante.
Ces effets sont liés à une action agoniste spécifique sur un récepteur central faisant partie du complexe "récepteurs macromoléculaires GABA-OMEGA", également appelés BZ1 et BZ2 et modulant l'ouverture du canal chlore.
5.2. Propriétés pharmacocinétiques
Distribution
Après injection IM ou IV de 50 mg de clorazépate dipotassique, celui-ci et son principal métabolite, le desméthyldiazépam, atteignent des concentrations plasmatiques maximales entre une demi-heure et une heure pour la voie intramusculaire, beaucoup plus précocement pour la voie intraveineuse.
Le volume de distribution du desméthyldiazépam est de l'ordre de 1 l/kg. La liaison aux protéines est importante, supérieure à 97 %.
Une relation concentration-effet n'a pu être établie pour cette classe de produits, en raison de l'intensité de leur métabolisme et du développement d'une tolérance.
Les benzodiazépines passent la barrière hémato-encéphalique ainsi que dans le placenta et le lait maternel.
Métabolisme et élimination
Le métabolite principal du clorazépate est le desméthyldiazépam, également actif, dont la demi-vie est plus importante que celle de la molécule-mère (entre 30 et 150 heures).
L'hydroxylation de cette molécule donne naissance à un autre métabolite actif, l'oxazépam.
L'inactivation se fait par glucuroconjugaison, aboutissant à des substances hydrosolubles éliminées dans les urines.
Populations à risque
Sujet âgé :
Le métabolisme hépatique diminue ainsi que la clairance totale avec augmentation des concentrations à l'équilibre, de la fraction libre et des demi-vies. Il importe alors de diminuer les doses.
Insuffisant hépatique :
On note une augmentation de la demi-vie, avec baisse de la clairance plasmatique totale.
5.3. Données de sécurité préclinique
D-Mannitol, carbonate dipotassique.
Solvant : hydrogénophosphate de potassium, dihydrogénophosphate de potassium, eau pour préparations injectables.
2 ans.
Après reconstitution de la solution : la solution reconstituée doit être utilisée immédiatement.
6.4. Précautions particulières de conservation
A conserver à l’abri de la lumière et de l'humidité.
A conserver à une température ne dépassant pas 25°C.
6.5. Nature et contenu de l'emballage extérieur
Poudre en flacon (verre brun) + 2 ml de solvant en ampoule (verre). Boîte de 5 ou 20 flacons et ampoules.
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
Sans objet.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
44, RUE CAMBRONNE
75015 PARIS
FRANCE
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 554 093 6 6 : poudre en flacon (verre brun) + 2 ml de solvant en ampoule (verre). Boîte de 20.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Liste I
Durée de prescription limitée à 12 semaines.
ANSM - Mis à jour le : 22/10/2025
TRANXENE 20 mg/2 ml, lyophilisat et solution pour usage parentéral
Clorazépate dipotassique
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin ou votre pharmacien.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que TRANXENE 20 mg/2 ml, lyophilisat et solution pour usage parentéral et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d’utiliser TRANXENE 20 mg/2 ml, lyophilisat et solution pour usage parentéral ?
3. Comment utiliser TRANXENE 20 mg/2 ml, lyophilisat et solution pour usage parentéral ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver TRANXENE 20 mg/2 ml, lyophilisat et solution pour usage parentéral ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE TRANXENE 20 mg/2 ml, lyophilisat et solution pour usage parentéral ET DANS QUELS CAS EST-IL UTILISE ?
Ce médicament est utilisé :
· pour traiter l'anxiété lorsque celle-ci s'accompagne de troubles gênants,
· pour prévenir ou traiter les manifestations liées à un sevrage alcoolique,
· avant certains examens afin de diminuer l'anxiété.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER TRANXENE 20 mg/2 ml, lyophilisat et solution pour usage parentéral ?
N’utilisez jamais TRANXENE 20 mg/2 ml, lyophilisat et solution pour usage parentéral :
· Si vous êtes allergique au clorazépate dipotassique ou à l'un des autres composants contenus dans ce médicament, mentionnés dans la rubrique 6.
· Si vous avez une insuffisance respiratoire grave.
· Si vous souffrez d'un syndrome d'apnée du sommeil (trouble caractérisé par des arrêts de la respiration pendant le sommeil).
· Si vous avez une maladie grave du foie (insuffisance hépatique grave).
· Si vous souffrez de myasthénie (maladie caractérisée par une tendance excessive à la fatigue musculaire).
En cas de doute, il est indispensable de demander l'avis de votre médecin ou de votre pharmacien.
Avertissements et précautions
Avant d’utiliser TRANXENE 20 mg/2 ml, lyophilisat et solution pour usage parentéral, prévenez votre médecin :
· si vous avez une insuffisance respiratoire,
· si vous avez une maladie du foie (insuffisance hépatique),
· si vous avez une maladie des reins (insuffisance rénale),
· si vous avez eu des problèmes de dépendance à l'alcool.
Avant d’utiliser TRANXENE 20 mg/2 ml, lyophilisat et solution pour usage parentéral, vous devez savoir que :
· Une anxiété peut révéler un autre trouble physique ou psychique. Une évaluation médicale doit être effectuée avant la prescription de ce médicament. Ce traitement médicamenteux ne peut à lui seul résoudre les difficultés liées à une anxiété. Il convient de demander conseil à votre médecin. Il vous indiquera les conduites pouvant aider à la lutte contre l'anxiété.
· Ce médicament ne traite pas la dépression. Si vous souffrez également de dépression, votre médecin vous prescrira un traitement approprié. Si la dépression n’est pas traitée, elle peut s’aggraver avec une persistance ou une augmentation possible du risque suicidaire.
Dans les heures qui suivent la prise du médicament, il peut survenir, en particulier chez les enfants et les personnes âgées :
· une perte de la mémoire concernant les événements survenus pendant le traitement (amnésie antérograde),
· des troubles du comportement (tels que agressivité ou actes automatiques), agitation, nervosité, colère, euphorie ou irritabilité, tension,
· une insomnie, des cauchemars,
· une altération de l'état de conscience, idées délirantes,
· une difficulté à coordonner certains mouvements (altération des fonctions psychomotrices).
Ces troubles peuvent être dangereux pour vous et pour autrui. Dans de tels cas, vous devez arrêter le traitement et contacter le plus rapidement possible un médecin.
Risque de dépendance
Ce médicament peut entraîner, surtout en cas d'utilisation prolongée, un état de dépendance physique et psychique.
Divers facteurs semblent favoriser la survenue de la dépendance :
· si vous prenez TRANXENE 20 mg/2 ml, lyophilisat et solution pour usage parentéral de façon prolongée,
· si vous prenez une dose importante,
· si vous avez déjà présenté une dépendance à d'autres médicaments, substances ou à l'alcool.
La dépendance peut survenir même en l'absence de ces facteurs favorisants.
Arrêter BRUTALEMENT ce traitement peut provoquer l'apparition d'un phénomène de SEVRAGE.
Celui-ci se caractérise par l'apparition, en quelques heures ou en quelques jours, de signes tels que : anxiété importante, insomnie, douleurs musculaires, mais on peut observer également une agitation, une irritabilité, des maux de tête, un engourdissement ou des picotements des extrémités, une sensibilité anormale au bruit, à la lumière ou aux contacts physiques, etc...
Pour plus d'information, parlez-en à votre médecin ou à votre pharmacien.
Risque de rebond
Une réapparition temporaire de l'anxiété peut survenir à l'arrêt du traitement.
Afin de diminuer le risque de survenue d'un phénomène de sevrage ou de rebond de l'anxiété, la dose sera diminuée progressivement et les prises seront espacées. Les modalités d'arrêt du traitement doivent être précisées par votre médecin.
Idée suicidaire/tentative de suicide/suicide et dépression
Certaines études ont montré un risque accru d’idées suicidaires, de tentatives de suicide et de suicides chez les patients prenant certains sédatifs et hypnotiques, y compris ce médicament. Cependant, il n’a pas été établi si cela est dû au médicament ou s’il peut y avoir d’autres raisons. Si vous avez des idées suicidaires, contactez votre médecin le plus tôt possible pour obtenir un conseil médical.
Risques de l’utilisation concomitante de TRANXENE 20 mg/2 ml, lyophilisat et solution pour usage parentéral avec des opioïdes
La prise concomitante de TRANXENE 20 mg/2 ml, lyophilisat et solution pour usage parentéral avec des opioïdes peut entrainer une sédation, une dépression respiratoire, un coma et un décès. Si vous prenez en même temps TRANXENE et des opioïdes, votre médecin portera une attention particulière aux signes de dépression respiratoire et de sédation
Utilisation chez les personnes âgées de plus de 65 ans
TRANXENE 20 mg/2 ml, lyophilisat et solution pour usage parentéral doit être utilisé avec prudence chez les personnes âgées en raison du risque de somnolence, de sensations vertigineuses et de relâchement musculaire qui peuvent favoriser les chutes.
Les chutes ont souvent des conséquences graves chez les personnes âgées.
Autres médicaments et TRANXENE 20 mg/2 ml, lyophilisat et solution pour usage parentéral
Informez votre médecin ou pharmacien si vous prenez, avez récemment pris ou pourriez prendre tout autre médicament, y compris tout médicament obtenu sans ordonnance tels que :
· l’oxybate de sodium (traitement de la narcolepsie)
· des médicaments sédatifs
· des médicaments appartenant à la classe des barbituriques tels que par exemple le phénobarbital (traitement anti-épileptique), le thiopental (traitement analgésique)
· la buprénorphine (traitement substitutif contre la pharmacodépendance aux opioïdes)
· la clozapine (traitement de la schizophrénie)
· certains médicaments analgésiques appartenant à la classe des morphiniques tels que par exemple la morphine, le tramadol,
Vous devez prévenir votre médecin si vous êtes traité par oxybate de sodium (utilisé dans le traitement de la narcolepsie chez les adultes présentant une cataplexie).
La prise de médicaments ou de boissons contenant de l'alcool est formellement déconseillée pendant la durée du traitement.
TRANXENE 20 mg/2 ml, lyophilisat et solution pour usage parentéral avec des aliments, boissons et de l’alcool
La consommation d'alcool ou de produits contenant de l'alcool est formellement déconseillée pendant la durée du traitement.
Grossesse, allaitement et fertilité
Ce médicament est déconseillé pendant la grossesse. Si vous découvrez que vous êtes enceinte ou que vous souhaitez l’être, consultez votre médecin afin qu’il réévalue l’intérêt du traitement.
Si vous prenez TRANXENE 20 mg/2 ml, lyophilisat et solution pour usage parentéral au cours du 1er trimestre de la grossesse : de nombreuses données n’ont pas montré d’effet malformatif des benzodiazépines. Cependant, certaines études ont décrit un risque potentiellement augmenté de survenue de fente labio-palatine chez le nouveau-né par rapport au risque présent dans la population générale. Une fente labio-palatine (parfois nommée « bec de lièvre ») est une malformation congénitale causée par une fusion incomplète du palais et de la lèvre supérieure. Selon ces données, l’incidence des fentes labio-palatines chez les nouveau-nés serait inférieure à 2/1000 après exposition aux benzodiazépines au cours de la grossesse alors que le taux attendu dans la population générale est de 1/1000.
Si vous prenez TRANXENE 20 mg/2 ml, lyophilisat et solution pour usage parentéral au 2ème et/ou 3ème trimestres de grossesse, une diminution des mouvements actifs fœtaux et une variabilité du rythme cardiaque fœtal peuvent survenir.
Si vous prenez TRANXENE 20 mg/2 ml, lyophilisat et solution pour usage parentéral en fin de grossesse, informez en l’équipe médicale, une surveillance du nouveau-né pourrait être effectuée : une faiblesse musculaire (hypotonie axiale), des difficultés d'alimentation (troubles de la succion entrainant une faible prise de poids), une hyperexcitabilité, une agitation ou des tremblements peuvent survenir chez le nouveau-né, ces troubles étant réversibles. A fortes doses, une insuffisance respiratoire ou des apnées, une baisse de la température centrale du corps (hypothermie) pourraient également survenir chez le nouveau-né.
Si votre bébé présente un ou plusieurs de ces symptômes à la naissance ou à distance de la naissance, contactez votre médecin et/ou votre sage-femme.
Ce médicament passe dans le lait maternel : en conséquence, l'allaitement est déconseillé.
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin ou pharmacien avant de prendre ce médicament.
Conduite de véhicules et utilisation de machines
Ce médicament peut diminuer la vigilance et la force musculaire et provoquer une perte de mémoire et de la somnolence. Si vous ressentez l'un de ces effets, vous ne devez pas conduire un véhicule ou utiliser une machine.
Si vous ne dormez pas suffisamment (au moins 7 à 8 heures), le risque de somnolence et de diminution de la vigilance est augmenté après avoir pris TRANXENE 20 mg/2 ml, lyophilisat et solution pour usage parentéral.
L'utilisation simultanée de TRANXENE 20 mg/2 ml, lyophilisat et solution pour usage parentéral avec d'autres médicaments sédatifs (tranquillisants, somnifères, certains médicaments contre la toux...) est déconseillée en cas de conduite automobile ou d'utilisation de machines.
TRANXENE 20 mg/2 ml, lyophilisat et solution pour usage parentéral contient moins de 1 mmol (17 mg) de potassium par flacon de 20 mg/2 ml de solution reconstituée, c’est-à-dire qu’il est essentiellement sans potassium.
Néanmoins, ce médicament contenant 17 mg de potassium par flacon de 20 mg/2 ml de solution reconstituée, il est à prendre en compte chez les patients insuffisants rénaux ou chez les patients contrôlant leur apport alimentaire en potassium pour des doses supérieures à 40 mg de solution reconstituée.
Du fait de sa concentration en potassium, ce médicament peut causer des douleurs au site d’injection.
3. COMMENT UTILISER TRANXENE 20 mg/2 ml, lyophilisat et solution pour usage parentéral ?
Mode et voie d’administration
Voie injectable IM ou IV lente ou perfusion.
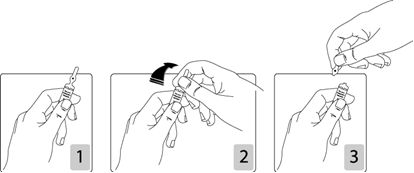
Pour ouvrir l’ampoule :
Tenir fermement l’ampoule, le point coloré face à vous (schéma 1). Saisir la tête de l’ampoule entre le pouce et l’index (le pouce sur le point coloré), puis exercer une pression vers l’arrière (schémas 2 et 3).
|
|
Durée du traitement
La durée du traitement doit être aussi brève que possible (voir rubrique « Avertissements et précautions »).
Si vous avez utilisé plus de TRANXENE 20 mg/2 ml, lyophilisat et solution pour usage parentéral que vous n’auriez dû :
Consultez immédiatement votre médecin ou votre pharmacien.
Si vous oubliez d’utiliser TRANXENE 20 mg/2 ml, lyophilisat et solution pour usage parentéral :
Sans objet.
Si vous arrêtez d’utiliser TRANXENE 20 mg/2 ml, lyophilisat et solution pour usage parentéral :
Phénomènes de sevrage et de rebond (voir rubrique « Avertissements et précautions »).
Si vous avez d’autres questions sur l’utilisation de ce médicament, demandez plus d’informations à votre médecin ou pharmacien.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Ils dépendent de la dose ingérée et de votre propre sensibilité.
Effets indésirables très fréquents (peuvent affecter plus de 1 personne sur 10)
· baisse de la vigilance voire somnolence (particulièrement chez les personnes âgées).
Effets indésirables fréquents (peuvent affecter jusqu’à 1 personne sur 10)
· sensations d’ivresse,
· fatigue,
· dépendance physique et psychique même à des doses recommandées par votre médecin,
· syndrome de sevrage ou de rebond à l’arrêt du traitement (voir également rubrique 2 les paragraphes «Risque de dépendance» et «Risque de rebond»).
Effets indésirables peu fréquents (peuvent affecter jusqu’à 1 personne sur 100)
· agitation, nervosité, euphorie ou irritabilité,
· faiblesse musculaire,
· confusion,
· troubles de l’attention,
· modifications de la libido,
· éruptions cutanées, avec ou sans démangeaisons,
· réactions allergiques (hypersensibilité).
Fréquence non connue
· perte de la mémoire concernant les événements survenus pendant le traitement (amnésie antérograde). Cet effet peut survenir aux doses prescrites par votre médecin. Le risque augmente proportionnellement à la dose,
· troubles de la parole,
· troubles du comportement (tels que agressivité ou actes automatiques), tension, colère, hallucinations, idées délirantes,
· altération de l’état de conscience,
· difficulté à coordonner certains mouvements (altération des fonctions psychomotrices),
· risque d'arrêt respiratoire en cas d'injection intraveineuse rapide,
· chutes,
· insomnie, cauchemars,
· maux de tête,
· vision double.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER TRANXENE 20 mg/2 ml, lyophilisat et solution pour usage parentéral ?
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur l’emballage après EXP. La date de péremption fait référence au dernier jour de ce mois.
Avant ouverture : A conserver à l'abri de la lumière et de l'humidité. A conserver à une température ne dépassant pas + 25°C.
Après reconstitution de la solution : la solution reconstituée doit être utilisée immédiatement.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient TRANXENE 20 mg/2 ml, lyophilisat et solution pour usage parentéral
· La substance active est :
Clorazépate dipotassique....................................................................................................... 20 mg
pour un flacon.
· Les autres composants sont :
D-Mannitol, carbonate dipotassique.
Solvant : hydrogénophosphate de potassium, dihydrogénophosphate de potassium, eau pour préparations injectables.
Ce médicament se présente sous forme de lyophilisat et solution pour usage parentéral.
Boîte de 5 ou 20 flacons et ampoules.
Toutes les présentations peuvent ne pas être commercialisées.
Titulaire de l’autorisation de mise sur le marché
44, RUE CAMBRONNE
75015 PARIS
FRANCE
Exploitant de l’autorisation de mise sur le marché
44, RUE CAMBRONNE
75015 PARIS
FRANCE
VIA VALCANELLO, 4
03012 ANAGNI (FR)
ITALIE
ou
NEURAXPHARM PHARMACEUTICALS S.L.
AVDA. DE BARCELONA 69
SANT JOAN DESPI
08970, BARCELONA
ESPAGNE
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Sans objet.
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).