Dernière mise à jour le 01/12/2025
LANSOPRAZOLE VIATRIS 30 mg, comprimé orodispersible
Indications thérapeutiques
Votre médecin peut prescrire Lansoprazole VIATRIS pour le :
· traitement de l'ulcère duodénal (de l’intestin) et de l'ulcère gastrique ;
· traitement de l'inflammation de l'œsophage (œsophagite par reflux) ;
· prévention de l'œsophagite par reflux ;
· traitement des brûlures d'estomac et des régurgitations acides ;
· traitement des infections induites par les bactéries Helicobacter pylori lorsqu'il est prescrit en association avec un antibiotique ;
· traitement ou prévention de l'ulcère duodénal (de l’intestin) ou de l'ulcère gastrique chez les patients nécessitant un traitement par AINS en continu (le traitement par anti-inflammatoires non stéroïdiens (AINS) est prescrit contre la douleur ou l'inflammation) ;
· traitement du syndrome Zollinger-Ellison.
Votre médecin peut avoir prescrit Lansoprazole VIATRIS pour une autre indication ou avec une dose différente de celles indiquées dans cette notice. Suivez les indications de votre médecin pour prendre votre médicament.
Présentations
> plaquette(s) pelable(s) OPA : polyamide orienté aluminium PVC de 14 comprimé(s)
Code CIP : 274 183-5 ou 34009 274 183 5 8
Déclaration de commercialisation : 27/12/2013
Cette présentation est agréée aux collectivités
- Prix hors honoraire de dispensation : 2,23 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 3,25 €
- Taux de remboursement :65%
> plaquette(s) pelable(s) OPA : polyamide orienté aluminium PVC de 28 comprimé(s)
Code CIP : 274 184-1 ou 34009 274 184 1 9
Déclaration de commercialisation : 27/12/2013
Cette présentation est agréée aux collectivités
- Prix hors honoraire de dispensation : 4,10 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 5,12 €
- Taux de remboursement :65%
Documents de bon usage du médicament
- Choix et durées d'antibiothérapies : Traitement probabiliste de l’infection par Helicobacter pylori chez l’adulte
Auteur : Haute autorité de santé
Type : Fiche mémo
Date de mise à jour :Juillet 2024
- Bon usage des inhibiteurs de la pompe à protons (IPP)
Auteur : Haute autorité de santé
Type : Fiche Bon Usage du Médicament
Date de mise à jour :Octobre 2022
Service médical rendu (SMR)
Amélioration du service médical rendu (ASMR)
Ce médicament étant un générique, l'ASMR n'a pas été évalué par la commission de la transparence (CT), il est possible de se référer à la /aux spécialité(s) de référence du groupe générique auquel appartient ce médicament (cliquez ici pour aller à la rubrique des groupes génériques)
ANSM - Mis à jour le : 12/09/2025
LANSOPRAZOLE VIATRIS 30 mg, comprimé orodispersible
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Chaque comprimé orodispersible contient 30 mg de lansoprazole (sous forme de micro-granules gastro-résistants).
Excipient(s) à effet notoire : Chaque comprimé orodispersible contient 11,93 mg d'aspartam (E951) et de 27,6 mg de saccharose.
Pour la liste complète des excipients, voir rubrique 6.1.
Comprimé plat, à bords biseautés, rond, blanc à blanc-cassé, d’approximativement 12,7 mm de diamètre, gravé « LP2 » sur une face et « M » sur l’autre avec des tâches orange à brun foncé.
4.1. Indications thérapeutiques
· Traitement de l'ulcère duodénal et de l'ulcère gastrique.
· Traitement de l'œsophagite par reflux.
· Prévention de l'œsophagite par reflux.
· Eradication de Helicobacter pylori (H. pylori) par administration concomitante d'une antibiothérapie appropriée pour le traitement des ulcères associés à H. pylori.
· Traitement de l'ulcère duodénal et de l'ulcère gastrique bénin, induits par les anti-inflammatoires non stéroïdiens (AINS) chez des patients nécessitant un traitement continu par AINS.
· Prévention de l'ulcère duodénal et de l'ulcère gastrique induits par les AINS chez des patients à risque (voir rubrique 4.2) nécessitant un traitement continu par AINS.
· Reflux gastro-œsophagien symptomatique.
· Syndrome de Zollinger-Ellison.
4.2. Posologie et mode d'administration
Posologie
Traitement de l'ulcère duodénal :
La posologie recommandée est de 30 mg une fois par jour pendant 2 semaines. Chez les patients dont la cicatrisation n'est pas complète après cette période, le traitement sera poursuivi, à la même posologie, pendant 2 semaines supplémentaires.
Traitement de l'ulcère gastrique :
La posologie recommandée est de 30 mg une fois par jour pendant 4 semaines. L'ulcère cicatrise habituellement en 4 semaines, mais chez les patients dont la cicatrisation n'est pas complète après cette période, le traitement peut être poursuivi, à la même posologie, pendant 4 semaines supplémentaires.
Œsophagite par reflux :
La posologie recommandée est de 30 mg une fois par jour pendant 4 semaines. Chez des patients dont la guérison n'est pas complète après cette période, le traitement peut être poursuivi, à la même posologie, pendant 4 semaines supplémentaires.
Prévention de l'œsophagite par reflux :
15 mg une fois par jour. La posologie peut être augmentée jusqu'à 30 mg par jour si nécessaire.
Eradication de Helicobacter pylori :
Le choix du traitement associé approprié doit prendre en compte les recommandations locales officielles concernant la résistance bactérienne, la durée de traitement (habituellement de 7 jours, mais peut parfois aller jusqu'à 14 jours), et l'utilisation appropriée d'agents antibactériens.
La posologie recommandée est de 30 mg de LANSOPRAZOLE VIATRIS deux fois par jour pendant 7 jours en association avec l'une des combinaisons suivantes :
· 250-500 mg de clarithromycine deux fois par jour + 1 g d'amoxicilline deux fois par jour,
· 250 mg de clarithromycine deux fois par jour + 400-500 mg de métronidazole deux fois par jour.
Les taux d'éradication de H. pylori jusqu'à 90 %, sont obtenus lorsque la clarithromycine est associée au lansoprazole et à l'amoxicilline ou au métronidazole.
Six mois après la réussite du traitement d'éradication, le risque de réinfection est faible et la rechute est par conséquent improbable.
L'utilisation d'une posologie comprenant 30 mg de lansoprazole deux fois par jour, 1 g d'amoxicilline deux fois par jour et 400-500 mg de métronidazole deux fois par jour a également été étudiée. En utilisant cette association, on a observé des taux d'éradication plus faibles que pour des posologies impliquant la clarithromycine. Elles peuvent être adaptées pour les patients ne pouvant pas prendre de clarithromycine dans le cadre du traitement d'éradication, lorsque les taux locaux de résistance au métronidazole sont faibles.
Traitement de l'ulcère duodénal et de l'ulcère gastrique bénin, induits par les AINS chez des patients nécessitant un traitement continu par AINS :
30 mg une fois par jour pendant quatre semaines. Chez des patients dont la cicatrisation n'est pas complète, le traitement peut être poursuivi pendant quatre semaines supplémentaires. Chez les patients à risque ou atteints d'ulcères difficiles à cicatriser, une durée de traitement plus longue et/ou une plus forte dose peut être utilisée.
Prévention de l'ulcère duodénal et de l'ulcère gastrique induits par les AINS chez des patients à risque (âgés de plus de 65 ans ou avec un antécédent d'ulcère gastrique ou duodénal) nécessitant un traitement prolongé par AINS :
15 mg une fois par jour. En cas d'échec du traitement, la posologie de 30 mg une fois par jour doit être utilisée.
Reflux gastro-œsophagien symptomatique :
La posologie recommandée est de 15 mg ou de 30 mg par jour. Le soulagement des symptômes est obtenu rapidement. Un ajustement individuel de la posologie doit être envisagé. Si les symptômes ne sont pas soulagés dans les 4 semaines avec une posologie quotidienne de 30 mg, des examens complémentaires sont recommandés.
Syndrome de Zollinger-Ellison :
La posologie initiale recommandée est de 60 mg une fois par jour. La posologie doit être ajustée individuellement et le traitement doit être poursuivi aussi longtemps que nécessaire. Des posologies journalières jusqu'à 180 mg ont été utilisées. Si la posologie journalière requise dépasse 120 mg, elle devra être divisée et administrée en deux prises.
Populations particulières
Insuffisance rénale :
Aucun ajustement de dose n'est nécessaire chez les patients atteints d'insuffisance rénale.
Insuffisance hépatique :
Les patients atteints de maladies hépatiques sévères ou modérées doivent être maintenus sous surveillance régulière et une réduction de 50 % de la dose journalière est recommandée (voir rubriques 4.4 et 5.2).
Sujets âgés :
En raison de la clairance réduite du lansoprazole chez les sujets âgés, un ajustement individuel de la dose peut être nécessaire. Une dose journalière de 30 mg ne doit pas être dépassée chez les sujets âgés, sauf s'il existe des indications cliniques pertinentes.
Population pédiatrique :
En l'absence de données cliniques suffisantes, l'utilisation de LANSOPRAZOLE VIATRIS n'est pas recommandée chez l'enfant (voir également rubrique 5.2).
Le traitement chez les nourrissons de moins de un an doit être évité, les données cliniques disponibles n'ayant pas démontré d'effet bénéfique du lansoprazole dans le traitement du reflux gastro-œsophagien.
Mode d’administration
Voie orale.
Pour un effet optimal, LANSOPRAZOLE VIATRIS doit être pris une fois par jour le matin, sauf dans le cas d'une éradication de H. pylori, pour lequel le traitement doit être pris deux fois par jour, une fois le matin et une fois le soir.
Les comprimés de LANSOPRAZOLE VIATRIS ont un arôme de fraise et doivent être placés sur la langue, puis sucés doucement. Les comprimés se délitent rapidement dans la bouche, libérant les microgranules gastrorésistants qui sont avalés avec la salive du patient.
Les comprimés peuvent également être avalés entiers avec un verre d'eau.
Les comprimés orodispersibles peuvent être délités dans une petite quantité d'eau et administrés via une sonde nasogastrique ou une seringue orale.
Lansoprazole comprimé orodispersible doit être pris au moins 30 minutes avant les repas (voir rubrique 5.2).
Administration par sonde nasogastrique :
· Oter le piston de la seringue (utiliser une seringue d'au moins 25 ml pour le comprimé de 15 mg et de 50 ml pour le comprimé de 30 mg).
· Mettre le comprimé dans le corps de la seringue.
· Remettre le piston sur la seringue.
· Pour le comprimé de 30 mg : aspirer 25 ml d'eau du robinet dans la seringue.
· Retourner la seringue et faire pénétrer 5 ml d'air supplémentaire.
· Secouer doucement la seringue pendant 10-20 secondes jusqu'à ce que le comprimé soit dissout.
· Raccorder la seringue sur la sonde et vider le contenu de la seringue dans la sonde gastrique.
· Pour le comprimé de 30 mg : remplir à nouveau la seringue avec 25 ml d'eau du robinet puis administrer le contenu dans la sonde.
Il est important de vérifier que la seringue et la sonde sélectionnées soient appropriées pour cette utilisation. Le diamètre minimum recommandé pour la sonde nasogastrique est de 3,3 mm (10 French).
Administration orale par une seringue :
· Oter le piston de la seringue (une seringue d'au moins 5 ml pour le comprimé de 15 mg et d’au moins 10 ml pour le comprimé de 30 mg).
· Mettre le comprimé dans le corps de la seringue.
· Remettre le piston sur la seringue.
· Pour le comprimé de 30 mg : aspirer 10 ml d'eau du robinet dans la seringue.
· Retourner la seringue et faire pénétrer 1 ml d'air supplémentaire.
· Secouer doucement la seringue pendant 10-20 secondes jusqu'à ce que le comprimé soit dissout.
· Le contenu peut être vidé directement dans la bouche.
· Remplir à nouveau la seringue avec 2-5 ml d'eau du robinet afin de rincer la seringue et vider la seringue dans la bouche.
· Répéter si nécessaire l'étape précédente.
· Hypersensibilité à la substance active ou à l'un des excipients mentionnés à la rubrique 6.1.
4.4. Mises en garde spéciales et précautions d'emploi
Tumeur gastrique maligne
Comme avec tous les autres traitements anti-ulcéreux, la possibilité de tumeur gastrique maligne doit être écartée lors du traitement de l'ulcère gastrique avec le lansoprazole car ce dernier peut masquer les symptômes et retarder le diagnostic.
Inhibiteurs de la protéase du virus de ’immunodéficience humaine (VIH)
L’administration concomitante du lansoprazole et d’inhibiteurs de la protéase du VIH, pour lesquels l’absorption dépend du pH gastrique, tels que atazanavir et, nelfinavir, n’est pas recommandée car cela risquerait de réduire leur biodisponibilité de manière significative (voir rubrique 4.5). Si la co-administration de lansoprazole avec des inhibiteurs de la protéase du VIH est inévitable, une surveillance clinique étroite est recommandée.
Hypomagnésémie
Des cas d’hypomagnésémies sévères ont été rarement rapportés chez des patients traités par des inhibiteurs de la pompe à protons (IPP) tels que le lansoprazole pendant au moins trois mois et, dans la plupart des cas pendant un an. L’hypomagnésémie peut se manifester par des signes cliniques graves tels que fatigue, tétanie, bouffées délirantes, convulsions, vertiges, arythmie ventriculaire, mais elle peut débuter de façon insidieuse et passer inaperçue.. L’hypomagnésémie peut entraîner une hypocalcémie et/ou une hypokaliémie (voir rubrique 4.8) Chez la plupart des patients, l’hypomagnésémie (et l’hypomagnésémie associée à une hypocalcémie et/ou une hypokaliémie) s’est améliorée après supplémentation en magnésium et arrêt de l’IPP.
Chez les patients nécessitant un traitement prolongé ou en cas d’association des IPP avec de la digoxine ou avec des médicaments pouvant induire une hypomagnésémie (par exemple des diurétiques), un dosage du taux de magnésium sanguin doit être envisagé par les professionnels de santé avant de commencer le traitement par l’IPP puis régulièrement pendant le traitement.
Interférence avec les tests de laboratoire
L’augmentation du taux de Chromogranine A (CgA) peut interférer avec les tests réalisés pour l’exploration des tumeurs neuroendocrines. Pour éviter cette interférence, le traitement par lansoprazole doit être interrompu au moins 5 jours avant de mesurer le taux de CgA (voir rubrique 5.1). Si les taux de CgA et de gastrine ne se sont pas normalisés après la mesure initiale, les mesures doivent être répétées 14 jours après l’arrêt du traitement par inhibiteur de la pompe à protons.
Influence sur l’absorption de la vitamine B12
Un traitement quotidien par tout antisécrétoire gastrique, durant une période prolongée (plusieurs années) peut diminuer l’absorption de la vitamine B12 (cyanocobalamine) en raison d’hypo- ou d’achlorhydrie. Le déficit en cyanocobalamine doit être pris en compte chez les patients atteints du syndrome de Zollinger-Ellison ou d’autres pathologies comprenant une hypersécrétion et requérant un traitement au long cours, disposant de réserves réduites ou présentant des facteurs de risque de diminution de l’absorption de la vitamine B12 (comme les personnes âgées) lors de traitement au long cours ou si des symptômes cliniques sont observés.
Insuffisance hépatique
Le lansoprazole doit être utilisé avec précaution chez les patients atteints d'insuffisance hépatique sévère ou modérée (voir rubriques 4.2 et 5.2).
Infections gastro-intestinales causées par des bactéries
Le lansoprazole, comme tous les inhibiteurs de la pompe à protons (IPP) peut augmenter les taux de bactéries normalement présentes dans le tractus gastro-intestinal. Cela peut conduire à une augmentation du risque d’infections gastro-intestinales dues à des bactéries telles que Salmonella, Campylobacter, et, éventuellement Clostridium difficile chez des patients hospitalisés.
Chez les patients souffrant d'ulcères gastro-duodénaux, la possibilité d'infection par H. pylori comme facteur étiologique doit être envisagée.
Si le lansoprazole est utilisé en association avec des antibiotiques pour le traitement d'éradication de H. pylori, les conditions d'utilisation de ces antibiotiques doivent alors également être suivies.
Traitement à long terme
En raison de données de sécurité d'emploi limitées chez les patients sous traitement d'entretien pendant plus d'un an, un suivi régulier du traitement et une évaluation approfondie du rapport bénéfice/risque doivent être régulièrement réalisés chez ces patients.
Troubles gastro-intestinaux
De très rares cas de colite ont été rapportés chez des patients sous lansoprazole. Par conséquent, dans le cas de diarrhée sévère et/ou persistante, l'arrêt du traitement doit être envisagé.
À l'exception des patients traités pour l'éradication de l'infection à H. pylori, si la diarrhée persiste, l'administration de lansoprazole doit être interrompue, en raison de la possibilité de colite microscopique avec épaississement du faisceau de collagène ou infiltration de cellules inflammatoires dans la grande sous-muqueuse de l'intestin grêle. Dans la majorité des cas, les symptômes de la colite microscopique conduisent à l'arrêt du lansoprazole.
Administration concomitante d’AINS
Le traitement de la prévention d'ulcération peptique des patients nécessitant un traitement continu par AINS doit être limité aux patients à haut risque (exemple : antécédents d'hémorragie gastrointestinale, perforation ou ulcère, âge avancé, association médicamenteuse connue pour augmenter la probabilité d'apparition d'évènements indésirables des voies digestives hautes [exemple: corticoïdes ou anticoagulants], présence d'un facteur grave de co-morbidité ou utilisation prolongée d'AINS aux doses maximales recommandées).
Fracture osseuse
Les inhibiteurs de la pompe à protons, en particulier s’ils sont utilisés à fortes doses et sur une durée prolongée (> 1 an), peuvent augmenter modérément le risque de fracture de la hanche, du poignet et des vertèbres, principalement chez les patients âgés ou en présence d’autres facteurs de risque identifiés. Des études observationnelles suggèrent que les inhibiteurs de la pompe à protons peuvent augmenter le risque global de fracture de 10 à 40%. Cette augmentation peut être en partie due à d’autres facteurs de risque. Les patients présentant un risque d’ostéoporose doivent être pris en charge conformément aux recommandations en vigueur, et recevoir un apport approprié en vitamine D et en calcium.
Réactions cutanées sévères
Les réactions cutanées sévères (SCARs), y compris le syndrome de Stevens-Johnson (SJS), la nécrolyse épidermique toxique (syndrome de Lyell), et le syndrome d’hypersensibilité médicamenteuse avec éosinophilie et symptômes systémiques (DRESS), qui peuvent mettre en jeu le pronostic vital ou être fatales, ont été rapportées en association avec le lansoprazole à une fréquence indéterminée (voir rubrique 4.8).
Au moment de la prescription, les patients doivent être informés de ces signes et ces symptômes et l’apparition de ces réactions cutanées doit être étroitement surveillée. En cas d'apparition de signes et de symptômes évocateurs de ces réactions, le lansoprazole doit être arrêté immédiatement et un traitement alternatif doit être envisagé.
Lupus érythémateux cutané subaigu (LECS)
Les inhibiteurs de la pompe à protons sont associés à des cas très occasionnels de LECS. Si des lésions se développent, notamment sur les zones cutanées exposées au soleil, et si elles s'accompagnent d'arthralgie, le patient doit consulter un médecin rapidement et le professionnel de santé doit envisager d'arrêter lansoprazole. La survenue d’un LECS après traitement par un inhibiteur de la pompe à protons peut augmenter le risque de LECS avec d'autres inhibiteurs de la pompe à protons (voir rubrique 4.8).
Atteinte de la fonction rénale
Une néphrite tubulo-interstitielle (NTI) aiguë a été observée chez des patients prenant du lansoprazole et peut survenir à tout moment au cours du traitement par lansoprazole (voir rubrique 4.8). La néphrite tubulo-interstitielle aiguë peut évoluer vers une insuffisance rénale.
En cas de suspicion de NTI, le lansoprazole doit être interrompu et un traitement approprié doit être rapidement instauré.
Excipients à effets notoires
Ce médicament contient 11,93 mg d’aspartam par comprimé.
L’aspartam contient une source de phénylalanine. L’aspartam est hydrolysé dans le tube gastro-digestif lorsqu’il est ingéré par voie orale. L’un des principaux produits de l’hydrolyse est la phénylalanine. Il peut être dangereux pour les personnes atteintes de phénylcétonurie (PCU), une maladie génétique rare caractérisée par l’accumulation de phénylalanine ne pouvant être éliminée correctement.
Ce médicament contient du saccharose. Les patients présentant une intolérance au fructose, un syndrome de malabsorption du glucose et du galactose ou un déficit en sucrase/isomaltase (maladies héréditaires rares) ne doivent pas prendre ce médicament.
Ce médicament contient moins de 1 mmol (23 mg) de sodium par comprimé c’est-à-dire qu’il est essentiellement « sans sodium ».
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Effets du lansoprazole sur d'autres médicaments
Médicaments avec absorption pH-dépendante
Le lansoprazole peut interférer avec l'absorption de médicaments pour le pH gastrique est un élément déterminant de leur biodisponibilité orale.
+ Inhibiteurs de la protéase du VIH :
L’administration concomitante du lansoprazole et d’inhibiteurs de la protéase du VIH, pour lesquels l’absorption est pH-dépendante, tels que atazanavir et nelfinavir, n’est pas recommandée car cela risquerait de réduire leur biodisponibilité de manière significative (voir rubrique 4.4).
Une étude a montré que l'administration concomitante de lansoprazole (60 mg une fois par jour) et d'atazanavir 400 mg à des volontaires sains réduit considérablement l'exposition à l'atazanavir (baisse d'environ 90 % des ASC (aire sous la courbe) et Cmax (concentration maximale)).
+ Kétoconazole et itraconazole :
L'absorption de kétoconazole et d'itraconazole au niveau du tractus gastro-intestinal est augmentée en présence d'acide gastrique. L'administration de lansoprazole peut induire des concentrations inférieures au seuil thérapeutique de kétoconazole et d'itraconazole et l'association doit être évitée.
+ Digoxine :
L'association de lansoprazole et de digoxine peut entraîner une augmentation de concentration plasmatique de digoxine. Les concentrations plasmatiques de digoxine doivent par conséquent être surveillées et la dose de digoxine ajustée si nécessaire au début et à la fin du traitement par lansoprazole.
Médicaments métabolisés par les enzymes du cytochrome P450
Le lansoprazole peut augmenter les concentrations plasmatiques des médicaments métabolisés par le CYP3A4. La prudence est recommandée lors de l'association du lansoprazole avec des médicaments métabolisés par cette enzyme et présentant une faible marge thérapeutique.
+ Warfarine
Des cas d’augmentation du Quotient International Normalisé (INR) et du temps de prothrombine ont été rapportés lors de l’administration concomitante de warfarine et d’IPP. Une augmentation de l’INR et du temps de prothrombine peut provoquer des hémorragies, potentiellement fatales. En conséquence, chez les patients traités simultanément par le lansoprazole et la warfarine, le suivi de l’INR et du temps de prothrombine est recommandé, particulièrement au début et à l’arrêt d’un traitement concomitant.
+ Théophylline :
Le lansoprazole réduit la concentration plasmatique de la théophylline, ce qui peut diminuer l'effet clinique attendu. Le patient doit être sous surveillance en cas d’administration concomitante de lansoprazole et de théophylline.
+ Tacrolimus :
L'administration concomitante de lansoprazole augmente les concentrations plasmatiques de tacrolimus (un substrat du CYP3A et de la P-gp). La prise de lansoprazole augmente le taux moyen de tacrolimus jusqu'à 81 %. La surveillance des concentrations plasmatiques de tacrolimus est recommandée au début ou à la fin du traitement par lansoprazole.
Médicaments transportés par la glycoprotéine P
Une inhibition de la glycoprotéine- P (P-gp) par le lansoprazole a été observée in vitro. La pertinence clinique en est inconnue.
Effets d'autres médicaments sur le lansoprazole
Médicaments inhibant le CYP2C19
+ Fluvoxamine :
Une diminution de la dose peut être envisagée lors de l'association du lansoprazole avec la fluvoxamine, inhibiteur du CYP2C19. Les concentrations plasmatiques du lansoprazole sont augmentées jusqu'à 4 fois la normale.
Médicaments induisant le CYP2C19 et le CYP3A4
Des inducteurs enzymatiques affectant le CYP2C19 et le CYP3A4 comme la rifampicine et le millepertuis (Hypericum perforatum) peuvent sensiblement réduire les concentrations plasmatiques du lansoprazole.
Autres
+ Méthotrexate :
L’utilisation concomitante de fortes doses de méthotrexate peut augmenter et prolonger les taux sanguins de méthotrexate et/ou ses métabolites pouvant mener à une toxicité du méthotrexate.
+ Sucralfate/Anti-acides :
Le sucralfate et les anti-acides peuvent diminuer la biodisponibilité du lansoprazole. Par conséquent, le lansoprazole doit être pris au moins 1 heure après la prise de ces médicaments.
+ Médicaments anti-inflammatoires non-stéroïdiens :
Aucune interaction significative sur le plan clinique entre le lansoprazole et les anti-inflammatoires non stéroïdiens n'a été démontrée, bien qu'aucune étude d'interaction formelle n'ait été réalisée.
4.6. Fertilité, grossesse et allaitement
Grossesse
Aucune donnée clinique lors de grossesses exposées au lansoprazole n'est disponible. Les études chez l'animal n'indiquent pas d'effet nocif direct ou indirect concernant la grossesse, le développement embryonnaire/fœtal, l'accouchement ou le développement post-natal.
Par conséquent, l'utilisation du lansoprazole n'est pas recommandée pendant la grossesse.
Allaitement
L'excrétion dans le lait maternel du lansoprazole n'est pas connue. Les études chez l'animal ont montré une excrétion de lansoprazole dans le lait.
La décision de continuer/interrompre l'allaitement ou de continuer/interrompre le traitement par lansoprazole doit prendre en compte le bénéfice de l'allaitement pour l'enfant et le bénéfice du traitement par lansoprazole pour la mère.
Fertilité
Aucune donnée concernant l’effet du lansoprazole sur la fertilité humaine n’est disponible. Le lansoprazole n’a pas eu d’effet sur la fertilité chez les rats mâles et femelles.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Des effets indésirables, tels qu'étourdissements, vertiges, troubles visuels et somnolence, peuvent survenir (voir rubrique 4.8). Dans ces conditions, la capacité à réagir peut être diminuée.
Les fréquences sont définies comme fréquent (≥ 1/100, < 1/10) ; peu fréquent (≥ 1/1,000, < 1/100) ; rare (≥ 1/10°000, < 1/1°000) ; très rare (< 1/10°000) et fréquence indéterminée (ne peut être estimée sur la base des données disponibles).
|
Fréquent |
Peu fréquent |
Rare |
Très rare |
Indéterminée |
||
|
Affections hématologiques et du système lymphatique |
Thrombopénie*, éosinophilie, leucopénie* |
Anémie |
Agranulocytose*, pancytopénie* |
|||
|
Affections du système immunitaire |
|
|
|
Choc anaphylactique* |
|
|
|
Troubles du métabolisme et de la nutrition |
|
|
|
Hyponatrémie* |
Hypomagnésémie* Hypocalcémie* ϯ Hypokaliémie* ϯ |
|
|
Affections psychiatriques |
Dépression |
Insomnie, hallucination, confusion |
Hallucinations visuelles |
|||
|
Affections du système nerveux |
Céphalée, étourdissement |
Instabilité psychomotrice, vertige, paresthésie, somnolence, tremblements |
||||
|
Affections oculaires |
Troubles visuels |
|||||
|
Affections gastro-intestinales |
Nausée, diarrhée, douleurs abdominales, constipation, vomissement, flatulence, sècheresse de la bouche ou de la gorge, polypes des glandes fundiques (bénins) |
Glossite, candidose œsophagienne, pancréatite, altérations du goût |
Colite*, stomatite |
|||
|
Affections hépatobiliaires |
Augmentation du taux des enzymes hépatiques |
Hépatite, ictère |
||||
|
Affections de la peau et du tissu sous-cutané |
Urticaire, prurit, rash |
Pétéchies, purpura, chute de cheveux, érythème polymorphe, photosensibilité |
Syndrome de Steven-Johnson*, nécrolyse épidermique toxique* (syndrome de Lyell) |
Lupus érythémateux cutané subaigu *, réaction médicamenteuse avec éosinophilie et symptômes systémiques (syndrome DRESS)* . |
|
|
|
Affections musculo-squelettiques et systémiques |
Arthralgie, myalgie, fracture de la hanche, du poignet ou des vertèbres |
|
||||
|
Affections du rein et des voies urinaires |
Néphrite tubulo-interstitielle (avec évolution possible vers une insuffisance rénale) |
|
||||
|
Affections des organes de reproduction et du sein |
Gynécomastie |
|
||||
|
Troubles généraux et anomalies au site d’administration |
Fatigue |
Œdème |
Fièvre, hyperhydrose, Œdème de Quincke, anorexie, impuissance |
|
||
|
Investigations |
Augmentation des taux de cholestérol et de triglycérides |
|
||||
* Effets indésirables post-commercialisation
ϯ L'hypocalcémie et/ou l'hypokaliémie peuvent être liées à l'apparition d'une hypomagnésémie (voir section 4.4)
voir rubrique 4.4
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.
Les effets d'un surdosage par lansoprazole chez l'homme ne sont pas connus (bien que la toxicité aiguë soit vraisemblablement faible), et, par conséquent, aucune conduite à tenir concernant le traitement ne peut être précisée. Cependant, des doses quotidiennes allant jusqu'à 180 mg de lansoprazole per os et jusqu'à 90 mg de lansoprazole par voie intraveineuse ont été administrées au cours des essais cliniques sans entraîner d'effets indésirables significatifs.
Veuillez-vous référer à la rubrique 4.8 concernant les symptômes éventuels d'un surdosage de lansoprazole.
Dans le cas d'un surdosage suspecté, le patient doit être surveillé. Le lansoprazole n'est pas significativement éliminé par hémodialyse. Si nécessaire, un lavage gastrique, l'utilisation de charbon, ainsi qu'un traitement symptomatique sont recommandés.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : Médicaments pour l’ulcère peptique et le reflux gastroœsophagien (RGO), Inhibiteurs de la pompe à protons.
Code ATC : A02BC03
Le lansoprazole est un inhibiteur de la pompe à protons gastrique. Il permet d'inhiber le dernier stade de formation de l'acide gastrique en inhibant l'activité de la pompe à protons H+/K+ ATPase au niveau des cellules pariétales de l'estomac. L'inhibition est réversible et dose-dépendante. Ses effets s'exercent à la fois sur les sécrétions d'acide gastrique basale et stimulée. Le lansoprazole se concentre dans les cellules pariétales et devient actif dans leur environnement acide et réagit avec le groupe sulfohydrique de la pompe à protons H+/K+ ATPase entraînant une inhibition de l'activité de l'enzyme.
Effet sur la sécrétion d'acide gastrique :
Le lansoprazole est un inhibiteur spécifique de la pompe à protons des cellules pariétales. Une dose orale unique de 30 mg de lansoprazole inhibe d'environ 80 % la sécrétion d'acide gastrique stimulée par la pentagastrine. Après l'administration quotidienne répétée pendant une période de sept jours, environ 90 % de la sécrétion gastrique est inhibée. Il a un effet semblable sur la sécrétion d'acide gastrique basale. Une administration orale unique de 30 mg réduit la sécrétion basale d'environ 70 %; les symptômes des patients sont donc améliorés dès la première dose. Après 8 jours d'administration répétée, la réduction est d'environ 85 %. Un soulagement rapide des symptômes est obtenu avec un comprimé orodispersible (30 mg) par jour, et la plupart des patients présentant un ulcère duodénal guérissent en 2 semaines, les patients présentant un ulcère gastrique ou une œsophagite par reflux en 4 semaines. En réduisant l'acidité gastrique, le lansoprazole crée un environnement dans lequel les antibiotiques appropriés peuvent être efficaces contre H. pylori.
Pendant le traitement par des médicaments antisécrétoires, la concentration sérique de gastrine augmente en réaction à la diminution de la sécrétion acide.
De même, le taux de CgA augmente à cause de la diminution de l’acidité gastrique. L’augmentation du taux de CgA peut interférer avec les tests réalisés pour l’exploration des tumeurs neuroendocrines.
D’après des données publiées, la prise d’inhibiteurs de la pompe à protons devrait être interrompue entre 5 jours et 2 semaines avant de mesurer le taux de CgA. Le but est de permettre un retour à la normale des taux de CgA qui auraient été artificiellement augmentés par la prise d’IPP.
5.2. Propriétés pharmacocinétiques
Le lansoprazole est un racémique de deux énantiomères actifs qui sont biotransformés en la forme active dans l'environnement acide des cellules pariétales. Etant donné que le lansoprazole est rapidement inactivé par l'acidité gastrique, il est administré per os sous forme gastrorésistante pour une absorption systémique.
Absorption et distribution
La biodisponibilité du lansoprazole en dose unique est élevée (80-90 %). Les concentrations plasmatiques maximales sont atteintes en 1,5 à 2,0 heures. La prise alimentaire ralentit le taux d'absorption du lansoprazole et réduit sa biodisponibilité d'environ 50 %. La liaison aux protéines plasmatiques est de 97 %.
Des études ont montré que les comprimés orodispersibles délités dans une petite quantité d'eau et administrés via une seringue directement dans la bouche ou administrés via une sonde nasogastrique ont une aire sous la courbe (ASC) équivalente à celle du mode d'administration habituel.
Biotransformation et élimination
Le lansoprazole est principalement métabolisé par le foie et les métabolites sont excrétés par les voies rénale et biliaire. Le métabolisme du lansoprazole est principalement catalysé par l'enzyme CYP2C19. L'enzyme CYP3A4 contribue également à son métabolisme. La demi-vie d'élimination plasmatique du lansoprazole est comprise entre 1,0 et 2,0 heures selon les doses unique ou multiples administrées à des sujets sains. Il n'existe pas de preuve d'accumulation après des doses multiples chez des sujets sains. Les dérivés sulfone, sulfite et 5-hydroxyle du lansoprazole ont été identifiés dans le plasma. Ces métabolites ont une activité antisécrétoire faible ou inexistante.
Une étude avec du lansoprazole marqué au 14C indique qu'environ un tiers de la quantité administrée a été excrétée dans l'urine et deux tiers dans les fèces.
Sujets âgés
La clairance du lansoprazole est réduite chez les sujets âgés avec une demi-vie d'élimination augmentée approximativement de 50 % à 100 %. Les concentrations plasmatiques maximales ne sont pas augmentées chez les personnes âgées.
Population pédiatrique
L'évaluation de la pharmacocinétique chez les enfants âgés de 1 à 17 ans a montré une exposition similaire à celle des adultes avec des doses de 15 mg pour ceux pesant moins de 30 kg et 30 mg pour ceux au-dessus. L'étude d'une dose de 17 mg/m2 de surface corporelle ou de 1 mg/kg de poids corporel a montré une exposition comparable du lansoprazole chez les enfants âgés de 2-3 mois à un an comparé aux adultes.
Une plus forte exposition au lansoprazole comparé aux adultes a été signalée chez des enfants de moins de 2-3 mois avec des doses de 1,0 mg/kg et 0,5 mg/kg de poids corporel données en dose unique.
Insuffisance hépatique
L'exposition au lansoprazole est doublée chez les patients présentant une insuffisance hépatique légère et est encore plus forte chez les patients présentant une insuffisance hépatique modérée à sévère.
Métaboliseurs lents du CYP2C19
Le CYP2C19 est sujet à un polymorphisme génétique, et 2 à 6 % de la population, appelée métaboliseurs lents (ML), sont homozygotes pour la mutation allélique du CYP2C19 et présente donc un déficit en enzyme CYP2C19 fonctionnelle. L'exposition au lansoprazole est multipliée plusieurs fois chez les ML par rapport aux métaboliseurs rapides (MR).
5.3. Données de sécurité préclinique
Les données non-cliniques issues des études conventionnelles de pharmacologie de sécurité, toxicologie en administration répétée, toxicité sur les fonctions de reproduction ou génotoxicité, n'ont pas révélé de risque particulier pour l'homme.
Dans deux études de carcinogénicité conduites chez le rat, le lansoprazole a engendré des hyperplasies cellulaires gastriques entérochromaffines (ECL) liées à la dose et des carcinoïdes cellulaires ECL associés à une hypergastrinémie en rapport avec l'inhibition de la sécrétion acide.
Une métaplasie intestinale a également été observée, ainsi qu'une hyperplasie des cellules de Leydig et des tumeurs bénignes des cellules de Leydig.
Après 18 mois de traitement, une atrophie rétinienne a été observée. Ceci n'a pas été constaté chez le singe, le chien et la souris.
Chez la souris, au cours des études de carcinogénicité, sont apparus des hyperplasies cellulaires gastriques entérochromaffines (ECL) liées à la dose, des tumeurs hépatiques et des adénomes du rete testis.
L’importance clinique de ces résultats est inconnue.
Etude sur les animaux juvéniles :
Chez des rats juvéniles, le lansoprazole a été administré du 7ème jour postnatal (âge équivalent à celui des nouveau-nés humains) au 62ème jour postnatal (âge équivalent à environ 14 ans chez l’humain).
Des études sur des rats juvéniles (étude de 8 semaines, étude de titration de la dose toxicocinétique de 6 semaines, étude de sensibilité au développement) ont montré une incidence accrue d’épaississement des valves cardiaques. Les résultats se sont inversés ou ont eu tendance à être réversibles après une période de récupération de 4 semaines sans médicament. Les rats juvéniles de moins de 21 jours (âge équivalent à environ 2 ans chez l’homme) étaient plus sensibles au développement d’un épaississement des valves cardiaques. La marge de sécurité par rapport à l’exposition humaine attendue est de l’ordre de 3 à 6 fois l’exposition dans les études juvéniles sur la base de l’ASC à la dose sans effet observé (no-observed-effect level, NOEL) (étude de 8 semaines, étude de titration de la dose toxicocinétique de 6 semaines) ou à la dose minimale pour laquelle un effet est observé (lowest-observed-effect level, LOEL) (étude de sensibilité au développement).
Ces études ont également montré des modifications des tissus reproducteurs mâles (testicules et épididyme).
De plus, un retard de croissance a été observé chez des rats mâles ou femelles, mais cela n'a entraîné un retard de l'épaisseur du cartilage de croissance fémoral que chez les mâles.
La pertinence de ces résultats pour les patients pédiatriques est inconnue.
Microgranules gastro-résistants :
Sphères de sucre, carbonate de magnésium léger (E504), crospovidone (E1202), hydroxypropylcellulose (E463), copolymère d'acide méthacrylique-acrylate d'éthyle (1:1), citrate de triéthyle (E1505), hydroxyde de sodium (E524) , talc (E553b), polysorbate(E433), macrogol, oxyde de fer rouge (E172), oxyde de fer jaune (E172).
Autres excipients :
Mannitol (E421), cellulose microcristalline (E460), carboxyméthylamidon sodique, crospovidone (E1202), aspartam (E951), laurylsulfate de sodium, hydrogénocarbonate de sodium (E500), acide citrique monohydraté (E330), arôme fraise, stéarate de magnésium.
2 ans.
Après première ouverture du flacon : à conserver 100 jours maximum.
6.4. Précautions particulières de conservation
A conserver dans l'emballage d'origine, à l'abri de l'humidité.
Après première ouverture du flacon : conserver le flacon soigneusement fermé.
6.5. Nature et contenu de l'emballage extérieur
7, 14, 28, 30, 56, 90 ou 98 comprimés sous plaquette pelable (OPA/Aluminium/PVC) et film pelable (papier/PET/Aluminium/HSL).
28 x 1 comprimés sous plaquette unitaire pelable (OPA/Aluminium/PVC) et film pelable (papier/PET/Aluminium/HSL).
7, 14, 28, 30, 56, 90 et ou 98 comprimés sous plaquette thermoformée (OPA/Aluminium/PVC) et film aluminium.
14 x 1, 28 x 1 comprimés sous plaquette thermoformée unitaire (OPA/Aluminium/ PVC) et film aluminium.
30, 100 ou 500 comprimés en flacon (PEHD), avec coton absorbant et bouchon en polypropylène (PP).
Les flacons peuvent être commercialisés avec ou sans étui cartonné en fonction des marchés.
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
Pas d’exigences particulières.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
1 RUE DE TURIN
69007 LYON
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 274 182 9 7 : 7 comprimés sous plaquette pelable (OPA/Aluminium/PVC).
· 34009 274 183 5 8 : 14 comprimés sous plaquette pelable (OPA/Aluminium/PVC).
· 34009 274 184 1 9 : 28 comprimés sous plaquette pelable (OPA/Aluminium/PVC).
· 34009 274 185 8 7 : 30 comprimés sous plaquette pelable (OPA/Aluminium/PVC).
· 34009 274 186 4 8 : 56 comprimés sous plaquette pelable (OPA/Aluminium/PVC).
· 34009 303 173 4 1 : 7 comprimés sous plaquette thermoformée (OPA/Aluminium/PVC).
· 34009 303 264 0 4 : 14 comprimés sous plaquette thermoformée (OPA/Aluminium/PVC).
· 34009 303 173 6 5 : 28 comprimés sous plaquette thermoformée (OPA/Aluminium/PVC).
· 34009 303 173 7 2 : 30 comprimés sous plaquette thermoformée (OPA/Aluminium/PVC).
· 34009 303 173 8 9 : 56 comprimés sous plaquette thermoformée (OPA/Aluminium/PVC).
· 34009 274 187 0 9 : 30 comprimés en flacon (PEHD).
· 34009 275 207 5 4 : 28 comprimés sous plaquette unitaire pelable (OPA/Aluminium/PVC).
· 34009 303 174 0 2 : 28 comprimés sous plaquette thermoformée unitaire (OPA/Aluminium/PVC).
· 34009 303 173 5 8: 14 comprimé sous plaquette thermoformée unitaire (OPA/Aluminium/PVC).
· 34009 585 060 2 4 : 90 comprimés sous plaquette pelable (OPA/Aluminium/PVC).
· 34009 585 061 9 2 : 98 comprimés sous plaquette pelable (OPA/Aluminium/PVC).
· 34009 551 080 2 3 : 90 comprimés sous plaquette thermoformée (OPA/Aluminium/PVC).
· 34009 551 080 3 0 : 98 comprimés sous plaquette thermoformée (OPA/Aluminium/PVC).
· 34009 585 063 1 4 : 100 comprimés en flacon (PEHD).
· 34009 585 064 8 2 : 500 comprimés en flacon (PEHD).
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Liste II.
ANSM - Mis à jour le : 12/09/2025
LANSOPRAZOLE VIATRIS 30 mg, comprimé orodispersible
Lansoprazole
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin, votre pharmacien ou votre infirmier/ère.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que LANSOPRAZOLE VIATRIS 30 mg, comprimé orodispersible et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant de prendre LANSOPRAZOLE VIATRIS 30 mg, comprimé orodispersible ?
3. Comment prendre LANSOPRAZOLE VIATRIS 30 mg, comprimé orodispersible ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver LANSOPRAZOLE VIATRIS 30 mg, comprimé orodispersible ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE LANSOPRAZOLE VIATRIS 30 mg, comprimé orodispersible ET DANS QUELS CAS EST-IL UTILISE ?
Votre médecin peut prescrire Lansoprazole VIATRIS pour le :
· traitement de l'ulcère duodénal (de l’intestin) et de l'ulcère gastrique ;
· traitement de l'inflammation de l'œsophage (œsophagite par reflux) ;
· prévention de l'œsophagite par reflux ;
· traitement des brûlures d'estomac et des régurgitations acides ;
· traitement des infections induites par les bactéries Helicobacter pylori lorsqu'il est prescrit en association avec un antibiotique ;
· traitement ou prévention de l'ulcère duodénal (de l’intestin) ou de l'ulcère gastrique chez les patients nécessitant un traitement par AINS en continu (le traitement par anti-inflammatoires non stéroïdiens (AINS) est prescrit contre la douleur ou l'inflammation) ;
· traitement du syndrome Zollinger-Ellison.
Votre médecin peut avoir prescrit Lansoprazole VIATRIS pour une autre indication ou avec une dose différente de celles indiquées dans cette notice. Suivez les indications de votre médecin pour prendre votre médicament.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT DE PRENDRE LANSOPRAZOLE VIATRIS 30 mg, comprimé orodispersible ?
Ne prenez jamais LANSOPRAZOLE VIATRIS 30 mg, comprimé orodispersible :
· si vous êtes allergique (hypersensible) au lansoprazole ou à l'un des autres composants contenus dans ce médicament (mentionnés dans la rubrique 6).
Avertissements et précautions
Adressez-vous à votre médecin ou votre pharmacien avant de prendre LANSOPRAZOLE VIATRIS :
· si vous avez des problèmes hépatiques. Il se peut que votre médecin doive ajuster la posologie ;
· s'il vous est déjà arrivé de développer une réaction cutanée après un traitement par un médicament réduisant l'acide gastrique similaire au lansoprazole ;
· si vous devez faire un examen sanguin spécifique (Chromogranine A) ;
· si vous avez des réserves corporelles en vitamine B12 diminuées ou des facteurs de risque de diminution du taux de vitamine B12 et que vous prenez du lansoprazole dans le cadre d’un traitement au long cours. Comme tous les agents diminuant l’acidité, le LANSOPRAZOLE VIATRIS peut provoquer une diminution de l’absorption de la vitamine B12.
Ce médicament peut affecter la façon dont votre corps absorbe la vitamine B12, en particulier si vous devez en prendre pendant une longue période. Veuillez contacter votre médecin si vous remarquez l'un des symptômes suivants, qui pourrait indiquer de faibles niveaux de vitamine B12 :
· fatigue extrême ou manque d'énergie ;
· fourmillements ;
· langue douloureuse ou rouge, aphtes ;
· faiblesse musculaire ;
· vision trouble ;
· problèmes de mémoire, confusion, dépression.
Des réactions cutanées graves, notamment un syndrome de Stevens-Johnson, une nécrolyse épidermique toxique et un syndrome d'hypersensibilité médicamenteuse avec éosinophilie et symptômes systémiques (DRESS), ont été rapportées lors d'un traitement par lansoprazole. Arrêtez d'utiliser LANSOPRAZOLE VIATRIS et consultez immédiatement un médecin si vous présentez l'un des symptômes décrits à la rubrique 4.
Si vous développez une éruption cutanée, en particulier au niveau des zones exposées au soleil, consultez votre médecin dès que possible, car vous devrez peut-être arrêter votre traitement par lansoprazole. N'oubliez pas de mentionner également tout autre effet néfaste, comme une douleur dans vos articulations.
Si votre médecin vous a prescrit LANSOPRAZOLE VIATRIS en plus d'autres médicaments destinés au traitement de l'infection causés par la bactérie Helicobacter pylori (antibiotiques) ou avec des anti-inflammatoires afin de traiter la douleur ou une pathologie rhumatismale : lisez également attentivement les notices de ces médicaments.
Votre médecin peut vous demander ou vous a demandé de pratiquer un examen complémentaire appelé endoscopie afin de diagnostiquer votre état pathologique et/ou exclure toute pathologie maligne.
Lors de la prise de LANSOPRAZOLE VIATRIS, une inflammation pourrait apparaître au niveau de vos reins. Les signes et symptômes peuvent inclure une diminution du volume des urines ou la présence de sang dans vos urines et/ou des réactions d’hypersensibilité telles que de la fièvre, une éruption cutanée et une raideur articulaire. Vous devez signaler ces symptômes au médecin traitant.
Si vous prenez LANSOPRAZOLE VIATRIS pendant plus de 3 mois, il est possible que le taux de magnésium dans votre sang diminue. Des faibles taux de magnésium peuvent se traduire par une fatigue, une désorientation, des sensations vertigineuses, des contractions musculaires involontaires, des convulsions, une accélération du rythme cardiaque. Si vous présentez l’un de ces symptômes, veuillez en informer immédiatement votre médecin (voir rubrique 4 « Effets indésirables »). Une diminution des taux de magnésium dans votre sang peut également entraîner une diminution des taux de calcium et de potassium dans votre sang. Par conséquent, votre médecin pourra décider d’effectuer des examens sanguins réguliers pour surveiller votre taux de magnésium.
La prise d’un inhibiteur de la pompe à protons tel que LANSOPRAZOLE VIATRIS, en particulier sur une période supérieure à un an, peut légèrement augmenter le risque de fracture de la hanche, du poignet ou des vertèbres. Prévenez votre médecin si vous souffrez d’ostéoporose ou si vous prenez des corticostéroïdes (qui peuvent augmenter le risque d’ostéoporose).
Si vous prenez LANSOPRAZOLE VIATRIS au long cours (plus d’un an), vous serez probablement soumis(e) à une surveillance médicale régulière. Vous devez faire part à votre médecin de tout nouveau symptôme inhabituel qui surviendrait.
Enfants et adolescents
Sans objet.
Durant le traitement
Si une diarrhée sévère ou persistante survient pendant le traitement avec Lansoprazole VIATRIS, contactez votre médecin immédiatement ; en effet, le lansoprazole a été associé à une légère augmentation des diarrhées infectieuses.
Autres médicaments et LANSOPRAZOLE VIATRIS 30 mg, comprimé orodispersible
Informez votre médecin ou pharmacien si vous prenez, avez récemment pris ou pourriez prendre tout autre médicament, y compris un médicament obtenu sans ordonnance.
En particulier, dites à votre médecin si vous prenez des médicaments contenant une ou plusieurs des substances actives suivantes :
· inhibiteurs de la protéase du VIH tels que l’atazanavir et le nelfinavir (utilisés dans le traitement de l’infection par le VIH) ;
· méthotrexate (utilisé dans le traitement de maladies auto-immunes et du cancer) ;
· kétoconazole (utilisé pour traiter le syndrome de Cushing – lorsque le corps produit un excès de cortisol) ;
· itraconazole (utilisé pour traiter les infections fongiques) ;
· rifampicine (utilisée pour traiter la tuberculose) ;
· digoxine (utilisée pour traiter les problèmes cardiaques) ;
· warfarine (utilisée pour traiter les caillots sanguins) ;
· théophylline (utilisée pour traiter l'asthme) ;
· tacrolimus (utilisé pour empêcher le rejet de greffe) ;
· fluvoxamine (utilisée pour traiter la dépression et d'autres troubles psychiatriques) ;
· anti-acides (utilisés pour traiter les brûlures d'estomac ou les régurgitations acides tels que l’hydroxyde d’aluminium ou le carbonate de magnésium) ;
· sucralfate (utilisé pour cicatriser les ulcères) ;
· millepertuis (Hypericum perforatum) (utilisé pour traiter la dépression légère).
LANSOPRAZOLE VIATRIS 30 mg, comprimé orodispersible avec des aliments et boissons
Sans objet
L’utilisation de Lansoprazole VIATRIS durant la grossesse n’est pas recommandée car il n’y a pas de données disponibles.
La présence de lansoprazole dans le lait maternel n’est pas connue. Discutez avec votre médecin pour savoir s’il est plus avantageux pour vous de continuer à prendre ce médicament ou d'allaiter votre enfant.
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin ou pharmacien avant de prendre ce médicament.
Conduite de véhicules et utilisation de machines
Des effets indésirables, tels que somnolence, vertiges (une sensation de tournis en position assise ou debout), fatigue ou troubles visuels, surviennent parfois chez les patients prenant du lansoprazole. Attention, si vous présentez ces effets indésirables, votre vigilance peut être réduite.
Vous êtes seul responsable de décider si vous êtes apte à conduire un véhicule ou à effectuer d'autres tâches demandant une concentration élevée. A cause de ces effets ou de ces effets indésirables, la prise de ce médicament peut réduire votre capacité à faire ces choses en toute sécurité.
La description de ces effets peut être trouvée dans d'autres rubriques. Veuillez lire l'intégralité de cette notice pour information.
Parlez-en avec votre médecin ou votre pharmacien en cas de doute.
LANSOPRAZOLE VIATRIS, comprimé orodispersible contient du saccharose, de l’aspartam et du sodium.
Ce médicament contient 11,93 mg d’aspartam par comprimé.
L’aspartam contient une source de phénylalanine. Il peut être dangereux pour les personnes atteintes de phénylcétonurie (PCU), une maladie génétique rare caractérisée par l’accumulation de phénylalanine ne pouvant être éliminée correctement.
Ce médicament contient du saccharose.
Si votre médecin vous a informé(e) d’une intolérance à certains sucres, contactez-le avant de prendre ce médicament.
Ce médicament contient moins de 1 mmol (23 mg) de sodium par comprimé, c’est-à-dire qu’il est essentiellement « sans sodium ».
3. COMMENT PRENDRE LANSOPRAZOLE VIATRIS 30 mg, comprimé orodispersible ?
La posologie de LANSOPRAZOLE VIATRIS dépend de votre état pathologique. Les posologies recommandées de LANSOPRAZOLE VIATRIS pour les adultes figurent ci-dessous. Votre médecin pourra parfois vous prescrire une posologie différente et vous indiquera la durée du traitement.
Traitement des brûlures d'estomac et des régurgitations acides : un comprimé orodispersible de 15 mg ou de 30 mg par jour pendant 4 semaines. Si les symptômes persistent, parlez-en à votre médecin. Si vos symptômes ne sont pas atténués : dans un délai de 4 semaines, contactez votre médecin.
Traitement de l'ulcère duodénal (de l’intestin) : un comprimé orodispersible de 30 mg chaque jour pendant 2 semaines.
Traitement de l'ulcère gastrique : un comprimé orodispersible de 30 mg chaque jour pendant 4 semaines.
Traitement de l'inflammation de l'œsophage (œsophagite par reflux) : un comprimé orodispersible de 30 mg chaque jour pendant 4 semaines.
Prévention à long terme de l'œsophagite par reflux : un comprimé orodispersible de 15 mg chaque jour ; il se peut que votre médecin ajuste la posologie à un comprimé orodispersible de 30 mg par jour.
Traitement de l'infection par Helicobacter pylori : la posologie recommandée est un comprimé orodispersible de 30 mg en association avec deux antibiotiques différents le matin et un comprimé orodispersible de 30 mg en association avec deux antibiotiques différents le soir. Le traitement est à prendre tous les jours généralement pendant 7 jours.
Les associations antibiotiques recommandées sont :
· LANSOPRAZOLE VIATRIS 30 mg avec clarithromycine 250-500 mg et amoxicilline 1000 mg.
· LANSOPRAZOLE VIATRIS 30 mg avec clarithromycine 250 mg et métronidazole 400-500 mg.
Si vous êtes traité(e) pour une infection en cas d'ulcère, il est improbable que celui-ci réapparaisse si l'infection est traitée avec succès. Pour que votre médicament agisse le mieux possible, respectez les heures de prise et ne manquez aucune prise.
Traitement de l'ulcère duodénal (de l’intestin) ou de l'ulcère gastrique chez les patients nécessitant un traitement par AINS (anti-inflammatoires non stéroïdiens) en continu : un comprimé orodispersible de 30 mg tous les jours pendant 4 semaines.
Prévention de l'ulcère duodénal (de l’intestin) ou de l'ulcère gastrique chez les patients nécessitant un traitement par AINS (anti-inflammatoires non stéroïdiens) en continu : un comprimé orodispersible de 15 mg chaque jour ; il se peut que votre médecin ajuste la posologie à un comprimé orodispersible de 30 mg par jour.
Syndrome de Zollinger-Ellison : la posologie recommandée est de deux comprimés orodispersibles de 30 mg par jour pour commencer, puis selon votre réponse à LANSOPRAZOLE VIATRIS, votre médecin pourra décider d'ajuster la dose.
Utilisation chez les insuffisants hépatiques
Si vous présentez des problèmes hépatiques sévères ou modérés, votre médecin peut vous prescrire la moitié de la dose recommandée.
Utilisation chez les personnes âgées
Votre médecin peut vous prescrire moins que la dose recommandée si vous êtes âgé(e). La dose maximum recommandée chez les personnes âgées est de 30 mg/jour.
Utilisation chez les enfants
LANSOPRAZOLE VIATRIS ne doit pas être administré chez les enfants.
Comment prendre LANSOPRAZOLE VIATRIS 30 mg, comprimé orodispersible
Pour obtenir les meilleurs résultats, prenez LANSOPRAZOLE VIATRIS au moins 30 minutes avant un repas.
Si vous prenez LANSOPRAZOLE VIATRIS une fois par jour, essayez de le prendre à la même heure chaque jour. Vous pouvez obtenir de meilleurs résultats si vous prenez LANSOPRAZOLE VIATRIS dès que vous vous levez le matin.
Si vous prenez LANSOPRAZOLE VIATRIS deux fois par jour, prenez la première dose le matin, puis la seconde dose le soir.
LANSOPRAZOLE VIATRIS se casse facilement, vous devez donc manipuler les comprimés avec soin. Ne manipulez pas les comprimés avec des mains mouillées car les comprimés peuvent se casser.
LANSOPRAZOLE VIATRIS peut être disponible en plaquettes thermoformées ou pelables.
1. Pour les plaquettes pelables uniquement, tenez la plaquette sur les bords et séparez une alvéole du reste de la plaquette en la détachant délicatement en suivant la ligne de prédécoupage.
2. Retirez délicatement le feuillet. Pour les plaquettes non perforées, veillez à ne pas décoller le dos des comprimés adjacents.
3. Sortez avec précaution le comprimé de son alvéole.
4. Placez le comprimé dans votre bouche. Il se dissout directement dans votre bouche, de sorte qu'il puisse être facilement avalé.
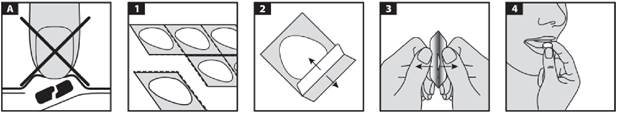
Votre médecin pourrait vous indiquer de prendre le comprimé avec une seringue, si vous rencontrez de sérieuses difficultés à l'avaler.
Si vous utilisez une seringue orale :
· Oter le piston de la seringue (une seringue d'au moins 5 mL pour le comprimé de 15 mg et d’au moins 10 mL pour le comprimé de 30 mg).
· Mettre le comprimé dans le corps de la seringue.
· Remettre le piston sur la seringue.
· Pour le comprimé de 30 mg : aspirer 10 mL d'eau du robinet dans la seringue.
· Retourner la seringue et faire pénétrer 1 mL d'air supplémentaire.
· Secouer doucement la seringue pendant 10-20 secondes jusqu'à ce que le comprimé soit dissout.
· Le contenu peut être vidé directement dans la bouche.
· Remplir à nouveau la seringue avec 2-5 mL d'eau du robinet afin de rincer la seringue et vider la seringue dans la bouche.
· Répéter si nécessaire la dernière étape.
Si vous utilisez une sonde nasogastrique :
Il est important de vérifier que la seringue et la sonde sélectionnées soient appropriées pour cette utilisation. Le diamètre minimum recommandé pour le tube nasogastrique est de 3,3 mm (10 French).
· Oter le piston de la seringue (utiliser une seringue d'au moins 25 mL pour le comprimé de 15 mg et d’au moins 50 mL pour le comprimé de 30 mg).
· Mettre le comprimé dans le corps de la seringue.
· Remettre le piston sur la seringue.
· Pour le comprimé de 30 mg : aspirer 25 mL d'eau du robinet dans la seringue.
· Retourner la seringue et faire pénétrer 5 mL d'air supplémentaire.
· Secouer doucement la seringue pendant 10-20 secondes jusqu'à ce que le comprimé soit dissout.
· Raccorder la seringue sur la sonde et vider le contenu de la seringue dans la sonde gastrique.
· Pour le comprimé de 15 mg : remplir à nouveau la seringue avec 10 mL d'eau du robinet puis vider le contenu de la seringue dans la sonde.
· Pour le comprimé de 30 mg : remplir à nouveau la seringue avec 25 mL d’eau du robinet puis vider le contenu de la seringue dans la sonde.
Si vous avez pris plus de LANSOPRAZOLE VIATRIS 30 mg, comprimé orodispersible que vous n’auriez dû :
Si vous avez pris plus de LANSOPRAZOLE VIATRIS que vous n’auriez dû, demandez immédiatement conseil à votre médecin.
Si vous oubliez de prendre LANSOPRAZOLE VIATRIS 30 mg, comprimé orodispersible :
Si vous oubliez de prendre une dose, prenez-la dès que vous vous en apercevez à moins qu’il ne soit presque temps de prendre la dose suivante. Si tel est le cas, ne prenez pas la dose manquée, et prenez normalement les autres comprimés orodispersibles. Ne prenez pas de dose double pour compenser le comprimé que vous avez oublié de prendre.
Si vous arrêtez de prendre LANSOPRAZOLE VIATRIS 30 mg, comprimé orodispersible :
En cas d’amélioration des symptômes, n’arrêtez pas votre traitement. Il se peut que vous ne soyez pas totalement guéri(e) et que les symptômes réapparaissent.
Si vous avez d'autres questions sur l'utilisation de ce médicament, demandez plus d'informations à votre médecin ou votre pharmacien.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Comme tous les médicaments, ce médicament peut provoquer des effets indésirables, mais ils ne surviennent pas systématiquement chez tout le monde.
Si vous pensez avoir un des effets indésirables graves suivants, arrêtez de prendre ce médicament et contactez immédiatement votre médecin ou rendez-vous au service des urgences de l’hôpital le plus proche :
· Très rarement, LANSOPRAZOLE VIATRIS peut provoquer des réactions d'hypersensibilité (allergiques) sévères. Les symptômes d'une réaction d'hypersensibilité peuvent inclure : fièvre, éruption cutanée, gonflement du visage, des ganglions lymphatiques, de la langue ou du pharynx, difficultés à avaler, urticaire, difficultés respiratoires et parfois une chute de la tension artérielle.
· Très rarement, des réactions cutanées sévères, potentiellement mortelles, ont été rapportées avec LANSOPRAZOLE VIATRIS. Les symptômes incluent : des plaques rougeâtres sur le tronc, des macules en forme de cible ou circulaires, souvent avec des cloques centrales, une desquamation de la peau, des ulcères de la bouche, de la gorge, du nez, des organes génitaux et des yeux. Ces éruptions cutanées graves peuvent être précédées de fièvre et de symptômes pseudo-grippaux [syndrome de Stevens-Johnson (SSJ), nécrolyse épidermique toxique (NET)].
· Éruption cutanée étendue, température corporelle élevée et ganglions lymphatiques enflés [Réaction médicamenteuse avec l'éosinophilie et le syndrome d'hypersensibilité systémique (DRESS, fréquence indéterminée)].
· Si vous prenez LANSOPRAZOLE VIATRIS pendant plus de trois mois, il est possible que votre taux de magnésium sanguin chute. Un faible taux de magnésium peut se manifester par de la fatigue, des contractions musculaires involontaires, une désorientation, des convulsions, des étourdissements et une accélération du rythme cardiaque. Si vous présentez l'un de ces symptômes, veuillez en informer rapidement votre médecin. Un faible taux de magnésium peut également entraîner une diminution des taux de potassium ou de calcium dans le sang. Votre médecin pourra décider de réaliser des analyses sanguines régulières pour surveiller votre taux de magnésium.
· Très rarement, LANSOPRAZOLE VIATRIS peut entraîner une diminution du nombre de globules blancs (agranulocytose) et une diminution de la résistance aux infections, ou une diminution anormale du nombre de globules rouges et blancs, ainsi que de plaquettes (pancytopénie). Si vous présentez une infection accompagnée de symptômes tels que fièvre et détérioration grave de votre état général, ou fièvre accompagnée de symptômes d'infection locale tels que maux de gorge, pharynx, bouche ou problèmes urinaires, ou si vous ressentez de la fatigue, une pâleur accompagnée d'ecchymoses inexpliquées ou des saignements plus longs que la normale, consultez immédiatement un médecin. Une analyse de sang sera effectuée pour vérifier une éventuelle diminution du nombre de globules blancs.
· Rarement, LANSOPRAZOLE VIATRIS peut provoquer une inflammation du pancréas (pancréatite). Ses symptômes incluent des douleurs intenses et soudaines au milieu de la partie supérieure de l'abdomen, pouvant irradier vers le dos, pouvant entraîner des nausées et des vomissements.
· Si une diarrhée sévère ou persistante survient pendant le traitement par LANSOPRAZOLE VIATRIS, contactez immédiatement votre médecin, car LANSOPRAZOLE VIATRIS a été associé à une légère augmentation des diarrhées infectieuses.
Autres effets indésirables possibles
Fréquents (peuvent affecter jusqu’à 1 personne sur 10) :
· maux de tête, sensations vertigineuses ;
· diarrhées, constipation, douleurs d'estomac, nausées ou vomissements, gaz ; bouche ou gorge sèche ou douloureuse
· éruption cutanée, démangeaisons ;
· perturbation du bilan hépatique (foie) ;
· fatigue ;
· polypes bénins dans l’estomac.
Peu fréquents (peuvent affecter jusqu’à 1 personne sur 100) :
· dépression ;
· douleur musculaire ou articulaire ;
· rétention hydrique ou œdème ;
· modifications de la formule sanguine ;
· risque de fracture de la hanche, du poignet et de la colonne vertébrale.
Rares (peuvent affecter jusqu’à 1 personne sur 1 000) :
· fièvre ;
· agitation, somnolence ;
· confusion, entendre, voir ou sentir des choses qui n’existent pas (hallucinations), troubles du sommeil (insomnie) ;
· troubles visuels ;
· sensation de tournis en restant immobile en position debout (vertiges) ;
· altération du goût, perte d'appétit, inflammation de la langue (glossite) ;
· réactions cutanées, telles que sensation de brûlure ou de picotements, hématomes, rougeurs et sudation excessive ;
· photosensibilité ;
· chute des cheveux ;
· fourmillements (paresthésie), tremblements ;
· anémie (pâleur) ;
· inflammation des reins (néphrite tubulo-interstitielle) dont symptômes possibles incluent des modifications de la quantité d'urine, la présence de sang dans les urines ;
· inflammation du foie (pouvant se manifester par un jaunissement de la peau ou des yeux) ;
· gonflement des seins chez les hommes, impuissance ;
· candidose (infection fongique, peut affecter la muqueuse de l'œsophage).
Très rares (peuvent affecter jusqu’à 1 personne sur 10 000) :
· inflammation de la bouche (stomatite) ;
· inflammation intestinale (colite) ;
· augmentation des valeurs de test telles que les taux de cholestérol et de triglycérides ;
· taux bas de sodium dans le sang, les symptômes courants sont les suivants : nausées et vomissements, maux de tête, somnolence et fatigue, confusion, faiblesse ou spasmes musculaires, irritabilité, convulsions, coma. Votre médecin pourra décider d’effectuer des examens sanguins réguliers pour surveiller votre taux de sodium..
Fréquence indéterminée (ne peut être estimée sur la base des données disponibles) :
· formes cutanées de lupus ou éruption cutanée lupique ;
· éruption cutanée, éventuellement accompagnée de douleurs articulaires ;
· hallucinations visuelles.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, votre pharmacien ou à votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr.
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER LANSOPRAZOLE VIATRIS 30 mg, comprimé orodispersible ?
Tenir ce médicament hors de la vue et de la portée des enfants.
Conserver dans l'emballage extérieur d'origine, à l'abri de l'humidité.
Flacons : conserver 100 jours maximum après la première ouverture. Conserver le flacon soigneusement fermé, à l'abri de l'humidité
N’utilisez pas ce médicament après la date de péremption indiquée sur la boîte, la plaquette ou le flacon après EXP. La date de péremption fait référence au dernier jour de ce mois.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient LANSOPRAZOLE VIATRIS 30 mg, comprimé orodispersible
· La substance active est : lansoprazole
· Les autres composants sont : sphères de sucre, carbonate de magnésium léger (E504), crospovidone (E1202), hydroxypropylcellulose (E463), copolymère d'acide méthacrylique-acrylate d'éthyle (1:1), citrate de triéthyle (E1505), hydroxyde de sodium (E524), talc (E553b), polysorbate (E433), macrogol, oxyde de fer rouge (E172), oxyde de fer jaune (E172), mannitol (E421), cellulose microcristalline (E460), carboxyméthylamidon sodique, aspartam (E951), laurilsulfate de sodium, hydrogénocarbonate de sodium (E500), acide citrique monohydraté (E330), arôme fraise et stéarate de magnésium (voir rubrique 2 « Lansoprazole VIATRIS contient du saccharose, de l’aspartam et du sodium »).
Ce médicament se présente sous forme de comprimé orodispersible (forme solide orale) qui se disperse pour libérer des microgranules gastro-résistants.
Comprimé plat, à bords biseautés, rond, blanc à blanc-cassé, avec des taches orange à brun foncé, gravé « LP2 » sur une face et « M » sur l’autre.
Ce médicament est disponible en :
· plaquettes pelables de 7, 14, 28, 30, 56, 90 ou 98 comprimés ;
· plaquettes unitaires pelables de 28x1 comprimés ;
· plaquettes thermoformées de 7, 14, 28, 30, 56, 90 ou 98 comprimés ;
· plaquettes thermoformées unitaires de 14x1, 28x1 comprimés ;
· flacons avec coton absorbant et bouchon à vis contenant 30, 100 ou 500 comprimés.
Toutes les présentations peuvent ne pas être commercialisées.
Titulaire de l’autorisation de mise sur le marché
1 RUE DE TURIN
69007 LYON
Exploitant de l’autorisation de mise sur le marché
1 RUE DE TURIN
69007 LYON
STATION CLOSE, POTTERS BAR,
HERTFORDSHIRE, EN6 1TL
ROYAUME-UNI
OU
Mc DERMOTT LABORATORIES LIMITED TRADING as GERARD LABORATORIES
35/36 BALDOYLE INDUSTRIAL ESTATE,
GRANGE ROAD, DUBLIN 13
IRLANDE
OU
MYLAN HUNGARY KFT
H-2900, KOMAROM MYLAN,
UTCA 1
HONGRIE
OU
MYLAN UK HEALTHCARE LIMITED,
BUILDING 20, STATION CLOSE, POTTERS BAR,
EN6 1TL,
ROYAUME-UNI
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Ce médicament est autorisé dans les Etats membres de l'Espace Economique Européen sous les noms suivants : Conformément à la réglementation en vigueur.
[À compléter ultérieurement par le titulaire]
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
< {MM/AAAA}>< {mois AAAA}.>
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).