Dernière mise à jour le 08/01/2026
MELPHALAN SUN 50 mg, poudre et solvant pour solution injectable/pour perfusion
Indications thérapeutiques
MELPHALAN SUN contient une substance appelée le melphalan. Il appartient à un groupe de médicaments appelés les cytotoxiques (également désignés par le terme « chimiothérapie »). MELPHALAN SUN est utilisé pour traiter le cancer. Il agit en réduisant le nombre de cellules anormales que produit votre organisme.
MELPHALAN SUN est utilisé en cas de :
· myélome multiple (un type de cancer qui se développe à partir des cellules de la moelle osseuse appelées « plasmocytes ». Ces cellules aident à combattre les infections et les maladies en produisant des anticorps.)
· carcinome avancé des ovaires
· neuroblastome chez l’enfant (cancer du système nerveux)
· mélanome malin (cancer de la peau)
· sarcome des tissus mous (cancer des muscles, de la graisse, des tissus fibreux, des vaisseaux sanguins ou d’autres tissus de soutien de l’organisme).
Vous devez vous adresser à votre médecin si vous ne ressentez aucune amélioration ou si vous vous sentez moins bien.
Présentations
> 1 flacon de poudre de 15 mL (verre) + 1 flacon de solvant de 10 mL (verre)
Code CIP : 34009 301 595 5 2
Déclaration de commercialisation : 10/09/2020
Cette présentation est agréée aux collectivités
Service médical rendu (SMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Important | Avis du 05/02/2020 | Inscription (CT) | Le service médical rendu par MELPHALAN SUN 50 mg, poudre et solvant pour solution injectable / pour perfusion est, comme pour ALKERAN 50 mg/10 ml, lyophilisat et solution pour usage parentéral (I.V.) important dans le traitement du myélome multiple et du neuroblastome chez l’enfant. |
| Insuffisant | Avis du 05/02/2020 | Inscription (CT) | Le service médical rendu par MELPHALAN SUN 50 mg, poudre et solvant pour solution injectable / pour perfusion est, comme pour ALKERAN 50 mg/10 ml, lyophilisat et solution pour usage parentéral (I.V.) insuffisant dans le traitement du carcinome ovarien avancé, du mélanome malin localisé des extrémités et du sarcome des tissus mous des extrémités. |
Amélioration du service médical rendu (ASMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprés de la HAS (plus d'informations dans l'aide). Les avis et synthéses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur de l'ASMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| V (Inexistant) | Avis du 05/02/2020 | Inscription (CT) | Cette spécialité est un hybride qui n’apporte pas d’amélioration du service médical rendu (ASMR V) par rapport à la spécialité princeps déjà inscrite. |
Autres informations
- Titulaire de l'autorisation : SUN PHARMACEUTICAL INDUSTRIES EUROPE BV
- Conditions de prescription et de délivrance :
- liste I
- médicament nécessitant une surveillance particulière pendant le traitement
- prescription hospitalière
- prescription réservée aux spécialistes et services CANCEROLOGIE
- prescription réservée aux spécialistes et services HEMATOLOGIE
- prescription réservée aux spécialistes et services ONCOLOGIE MEDICALE
- Statut de l'autorisation : Valide
- Type de procédure : Procédure décentralisée
- Code CIS : 6 225 246 7
ANSM - Mis à jour le : 05/11/2025
MELPHALAN SUN 50 mg, poudre et solvant pour solution injectable / pour perfusion
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Chaque flacon de poudre contient du chlorhydrate de melphalan équivalant à 50 mg de melphalan.
Après reconstitution avec 10 mL de solvant, la solution qui en résulte contient 5 mg/mL de melphalan.
Excipient à effet notoire :
Après reconstitution, chaque flacon contient 0,68 mmol (15,63 mg) de sodium, 0,52 mL (0,4 g) d’éthanol et 6,0 mL de propylène glycol.
Pour la liste complète des excipients, voir rubrique 6.1.
Poudre et solvant pour solution injectable / pour perfusion
Poudre : poudre ou poudre agglomérée, blanche à blanc cassé.
Solvant : une solution liquide limpide, incolore.
Le pH de la solution reconstituée est de 6,5.
4.1. Indications thérapeutiques
A une posologie intraveineuse élevée, le melphalan est indiqué, avec ou sans greffe de cellules souches hématopoïétiques, pour le traitement du myélome multiple et du neuroblastome chez l’enfant.
Le melphalan, administré par perfusion artérielle régionale, est indiqué pour le traitement du mélanome malin localisé des extrémités et du sarcome des tissus mous des extrémités.
Dans les indications ci-dessus, le melphalan peut être utilisé seul ou en association avec d’autres médicaments cytotoxiques.
4.2. Posologie et mode d'administration
Informations générales
Le melphalan est destiné à une utilisation soit en intraveineuse, soit en perfusion artérielle régionale. Le melphalan ne peut être administré sans autogreffe de cellules souches hématopoïétiques à des doses supérieures à 140 mg/m2.
Posologie
Myélome multiple
Dose classique
Le melphalan est administré seul sur une base intermittente ou en association avec d’autres médicaments cytotoxiques. L’administration de prednisone a également été incluse dans de nombreux traitements.
En monothérapie, une posologie typique de melphalan en intraveineuse est de 0,4 mg/kg de poids corporel (16 mg/m2 de surface corporelle) répétée à des intervalles appropriés (par ex. une fois toutes les 4 semaines), à condition qu’il y ait eu un rétablissement de la numération globulaire du sang périphérique au cours de cette période.
Forte dose
Les traitements à forte dose utilisent généralement des doses en intraveineuse uniques entre 100 et 200 mg/m2 de surface corporelle (approximativement 2,5 à 5,0 mg/kg de poids corporel), mais une greffe de cellules souches hématopoïétiques est essentielle en cas d’administration de doses supérieures à 140 mg/m2 de surface corporelle.
Adénocarcinome ovarien
En monothérapie et en intraveineuse, une dose de 1 mg/kg de poids corporel (approximativement 40 mg/m2 de surface corporelle) administrée à des intervalles de 4 semaines est souvent été utilisée.
En association avec d’autres médicaments cytotoxiques, des doses intraveineuses de 0,3 à 0,4 mg/kg de poids corporel (12 à 16 mg/m2 de surface corporelle) sont utilisées à des intervalles de 4 à 6 semaines.
Neuroblastome avancé
Des doses comprises entre 100 et 240 mg/m2 de surface corporelle (parfois réparties de façon égale sur 3 jours consécutifs), assorties d’une greffe de cellules souches hématopoïétiques, sont utilisées seules ou en association avec une radiothérapie et/ou d’autres médicaments cytotoxiques.
Mélanome malin
Une perfusion hyperthermique régionale de melphalan est utilisée comme adjuvant en cas de chirurgie pour un mélanome malin au stade précoce et comme traitement palliatif pour une maladie avancée, mais localisée. Pour des informations détaillées sur la technique de perfusion et le dosage appliqué, il convient de consulter la littérature scientifique. L’intervalle posologique usuel pour les perfusions effectuées dans les membres supérieurs est de 0,6 à 1,0 mg/kg de poids corporel, et pour les perfusions dans les membres inférieurs de 0,8 à 1,5 mg/kg de poids corporel.
Sarcome des tissus mous
Une perfusion hyperthermique régionale de melphalan est utilisée pour la gestion de tous les stades de sarcome des tissus mous localisé, habituellement en association avec la chirurgie. L’intervalle posologique typique pour les perfusions effectuées dans les membres supérieurs est de 0,6 à 1,0 mg/kg de poids corporel, et pour les perfusions dans les membres inférieurs de 1 à 1,4 mg/kg de poids corporel.
Populations particulières
Population pédiatrique
Le melphalan, à des doses classiques, n’est que rarement indiqué chez les enfants et des lignes directrices posologiques ne peuvent être formulées.
Le melphalan à haute dose, en association avec une greffe de cellules souches hématopoïétiques, est utilisé pour le neuroblastome chez l’enfant et des lignes directrices posologiques basées sur la surface corporelle peuvent être utilisées.
Personnes âgées
Bien que le melphalan soit fréquemment utilisé à une dose classique chez les personnes âgées, il n’existe aucune information spécifique disponible sur son administration dans ce sous-groupe de patients. L’expérience relative à l’utilisation de fortes doses de melphalan chez les patients âgés est limitée. Il convient donc de garantir un état des performances et un fonctionnement organique adéquats avant d’utiliser de fortes doses de melphalan chez les patients âgés.
Patients insuffisants rénaux
La clairance du melphalan, bien que variable, peut être réduite en cas d’insuffisance rénale.
Les données de pharmacocinétique actuellement disponibles ne justifient pas une recommandation absolue de réduction posologique à l’administration de melphalan chez les insuffisants rénaux. Toutefois, par prudence, une diminution de la posologie initiale peut être envisagée jusqu’à ce que la tolérance au traitement soit établie.
Lorsque le melphalan est utilisé à une posologie intraveineuse classique (8-40 mg/m2 de surface corporelle), il est recommandé de réduire la dose initiale de moitié et de déterminer le dosage ultérieur en fonction du degré de suppression hématologique.
Pour de fortes doses de melphalan en intraveineuse (100 à 240 mg/m2 de surface corporelle), la nécessité d’une réduction des doses dépend du degré de l’insuffisance rénale, qu’il y ait greffe de cellules souches hématopoïétiques ou non, et des besoins thérapeutiques. Comme référence, pour le traitement par melphalan à fortes doses sans greffe de cellules souches hématopoïétiques chez les patients présentant une insuffisance rénale modérée (clairance de la créatinine 30-50 mL/min.), une réduction de moitié de la dose est habituelle.
Une forte dose de melphalan, assortie d’une greffe de cellules souches hématopoïétiques, est appliquée avec succès même chez les patients dialysés présentant une insuffisance rénale en stade terminal. Pour davantage de détails, il convient de consulter la littérature pertinente.
Événement thromboembolique
Une thromboprophylaxie doit être administrée au moins pendant les 5 premiers mois du traitement, en particulier chez les patients présentant des facteurs de risque de thrombose supplémentaires. La décision de mettre en place des mesures prophylactiques antithrombotiques doit être prise après une évaluation minutieuse des facteurs de risque sous-jacents de chaque patient (voir rubriques 4.4 et 4.8).
La survenue d’un quelconque événement thromboembolique impose l’interruption du traitement et l’initiation d’un traitement par anticoagulant standard. Après stabilisation de l’état du patient sous traitement par anticoagulant et dès que les complications liées à l’événement thromboembolique sont sous contrôle, le melphalan en association avec le lénalidomide et la prednisone ou le thalidomide et la prednisone ou la dexaméthasone peut être recommencé à la dose initiale en fonction de l’évaluation du rapport bénéfice/risque. Le patient doit poursuivre le traitement par anticoagulant tout au long du traitement par melphalan.
Mode d’administration
Pour une administration en intraveineuse, il est recommandé d’administrer le melphalan en l’injectant lentement dans une solution pour perfusion à débit rapide par le biais d’un port d’injection nettoyé. Si l’injection directe dans une perfusion à débit rapide n’est pas appropriée, le melphalan peut être administré dilué dans une poche à perfusion.
Il convient d’être vigilant pour éviter toute extravasation de melphalan et au cas où l’administration intraveineuse directe s'avérerait difficile, on envisagera l’emploi d’un cathéter veineux central.
Si une forte dose de melphalan est administrée avec ou sans greffe autologue de moelle osseuse, une administration par le biais d’un cathéter veineux central est recommandée. Étant donné les dangers éventuels et le niveau de soins de soutien requis (voir rubrique 4.4), l’administration de fortes doses de melphalan doit être limitée à des centres spécialisés, disposant des équipements appropriés, et être uniquement réalisée par des cliniciens expérimentés.
Pour une perfusion artérielle régionale, il convient de consulter la littérature pour une méthodologie détaillée.
Pendant l’administration intraveineuse, protéger le patient d’un contact externe avec le melphalan solution pour injection/perfusion (voir rubrique 4.4).
Injection/perfusion
Pour des instructions relatives à la reconstitution et, si applicable, à la dilution du médicament avant administration, voir rubrique 6.6.
Après reconstitution, le médicament doit présenter l’aspect d’une solution limpide, voir section 6.6.
· Hypersensibilité à la substance active (melphalan) ou à l’un des excipients mentionnés à la rubrique 6.1.
· Allaitement.
4.4. Mises en garde spéciales et précautions d'emploi
L’inoculation d’un vaccin vivant présente le potentiel de causer une infection chez les sujets immunodéprimés. C’est pourquoi les vaccins vivants ne sont pas recommandés.
Les yeux, la peau et les muqueuses des patients doivent être protégés d’un contact avec le melphalan solution pour injection/perfusion ou la solution reconstituée.
Puisque le melphalan est myélosuppresseur, une numération globulaire fréquente est essentielle pendant le traitement et la posologie doit être retardée ou ajustée, si nécessaire.
En cas d’extravasation, le melphalan peut causer des lésions aux tissus locaux. Par conséquent, il ne doit pas être administré par injection directe dans une veine périphérique.
Chez les patients recevant une forte dose de melphalan, il convient d’envisager l’administration prophylactique d’agents anti-infectieux et l’administration de produits sanguins si nécessaire. Il convient de garantir un état de performances et un fonctionnement organique adéquats avant d’utiliser de fortes doses de melphalan.
Le melphalan doit être utilisé avec prudence chez les patients ayant suivi une radiothérapie ou une chimiothérapie récente par rapport à une toxicité médullaire accrue.
Comme pour toute chimiothérapie cytotoxique, des précautions contraceptives adéquates doivent être appliquées lorsque l’un des partenaires reçoit du melphalan, jusqu’à trois mois après la fin du traitement. Dans le cancer ovarien, les méthodes contraceptives non hormonales sont conseillées.
Surveillance
En raison du puissant effet myélosuppresseur du melphalan, il est essentiel d’accorder une attention particulière à la surveillance des numérations globulaires afin d’éviter tout risque de myélosuppression excessive ou d’aplasie médullaire irréversible. Les numérations globulaires peuvent continuer à chuter après l’arrêt du traitement. Dès lors, au premier signe d’une baisse anormalement importante des nombres de leucocytes ou de plaquettes, le traitement doit être interrompu temporairement.
L'incidence de la diarrhée, des vomissements et de la stomatite engendre une toxicité limitant la dose chez les patients ayant reçu des doses intraveineuses élevées de melphalan en association avec une greffe de moelle osseuse autologue. Le traitement préalable à la cyclophosphamide semble réduire la sévérité des dommages gastro-intestinaux induits par le melphalan à forte dose et la littérature devrait être consultée pour plus de détails.
Insuffisance rénale
La clairance du melphalan peut être réduite chez les patients insuffisants rénaux qui peuvent également présenter une myélosuppression urémique. Une diminution posologique peut dès lors s’avérer nécessaire (voir rubrique 4.2). Voir rubrique 4.8 pour les effets indésirables de l’augmentation de l’urée sanguine. Il convient de surveiller étroitement tout signe de surdosage chez les patients insuffisants rénaux.
Événements thromboemboliques
Les patients traités par melphalan en association avec le lénalidomide et la prednisone ou le thalidomide et la prednisone ou la dexaméthasone présentent un risque accru d’événements thromboemboliques (voir rubrique 4.8). Des mesures prophylactiques antithrombotiques doivent être considérées, en particulier chez les patients présentant des facteurs de risques thrombotiques supplémentaires (voir rubriques 4.2 et 4.8).
Mutagénicité
Le melphalan est mutagène chez les animaux et des anomalies chromosomiques sont observées chez des patients traités par ce médicament.
Carcinogénicité (cancers primitifs secondaires)
Le melphalan a été rapporté comme leucémogène. Des cas de leucémies aiguës survenant après un traitement par melphalan pour des maladies telles que l’amyloïdose, le mélanome malin, le myélome multiple, la macroglobulinémie, le syndrome d’agglutination à froid et le carcinome ovarien ont été signalés.
Une étude comparative entre des patientes atteintes d’un carcinome ovarien qui ont reçu des substances alkylantes et des patientes qui n’en ont pas reçu a démontré que l’utilisation de substances alkylantes, dont le melphalan, a sensiblement augmenté l’incidence de leucémies aiguës.
Le risque leucémogène doit être considéré par rapport au bénéfice thérapeutique potentiel de l’utilisation de melphalan.
Tumeurs solides
L’utilisation d’agents alkylants a été associée au développement de cancers primitifs secondaires (CPS). En particulier, le melphalan en association avec le lénalidomide et la prednisone, et dans une moindre mesure, avec le thalidomide et la prednisone, a été associé à un risque accru de tumeurs solides secondaires chez les patients âgés ayant un diagnostic récent de myélome multiple.
Les caractéristiques du patient (par exemple âge, groupe ethnique), l’indication principale et les modalités thérapeutiques (par exemple radiothérapie, greffe), ainsi que les facteurs de risque environnementaux (par exemple tabagisme) doivent être évalués avant l’administration de melphalan.
5 % d’éthanol (alcool)
Ce médicament contient de l’éthanol (alcool) à 5 %, soit l’équivalent de 10 mL de bière ou de 2,4 mL de vin. Nocif pour les patients alcooliques. Doit être pris en considération chez les femmes enceintes ou allaitantes, les enfants et les groupes à haut risque comme les patients souffrant d’une affection hépatique ou d’épilepsie.
Propylène glycol
Ce médicament contient du propylène glycol. Peut causer des symptômes semblables à ceux de l’alcoolisme.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
L’inoculation de vaccins vivants n’est pas recommandée chez des sujets immunodéprimés (voir section 4.4).
Acide Nalidixique
De l’acide nalidixique associé à du melphalan hautement dosé en intraveineuse cause des entérocolites hémorragiques fatales chez l’enfant. Tout traitement combiné de melphalan associé à de l’acide nalidixique doit être évité.
Busulfan
Dans la population pédiatrique, il a été rapporté pour le traitement busulfan-melphalan que l’administration de melphalan moins de 24 heures après la dernière administration orale de busulfan peut influencer le développement de toxicités.
Ciclosporine
Une insuffisance rénale a été décrite chez les patients qui ont subi une greffe médullaire ayant reçu une forte dose de melphalan en intraveineuse et ayant ultérieurement reçu de la ciclosporine pour prévenir toute réaction du greffon contre l’hôte.
4.6. Fertilité, grossesse et allaitement
Contraception des hommes et des femmes en âge de procréer
Comme pour tout traitement cytotoxique, les patients masculins et féminins qui prennent MELPHALAN SUN doivent utiliser des moyens contraceptifs efficaces et fiables jusqu’à trois mois après l’arrêt du traitement. L’utilisation de contraceptifs hormonaux doit être évitée dans le cancer ovarien.
Grossesse
Les données sur l’utilisation du melphalan chez la femme enceinte sont limitées voire inexistantes. Des études menées chez les animaux ont mis en évidence des effets toxiques sur la reproduction (voir rubrique 5.3). Le risque chez l’être humain est inconnu, mais en raison des propriétés mutagènes et de la similarité structurelle du melphalan avec des composés tératogènes connus, il est possible que le melphalan puisse induire des malformations congénitales chez les enfants des patients traités. Le melphalan ne doit pas être utilisé pendant la grossesse, sauf si l’état clinique de la patiente requiert un traitement par melphalan.
Allaitement
On ignore si le melphalan ou ses métabolites sont excrétés dans le lait maternel. En raison de ses propriétés mutagènes, MELPHALAN SUN est contre-indiqué pendant l’allaitement (voir rubrique 4.3).
Fertilité
Le melphalan induit une dépression de la fonction ovarienne chez la femme préménopausée, induisant ainsi une aménorrhée chez un grand nombre de patientes.
Diverses études menées chez les animaux ont démontré que le melphalan peut présenter des effets indésirables sur la spermatogenèse (voir rubrique 5.3). Il se peut dès lors que le melphalan puisse avoir des effets indésirables temporaires ou permanents sur la fertilité masculine. Il est recommandé que les hommes qui suivent un traitement par melphalan ne conçoivent pas d’enfant pendant leur traitement et jusqu’à 3 mois après l’arrêt du traitement. La cryopréservation de sperme avant le traitement est recommandée.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Il n’existe aucune documentation clinique récente pouvant servir de base pour établir la fréquence des effets indésirables de ce produit. Les effets indésirables peuvent varier en incidence en fonction de l’indication et de la dose administrée, ainsi qu’en cas d’administration en association avec d’autres traitements.
La convention suivante est appliquée pour la classification de la fréquence : très fréquent ≥ 1/10, fréquent ≥ 1/100 et < 1/10, peu fréquent ≥ 1/1000 et < 1/100, rare ≥ 1/10 000 et < 1/1 000, très rare < 1/10 000, fréquence indéterminée (ne peut être estimée sur la base des données disponibles).
|
Classe de systèmes d’organes |
Fréquence |
Effets indésirables |
|
Tumeurs bénignes, malignes et non précisées (incl kystes et polypes) |
Fréquence indéterminée |
Leucémie myéloïde aiguë secondaire et syndrome myéolodysplasique (voir rubrique 4.4) |
|
Affections hématologiques et du système lymphatique |
Très fréquent |
Dépression médullaire induisant une leucopénie, une thrombocytopénie, une neutropénie et une anémie |
|
Rare |
Anémie hémolytique |
|
|
Affections du système immunitaire |
Rare |
Réactions allergiques1 (voir « Affections de la peau et du tissus sous-cutané ») |
|
Affections respiratoires, thoraciques et médiastinales |
Rare |
Pneumonite interstitielle et fibrose pulmonaire (mortelles dans certains cas) |
|
Affections gastro-intestinales |
Très fréquent |
Nausées, vomissements et diarrhée, stomatite à forte dose |
|
Rare |
Stomatite à des doses classiques |
|
|
Affections hépatobiliaires |
Rare |
Affections hépatobiliaires allant de tests anormaux de la fonction hépatique à des manifestations cliniques, comme l’hépatite et la jaunisse ; troubles veino-occlusifs à la suite d’un traitement à des doses élevées |
|
Affections de la peau et du tissu sous-cutané |
Très fréquent |
Alopécie à des doses élevées |
|
Fréquent |
Alopécie à des doses classiques |
|
|
Rare |
Éruptions maculopapuleuses et prurit (voir « Affections du système immunitaire ») |
|
|
Affections musculo-squelettiques et systémiques2 |
Très fréquent |
Atrophie musculaire, fibrose musculaire, myalgie, augmentation de la créatine phosphokinase dans le sang |
|
Fréquent |
Syndrome du compartiment |
|
|
Fréquence indéterminée |
Nécrose musculaire, rhabdomyolyse |
|
|
Affections du rein et des voies urinaires |
Fréquent |
Augmentation de l’urée dans le sang3 |
|
Affections des organes de reproduction et du sein |
Fréquence indéterminée |
Azoospermie, aménorrhée |
|
Affections vasculaires4 |
Fréquence indéterminée |
Thrombose veineuse profonde et embolie pulmonaire |
|
Troubles généraux et anomalies au site d’administration |
Très fréquent |
Sensation subjective et passagère de chaleur et/ou de fourmillement |
1Des réactions allergiques au melphalan, comme de l’urticaire, des œdèmes, des éruptions cutanées et des chocs anaphylactiques, ont été peu rapportées à la suite d’un dosage initial ou subséquent, en particulier après une administration en intraveineuse. Un arrêt cardiaque a également été rarement rapporté en association avec de tels événements.
2Uniquement avec une perfusion de melphalan après l’administration d’une perfusion régionale dans le membre
3Une augmentation temporairement significative de l’urée dans le sang a été observée dans les premières phases du traitement par melphalan chez les patients atteints de myélome, présentant des troubles rénaux.
4Parmi les effets indésirables cliniquement significatifs associés à l’utilisation du melphalan en association avec le thalidomide et la prednisone ou la dexaméthasone et, dans une moindre mesure, le melphalan en association avec le lénalidomide et la prednisone : thrombose veineuse profonde et embolie pulmonaire (voir rubriques 4.2 et 4.4).
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr.
Des effets gastro-intestinaux, notamment les nausées, les vomissements et la diarrhée, sont les signes de surdosage oral aigus les plus probables. Les effets immédiats d’un surdosage intraveineux aigus sont des nausées et des vomissements. Des lésions à la muqueuse gastro-intestinale peuvent également s’ensuivre et une diarrhée, quelquefois hémorragique, a été rapportée avec un surdosage. Le principal effet toxique est une myélodépression, induisant une leucopénie, une thrombocytopénie et une anémie.
Traitement
Des mesures générales de soutien, assorties de transfusions appropriées de sang et de plaquettes, doivent être prises si nécessaire et il convient d’envisager une hospitalisation, une prophylaxie par antibiotique, l’utilisation de facteurs de croissance hématologiques.
Il n’existe aucun antidote spécifique. L’hémogramme doit être étroitement surveillé pendant au moins quatre semaines après tout surdosage, jusqu’aux premiers signes de récupération.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Mécanisme d’action
Le melphalan est un agent alkylant bifonctionnel. La formation d’ions carbonium intermédiaires de chacun des deux groupes bis-2-chloroéthyl permet l’alkylation par une liaison covalente avec le 7-N de la guanine dans l’ADN, avec formation de pont entre les deux bris d’ADN. Par ce mécanisme, le melphalan empêche la réplication cellulaire.
5.2. Propriétés pharmacocinétiques
L’absorption du melphalan oral est très variable en termes de délai d’apparition du produit dans le plasma et de pic plasmatique.
Diverses études menées sur la biodisponibilité absolue du melphalan indiquent une biodisponibilité absolue moyenne variant de 56 à 85 %.
La voie intraveineuse peut être utilisée pour éviter les variations d’absorption associées à un traitement myéloablatif.
Distribution
Le melphalan est modérément lié aux protéines plasmatiques. Le taux de fixation aux protéinesplasmatiques est entre 69 % et 78 %. Il a été prouvé que la fixation aux protéines est linéaire dans la fourchette des concentrations plasmatiques habituellement atteintes lors d’un traitement à doses standard, mais qu’elle peut dépendre des concentrations plasmatiques en cas de traitement à doses élevées. L’albumine sérique est la principale protéine de fixation, représentant environ 55 à 60 % de la fixation. 20 % sont liés à l’α-1-glycoprotéine acide. Par ailleurs, des études sur la fixation du melphalan ont révélé l’existence d’un composant irréversible dû à la réaction d’alkylation avec des protéines plasmatiques.
Après perfusion pendant deux minutes de doses allant de 5 à 23 mg/m2 de surface corporelle (approximativement 0,1 à 0,6 mg/kg de poids corporel) chez 10 patients souffrant d’un carcinome ovarien ou d’un myélome multiple, le volume de distribution moyen en steady-state et le volume compartimental central moyen étaient respectivement de 29,1 ± 13,6 litres et de 12,2 ± 6,5 litres.
Chez 28 patients atteints de différentes affections malignes et recevant des doses entre 70 et 200 mg/m2 de surface corporelle en perfusion pendant 2 à 20 min., le volume de distribution moyen en steady-state et le volume compartimental central moyen étaient respectivement de 40,2 ± 18,3 litres et de 18,2 ± 11,7 litres.
Le melphalan franchit de façon limitée la barrière hémato-encéphalique. Plusieurs investigateurs n’ont pas trouvé de quantité mesurable du médicament dans des prélèvements de liquide cérébrorachidien. Une seule étude à doses élevées chez l’enfant a identifié de faibles concentrations (+/- 10 % des concentrations plasmatiques).
Biotransformation
Des données in vivo et in vitro laissent entendre qu’une dégradation spontanée plutôt qu’une métabolisation enzymatique détermine essentiellement la demi-vie du médicament chez l’homme.
Élimination
Chez 13 patients ayant reçu du melphalan par voie orale à 0,6 mg/kg de poids corporel, la durée de demi-vie d’élimination terminale moyenne plasmatique était de 90 ± 57 min., 11 % du médicament étant excrété dans les urines après 24 heures.
Chez 8 patients, après l’injection d’une dose bolus unique de 0,5 à 0,6 mg/kg de poids corporel, les durées de demi-vies initiale et terminale composées étaient respectivement de 7,7 ± 3,3 min. et de 108 ± 20,8 min. Après injection, du monohydroxymelphalan et du dihydroxymelphalan ont été détectés dans le plasma des patients, avec des pics plasmatiques atteints après respectivement 60 et 105 minutes environ. Une durée de demi-vie similaire de 126 ± 6 min. a été observée après ajout in vitro (37 °C) de melphalan dans le sérum des patients.
Ceci laisse entendre que le facteur principal de la demi-vie du produit chez l’homme serait une dégradation spontanée plutôt qu’une métabolisation enzymatique.
Après perfusion pendant deux minutes de doses allant de 5 à 23 mg/m2 de surface corporelle (approximativement 0,1 à 0,6 mg/kg de poids corporel) chez 10 patients souffrant d’un carcinome ovarien ou d’un myélome multiple, les durées de demi-vie initiales et terminales poolées étaient respectivement de 8,1 ± 6,6 min. et de 76,9 ± 40,7 min. La clairance moyenne était de 342,7 ± 96,8 mL/min.
Chez 15 enfants et 11 adultes ayant reçu de fortes doses en intraveineuse de melphalan (140 mg/m2 de surface corporelle) avec une diurèse augmentée, les durées de demi-vies initiale et terminale moyennes étaientrespectivement de 6,5 ± 3,6 min. et de 41,4 ± 16,5 min. Chez 28 patients atteints de différentes affections malignes et recevant des doses de 70 à 200mg/m2 de surface corporelle en perfusion pendant 2 à 20 minutes, les durées de demi-vies initiale et terminale moyennes étaient respectivement de 8,8 ± 6,6 min. et de 73,1 ± 45,9 min. La clairance moyenne était de 564,6 ± 159,1 mL/min.
Chez 11 patients atteints d’un mélanome malin avancé, les durées de demi-vies initiale etterminale moyennes après une perfusion hyperthermique (39 °C) d’un membre inférieur à un dosage de 1,75 mg/kg de poids corporel étaient respectivement de 3,6 ± 1,5 min. et de 46,5 ± 17,2 min. La clairance moyenne était de 55,0 ± 9,4 mL/min.
Populations particulières
Insuffisance rénale
La clairance du melphalan peut être réduite en cas d’insuffisance rénale (voir rubriques 4.2. et 4.4).
Personnes âgées
Aucune corrélation entre l’âge et la clairance du melphalan ou la demi-vie d’éliminationterminale du melphalan n’a été mise en évidence (voir rubrique 4.2).
5.3. Données de sécurité préclinique
Le melphalan est un agent cytostatique et sa mutagénicité n’a donc pas été étudiée en profondeur dans des études précliniques. Le melphalan était mutagène in vivo en raison d’anomalies chromosomiques. Des informations cliniques sur la toxicité potentielle du melphalan sont fournies aux rubriques 4.4 et 4.6.
Toxicité pour la reproduction et la fertilité
Le melphalan était tératogène chez le rat après une exposition à une dose unique dans le cadre d’études sur la reprotoxicité. Dans des études menées sur la reprotoxicité avec des doses répétées, le melphalan était toxique pour la mère et induisait des malformations congénitales, une mort intra-utérine, un retard de croissance et un développement perturbé.
Une dose unique de melphalan chez les souris mâles a induit une cytotoxicité et des anomalies chromosomiques dans les spermatozoïdes. Chez les souris femelles, une réduction du nombre de souriceaux par portée a été observée. Après rétablissement, le nombre de souriceaux par portée a également diminué avec le temps, ce qui était lié à un nombre réduit de follicules.
Acide chlorhydrique
Povidone
Solvant
Eau pour préparations injectables
Citrate de sodium
Propylène glycol
Éthanol
La stabilité physique et chimique du produit après ouverture a été démontrée pendant 1 heure à température ambiante.
D’un point de vue microbiologique, le produit doit être utilisé immédiatement. En cas d’utilisation non immédiate, la durée et les conditions de conservation après ouverture et avant administration relèvent de la responsabilité de l’utilisateur. Tout flacon non utilisé doit être éliminé.
6.4. Précautions particulières de conservation
À conserver à une température ne dépassant pas 30 °C.
Ne pas mettre au réfrigérateur.
A conserver dans l’emballage d’origine, à l’abri de la lumière.
6.5. Nature et contenu de l'emballage extérieur
Flacon en verre transparent équipé d’un bouchon en caoutchouc bromobutyle et d’une bride en aluminium avec un opercule en plastique.
Conditionnement : un flacon contenant 50 mg de melphalan.
Solvant
Flacon en verre transparent de équipé d’un bouchon en caoutchouc bromobutyle et d’une bride en aluminium avec un opercule en plastique.
Conditionnement : un flacon contenant 10 mL de solvant.
6.6. Précautions particulières d’élimination et de manipulation
Manipulation en toute sécurité de MELPHALAN SUN :
MELPHALAN SUN doit être préparé pour l’administration par un professionnel formé, familiarisé avec ses propriétés et les conditions de manipulation en toute sécurité. Se référer aux lignes directrices cytotoxiques locales avant de procéder. Pour des instructions sur l’administration, voir rubrique 4.2.
MELPHALAN SUN doit être préparée dans l’unité aseptique d’une pharmacie équipée d’une hotte à flux laminaire vertical. En l’absence d’un tel équipement, la solution doit être préparée dans un local aménagé à cette fin au sein d’une clinique ou d’un service.
Le personnel chargé de la préparation ou de la manipulation de MELPHALAN SUN doit porter les vêtements de protection suivants :
Gants jetables, en latex chirurgical ou en chlorure de polyvinyle d’une qualité appropriée (les gants en caoutchouc ne sont pas appropriés) ;
Masque chirurgical de qualité adéquate ;
Gants ou lunettes de protection qui doivent être soigneusement lavés à l’eau après usage ;
Tablier jetable.
Dans une installation aseptique, d’autres vêtements adéquats seront requis.
Tout déversement doit immédiatement être épongé (par du personnel portant des vêtements de protection appropriés) à l’aide de serviettes en papier jetables humides, placées après utilisation dans un sac pour déchets à haut risque pour être éliminées conformément à la législation locale en vigueur. Toute surface contaminée doit être lavée abondamment à l’eau.
Si une solution de MELPHALAN SUN entre en contact avec la peau, bien laver immédiatement la peau contaminée avec du savon et de l’eau froide en abondance. Il peut en l’occurrence s’avérer prudent de consulter un médecin.
En cas de contact avec les yeux, irriguer ceux-ci IMMÉDIATEMENT avec un collyre à base de chlorure de sodium. Il convient également de consulter un médecin sans délai. Si un tel collyre n’est pas disponible, on peut utiliser de l’eau en grande quantité.
Les femmes enceintes ou qui tentent d’avoir un enfant, parmi les membres du personnel, doivent éviter de manipuler MELPHALAN SUN.
Préparation d’une solution de melphalan
MELPHALAN SUN doit être préparé à une température de 25 °C, pour la reconstitution de la poudre lyophilisée/agglomérée avec le solvant-diluant fourni.
Reconstitution
Il est important que tant la poudre lyophilisée/agglomérée que le solvant fourni soient à température ambiante avant de procéder à la reconstitution.
10 mL de ce solvant doivent être ajoutés rapidement en une seule fois dans le flacon contenant la poudre lyophilisée. Secouez ensuite vigoureusement (pendant environ 1 minute) jusqu’à l’obtention d’une solution limpide, sans particules visibles.
Si la solution obtenue est trouble, frottez le flacon entre vos paumes pendant quelques minutes afin d'obtenir une solution claire. Réchauffer le diluant dans la main peut faciliter la reconstitution.
Veuillez-vous référer à l'image ci-dessous pour le frottement entre les mains :
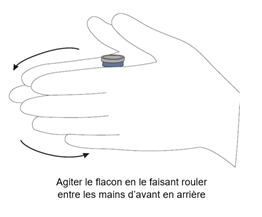
Chaque flacon doit être reconstitué individuellement de cette façon. La solution obtenue contient l’équivalent de 5 mg/mL de melphalan anhydre et a un pH d’environ 6,5.
|
Taille du flacon |
Volume du solvant à ajouter au flacon |
Volume disponible approximatif |
Concentration nominale par mL |
|
50 mg |
10 mL |
10 mL |
5 mg/mL |
La solution de melphalan présente une stabilité limitée et doit être préparée juste avant utilisation.
La solution reconstituée ne doit pas être réfrigérée. Cela en provoquerait la précipitation.
Mélange
Retirez immédiatement la solution reconstituée d’une concentration de 5 mg/mL de melphalan anhydre du flacon reconstitué et à l’aide d’une nouvelle seringue de 10 mL, ajoutez-la dans la poche de perfusion contenant une solution de chlorure de sodium à 0,9 % pour perfusion intraveineuse. Mélangez bien cette solution diluée par des rotations manuelles pour veiller à une concentration nominale de 0,45 mg/mL de melphalan anhydre.
En cas de dilution supplémentaire dans une solution pour perfusion, le melphalan présente une stabilité réduite et sa vitesse de dégradation augmente rapidement avec la hausse de température. Si le melphalan est perfusé à une température d’environ 25 °C, la durée totale entre la préparation de la solution d’injection et la fin de la perfusion ne doit pas excéder 1,5 heure.
Le melphalan n’est pas compatible avec des solutions pour perfusion contenant du dextrose et il est recommandé d’utiliser exclusivement une solution pour perfusion i.v. à base de chlorure de sodium de 0,9 %.
En cas de cristallisation ou de turbidité visible dans les solutions reconstituées ou diluées, la préparation doit être éliminée.
Élimination
Toute solution non utilisée après une heure doit être éliminée conformément aux lignes directrices standard de manipulation et d’élimination de médicaments cytotoxiques.
Les objets pointus, comme les aiguilles, les seringues, les kits d’administration et les ampoules, doivent être placés dans des récipients durs pourvus d’une étiquette de mise en garde appropriée. Le personnel chargé de l’élimination doit être informé sur les précautions à prendre et le matériel doit être incinéré si nécessaire.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
SUN PHARMACEUTICAL INDUSTRIES EUROPE B.V.
POLARIS AVENUE 87
2132 JH HOOFDDORP
PAYS-BAS
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 301 595 5 2 : 1 flacon de poudre de 15 mL (verre) + 1 flacon de solvant de 10 mL (verre)
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Liste I
Prescription hospitalière.
Médicament nécessitant une surveillance particulière pendant le traitement.
Prescription réservée aux spécialistes en CANCEROLOGIE ou HEMATOLOGIE ou ONCOLOGIE MEDICALE.
ANSM - Mis à jour le : 05/11/2025
MELPHALAN SUN 50 mg, poudre et solvant pour solution injectable / pour perfusion
melphalan
Veuillez lire attentivement cette notice avant de prendre ce médicament car elle contient des informations importantes pour vous.
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin ou votre infirmier/ère.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que MELPHALAN SUN 50 mg, poudre et solvant pour solution injectable / pour perfusion et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d'utiliser MELPHALAN SUN 50 mg, poudre et solvant pour solution injectable / pour perfusion ?
3. Comment utiliser MELPHALAN SUN 50 mg, poudre et solvant pour solution injectable / pour perfusion ?
4. Quels sont les effets indésirables éventuels 50 mg, poudre et solvant pour solution injectable / pour perfusion ?
5. Comment conserver MELPHALAN SUN 50 mg, poudre et solvant pour solution injectable / pour perfusion ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE MELPHALAN SUN 50 mg, poudre et solvant pour solution injectable / pour perfusion ET DANS QUELS CAS EST-IL UTILISE ?
MELPHALAN SUN contient une substance appelée le melphalan. Il appartient à un groupe de médicaments appelés les cytotoxiques (également désignés par le terme « chimiothérapie »). MELPHALAN SUN est utilisé pour traiter le cancer. Il agit en réduisant le nombre de cellules anormales que produit votre organisme.
MELPHALAN SUN est utilisé en cas de :
· myélome multiple (un type de cancer qui se développe à partir des cellules de la moelle osseuse appelées « plasmocytes ». Ces cellules aident à combattre les infections et les maladies en produisant des anticorps.)
· carcinome avancé des ovaires
· neuroblastome chez l’enfant (cancer du système nerveux)
· mélanome malin (cancer de la peau)
· sarcome des tissus mous (cancer des muscles, de la graisse, des tissus fibreux, des vaisseaux sanguins ou d’autres tissus de soutien de l’organisme).
Vous devez vous adresser à votre médecin si vous ne ressentez aucune amélioration ou si vous vous sentez moins bien.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER MELPHALAN SUN 50 mg, poudre et solvant pour solution injectable / pour perfusion ?
· vous êtes allergique au melphalan ou à l’un des autres composants contenus dans ce médicament (mentionnés dans la rubrique 6) ;
· vous allaitez.
Avertissements et précautions
Avant d’utiliser MELPHALAN SUN, indiquez à votre médecin si l’une des situations suivantes vous est applicable :
· vous suivez ou avez récemment suivi une radiothérapie ou une chimiothérapie ;
· vous avez un problème rénal ;
· vous allez bientôt être vacciné(e) ou vous l’avez été récemment. En effet, certains vaccins (notamment contre la polio, la rougeole, les oreillons et la rubéole) peuvent vous donner une infection s’ils vous sont inoculés pendant votre traitement par MELPHALAN SUN ;
· vous avez un caillot de sang dans la jambe (thrombose), le poumon (embolie pulmonaire) ou toute autre partie de votre organisme, ou si vous en avez déjà eu un ;
· vous souffrez d’une maladie qui augmente votre risque de développer un caillot de sang dans les artères ;
· les hommes qui prennent MELPHALAN SUN ne doivent pas concevoir d’enfant pendant le traitement et jusqu’à 3 mois après la fin du traitement.
Chez un faible nombre de patients, le melphalan pourrait augmenter le risque d’apparition d’autres types de cancer (tumeurs solides secondaires par exemple), en particulier s’il est utilisé en association avec le lénalidomide, le thalidomide et la prednisone. Votre médecin devra évaluer soigneusement les bénéfices et les risques lorsque MELPHALAN SUN vous est prescrit.
Autres médicaments et MELPHALAN SUN 50 mg, poudre et solvant pour solution injectable / pour perfusion
Informez votre médecin ou votre infirmier/ère si vous prenez ou avez récemment pris un autre médicament, même un médicament obtenu sans ordonnance.
En particulier, informez votre médecin ou votre infirmier si vous prenez l’un des médicaments suivants :
· autres médicaments cytotoxiques (chimiothérapie) ;
· acide nalidixique (un antibiotique utilisé pour traiter les infections des voies urinaires) ;
· ciclosporine (utilisée pour prévenir le rejet à la suite d’une greffe, pour traiter certaines affections cutanées comme le psoriasis et l’eczéma ou pour traiter la polyarthrite rhumatoïde) ;
· vaccins qui contiennent des organismes vivants (voir « Avertissements et précautions ») ;
· chez les enfants, le busulfan (utilisé pour traiter certains types de cancer).
Grossesse, allaitement et fertilité
Grossesse et allaitement
Si vous êtes enceinte, si vous pensez l’être, si vous en avez l’intention ou si vous allaitez, demandez conseil à votre médecin avant d’utiliser ce médicament.
Grossesse
Le traitement par MELPHALAN SUN n’est pas recommandé pendant la grossesse, car il peut causer des dommages permanents au fœtus. Si vous êtes déjà enceinte, il est important d’en parler à votre médecin avant d’utiliser MELPHALAN SUN. Votre médecin examinera les risques et bénéfices, pour vous et votre bébé, d’un traitement par MELPHALAN SUN.
Il convient de prendre des précautions contraceptives fiables pour éviter toute grossesse pendant votre traitement, à vous ou votre partenaire, par cette injection/perfusion.
Allaitement
On ignore si MELPHALAN SUN est excrété dans le lait maternel. N’allaitez pas pendant votre traitement par MELPHALAN SUN.
Fertilité
MELPHALAN SUN peut affecter les ovaires ou les spermatozoïdes, ce qui peut mener à une infertilité (incapacité d’avoir un bébé). Chez la femme, les menstruations peuvent s’arrêter (aménorrhée) et chez l’homme, une absence totale de spermatozoïdes peut être observée (azoospermie) à la suite d’un traitement par MELPHALAN SUN. C’est la raison pour laquelle il est recommandé aux hommes de consulter en vue d’une conservation du sperme préalablement au traitement.
Contraception masculine et féminine
Il est recommandé aux hommes qui utilisent MELPHALAN SUN de ne pas concevoir d’enfant pendant le traitement et jusqu’à 3 mois après la fin du traitement. Parlez-en à votre médecin si vous souhaitez utiliser des contraceptifs efficaces et fiables.
Conduite de véhicules et utilisation de machines
Les effets sur l’aptitude à conduire des véhicules et à utiliser des machines chez les patients prenant ce médicament n’ont pas encore été étudiés. Ce médicament ne devrait pas affecter l’aptitude à conduire des véhicules et à utiliser des machines.
MELPHALAN SUN 50 mg, poudre et solvant pour solution injectable / pour perfusion contient du sodium
Ce médicament contient moins de 2 mmol (46 mg) par dose, ce qui doit être pris en considération chez les patients traités par un régime à faible teneur en sodium.
MELPHALAN SUN 50 mg, poudre et solvant pour solution injectable / pour perfusion contient de l’éthanol (alcool)
Ce médicament contient de l’éthanol (alcool) à 5 %, soit l’équivalent de 10 mL de bière ou de 2,4 mL de vin par dose.
Nocif pour les patients alcooliques.
Doit être pris en considération chez les femmes enceintes ou allaitantes, les enfants et les groupes à haut risque comme les patients souffrant d’une affection hépatique ou d’épilepsie.
MELPHALAN SUN 50 mg, poudre et solvant pour solution injectable / pour perfusion contient du propylène glycol
Peut causer des symptômes semblables à ceux de l’alcoolisme.
3. COMMENT UTILISER MELPHALAN SUN 50 mg, poudre et solvant pour solution injectable / pour perfusion ?
Mode d’administration
MELPHALAN SUN peut être administré
· sous forme de perfusion dans une veine
· dans une artère d'une partie du corps déterminée (perfusion).
En quelle quantité MELPHALAN SUN 50 mg, poudre et solvant pour solution injectable / pour perfusion est-il administré
Votre médecin décidera de la quantité dans laquelle MELPHALAN SUN vous sera administré. La quantité de MELPHALAN SUN dépend de
· votre poids corporel ou de la surface corporelle (une mesure spécifique qui tient compte de votre taille et de votre poids) ;
· tout autre médicament que vous prenez ;
· votre maladie ;
· votre âge ;
· votre insuffisance rénale éventuelle.
Lors de votre traitement par MELPHALAN SUN, votre médecin vous prélèvera régulièrement des échantillons de sang. Le but en est de vérifier le nombre de cellules présentes dans votre sang. Votre médecin peut ajuster votre dose en fonction des résultats de ces tests.
Risque de caillots (événements thromboemboliques)
Votre médecin décidera si vous devez recevoir un traitement préventif contre la formation de caillots dans les veines. Cela vaut pendant les 5 premiers mois de traitement ou si vous présentez un risque accru de développer un caillot dans les veines.
Utilisation chez les enfants
MELPHALAN SUN n’est que rarement utilisé chez l’enfant. Aucune ligne directrice posologique n’est disponible pour l’enfant.
Utilisation chez les personnes âgées
Aucun ajustement posologique spécifique n’est prévu pour les personnes âgées.
Utilisation chez les patients insuffisants rénaux
Si vous souffrez d’une insuffisance rénale, votre médecin vous donnera généralement une dose plus faible que pour tout autre adulte.
Si vous avez utilisé plus de MELPHALAN SU 50 mg, poudre et solvant pour solution injectable / pour perfusion que vous n’auriez dû
Votre médecin vous administrera MELPHALAN SUN. Il est donc peu probable que vous en receviez trop. Si vous pensez en avoir reçu trop ou si vous avez manqué une dose, informez-en votre médecin ou votre infirmier.
Si vous oubliez d’utiliser MELPHALAN SUN 50 mg, poudre et solvant pour solution injectable / pour perfusion
Votre médecin vous administrera MELPHALAN SUN. Il est donc peu probable que vous en manquiez une dose. Si vous pensez avoir manqué une dose, sautez-la et vous recevrez la prochaine dose au prochain moment prescrit. Ne prenez pas de dose double ou n’augmentez pas la quantité de la prochaine dose pour compenser la dose que vous avez oublié de prendre.
Si vous arrêtez d’utiliser MELPHALAN SUN 50 mg, poudre et solvant pour solution injectable / pour perfusion
Si vous avez la sensation que vous devriez arrêter ce médicament, consultez votre médecin avant toute chose.
Si vous avez d’autres questions sur l’utilisation de ce médicament, demandez plus d’informations à votre médecin ou à votre pharmacien.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Effets indésirables graves
Si vous présentez l’un des effets indésirables ci-dessous, parlez-en à votre spécialiste ou rendez-vous immédiatement à l’hôpital :
· réaction allergique, dont les signes peuvent être :
o une éruption cutanée, des boursoufflures ou de l’urticaire sur la peau
o gonflement du visage, des paupières ou des lèvres
o difficultés soudaines à respirer et oppression dans la poitrine
o collapsus (dû à un arrêt cardiaque)
· signe de fièvre ou d’infection (mal de gorge, bouche douloureuse ou problèmes urinaires)
· contusion ou hémorragie inattendue ou fatigue extrême, étourdissement ou essoufflement, car cela pourrait indiquer une production insuffisante de globules rouges d’un type spécifique
· malaise soudain (même à une température normale)
· endolorissement, raideur ou faiblesse musculaire et urine plus foncée qu’à l’accoutumée, brune ou rouge quand MELPHALAN SUN vous est directement administré dans le bras ou la jambe.
Si vous présentez des symptômes de caillots dans les veines, en particulier dans les jambes, parlez-en immédiatement à votre médecin. Les symptômes sont les suivants : gonflement, douleurs et rougeur de la jambe. Les caillots peuvent passer des vaisseaux sanguins aux poumons en induisant des douleurs dans la poitrine et des difficultés respiratoires.
Autres effets indésirables :
Effets indésirables très fréquents (peuvent toucher plus d’1 personne sur 10) :
· fièvre
· baisse du nombre de globules et de plaquettes
· ne pas se sentir bien (nausée), être malade (vomissements) et diarrhée
· ulcères buccaux (à de fortes doses de MELPHALAN SUN)
· perte de cheveux (avec de fortes doses de MELPHALAN SUN)
· picotements ou sensation de chaleur sur le site d’injection de MELPHALAN SUN
· problèmes musculaires, notamment fonte musculaire et myalgie quand MELPHALAN SUN vous est directement administré dans le bras ou la jambe.
Effets indésirables fréquents (peuvent toucher jusqu’à 1 personne sur 10)
· perte de cheveux avec des doses classiques de MELPHALAN SUN
· niveaux élevés du produit chimique appelé « urée » dans le sang, chez les insuffisants rénaux traités pour myélome
· un problème musculaire qui peut causer des douleurs, une raideur, des picotements, des brûlures ou des engourdissements, que l’on appelle « syndrome du compartiment ». Cela peut survenir quand MELPHALAN SUN vous est directement administré dans le bras ou la jambe.
Effets indésirables rares (peuvent toucher jusqu’à 1 personne sur 1 000)
· une maladie qui réduit votre nombre de globules rouges, en raison de leur destruction prématurée. Cela peut induire une grande fatigue, un essoufflement et des vertiges, et peut vous donner des maux de tête ou faire jaunir votre peau ou vos yeux.
· problèmes pulmonaires qui peuvent induire une toux ou une respiration sifflante et des difficultés à respirer
· problèmes hépatiques qui peuvent être détectés dans vos analyses sanguines ou causer une jaunisse (jaunissement du blanc des yeux et de la peau)
· ulcères buccaux à des doses normales de MELPHALAN SUN
· éruptions cutanées ou démangeaisons
Fréquence indéterminée (ne peut être estimée sur la base des données disponibles)
· leucémie (cancer du sang)
· chez la femme : arrêt des menstruations (aménorrhée)
· chez l’homme : absence de spermatozoïdes dans le sperme (azoospermie)
· mort du tissu musculaire (nécrose musculaire)
· dégradation des fibres musculaires (rhabdomyolyse)
· formation d’un caillot, ce que l’on appelle un thrombus, dans une veine profonde, en particulier les jambes (thrombose veineuse profonde) et obstruction d’une artère pulmonaire (embolie pulmonaire).
· Tumeurs solides secondaires
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou à votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER MELPHALAN SUN 50 mg, poudre et solvant pour solution injectable / pour perfusion ?
Tenir hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur l’étiquette et l’emballage extérieur après EXP. La date de péremption fait référence au dernier jour de ce mois.
À conserver à une température ne dépassant pas 30 °C.
Ne pas mettre au réfrigérateur.
A conserver dans l’emballage d’origine, à l’abri de la lumière.
Votre MELPHALAN SUN sera préparé pour une utilisation par un professionnel des soins de santé. Une fois préparé, il doit être utilisé immédiatement et ne doit pas être stocké ni réfrigéré.
Ne jetez aucun médicament au tout-à-l’égout ni avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient MELPHALAN SUN 50 mg, poudre et solvant pour solution injectable / pour perfusion
· La substance active est : le chlorhydrate de melphalan.
Chaque flacon contient du chlorhydrate de melphalan équivalant à 50 mg de melphalan.
· Les autres composants sont : la povidone et l’acide chlorhydrique.
Le melphalan est dissous dans 10 mL de solvant avant d’être injecté. Le solvant contient de l’eau pour préparations injectables, du citrate de sodium, du propylène glycol et de l’éthanol anhydre.
Chaque pack de MELPHALAN SUN contient un flacon de MELPHALAN SUN poudre et un flacon de solvant. Le flacon de poudre contient 50 mg de substance active melphalan en poudre et le flacon de solvant contient 10 mL de solvant dans lequel la poudre sera reconstituée (dissoute).
La poudre est une poudre ou une poudre agglomérée, de couleur blanche à blanc cassé et le solvant est une solution liquide limpide, incolore.
Après reconstitution avec 10 mL de solvant, la solution qui en résulte contient 5 mg/mL de melphalan.
Titulaire de l’autorisation de mise sur le marché
SUN PHARMACEUTICAL INDUSTRIES EUROPE B.V.
POLARIS AVENUE 87
2132 JH HOOFDDORP
PAYS-BAS
Exploitant de l’autorisation de mise sur le marché
31 RUE DES POISSONNIERS
92200 NEUILLY-SUR-SEINE
SUN PHARMACEUTICAL INDUSTRIES EUROPE B.V.
POLARIS AVENUE 87
2132 JH HOOFDDORP
PAYS-BAS
OU
TERAPIA SA
STR. FABRICII NR. 124
400 632 CLUJ NAPOCA
ROUMANIE
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Ce médicament est autorisé dans les Etats membres de l'Espace Economique Européen sous les noms suivants : Conformément à la réglementation en vigueur.
[à compléter ultérieurement par le titulaire]
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).
Les informations suivantes sont destinées exclusivement aux professionnels de la santé.
Manipulation en toute sécurité de MELPHALAN SUN :
MELPHALAN SUN doit être préparé pour l’administration par un professionnel formé, familiarisé avec ses propriétés et les conditions de manipulation en toute sécurité. Se référer aux lignes directrices cytotoxiques locales avant de procéder. Pour des instructions sur l’administration, voir rubrique 4.2.
MELPHALAN SUN doit être préparée dans l’unité aseptique d’une pharmacie équipée d’une hotte à flux laminaire vertical. En l’absence d’un tel équipement, la solution doit être préparée dans un local aménagé à cette fin au sein d’une clinique ou d’un service.
Le personnel chargé de la préparation ou de la manipulation de MELPHALAN SUN doit porter les vêtements de protection suivants :
Gants jetables, en latex chirurgical ou en chlorure de polyvinyle d’une qualité appropriée (les gants en caoutchouc ne sont pas appropriés) ;
Masque chirurgical de qualité adéquate ;
Gants ou lunettes de protection qui doivent être soigneusement lavés à l’eau après usage ;
Tablier jetable.
Dans une installation aseptique, d’autres vêtements adéquats seront requis.
Tout déversement doit immédiatement être épongé (par du personnel portant des vêtements de protection appropriés) à l’aide de serviettes en papier jetables humides, placées après utilisation dans un sac pour déchets à haut risque pour être éliminées conformément à la législation locale en vigueur. Toute surface contaminée doit être lavée abondamment à l’eau.
Si une solution de MELPHALAN SUN entre en contact avec la peau, bien laver immédiatement la peau contaminée avec du savon et de l’eau froide en abondance. Il peut en l’occurrence s’avérer prudent de consulter un médecin.
En cas de contact avec les yeux, irriguer ceux-ci IMMÉDIATEMENT avec un collyre à base de chlorure de sodium. Il convient également de consulter un médecin sans délai. Si un tel collyre n’est pas disponible, on peut utiliser de l’eau en grande quantité.
Les femmes enceintes ou qui tentent d’avoir un enfant, parmi les membres du personnel, doivent éviter de manipuler MELPHALAN SUN.
Préparation d’une solution MELPHALAN SUN :
MELPHALAN SUN doit être préparé à une température de 25 °C, pour la reconstitution de la poudre lyophilisée/agglomérée avec le solvant-diluant fourni.
Reconstitution
Il est important que tant la poudre lyophilisée/agglomérée que le solvant fourni soient à température ambiante avant de procéder à la reconstitution.
10 mL de ce solvant doivent être ajoutés rapidement en une seule fois dans le flacon contenant la poudre lyophilisée. Secouez ensuite vigoureusement (pendant environ 1 minute) jusqu’à l’obtention d’une solution limpide, sans particules visibles.
Si la solution obtenue est trouble, frottez le flacon entre vos paumes pendant quelques minutes afin d'obtenir une solution claire. Réchauffer le diluant dans la main peut faciliter la reconstitution.
Veuillez-vous référer à l'image ci-dessous pour le frottement entre les mains :
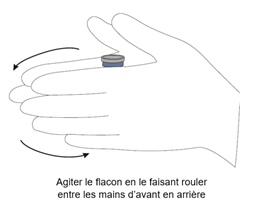
Chaque flacon doit être reconstitué individuellement de cette façon. La solution obtenue contient l’équivalent de 5 mg/mL de melphalan anhydre et a un pH d’environ 6,5.
|
Taille du flacon |
Volume du solvant à ajouter au flacon |
Volume disponible approximatif |
Concentration nominale par mL |
|
50 mg |
10 mL |
10 mL |
5 mg/mL |
La solution MELPHALAN SUN présente une stabilité limitée et doit être préparée juste avant utilisation.
La solution reconstituée ne doit pas être réfrigérée. Cela en provoquerait la précipitation.
Mélange
Retirez immédiatement la solution reconstituée d’une concentration de 5 mg/mL de melphalan anhydre du flacon reconstitué et à l’aide d’une nouvelle seringue de 10 mL, ajoutez-la dans la poche de perfusion contenant une solution de chlorure de sodium à 0,9 % pour perfusion intraveineuse. Mélangez bien cette solution diluée par des rotations manuelles pour veiller à une concentration nominale de 0,45 mg/mL de melphalan anhydre.
En cas de dilution supplémentaire dans une solution pour perfusion, le melphalan présente une stabilité réduite et sa vitesse de dégradation augmente rapidement avec la hausse de température. Si le melphalan est perfusé à une température d’environ 25 °C, la durée totale entre la préparation de la solution d’injection et la fin de la perfusion ne doit pas excéder 1,5 heure.
Le melphalan n’est pas compatible avec des solutions pour perfusion contenant du dextrose et il est recommandé d’utiliser exclusivement une solution pour perfusion i.v. à base de chlorure de sodium de 0,9 %.
En cas de cristallisation ou de turbidité visible dans les solutions reconstituées ou diluées, la préparation doit être éliminée.
Élimination
Toute solution non utilisée après une heure doit être éliminée conformément aux lignes directrices standards de manipulation et d’élimination de médicaments cytotoxiques.
Les objets pointus, comme les aiguilles, les seringues, les kits d’administration et les ampoules, doivent être placés dans des récipients durs pourvus d’une étiquette de mise en garde appropriée. Le personnel chargé de l’élimination doit être informé sur les précautions à prendre et le matériel doit être incinéré si nécessaire.