Dernière mise à jour le 12/08/2025
NEFOPAM VIATRIS 20 mg/2 ml, solution injectable
Présentations
> 5 ampoule(s) en verre de 2 ml
Code CIP : 358 765-5 ou 34009 358 765 5 3
Déclaration de commercialisation : 01/07/2021
Cette présentation est agréée aux collectivités
- Prix hors honoraire de dispensation : 2,58 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 3,60 €
- Taux de remboursement :65%
> 10 ampoule(s) en verre de 2 ml
Code CIP : 358 766-1 ou 34009 358 766 1 4
Déclaration de commercialisation : 17/11/2010
Cette présentation est agréée aux collectivités
Service médical rendu (SMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Important | Avis du 08/09/2010 | Inscription (CT) | Le service médical rendu par cette spécialité est important. |
Amélioration du service médical rendu (ASMR)
Ce médicament étant un générique, l'ASMR n'a pas été évalué par la commission de la transparence (CT), il est possible de se référer à la /aux spécialité(s) de référence du groupe générique auquel appartient ce médicament (cliquez ici pour aller à la rubrique des groupes génériques)
ANSM - Mis à jour le : 02/07/2025
NEFOPAM VIATRIS 20 mg/2 ml, solution injectable
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Chlorhydrate de néfopam ..................................................................................................... 20 mg
Excipient à effet notoire : sodium
Ce médicament contient 5,16 mg de sodium par ampoule de 2 mL.
Pour la liste complète des excipients, voir rubrique 6.1.
4.1. Indications thérapeutiques
4.2. Posologie et mode d'administration
Comme pour tous les médicaments antalgiques, la posologie doit être adaptée à l'intensité de la douleur et à la réponse clinique de chaque patient.
· Voie IM: NEFOPAM VIATRIS 20 mg/2 ml doit être administré en IM profonde. La dose usuelle recommandée est de 20 mg par injection. Si nécessaire, elle peut être répétée toutes les 6 heures sans dépasser une dose totale de 120 mg/24 heures.
· Voie IV: NEFOPAM VIATRIS 20 mg/2 ml doit être administré en perfusion IV lente sur plus de 15 minutes, le patient étant en décubitus, afin d'éviter la survenue d'effets indésirables (nausées, vertiges, sueurs). La dose unique usuelle recommandée est de 20 mg par injection, répétée toutes les 4 heures, si nécessaire, sans dépasser une dose totale de 120 mg/24 heures.
Mode d’administration
NEFOPAM VIATRIS 20 mg/2 ml peut être administré dans les solutions usuelles pour perfusion (solution isotonique de chlorure de sodium ou glucosée). Il est recommandé d'éviter de mélanger dans la même seringue NEFOPAM VIATRIS 20 mg/2 ml et d'autres spécialités injectables.
· Hypersensibilité à la substance active ou à l’un des excipients mentionnés à la rubrique 6.1.
· Enfant de moins de 15 ans, en l'absence d'étude clinique,
· Convulsions ou antécédents de troubles convulsifs,
· Risques de rétention urinaire liés à des troubles urétroprostatiques,
· Risque de glaucome par fermeture de l'angle.
4.4. Mises en garde spéciales et précautions d'emploi
Mises en garde
Il existe un risque de pharmacodépendance avec NEFOPAM VIATRIS 20 mg/2 ml.
NEFOPAM VIATRIS 20 mg/2 ml n'est ni un morphinique, ni un antagoniste des morphiniques. De ce fait, arrêter un morphinique chez un patient physiquement dépendant, et traité par NEFOPAM VIATRIS 20 mg/2 ml, risque d'aboutir à un syndrome de sevrage.
Le rapport bénéfice/risque du traitement par NEFOPAM VIATRIS 20 mg/2 ml doit être régulièrement réévalué.
NEFOPAM VIATRIS 20 mg/2 ml n'est pas indiqué dans le traitement des affections douloureuses chroniques.
Précautions particulières d'emploi
Il conviendra d'être particulièrement prudent en cas :
· D’insuffisance hépatique,
· D’insuffisance rénale, en raison du risque d'accumulation et donc du risque augmenté d'effet indésirable,
· Chez tous les patients avec pathologie cardiovasculaire en raison de l'effet tachycardisant du produit (voir rubriques 4.5 et 4.8),
· En raison de ces effets anticholinergiques, le traitement par NEFOPAM VIATRIS 20 mg/2 ml est déconseillé chez le sujet âgé.
Excipient :
Ce médicament contient moins de 1 mmol (23 mg) de sodium par ampoule, c’est-à-dire qu’il est essentiellement « sans sodium ».
Ce médicament contient 30,95 mg de sodium par dose maximale de 6 ampoules, ce qui équivaut à 1,55 % de l’apport alimentaire quotidien maximal recommandé par l’OMS de 2 g de sodium par adulte.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Il faut prendre en compte le fait que de nombreux médicaments ou substances peuvent additionner leurs effets dépresseurs du système nerveux central et contribuer à diminuer la vigilance. Il s'agit des dérivés morphiniques (analgésiques, antitussifs et traitements de substitution), des neuroleptiques, des barbituriques, des benzodiazépines, des anxiolytiques autres que les benzodiazépines (par exemple, le méprobamate), des hypnotiques, des antidépresseurs sédatifs (amitriptyline, doxépine, miansérine, mirtazapine, trimipramine), des antihistaminiques H1 sédatifs, des antihypertenseurs centraux, du baclofène et du thalidomide.
· Consommation d’alcool
Majoration par l'alcool de l'effet sédatif de ces substances.
L'altération de la vigilance peut rendre dangereuse la conduite de véhicules et l'utilisation de machines.
Eviter la prise de boissons alcoolisées et de médicaments contenant de l'alcool.
Associations à prendre en compte
· Autres médicaments sédatifs
Dérivés morphiniques (analgésiques, antitussifs et traitements de substitution), neuroleptiques, barbituriques, benzodiazépines, anxiolytiques autres que les benzodiazépines (par exemple, le méprobamate), hypnotiques, antidépresseurs sédatifs (amitriptyline, doxépine, miansérine, mirtazapine, trimipramine), antihistaminiques H1 sédatifs, antihypertenseurs centraux, baclofène et thalidomide.
Majoration de la dépression centrale. L’altération de la vigilance peut rendre dangereuses la conduite de véhicules et l’utilisation de machines.
4.6. Fertilité, grossesse et allaitement
En l'absence d'étude chez l'animal et de données cliniques humaines, le risque n'est pas connu ; par conséquent, par mesure de prudence, ne pas prescrire pendant la grossesse, ni pendant l'allaitement.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Les effets indésirables qui ont été rapportés sont classés ci-dessous par système-organe et par fréquence comme définies ci-après: très fréquents (> 1/10), fréquents (> 1/100, < 1/10), peu fréquents (> 1/1.000, < 1/100) et rares (> 1/10.000, < 1/1.000) et indéterminées (ne peut être estimée sur la base des données disponibles).
|
Système -Organe |
Très fréquents |
Fréquents |
Rares |
Indéterminées |
|
Psychiatrie |
|
|
Excitabilité*, irritabilité*, hallucination, abus, pharmacodépendance |
Etat confusionnel |
|
Système Nerveux Central |
Somnolence |
Vertige* |
Convulsion* |
Coma |
|
Cœur |
|
Tachycardie*, palpitation* |
|
|
|
Gastro-intestinal |
Nausée avec ou sans vomissement |
Bouche sèche* |
|
|
|
Rein |
|
Rétention urinaire |
|
|
|
Général |
Hyperhydrose* |
|
Malaise |
|
|
Système immunitaire |
|
|
Réaction d'hypersensibilité (urticaire, œdème de Quincke, choc anaphylactique) |
|
|
Troubles généraux et anomalies au site d'administration |
|
|
|
Douleur au site d'injection |
*Bien que n'ayant jamais été rapportés, d'autres effets atropiniques que ceux décrits sont susceptibles d'être constatés.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/
Symptômes
Ce sont des manifestations de type anticholinergique: tachycardie, coma, convulsions et hallucinations (voir rubrique 4.4).
Traitement
Traitement symptomatique avec surveillance cardiaque et respiratoire, en milieu hospitalier.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
· Analgésique central non morphinique, NEFOPAM VIATRIS 20 mg/2 ml possède une structure chimique non apparentée à celle des antalgiques actuellement connus.
· In vitro, sur des synaptosomes de rat, une inhibition de la recapture des catécholamines et de la sérotonine est évoquée.
· In vivo, chez l'animal, le néfopam a montré des propriétés antinociceptives. Il a également été démontré une activité antihyperalgésiques par un mécanisme qui n'est pas complètement élucidé.
· Le néfopam a montré un effet sur le frisson post-opératoire au cours d'études cliniques.
· Le néfopam n'a aucune action anti-inflammatoire ou antipyrétique. Il n'entraîne pas de dépression respiratoire et ne ralentit pas le transit intestinal.
· Le néfopam possède une activité anticholinergique.
Sur le plan hémodynamique, il a été observé une augmentation modérée et transitoire de la fréquence cardiaque et de la pression artérielle.
5.2. Propriétés pharmacocinétiques
Absorption
Après administration d'une dose de 20 mg par voie IM, le pic plasmatique (Tmax) est situé entre 0,5 et 1 heure et les concentrations maximales (Cmax) sont en moyenne de 25 ng/ml. La demi-vie plasmatique moyenne est de 5 heures.
Lors d'une administration par voie IV d'une même dose, la demi-vie plasmatique moyenne est de 4 heures.
Distribution
La liaison aux protéines plasmatiques est de 71-76 %.
Biotransformation
La biotransformation est importante et 3 métabolites majeurs ont été identifiés : le déméthyl-néfopam, le N-oxyde-néfopam et le N-glucuronide-néfopam. Les deux premiers métabolites, non conjugués, n'ont pas montré d'activité analgésique chez l'animal.
Élimination
L'élimination est essentiellement urinaire : 87 % de la dose administrée sont retrouvés dans les urines.
Moins de 5 % de la dose sont excrétés sous forme inchangée ; les métabolites identifiés dans les urines représentent respectivement 6 %, 3 %, et 36 % de la dose administrée par voie IV.
5.3. Données de sécurité préclinique
3 ans.
6.4. Précautions particulières de conservation
Ce médicament ne nécessite pas de précautions particulières de conservation.
6.5. Nature et contenu de l'emballage extérieur
2 ml en ampoule (verre type I); boîtes de 1, 5, 10 ou 20.
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
Pas d’exigences particulières.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
1 RUE DE TURIN
69007 LYON
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· CIP 358 764-9 ou 34009 358 764 9 2 : 2 ml en ampoule (verre type I). Boîte de 1.
· CIP 358 765-5 ou 34009 358 765 5 3 : 2 ml en ampoule (verre type I). Boîte de 5.
· CIP 358 766-1 ou 34009 358 766 1 4 : 2 ml en ampoule (verre type I). Boîte de 10.
· CIP 576 865-1 ou 34009 576 865 1 2 : 2 ml en ampoule (verre type I). Boîte de 20.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Liste I.
ANSM - Mis à jour le : 02/07/2025
NEFOPAM VIATRIS 20 mg/2 ml, solution injectable
Chlorhydrate de néfopam
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin ou votre pharmacien.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que NEFOPAM VIATRIS 20 mg/2 ml, solution injectable et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d'utiliser NEFOPAM VIATRIS 20 mg/2 ml, solution injectable ?
3. Comment utiliser NEFOPAM VIATRIS 20 mg/2 ml, solution injectable ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver NEFOPAM VIATRIS 20 mg/2 ml, solution injectable ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE NEFOPAM VIATRIS 20 mg/2 ml, solution injectable ET DANS QUELS CAS EST-IL UTILISE ?
Traitement symptomatique de la douleur aiguë, notamment de la douleur post-opératoire.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER NEFOPAM VIATRIS 20 mg/2 ml, solution injectable ?
N’utilisez jamais NEFOPAM VIATRIS 20 mg/2 ml, solution injectable :
· si vous êtes allergique à la substance active ou à l’un des autres composants contenus dans ce médicament, mentionnés dans la rubrique 6.En cas de glaucome à angle fermé (augmentation de la pression à l'intérieur de l'œil),
· Si vous avez des difficultés pour uriner d'origine prostatique,
· En cas de convulsions ou antécédents de convulsion,
· Chez les enfants de moins de 15 ans.
Avertissements et précautions
Adressez-vous à votre médecin ou pharmacien avant d’utiliser NEFOPAM VIATRIS 20 mg/2 ml, solution injectable.
Il existe un risque de dépendance avec NEFOPAM VIATRIS 20 mg/2 ml.
En cas d’utilisation conjointe d’un médicament dérivé de la morphine, l’arrêt brutal de ce médicament dérivé de la morphine peut provoquer un syndrome de sevrage. NEFOPAM VIATRIS 20 mg/2 ml n’étant pas un médicament dérivé de la morphine.
Utiliser ce médicament avec précaution :
· en cas d'insuffisance hépatique,
· en cas d'insuffisance rénale,
· chez les patients présentant une pathologie cardiovasculaire en raison de l'effet tachycardisant de ce médicament (augmentation de la fréquence cardiaque).
· En raison de ses effets anticholinergiques, le traitement par NEFOPAM VIATRIS 20 mg/2 ml est déconseillé chez le sujet âgé.
Enfants et adolescents
Sans objet.
Autres médicaments et NEFOPAM VIATRIS 20 mg/2 ml, solution injectable
NEFOPAM VIATRIS 20 mg/2 ml peut interagir avec d'autres médicaments.
Informez votre médecin ou pharmacien si vous utilisez, avez récemment utilisé ou pourriez utiliser tout autre médicament.
NEFOPAM VIATRIS 20 mg/2 ml, solution injectable avec des aliments et des boissons
Sans objet.
L'effet de ce médicament pendant la grossesse ou l'allaitement étant mal connu, la prise de ce médicament est déconseillée en cas de grossesse et d'allaitement.
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin ou pharmacien avant de prendre ce médicament.
Conduite de véhicules et utilisation de machines
En raison d'un risque éventuel de somnolence, les conducteurs et utilisateurs de machines devront être vigilants.
Excipient :
Ce médicament contient moins de 1 mmol (23 mg) de sodium par ampoule, c’est-à-dire qu’il est essentiellement « sans sodium ».
Ce médicament contient 30,95 mg de sodium (composant principal du sel de cuisine/table) par dose maximale de 6 ampoules. Cela équivaut à 1,55 % de l’apport alimentaire quotidien maximal recommandé de sodium pour un adulte.
3. COMMENT UTILISER NEFOPAM VIATRIS 20 mg/2 ml, solution injectable ?
La posologie est strictement individuelle.
Elle est généralement de 1 ampoule (voie IV ou voie IM) par prise, à renouveler jusqu'à 6 ampoules par jour si nécessaire.
Mode et voie d'administration
NEFOPAM VIATRIS 20 mg/2 ml peut être administré par voie intramusculaire (IM) profonde ou en perfusion intraveineuse (IV) lente (de plus de 15 minutes).
Par voie intraveineuse, il est nécessaire d'être allongé pour éviter la survenue d'effets indésirables tels que nausées, vertiges et sueurs.
Mode d’emploi pour l’ouverture des ampoules
Les ampoules sont munies d’un système d’ouverture OPC (One point Cut) et doivent être cassées selon les instructions suivantes:

· Tapoter doucement sur la tête de l’ampoule avec le doigt pour faire descendre la solution dans le bas de l’ampoule.
· Tenir fermement le bas de l’ampoule, le point coloré face à vous, l’ampoule inclinée sur le côté (voir figure 1).
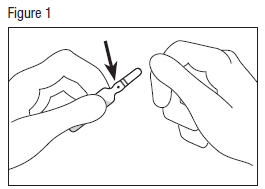
· Saisir la tête de l’ampoule avec l’autre main, entre le pouce et l’index (le pouce sur le point coloré), puis exercer une pression vers l’extérieur, d’un mouvement sec (voir figure 2).
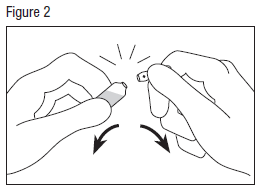
Il est possible d’utiliser un mouchoir ou une compresse comme protection.
· Vérifier l’absence de particules de verre dans la solution contenue dans l’ampoule.
· Les bords en verre au niveau de l'ouverture peuvent être tranchants, soyez prudent lorsque vous manipulez l'ampoule.
Fréquence d'administration
Les injections pourront être renouvelées toutes les 6 heures (voie IM) ou toutes les 4 heures (voie IV).
Durée du traitement
La durée du traitement prescrit par votre médecin doit être scrupuleusement respectée.
Si vous avez utilisé plus de NEFOPAM VIATRIS 20 mg/2 ml, solution injectable que vous n’auriez dû
Le surdosage accidentel peut éventuellement conduire à des troubles cardiovasculaires, des convulsions et des hallucinations qui nécessitent une surveillance des fonctions cardiaque et respiratoire avec traitement des symptômes en milieu hospitalier.
Consultez immédiatement votre médecin ou votre pharmacien.
Si vous oubliez d’utiliser NEFOPAM VIATRIS 20 mg/2 ml, solution injectable
Lorsqu'une injection a été omise, il n'est pas nécessaire d'augmenter d'autant la dose suivante.
Si vous arrêtez d’utiliser NEFOPAM VIATRIS 20 mg/2 ml, solution injectable
L'arrêt du traitement n'entraîne pas de syndrome de sevrage (état de privation ou de manque ressenti après l'arrêt de certains médicaments avec réapparition ou aggravation des troubles).
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Les effets indésirables les plus fréquemment rapportés sont : vertiges, nausées avec ou sans vomissements, somnolence, sueurs.
Il a également été observé, des troubles tels que bouche sèche, accélération du rythme cardiaque, palpitations, rétention d'urine.
Plus rarement ont été rapportés excitabilité, irritabilité, malaise, hallucination, abus, pharmacodépendance, convulsion, réactions allergiques (éruption cutanée, œdème de Quincke, choc anaphylactique )
D’autres effets indésirables de fréquence indéterminée (ne peut être estimée sur la base de données disponibles) ont également été observés : coma, confusion, douleur au point d'injection.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER NEFOPAM VIATRIS 20 mg/2 ml, solution injectable ?
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur l’emballage. La date de péremption fait référence au dernier jour de ce mois.
Ce médicament ne nécessite pas de précautions particulières de conservation.
Après ouverture/dilution : le produit doit être utilisé immédiatement.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient NEFOPAM VIATRIS 20 mg/2 ml, solution injectable
· La substance active est :
Chlorhydrate de néfopam ..................................................................................................... 20 mg
Pour 2mL de solution
· Les autres composants sont :
Phosphate monosodique dihydraté, phosphate disodique dodécahydraté, eau pour préparations injectables.
Qu’est-ce que NEFOPAM VIATRIS 20 mg/2 ml, solution injectable et contenu de l’emballage extérieur
Ce médicament se présente sous forme de solution injectable. Boîtes de 1, 5, 10 ou 20 ampoules de 2 ml.
Toutes les présentations peuvent ne pas être commercialisées.
Titulaire de l’autorisation de mise sur le marché
1 RUE DE TURIN
69007 LYON
Exploitant de l’autorisation de mise sur le marché
VIATRIS SANTÉ
1 RUE DE TURIN
69007 LYON
1 RUE DE TURIN
69007 LYON
ou
STERISCIENCE SP. Z O.O.
10 RUE DANISZEWSKA,
03-230 VARSOVIE
POLOGNE
ou
HAUPT PHARMA LIVRON
26250 LIVRON SUR DROME
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Sans objet.
La dernière date à laquelle cette notice a été révisée est :
A compléter ultérieurement par le titulaire
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).