Dernière mise à jour le 06/11/2025
NUVARING 15 microgrammes/120 microgrammes/24 heures, système de diffusion vaginal
Indications thérapeutiques
NUVARING est un anneau vaginal contraceptif utilisé pour empêcher la survenue d'une grossesse.
Chaque anneau comporte une petite quantité de 2 hormones sexuelles féminines : l'étonogestrel et l'éthinylestradiol. L'anneau libère lentement ces hormones dans la circulation sanguine. En raison de la faible quantité d'hormones libérées, NUVARING est considéré comme un contraceptif hormonal faiblement dosé. Dans la mesure où NUVARING libère 2 types d'hormones différentes, il s'agit d'un contraceptif hormonal combiné.
NUVARING agit comme une pilule contraceptive estroprogestative mais au lieu de prendre un comprimé chaque jour, l'anneau est utilisé pendant 3 semaines d’affilée sans interruption.
NUVARING libère deux hormones sexuelles féminines qui empêchent la libération de l'ovule par les ovaires. S’il n’y a pas d’ovulation, vous ne pourrez pas être enceinte.
Présentations
> 1 sachet(s) aluminium polyéthylène polytéréphtalate (PET) de 1 anneau
Code CIP : 363 081-3 ou 34009 363 081 3 8
Déclaration de commercialisation : 31/08/2022
Cette présentation n'est pas agréée aux collectivités
> 3 sachet(s) aluminium polyéthylène polytéréphtalate (PET) de 1 anneau
Code CIP : 363 083-6 ou 34009 363 083 6 7
Déclaration de commercialisation : 03/08/2021
Cette présentation n'est pas agréée aux collectivités
Documents de bon usage du médicament
- Contraception chez la femme en post-partum
Auteur : Haute autorité de santé
Type : Fiche mémo
Date de mise à jour :Septembre 2019
- Contraception d’urgence
Auteur : Haute autorité de santé
Type : Fiche mémo
Date de mise à jour :Septembre 2019
- Contraception chez l’homme
Auteur : Haute autorité de santé
Type : Fiche mémo
Date de mise à jour :Septembre 2019
- Stérilisation à visée contraceptive chez l’homme et chez la femme
Auteur : Haute autorité de santé
Type : Fiche mémo
Date de mise à jour :Septembre 2019
- Contraception chez la femme adulte et de l'adolescente en âge de procréer (hors post-partum et post-IVG)
Auteur : Haute autorité de santé
Type : Fiche mémo
Date de mise à jour :Septembre 2019
- Contraception chez la femme à risque cardio-vasculaire
Auteur : Haute autorité de santé
Type : Fiche mémo
Date de mise à jour :Septembre 2019
- Contraception : prescriptions et conseils aux femmes
Auteur : Haute autorité de santé
Type : Fiche mémo
Date de mise à jour :Septembre 2019
- Contraception hormonale orale : dispensation en officine
Auteur : Haute autorité de santé
Type : Fiche mémo
Date de mise à jour :Septembre 2019
- Contraception d’urgence : dispensation en officine
Auteur : Haute autorité de santé
Type : Fiche mémo
Date de mise à jour :Septembre 2019
- Contraception estroprogestative transdermique ou vaginale : dispensation en officine
Auteur : Haute autorité de santé
Type : Fiche mémo
Date de mise à jour :Septembre 2019
- Contraception chez la femme après une interruption volontaire de grossesse (IVG)
Auteur : Haute autorité de santé
Type : Fiche mémo
Date de mise à jour :Septembre 2019
- Méthodes contraceptives : Focus sur les méthodes les plus efficaces disponibles
Auteur : Haute autorité de santé
Type : Evaluation des technologies de santé
Date de mise à jour :Novembre 2017
Service médical rendu (SMR)
Amélioration du service médical rendu (ASMR)
Pas d'ASMR disponible pour ce médicament (plus d'informations dans l\'aide)
ANSM - Mis à jour le : 25/02/2025
NUVARING 15 microgrammes/120 microgrammes/24 heures, système de diffusion vaginal
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Ethinylestradiol ............................................................................................................................2,70 mg
Etonogestrel ...............................................................................................................................11,70 mg
Pour un anneau vaginal.
Chaque anneau libère en moyenne 15 microgrammes d'éthinylestradiol et 120 microgrammes d'étonogestrel par 24 heures, pendant une période de 3 semaines.
Pour la liste complète des excipients, voir rubrique 6.1.
Anneau souple, transparent, quasiment incolore dont le diamètre externe est de 54 mm et le diamètre de section de 4 mm.
4.1. Indications thérapeutiques
NUVARING est destiné aux femmes en âge de procréer. La sécurité et l'efficacité ont été établies chez des femmes âgées de 18 à 40 ans.
La décision de prescrire NUVARING doit être prise en tenant compte des facteurs de risque de la patiente, notamment ses facteurs de risque de thrombo-embolie veineuse (TEV), ainsi que du risque de TEV associé à NUVARING en comparaison aux autres contraceptifs hormonaux combinés (CHC) (voir rubriques 4.3 et 4.4).
4.2. Posologie et mode d'administration
Afin d’atteindre une efficacité contraceptive optimale, NUVARING doit être utilisé comme indiqué (voir rubrique « Comment utiliser NUVARING » et « Première utilisation de NUVARING »).
Population pédiatrique
La sécurité et l’efficacité de NUVARING n’ont pas été étudiées chez les adolescentes de moins de 18 ans.
Mode d’administration
Comment utiliser NUVARING :
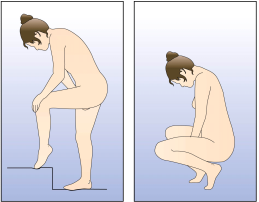
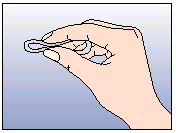
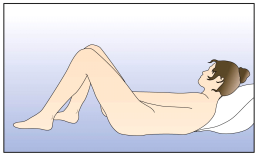
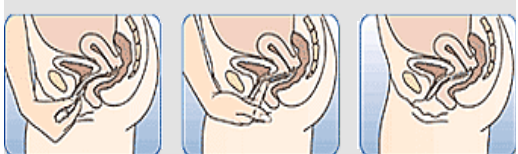
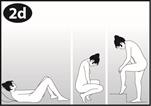
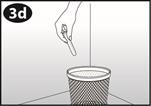
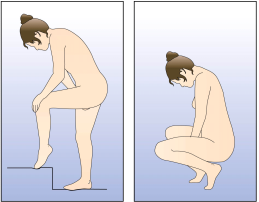
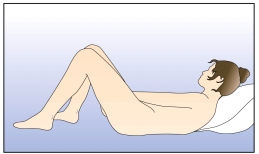
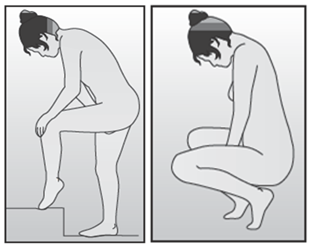
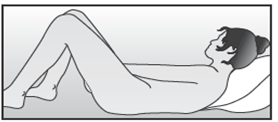
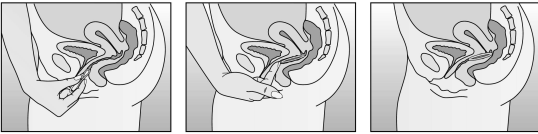
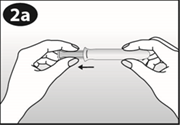
La femme peut elle-même mettre en place NUVARING dans le vagin. Le médecin doit expliquer à la femme comment mettre en place et retirer NUVARING. Pour l'insertion, la femme devra choisir la position lui paraissant la plus confortable, par exemple debout avec une jambe relevée, accroupie ou couchée. NUVARING doit être pincé et inséré dans le vagin jusqu'à ce qu'aucune gêne ne soit perçue. Une option alternative est d’insérer l’anneau en utilisant l’applicateur NUVARING qui est fourni séparément ou inclus dans l’emballage. L’applicateur NUVARING peut ne pas être disponible dans tous les pays. L'effet contraceptif de l'anneau est assuré quelle que soit sa place dans le vagin (voir Figures 1 à 4).
Une fois inséré dans le vagin (voir « Première utilisation de NUVARING »), NUVARING est laissé en place sans interruption pendant 3 semaines. Conseillez aux femmes de s’assurer régulièrement de la présence de NUVARING dans le vagin (par exemple, avant et après un rapport sexuel).
Si NUVARING est expulsé accidentellement, la femme doit suivre les instructions de la rubrique 4.2 « Que faire si l’anneau est temporairement resté en dehors du vagin » (pour plus d’informations voir aussi la rubrique 4.4 « expulsions »). NUVARING doit être retiré après 3 semaines d'utilisation, le même jour de la semaine que celui où il a été inséré.
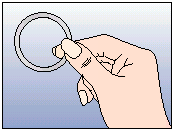
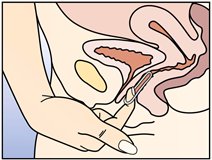
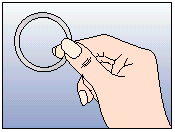
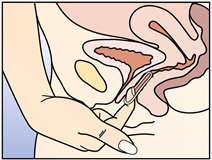
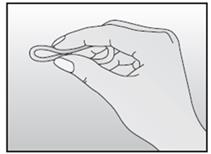
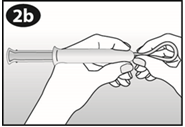
Après une période d'une semaine sans anneau, un nouvel anneau est inséré (par exemple, si NUVARING a été inséré un mercredi vers 22.00 heures, l'anneau doit être retiré également le mercredi vers 22.00 heures, 3 semaines plus tard. Un nouvel anneau doit être inséré le mercredi suivant). NUVARING peut être retiré soit en passant l'index sous l'anneau, soit en le saisissant entre l'index et le majeur (voir figure 5).
Une fois utilisé, l'anneau doit être remis dans son sachet (tenu hors de portée des enfants et des animaux de compagnie) et être jeté comme indiqué à la rubrique 6.6.
L'hémorragie de privation apparaît habituellement 2 à 3 jours après le retrait de NUVARING et peut ne pas être complètement terminée lors de l'insertion de l'anneau suivant.
Utilisation avec d'autres méthodes barrières féminines vaginales
NUVARING peut interférer avec le placement et le positionnement correct de certaines méthodes barrières féminines, tel qu’un diaphragme, une cape cervicale ou un préservatif féminin. Ces méthodes contraceptives ne doivent pas être utilisées comme méthodes de recours avec NUVARING.
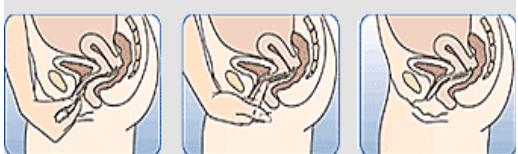
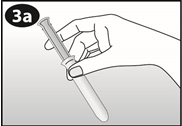
Comment insérer NUVARING avec les doigts seulement :
|
Figure 1 : Otez NUVARING du sachet. |
|
|
|
Figure 2: Pincez l'anneau. |
Figure 3 : Choisissez une position confortable pour insérer l'anneau. |
|
|
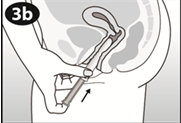
Figure 4A Figure 4B Figure 4C Insérez l'anneau dans le vagin avec une main (Figure 4A), en écartant les lèvres à l'aide de l'autre main si nécessaire. Poussez l'anneau dans le vagin jusqu'à ce qu'aucune gêne ne soit perçue (Figure 4B). Laissez l'anneau en place pendant 3 semaines (Figure 4C). |
||
|
|
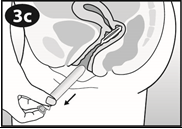
Figure 5 :
NUVARING peut être retiré soit en passant l'index dans l'anneau, soit en le saisissant entre l'index et le majeur.
|
|
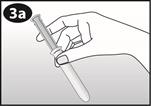
Comment insérer NUVARING avec l’applicateur :
1: Préparer
|
|
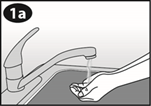
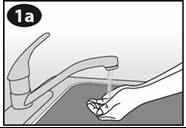
Lavez-vous les mains avant d’ouvrir l’emballage. Ouvrir SEULEMENT immédiatement avant utilisation. NE PAS utiliser si le contenu ou l’emballage est visiblement endommagé. |
|
|
|
|
|
L’applicateur est conçu pour être utilisé EXCLUSIVEMENT avec les anneaux NUVARING, et pas avec d’autres produits.
|
|
|
|
|
|
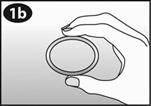
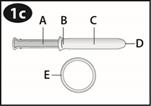
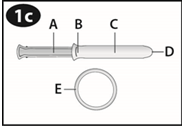
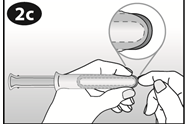
Revoir le schéma de l'applicateur pour vous familiariser avec ses différentes parties.
A. Piston B. Extrémité renflée C. Cylindre D. Ouverture du cylindre E. NUVARING |
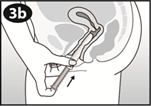
2 : Charger et positionner
|
|
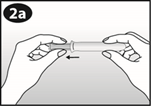
Tirez doucement le piston jusqu'à ce qu'il s'arrête. |
|
|
|
|
|
|
|
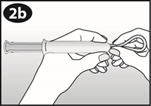
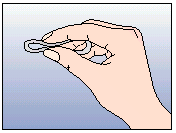
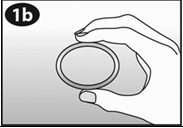
Pincez les côtés opposés de l’anneau et insérez l’anneau dans l'ouverture du cylindre.
|
|
|
|
|
|
|
|
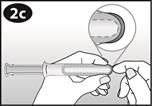
Poussez doucement l’anneau dans le cylindre. La pointe de l'anneau doit rester légèrement hors de l’ouverture du cylindre.
|
|
|
|
|
|
|
|
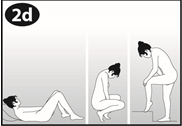
Choisissez la position la plus confortable pour vous afin d’insérer l’anneau, telles que : position allongée sur le dos, accroupie, ou debout avec une jambe relevée. |
|
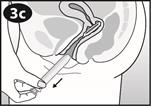
3 : Insérer et Jeter
|
|
Placez votre pouce et le majeur sur l’extrémité renflée. |
|
|
|
|
|
Introduisez doucement le cylindre dans le vagin jusqu'à ce que vos doigts (sur l’extrémité renflée) touchent votre corps. Ensuite, utilisez votre index pour pousser doucement le piston entièrement dans le cylindre. Certaines femmes ont éprouvé une brève et légère sensation de pincement lors de l’utilisation de l’applicateur. |
|
|
|
|
|
L’anneau est repoussé hors de l'applicateur. Retirez doucement l'applicateur. |
|
|
|
|
|
Assurez-vous que l’anneau n'est PAS resté dans l'applicateur. Jetez l'applicateur utilisé dans la poubelle. NE jetez PAS l'applicateur dans les toilettes. NE réutilisez PAS l’applicateur.
|
Première utilisation de NUVARING :
· Pas de contraception hormonale préalable au cours du cycle précédent :
NUVARING doit être inséré le 1er jour du cycle (c'est-à-dire le premier jour des règles). La femme peut également commencer NUVARING entre le 2ème et le 5ème jour du cycle, mais, dans ce cas, il est recommandé d'utiliser une méthode contraceptive complémentaire au cours des 7 premiers jours de ce premier cycle d'utilisation de NUVARING.
· Relais d'un contraceptif hormonal combiné :
La femme doit insérer NUVARING au plus tard le jour suivant l'intervalle habituel sans comprimé ou sans patch, ou, le jour suivant le dernier comprimé placebo du contraceptif hormonal combiné. Si la méthode précédente a été utilisée correctement et conformément aux recommandations et si une grossesse peut être raisonnablement écartée, le relais par NUVARING peut également être effectué n’importe quel jour du cycle.
L’intervalle libre de la méthode précédente ne doit jamais excéder la durée recommandée.
· Relais d'une méthode uniquement progestative (pilule microprogestative, implant ou injection) ou relais d’un système intrautérin libérant un progestatif (SIU) :
La femme peut commencer NUVARING n'importe quel jour de la prise d'une pilule microprogestative (dans le cas d'un implant ou d’un SIU, la mise en place de l'anneau se fait le jour du retrait de l'implant ou du SIU, et dans le cas d'une injection, le jour où aurait dû avoir lieu la prochaine injection) mais elle doit, dans tous ces cas, utiliser une méthode contraceptive complémentaire (de type barrière) pendant les 7 premiers jours d’utilisation de NUVARING.
· Après un avortement du premier trimestre :
La femme peut commencer immédiatement. Dans ce cas, il n'est pas nécessaire qu'elle utilise une méthode contraceptive complémentaire. Si une utilisation immédiate de NUVARING n'est pas souhaitable, la femme devra respecter les recommandations mentionnées à la rubrique « Pas de contraception hormonale préalable au cours du cycle précédent ». En attendant, il faut lui conseiller d'utiliser une autre méthode contraceptive.
· Après un accouchement ou un avortement du second trimestre :
Pour les femmes qui allaitent, voir la rubrique 4.6.
Il sera conseillé aux femmes de commencer NUVARING au cours de la quatrième semaine après l'accouchement ou après l’avortement du second trimestre. Si l'utilisation de NUVARING a été plus tardive, la femme doit utiliser en plus une méthode contraceptive complémentaire pendant les 7 premiers jours d'utilisation de NUVARING. Cependant, si des rapports sexuels ont déjà eu lieu, toute grossesse devra être exclue avant de commencer NUVARING ou bien la femme devra attendre la survenue de ses premières règles normales.
Non respect des instructions d'utilisation :
L'efficacité contraceptive et le contrôle du cycle peuvent être compromis si la femme ne respecte pas les instructions d'utilisation. Dans ce cas, pour éviter la perte d'efficacité contraceptive, les recommandations suivantes peuvent être données :
· Que faire si la période sans anneau a excédé 7 jours :
Dès que la femme s'aperçoit de l'oubli, elle doit mettre en place un nouvel anneau. Une méthode contraceptive supplémentaire, comme le préservatif masculin doit être utilisée pendant les 7 jours suivants. Si des rapports sexuels ont eu lieu pendant l'intervalle de temps sans anneau, la possibilité d'une grossesse devra être évoquée. Le risque de grossesse est d'autant plus élevé que la durée de l'intervalle sans anneau est plus longue.
· Que faire si l'anneau est temporairement resté en dehors du vagin :
NUVARING doit être laissé en place dans le vagin en continu pendant une période de 3 semaines. Si l'anneau est accidentellement expulsé, il doit être rincé à l’eau froide ou tiède (mais pas chaude) et être réinséré immédiatement.
Si NUVARING est resté en dehors du vagin pendant moins de 3 heures, l'efficacité contraceptive n'est pas réduite. La femme doit remettre l'anneau en place dès que possible, au plus tard dans un délai de 3 heures.
Si NUVARING est resté en dehors du vagin pendant plus de 3 heures, ou en cas de doute sur la durée pendant laquelle l’anneau est resté en dehors du vagin, lors de la 1ère ou de la 2ème semaine du cycle, l'efficacité contraceptive peut être réduite. La femme doit remettre l'anneau en place dès qu'elle s'en rend compte et utiliser simultanément une méthode contraceptive supplémentaire, comme le préservatif masculin pendant les 7 jours suivants. Le risque de grossesse est d'autant plus élevé que la période pendant laquelle NUVARING est resté en dehors du vagin est longue et proche de l'intervalle habituel sans anneau.
Si NUVARING est resté en dehors du vagin pendant plus de 3 heures, ou en cas de doute sur la durée pendant laquelle l’anneau est resté en dehors du vagin, lors de la 3ème semaine du cycle, l'efficacité contraceptive peut être réduite. La femme doit jeter cet anneau et choisir l'une des 2 options suivantes :
1. Insérer un nouvel anneau immédiatement.
Remarque : L'insertion de ce nouvel anneau marquera le début de la période suivante de 3 semaines d'utilisation. La femme peut ne pas avoir les règles correspondant à son précédent cycle. Cependant des spottings ou des saignements peuvent apparaître.
2. Attendre la survenue des règles et insérer un nouvel anneau au plus tard dans les 7 jours (7x24 heures) qui suivent le retrait ou l'expulsion de l'anneau précédent.
Attention : Cette option ne devra être choisie que si l'anneau a été utilisé de façon continue pendant les 7 jours précédents.
Si NUVARING est resté hors du vagin pendant une durée inconnue, la possibilité d’une grossesse doit être envisagée. Un test de grossesse doit être effectué avant d’insérer un nouvel anneau.
· Que faire en cas d'une utilisation prolongée de l'anneau :
Si la durée d'utilisation de NUVARING n'a pas dépassé 4 semaines, l'efficacité contraceptive est toujours assurée, cependant cette durée d’utilisation n’est pas préconisée. La femme peut respecter l’intervalle d’une semaine sans anneau puis insérer un nouvel anneau. Si NUVARING est laissé en place pendant plus de 4 semaines, l'efficacité contraceptive peut être réduite et une grossesse doit être exclue avant la mise en place d'un nouvel anneau.
Si la femme n'a pas respecté les instructions d'utilisation et n'a pas d’hémorragie de privation durant l'intervalle suivant sans anneau, une grossesse doit être exclue avant la mise en place d'un nouvel anneau.
Comment décaler ou retarder les règles :
De façon exceptionnelle, pour retarder les règles, la femme peut mettre en place un nouvel anneau à la suite du précédent sans respecter la semaine habituelle sans anneau. L'anneau suivant peut alors être utilisé pendant une période de 3 semaines. Des saignements ou des spottings peuvent apparaître. L'utilisation normale de NUVARING est ensuite reprise après l’intervalle habituel d’une semaine sans anneau.
Pour décaler la survenue des règles, on peut conseiller à la femme de raccourcir l'intervalle sans anneau, du nombre de jours qu'elle souhaite. Plus l'intervalle sans anneau sera court, plus le risque de ne pas avoir d'hémorragie de privation et de présenter des saignements et des spottings pendant l'utilisation de l'anneau suivant sera élevé.
· Présence ou risque de thrombo-embolie veineuse (TEV)
o Thrombo-embolie veineuse – présence de TEV (patiente traitée par des anticoagulants) ou antécédents de TEV (p. ex. thrombose veineuse profonde [TVP] ou embolie pulmonaire [EP]).
o Prédisposition connue, héréditaire ou acquise, à la thrombo-embolie veineuse, telle qu’une résistance à la protéine C activée (PCa) (y compris une mutation du facteur V de Leiden), un déficit en antithrombine III, un déficit en protéine C, un déficit en protéine S.
o Intervention chirurgicale majeure avec immobilisation prolongée (voir rubrique 4.4).
o Risque élevé de thrombo-embolie veineuse dû à la présence de multiples facteurs de risque (voir rubrique 4.4).
· Présence ou risque de thrombo-embolie artérielle (TEA)
o Thrombo-embolie artérielle – présence ou antécédents de thrombo-embolie artérielle (p. ex. infarctus du myocarde [IM]) ou de prodromes (p. ex. angine de poitrine).
o Affection cérébrovasculaire – présence ou antécédents d’accident vasculaire cérébral (AVC) ou de prodromes (p. ex. accident ischémique transitoire [AIT]).
o Prédisposition connue, héréditaire ou acquise, à la thrombo-embolie artérielle, telle qu’une hyperhomocystéinémie ou la présence d’anticorps anti-phospholipides (anticorps anti-cardiolipine, anticoagulant lupique).
o Antécédents de migraine avec signes neurologiques focaux.
o Risque élevé de thrombo-embolie artérielle dû à la présence de multiples facteurs de risque (voir rubrique 4.4) ou d’un facteur de risque sévère tel que :
§ diabète avec symptômes vasculaires,
§ hypertension artérielle sévère,
§ dyslipoprotéinémie sévère.
· Présence ou antécédents d'affections hépatiques sévères jusqu'à normalisation des paramètres de la fonction hépatique.
· Pancréatite ou antécédent de pancréatite surtout si associé à une hypertriglycéridémie sévère.
· Présence ou antécédents de tumeurs hépatiques (bénignes ou malignes).
· Diagnostic ou suspicion d'affections malignes hormonodépendantes des organes génitaux ou du sein.
· Hémorragies génitales non diagnostiquées.
· Hypersensibilité à l'une des substances actives ou à l'un des excipients mentionnés à la rubrique 6.1.
NUVARING est contre-indiqué lors d’une utilisation concomitante avec des médicaments contenant de l’ombitasvir / paritaprevir / ritonavir et dasabuvir ou des médicaments contenant du glécaprévir / pibrentasvir (voir rubriques 4.4 et 4.5).
4.4. Mises en garde spéciales et précautions d'emploi
Si la patiente présente l’un des troubles ou l'un des facteurs de risque mentionnés ci-dessous, la pertinence du traitement par NUVARING doit être discutée avec elle.
En cas d'aggravation ou de survenue de l’un de ces troubles ou facteurs de risque, la nécessité d’interrompre l’utilisation de NUVARING doit être discutée entre le médecin et la patiente.
1. Troubles circulatoires
Risque de thrombo-embolie veineuse (TEV)
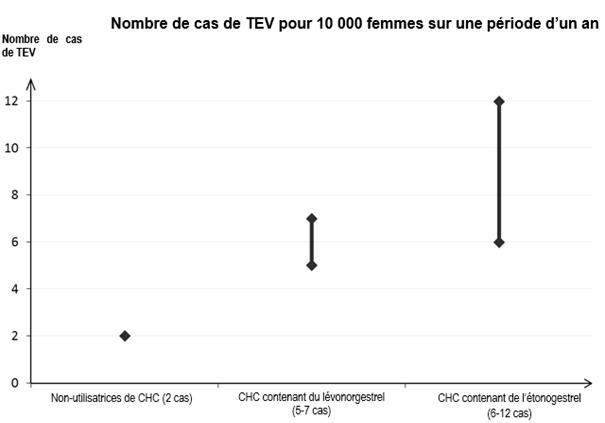
· Le risque de TEV est augmenté chez les femmes qui utilisent un contraceptif hormonal combiné (CHC) en comparaison aux femmes qui n’en utilisent pas. Les CHC contenant du lévonorgestrel, du norgestimate ou de la noréthistérone sont associés au risque de TEV le plus faible. Le risque de TEV associé aux autres CHC, tels que NUVARING, peut être jusqu’à deux fois plus élevé. La décision d’utiliser tout autre CHC que ceux associés au risque de TEV le plus faible doit être prise uniquement après concertation avec la patiente afin de s’assurer qu’elle comprend le risque de TEV associé à NUVARING, l’influence de ses facteurs de risque actuels sur ce risque et le fait que le risque de TEV est maximal pendant la première année d’utilisation.
Certaines données indiquent également une augmentation du risque lors de la reprise d’un CHC après une interruption de 4 semaines ou plus.
· Parmi les femmes qui n’utilisent pas de CHC et qui ne sont pas enceintes, environ 2 sur 10 000 développeront une TEV sur une période d’un an. Cependant, chez une femme donnée, le risque peut être considérablement plus élevé, selon les facteurs de risque qu’elle présente (voir ci-dessous).
· On estime que sur 10 000 femmes qui utilisent un CHC faiblement dosé contenant du lévonorgestrel, environ 61 développeront une TEV sur une période d’un an. Des résultats contradictoires ont été obtenus concernant le risque de TEV associé à NUVARING en comparaison aux CHC contenant du lévonorgestrel (avec des estimations du risque relatif allant d’une absence d’augmentation [RR = 0,96] à un risque pratiquement multiplié par 2 [RR = 1,90]). Ceci correspond à environ 6 à 12 cas de TEV par an pour 10 000 femmes utilisant NUVARING.
· Dans les deux cas, le nombre de TEV par année est inférieur à celui attendu pendant la grossesse ou en période post-partum.
· La TEV peut être fatale dans 1 à 2 % des cas.
1 Point central de l’intervalle de 5-7 pour 10 000 années-femmes sur la base d’un risque relatif, pour les CHC contenant du lévonorgestrel par rapport à la non-utilisation d’un CHC, d’environ 2,3 à 3,6
· De façon extrêmement rare, des cas de thrombose chez les utilisatrices de CHC ont été signalés dans d'autres vaisseaux sanguins, p. ex. les veines et artères hépatiques, mésentériques, rénales ou rétiniennes.
Facteurs de risque de TEV
Le risque de complications thrombo-emboliques veineuses chez les utilisatrices de CHC peut être considérablement accru si d’autres facteurs de risque sont présents, en particulier si ceux-ci sont multiples (voir le tableau ci-dessous).
NUVARING est contre-indiqué chez les femmes présentant de multiples facteurs de risque, ceux-ci les exposant à un risque élevé de thrombose veineuse (voir rubrique 4.3). Lorsqu’une femme présente plus d’un facteur de risque, il est possible que l’augmentation du risque soit supérieure à la somme des risques associés à chaque facteur pris individuellement – dans ce cas, le risque global de TEV doit être pris en compte. Si le rapport bénéfice/risque est jugé défavorable, le CHC ne doit pas être prescrit (voir rubrique 4.3).
Tableau : Facteurs de risque de TEV
|
Facteur de risque |
Commentaire |
|
Obésité (indice de masse corporelle supérieur à 30 kg/m²). |
L’élévation de l’IMC augmente considérablement le risque.
|
|
Ceci est particulièrement important à prendre en compte si d’autres facteurs de risque sont présents. |
|
|
Immobilisation prolongée, intervention chirurgicale majeure, toute intervention chirurgicale sur les jambes ou le bassin, neurochirurgie ou traumatisme majeur. |
Dans ces situations, il est conseillé de suspendre l’utilisation de l’anneau (au moins quatre semaines à l’avance en cas de chirurgie programmée) et de ne reprendre le CHC que deux semaines au moins après la complète remobilisation. Une autre méthode de contraception doit être utilisée afin d’éviter une grossesse non désirée. |
|
Remarque : l’immobilisation temporaire, y compris les trajets aériens > 4 heures, peut également constituer un facteur de risque de TEV, en particulier chez les femmes présentant d’autres facteurs de risque. |
Un traitement anti-thrombotique devra être envisagé si NUVARING n’a pas été interrompu à l’avance. |
|
Antécédents familiaux (thrombo-embolie veineuse survenue dans la fratrie ou chez un parent, en particulier à un âge relativement jeune, c.-à-d. avant 50 ans). |
En cas de prédisposition héréditaire suspectée, la femme devra être adressée à un spécialiste pour avis avant toute décision concernant l’utilisation de CHC. |
|
Autres affections médicales associées à la TEV. |
Cancer, lupus érythémateux disséminé, syndrome hémolytique et urémique, maladies inflammatoires chroniques intestinales (maladie de Crohn ou rectocolite hémorragique) et drépanocytose. |
|
Âge |
En particulier au-delà de 35 ans |
· Il n’existe aucun consensus quant au rôle éventuel joué par les varices et les thrombophlébites superficielles dans l’apparition ou la progression d’une thrombose veineuse.
· L’augmentation du risque de thrombo-embolie pendant la grossesse, et en particulier pendant les 6 semaines de la période puerpérale, doit être prise en compte (pour des informations concernant « Grossesse et allaitement », voir rubrique 4.6).
Symptômes de TEV (thrombose veineuse profonde et embolie pulmonaire)
Les femmes doivent être informées qu’en cas d’apparition de ces symptômes, elles doivent consulter un médecin en urgence et lui indiquer qu’elles utilisent un CHC.
Les symptômes de la thrombose veineuse profonde (TVP) peuvent inclure :
· gonflement unilatéral d’une jambe et/ou d’un pied ou le long d’une veine de la jambe ;
· douleur ou sensibilité dans une jambe, pouvant n’être ressentie qu’en position debout ou lors de la marche ;
· sensation de chaleur, rougeur ou changement de la coloration cutanée de la jambe affectée.
Les symptômes de l’embolie pulmonaire (EP) peuvent inclure :
· apparition soudaine et inexpliquée d’un essoufflement ou d’une accélération de la respiration ;
· toux soudaine, pouvant être associée à une hémoptysie ;
· douleur thoracique aiguë ;
· étourdissements ou sensations vertigineuses sévères ;
· battements cardiaques rapides ou irréguliers.
Certains de ces symptômes (p. ex. « essoufflement », « toux ») ne sont pas spécifiques et peuvent être interprétés à tort comme des signes d’événements plus fréquents ou moins sévères (infections respiratoires, p. ex.).
Les autres signes d’une occlusion vasculaire peuvent inclure : douleur soudaine, gonflement et coloration légèrement bleutée d’une extrémité.
Si l’occlusion se produit dans l’œil, les symptômes peuvent débuter sous la forme d’une vision trouble indolore pouvant évoluer vers une perte de la vision. Dans certains cas, la perte de la vision peut survenir presque immédiatement.
Risque de thrombo-embolie artérielle (TEA)
Des études épidémiologiques ont montré une association entre l’utilisation de CHC et l’augmentation du risque de thrombo-embolie artérielle (infarctus du myocarde) ou d’accident cérébrovasculaire (p. ex. accident ischémique transitoire, AVC). Les événements thrombo-emboliques artériels peuvent être fatals.
Facteurs de risque de TEA
Le risque de complications thrombo-emboliques artérielles ou d’accident cérébrovasculaire chez les utilisatrices de CHC augmente avec la présence de facteurs de risque (voir le tableau). NUVARING est contre-indiqué chez les femmes présentant un facteur de risque sévère ou de multiples facteurs de risque de TEA qui les exposent à un risque élevé de thrombose artérielle (voir rubrique 4.3). Lorsqu’une femme présente plus d’un facteur de risque, il est possible que l’augmentation du risque soit supérieure à la somme des risques associés à chaque facteur pris individuellement – dans ce cas, le risque global doit être pris en compte. Si le rapport bénéfice/risque est jugé défavorable, le CHC ne doit pas être prescrit (voir rubrique 4.3).
Tableau : Facteurs de risque de TEA
|
Facteur de risque |
Commentaire |
|
Âge |
En particulier au-delà de 35 ans. |
|
Tabagisme |
Il doit être conseillé aux femmes de ne pas fumer si elles souhaitent utiliser un CHC. Il doit être fortement conseillé aux femmes de plus de 35 ans qui continuent de fumer d’utiliser une méthode de contraception différente. |
|
Hypertension artérielle |
|
|
Obésité (indice de masse corporelle supérieur à 30 kg/m2) |
L’élévation de l’IMC augmente considérablement le risque. |
|
Ceci est particulièrement important à prendre en compte chez les femmes présentant d’autres facteurs de risque. |
|
|
Antécédents familiaux (thrombo-embolie artérielle survenue dans la fratrie ou chez un parent, en particulier à un âge relativement jeune, c.-à-d. avant 50 ans) |
En cas de prédisposition héréditaire suspectée, la femme devra être adressée à un spécialiste pour avis avant toute décision concernant l’utilisation de CHC. |
|
Migraine |
L’accroissement de la fréquence ou de la sévérité des migraines lors de l’utilisation d’un CHC (qui peut être le prodrome d’un événement cérébrovasculaire) peut constituer un motif d’arrêt immédiat du CHC. |
|
Autres affections médicales associées à des événements indésirables vasculaires |
Diabète, hyperhomocystéinémie, valvulopathie cardiaque et fibrillation auriculaire, dyslipoprotéinémie et lupus érythémateux disséminé. |
Symptômes de TEA
Les femmes doivent être informées qu’en cas d’apparition de ces symptômes, elles doivent consulter un médecin en urgence et lui indiquer qu’elles utilisent un CHC.
Les symptômes d’un accident cérébrovasculaire peuvent inclure :
· apparition soudaine d’un engourdissement ou d’une faiblesse du visage, d’un bras ou d’une jambe, en particulier d’un côté du corps ;
· apparition soudaine de difficultés à marcher, de sensations vertigineuses, d’une perte d’équilibre ou de coordination ;
· apparition soudaine d’une confusion, de difficultés à parler ou à comprendre ;
· apparition soudaine de difficultés à voir d’un œil ou des deux yeux ;
· céphalée soudaine, sévère ou prolongée, sans cause connue ;
· perte de conscience ou évanouissement avec ou sans crise convulsive.
Des symptômes temporaires suggèrent qu’il s’agit d’un accident ischémique transitoire (AIT).
Les symptômes de l’infarctus du myocarde (IM) peuvent inclure :
· douleur, gêne, pression, lourdeur, sensation d’oppression ou d’encombrement dans la poitrine, le bras ou sous le sternum ;
· sensation de gêne irradiant vers le dos, la mâchoire, la gorge, le bras, l’estomac ;
· sensation d’encombrement, d’indigestion ou de suffocation ;
· transpiration, nausées, vomissements ou sensations vertigineuses ;
· faiblesse, anxiété ou essoufflement extrêmes ;
· battements cardiaques rapides ou irréguliers.
En cas de TEV ou TEA suspectée ou confirmée, l’utilisation des CHC doit être interrompue. Un mode de contraception adéquat doit être initié en raison de la tératogénicité des traitements anti-coagulants (coumarines).
2. Tumeurs
· Certaines études épidémiologiques rapportent que l'utilisation à long terme de contraceptifs oraux est un facteur de risque de développement du cancer du col de l'utérus chez les femmes contaminées par le papillomavirus humain (HPV).
Cependant il persiste une controverse sur l'importance de cette conclusion en raison de la présence de facteurs confondants (tels que les différences dans le nombre de partenaires sexuels, ou l'utilisation de méthodes contraceptives mécaniques). Aucune donnée épidémiologique sur le risque de cancer du col de l'utérus chez les utilisatrices de NUVARING n'est disponible (voir rubrique Examen Médical/Consultation).
· Une méta-analyse portant sur 54 études épidémiologiques a rapporté qu'il existait un risque relatif légèrement plus élevé (RR = 1,24) de diagnostiquer un cancer du sein chez les femmes prenant régulièrement des COC. L'augmentation de ce risque disparaît progressivement dans les 10 ans qui suivent l'arrêt de l'utilisation de COC. Le cancer du sein étant rare chez les femmes de moins de 40 ans, l'augmentation des cancers du sein diagnostiqués chez les utilisatrices récentes et régulières de COC est faible par rapport au risque global de cancer du sein. Les cas de cancers du sein diagnostiqués chez les utilisatrices au long cours tendent à être à un stade moins avancé que ceux des patientes n'ayant jamais utilisé de COC.
L'augmentation du risque observé chez les utilisatrices de COC peut être liée à un diagnostic plus précoce du cancer du sein, aux effets biologiques des COC ou à l'association des deux.
· Dans de rares cas, des tumeurs hépatiques bénignes et plus rarement encore, des tumeurs hépatiques malignes ont été rapportées chez des utilisatrices de COC. Dans des cas isolés, ces tumeurs ont entraîné des hémorragies intra-abdominales menaçant le pronostic vital. En conséquence, en cas de douleur épigastrique aiguë, d'hépatomégalie ou de signes d'hémorragie intra-abdominale chez des femmes utilisant NUVARING, une tumeur hépatique doit être recherchée.
3. Augmentation des ALAT
· Lors des études cliniques réalisées chez des patientes traitées pour une infection par le virus de l’hépatite C (VHC) par des médicaments contenant ombitasvir/paritaprevir/ritonavir et dasabuvir avec ou sans ribavirine, la survenue d’élévations des transaminases (ALAT) de plus de 5 fois la limite supérieure de la normale (LSN) étaient significativement plus fréquentes chez les femmes utilisant des médicaments contenant de l’éthinylestradiol tels que les contraceptifs hormonaux combinés (CHCs). De plus, , une augmentation des ALAT a été observée chez les patientes utilisant des médicaments contenant de l’éthynylestradiol tels que les CHCs et traitées par glécaprévir / pibrentasvir (voir sections 4.3 et 4.5).
4. Autres affections
· Les femmes ayant une hypertriglycéridémie ou des antécédents familiaux peuvent présenter un risque plus élevé de pancréatite lors de l'utilisation de contraceptifs hormonaux.
· Des cas d'augmentation modérée de la pression artérielle ont été observés chez de nombreuses patientes utilisant des contraceptifs hormonaux ; les augmentations ayant des conséquences cliniques sont cependant rares. L’existence d’une relation certaine de cause à effet entre l'utilisation d'un contraceptif hormonal et une hypertension artérielle clinique n'a pas été établie. Néanmoins, si une hypertension artérielle prolongée et cliniquement significative survient pendant l'utilisation de NUVARING, la prudence impose alors au médecin de suspendre l'utilisation de l'anneau et de traiter l'hypertension. Dans certains cas, l'utilisation de NUVARING peut être reprise si des valeurs normales de pression artérielle sont obtenues sous traitement antihypertenseur.
· Les affections suivantes sont apparues ou se sont aggravées en cas de grossesse ou d'utilisation de contraceptifs hormonaux, mais leur imputabilité n'est pas certaine : ictère et/ou prurit en relation avec une cholestase, lithiase biliaire, porphyrie, lupus érythémateux disséminé, syndrome urémique et hémolytique, chorée de Sydenham, herpès gestationis, perte de l'audition liée à une otosclérose.
· Les œstrogènes exogènes peuvent causer ou aggraver les symptômes d’un angioedème héréditaire et acquis.
· Des troubles aigus ou chroniques de la fonction hépatique peuvent imposer l'arrêt de l'utilisation de NUVARING jusqu'à la normalisation des paramètres hépatiques. La réapparition d'un ictère cholestatique et/ou d'un prurit lié à une cholestase après une première apparition au cours d'une grossesse ou lors d'une utilisation antérieure de stéroïdes sexuels, impose l'arrêt de l'utilisation de l'anneau.
· Chez les diabétiques utilisant une contraception hormonale, il n'existe aucun élément imposant une modification du schéma thérapeutique même si les œstrogènes et les progestatifs peuvent avoir un effet sur la sensibilité périphérique à l'insuline et sur la tolérance au glucose. Les femmes diabétiques doivent néanmoins être attentivement suivies pendant l'utilisation de NUVARING, notamment pendant les premiers mois d'utilisation.
· Une apparition ou une aggravation de la maladie de Crohn et de la rectocolite hémorragique a été rapportée avec l'utilisation de contraceptifs hormonaux, mais la preuve d’un lien avec leur utilisation n’est pas concluante.
· Un chloasma peut occasionnellement survenir, notamment chez les femmes ayant des antécédents de chloasma gravidique. Les femmes ayant des prédispositions au chloasma doivent éviter de s'exposer au soleil ou aux ultraviolets pendant l'utilisation de NUVARING.
· Si une femme présente l'une des affections suivantes, il est possible qu'elle ne parvienne pas à placer correctement NUVARING ou qu'elle perde l'anneau : prolapsus du col utérin, cystocèle et/ou rectocèle, constipation sévère ou chronique.
Très rarement, il a été rapporté que NUVARING pouvait être inséré par inadvertance dans l’urètre et arriver dans la vessie. Donc un mauvais positionnement doit être évoqué dans un diagnostic différentiel devant des symptômes de cystite.
· Chez les femmes utilisant NUVARING, des vaginites peuvent occasionnellement survenir. Il n'existe aucun élément indiquant que l'efficacité de NUVARING est affectée par le traitement de la vaginite ou que l'utilisation de NUVARING affecte le traitement de la vaginite (voir rubrique 4.5).
· Très rarement, il a été rapporté que l’anneau a pu adhérer à la paroi du vagin, nécessitant l’intervention d’un médecin pour le retrait. Dans certains cas, lorsque le tissu s’était développé sur l'anneau, le retrait a été réalisé en coupant l'anneau sans inciser le tissu vaginal le recouvrant.
· L’état dépressif et la dépression sont des effets indésirables bien connus liés à l’utilisation de contraceptifs hormonaux (voir rubrique 4.8). La dépression peut être grave et constitue un facteur de risque bien connu de comportement suicidaire et de suicide. Il convient de conseiller aux femmes de contacter leur médecin en cas de changements d’humeur et de symptômes dépressifs, y compris peu de temps après le début du traitement.
Examen médical/Consultation :
Avant l’instauration ou la reprise d’un traitement par NUVARING, une recherche complète des antécédents médicaux (y compris les antécédents familiaux) doit être effectuée et la présence d’une grossesse doit être exclue. La pression artérielle doit être mesurée et un examen physique doit être réalisé, en ayant à l’esprit les contre-indications (voir rubrique 4.3) et les mises en garde (voir rubrique 4.4). Il est important d’attirer l’attention des patientes sur les informations relatives à la thrombose veineuse et artérielle, y compris le risque associé à NUVARING comparé à celui associé aux autres CHC, les symptômes de la TEV et de la TEA, les facteurs de risque connus et la conduite à tenir en cas de suspicion de thrombose.
Il doit également être indiqué aux patientes de lire attentivement la notice et de suivre les conseils fournis. La fréquence et la nature des examens doivent être définies sur la base des recommandations en vigueur et adaptées à chaque patiente.
Les patientes doivent être averties que les contraceptifs hormonaux ne protègent pas contre l’infection par le VIH (SIDA) et les autres maladies sexuellement transmissibles.
Diminution de l'efficacité :
L'efficacité de NUVARING peut être réduite en cas de mauvaise observance (voir rubrique 4.2) ou lors de l’utilisation de traitements médicamenteux concomitants qui diminuent la concentration plasmatique d’éthinylestradiol et/ou d’étonogestrel (voir rubrique 4.5).
Anomalie du contrôle du cycle :
Pendant l'utilisation de NUVARING, des saignements irréguliers (spottings ou métrorragies) peuvent survenir. Si des saignements irréguliers surviennent alors que les cycles antérieurs étaient réguliers et que NUVARING a été utilisé conformément aux instructions, des causes non-hormonales devront être recherchées et des mesures diagnostiques appropriées devront être prises pour exclure une affection maligne ou une grossesse.
Ces mesures peuvent inclure un curetage.
Chez certaines femmes, les hémorragies de privation peuvent ne pas survenir pendant l'intervalle sans anneau. Si NUVARING a été utilisé conformément aux instructions décrites à la rubrique 4.2, il est peu probable que la femme soit enceinte. Néanmoins, si NUVARING n'a pas été utilisé conformément à ces instructions avant la première absence de règles ou si les règles sont absentes 2 fois de suite, une grossesse doit être exclue avant de poursuivre l'utilisation de NUVARING.
Exposition masculine à l'éthinylestradiol et à l'étonogestrel :
L'importance et l’effet pharmacologique possible de l'exposition des partenaires sexuels masculins à l'éthinylestradiol et à l'étonogestrel par absorption par le pénis n'ont pas été étudiés.
Ruptures d'anneaux
De très rares cas de rupture d'anneau ont été rapportés durant leur utilisation (voir rubrique 4.5). Une lésion vaginale associée à une rupture de l’anneau a été rapportée. Il est conseillé à la femme de retirer l'anneau rompu et de réinsérer un nouvel anneau dès que possible. Une méthode contraceptive mécanique complémentaire, comme le préservatif masculin, doit être utilisée simultanément pendant les 7 jours suivants. L'éventualité d'une grossesse doit être évoquée et la femme doit contacter son médecin.
Expulsion
Des expulsions de l’anneau ont été rapportées, par exemple quand l’anneau n’a pas été correctement mis en place, lors du retrait d’un tampon, pendant les rapports sexuels, ou en cas de constipation sévère ou chronique. Une expulsion prolongée de l’anneau peut entraîner un échec contraceptif ou des saignements irréguliers. En conséquence pour assurer l’efficacité de NUVARING, il faut conseiller à la femme de vérifier régulièrement la présence de NUVARING (par exemple, avant et après un rapport sexuel).
Si NUVARING est accidentellement expulsé et resté en dehors du vagin pendant moins de 3 heures, l’efficacité contraceptive n’est pas réduite. La femme doit rincer l’anneau à l’eau froide ou tiède (mais pas chaude) et le réinsérer dès que possible, au plus tard dans les 3 heures.
Si NUVARING est resté en dehors du vagin pendant plus de 3 heures, ou en cas de doute sur la durée pendant laquelle l’anneau est resté en dehors du vagin, l’efficacité contraceptive peut être réduite. Dans ce cas, les instructions de la rubrique 4.2 « Que faire si l’anneau est temporairement resté en dehors du vagin » doivent être suivies.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Interactions avec d’autres médicaments
Note : les informations concernant les médicaments prescrits en association doivent être consultées afin d’identifier les interactions éventuelles.
Effets d’autres médicaments sur NUVARING
Des interactions peuvent se produire avec les médicaments et les produits à base de plantes inducteurs des enzymes microsomales, ce qui peut conduire à une augmentation de la clairance des hormones sexuelles et peut entraîner des saignements irréguliers et/ou des échecs contraceptifs.
Conduite à tenir
L’induction enzymatique peut être observée après seulement quelques jours de traitement. L’induction enzymatique maximale est généralement observée en quelques semaines. Après l'arrêt du traitement, l’induction enzymatique peut perdurer pendant environ 4 semaines.
Traitement à court terme
Les femmes traitées par des médicaments inducteurs enzymatiques ou produits à base de plantes, doivent temporairement utiliser une méthode contraceptive barrière ou une autre méthode de contraception en plus de NUVARING. Note : NUVARING ne doit pas être utilisé avec un diaphragme, une cape cervicale ou un préservatif féminin. La méthode barrière doit être utilisée pendant toute la durée du traitement concomitant et jusqu’à 28 jours après son arrêt. Si l'administration du médicament concomitant va au-delà des 3 semaines du cycle avec l’anneau, l’anneau suivant devra être inséré immédiatement, sans respecter l'intervalle habituel sans anneau.
Traitement à long terme
Chez les femmes sous traitement à long terme par des substances actives inductrices des enzymes hépatiques, une autre méthode contraceptive fiable, non hormonale doit être recommandée.
Les interactions suivantes ont été rapportées dans la littérature.
Substances augmentant la clairance des contraceptifs hormonaux combinés
Des interactions peuvent se produire avec des médicaments ou des produits à base de plantes inducteurs enzymatiques microsomiaux, en particulier les enzymes du cytochrome P450 (CYP), ce qui peut entraîner une augmentation de la clairance, réduisant les concentrations plasmatiques des hormones sexuelles et pouvant diminuer l’efficacité des contraceptifs hormonaux combinés, y compris NUVARING. Ces produits incluent phénytoïne, phénobarbital, primidone, bosentan, carbamazépine, rifampicine, et potentiellement aussi oxcarbazépine, topiramate, felbamate, griséofulvine, certains inhibiteurs de la protéase du VIH (ex. ritonavir) et les inhibiteurs non nucléosidiques de la transcriptase inverse (ex. éfavirenz), ainsi que les produits contenant du millepertuis.
Substances ayant des effets variables sur la clairance des contraceptifs hormonaux combinés
Lors de l’administration concomitante avec des contraceptifs hormonaux, de nombreuses associations d’inhibiteurs de la protéase du VIH (ex. nelfinavir) et d’inhibiteurs non nucléosidiques de la transcriptase inverse (ex. névirapine), et/ou des associations avec des médicaments contre le VHC (ex. bocéprévir, télaprévir), peuvent augmenter ou diminuer les concentrations plasmatiques des progestatifs, y compris l’étonogestrel, ou de l’œstrogène. Dans certains cas, l'impact de ces modifications peut être cliniquement significatif.
Substances diminuant la clairance des contraceptifs hormonaux combinés
La pertinence clinique des interactions potentielles avec les inhibiteurs enzymatiques reste inconnue. L’administration concomitante d’inhibiteurs puissants du CYP3A4 (par exemple, kétoconazole, itraconazole, clarithromycine) ou modérés (par exemple, fluconazole, diltiazem, érythromycine) peut augmenter les concentrations sériques des œstrogènes ou des progestatifs, y compris l’étonogestrel.
Des cas de rupture d’anneau ont été rapportés pendant l’utilisation concomitante de préparations intravaginales, incluant les produits antimycosiques, antibiotiques et lubrifiants (voir rubrique 4.4 « Ruptures d’anneaux »). D'après les données pharmacocinétiques, il est peu probable que les antimycosiques administrés par voie vaginale ainsi que les spermicides affectent l'efficacité contraceptive et la sécurité d'emploi de NUVARING.
Les contraceptifs hormonaux peuvent interférer avec le métabolisme d’autres médicaments. En conséquence, les concentrations plasmatiques et tissulaires peuvent augmenter (par ex. ciclosporine) ou diminuer (par ex. lamotrigine).
Interactions pharmacodynamiques
L’utilisation concomitante avec des médicaments contenant de l’ombitasvir/paritaprevir/ritonavir et dasabuvir, avec ou sans ribavirine, ou glécaprévir / pibrentasvir peut augmenter le risque d’élévation des ALAT (voir sections 4.3 et 4.4). Ainsi, les utilisatrices de NUVARING doivent passer à une méthode de contraception alternative (par exemple, une contraception à base de progestatifs seuls ou des méthodes non-hormonales), avant de commencer un traitement avec cette combinaison de médicaments. NUVARING peut être réutilisé 2 semaines après la fin du traitement par cette combinaison de médicaments.
Analyses biologiques
L'utilisation de stéroïdes contraceptifs peut influencer les résultats de certains paramètres biologiques dont les paramètres biochimiques hépatiques, thyroïdiens, surrénaliens et rénaux, les taux sériques de protéines porteuses (par exemple la « corticosteroid binding globulin » et la « sex hormone binding globulin »), les fractions lipidiques/lipoprotéiniques, les paramètres du métabolisme des hydrates de carbone et les paramètres de la coagulation et de la fibrinolyse. Les modifications restent en général dans les valeurs normales.
Interactions avec les tampons
Les données pharmacocinétiques montrent que l'utilisation de tampons n'a aucun effet sur l'absorption systémique des hormones libérées par NUVARING. Dans de rares cas, NUVARING peut être expulsé lors du retrait du tampon (cf. « Que faire si l'anneau est temporairement resté en dehors du vagin »).
4.6. Fertilité, grossesse et allaitement
Fertilité
NUVARING est indiqué pour prévenir les grossesses. Si la femme veut arrêter NUVARING pour débuter une grossesse, il lui est conseillé d’attendre d’avoir eu un cycle naturel avant d’essayer de concevoir car cela facilitera le calcul de la date de la naissance.
Grossesse
NUVARING n'est pas indiqué pendant la grossesse. Si une grossesse survient lors de l'utilisation de NUVARING, l'anneau devra être retiré. De larges études épidémiologiques n’ont pas montré d’augmentation du risque de malformation chez les enfants nés de femmes ayant utilisé des COC avant la grossesse, ni d'effet tératogène chez les femmes ayant utilisé des COC par mégarde au début de la grossesse.
Une étude clinique chez un nombre restreint de femmes a montré que malgré l’administration intravaginale, les concentrations intra-utérines des stéroïdes contraceptifs chez les utilisatrices de NUVARING sont comparables aux concentrations observées chez les utilisatrices de COC (voir rubrique 5.2). L'expérience clinique des conséquences des grossesses exposées à NUVARING n'est pas connue.
L’augmentation du risque de TEV en période post-partum doit être prise en compte lors de la reprise de NUVARING (voir rubriques 4.2 et 4.4).
Allaitement
Les œstrogènes peuvent influencer la lactation en diminuant la quantité du lait maternel et en modifiant sa composition. Par conséquent, l'utilisation de NUVARING n'est pas recommandée chez les femmes qui allaitent. De faibles quantités de stéroïdes contraceptifs et/ou de leurs métabolites peuvent passer dans le lait mais il n'existe aucun élément indiquant un effet néfaste sur la santé des nourrissons.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Description de certains effets indésirables particuliers
Une augmentation du risque d'événement thrombotique et thrombo-embolique artériel et veineux, incluant l’infarctus du myocarde, l’AVC, les accidents ischémiques transitoires, la thrombose veineuse et l’embolie pulmonaire, a été observée chez les femmes utilisant des CHC ; ceci est abordé plus en détails en rubrique 4.4.
D’autres effets indésirables ont également été rapportés chez les femmes utilisant des CHC : ils sont abordés plus en détails en rubrique 4.4.
Les évènements indésirables ayant été rapportés avec NUVARING dans les essais cliniques, les études observationnelles, ou depuis la commercialisation sont listés dans le tableau ci-dessous. Les termes MedDRA les plus appropriés pour décrire un type d'effet indésirable ont été retenus.
Tous les évènements indésirables sont listés par classes de systèmes d’organes et par fréquences ; fréquent (≥ 1/100 à < 1/10), peu fréquent (≥ 1/1 000 à < 1/100), rare (≥ 1/10 000 à < 1/1 000) et fréquence indéterminée (ne peut être estimée sur la base des données disponibles).
|
Classes de systèmes d’organes |
Fréquent |
Peu fréquent |
Rare |
Fréquence indéterminée1 |
|
Infections et infestations |
Infections vaginales |
Cervicite, |
|
|
|
Cystite, |
|
|
||
|
infection urinaire |
|
|
||
|
Troubles du système immunitaire |
|
|
|
Réaction d’hypersensibilité, notamment anaphylaxie et aggravation des symptômes d’angioedème héréditaire et acquis |
|
Affections du métabolisme et de la nutrition |
|
Augmentation de l’appétit |
|
|
|
Affections psychiatriques |
Dépression, |
Labilité affective, |
|
|
|
baisse de la libido |
altération de l’humeur, |
|
|
|
|
|
sautes d’humeur |
|
|
|
|
Affections du système nerveux |
Céphalées, |
Vertiges, |
|
|
|
migraines |
hypoesthésies |
|
|
|
|
Affections oculaires |
|
Trouble de la vue |
|
|
|
Affections vasculaires |
|
Bouffées de chaleur |
Accident thrombo-embolique veineux |
|
|
|
Thrombo-embolie artérielle |
|
||
|
Affections gastro-intestinales |
Douleurs abdominales, |
Ballonnement de l’abdomen, |
|
|
|
nausées |
diarrhée, |
|
|
|
|
|
vomissements, |
|
|
|
|
|
constipation |
|
|
|
|
Affections de la peau et du tissu sous-cutané |
Acné |
Alopécie, |
|
Chloasma |
|
|
eczéma, |
|
|
|
|
|
prurit, |
|
|
|
|
|
rash, urticaire |
|
|
|
|
Affections musculo-squelettiques et systémiques |
|
Douleur du dos, |
|
|
|
|
contractions musculaires, |
|
|
|
|
|
douleur aux extrémités |
|
|
|
|
Affections du rein et des voies urinaires |
|
Dysurie, |
|
|
|
|
miction urgente, |
|
|
|
|
|
pollakiurie |
|
|
|
|
Affections des organes de reproduction et du sein |
Tension mammaires, |
Aménorrhée, |
Galactorrhée |
Troubles au niveau du pénis |
|
prurit génital, |
inconfort mammaire, |
|
|
|
|
dysménorrhée, |
hypertrophie mammaire, |
|
|
|
|
douleurs pelviennes, |
masse mammaire, |
|
|
|
|
pertes vaginales |
polype cervical, |
|
|
|
|
|
saignements coïtaux, |
|
|
|
|
|
dyspareunie, |
|
|
|
|
|
ectropion du col, |
|
|
|
|
|
maladie fibrokystique du sein, |
|
|
|
|
|
ménorragie, |
|
|
|
|
|
métrorragie, |
|
|
|
|
|
gêne pelvienne, |
|
|
|
|
|
syndrome prémenstruel, |
|
|
|
|
|
contractions utérines, |
|
|
|
|
|
sensation de brûlure vaginale, |
|
|
|
|
|
odeur vaginale, |
|
|
|
|
|
douleur vaginale, |
|
|
|
|
|
gêne vulvo-vaginale, |
|
|
|
|
|
sécheresse vulvo-vaginale. |
|
|
|
|
Troubles généraux et anomalies au site d’administration |
|
Fatigue, |
|
Excroissance du tissu au niveau du site de l'anneau vaginal |
|
|
irritabilité, |
|
|
|
|
|
malaise, |
|
|
|
|
|
œdème, |
|
|
|
|
|
sensation de corps étranger |
|
|
|
|
Investigations |
Prise de poids |
Augmentation de la pression artérielle |
|
|
|
Lésion, intoxications et complications liées aux procédures |
Gêne liée à l’anneau vaginal, |
Complication liée à l’anneau vaginal |
|
Lésion vaginale associée à une rupture de l’anneau |
|
expulsion de l’anneau vaginal, |
|
|
|
1 Les données sont issues de l’expérience post-marketing.
Des tumeurs hormono-dépendantes (par exemple tumeurs hépatiques, cancer du sein) ont été rapportées lors de l’utilisation de contraceptifs hormonaux combinés. Pour plus d’informations, voir rubrique 4.4.
Très rarement, une rupture de l'anneau a été rapportée lors de l’utilisation de Nuvaring (voir rubriques 4.4 et 4.5).
Interactions
Des métrorragies et/ou un échec de la contraception peuvent être le résultat d’interactions entre d’autres médicaments (inducteurs enzymatiques) et les contraceptifs hormonaux (voir rubrique 4.5).
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Mécanisme d’action
NUVARING contient de l'étonogestrel et de l'éthinylestradiol. L'étonogestrel est un progestatif dérivé de la 19-nortestostérone ; il se lie avec une grande affinité aux récepteurs de la progestérone au niveau des organes cibles. L'éthinylestradiol est un œstrogène largement utilisé dans les contraceptifs. L'effet contraceptif de NUVARING repose sur divers mécanismes, le plus important étant l'inhibition de l'ovulation.
Sécurité et efficacité clinique
Des essais cliniques ont été réalisés à travers le monde (Etats-Unis, Europe, et Brésil) chez des femmes entre 18 et 40 ans. L’efficacité contraceptive semble au moins comparable à l’efficacité connue des contraceptifs oraux combinés. Le tableau suivant montre les indices de Pearl (nombre de grossesses pour 100 années-femme) retrouvés dans les études cliniques avec NUVARING.
|
Méthode d'analyse |
Indice de Pearl |
IC 95 % |
Nombre de cycles |
|
ITT1 (utilisatrices + échecs de la méthode) |
0,96 |
0,64-1,39 |
37 977 |
|
PP2 (échecs de la méthode) |
0,64 |
0,35-1,07 |
28 723 |
1 Intention de traiter
2 Per protocol
Le risque de cancer de l'endomètre et des ovaires est diminué avec l'utilisation de COC fortement dosés (0,05 mg d'éthinylestradiol). Il reste à déterminer si ceci s'applique aussi à des contraceptifs faiblement dosés comme NUVARING.
Profil de saignements
Une vaste étude comparative avec un contraceptif oral contenant 150 µg de lévonorgestrel/30 µg d'éthinylestradiol (n = 512 vs n = 518) évaluant le profil des saignements vaginaux sur 13 cycles a montré une faible incidence des spottings ou des saignements irréguliers chez les utilisatrices de NUVARING (2,0 – 6,4%). De plus, les hémorragies de privation sont survenues exclusivement pendant l'intervalle sans anneau chez la plupart des utilisatrices (58,8 – 72,8%).
Effets sur la densité minérale osseuse
Les effets de NUVARING (n = 76) sur la densité minérale osseuse (DMO) ont été étudiés chez la femme en comparaison à un dispositif intra-utérin non hormonal (DIU) (n = 31) sur une période de 2 ans. Aucun effet indésirable sur la masse osseuse n'a été observé.
Population pédiatrique
La sécurité et l’efficacité de NUVARING n’ont pas été étudiées chez les adolescentes de moins de 18 ans.
5.2. Propriétés pharmacocinétiques
Absorption
L'absorption au niveau de la muqueuse vaginale de l'étonogestrel libéré par NUVARING est rapide. Des concentrations sériques maximales d'étonogestrel d'environ 1 700 pg/ml sont atteintes environ une semaine après l'insertion. Les concentrations sériques présentent de légères fluctuations et diminuent lentement jusqu'à environ 1 600 pg/ml après 1 semaine, 1 500 pg/ml après 2 semaines et 1 400 pg/ml après 3 semaines d’utilisation. La biodisponibilité absolue est d'environ 100 %, ce qui est supérieur à celle observée après administration par voie orale. Les taux cervicaux et intra-utérins d’étonogestrel ont été mesurés chez un nombre restreint de femmes utilisant NUVARING ou un contraceptif oral contenant 0,150 mg de désogestrel et 0,020 mg d’éthinylestradiol. Les taux observés étaient comparables dans les 2 groupes.
Distribution
L'étonogestrel est lié à l'albumine sérique et à la « Sex Hormone Binding Globulin » (SHBG). Le volume de distribution apparent de l'étonogestrel est de 2,3 l/kg.
Biotransformation
L'étonogestrel est métabolisé par les voies connues du métabolisme des stéroïdes. La clairance sérique apparente est d'environ 3,5 l/heure. Aucune interaction directe n'a été constatée avec l'éthinylestradiol administré de manière concomitante.
Élimination
Les concentrations sériques d'étonogestrel diminuent en deux phases. La phase d'élimination terminale se caractérise par une demi-vie d'environ 29 heures. L'étonogestrel et ses métabolites sont éliminés par voie urinaire et par voie biliaire avec un ratio de 1,7/1. La demi-vie d'élimination des métabolites est d'environ 6 jours.
ETHINYLESTRADIOL
Absorption
L'absorption au niveau de la muqueuse vaginale de l'éthinylestradiol libéré par NUVARING est rapide. Des concentrations sériques maximales d'environ 35 pg/ml sont atteintes 3 jours après l'insertion et diminuent jusqu'à 19 pg/ml après 1 semaine, 18 pg/ml après 2 semaines et 18 pg/ml après 3 semaines d’utilisation. L’exposition systémique mensuelle à l’éthinylestradiol (AUC 0-¥) avec NUVARING est 10,9 ng.h/ml. La biodisponibilité absolue est d'environ 56 %, ce qui est comparable à l'administration de l'éthinylestradiol par voie orale. Les taux cervicaux et intra-utérins d’éthinylestradiol ont été mesurés chez un nombre restreint de femmes utilisant NUVARING ou un contraceptif oral contenant 0,150 mg de désogestrel et 0,020 mg d’éthinylestradiol. Les taux observés étaient comparables dans les 2 groupes.
Distribution
L'éthinylestradiol est fortement lié à l'albumine sérique, mais de manière non spécifique. Le volume de distribution apparent est d'environ 15 l/kg.
Biotransformation
L'éthinylestradiol est principalement métabolisé par hydroxylation aromatique mais il existe une grande variété de métabolites hydroxylés et méthylés. Ceux-ci sont présents sous forme de métabolites libres et sous forme sulfo ou glucuronoconjugués. La clairance apparente est de 35 l/h environ.
Elimination
Les concentrations sériques d'éthinylestradiol diminuent en deux phases. La phase d'élimination terminale se caractérise par une variation individuelle importante de la demi-vie, aboutissant à une médiane de demi-vie d'environ 34 heures. L'ethinylestradiol, sous forme inchangée n'est pas éliminé; les métabolites de l'éthinylestradiol sont éliminés par voie urinaire et par voie biliaire avec un ratio de 1,3/1. La demi-vie d'élimination des métabolites est d'environ 1,5 jours.
Populations spécifiques
Population pédiatrique :
La pharmacocinétique de NUVARING n’a pas été étudiée chez les adolescentes menstruées en bonne santé de moins de 18 ans.
Effet d’une dysfonction rénale :
Aucune étude n’a été réalisée pour évaluer l’effet d’une dysfonction rénale sur la pharmacocinétique de NUVARING.
Effet d’une dysfonction hépatique :
Aucune étude n’a été réalisée pour évaluer l’effet des maladies hépatiques sur la pharmacocinétique de NUVARING. Cependant, les hormones stéroïdes peuvent être mal métabolisées chez les femmes souffrant d’une dysfonction hépatique.
Groupes ethniques :
Aucune étude formalisée n’a été réalisée pour étudier la pharmacocinétique de NUVARING dans les groupes ethniques.
5.3. Données de sécurité préclinique
Evaluation du risque environnemental
Des études d'évaluation du risque environnemental ont montré que le 17α-éthinylestradiol et l’étonogestrel peuvent présenter un risque pour les organismes vivant dans les eaux de surface (voir rubrique 6.6).
6.4. Précautions particulières de conservation
Avant la délivrance à la patiente : 3 ans.
A conserver au réfrigérateur (entre 2°C et 8°C).
Au moment de la délivrance à la patiente : Le pharmacien inscrit la date de délivrance sur les articles de conditionnement. Le produit ne doit pas être inséré plus de 4 mois après la date de délivrance, mais dans tous les cas avant la date de péremption, la date la plus précoce devant être respectée.
Après la délivrance à la patiente : 4 mois. A conserver à une température en dessous de 30°C et dans le conditionnement primaire d'origine, à l’abri de la lumière et de l’humidité.
6.5. Nature et contenu de l'emballage extérieur
Système de diffusion vaginal (anneau vaginal) en sachet. Le sachet est constitué d'un film d'aluminium comportant une couche interne de polyéthylène de faible densité et une couche externe de polyéthylène téréphtalate (PET). Il est étanche et peut être refermé. Le sachet est inclus dans la boîte avec la notice.
Applicateur NUVARING
Fourni séparément ou inclus dans l’emballage. L'applicateur NUVARING peut ne pas être disponible dans tous les pays. L'applicateur est un dispositif en plastique, non stérile, fabriqué à partir d’un polymère de polypropylène contenant un additif de réduction de frottement (moins de 5%). Il est destiné à un usage unique (c'est-à-dire jetable). Chaque applicateur est emballé individuellement. L'applicateur possède un marquage CE, gravé sur le dispositif.
Le produit est fourni comme suit :
· Boîte de 1 anneau
· Boîte de 1 anneau et 1 applicateur
· Boîte de 3 anneaux
· Boîte de 3 anneaux et 3 applicateurs
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
NUVARING
Voir rubrique 4.2 Posologie et mode d'administration. Le pharmacien doit préciser la date de délivrance sur les articles de conditionnement. Il est recommandé pour la présentation par 3 sachets d'indiquer cette date sur l'étui et sur chaque sachet. NUVARING ne doit pas être inséré plus de 4 mois après la date de délivrance mais dans tous les cas avant la date de péremption, la date la plus précoce devant être respectée. Après retrait, NUVARING devra être conservé dans le sachet refermable. NUVARING devra être jeté avec les déchets domestiques normaux de manière à éviter tout contact accidentel. Ce médicament peut présenter un risque pour l’environnement (voir rubrique 5.3). NUVARING ne devra pas être jeté dans les toilettes. Les anneaux non utilisés (périmés) doivent être éliminés conformément à la réglementation en vigueur.
Applicateur NUVARING
L'applicateur NUVARING ne doit pas être réutilisé ; il est conçu pour un usage unique. Si l'applicateur tombe accidentellement, il doit être lavé avec de l'eau froide à tiède (PAS d’eau chaude). L'applicateur doit être jeté avec les déchets ménagers traditionnels immédiatement après utilisation. Il ne doit pas être jeté dans les toilettes.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
176 RUE MONTMARTRE
75002 PARIS
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 363 081 3 8 : anneau vaginal en sachet (Aluminium/PE/Polyester) ; boîte de 1.
· 34009 363 083 6 7 : anneau vaginal en sachet (Aluminium/PE/Polyester) ; boîte de 3.
· 34009 301 028 8 6 : anneau vaginal en sachet (Aluminium/PE/Polyester) et applicateur ; boîte de 1 anneau et 1 applicateur.
· 34009 301 028 93 : anneau vaginal en sachet (Aluminium/PE/Polyester) et applicateur ; boîte de 3 anneaux et 3 applicateurs.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Liste I
ANSM - Mis à jour le : 25/02/2025
NUVARING 15 microgrammes/120 microgrammes/24 heures, système de diffusion vaginal
Ethinylestradiol/Etonogestrel
Points importants à connaître concernant les contraceptifs hormonaux combinés (CHC) :
· Ils comptent parmi les méthodes de contraception réversibles les plus fiables lorsqu’ils sont utilisés correctement.
· Ils augmentent légèrement le risque de formation d’un caillot sanguin dans les veines et les artères, en particulier pendant la première année de leur utilisation ou lorsque le contraceptif hormonal combiné est repris après une interruption de 4 semaines ou plus.
· Soyez vigilante et consultez votre médecin si vous pensez présenter les symptômes évocateurs d’un caillot sanguin (voir rubrique 2 « Caillots sanguins »).
Veuillez lire attentivement cette notice avant d’utiliser NUVARING car elle contient des informations importantes pour vous.
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin ou votre pharmacien.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que NUVARING 15 microgrammes/120 microgrammes/24 heures, système de diffusion vaginal et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d'utiliser NUVARING 15 microgrammes/ 120 microgrammes/24 heures, système de diffusion vaginal ?
3. Comment utiliser NUVARING 15 microgrammes/120 microgrammes/24 heures, système de diffusion vaginal ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver NUVARING 15 microgrammes/120 microgrammes/24 heures, système de diffusion vaginal ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE NUVARING 15 microgrammes/120 microgrammes/24 heures, système de diffusion vaginal ET DANS QUELS CAS EST-IL UTILISE ?
NUVARING est un anneau vaginal contraceptif utilisé pour empêcher la survenue d'une grossesse.
Chaque anneau comporte une petite quantité de 2 hormones sexuelles féminines : l'étonogestrel et l'éthinylestradiol. L'anneau libère lentement ces hormones dans la circulation sanguine. En raison de la faible quantité d'hormones libérées, NUVARING est considéré comme un contraceptif hormonal faiblement dosé. Dans la mesure où NUVARING libère 2 types d'hormones différentes, il s'agit d'un contraceptif hormonal combiné.
NUVARING agit comme une pilule contraceptive estroprogestative mais au lieu de prendre un comprimé chaque jour, l'anneau est utilisé pendant 3 semaines d’affilée sans interruption.
NUVARING libère deux hormones sexuelles féminines qui empêchent la libération de l'ovule par les ovaires. S’il n’y a pas d’ovulation, vous ne pourrez pas être enceinte.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER NUVARING 15 microgrammes/120 microgrammes/24 heures, système de diffusion vaginal ?
|
Avant de commencer à utiliser NUVARING, vous devez lire les informations concernant les caillots sanguins en rubrique 2. Il est particulièrement important de lire la description des symptômes d’un caillot sanguin - voir rubrique 2, « Caillots sanguins ». Cette notice décrit plusieurs situations au cours desquelles vous devez arrêter d'utiliser NUVARING ou qui peuvent le rendre moins fiable. Dans de telles situations, vous devez vous abstenir de tout rapport sexuel ou utiliser une méthode contraceptive non hormonale complémentaire, telle qu'un préservatif masculin ou une autre méthode dite « barrière ». Ne pas utiliser des méthodes fondées sur le calcul du jour de l'ovulation ou sur la température. En effet, ces méthodes peuvent ne pas être fiables car NUVARING modifie la courbe de température mensuelle et la glaire cervicale. Comme les autres contraceptifs hormonaux, NUVARING ne protège pas de l'infection à VIH (SIDA), ni des autres maladies sexuellement transmissibles. |
N’utilisez jamais NUVARING 15 microgrammes/120 microgrammes/24 heures, système de diffusion vaginal :
Vous ne devez pas utiliser NUVARING si vous êtes dans l’une des situations listées ci-dessous. Si tel est le cas, vous devez en informer votre médecin. Votre médecin discutera avec vous d’autres méthodes de contraception qui seraient plus adaptées.
· si vous avez (ou avez déjà eu) un caillot dans un vaisseau sanguin d’une jambe (thrombose veineuse profonde [TVP]), d’un poumon (embolie pulmonaire [EP]), ou d'autres organes ;
· si vous vous savez atteinte d’un trouble affectant la coagulation sanguine – par exemple, un déficit en protéine C, un déficit en protéine S, un déficit en antithrombine III, une mutation du facteur V de Leiden ou la présence d’anticorps anti-phospholipides ;
· si vous devez être opérée ou si vous êtes alitée pendant une durée prolongée (voir rubrique « Caillots sanguins ») ;
· si vous avez déjà eu une crise cardiaque ou un accident vasculaire cérébral (AVC) ;
· si vous avez (ou avez déjà eu) une angine de poitrine (une maladie provoquant des douleurs intenses dans la poitrine et pouvant être le signe précurseur d’une crise cardiaque) ou un accident ischémique transitoire (AIT – symptômes temporaires d’AVC) ;
· si vous avez l’une des maladies suivantes pouvant augmenter le risque de caillot dans les artères :
o diabète sévère avec atteinte des vaisseaux sanguins
o pression artérielle très élevée
o taux très élevé de graisses dans le sang (cholestérol ou triglycérides)
o maladie appelée hyperhomocystéinémie
· si vous avez (ou avez déjà eu) un type de migraine appelé « migraine avec aura » ;
· si vous avez (ou avez eu) une pancréatite (inflammation du pancréas) associée à des taux élevés de graisses dans le sang ;
· si vous avez (ou avez eu) une maladie sévère du foie avec non-retour à la normale des paramètres hépatiques ;
· si vous avez (ou avez eu) une tumeur bénigne ou maligne du foie ;
· si vous avez (ou avez eu), ou vous êtes susceptible d’avoir un cancer du sein ou des organes génitaux ;
· si vous présentez des saignements vaginaux d'origine indéterminée ;
· si vous êtes allergique à l'étonogestrel ou à l'éthinylestradiol ou à l’un des autres composants contenus dans ce médicament (mentionnés dans la rubrique 6).
N’utilisez pas NUVARING si vous avez une hépatite C et que vous prenez des médicaments contenant ombitasvir / paritaprevir / ritonavir et dasabuvir ou glécaprévir / pibrentasvir (voir aussi la rubrique « Autres médicaments et NUVARING »).
En cas de survenue de l'une des affections ci-dessus alors que vous utilisez NUVARING, retirez immédiatement l’anneau et contactez votre médecin. En attendant, utilisez des mesures contraceptives non hormonales.
Avertissements et précautions
|
Dans quels cas devez-vous contacter votre médecin ? Consultez un médecin de toute urgence · si vous remarquez de possibles signes d’un caillot sanguin, qui pourraient indiquer que vous avez un caillot sanguin dans une jambe (thrombose veineuse profonde), que vous avez un caillot sanguin dans un poumon (embolie pulmonaire) ou que vous faites une crise cardiaque ou un AVC (voir la rubrique « Caillots sanguins » ci-dessous). Pour la description des symptômes de ces effets indésirables graves, reportez-vous à la rubrique « Comment reconnaître un caillot sanguin ». |
Si vous êtes dans l’une des situations suivantes, informez-en votre médecin.
Si le problème apparaît ou s’aggrave pendant l’utilisation de NUVARING, vous devez également en informer votre médecin.
· si un membre de votre famille a ou a déjà eu un cancer du sein ;
· si vous avez de l’épilepsie (voir rubrique « Autres médicaments et NUVARING ») ;
· si vous avez une maladie du foie (par exemple : jaunisse) ou une maladie de la vésicule biliaire (par exemple : calculs dans la vésicule biliaire) ;
· si vous êtes atteinte de la maladie de Crohn ou de rectocolite hémorragique (maladies inflammatoires chroniques des intestins) ;
· si vous avez un lupus érythémateux disséminé (LED) (une maladie qui affecte votre système de défenses naturelles) ;
· si vous avez un syndrome hémolytique et urémique (SHU) (un trouble de la coagulation sanguine qui entraîne une défaillance des reins) ;
· si vous avez une drépanocytose (une maladie héréditaire touchant les globules rouges) ;
· si vous avez des taux élevés de graisses dans le sang (hypertriglycéridémie) ou des antécédents familiaux de ce trouble. L’hypertriglycéridémie a été associée à une augmentation du risque de pancréatite (inflammation du pancréas) ;
· si vous devez être opérée ou si vous êtes alitée pendant une durée prolongée (reportez-vous à la rubrique 2, « Caillots sanguins ») ;
· si vous venez juste d’accoucher, vous êtes exposée à un risque augmenté de caillots sanguins. Vous devez demander à votre médecin combien de temps après l’accouchement vous pouvez commencer à utiliser NUVARING ;
· si vous avez une inflammation des veines situées sous la peau (thrombophlébite superficielle) ;
· si vous avez des varices ;
· si vous avez une maladie apparue pour la 1ère fois ou s'étant aggravée lors d'une grossesse ou d'un précédent traitement hormonal (par exemple perte de l'audition, porphyrie (maladie du sang), herpès gestationnel (éruptions cutanées avec des vésicules survenant au cours d'une grossesse) ou une chorée de Sydenham (maladie des nerfs au cours de laquelle apparaissent des mouvements soudains du corps) ;
· si vous présentez les symptômes d’un angioedème tels que gonflement du visage, de la langue et/ou de la gorge et/ou des difficultés à avaler ou une éruption d’urticaire potentiellement associés à une difficulté à respirer, contactez immédiatement un médecin. Les médicaments contenant des œstrogènes peuvent causer ou aggraver des symptômes d'angioedème héréditaire et acquis. ;
· si vous avez (ou avez eu) un chloasma (taches pigmentées brun-jaune, appelées aussi masque de grossesse, en général au niveau du visage). Evitez de vous exposer au soleil ou aux radiations UV
· en cas de constipation, de prolapsus du col de l’utérus ou de douleurs au cours des rapports sexuels, l'utilisation de NUVARING peut s'avérer difficile ;
· si vous avez une miction urgente, fréquente, brûlante et/ou douloureuse, et ne pouvez pas localiser l'anneau dans le vagin. Ces symptômes pourraient indiquer un placement accidentel de NUVARING dans la vessie.
CAILLOTS SANGUINS
L'utilisation d’un contraceptif hormonal combiné tel que NUVARING augmente le risque d’apparition d’un caillot sanguin en comparaison à une non-utilisation. Dans de rares cas, un caillot sanguin peut bloquer des vaisseaux sanguins et provoquer de graves problèmes.
Les caillots sanguins peuvent se former :
· dans les veines (on parle alors de « thrombose veineuse » ou de « thrombo-embolie veineuse » [TEV]) ;
· dans les artères (on parle alors de « thrombose artérielle » ou de « thrombo-embolie artérielle » [TEA]).
Le rétablissement, suite à des caillots sanguins, n’est pas toujours complet. Dans de rares cas, ils peuvent entraîner des séquelles graves et durables et, dans de très rares cas, ils peuvent être fatals.
Il est important de garder à l’esprit que le risque global de caillot sanguin dû à NUVARING est faible.
COMMENT RECONNAITRE UN CAILLOT SANGUIN
Consultez un médecin de toute urgence si vous remarquez l’un des signes ou symptômes suivants.
|
Présentez-vous l’un de ces signes ? |
Il peut éventuellement s’agir de : |
|
· gonflement d’une jambe ou le long d’une veine de la jambe ou du pied, en particulier s’il s’accompagne de : |
Thrombose veineuse profonde |
|
o douleur ou sensibilité dans la jambe, pouvant n’être ressentie qu’en position debout ou lors de la marche ; |
|
|
o chaleur dans la jambe affectée ; |
|
|
o changement de couleur de la peau de la jambe, devenant p. ex. pâle, rouge ou bleue. |
|
|
· apparition soudaine et inexpliquée d’un essoufflement ou d’une respiration rapide ; |
Embolie pulmonaire |
|
· toux soudaine sans cause apparente, avec parfois des crachats de sang ; |
|
|
· douleur aiguë dans la poitrine, qui peut s’accentuer en cas de respiration profonde ; |
|
|
· étourdissements ou sensations vertigineuses sévères ; |
|
|
· battements de cœur rapides ou irréguliers ; |
|
|
· douleur intense dans l’estomac. |
|
|
En cas de doute, consultez un médecin car certains de ces symptômes, comme la toux ou l’essoufflement, peuvent être pris à tort pour les signes d’une maladie moins sévère telle qu’une infection respiratoire (p.ex. un simple rhume). |
|
|
Symptômes apparaissant le plus souvent dans un seul œil : |
Thrombose veineuse rétinienne (caillot sanguin dans l’œil) |
|
· perte immédiate de la vision ou |
|
|
· vision trouble sans douleur pouvant évoluer vers une perte de la vision. |
|
|
· douleur, gêne, pression, lourdeur dans la poitrine ; |
Crise cardiaque |
|
· sensation d’oppression ou d’encombrement dans la poitrine, le bras ou sous le sternum ; |
|
|
· sensation d’encombrement, d’indigestion ou de suffocation ; |
|
|
· sensation de gêne dans le haut du corps irradiant vers le dos, la mâchoire, la gorge, le bras et l’estomac ; |
|
|
· transpiration, nausées, vomissements ou sensations vertigineuses ; |
|
|
· faiblesse, anxiété ou essoufflement extrêmes ; |
|
|
· battements de cœur rapides ou irréguliers. |
|
|
· apparition soudaine d’une faiblesse ou d’un engourdissement au niveau du visage, d’un bras ou d’une jambe, en particulier d’un côté du corps ; |
Accident vasculaire cérébral (AVC) |
|
· apparition soudaine d’une confusion, de difficultés à parler ou à comprendre ; |
|
|
· apparition soudaine de difficultés à voir d’un œil ou des deux yeux ; |
|
|
· apparition soudaine de difficultés à marcher, de sensations vertigineuses, d’une perte d’équilibre ou de coordination ; |
|
|
· maux de tête soudains, sévères ou prolongés, sans cause connue ; |
|
|
· perte de conscience ou évanouissement avec ou sans crise convulsive. |
|
|
Parfois, les symptômes de l’AVC peuvent être de courte durée, avec un rétablissement presque immédiat et complet, mais vous devez tout de même consulter un médecin de toute urgence car vous pourriez être exposée au risque d’un nouvel AVC. |
|
|
· gonflement et coloration légèrement bleutée d’une extrémité ; |
Caillots sanguins bloquant d’autres vaisseaux sanguins |
|
· douleur intense dans l’estomac (« abdomen aigu ») |
CAILLOTS SANGUINS DANS UNE VEINE
Que peut-il se passer si un caillot sanguin se forme dans une veine ?
· Un lien a été établi entre l’utilisation de contraceptifs hormonaux combinés et l’augmentation du risque de caillots sanguins dans les veines (thrombose veineuse). Cependant, ces effets indésirables sont rares. Le plus souvent, ils surviennent pendant la première année d’utilisation d’un contraceptif hormonal combiné.
· Lorsqu’un caillot sanguin se forme dans une veine d’une jambe ou d’un pied, il peut provoquer une thrombose veineuse profonde (TVP).
· Si le caillot sanguin migre de la jambe vers le poumon, il peut provoquer une embolie pulmonaire.
· Dans de très rares cas, un caillot peut se former dans une veine d’un autre organe, comme l’œil (thrombose veineuse rétinienne).
À quel moment le risque d’apparition d’un caillot sanguin dans une veine est-il le plus élevé ?
Le risque d’apparition d’un caillot sanguin dans une veine est maximal pendant la première année d’utilisation d’un contraceptif hormonal combiné pris pour la première fois. Le risque peut également être augmenté lorsque vous recommencez à prendre un contraceptif hormonal combiné (le même produit ou un produit différent) après une interruption de 4 semaines ou plus.
Après la première année, le risque diminue mais reste toujours légèrement plus élevé que si vous n’utilisiez pas de contraceptif hormonal combiné.
Lorsque vous arrêtez de prendre NUVARING, le risque d’apparition de caillot sanguin revient à la normale en quelques semaines.
Quel est le risque d’apparition d’un caillot sanguin ?
Le risque dépend de votre risque de base de TEV et du type de contraceptif hormonal combiné que vous prenez.
Le risque global de caillot sanguin dans une jambe ou un poumon (TVP ou EP) associé à NUVARING est faible.
· Sur 10 000 femmes qui n’utilisent aucun contraceptif hormonal combiné et qui ne sont pas enceintes, environ 2 développeront un caillot sanguin sur une période d’un an.
· Sur 10 000 femmes qui utilisent un contraceptif hormonal combiné contenant du lévonorgestrel, de la noréthistérone ou du norgestimate, environ 5 à 7 développeront un caillot sanguin sur une période d’un an.
· Sur 10 000 femmes qui utilisent un contraceptif hormonal combiné contenant de la norelgestromine, ou de l’étonogestrel comme NUVARING, environ 6 à 12 développeront un caillot sanguin sur une période d’un an.
· Le risque d’apparition d’un caillot sanguin variera selon vos antécédents médicaux personnels (voir « Facteurs augmentant le risque de caillot sanguin » ci-dessous).
|
|
Risque d’apparition d’un caillot sanguin sur une période d’un an |
|
Femmes qui n’utilisent pas de contraceptif hormonal combiné (pilule/patch/anneau) et qui ne sont pas enceintes |
Environ 2 femmes sur 10 000 |
|
Femmes qui utilisent une pilule contraceptive hormonale combinée contenant du lévonorgestrel, de la noréthistérone ou du norgestimate |
Environ 5 à 7 femmes sur 10 000 |
|
Femmes qui utilisent NUVARING |
Environ 6 à 12 femmes sur 10 000 |
Facteurs augmentant le risque de caillot sanguin dans une veine
Le risque de caillot sanguin associé à NUVARING est faible mais certaines situations peuvent augmenter ce risque. Le risque sera plus élevé :
· si vous avez un surpoids important (indice de masse corporelle [IMC] supérieur à 30 kg/m2) ;
· si l’un des membres de votre famille proche a eu un caillot sanguin dans une jambe, un poumon, ou un autre organe à un âge relativement jeune (p. ex. avant l’âge de 50 ans). Si tel est le cas, vous pourriez être atteinte d’un trouble héréditaire de la coagulation sanguine ;
· si vous devez être opérée ou si vous êtes alitée pendant une période prolongée en raison d’une blessure ou d’une maladie, ou si votre jambe est immobilisée (p. ex. plâtre). Il pourra être nécessaire d’interrompre l’utilisation de NUVARING plusieurs semaines avant l’opération chirurgicale et/ou tant que votre mobilité est réduite. Si vous devez arrêter d’utiliser NUVARING, demandez à votre médecin à quel moment vous pourrez recommencer à l’utiliser ;
· avec l'âge (en particulier au-delà de 35 ans) ;
· si vous avez accouché dans les semaines précédentes.
Plus vous cumulez ces situations, plus le risque d’apparition d’un caillot sanguin augmente.
Les voyages en avion (de plus de 4 heures) peuvent augmenter temporairement le risque de caillot sanguin, en particulier si vous présentez déjà certains des autres facteurs listés.
Il est important de prévenir votre médecin si vous êtes concernée par l’une de ces situations, même si vous n’en êtes pas certaine. Votre médecin pourra décider qu’il est nécessaire d’arrêter le traitement par NUVARING.
Si l’une des situations ci-dessus évolue pendant la période où vous utilisez NUVARING, par exemple si un membre de votre famille proche développe une thrombose sans raison connue ou si vous prenez beaucoup de poids, parlez-en à votre médecin.
CAILLOTS SANGUINS DANS UNE ARTERE
Que peut-il se passer si un caillot sanguin se forme dans une artère ?
Comme un caillot sanguin dans une veine, un caillot dans une artère peut provoquer de graves problèmes. Par exemple, il peut provoquer une crise cardiaque ou un accident vasculaire cérébral (AVC).
Facteurs augmentant le risque de caillot sanguin dans une artère
Il est important de noter que le risque de crise cardiaque ou d’AVC lié à l’utilisation de NUVARING est très faible mais peut augmenter :
· avec l'âge (au-delà de 35 ans) ;
· si vous fumez. Lors de l’utilisation d’un contraceptif hormonal combiné tel que NUVARING, il est conseillé d'arrêter de fumer. Si vous ne parvenez pas à arrêter de fumer et si vous êtes âgée de plus de 35 ans, votre médecin pourra vous conseiller d’utiliser une méthode de contraception différente ;
· si vous êtes en surpoids ;
· si vous avez une pression artérielle élevée ;
· si un membre de votre famille proche a déjà eu une crise cardiaque ou un AVC à un âge relativement jeune (avant l’âge de 50 ans). Si tel est le cas, le risque que vous ayez une crise cardiaque ou un AVC pourrait également être plus élevé ;
· si vous, ou un membre de votre famille proche, avez un taux de graisses élevé dans le sang (cholestérol ou triglycérides) ;
· si vous avez des migraines, en particulier des migraines avec aura ;
· si vous avez des problèmes cardiaques (maladie de la valve cardiaque, trouble du rythme appelé fibrillation auriculaire) ;
· si vous êtes diabétique.
Si vous cumulez plusieurs de ces situations ou si l’une d’entre elles est particulièrement sévère, le risque d’apparition d’un caillot sanguin peut être encore plus élevé.
Si l’une des situations ci-dessus évolue pendant la période où vous utilisez NUVARING, par exemple si vous commencez à fumer, si un membre de votre famille proche développe une thrombose sans raison connue ou si vous prenez beaucoup de poids, parlez-en à votre médecin.
Cancer
Les informations fournies ci-dessous proviennent d'études sur les contraceptifs oraux combinés et peuvent également s'appliquer à NUVARING. Il n'existe aucune information relative à l'administration par voie vaginale d'hormones contraceptives (comme dans le cas de NUVARING).
Le cancer du sein est légèrement plus fréquent chez les femmes utilisant un contraceptif oral combiné. Il n'est cependant pas établi si cette différence est due au contraceptif oral combiné. En effet, il est possible que les femmes prenant un contraceptif oral combiné soient examinées plus souvent par leurs médecins. Cette différence disparaît progressivement après l'arrêt du contraceptif oral.
Il est important d'examiner régulièrement vos seins. En cas de survenue d'une grosseur suspecte, d’un cancer ou d’antécédent de cancer du sein dans votre famille, contactez votre médecin (voir rubrique « Avertissements et précautions »).
Dans de rares cas, des tumeurs bénignes du foie, et plus rarement encore des tumeurs malignes du foie, ont été observées chez des femmes prenant un contraceptif oral. Consultez votre médecin si vous présentez subitement des maux de ventre intenses.
Chez les utilisatrices de contraceptifs oraux combinés, il a été rapporté que les cancers de l’endomètre (muqueuse utérine) et les cancers des ovaires étaient moins fréquents, ce qui pourrait aussi s’appliquer à NUVARING mais qui n’a pas été démontré.
Troubles psychiatriques
Certaines femmes qui utilisent des contraceptifs hormonaux dont NUVARING ont fait état d’une dépression ou d’un état dépressif. La dépression peut être grave et peut parfois donner lieu à des idées suicidaires. Si vous présentez des changements d’humeur et des symptômes dépressifs, sollicitez les conseils de votre médecin dès que possible.
Enfants et adolescents
La sécurité et l’efficacité de NUVARING n’ont pas été étudiées chez les adolescentes de moins de 18 ans.
Autres médicaments et NUVARING 15 microgrammes/120 microgrammes/24 heures, système de diffusion vaginal
|
Indiquez toujours à votre médecin quels médicaments ou produits à base de plantes vous prenez déjà. Indiquez également à tout autre médecin ou dentiste (ou au pharmacien) qui vous prescrit un autre médicament que vous utilisez NUVARING. Ils pourront vous dire si vous avez besoin de prendre des précautions contraceptives supplémentaires (par exemple, des préservatifs masculins) et le cas échéant, pendant combien de temps, ou si un autre médicament dont vous avez besoin doit être changé. |
Certains médicaments
· peuvent influer sur les taux sanguins de NUVARING
· peuvent le rendre moins efficace pour prévenir une grossesse
· peuvent provoquer des saignements inattendus.
Cela inclut des médicaments utilisés pour le traitement :
· de l'épilepsie (par exemple, primidone, phénytoïne, barbituriques, carbamazépine, oxcarbazépine, topiramate, felbamate) ;
· de la tuberculose (par exemple, rifampicine) ;
· de l’infection par le VIH (par exemple, ritonavir, nelfinavir, névirapine, éfavirenz) ;
· de l’infection par le virus de l’hépatite C (par exemple bocéprévir, télaprévir) ;
· d'autres maladies infectieuses (par exemple, griséofulvine) ;
· de l’hypertension artérielle dans les vaisseaux sanguins du poumon (bosentan) ;
· de l’humeur dépressive (millepertuis).
Si vous prenez des médicaments ou des produits à base de plantes qui peuvent rendre NUVARING moins efficace, une méthode contraceptive barrière doit également être utilisée (par exemple, un préservatif masculin). Comme l'effet d'un autre médicament sur NUVARING peut durer jusqu'à 28 jours après l'arrêt du médicament, il est nécessaire d'utiliser une méthode contraceptive barrière supplémentaire pendant toute cette durée. Note : Ne pas utiliser NUVARING avec un diaphragme, une cape cervicale ou un préservatif féminin.
NUVARING peut influencer l'effet d'autres médicaments, par exemple :
· les médicaments contenant de la ciclosporine
· l’antiépileptique lamotrigine (cela pourrait conduire à une augmentation de la fréquence des crises d’épilepsie).
N’utilisez pas NUVARING si vous avez une hépatite C et que vous prenez des médicaments contenant ombitasvir / paritaprevir / ritonavir et dasabuvir ou glécaprévir / pibrentasvir car cela peut entraîner des augmentations des résultats des tests sanguins de la fonction hépatique (augmentation des enzymes hépatiques ALAT). Votre médecin vous prescrira un autre moyen de contraception avant de commencer le traitement par ces médicaments. NUVARING peut être réutilisé environ 2 semaines après la fin de ce traitement. Voir rubrique 2 « N’utilisez jamais NUVARING ».
Demandez conseil à votre médecin ou pharmacien avant d’utiliser tout médicament.
Vous pouvez utiliser des tampons en même temps que NUVARING. Insérez NUVARING avant d'insérer le tampon. Faites également attention à ne pas extraire accidentellement l'anneau lors du retrait du tampon. Dans le cas où l'anneau sortirait avec le tampon, rincez-le simplement à l'eau froide voire tiède et remettez-le immédiatement en place.
Une rupture de l’anneau s’est produite lors de l’utilisation d’un produit vaginal tel qu’un lubrifiant ou un traitement pour une infection (voir la rubrique 3 « Que faire si votre anneau se rompt ?»). L'utilisation de spermicides ou d'antimycosiques administrés par voie vaginale ne réduira pas l'efficacité contraceptive de NUVARING.
Analyses biologiques
Si vous faites des analyses de sang ou d’urine, informez votre professionnel de santé que vous utilisez NUVARING car il peut avoir une influence sur les résultats de ces analyses.
Grossesse et allaitement
NUVARING ne doit pas être utilisé chez la femme enceinte ou qui pense l'être. Si vous découvrez que vous êtes enceinte pendant l'utilisation de NUVARING, retirez l'anneau et consultez votre médecin.
Si vous voulez arrêter d’utiliser NUVARING parce que vous envisagez une grossesse, voir la rubrique 3 « Si vous arrêtez d’utiliser NUVARING ».
En cas d'allaitement, l'utilisation de NUVARING n'est généralement pas recommandée. Si vous souhaitez utiliser NUVARING alors que vous allaitez, veuillez demander conseil à votre médecin.
Conduite de véhicules et utilisation de machines
Il est peu probable que NUVARING ait un effet sur votre aptitude à conduire des véhicules ou à utiliser des machines.
3. COMMENT UTILISER NUVARING 15 microgrammes/120 microgrammes/24 heures, système de diffusion vaginal ?
Quand et comment utiliser NUVARING ?
Vous pouvez mettre en place et retirer NUVARING vous-même.
Votre médecin vous indiquera à quel moment vous pouvez commencer à utiliser NUVARING pour la première fois. L'anneau vaginal doit être mis en place le jour approprié de votre cycle mensuel (voir la section « Quand mettre en place le premier anneau ») et laissé en place pendant 3 semaines d’affilée sans interruption. Vérifiez régulièrement que NUVARING est dans votre vagin (par exemple, avant et après un rapport sexuel) pour vous assurer que vous êtes protégée d’une grossesse.
Après la troisième semaine, retirez NUVARING et laissez passer un délai d'une semaine. Vos règles surviendront en général au cours de cet intervalle d'une semaine sans anneau.
Lors de l'utilisation de NUVARING, vous ne devez pas utiliser certaines méthodes contraceptives barrière féminines, tel qu’un diaphragme vaginal, une cape cervicale ou un préservatif féminin. Ces méthodes contraceptives ne doivent pas être utilisées comme méthode contraceptive de recours parce que NUVARING peut interférer avec le placement et le positionnement correct d’un diaphragme, une cape cervicale ou un préservatif féminin. Cependant, vous pouvez utiliser un préservatif masculin comme une méthode contraceptive barrière supplémentaire.
Comment mettre en place et retirer NUVARING ?
NUVARING sans applicateur
Avant d’insérer l’anneau, vérifier que la date limite d’utilisation ne soit pas dépassée (voir rubrique 5 « Comment conserver NUVARING »)
Lavez-vous les mains avant d'insérer ou de retirer l'anneau.
Choisissez la position qui vous paraît la plus confortable pour la mise en place de l'anneau (debout avec une jambe relevée, accroupie ou allongée).
Otez l'anneau de son sachet.
Tenez l'anneau entre le pouce et l'index, pincez l'anneau et insérez-le dans le vagin (voir Figures 1 à 4). Vous pouvez également choisir d’utiliser l’applicateur NUVARING (non inclus avec NUVARING) pour vous aider à insérer l’anneau. L’applicateur NUVARING peut ne pas être disponible dans tous les pays. Quand l'anneau est en place, vous ne devez pas le ressentir. Si vous ne vous sentez pas à l'aise, modifiez doucement la position de NUVARING (par ex., poussez l'anneau plus profondément dans le vagin) jusqu’à ce que cela soit confortable. La position exacte de l'anneau dans le vagin n'a aucune importance.
Retirez l'anneau du vagin 3 semaines après sa mise en place. Pour cela, vous pouvez passer votre index dans l'anneau ou le saisir entre l'index et le majeur et le tirer en dehors du vagin (Figure 5). Si vous localisez l’anneau dans votre vagin mais que vous n’arrivez pas à le retirer, veuillez consulter votre médecin.
Jetez l'anneau utilisé avec les déchets ménagers traditionnels, de préférence après l'avoir remis dans son sachet refermable d'origine. Ne pas jeter NUVARING dans les toilettes.
|
Figure 1 : Otez NUVARING du sachet. |
|
|
|
Figure 2: Pincez l'anneau. |
Figure 3 : Choisissez une position confortable pour insérer l'anneau. |
|
|
Figure 4A Figure 4B Figure 4C Insérez l'anneau dans le vagin avec une main (Figure 4A), en écartant les lèvres à l'aide de l'autre main si nécessaire. Poussez l'anneau dans le vagin jusqu'à ce qu'aucune gêne ne soit perçue (Figure 4B). Laissez l'anneau en place pendant 3 semaines (Figure 4C). |
||
|
|
Figure 5 : NUVARING peut être retiré soit en passant l'index dans l'anneau, soit en le saisissant entre l'index et le majeur. |
|
NUVARING avec applicateur
Avant d’insérer l’anneau, vérifier que la date limite d’utilisation ne soit pas dépassée (voir rubrique 5 « Comment conserver NUVARING »)
Lavez-vous les mains avant d'insérer ou de retirer l'anneau.
Choisissez la position qui vous paraît la plus confortable pour la mise en place de l'anneau (debout avec une jambe relevée, accroupie ou allongée).
Otez l'anneau de son sachet.
Tenez l'anneau entre le pouce et l'index, pincez l'anneau et insérez-le dans le vagin (voir Figures 1 à 4). Vous pouvez également choisir d’utiliser l’applicateur NUVARING pour vous aider à insérer l’anneau (voir les instructions d’utilisation ci-dessous). Quand l'anneau est en place, vous ne devez pas le ressentir. Si vous ne vous sentez pas à l'aise modifiez doucement la position de NUVARING (par ex., poussez l'anneau plus profondément dans le vagin) jusqu’à ce que cela soit confortable. La position exacte de l'anneau dans le vagin n'a aucune importance.
Retirez l'anneau du vagin 3 semaines après sa mise en place. Pour cela, vous pouvez passer votre index dans l'anneau ou le saisir entre l'index et le majeur et le tirer en dehors du vagin (Figure 5). Si vous localisez l’anneau dans votre vagin mais que vous n’arrivez pas à le retirer, veuillez consulter votre médecin.
Jetez l'anneau utilisé avec les déchets ménagers traditionnels, de préférence après l'avoir remis dans son sachet refermable d'origine. Ne pas jeter NUVARING dans les toilettes.
Comment insérer NUVARING avec les doigts seulement :
|
Figure 1 : Otez NUVARING du sachet. |
|
||
|
Figure 2: Pincez l'anneau.
|
Figure 3 : Choisissez une position confortable pour insérer l'anneau.
|
||
|
Figure 4A Figure 4B Figure 4C Insérez l'anneau dans le vagin avec une main (Figure 4A), en écartant les lèvres à l'aide de l'autre main si nécessaire. Poussez l'anneau dans le vagin jusqu'à ce qu'aucune gêne ne soit perçue (Figure 4B). Laissez l'anneau en place pendant 3 semaines (Figure 4C).
|
|||
|
|
|||
Informations importantes concernant l’applicateur NUVARING :
1. A usage facultatif pour aider à insérer NUVARING.
2. NE réutilisez PAS l’applicateur ; il est conçu pour un usage unique.
3. NE partagez PAS l’applicateur avec d’autres.
4. Si vous laissez tomber accidentellement l’applicateur, lavez-le avec de l’eau froide ou tiède (PAS d’eau chaude).
5. Jetez l'applicateur avec les déchets ménagers traditionnels immédiatement après usage.
6. Ne jetez pas l’applicateur dans les toilettes.
Comment insérer NUVARING avec l’applicateur :
1: Préparer
|
|
Lavez-vous les mains avant d’ouvrir l’emballage. Ouvrir SEULEMENT immédiatement avant utilisation. NE PAS utiliser si le contenu ou l’emballage est visiblement endommagé. |
|
|
|
|
|
L’applicateur est conçu pour être utilisé EXCLUSIVEMENT avec les anneaux NUVARING, et pas avec d’autres produits. |
|
|
|
|
|
Revoir le schéma de l'applicateur pour vous familiariser avec ses différentes parties. A. Piston B. Extrémité renflée C. Cylindre D. Ouverture du cylindre E. NUVARING |
2 : Charger et positionner
|
|
Tirez doucement le piston jusqu'à ce qu'il s'arrête. |
|
|
|
Pincez les côtés opposés de l’anneau et insérez l’anneau dans l'ouverture du cylindre. |
|
|
|
|
|
|
|
Poussez doucement l’anneau dans le cylindre. La pointe de l'anneau doit rester légèrement hors de l’ouverture du cylindre. |
|
|
|
|
|
|
|
Choisissez la position la plus confortable pour vous afin d’insérer l’anneau, telles que : position allongée sur le dos, accroupie, ou debout avec une jambe relevée. |
|
3 : Insérer et Jeter
|
|
Placez votre pouce et le majeur sur l’extrémité renflée. |
|
|
|
|
|
Introduisez doucement le cylindre dans le vagin jusqu'à ce que vos doigts (sur l’extrémité renflée) touchent votre corps. Ensuite, utilisez votre index pour pousser doucement le piston entièrement dans le cylindre. Certaines femmes ont éprouvé une brève et légère sensation de pincement lors de l’utilisation de l’applicateur. |
|
|
|
|
|
L’anneau est repoussé hors de l'applicateur. Retirez doucement l'applicateur. |
|
|
Assurez-vous que l’anneau n'est PAS resté dans l'applicateur. Jetez l'applicateur utilisé dans la poubelle. NE jetez PAS l'applicateur dans les toilettes. NE réutilisez PAS l’applicateur. |
Trois semaines avec anneau, une semaine sans anneau
1- A compter du jour de sa mise en place, l'anneau vaginal doit être laissé en place sans interruption pendant 3 semaines.
2- Retirez l'anneau 3 semaines après sa mise en place, le même jour de la semaine que celui où il a été inséré et approximativement à la même heure. Par exemple, si vous avez mis NUVARING pour la première fois un mercredi vers 22 h 00, vous devrez le retirer 3 semaines plus tard, un mercredi vers 22 h 00.
3- Après avoir retiré l'anneau, ne pas mettre d'autre anneau pendant 1 semaine. Les règles doivent apparaître au cours de cette semaine. Les règles apparaissent généralement 2 à 3 jours après le retrait de NUVARING.
4- Utilisez un nouvel anneau exactement après l'intervalle libre d'une semaine (une fois encore, le même jour de la semaine et approximativement à la même heure), même si vos règles ne sont pas terminées. Si le nouvel anneau est introduit avec plus de 3 heures de retard, il est possible que la protection contraceptive soit diminuée. Suivez les instructions de la section « Que faire si vous avez oublié d’insérer un nouvel anneau après l’intervalle de 7 jours sans anneau ».
Si vous utilisez NUVARING conformément aux indications données ci-dessus, vos règles apparaîtront à peu près aux mêmes jours tous les mois.
Quand mettre en place le premier anneau ?
· Vous n'avez pas utilisé de contraception hormonale au cours du dernier mois : Mettez en place NUVARING le 1er jour du cycle (soit le 1er jour de vos règles).
NUVARING commence à agir immédiatement. Vous n'avez pas besoin d'utiliser d'autres précautions contraceptives.
Vous pouvez également commencer à utiliser NUVARING entre le 2ème et le 5ème jour de votre cycle. Cependant, en cas de rapports sexuels au cours des 7 premiers jours d'utilisation de NUVARING, vous devez alors utiliser une méthode de contraception supplémentaire (telle qu'un préservatif masculin). Ce conseil ne doit être suivi que dans le cas de la première utilisation de NUVARING.
· Vous avez utilisé une contraception estroprogestative au cours du dernier mois :
Commencez l'utilisation de NUVARING au plus tard le jour suivant l'intervalle habituel sans votre pilule.
Si votre pilule contient 28 comprimés, commencez au plus tard le jour qui suit la prise du dernier comprimé. Si vous avez un doute sur le comprimé concerné, demandez conseil à votre médecin ou à votre pharmacien. Ne prolongez jamais la période sans hormone de votre pilule actuelle au-delà de sa durée recommandée.
Si vous avez utilisé votre pilule correctement et conformément aux recommandations et si vous êtes sûre de ne pas être enceinte, vous pouvez également arrêter de prendre votre pilule n'importe quel jour et insérer NUVARING immédiatement.
· Vous avez utilisé un patch transdermique au cours du dernier mois :
Commencez l'utilisation de NUVARING au plus tard le jour suivant l'intervalle habituel sans patch. Ne prolongez jamais la période sans patch au-delà de sa durée recommandée.
Si vous avez utilisé le patch correctement et conformément aux recommandations et si vous êtes sûre de ne pas être enceinte, vous pouvez également arrêter d'utiliser le patch n'importe quel jour et insérer NUVARING immédiatement.
· Vous avez utilisé une pilule uniquement progestative au cours du dernier mois :
Vous pouvez arrêter votre pilule n'importe quel jour et insérer NUVARING le jour suivant au moment où vous auriez dû prendre normalement votre pilule.
Utilisez impérativement une méthode contraceptive supplémentaire (telle qu’un préservatif masculin), pendant les 7 premiers jours de l'utilisation de l'anneau.
· Vous avez utilisé un dispositif injectable, un implant ou un dispositif intra-utérin (DIU) libérant un progestatif au cours du dernier mois :
Commencez à utiliser NUVARING au moment où doit être effectuée votre prochaine injection ou le jour où votre implant ou votre système intra-utérin libérant un progestatif est retiré.
Veillez cependant à utiliser également une méthode contraceptive complémentaire (telle qu’un préservatif masculin) pendant les 7 premiers jours de l'utilisation de l'anneau.
· Après un accouchement
Si vous venez d'accoucher, votre médecin vous demandera d'attendre jusqu'à la fin de vos premières règles normales avant de commencer à utiliser NUVARING.
Il est parfois possible de commencer plus tôt. Votre médecin vous conseillera à ce sujet. Si vous souhaitez utiliser NUVARING alors que vous allaitez, vous devez d'abord en discuter avec votre médecin.
· Après une fausse-couche ou un avortement :
Demandez conseil à votre médecin.
|
Que faire si votre anneau a été accidentellement expulsé du vagin ? NUVARING peut être accidentellement expulsé du vagin, par exemple s'il n'a pas été correctement mis en place, lors du retrait d'un tampon, pendant les rapports sexuels, si vous êtes constipée, ou si vous avez un prolapsus de l'utérus. Vous devez donc vérifier régulièrement la présence de l'anneau dans votre vagin (par exemple, avant et après un rapport sexuel). Que faire si votre anneau est resté temporairement en dehors du vagin ? NUVARING pourrait encore vous protéger contre une grossesse, mais cela dépend de la durée pendant laquelle l’anneau est resté en dehors du vagin. Si l'anneau est resté en dehors du vagin pendant : · moins de 3 heures, vous êtes toujours protégée contre une éventuelle grossesse. Vous devez rincer l’anneau à l’eau froide ou tiède (mais pas chaude) et réinsérez l’anneau dès que possible mais seulement si l’anneau est resté en dehors du vagin moins de 3 heures. · plus de 3 heures, lors de la 1ère ou la 2ème semaine du cycle, il est possible que vous ne soyez pas protégée contre une grossesse. Vous devez rincer l’anneau à l’eau froide ou tiède (mais pas chaude) et réinsérez l'anneau dans le vagin dès que vous vous en rendez compte et laissez-le en place sans interruption pendant au moins 7 jours. En cas de rapports sexuels, vous devrez également utiliser un préservatif masculin pendant ces 7 jours. Si vous êtes dans la 1ère semaine et que vous avez eu des rapports sexuels au cours des 7 derniers jours, il se peut que vous soyez enceinte. Dans ce cas, contactez votre médecin. · plus de 3 heures, lors de la 3ème semaine du cycle, il est possible que vous ne soyez pas protégée contre une grossesse. Vous devrez jeter cet anneau et choisir l'une des 2 options suivantes : 1. Insérez un nouvel anneau immédiatement L'insertion du nouvel anneau marquera le début de la période suivante de 3 semaines d'utilisation. Il est possible que vous n'ayez pas vos règles mais des « spottings » (traces ou taches de sang) ou des saignements peuvent survenir. 2. Ne pas réinsérer l'anneau. Laissez d'abord passer vos règles et insérez un nouvel anneau au plus tard 7 jours après le moment où l'anneau précédent a été retiré ou expulsé. Vous ne pourrez choisir cette option que si l'anneau a été utilisé de façon continue pendant les 7 jours précédents. · une durée inconnue, vous pouvez ne pas être protégée contre une grossesse. Effectuez un test de grossesse et consultez votre médecin avant d’insérer un nouvel anneau.
Que faire si votre anneau se rompt ? Très rarement, NUVARING peut se rompre. Une lésion vaginale associée à une rupture de l’anneau a été rapportée. Dans ce cas, jetez cet anneau et remplacez-le par un nouvel anneau dès que possible. Utilisez des méthodes contraceptives complémentaires (par exemple un préservatif masculin) pendant les 7 jours suivants. Si vous avez eu des rapports sexuels avant de vous rendre compte de la rupture de votre anneau, veuillez contacter votre médecin. Vous avez inséré plus d’un anneau Aucun effet nocif grave n'a été rapporté suite à un surdosage en hormones contenues dans NUVARING. Si vous avez accidentellement inséré plus d'un anneau, vous pouvez vous sentir malade (nausées), ou avoir des vomissements ou des saignements vaginaux. Ne conservez qu’un seul anneau et contactez votre médecin si les symptômes persistent. Que faire si vous avez oublié d'insérer un nouvel anneau après l’intervalle de 7 jours sans anneau ? Si votre intervalle sans anneau a été supérieur à 7 jours, insérez un nouvel anneau dès que vous vous en rendez compte. Utilisez des méthodes contraceptives complémentaires (telle qu’un préservatif masculin) si vous avez des rapports sexuels au cours des 7 jours suivants. Si vous avez eu des rapports sexuels pendant l’intervalle sans anneau, vous risquez d'être enceinte. Dans ce cas, prévenez votre médecin immédiatement. En effet, plus l’intervalle sans anneau est long, plus le risque d'être enceinte est élevé. Que faire si vous avez oublié de retirer l'anneau ? · Si l'anneau a été laissé en place entre 3 semaines et 4 semaines, il continuera à vous protéger contre une éventuelle grossesse. Respectez l'intervalle sans anneau d'une semaine puis insérez un nouvel anneau. · Si l'anneau a été laissé en place pendant plus de 4 semaines, il se peut que vous tombiez enceinte. Contactez votre médecin avant d'utiliser un nouvel anneau. Que faire si vous n'avez pas vos règles ? · Vous avez utilisé NUVARING conformément aux instructions. Si vous n'avez pas vos règles alors que vous avez utilisé l'anneau conformément aux instructions données et que vous n'avez pris aucun autre médicament, il est peu probable que vous soyez enceinte. Continuez d'utiliser NUVARING comme d'habitude. En revanche, si vos règles ne surviennent pas deux fois de suite, il est possible que vous soyez enceinte. Prenez immédiatement contact avec votre médecin. Ne recommencez pas à utiliser un nouvel anneau avant que votre médecin ait vérifié que vous n'étiez pas enceinte. · Si vous n'avez pas utilisé NUVARING conformément aux instructions. Si vous n'avez pas utilisé l'anneau conformément aux instructions données et si vous n'avez pas vos règles lors du premier intervalle sans anneau, vous risquez d'être enceinte. Contactez votre médecin avant d'utiliser un nouvel anneau. Que faire si vous avez des saignements inexpliqués ? Lors de l'utilisation de l'anneau, des saignements vaginaux inexpliqués peuvent se produire chez certaines femmes en dehors des règles. L'utilisation d'une serviette de protection peut être nécessaire. Dans tous les cas, laissez l'anneau en place dans le vagin et continuez à l'utiliser normalement. Si les saignements irréguliers persistent, deviennent plus importants, ou recommencent, prévenez votre médecin. Que faire si vous désirez changer le premier jour de vos règles définitivement ? Si vous désirez changer le jour de vos règles, vous pouvez le faire en raccourcissant l'intervalle libre entre deux anneaux (mais ne le rallongez jamais !). Par exemple, si votre période sans anneau commence un vendredi et que vous souhaitez le changer pour un mardi (3 jours plus tôt), vous devez mettre en place l’anneau suivant 3 jours plus tôt que ce que vous faites habituellement. Ensuite, vos prochaines règles débuteront 3 jours plus tôt. Si vous souhaitez une période sans anneau très courte (par exemple, 3 jours ou moins), il est possible que vous n'ayez pas vos saignements au cours de cette période sans anneau. Vous pourrez avoir des spottings (traces ou taches de sang) ou des saignements intermenstruels lors de l'utilisation de l'anneau suivant. Si vous n'êtes pas sûre de la façon de procéder, contacter votre médecin qui vous conseillera. Que faire si vous voulez retarder vos règles ? Bien que cela ne soit pas son utilisation normale, vous pouvez retarder vos règles (saignement de privation) en introduisant un nouvel anneau immédiatement après avoir retiré l'anneau en cours, sans laisser d’intervalle sans anneau. Vous pouvez laisser le nouvel anneau en place pendant 3 semaines au maximum. Vous pourrez avoir des spottings (traces ou taches de sang) ou des saignements intermenstruels lors de l'utilisation de l'anneau suivant. Il vous suffit alors de retirer l'anneau lorsque vous souhaitez que vos règles commencent. Il est recommandé de respecter un intervalle d’une semaine sans anneau avant l’insertion d’un nouvel anneau. Vous devrez demander conseil à votre médecin avant de décider de retarder vos règles. |
Si vous arrêtez d’utiliser NUVARING 15 microgrammes/120 microgrammes/24 heures, système de diffusion vaginal
Vous pouvez arrêter d'utiliser NUVARING à tout moment. Si vous ne souhaitez pas être enceinte, demandez conseil à votre médecin sur les autres méthodes de contraception possibles.
Si vous arrêtez NUVARING parce que vous envisagez une grossesse, attendez d'avoir eu des règles naturelles avant d'essayer de concevoir. Il vous sera ainsi plus facile de calculer à quel moment votre bébé doit naître.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Il existe une augmentation du risque de caillots sanguins dans les veines (thrombo-embolie veineuse [TEV]) ou dans les artères (thrombo-embolie artérielle [TEA]) chez toutes les femmes qui prennent des contraceptifs hormonaux combinés. Pour plus de précisions sur les différents risques associés à la prise de contraceptifs hormonaux combinés, reportez-vous à la rubrique 2, « Quelles sont les informations à connaître avant d’utiliser NUVARING ».
Si vous êtes allergique à l’un des composants contenus dans NUVARING (hypersensibilité) vous pourriez avoir les symptômes suivants (fréquence indéterminée) : angioedème et/ou anaphylaxie (gonflement du visage, des lèvres, de la langue et/ou de la gorge et/ou des difficultés à avaler) ou une éruption d’urticaire potentiellement associés à une difficulté à respirer. Si cela arrive, retirez NUVARING et contactez immédiatement votre médecin (voir section 2 « QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER NUVARING 15 microgrammes/ 120 microgrammes/24 heures, système de diffusion vaginal ? »).
Les effets indésirables suivants ont été rapportés chez les utilisatrices de NUVARING.
Fréquent : peut affecter jusqu’à 1 femme sur 10
· Douleur abdominale, sensation de malaise (nausées).
· Infection vaginale à levures ; inconfort dans le vagin dû à l’anneau ; démangeaisons génitales ; sécrétions vaginales.
· Maux de tête ou migraine ; humeur dépressive ; baisse de la libido.
· Douleur mammaire ; douleur pelvienne ; règles douloureuses.
· Acné.
· Prise de poids.
· Expulsion de l’anneau.
Peu fréquent : peut affecter jusqu’à 1 femme sur 100
· Troubles de la vue ; vertiges.
· Ballonnement de l’abdomen ; vomissements, diarrhée ou constipation.
· Sensation de fatigue, malaise ou irritabilité ; changement d’humeur; sautes d’humeur.
· Œdèmes.
· Infection urinaire ou de la vessie.
· Difficulté ou douleur au passage de l’urine ; forte envie ou besoin d’uriner ; envie fréquente d’uriner.
· Troubles lors des rapports sexuels, dont douleur, saignements ou partenaire gêné par l’anneau.
· Augmentation de la pression sanguine.
· Augmentation de l’appétit.
· Douleur du dos ; contractions musculaires ; douleur des jambes ou des bras.
· Peau moins sensible.
· Gonflement ou douleur des seins ; maladie fibrokystique du sein (kyste dans les seins qui peuvent grossir ou devenir douloureux).
· Inflammation du col ; polypes au niveau du col (grosseurs au niveau du col) ; érosion du col avec éversion de la muqueuse du col de l’utérus (ectropion).
· Modification des règles (par exemple plus abondantes, plus longues, irrégulières ou s’arrêtant totalement) : gêne pelvienne ; syndrome prémenstruel ; contractions utérines.
· Infection vaginale (fongique ou bactérienne) ; sensation de brûlure ; odeur ; douleur, inconfort ou sécheresse du vagin ou de la vulve.
· Perte de cheveux, eczéma, démangeaisons, éruption ou bouffées de chaleur.
· Urticaire.
Rare : peut affecter jusqu’à 1 femme sur 1 000
· Caillots sanguins, pouvant être dangereux, dans une veine ou une artère, par exemple :
o dans une jambe ou un pied (thrombose veineuse profonde, TVP)
o dans un poumon (embolie pulmonaire, EP)
o crise cardiaque
o accident vasculaire cérébral (AVC)
o mini-AVC ou symptômes temporaires de type AVC, connus sous le nom d’accident ischémique transitoire (AIT)
o caillots sanguins dans le foie, l’estomac/l’intestin, les reins ou un œil.
Le risque d’apparition d’un caillot sanguin peut être plus élevé si vous présentez certains autres facteurs qui augmentent ce risque (voir rubrique 2 pour plus d’informations sur les facteurs augmentant le risque de caillots sanguins et les symptômes d’un caillot sanguin).
· Ecoulement du mamelon.
Fréquence indéterminée (ne peut être estimée sur la base des données disponibles) :
· Chloasma (taches pigmentées sur la peau de couleur brun jaune, en général sur le visage),
· Sensation d’inconfort au niveau du pénis chez le partenaire (telle que irritation, éruption, démangeaisons).
· Incapacité à retirer l'anneau sans assistance médicale (par exemple, suite à l'adhérence à la paroi vaginale).
· Lésion vaginale associée à une rupture de l’anneau.
Des cancers du sein et des tumeurs du foie ont été rapportés chez les utilisatrices de contraceptifs hormonaux combinés. Pour plus d’informations, voir la rubrique 2 « Avertissements et précautions, Cancer ».
Très rarement, NUVARING peut se rompre. Pour plus d’informations, voir la rubrique 3 « Que faire si votre anneau se rompt ?».
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/.
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER NUVARING 15 microgrammes/120 microgrammes/ 24 heures, système de diffusion vaginal ?
Tenir ce médicament hors de la vue et de la portée des enfants.
Si vous découvrez qu’un enfant a été exposé aux hormones de NUVARING, demandez conseil à votre médecin.
A conserver à une température en dessous de 30°C et dans le conditionnement primaire d'origine à l'abri de la lumière et de l'humidité.
N’utilisez pas NUVARING plus de 4 mois après la date de délivrance. Le pharmacien inscrit la date de délivrance sur la boîte et le sachet.
N’utilisez pas NUVARING après la date de péremption indiquée sur la boîte et le sachet après « EXP ». La date de péremption fait référence au dernier jour de ce mois.
N’utilisez pas ce médicament si vous remarquez un changement de couleur de l'anneau ou tout signe de détérioration.
|
Notez ici la date que votre médecin ou votre pharmacien a inscrite sur la boîte A utiliser dans les 4 mois qui suivent l’achat ou la remise par le médecin soit avant le : |
Jetez l’anneau utilisé avec les déchets ménagers traditionnels, de préférence après l’avoir remis dans son sachet refermable d’origine. Ne jetez pas NUVARING dans les toilettes. Comme pour les autres médicaments, ne jetez pas les anneaux inutilisés ou périmés au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
NUVARING avec applicateur
Tenir ce médicament hors de la vue et de la portée des enfants.
Si vous découvrez qu’un enfant a été exposé aux hormones de NUVARING, demandez conseil à votre médecin.
A conserver à une température en dessous de 30°C et dans le conditionnement primaire d'origine à l'abri de la lumière et de l'humidité.
N’utilisez pas NUVARING plus de 4 mois après la date de délivrance. Le pharmacien inscrit la date de délivrance sur la boîte et le sachet.
N’utilisez pas NUVARING après la date de péremption indiquée sur la boîte et le sachet après « EXP ». La date de péremption fait référence au dernier jour de ce mois.
N’utilisez pas ce médicament si vous remarquez un changement de couleur de l'anneau ou tout signe de détérioration.
|
Notez ici la date que votre médecin ou votre pharmacien a inscrite sur la boîte A utiliser dans les 4 mois qui suivent l’achat ou la remise par le médecin soit avant le : |
Jetez l’anneau utilisé avec les déchets ménagers traditionnels, de préférence après l’avoir remis dans son sachet refermable d’origine. Jetez l’applicateur utilisé avec les déchets ménagers traditionnels. Ne jetez pas NUVARING ou l’applicateur dans les toilettes. Comme pour les autres médicaments, ne jetez pas les anneaux inutilisés ou périmés au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient NUVARING 15 microgrammes/120 microgrammes/24 heures, système de diffusion vaginal
· Les substances actives sont :
Ethinylestradiol.............................................................................................................. 2,70 mg
Etonogestrel................................................................................................................ 11,70 mg
Pour un anneau vaginal.
Chaque anneau libère en moyenne 15 microgrammes d'éthinylestradiol et 120 microgrammes d'étonogestrel par 24 heures, pendant une période de 3 semaines.
· Les autres composants sont :
Copolymères d'éthylène d'acétate de vinyle (28 % et 9% d'acétate de vinyle) (un type de plastique qui ne se dissout pas dans le corps), stéarate de magnésium.
NUVARING sans applicateur
NUVARING est un anneau flexible transparent, presque incolore, d'un diamètre externe de 54 mm.
Chaque anneau est emballé dans un sachet refermable. Le sachet est emballé dans une boîte avec la notice. Chaque boîte contient 1 ou 3 anneaux.
Toutes les présentations peuvent ne pas être commercialisées.
NUVARING avec applicateur
NUVARING est un anneau flexible transparent, presque incolore, d'un diamètre externe de 54 mm.
Chaque anneau est emballé dans un sachet refermable.
L’applicateur est un dispositif en plastique, non stérile, destiné à un usage unique (c’est-à-dire jetable). Chaque applicateur est emballé individuellement. L'applicateur possède un marquage CE, gravé sur le dispositif.
Le sachet et l’applicateur sont emballés dans une boîte avec la notice. Chaque boîte contient 1 ou 3 anneaux et applicateurs.
Toutes les présentations peuvent ne pas être commercialisées.
Titulaire de l’autorisation de mise sur le marché
176 RUE MONTMARTRE
75002 PARIS
Exploitant de l’autorisation de mise sur le marché
176 RUE MONTMARTRE
75002 PARIS
KLOOSTERSTRAAT 6
5349 AB Oss
PAYS-BAS
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Ce médicament est autorisé dans les Etats membres de l'Espace Economique Européen et au Royaume-Uni (Irlande du Nord) sous les noms suivants : Conformément à la réglementation en vigueur.
[À compléter ultérieurement par le titulaire]
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France)