Dernière mise à jour le 01/12/2025
ANAPEN 150 microgrammes/0,3 ml, solution injectable en seringue préremplie
Indications thérapeutiques
Classe pharmacothérapeutique : agents adrénergiques et dopaminergiques - code ATC : C01CA24
ANAPEN 150 microgrammes/0,3 ml, solution injectable en seringue est une seringue préremplie d'adrénaline contenue dans un dispositif d'injection automatique (auto-injecteur). Ce dispositif injecte une dose unique d'adrénaline dans le muscle.
Ce médicament est indiqué comme traitement d'urgence exclusivement ; vous devez consulter un service médical d'urgence après avoir utilisé votre auto-injecteur.
L'adrénaline est une hormone naturelle libérée en réponse à un stress. Dans les réactions allergiques aiguës, elle améliore la pression sanguine, la fonction cardiaque et la respiration et réduit l'œdème. L'adrénaline est également connue sous le nom d'épinéphrine.
ANAPEN 150 microgrammes/0,3 ml, solution injectable en seringue préremplie est utilisé pour le traitement d'urgence des réactions allergiques graves ou du choc anaphylactique provoqués par les cacahuètes ou d'autres aliments, des médicaments, des piqûres ou morsures d'insectes, d'autres allergènes, ainsi que du choc anaphylactique induit par un effort physique ou de cause inconnue.
Présentations
> 2 seringue(s) préremplie(s) en verre de 0,3 ml (boîte de 2 auto-injecteurs)
Code CIP : 361 573-6 ou 34009 361 573 6 1
Déclaration de commercialisation : 03/10/2012
Cette présentation est agréée aux collectivités
- Prix hors honoraire de dispensation : 62,33 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 63,35 €
- Taux de remboursement :65%
Service médical rendu (SMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Important | Avis du 23/04/2014 | Renouvellement d'inscription (CT) | Le service médical rendu par ANAPEN reste important dans l’indication de l’AMM. |
Amélioration du service médical rendu (ASMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprés de la HAS (plus d'informations dans l'aide). Les avis et synthéses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur de l'ASMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| III (Modéré) | Avis du 15/10/2003 | Inscription (CT) | ANAPEN apporte une amélioration du service médical rendu de niveau III par rapport à ANAHELP |
ANSM - Mis à jour le : 16/05/2025
ANAPEN 150 microgrammes/0,3 ml, solution injectable en seringue préremplie
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Adrénaline ......................................................................................................................... 0,50 mg
Pour 1 ml.
Une dose de 0,3 ml contient 150 microgrammes d'adrénaline (épinéphrine).
Excipient(s) à effet notoire : métabisulfite de sodium (E223).
Une dose de 0,3 ml (150 microgrammes) contient 0,51 mg de métabisulfite de sodium (E223).
Pour la liste complète des excipients, voir rubrique 6.1.
Solution injectable en seringue préremplie.
Solution claire, incolore, pratiquement exempte de particules.
4.1. Indications thérapeutiques
4.2. Posologie et mode d'administration
Posologie
La dose habituellement efficace se situe entre 5 à 10 microgrammes/kg de poids corporel mais des doses supérieures peuvent être nécessaires dans certains cas.
Population pédiatrique
Utilisation chez l’enfant :
La dose appropriée est de 150 microgrammes (ANAPEN 150 microgrammes/0,3 ml) ou 300 microgrammes (ANAPEN 300 microgrammes/0,3 ml) d'adrénaline selon le poids corporel de l'enfant et la décision du médecin. L’ANAPEN contenant la dose de 300 microgrammes (ANAPEN 300 microgrammes/0,3 ml) doit être prescrit chez les enfants et les adolescents de plus de 30kg.
Une injection supplémentaire peut être nécessaire chez les enfants dont le poids est élevé.
En l'absence d'amélioration clinique ou en cas d'aggravation des symptômes, une seconde injection avec un nouvel auto-injecteur d’ANAPEN peut être nécessaire 5 à 15 minutes après la première injection. Il est recommandé de prescrire 2 stylos d’ANAPEN aux patients qui devront toujours les avoir sur eux.
L'auto-injecteur ANAPEN 150 microgrammes/0,3 ml est conçu pour délivrer une dose unique de 150 microgrammes d'adrénaline.
L'utilisation n'est pas recommandée chez des enfants pesant moins de 15 kg sauf en cas de risque vital ou de décision du médecin ; une dose inférieure à 150 microgrammes d'adrénaline ne pouvant être administrée avec précision chez ces enfants.
Mode d’administration
Injection intramusculaire.
ANAPEN est constitué d'une seringue préremplie d'adrénaline contenue dans un dispositif d'auto-injection. Le tout constitue un auto-injecteur.
L'injection d'ANAPEN doit être effectuée en intra-musculaire, sans attendre, dès l'apparition des signes précurseurs et symptômes du choc anaphylactique. Ceux-ci peuvent survenir dans les minutes qui suivent l'exposition à l'allergène. Ils se manifestent le plus souvent par une urticaire, des bouffées de chaleur ou un angioœdème. Des réactions plus sévères peuvent toucher les systèmes circulatoire et pulmonaire.
Injecter ANAPEN uniquement dans la face antéro-latérale de la cuisse et non dans le muscle fessier. La zone d'injection peut être massée légèrement pendant 10 secondes après l'administration pour accélérer l’absorption. L’administration peut être pratiquée au travers des vêtements ou directement au contact de la peau.
L'auto-injecteur ANAPEN 150 microgrammes/0,3 ml est destiné à l'auto-administration immédiate par une personne présentant un antécédent de réaction anaphylactique. Il est conçu pour délivrer une dose unique de 150 microgrammes (0,3 ml) d'adrénaline. Pour des raisons de stabilité, un volume de 0,77 ml reste inutilisé dans la seringue après utilisation. Le dispositif ne doit cependant pas être réutilisé et doit être jeté avec les précautions de sécurité qui s'imposent.
Les patients / soignants doivent être informés que, après chaque utilisation d’ANAPEN :
· ils doivent appeler immédiatement une assistance médicale; appeler le 15 (pour la France) ou le 112 (numéro international), et demander l’intervention du SAMU en précisant « choc anaphylactique » même si les symptômes s’améliorent (voir rubrique.4.4).
· Les patients conscients doivent de préférence être allongés sur le dos avec les jambes relevées mais être en position assise si ils ont des difficultés respiratoires. Les patients inconscients doivent être placés sur le côté en position latérale de sécurité.
· Le patient doit si possible rester sous le contrôle d’une autre personne jusqu’à l’arrivée de l’assistance médicale.
Hypersensibilité à l’adrénaline ou à l’un des excipients mentionnés à la rubrique 6.1 (voir rubrique 4.4 pour plus d'informations sur le métabisulfite de sodium). Il n’y a pas de contre-indication absolue connue à l’utilisation d’ANAPEN en cas d’urgence allergique.
4.4. Mises en garde spéciales et précautions d'emploi
ANAPEN est uniquement indiqué comme traitement d'urgence. Un suivi médical est indispensable après administration afin de bénéficier d’une surveillance médicale attentive de l’épisode anaphylactique et recevoir un traitement complémentaire si nécessaire.
Le patient/soignant doit être informé de la possibilité d’un choc anaphylactique biphasique défini comme une récurrence des symptômes anaphylactiques survenant quelques heures plus tard après la résolution initiale.
Les patients souffrant d’asthme peuvent être plus à risque de réactions anaphylactiques sévères.
· Utiliser avec précaution chez les patients présentant une pathologie cardiaque, c'est-à-dire une maladie coronaire, une atteinte myocardique (déclenchement possible d'angine de poitrine), une insuffisance ventriculaire droite, des troubles du rythme cardiaque ou une tachycardie.
· Après administration d'adrénaline, des effets secondaires peuvent survenir chez des patients hyperthyroïdiens, cardiaques (angine de poitrine sévère, cardiomyopathie obstructive, arythmie ventriculaire et hypertension), souffrant de phéochromocytome, de glaucome, d'insuffisance rénale sévère, d'adénome prostatique avec rétention d'urine, d'hypercalcémie, d'hypokaliémie, chez les diabétiques, les personnes âgées et les femmes enceintes.
· Des injections locales répétées peuvent provoquer une nécrose au niveau des points d'injection par vasoconstriction.
· Une injection intravasculaire accidentelle peut entraîner une hémorragie cérébrale suite à une augmentation de la pression artérielle.
· Une injection accidentelle dans la main ou le pied peut par vasoconstriction provoquer un défaut d'irrigation sanguine de l'extrémité du membre concerné.
Ce médicament contient moins de 1 mmol de sodium (23mg) par dose et est donc considéré « sans sodium ».
Les patients doivent être avertis des allergènes impliqués et doivent être suivis si possible afin d’identifier les allergènes spécifiques.
Chez les patients sensibilisés au métabisulfite de sodium, en particulier chez les asthmatiques, ANAPEN peut provoquer des réactions de type allergique (symptômes anaphylactique, bronchospasme). Les patients susceptibles de présenter ces réactions doivent être parfaitement informés des circonstances dans lesquelles ANAPEN doit être utilisé.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Une hypertension artérielle sévère et une bradycardie peuvent se produire si l'adrénaline est administrée en association avec des médicaments bêtabloquants non sélectifs.
L'association à des médicaments sympathomimétiques peut potentialiser les effets de l'adrénaline.
Utiliser ANAPEN avec précaution chez les patients recevant un traitement pouvant favoriser une arythmie, par exemple : les digitaliques, la quinidine, les anesthésiques halogénés.
Les effets vasopresseurs de l'adrénaline peuvent être annulés par l'administration de vasodilatateurs à action rapide ou de médicaments bloquant les récepteurs alpha adrénergiques.
Les effets anti-anaphylactiques peuvent être antagonisés par des agents bêta-bloquants, en particulier les bêta-bloquants non sélectifs.
L'adrénaline inhibant la sécrétion d'insuline, il peut être nécessaire d'ajuster le traitement par l'insuline ou d'autres traitements hypoglycémiants.
4.6. Fertilité, grossesse et allaitement
Grossesse
Aucune étude spécifique, contrôlée n'est disponible chez la femme enceinte.
L'adrénaline ne doit être utilisée chez la femme enceinte que si le bénéfice attendu justifie le risque potentiel pour le fœtus.
L'adrénaline peut diminuer, de manière importante, le flux sanguin placentaire, ce qui peut aussi se produire lors d'un choc anaphylactique.
L'adrénaline n'est pas biodisponible par voie orale ; l'adrénaline excrétée dans le lait maternel ne devrait pas avoir d'effet chez le nourrisson.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Les effets indésirables dépendent de la sensibilité individuelle du patient et de la dose administrée.
A faible dose, les effets indésirables fréquents sont : palpitations, tachycardie, sueurs, nausées, vomissements, difficultés respiratoires, pâleur, étourdissements, faiblesse, tremblements, céphalées, inquiétude, nervosité, anxiété et refroidissement des extrémités.
Les effets moins fréquents sont : hallucinations, syncopes, hyperglycémie, hypokaliémie, acidose métabolique, mydriase, difficulté mictionnelle avec rétention urinaire, tremblements musculaires.
A forte dose ou chez les patients sensibles à l'adrénaline, les effets indésirables sont : arythmie cardiaque (fibrillation ventriculaire/arrêt cardiaque), accès d'hypertension artérielle (provoquant parfois une hémorragie cérébrale), voire une vasoconstriction (par exemple cutanée, des muqueuses et des reins).
ANAPEN contient du métabisulfite de sodium et peut provoquer des réactions de type allergique dont des symptômes anaphylactiques voire un risque vital. Des crises d'asthme peu sévères chez certains patients sensibles au sulfite peuvent également se produire.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/.
Les effets vasopresseurs de l'adrénaline peuvent être antagonisés par l'administration de vasodilatateurs à action rapide ou de médicaments alpha-bloquants adrénergiques. Malgré ces mesures, en cas d'hypotension artérielle réactionnelle prolongée, il peut être nécessaire d'administrer un autre médicament vasopresseur telle que de la noradrénaline.
En cas de surdosage, un œdème pulmonaire aigu avec obstruction des voies respiratoires peut être traité par l'administration de médicaments alpha-bloquants adrénergiques à action rapide telle que la phentolamine et/ou la pratique de la ventilation assistée en pression positive.
Un surdosage d'adrénaline peut provoquer une bradycardie transitoire suivie d'une tachycardie pouvant conduire à une arythmie pouvant être fatale. Cette arythmie peut être traitée par l'administration de bêta-bloquants adrénergiques précédés ou associés à des alpha bloquants adrénergiques permettant de contrôler des effets circulatoires périphériques alpha adrénergiques.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
L'adrénaline est une catécholamine naturellement secrétée par la médullosurrénale en réponse à l'épuisement ou au stress. C'est une amine sympathomimétique à action directe, ayant des effets aussi bien sur les récepteurs alpha que bêta adrénergiques et dont les effets sur les organes cibles sont complexes. C'est le médicament de choix pour combattre les réactions d'hypersensibilité allergiques ou idiopathiques et l'anaphylaxie induite par l'effort.
Mécanisme d’action
L'adrénaline a une action vasoconstrictrice par stimulation alpha adrénergique importante. Elle permet de lutter contre la vasodilatation et l'excès de la perméabilité vasculaire responsables d'une perte liquidienne intravasculaire et une hypotension ; symptômes pharmaco-toxiques prépondérants du choc anaphylactique. Par son action stimulante des récepteurs bronchiaux bêta adrénergiques, l'adrénaline provoque une puissante bronchodilatation diminuant le sifflement respiratoire et la dyspnée. L'adrénaline diminue également le prurit, l'urticaire et l'angioœdème associés au choc
5.2. Propriétés pharmacocinétiques
La majorité d'une dose d'adrénaline est excrétée sous forme de métabolites par voie urinaire.
La demi-vie plasmatique est d'environ 2 à 3 minutes. Cependant, administrée par voie sous-cutanée ou intramusculaire, la vasoconstriction locale peut légèrement retarder l'absorption et les effets peuvent durer plus longtemps que ne le suggère la demi-vie plasmatique.
L’impact de l’administration d’adrénaline au niveau de deux sites d’injection dans la cuisse, chez 18 volontaires hommes de poids normal, en utilisant soit ANAPEN, soit une seringue préremplie, a été étudiée. De plus, l’administration d’ANAPEN a été étudiée chez 12 femmes en surpoids. La profondeur du dépôt en adrénaline a été mesurée par échographie, l'adrénaline plasmatique a été mesurée par spectrométrie de masse- CLHP (Chromatographie Liquide Haute Performance) et la fréquence cardiaque (FC) a été mesurée à l'aide d'un moniteur Holter.
Les réponses pharmacocinétiques et cardiovasculaires à l’adrénaline dans ces deux cohortes ont été bien corrélées, à la fois dans le temps et en amplitude relative. Les concentrations plasmatiques d'adrénaline ont montré un double pic, avec en parallèle des changements de la FC. Le premier pic, d'une importance potentiellement vitale dans le traitement de l'anaphylaxie, est survenu environ 10 minutes après l'injection, la Cmax et l'ASC (aire sous la courbe) étant significativement plus élevées avec ANAPEN qu'avec les seringues préremplies à aiguilles plus longues. L'amplitude du second pic, qui a duré jusqu'à 2 h, n’a pas été modifiée en fonction du contexte. De manière inattendue, chez les femmes en surpoids traitées par une administration d’ANAPEN au niveau du tiers antéro-inférieur de la cuisse, bien que l'injection soit sous-cutanée, l'amplitude du premier pic était similaire à celle observée chez les hommes et la biodisponibilité globale a été renforcée.
5.3. Données de sécurité préclinique
15 mois.
6.4. Précautions particulières de conservation
A conserver à une température ne dépassant pas 25°C.
Conserver l’auto-injecteur dans l’emballage extérieur, à l’abri de la lumière.
6.5. Nature et contenu de l'emballage extérieur
1 ml en seringue préremplie en verre (obturée à une extrémité par un piston de caoutchouc, l'autre extrémité se termine par la gaine protectrice de l'aiguille) contenue dans un dispositif d'auto-injection à usage unique. L'auto-injecteur délivre 0,3 ml de solution.
Seringue :
BD (Becton Dickinson) : verre borosilicaté type 1, 27G 1/2"
Longueur d’aiguille exposée : 10 mm ± 1.5 mm
Diaphragme :
BD (Becton Dickinson) : chlorobutyl noir PH 701/50
Boite de 1 ou 2 auto-injecteurs dans une barquette de protection thermoformée.
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
Voir rubrique 4.2 pour les instructions dispensées au patient/soignant concernant les actions à mener après chaque utilisation d’ANAPEN.
Mode d’emploi
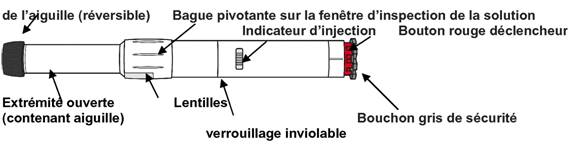
A. Différentes parties de l'auto-injecteur ANAPEN :
Avant d'utiliser l'auto-injecteur ANAPEN, le patient doit connaître les différentes parties de l'auto-injecteur. Elles sont présentées dans le schéma :
Bouchon noir protecteur
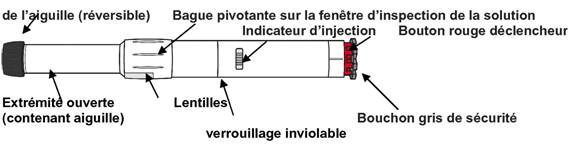
· Bague pivotante sur la fenêtre d'inspection de la solution : le patient tourne cette bague pour aligner les lentilles devant la fenêtre d'inspection de la solution.
· Fenêtre d'inspection de la solution : avant l'injection, le patient vérifie par cette fenêtre que la solution est claire et prête à l'emploi.
· Indicateur d'injection : avant l'injection, le patient peut observer par cette fenêtre un piston en plastique blanc qui indique que l'auto-injecteur ANAPEN n'a pas été déclenché par erreur ou n'est pas défectueux. Après l'injection, l'indicateur d'injection devient rouge, ce qui indique que l'auto-injecteur ANAPEN s'est correctement déclenché.
· Bouchon noir protecteur de l'aiguille (réversible) : ce bouchon protège l'aiguille lorsque le patient n'utilise pas l'auto-injecteur ANAPEN. Avant l'injection, le patient tire sur le bouchon protecteur de l'aiguille pour l'enlever. Après l'injection, le patient retourne le bouchon noir protecteur de l'aiguille et le replace sur la même extrémité de l'auto-injecteur ANAPEN afin de recouvrir l'aiguille.
· Bouchon gris de sécurité : il recouvre le bouton déclencheur rouge. Il empêche d'appuyer par erreur sur le bouton déclencheur.
Le patient ne doit pas retirer le bouchon noir protecteur de l'aiguille ou le bouchon gris de sécurité avant d'avoir besoin d'utiliser l'auto-injecteur ANAPEN.
B. Vérification de l'auto-injecteur ANAPEN :
Avant d'utiliser l'auto-injecteur ANAPEN, le patient doit vérifier le dispositif en procédant comme suit :
 1. Tourner la bague pivotante pour aligner les lentilles sur la fenêtre d'inspection de la solution comme indiqué par les flèches.
1. Tourner la bague pivotante pour aligner les lentilles sur la fenêtre d'inspection de la solution comme indiqué par les flèches.
 2. Regarder par la fenêtre d'inspection de la solution. Vérifier que la solution est limpide et incolore.
2. Regarder par la fenêtre d'inspection de la solution. Vérifier que la solution est limpide et incolore.
Si la solution présente un aspect trouble, coloré ou contient des particules, l'auto-injecteur ANAPEN devra être éliminé.
 3. S'assurer que l'indicateur d'injection n'est pas rouge. L'indicateur rouge signifie que l'auto-injecteur ANAPEN a déjà été déclenché et qu'il doit être éliminé.
3. S'assurer que l'indicateur d'injection n'est pas rouge. L'indicateur rouge signifie que l'auto-injecteur ANAPEN a déjà été déclenché et qu'il doit être éliminé.
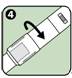 4. Retourner la bague pivotante comme indiqué par les flèches pour s'assurer que la fenêtre d'inspection de la solution est bien recouverte. Replacer l'auto-injecteur ANAPEN dans son carton d'emballage jusqu'à ce qu'il ait besoin d'être utilisé.
4. Retourner la bague pivotante comme indiqué par les flèches pour s'assurer que la fenêtre d'inspection de la solution est bien recouverte. Replacer l'auto-injecteur ANAPEN dans son carton d'emballage jusqu'à ce qu'il ait besoin d'être utilisé.
C. Utilisation de l'auto-injecteur ANAPEN :
Si le bouchon noir protecteur de l'aiguille a été retiré, le patient ne doit pas poser son pouce, ses doigts ou sa main sur l'extrémité ouverte (contenant l'aiguille) de l'auto-injecteur ANAPEN.
Pour utiliser l'auto-injecteur ANAPEN, le patient doit suivre les étapes suivantes :
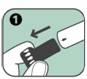 1. Enlever le bouchon noir protecteur de l'aiguille en tirant fortement dans le sens de la flèche ; cela permet également de retirer une gaine grise de protection de l'aiguille.
1. Enlever le bouchon noir protecteur de l'aiguille en tirant fortement dans le sens de la flèche ; cela permet également de retirer une gaine grise de protection de l'aiguille.
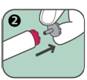 2. Enlever le bouchon gris de sécurité du bouton rouge déclencheur en tirant dans le sens de la flèche.
2. Enlever le bouchon gris de sécurité du bouton rouge déclencheur en tirant dans le sens de la flèche.
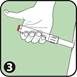 3. Appuyer l'extrémité ouverte (contenant l'aiguille) de l'auto-injecteur ANAPEN sur la face externe de la cuisse. Il est possible d'utiliser ANAPEN à travers un vêtement léger, tel que du jean, du coton ou du polyester.
3. Appuyer l'extrémité ouverte (contenant l'aiguille) de l'auto-injecteur ANAPEN sur la face externe de la cuisse. Il est possible d'utiliser ANAPEN à travers un vêtement léger, tel que du jean, du coton ou du polyester.
 4. Appuyer sur le bouton rouge déclencheur de façon à entendre un « clic ». Maintenir en position pendant 10 secondes. Retirer lentement l'auto-injecteur de la cuisse puis masser légèrement le site d'injection.
4. Appuyer sur le bouton rouge déclencheur de façon à entendre un « clic ». Maintenir en position pendant 10 secondes. Retirer lentement l'auto-injecteur de la cuisse puis masser légèrement le site d'injection.
 5. L'indicateur d'injection est passé au rouge, ce qui indique que l'injection est terminée. Si l'indicateur d'injection n'est pas rouge, recommencer l'injection avec un autre auto-injecteur ANAPEN.
5. L'indicateur d'injection est passé au rouge, ce qui indique que l'injection est terminée. Si l'indicateur d'injection n'est pas rouge, recommencer l'injection avec un autre auto-injecteur ANAPEN.
 6. Après l'injection, l'aiguille dépasse du dispositif. Pour la recouvrir, replacer la partie large du bouchon noir protecteur de l'aiguille en l'enclenchant sur l'extrémité ouverte (contenant l'aiguille) de l'auto-injecteur ANAPEN (comme indiqué par la flèche).
6. Après l'injection, l'aiguille dépasse du dispositif. Pour la recouvrir, replacer la partie large du bouchon noir protecteur de l'aiguille en l'enclenchant sur l'extrémité ouverte (contenant l'aiguille) de l'auto-injecteur ANAPEN (comme indiqué par la flèche).
Immédiatement après l’utilisation d’ANAPEN, le patient doit appeler les urgences, demander le SAMU et dire qu’il fait un « choc anaphylactique ». Le patient doit expliquer aux personnels médicaux qu’il/elle a reçu une injection d’adrénaline dans le muscle de la cuisse et leur montrer la boîte et les instructions d’utilisation.
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
9 RUE RAMEAU
75002 PARIS
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 361 570 7 1 : 0,3 ml en seringue préremplie (verre). Boîte de 1 auto-injecteur.
· 34009 361 573 6 1 : 0,3 ml en seringue préremplie (verre). Boîte de 2 auto-injecteurs.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Liste I
ANSM - Mis à jour le : 16/05/2025
ANAPEN 150 microgrammes/0,3 ml, solution injectable en seringue préremplie
Auto-injecteur d’Adrénaline (épinéphrine)
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin ou votre pharmacien.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que ANAPEN 150 microgrammes/0,3 ml, solution injectable en seringue préremplie et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d'utiliser ANAPEN 150 microgrammes/0,3 ml, solution injectable en seringue préremplie ?
3. Comment utiliser ANAPEN 150 microgrammes/0,3 ml, solution injectable en seringue préremplie ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver ANAPEN 150 microgrammes/0,3 ml, solution injectable en seringue préremplie ?
6. Contenu de l’emballage et autres informations.

1. QU’EST-CE QUE ANAPEN 150 microgrammes/0,3 ml, solution injectable en seringue préremplie ET DANS QUELS CAS EST-IL UTILISE ?
Classe pharmacothérapeutique : agents adrénergiques et dopaminergiques - code ATC : C01CA24
ANAPEN 150 microgrammes/0,3 ml, solution injectable en seringue est une seringue préremplie d'adrénaline contenue dans un dispositif d'injection automatique (auto-injecteur). Ce dispositif injecte une dose unique d'adrénaline dans le muscle.
Ce médicament est indiqué comme traitement d'urgence exclusivement ; vous devez consulter un service médical d'urgence après avoir utilisé votre auto-injecteur.
L'adrénaline est une hormone naturelle libérée en réponse à un stress. Dans les réactions allergiques aiguës, elle améliore la pression sanguine, la fonction cardiaque et la respiration et réduit l'œdème. L'adrénaline est également connue sous le nom d'épinéphrine.
ANAPEN 150 microgrammes/0,3 ml, solution injectable en seringue préremplie est utilisé pour le traitement d'urgence des réactions allergiques graves ou du choc anaphylactique provoqués par les cacahuètes ou d'autres aliments, des médicaments, des piqûres ou morsures d'insectes, d'autres allergènes, ainsi que du choc anaphylactique induit par un effort physique ou de cause inconnue.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER ANAPEN 150 microgrammes/0,3 ml, solution injectable en seringue préremplie ?
N’utilisez jamais ANAPEN 150 microgrammes/0,3 ml, solution injectable en seringue préremplie :
· si vous êtes allergique (hypersensible) à l’adrénaline ou à l’un des autres composants contenus dans ce médicament, mentionnés dans la rubrique 6 (informations sur les sulfites : voir ci-dessous).
· Il n'existe aucune raison connue empêchant d'utiliser ANAPEN en cas d'urgence allergique.
Avertissements et précautions
Adressez-vous à votre médecin ou pharmacien avant d’utiliser ANAPEN.
Votre médecin doit vous avoir expliqué en détail à quel moment et comment utiliser votre auto-injecteur ANAPEN 150 microgrammes/0,3 ml, solution injectable en seringue préremplie.
Informez votre médecin si vous souffrez d'une maladie cardiaque, y compris d'angine de poitrine, d'hyperthyroïdie, d'hypertension artérielle, d'hypokaliémie et d'hypercalcémie, de troubles de la circulation sanguine, d'un phéochromocytome (un type de tumeur des glandes surrénales), de glaucome (pression élevée à l'intérieur de l'œil), de maladie des reins ou de la prostate, de diabète ou toute autre pathologie.
Si vous souffrez d’asthme, vous avez plus de risques d’avoir des réactions allergiques sévères.
Toute personne qui a eu une réaction anaphylactique doit consulter un médecin pour effectuer des tests sur des substances pour lesquelles elle peut être allergique, de manière à les éviter dans le futur. Il est important de savoir qu’une allergie à une substance peut provoquer des allergies à d’autres substances apparentées.
Si vous avez des allergies alimentaires, il est important de vérifier les ingrédients de tout ce que vous mangez (y compris les médicaments) car même une quantité infime peut provoquer des réactions sévères.
Des injections locales répétées peuvent provoquer des lésions cutanées au niveau des points d'injection. Une injection accidentelle dans un vaisseau sanguin peut entraîner une augmentation soudaine de la pression artérielle. Une injection accidentelle dans la main ou le pied peut provoquer un défaut d'irrigation sanguine de l'extrémité du membre concerné. Consultez immédiatement le service des urgences de l'hôpital le plus proche.
Autres médicaments et ANAPEN 150 microgrammes/0,3 ml, solution injectable en seringue préremplie :
Informez votre médecin ou pharmacien si vous prenez, avez récemment pris ou pourriez prendre tout autre médicament, en particulier :
· Médicaments destinés au traitement d'une maladie cardiaque, tels que les digitaliques (digoxine), les bêtabloquants, la quinidine,
· Médicaments destinés au traitement de la dépression, tels que les antidépresseurs tricycliques, les inhibiteurs de la monoamine oxydase (IMAO), les inhibiteurs de la recapture de la sérotonine et de la noradrénaline (IRSN),
· Médicaments antidiabétiques, une modification de la posologie pourra être décidée par votre médecin après l'utilisation d'ANAPEN,
· Médicaments destinés au traitement de la maladie de Parkinson,
· Médicaments destinés au traitement de maladies thyroïdiennes,
· Autres médicaments : antihistaminiques tels que la diphénydramine ou la chlorphéniramine, la théophylline, l'ipratropium et l'oxitropium (utilisés pour traiter les maladies des voies aériennes telles que l'asthme), l'ocytocine (utilisée lors de l'accouchement), les anesthésiques inhalés, les alphabloquants (utilisés pour traiter l'hypertension artérielle), les sympathomimétiques (utilisés pour traiter l'asthme, d'autres maladies des voies aériennes et la congestion nasale).
ANAPEN 150 microgrammes/0,3 ml, solution injectable en seringue préremplie avec de l’alcool
L'alcool peut accroître les effets de ce médicament.
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin ou pharmacien avant de prendre ce médicament.
On ne sait pas si l'administration d'adrénaline pendant la grossesse présente un danger pour l'enfant à naître. Cela ne doit pas vous empêcher d'utiliser ANAPEN 150 microgrammes/0,3 ml, solution injectable en seringue préremplie en cas d'urgence pendant une grossesse si votre vie est en danger. Vous devez en discuter avec votre médecin avant qu'une telle situation d'urgence se présente.
On pense que l'adrénaline n'a pas d'effet sur l'enfant allaité.
Conduite de véhicules et utilisation de machines
La conduite de véhicules ou l'utilisation de machines n'est pas recommandée après l'injection de ce médicament, en raison des symptômes consécutifs au choc anaphylactique.
ANAPEN 150 microgrammes/0,3 ml, solution injectable en seringue préremplie contient du métabisulfite de sodium (E223), qui peut provoquer des réactions de type allergique et des difficultés respiratoires, en particulier chez les sujets ayant des antécédents asthmatiques.
Si vous savez que vous êtes allergique au métabisulfite de sodium, vous devez en informer votre médecin ou pharmacien.
ANAPEN 150 microgrammes/0,3 ml, solution injectable en seringue préremplie contient une faible quantité de chlorure de sodium (sel). Ce médicament contient moins de 1 mmol de sodium (23 mg) par dose. Il est donc sans sel.
3. COMMENT UTILISER ANAPEN 150 microgrammes/0,3 ml, solution injectable en seringue préremplie ?
Veillez à toujours utiliser ce médicament en suivant exactement les indications de votre médecin ou pharmacien. Vérifiez auprès de votre médecin ou pharmacien en cas de doute.
Posologie
Injectez ANAPEN 150 microgrammes/0,3 ml, solution injectable en seringue préremplie uniquement dans le muscle de la cuisse.
Usage unique. Jeter le dispositif immédiatement après utilisation en respectant les précautions de sécurité.
ANAPEN délivre une dose unique de 0,3ml qui correspond à 150 microgrammes d’adrénaline. Après utilisation, un volume de 0,77 ml reste inutilisé dans l’auto-injecteur mais ne pourra pas être réutilisé.
La réaction allergique démarre généralement dans les minutes qui suivent le contact avec l'allergène ; elle peut se manifester par :
· Des démangeaisons cutanées, une urticaire, des bouffées de chaleur et un gonflement des yeux, des lèvres ou de la langue.
· Des difficultés respiratoires résultant d'un gonflement de la gorge. Un sifflement respiratoire, un essoufflement et une toux peuvent résulter d'une constriction des poumons.
· D'autres symptômes de choc anaphylactique, de type maux de tête, vomissements et diarrhée.
· Un collapsus et une perte de conscience dus à une baisse soudaine de la pression artérielle.
Si ces signes et symptômes apparaissent, vous devez injecter ANAPEN 150 microgrammes/0,3 ml, solution injectable en seringue préremplie immédiatement. L'injection doit être effectuée uniquement dans le muscle situé sur la face extérieure de la cuisse, jamais dans les fesses.
Utilisation chez les adultes
La posologie appropriée est de 300 microgrammes (ANAPEN 300 microgrammes).
Chez les adultes de forte corpulence, plus d’une injection peut être nécessaire pour inverser les effets d’une réaction allergique.
Utilisation chez les enfants et les adolescents
· La posologie appropriée est de 150 microgrammes (ANAPEN 150 microgrammes/0,3 ml) ou 300 microgrammes (ANAPEN 300 microgrammes/0,3 ml).
· La posologie dépend du poids de l'enfant et de la décision du médecin.
· Un auto-injecteur délivrant 300 microgrammes (ANAPEN 300 microgrammes/0,3 ml) d'adrénaline est également disponible. ANAPEN 300 microgrammes/0,3 ml doit être prescrit aux enfants et adolescents pesant plus de 30 kg.
· Une dose inférieure à 150 microgrammes ne peut pas être administrée avec une précision suffisante chez les enfants pesant moins de 15 kg et son utilisation n'est donc pas recommandée, sauf en cas de risque vital ou de décision du médecin.
Lorsqu'une dose unique d'adrénaline ne suffit pas à inverser les effets d'une réaction allergique, une nouvelle dose peut être injectée après un délai de 5 à 15 minutes.
Enfants pesant entre 15 kg et 30 kg :
La dose usuelle est de 150 microgrammes.
Enfants de plus de 30 kg :
La dose usuelle est de 300 microgrammes.
ANAPEN est un traitement d'urgence. Vous devez toujours demander une assistance médicale immédiatement après l’utilisation d’ANAPEN. Appelez le 15 (pour la France) ou le 112 (numéro international), et demandez l’intervention du SAMU en précisant « choc anaphylactique » même si les symptômes s’améliorent. Vous devez aller à l’hôpital pour être gardé en observation et recevoir un traitement complémentaire si nécessaire. En effet, une nouvelle réaction peut se produire un peu plus tard.
En attendant le SAMU, vous devez vous allonger avec vos jambes relevées sauf si vous avez du mal à respirer, dans ce cas vous devez vous asseoir. Demandez à quelqu’un de rester avec vous jusqu’à ce que les secours arrivent au cas où un nouveau malaise surviendrait.
Les patients inconscients doivent être placés sur le côté en position latérale de sécurité.
Mode d’emploi
Il est recommandé que les membres de votre famille, le personnel soignant, les enseignants soient également formés à l’utilisation correcte d’ANAPEN.
A. Différentes parties de l'auto-injecteur ANAPEN :
Avant d'utiliser l'auto-injecteur ANAPEN, le patient doit connaître les différentes parties de l'auto-injecteur. Elles sont présentées dans le schéma :
Bouchon noir protecteur
· Bague pivotante sur la fenêtre d'inspection de la solution : le patient tourne cette bague pour aligner les lentilles devant la fenêtre d'inspection de la solution.
· Fenêtre d'inspection de la solution : avant l'injection, le patient vérifie par cette fenêtre que la solution est claire et prête à l'emploi.
· Indicateur d'injection : avant l'injection, le patient peut observer par cette fenêtre un piston en plastique blanc qui indique que l'auto-injecteur ANAPEN n'a pas été déclenché par erreur ou n'est pas défectueux. Après l'injection, l'indicateur d'injection devient rouge, ce qui indique que l'auto-injecteur ANAPEN s'est correctement déclenché.
· Bouchon noir protecteur de l'aiguille (réversible) : ce bouchon protège l'aiguille lorsque le patient n'utilise pas l'auto-injecteur ANAPEN. Avant l'injection, le patient tire sur le bouchon protecteur de l'aiguille pour l'enlever. Après l'injection, le patient retourne le bouchon noir protecteur de l'aiguille et le replace sur la même extrémité de l'auto-injecteur ANAPEN afin de recouvrir l'aiguille.
· Bouchon gris de sécurité : il recouvre le bouton déclencheur rouge. Il empêche d'appuyer par erreur sur le bouton déclencheur.
Le patient ne doit pas retirer le bouchon noir protecteur de l'aiguille ou le bouchon gris de sécurité avant d'avoir besoin d'utiliser l'auto-injecteur ANAPEN.
B. Vérification de l’auto-injecteur ANAPEN
Avant d'utiliser l'auto-injecteur ANAPEN, le patient doit vérifier le dispositif en procédant comme suit :
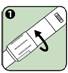 1. Tourner la bague pivotante pour aligner les lentilles sur la fenêtre d'inspection de la solution comme indiqué par les flèches.
1. Tourner la bague pivotante pour aligner les lentilles sur la fenêtre d'inspection de la solution comme indiqué par les flèches.
 2. Regarder par la fenêtre d'inspection de la solution. Vérifier que la solution est limpide et incolore.
2. Regarder par la fenêtre d'inspection de la solution. Vérifier que la solution est limpide et incolore.
Si la solution présente un aspect trouble, coloré ou contient des particules, l'auto-injecteur ANAPEN devra être éliminé.
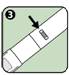 3. S'assurer que l'indicateur d'injection n'est pas rouge. L'indicateur rouge signifie que l'auto-injecteur ANAPEN a déjà été déclenché et qu'il doit être éliminé.
3. S'assurer que l'indicateur d'injection n'est pas rouge. L'indicateur rouge signifie que l'auto-injecteur ANAPEN a déjà été déclenché et qu'il doit être éliminé.
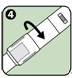 4. Retourner la bague pivotante comme indiqué par les flèches pour s'assurer que la fenêtre d'inspection de la solution est bien recouverte. Replacer l'auto-injecteur ANAPEN dans son carton d'emballage jusqu'à ce qu'il ait besoin d'être utilisé.
4. Retourner la bague pivotante comme indiqué par les flèches pour s'assurer que la fenêtre d'inspection de la solution est bien recouverte. Replacer l'auto-injecteur ANAPEN dans son carton d'emballage jusqu'à ce qu'il ait besoin d'être utilisé.
C. Utilisation de l'auto-injecteur ANAPEN
Si le bouchon noir protecteur de l'aiguille a été retiré, le patient ne doit pas poser son pouce, ses doigts ou sa main sur l'extrémité ouverte (contenant l'aiguille) de l'auto-injecteur ANAPEN.
Pour utiliser l'auto-injecteur ANAPEN, le patient doit suivre les étapes suivantes :
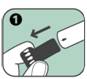 1. Enlever le bouchon noir protecteur de l'aiguille en tirant fortement dans le sens de la flèche ; cela permet également de retirer une gaine grise de protection de l'aiguille.
1. Enlever le bouchon noir protecteur de l'aiguille en tirant fortement dans le sens de la flèche ; cela permet également de retirer une gaine grise de protection de l'aiguille.
 2. Enlever le bouchon gris de sécurité du bouton rouge déclencheur en tirant dans le sens de la flèche.
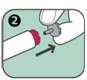
2. Enlever le bouchon gris de sécurité du bouton rouge déclencheur en tirant dans le sens de la flèche.
 3. Appuyer l'extrémité ouverte (contenant l'aiguille) de l'auto-injecteur ANAPEN sur la face externe de la cuisse. Il est possible d'utiliser ANAPEN à travers un vêtement léger, tel que du jean, du coton ou du polyester.
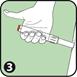
3. Appuyer l'extrémité ouverte (contenant l'aiguille) de l'auto-injecteur ANAPEN sur la face externe de la cuisse. Il est possible d'utiliser ANAPEN à travers un vêtement léger, tel que du jean, du coton ou du polyester.
 4. Appuyer sur le bouton rouge déclencheur de façon à entendre un « clic ». Maintenir en position pendant 10 secondes. Retirer lentement l'auto-injecteur de la cuisse puis masser légèrement le site d'injection.
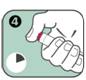
4. Appuyer sur le bouton rouge déclencheur de façon à entendre un « clic ». Maintenir en position pendant 10 secondes. Retirer lentement l'auto-injecteur de la cuisse puis masser légèrement le site d'injection.
 5. L'indicateur d'injection est passé au rouge, ce qui indique que l'injection est terminée. Si l'indicateur d'injection n'est pas rouge, recommencer l'injection avec un autre auto-injecteur ANAPEN.
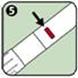
5. L'indicateur d'injection est passé au rouge, ce qui indique que l'injection est terminée. Si l'indicateur d'injection n'est pas rouge, recommencer l'injection avec un autre auto-injecteur ANAPEN.
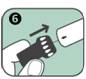 6. Après l'injection, l'aiguille dépasse du dispositif. Pour la recouvrir, replacer la partie large du bouchon noir protecteur de l'aiguille en l'enclenchant sur l'extrémité ouverte (contenant l'aiguille) de l'auto-injecteur ANAPEN (comme indiqué par la flèche).
6. Après l'injection, l'aiguille dépasse du dispositif. Pour la recouvrir, replacer la partie large du bouchon noir protecteur de l'aiguille en l'enclenchant sur l'extrémité ouverte (contenant l'aiguille) de l'auto-injecteur ANAPEN (comme indiqué par la flèche).
Si vous avez utilisé plus d’ANAPEN 150 microgrammes/0,3 ml, solution injectable en seringue préremplie que vous n’auriez dû :
· Si vous injectez trop d'adrénaline ou injectez le médicament accidentellement dans un vaisseau sanguin ou un doigt, consultez immédiatement le service des urgences de l'hôpital le plus proche.
· Si vous avez d’autres questions sur l’utilisation de ce médicament, demandez plus d’informations à votre médecin ou à votre pharmacien.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
ANAPEN 150 microgrammes/0,3 ml, solution injectable en seringue préremplie contient du métabisulfite de sodium (E223), qui peut provoquer des réactions de type allergique et des difficultés respiratoires, en particulier chez les sujets ayant des antécédents asthmatiques. Si vous présentez ces effets indésirables, vous devez consulter immédiatement un médecin.
Les effets indésirables fréquents de l'adrénaline sont : palpitations, battements cardiaques rapides ou irréguliers, transpiration, nausées, vomissements, difficultés respiratoires, étourdissements, faiblesse, pâleur, tremblements, maux de tête, inquiétude, nervosité, anxiété et refroidissement des extrémités.
D'autres effets indésirables moins fréquents sont : hallucinations, syncope, dilatation des pupilles, difficultés d'uriner, tremblements musculaires, augmentation de la pression sanguine et modifications du sang telles qu'un taux élevé de sucre, un taux bas de potassium et une teneur élevée en acide.
Occasionnellement à forte dose ou chez les patients sensibles à l'adrénaline, les effets indésirables sont : augmentation soudaine de la pression sanguine pouvant provoquer parfois une hémorragie cérébrale, battements cardiaques irréguliers et arrêt cardiaque, réduction de l'irrigation sanguine de la peau, des muqueuses et des reins.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER ANAPEN 150 microgrammes/0,3 ml, solution injectable en seringue préremplie ?
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption mentionnée sur la boîte et l’auto-injecteur après EXP.
La date de péremption fait référence au dernier jour de ce mois.
A conserver à une température ne dépassant pas 25°C.
Conserver l’auto-injecteur dans l'emballage extérieur, à l'abri de la lumière.
N’utilisez pas ce médicament si vous remarquez que la solution présente un aspect trouble, coloré ou contient des particules. Voir « Mode d’emploi » section « B. Vérification de l’auto-injecteur Anapen ».
Ne jetez aucun médicament au tout-à-l’égout ni avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient ANAPEN 150 microgrammes/0,3 ml, solution injectable en seringue préremplie
· La substance active est :
Adrénaline..................................................................................................................... 0,50 mg
Pour 1 ml.
· Les autres composants sont :
Métabisulfite de sodium (E223), chlorure de sodium, acide chlorhydrique (pour ajustement du pH), eau pour préparations injectables.
ANAPEN est une seringue préremplie d'adrénaline en solution injectable contenue dans un dispositif d'injection automatique (auto-injecteur).
Longueur d’aiguille exposée : 10 mm ± 1.5 mm.
ANAPEN est disponible en boîte de un ou deux auto-injecteurs dans une barquette de protection thermoformée.
Toutes les présentations peuvent ne pas être commercialisées.
Titulaire de l’autorisation de mise sur le marché
9 rue rameau
75002 paris
Exploitant de l’autorisation de mise sur le marché
BIOPROJET PHARMA
9 rue rameau
75002 paris
Primsdown Industrial Estate,
Worcester Road,
Chipping Norton,
Oxfordshire OX7 5XP,
royaume uni
LYOFAL - SALON DE PROVENCE, ZA La Gandonne
452 rue du Rémoulaire, SALON DE PROVENCE,
13300, FranCE
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Ce médicament est autorisé dans les Etats membres de l'Espace Economique Européen sous les noms suivants : Conformément à la réglementation en vigueur.
[à compléter ultérieurement par le titulaire]
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]