Dernière mise à jour le 01/12/2025
PROPIONATE DE FLUTICASONE/SALMETEROL TEVA 250 microgrammes/25 microgrammes/dose, suspension pour inhalation en flacon pressurisé
Indications thérapeutiques
Classe pharmacothérapeutique : Adrénergiques en association avec des corticoïdes ou d'autres médicaments, à l'exclusion des anticholinergiques, code ATC : R03AK06.
· Le salmétérol est un bronchodilatateur de longue durée d’action. Les bronchodilatateurs aident à garder les bronches ouvertes. Cela permet de faciliter l’entrée et la sortie de l’air dans les poumons. L’effet dure au moins 12 heures.
· Le propionate de fluticasone est un corticoïde qui diminue l’inflammation et l’irritation dans les poumons.
Votre médecin vous a prescrit ce médicament pour aider à prévenir certains troubles respiratoires tels que l’asthme.
Vous devez utiliser PROPIONATE DE FLUTICASONE/SALMETEROL TEVA tous les jours comme indiqué par votre médecin. Cela permettra de contrôler correctement votre asthme.
PROPIONATE DE FLUTICASONE/SALMETEROL TEVA permet d’éviter la survenue d’essoufflement et de sifflement. Cependant, PROPIONATE DE FLUTICASONE/SALMETEROL TEVA ne doit pas être utilisé lorsque vous avez une crise soudaine d’essoufflement ou de sifflement. Dans ces cas, vous devez utiliser votre médicament bronchodilatateur dit « de secours » d’action rapide et de courte durée, comme le salbutamol. Vous devez toujours avoir sur vous votre inhalateur dit « de secours » d’action rapide et de courte durée.
Présentations
> 1 flacon(s) pressurisé(s) aluminium de 120 dose(s) avec valve(s) doseuse(s)
Code CIP : 34009 301 564 5 2
Déclaration de commercialisation : 15/02/2024
Cette présentation est agréée aux collectivités
- Prix hors honoraire de dispensation : 21,31 €
- Honoraire de dispensation : 1,02 €
- Prix honoraire compris : 22,33 €
- Taux de remboursement :65 %
Service médical rendu (SMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Important | Avis du 12/07/2023 | Inscription (CT) | Le service médical rendu par PROPIONATE DE FLUTICASONE/SALMETEROL CIPLA 125 µg/25 µg/dose et 250 µg/25 µg/dose (propionate de fluticasone/salmétérol) est important dans l’indication de l’AMM. |
Amélioration du service médical rendu (ASMR)
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence. Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien `Avis du jj/mm/aaaa` ou encore sur demande auprés de la HAS (plus d'informations dans l'aide). Les avis et synthéses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur de l'ASMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| V (Inexistant) | Avis du 12/07/2023 | Inscription (CT) | Ces spécialités sont des hybrides qui n’apportent pas d’amélioration du service médical rendu (ASMR V) par rapport aux spécialités de référence SERETIDE (propionate de fluticasone/salmétérol) 125 µg / 25 µg / dose et 250 µg / 25 µg / dose. |
ANSM - Mis à jour le : 09/04/2025
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Salmétérol............................................................................................................ 25 microgrammes
Sous forme de xinafoate de salmétérol
Par dose émise par la valve
Soit
Propionate de fluticasone.................................................................................... 220 microgrammes
Salmétérol............................................................................................................ 21 microgrammes
Pour une dose délivrée à la sortie de l’embout buccal.
Pour la liste complète des excipients, voir rubrique 6.1.
Suspension pour inhalation en flacon pressurisé.
Le flacon contient une suspension homogène blanche.
4.1. Indications thérapeutiques
· chez des patients insuffisamment contrôlés par une corticothérapie inhalée et la prise d’un bronchodilatateur β2 agoniste de courte durée d’action par voie inhalée « à la demande » ;
ou
· chez des patients déjà bien contrôlés par une corticothérapie inhalée et la prise d’un bronchodilatateur β2 agoniste de longue durée d'action par voie inhalée.
4.2. Posologie et mode d'administration
PROPIONATE DE FLUTICASONE/SALMETEROL TEVA est destiné exclusivement à la voie inhalée.
Le patient doit être informé que PROPIONATE DE FLUTICASONE/SALMETEROL TEVA doit être utilisé quotidiennement pour obtenir un effet optimal, même quand il est asymptomatique.
Le médecin devra vérifier régulièrement que le dosage prescrit de PROPIONATE DE FLUTICASONE/SALMETEROL TEVA est bien adapté à l’état clinique du patient. Il ne sera modifié que sur avis médical. La posologie doit être ajustée à la plus faible dose qui permet de maintenir un contrôle efficace des symptômes. Lorsque les symptômes sont contrôlés par la plus faible posologie recommandée de PROPIONATE DE FLUTICASONE/SALMETEROL TEVA (125/25 microgrammes), il peut être alors envisagé d’utiliser une autre formulation de fluticasone/salmétérol par inhalation, à une concentration plus faible (50/25 microgrammes).
Il pourra être également envisagé de réduire la posologie de propionate de fluticasone/salmétérol à une prise par jour, si le médecin estime nécessaire de maintenir un traitement par β2-agoniste de longue durée d'action pour le contrôle des symptômes. Si la prédominance des symptômes est nocturne, la dose sera administrée le soir ; si elle est diurne, la dose sera administrée le matin.
Le dosage de propionate de fluticasone/salmétérol qui sera prescrit au patient devra correspondre à la dose de propionate de fluticasone adaptée à la sévérité de son asthme. Chez les patients asthmatiques, le propionate de fluticasone est aussi efficace que d'autres corticoïdes inhalés à environ la moitié de la dose quotidienne exprimée en microgrammes. Si un patient nécessite une posologie autre que celle recommandée, il convient de prescrire des doses appropriées de β2-agoniste et/ou de corticoïde.
Remarque : Si une dose de propionate de fluticasone supérieure à 250 microgrammes est nécessaire, un produit alternatif doit être utilisé.
Posologies recommandées
Adultes et adolescents (à partir de 12 ans)
· deux inhalations de 125 microgrammes de propionate de fluticasone et 25 microgrammes de salmétérol deux fois par jour ;
ou
· deux inhalations de 250 microgrammes de propionate de fluticasone et 25 microgrammes de salmétérol deux fois par jour.
Il n’a pas été établi de bénéfice évident de PROPIONATE DE FLUTICASONE/SALMETEROL TEVA utilisé en traitement d’initiation par rapport à un traitement inhalé par propionate de fluticasone seul, lorsque 1 à 2 des critères de sévérité évoqués ci-dessus ne sont pas présents. Dans la majorité des cas, le traitement de première intention demeure l’administration de corticoïdes inhalés seuls. PROPIONATE DE FLUTICASONE/SALMETEROL TEVA n’est pas destiné au traitement de première intention de l’asthme léger.
L'utilisation d'une chambre d'inhalation avec PROPIONATE DE FLUTICASONE/SALMETEROL TEVA est recommandée chez les patients ayant, ou susceptibles d’avoir des difficultés à coordonner leur inspiration avec le déclenchement du dispositif d’inhalation.
Une chambre d'inhalation, comme la chambre Volumatic, AeroChamber Plus ou une autre chambre, peut être utilisée (selon les recommandations nationales). Les données pharmacocinétiques d'administration d'une dose unique ont montré que l'exposition systémique au salmétérol et au propionate de fluticasone peut différer en fonction des différentes chambres d'inhalation utilisées (voir rubrique 4.4).
Les patients devront être informés des modalités d’utilisation et d’entretien de leur dispositif d’inhalation et de leur chambre d’inhalation. Il conviendra également de vérifier que le patient les utilise convenablement afin que le produit soit délivré de façon optimale jusqu’au poumon.
Dans la mesure du possible, les patients doivent continuer à utiliser le même type de chambre d’inhalation, car le passage d’une chambre d’inhalation à une autre peut faire varier la dose de produit inhalé (voir rubrique 4.4).
Lors de l’introduction ou du changement de chambre d’inhalation, il convient de toujours rechercher la dose minimale efficace.
Populations à risque
Il n’y a pas lieu d’ajuster les doses chez les sujets âgés ou atteints d’insuffisance rénale. Aucune donnée n’est disponible concernant l'utilisation de PROPIONATE DE FLUTICASONE/SALMETEROL TEVA chez les patients atteints d'insuffisance hépatique.
Mode d'administration
Instructions pour l’utilisation
Les patients doivent être formés à l'utilisation correcte de l'inhalateur (voir la notice d'information du patient).
Durant l’inhalation, le patient doit, de préférence se tenir assis ou debout. L'inhalateur a été conçu pour un usage en position verticale.
Vérification du fonctionnement de l'inhalateur
Avant la première utilisation, afin de vérifier le bon fonctionnement du dispositif, les patients doivent retirer le capuchon de l’embout buccal en exerçant une pression de chaque côté, bien agiter l’inhalateur, tenir le dispositif entre les doigts en positionnant le pouce à la base du dispositif sous l’embout buccal, puis libérer quatre bouffées.
Bien agiter le dispositif juste avant de l’activer pour libérer chaque bouffée. Si le dispositif n’a pas été utilisé depuis une semaine ou plus, le patient doit bien agiter l’inhalateur après avoir retiré le capuchon de l’embout buccal et doit libérer deux bouffées de produit dans l’air.
Utilisation de l'inhalateur
1. Le patient doit retirer le capuchon de l'embout buccal en exerçant une pression de chaque côté.
2. Le patient doit vérifier que l'intérieur et l'extérieur de l'inhalateur, particulièrement l'embout buccal, sont exempts de corps étrangers.
3. Le patient doit bien agiter l’aérosol pour éliminer tout corps étranger et assurer le mélange des composants de la suspension dans le flacon.
4. Le patient doit tenir l'inhalateur bien droit entre les doigts et le pouce avec son pouce à la base, sous l’embout buccal.
5. Le patient doit expirer autant que possible puis placer l’embout buccal dans sa bouche entre les dents et fermer les lèvres autour. Signaler au patient qu’il ne doit pas mordre l’embout buccal.
6. Juste après le début de l'inspiration par la bouche, le patient doit appuyer fermement vers le bas sur le haut de l'inhalateur pour libérer PROPIONATE DE FLUTICASONE/SALMETEROL TEVA tout en continuant à inspirer régulièrement et profondément.
7. Pendant qu’il retient sa respiration, le patient retirera l’inhalateur de sa bouche. Le patient retiendra sa respiration autant que cela lui est possible.
8. Si le patient doit prendre une seconde inhalation, il devra garder l'inhalateur bien droit et attendre environ 30 secondes avant de répéter les étapes 3 à 7.
9. Le patient devra replacer le capuchon sur l’embout buccal immédiatement après en appuyant fermement sur le capuchon en veillant à ce qu’il soit placé dans la position correcte. Il n’y a pas besoin d’exercer une force importante pour replacer le capuchon sur l’embout buccal, un simple « clic » suffit à s’assurer de la fermeture de l’embout buccal par le capuchon.
IMPORTANT
Les étapes 5, 6 et 7 ne devront pas être réalisées dans la précipitation. Il est important que le patient débute une respiration aussi lente que possible avant de déclencher son dispositif. Le patient devra s’entraîner les premières fois devant un miroir. S’il voit un peu de « fumée » sortir du haut de l’aérosol doseur ou à la commissure des lèvres, il doit alors recommencer à partir de l’étape 3.
Les patients devront se rincer la bouche avec de l’eau en la recrachant et/ou se brosser les dents après chaque utilisation de médicament, afin de réduire les risques de candidose buccale et pharyngée ainsi que l’apparition d’une raucité de la voix.
Les patients doivent penser au remplacement de l'inhalateur quand l'indicateur affiche le nombre « 40 » et que la couleur de l'indicateur de doses passe du vert au rouge. Les patients doivent arrêter l'utilisation de l'inhalateur quand l'indicateur affiche « 0 » parce que son contenu est insuffisant pour l'administration d'une dose complète.
Ne jamais tenter de modifier les nombres de l'indicateur ou de détacher l'indicateur du poussoir d'activation. L'indicateur ne peut pas être réinitialisé et il est fixé de manière permanente au poussoir d'activation.
Nettoyage :
L'inhalateur doit être nettoyé au moins une fois par semaine.
1. Retirer le capuchon de l'embout buccal.
2. Ne pas sortir le flacon de son adaptateur en plastique.
3. Essuyer l'intérieur et l'extérieur de l'embout buccal et de l’adaptateur en plastique avec un tissu ou un mouchoir propre et sec.
4. Remettre le capuchon de l’embout buccal en veillant à ce qu’il soit placé correctement dans le bon sens. Il n’y a pas besoin d’exercer une force importante pour replacer le capuchon sur l’embout buccal, un simple « clic » suffit à s’assurer de la fermeture de l’embout buccal par le capuchon.
NE PAS METTRE LE FLACON METALLIQUE DANS L'EAU.
Hypersensibilité aux substances actives ou à l'un des excipients mentionnés à la rubrique 6.1.
4.4. Mises en garde spéciales et précautions d'emploi
Le propionate de fluticasone/salmétérol n'est pas adapté au traitement des crises d'asthme. Dans ces situations, le patient devra avoir recours à un bronchodilatateur à action rapide et de courte durée pour traiter les symptômes aigus. Le patient sera informé qu'il doit ainsi avoir en permanence à sa disposition un médicament bronchodilatateur à action rapide et de courte durée destiné à être utilisé en cas de crise d'asthme.
Le traitement par propionate de fluticasone/salmétérol ne doit pas être initié pendant une phase d'exacerbation, ni en cas d’aggravation significative ou de détérioration aiguë de son asthme.
Des événements indésirables graves liés à l'asthme et des exacerbations peuvent survenir lors du traitement par PROPIONATE DE FLUTICASONE/SALMETEROL TEVA. Il convient d’informer les patients que si les symptômes de l’asthme persistent ou s’aggravent au cours du traitement par PROPIONATE DE FLUTICASONE/SALMETEROL TEVA, ils doivent continuer leur traitement mais prendre avis auprès de leur médecin.
Une augmentation de la consommation de médicaments bronchodilatateurs à action rapide et de courte durée (dit « médicaments de secours ») ou une diminution de la réponse à ceux-ci est le signe d'une déstabilisation de la maladie. Dans ce cas, le patient devra consulter son médecin.
Une détérioration plus ou moins rapide du contrôle des symptômes doit faire craindre une évolution vers un asthme aigu grave pouvant mettre en jeu le pronostic vital et, par conséquent, nécessite une consultation médicale urgente. Il conviendra alors d'envisager une augmentation de la corticothérapie. Le patient doit également faire l’objet d’une réévaluation si la posologie actuelle de propionate de fluticasone/salmétérol n'a pas permis un contrôle adéquat de son asthme. Il faudra alors envisager l'instauration d'une corticothérapie supplémentaire.
Dès que les symptômes de l’asthme sont contrôlés, une diminution progressive de la dose de propionate de fluticasone/salmétérol doit être envisagée. Il est important que les patients soient suivis régulièrement lors de la période de réduction du traitement. La dose minimale efficace de propionate de fluticasone/salmétérol doit être utilisée (voir rubrique 4.2).
Le traitement par propionate de fluticasone/salmétérol ne devra pas être interrompu brusquement en raison du risque d'exacerbation. Le traitement ne devra être diminué que sous la supervision d'un médecin.
Comme les autres corticoïdes destinés à être administrés par voie inhalée, le propionate de fluticasone/salmétérol doit être utilisé avec précaution chez les patients atteints de tuberculose pulmonaire active ou quiescente, d’infections fongiques et virales ou d'autres infections des voies respiratoires. Un traitement approprié doit être instauré rapidement si nécessaire.
Rarement, le propionate de fluticasone/salmétérol peut entraîner des troubles du rythme cardiaque tels que tachycardie supraventriculaire, extrasystoles et fibrillation auriculaire, ainsi qu’une baisse modérée et transitoire de la kaliémie à des doses thérapeutiques élevées. Le propionate de fluticasone/salmétérol doit être utilisé avec prudence en cas de pathologies cardiovasculaires sévères, de troubles du rythme cardiaque et chez les patients présentant un diabète, une hyperthyroïdie, une hypokaliémie non corrigée ou à risque d’hypokaliémie.
Des augmentations de la glycémie ont été très rarement rapportées (voir rubrique 4.8). Ceci doit être pris en compte lors de la prescription à des patients diabétiques.
Comme avec d’autres traitements inhalés, un bronchospasme paradoxal peut survenir, caractérisé par une augmentation des sifflements et un essoufflement survenant immédiatement après l’administration. Le bronchospasme paradoxal doit être traité immédiatement avec un bronchodilatateur d’action rapide et de courte durée. Il convient alors de cesser toute administration de propionate de fluticasone/salmétérol, d'évaluer l'état du patient et au besoin, d’instaurer un traitement alternatif.
Il convient d'être prudent lors du passage à un traitement par propionate de fluticasone/salmétérol, particulièrement s'il existe des raisons de supposer que la fonction surrénalienne est affectée par une corticothérapie systémique antérieure.
Les effets indésirables pharmacologiques des traitements β2 agoniste, tels que tremblements, palpitations et maux de tête ont été rapportés, mais ces manifestations sont généralement transitoires et s'atténuent au cours d'un traitement régulier.
La corticothérapie inhalée peut entraîner des effets systémiques, en particulier lors de traitements à fortes doses au long cours. La survenue de ces effets reste cependant moins probable qu'au cours d'une corticothérapie orale. Il peut être observé un syndrome de Cushing, un tableau cushingoïde, une inhibition de la fonction surrénalienne, une diminution de la densité minérale osseuse, une cataracte et un glaucome et, plus rarement, divers effets psychologiques ou comportementaux incluant hyperactivité psychomotrice, troubles du sommeil, anxiété, dépression ou agressivité (en particulier chez l’enfant) (voir la sous-rubrique Population pédiatrique ci-dessous pour plus d’informations sur les effets systémiques des corticoïdes inhalés chez les enfants et les adolescents). En conséquence, le patient sera suivi régulièrement et la posologie minimale efficace devra toujours être recherchée.
Une perturbation visuelle peut être signalée lors de l’utilisation systémique et topique des corticostéroïdes. Si un patient présente des symptômes tels qu’une vision floue ou d'autres troubles visuels, il devra être orienté vers un ophtalmologiste pour une évaluation des causes possibles qui peuvent inclure une cataracte, un glaucome ou des maladies rares telles que la choriorétinopathie séreuse centrale (CSCR) qui ont été rapportés après l'administration de corticostéroïdes systémiques et topiques.
L’administration prolongée de doses élevées de corticoïdes par voie inhalée peut provoquer une inhibition de la fonction surrénalienne et une insuffisance surrénalienne aiguë. Des cas d’inhibition de la fonction surrénalienne et d’insuffisance surrénale aiguë ont également été très rarement décrits avec des doses de propionate de fluticasone comprises entre 500 et 1000 microgrammes. Les crises d’insuffisance surrénalienne peuvent être déclenchées par un traumatisme, une intervention chirurgicale, une infection ou toute diminution rapide de la posologie. Le tableau clinique est généralement atypique pouvant comprendre anorexie, douleur abdominale, perte de poids, fatigue, maux de tête, nausées, vomissements, hypotension, troubles de la conscience, hypoglycémie et convulsions. En cas de stress ou lorsqu'une intervention chirurgicale est prévue, une corticothérapie de supplémentation par voie générale peut être nécessaire.
Le propionate de fluticasone et le salmétérol sont essentiellement absorbés par voie pulmonaire. L’utilisation d’une chambre d’inhalation associée à l’aérosol-doseur peut augmenter la dose de produit délivrée au poumon, pouvant ainsi augmenter le risque de survenue d’effets indésirables systémiques. Des données de cinétique en administration en dose unique ont mis en évidence que l'exposition systémique au salmétérol et au propionate de fluticasone peut différer en fonction des différentes chambres d'inhalation utilisées.
L'administration de propionate de fluticasone par voie inhalée favorise la diminution du recours aux corticoïdes oraux pour traiter l'asthme, mais elle ne prévient pas le risque d'apparition d'une insuffisance surrénalienne lors du sevrage des patients traités au long cours par une corticothérapie orale. Par conséquent, ces patients doivent être traités avec précaution et leur fonction cortico-surrénalienne régulièrement surveillée. Ce risque existe également chez les patients ayant reçu de fortes doses de corticoïdes en urgence. Le risque de persistance d'une inhibition des fonctions surrénaliennes doit rester présent à l'esprit dans les situations d'urgence et/ou susceptibles de déclencher un état de stress. Une corticothérapie substitutive adaptée devra être envisagée. Un avis spécialisé peut être requis.
Le ritonavir peut augmenter considérablement les concentrations plasmatiques de propionate de fluticasone. Par conséquent, à moins que le bénéfice attendu pour le patient ne l’emporte sur le risque d’effets systémiques de la corticothérapie, il convient d’éviter de les administrer de façon concomitante. Le risque d’effets indésirables systémiques de la corticothérapie est également augmenté en cas d’administration concomitante de propionate de fluticasone avec d’autres inhibiteurs puissants du cytochrome P450 3A4 incluant des produits contenant du cobicistat (voir rubrique 4.5).
Une augmentation des cas d’infections respiratoires basses (en particulier pneumonie et bronchite) a été observée dans une étude menée sur 3 ans chez des patients atteints de Broncho-Pneumopathie Chronique Obstructive (BPCO) traités par l’association fixe salmétérol et propionate de fluticasone administrée via le dispositif Diskus, par rapport à ceux recevant du placebo (voir rubrique 4.8). Dans cette étude, le risque de développer une pneumonie, indépendamment du traitement, était le plus élevé chez les patients âgés, les patients ayant un faible indice de masse corporelle (< 25 kg/m2) et ceux ayant une maladie très sévère (VEMS < 30 % de la valeur théorique). Les médecins doivent rester vigilants sur la survenue possible d’une pneumonie ou d’autres infections respiratoires basses chez les patients atteints de BPCO car les manifestations cliniques de ce type d’infection et d’une simple exacerbation sont souvent confondues. La survenue d’une pneumonie chez un sujet atteint de BPCO à un stade sévère doit conduire à réévaluer le traitement par propionate de fluticasone/salmétérol. La sécurité et l’efficacité du propionate de fluticasone/salmétérol n’a pas été établie pour les patients atteints de BPCO, par conséquent le propionate de fluticasone/salmétérol n’est pas indiqué dans le traitement des patients atteints de BPCO.
L’administration concomitante de kétoconazole par voie systémique augmente de manière significative l’exposition systémique au salmétérol pouvant entraîner une augmentation du risque de survenue d’effets systémiques (par exemple : prolongation de l’intervalle QTc et palpitations). Par conséquent, il convient d’éviter l’administration concomitante de kétoconazole ou d’autres inhibiteurs puissants du cytochrome P450 3A4 sauf si les bénéfices attendus l’emportent sur le risque potentiel de survenue d’effets systémiques du salmétérol (voir rubrique 4.5).
Population pédiatrique
Les enfants et les adolescents de moins de 16 ans recevant de fortes doses de propionate de fluticasone (généralement ≥ 1000 microgrammes par jour) sont particulièrement à risque. Des effets systémiques peuvent survenir, en particulier lors de traitements à fortes doses au long cours. Il peut être observé un syndrome de Cushing, un tableau cushingoïde, une inhibition de la fonction surrénalienne, une insuffisance surrénalienne aiguë et un retard de croissance chez l'enfant et l'adolescent et, plus rarement, divers effets psychologiques ou comportementaux incluant hyperactivité psychomotrice, troubles du sommeil, anxiété, dépression ou agressivité. Il convient alors d’adresser l’enfant ou l’adolescent à un pédiatre spécialisé en pneumologie.
La croissance des enfants recevant une corticothérapie inhalée à long terme devra être régulièrement surveillée. La corticothérapie inhalée devra être réduite à la plus faible dose assurant un contrôle efficace de l’asthme.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Les β-bloquants adrénergiques peuvent diminuer ou antagoniser l’effet du salmétérol. Les β-bloquants, sélectifs ou non, doivent être évités chez les patients atteints d’asthme, sauf nécessité absolue. Une hypokaliémie potentiellement grave peut survenir suite à un traitement par β2 agoniste. Une attention particulière est recommandée en cas d’asthme aigu sévère en raison du risque d’aggravation de cette hypokaliémie par l’administration d’un traitement concomitant à base de dérivés de la xanthine, de stéroïdes et de diurétiques.
L’administration concomitante d’autres b-adrénergiques peut potentialiser les effets b2 mimétiques.
+ Propionate de fluticasone
Dans les conditions normales d’emploi, les concentrations plasmatiques de propionate de fluticasone atteintes après administration par voie inhalée sont faibles du fait d’un effet de premier passage présystémique important (hépatique et intestinal) et d’une forte clairance plasmatique par une importante métabolisation médiée par le cytochrome CYP3A4. Par conséquent, le risque d’interactions cliniquement significatives avec le propionate de fluticasone semble faible.
Une étude d’interaction chez des volontaires sains recevant du propionate de fluticasone par voie nasale a montré que le ritonavir (un inhibiteur très puissant du cytochrome CYP3A4) à la dose de 100 mg deux fois par jour augmentait de plusieurs centaines de fois les concentrations plasmatiques de propionate de fluticasone, entraînant une diminution marquée des concentrations en cortisol plasmatique. Il n’y a pas de donnée documentant l’interaction avec le propionate de fluticasone administré par voie inhalée, mais une augmentation importante des concentrations plasmatiques est attendue. Des cas de syndrome de Cushing et d’inhibition de la fonction surrénalienne ont été rapportés. Il convient donc d’éviter l’administration concomitante de propionate de fluticasone et de ritonavir, à moins que le bénéfice ne l’emporte sur le risque accru d’effets systémiques de la corticothérapie.
Une étude de faible effectif menée chez des volontaires sains a montré que le kétoconazole, inhibiteur un peu moins puissant du cytochrome P450 3A4 augmentait de 150 % l’exposition systémique d’une dose de propionate de fluticasone par voie inhalée. La réduction du cortisol plasmatique était plus importante que celle observée après l’administration de propionate de fluticasone seul. Une augmentation de l’exposition systémique et du risque d’effets indésirables systémiques est attendue en cas d’administration concomitante d’autres inhibiteurs puissants du cytochrome P450 3A4 (ex : itraconazole et médicaments contenant du cobicistat) et d’inhibiteurs modérés du CYP3A (ex : érythromycine). L'administration concomitante doit être évitée sauf si les bénéfices attendus sont supérieurs au risque accru d'effets secondaires systémiques des corticostéroïdes. Dans ce cas, les patients doivent être surveillés en vue de détecter les éventuels effets secondaires systémiques des corticostéroïdes.
+ Salmétérol
Inhibiteurs puissants du CYP3A4
L’administration concomitante de kétoconazole (400 mg par voie orale une fois par jour) et de salmétérol (50 µg par voie inhalée deux fois par jour) chez 15 volontaires sains pendant 7 jours a entraîné une augmentation significative des concentrations plasmatiques de salmétérol (Concentration maximale (Cmax) augmentée d’un facteur 1,4 et aire sous la courbe (ASC) augmentée d’un facteur 15). Cette observation suggère donc une augmentation du risque de survenue des effets systémiques du salmétérol, tels que prolongation de l’intervalle QT et palpitations, par rapport à l’administration de salmétérol ou de kétoconazole seuls (voir rubrique 4.4).
Il n’a pas été observé d’effet cliniquement significatif sur la pression artérielle, la fréquence cardiaque, la glycémie et la kaliémie. L’administration concomitante de kétoconazole n’a pas entraîné de prolongation de la demi-vie d’élimination du salmétérol ni son accumulation après administrations répétées.
Il convient d’éviter l’association de kétoconazole avec un traitement par salmétérol sauf si les bénéfices attendus l’emportent sur le risque potentiel de survenue d’effets systémiques du salmétérol. Un risque d’interaction du même ordre est attendu avec d’autres inhibiteurs puissants du cytochrome P450 3A4 (par exemple avec l’itraconazole, la télithromycine, le ritonavir).
Inhibiteurs modérés du CYP3A4
L’administration concomitante d’érythromycine (500 mg par voie orale trois fois par jour) et de salmétérol (50 microgrammes par voie inhalée deux fois par jour) chez 15 volontaires sains pendant 6 jours a entraîné une légère augmentation, mais non statistiquement significative, des concentrations plasmatiques du salmétérol (Cmax augmentée d’un facteur 1,4 et ASC augmentée d’un facteur 1,2). Aucun effet indésirable grave n’a été associé à l’administration concomitante avec l’érythromycine.
4.6. Fertilité, grossesse et allaitement
Fertilité
Il n’existe pas de données chez l’Homme. Cependant, les études menées chez l’animal n’ont montré aucun effet du salmétérol ou du propionate de fluticasone sur la fertilité.
Grossesse
Une quantité importante de données obtenues chez la femme enceinte (plus de 1 000 cas de grossesses documentées) ne rapportent pas de toxicité malformative ou fœto-néonatale en relation avec du salmétérol et du propionate de fluticasone. Les études chez l'animal ont montré une toxicité sur la reproduction après l'administration d'agonistes des adrénorécepteurs β2 et de glucocorticoïdes (voir rubrique 5.3).
L'administration de propionate de fluticasone/salmétérol pendant la grossesse ne doit être envisagée que si le bénéfice attendu pour la mère est supérieur à tout risque possible pour le fœtus.
Chez la femme enceinte, il conviendra de toujours rechercher la dose minimale efficace de propionate de fluticasone assurant un contrôle satisfaisant des symptômes de l’asthme.
Le passage dans le lait maternel du salmétérol et du propionate de fluticasone et de leurs métabolites n’est pas connu.
Des études ont mis en évidence que le salmétérol et le propionate de fluticasone, et leurs métabolites, sont excrétés dans le lait des rates allaitantes.
Un risque pour les nouveau-nés/nourrissons nourris au sein ne peut être exclu. La décision d’interruption de l’allaitement ou du traitement par propionate de fluticasone/salmétérol sera établie en fonction du bénéfice attendu de l'allaitement maternel pour l'enfant face à celui du traitement pour la femme qui allaite.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
PROPIONATE DE FLUTICASONE/SALMETEROL TEVA contient du salmétérol et du propionate de fluticasone, dont les effets indésirables sont connus. Aucun effet indésirable nouveau n’est apparu lors de l’administration conjointe des deux principes actifs dans la même formulation.
Les effets indésirables associés au propionate de fluticasone/salmétérol sont indiqués ci-dessous, listés par classe de systèmes d'organes et par fréquence. Les fréquences sont définies comme suit : très fréquent (≥ 1/10), fréquent (≥ 1/100 à < 1/10), peu fréquent (≥ 1/1 000 à < 1/100), rare (≥ 1/10 000 à < 1/1 000) et indéterminée (ne peut être estimée sur la base des données disponibles).
Les fréquences ont été définies d'après les données des essais cliniques. L'incidence dans les groupes placebo n'a pas été prise en considération.
|
Classe de systèmes d'organes |
Evénement indésirable |
Fréquence |
|
Infections et infestations |
Candidose buccale et pharyngée |
Fréquent |
|
Pneumonie |
Fréquent1,3 |
|
|
Bronchite |
Fréquent1,3 |
|
|
Candidose œsophagienne |
Rare |
|
|
Affections du système immunitaire |
Réactions d'hypersensibilité avec les manifestations suivantes : |
|
|
Réactions cutanées d'hypersensibilité |
Peu fréquent |
|
|
Dyspnée |
Peu fréquent |
|
|
Angio-œdème (principalement œdème facial et oropharyngé) |
Rare |
|
|
Bronchospasme |
Rare |
|
|
Réactions anaphylactiques notamment choc anaphylactique |
Rare |
|
|
Affections endocriniennes |
Syndrome de Cushing, tableau cushingoïde, inhibition de la fonction surrénalienne, ralentissement de la croissance chez l'enfant et l'adolescent, diminution de la densité minérale osseuse |
Rare4 |
|
Troubles du métabolisme et de la nutrition |
Hypokaliémie |
Fréquent3 |
|
Hyperglycémie |
Peu fréquent4 |
|
|
Affections psychiatriques |
Anxiété |
Peu fréquent |
|
Troubles du sommeil |
Peu fréquent |
|
|
Troubles comportementaux, notamment hyperactivité psychomotrice et irritabilité (principalement chez l'enfant) |
Rare |
|
|
Dépression, agressivité (principalement chez l'enfant) |
Fréquence indéterminée |
|
|
Affections du système nerveux |
Céphalées |
Très fréquent1 |
|
Tremblements |
Peu fréquent |
|
|
Affections oculaires |
Cataracte |
Peu fréquent |
|
Glaucome |
Rare4 |
|
|
Vision floue (voir la section 4.4) |
Fréquence indéterminée |
|
|
Affections cardiaques |
Palpitations |
Peu fréquent |
|
Tachycardie |
Peu fréquent |
|
|
Fibrillation auriculaire |
Peu fréquent |
|
|
Angine de poitrine |
Peu fréquent |
|
|
Arythmies cardiaques (y compris tachycardie supraventriculaire et extrasystoles) |
Rare |
|
|
Affections respiratoires, thoraciques et médiastinales |
Rhinopharyngite |
Très fréquent2,3 |
|
Gêne pharyngée |
Fréquent |
|
|
Raucité de la voie/dysphonie |
Fréquent |
|
|
Sinusite |
Fréquent1,3 |
|
|
Bronchospasme paradoxal |
Rare4 |
|
|
Affections de la peau et du tissu sous-cutané |
Contusions |
Fréquent1,3 |
|
Affections musculo‑squelettiques et systémiques |
Crampes musculaires |
Fréquent |
|
Fractures traumatiques |
Fréquent1,3 |
|
|
Arthralgie |
Fréquent |
|
|
Myalgie |
Fréquent |
1. Rapporté fréquemment dans les groupes placebo.
2. Rapporté très fréquemment dans les groupes placebo.
3. Rapporté sur 3 ans dans une étude dans la BPCO.
4. Voir rubrique 4.4.
Description d'effets indésirables particuliers
Des effets pharmacologiques indésirables du traitement par β2 agoniste, comme des tremblements, des palpitations et des maux de tête, ont été rapportés, mais ils sont le plus souvent transitoires et diminuent avec la poursuite du traitement.
Comme avec d’autres traitements inhalés, un bronchospasme paradoxal peut survenir, caractérisé par une augmentation des sifflements et un essoufflement survenant immédiatement après l’administration. Le bronchospasme paradoxal doit être traité immédiatement avec un bronchodilatateur d’action rapide et de courte durée. Il convient alors de cesser immédiatement toute administration de propionate de fluticasone/salmétérol, d'évaluer l'état du patient et au besoin, d’instaurer un traitement alternatif.
Des effets indésirables associés au propionate de fluticasone comme une raucité de la voix et une candidose (muguet) buccale et pharyngée, et rarement œsophagienne, peuvent survenir chez certains patients. La raucité de la voie et les candidoses buccales et pharyngées peuvent être réduites par le rinçage de la bouche à l’eau et/ou le brossage de dents après utilisation de propionate de fluticasone/salmétérol. Les candidoses buccales et pharyngées symptomatiques peuvent être traitées par des antifongiques locaux tout en continuant le traitement par propionate de fluticasone/salmétérol.
Population pédiatrique
Les effets systémiques, tels que Syndrome de Cushing, tableau cushingoïde, inhibition de la fonction surrénalienne et ralentissement de la croissance chez l’enfant et chez l’adolescent, sont possibles (voir rubrique 4.4). Anxiété, troubles du sommeil et modifications du comportement, incluant hyperactivité et irritabilité, peuvent également survenir chez les enfants et les adolescents.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/.
Les signes et symptômes d’un surdosage en salmétérol sont des vertiges, une augmentation de la pression artérielle systolique, des tremblements, des céphalées et une tachycardie. Les antidotes à utiliser préférentiellement sont les β‑bloquants cardiosélectifs ; ils doivent cependant être utilisés avec prudence chez les patients avec antécédents de bronchospasme. Si le traitement par propionate de fluticasone/salmétérol doit être interrompu en raison d’une exposition excessive aux β2 mimétiques, il sera remplacé par un corticoïde seul. Si une hypokaliémie apparaît, elle devra être corrigée par un apport adapté de potassium et la kaliémie devra être surveillée.
Surdosage aigu
L'administration de propionate de fluticasone à des doses supérieures à celles recommandées par voie inhalée peut entraîner une inhibition temporaire de la fonction surrénalienne. Il n’y a pas lieu d’adopter une mesure d’urgence car la fonction surrénalienne se rétablit en quelques jours comme en témoignent les mesures du cortisol plasmatique.
Surdosage chronique en propionate de fluticasone inhalé
La fonction surrénalienne doit être surveillée et un traitement à base de corticoïde systémique peut alors être nécessaire. Une fois stabilisé, le traitement doit être poursuivi avec un corticoïde inhalé à la dose recommandée. Se reporter à la rubrique 4.4 : Risque d’inhibition surrénalienne.
Une surveillance de la réserve surrénalienne peut être indiquée. En cas de surdosage aigu et chronique en propionate de fluticasone, le traitement par propionate de fluticasone/salmétérol doit être poursuivi en ajustant la posologie aux doses suffisantes pour un contrôle optimal des symptômes de l’asthme.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : Adrénergiques en association avec des corticoïdes ou d'autres médicaments, à l'exclusion des anticholinergiques, code ATC : R03AK06.
Mécanisme d'action et effets pharmacodynamiques
PROPIONATE DE FLUTICASONE/SALMETEROL TEVA contient du salmétérol et du propionate de fluticasone qui ont des modes d'action différents.
Les mécanismes d'action respectifs des deux médicaments sont présentés ci-après.
Salmétérol
Le salmétérol est un agoniste sélectif à longue durée d'action (12 heures) des récepteurs β2‑adrénergiques possédant une longue chaîne latérale qui le lie à l'exo-site du récepteur.
Le salmétérol produit une bronchodilatation qui persiste pendant au moins 12 heures. Cette durée est supérieure à celle observée généralement avec les β2 mimétiques de courte durée d'action administrés aux posologies usuelles.
Propionate de fluticasone
Le propionate de fluticasone administré par voie inhalée aux doses préconisées exerce une activité glucocorticoïde entraînant un effet anti-inflammatoire local au niveau de la muqueuse bronchique. En conséquence, les symptômes et les exacerbations d'asthme sont diminués alors que les effets systémiques sont limités comparativement à l'administration de corticoïdes par voie générale.
Efficacité clinique et sécurité
Etudes cliniques conduites avec le propionate de fluticasone/salmétérol dans l'asthme
Une étude de douze mois (Gaining Optimal Asthma controL, GOAL), sur 3 416 patients adultes et adolescents atteints d'asthme persistant, a comparé la tolérance et l'efficacité du propionate de fluticasone/salmétérol à celle d’une corticothérapie inhalée seule (propionate de fluticasone) afin d’évaluer la possibilité d'atteindre les objectifs de la prise en charge de l'asthme. La posologie du traitement était augmentée toutes les 12 semaines jusqu'à ce que le contrôle total** ait été obtenu ou que la posologie la plus élevée du médicament de l'étude ait été atteinte. L'étude GOAL a montré qu'un nombre plus important de patients traités par propionate de fluticasone/salmétérol ont obtenu le contrôle de l'asthme par rapport à ceux traités par un corticoïde inhalé (CSI) seul ; ce contrôle était obtenu avec une plus faible posologie de corticoïde.
Un contrôle satisfaisant* de l'asthme était obtenu plus rapidement avec le propionate de fluticasone/salmétérol qu'avec le seul CSI. La durée de traitement nécessaire pour que 50 % des sujets obtiennent leur première semaine de contrôle satisfaisant était de 16 jours dans le groupe propionate de fluticasone/salmétérol contre 37 jours pour le groupe CSI. Dans le sous-groupe des patients asthmatiques naïfs de corticoïdes, la durée de traitement avant une première semaine bien contrôlée était de 16 jours dans le groupe propionate de fluticasone/salmétérol contre 23 jours dans le groupe CSI.
Les résultats globaux de l'étude étaient les suivants :
|
Pourcentage de patients obtenant un contrôle satisfaisant* (CS) et un contrôle total** (CT) de l'asthme sur 12 mois |
||||
|
Traitement avant l'étude |
PF/Salmétérol |
PF |
||
|
CS |
CT |
CS |
CT |
|
|
Aucun CSI (BACA seul) |
78 % |
50 % |
70 % |
40 % |
|
CSI à faible dose (≤ 500 microgrammes de BDP ou équivalent/jour) |
75 % |
44 % |
60 % |
28 % |
|
CSI à dose moyenne (> 500– 1 000 microgrammes de BDP ou équivalent/jour) |
62 % |
29 % |
47 % |
16 % |
|
Résultats regroupés des 3 niveaux de traitement |
71 % |
41 % |
59 % |
28 % |
*Contrôle satisfaisant de l'asthme ; au plus 2 jours avec un score des symptômes supérieur à 1 (un score des symptômes de 1 est défini comme « symptômes de courte durée pendant la journée »), utilisation de BACA pendant au plus 2 jours et au plus à 4 occasions/semaine, débit maximal expiratoire matinal supérieur ou égal à 80 % de la valeur théorique, pas de réveils nocturnes, ni d'exacerbations, ni d'effets indésirables nécessitant une modification de traitement.
**Contrôle total de l'asthme ; pas de symptômes, pas d'utilisation de BACA, débit maximal expiratoire matinal supérieur ou égal à 80 % de la valeur théorique, pas de réveils nocturnes, ni d'exacerbations, ni d'effets indésirables nécessitant une modification de traitement.
Une étude en double aveugle, randomisée, en groupes parallèles sur 318 patients d'au moins 18 ans atteints d'asthme persistant, a évalué la sécurité et la tolérance de l'administration de deux inhalations deux fois par jour (double dose) de propionate de fluticasone/salmétérol pendant deux semaines. Cette étude a montré que le doublement de la dose de propionate de fluticasone/salmétérol (quel que soit le dosage), sur une durée allant jusqu’à 14 jours, entraîne par rapport à l’administration d’une inhalation deux fois par jour, une légère augmentation des effets indésirables liés à l’activité β-mimétique (tremblements, 1 patient [1 %] contre 0 ; palpitations, 6 [3 %] contre 1 [<1 %] ; crampes musculaires, 6 [3 %] contre 1 [<1 %]) et une incidence similaire des événements indésirables liés au corticoïde inhalé (par ex. candidose buccale, 6 [6%] contre 16 [8%] ;raucité de la voie, 2 [2 %] contre 4 [2 %]).
La faible augmentation des effets indésirables liés à l’activité β-mimétique doit être prise en considération, s’il est envisagé de doubler la dose prescrite de propionate de fluticasone/salmétérol chez des patients adultes qui nécessiteraient une augmentation de la corticothérapie inhalée pendant une courte période (jusqu’à 14 jours).
Asthme
Etude de recherche SMART (Salmeterol Multi-center Asthma Research Trial)
L’étude SMART (Salmeterol Multi-center Asthma Research Trial) était une étude de 28 semaines réalisée aux Etats-Unis chez des patients adultes et adolescents afin d’évaluer la sécurité du salmétérol comparé au placebo ajouté au traitement habituel. Bien qu’aucune différence significative n’ait été observée pour le critère principal d’évaluation, critère combiné associant le nombre de décès liés à une cause respiratoire et le nombre de détresses respiratoires mettant en jeu le pronostic vital, l’étude a montré une augmentation significative du nombre de décès liés à l’asthme chez les patients recevant du salmétérol (13 décès chez les 13 176 patients traités par salmétérol comparé à 3 décès chez les 13 179 patients recevant le placebo). L’étude n’était pas conçue pour évaluer l’impact des corticostéroïdes inhalés administrés en parallèle ; à l’inclusion, l’utilisation de CSI n’a été rapportée que chez 47 % des patients.
Sécurité et efficacité de propionate de fluticasone/salmétérol versus propionate de fluticasone en monothérapie dans l’asthme
Deux études multi-centriques de 26 semaines ont été réalisées afin de comparer la sécurité et l’efficacité de propionate de fluticasone/salmétérol versus propionate de fluticasone en monothérapie : une chez des patients adultes et adolescents (étude AUSTRI) et l’autre chez des patients pédiatriques âgés de 4 à 11 ans (étude VESTRI). Pour les deux études, les patients inclus présentaient un asthme persistant modéré à sévère, associé à des antécédents d’hospitalisations liées à l’asthme ou à des épisodes d’exacerbation au cours de l’année précédente. Le critère principal d’évaluation de chaque étude consistait à déterminer si l’ajout de LABA au traitement par CSI (propionate de fluticasone/salmétérol) était non-inférieur au CSI administré seul en termes de risque d’évènements indésirables graves liés à l’asthme (hospitalisation due à l’asthme, intubation endotrachéale et décès). L’objectif secondaire d’efficacité de ces études consistait à évaluer si l’association CSI/LABA (propionate de fluticasone/salmétérol) était supérieure au traitement par CSI seuls (propionate de fluticasone) en termes d’exacerbation sévère de l’asthme (définie comme une détérioration de l’asthme nécessitant l’utilisation de corticostéroïdes par voie systémique pendant au moins 3 jours ou bien une hospitalisation ou une consultation dans un service d’urgences pour un asthme qui requière l’utilisation de corticostéroïdes par voie systémique).
Un total de respectivement 11 679 et 6 208 patients ont été randomisés afin de recevoir le traitement défini dans le cadre des études AUSTRI et VESTRI. En ce qui concerne le critère principal d’évaluation, une non-infériorité a été démontrée dans les deux études (voir tableau ci-dessous).
Effets indésirables graves liés à l’asthme rapportés dans les études de 26 semaines AUSTRI et VESTRI
|
AUSTRI |
VESTRI |
|||
|
PF-Salmétérol (n = 5 834) |
PF en monthérapie (n = 5 845) |
PF-Salmétérol (n = 3 107) |
PF en monothérapie (n = 3 101) |
|
|
Critère d’évaluation composite (hospitalisation liée à l’asthme, intubation endotrachéale ou décès) |
34 (0,6 %) |
33 (0,6 %) |
27 (0,9 %) |
21 (0,7 %) |
|
PF-Salmétérol/PF Hazard ratio (IC 95 %) |
1,029 (0,638-1,662)a |
1,285 (0,726-2,272)b |
||
|
Décès |
0 |
0 |
0 |
0 |
|
Hospitalisation liée à l’asthme |
34 |
33 |
27 |
21 |
|
Intubation endotrachéale |
0 |
2 |
0 |
0 |
a L’obtention d’une estimation supérieure de l’IC 95 % du risque relatif inférieure à 2,0 a permis de conclure à une non-infériorité.
b L’obtention d’une estimation supérieure de l’IC 95 % du risque relatif inférieure à 2,675 a permis de conclure à une non-infériorité.
Pour le critère d’évaluation secondaire, une réduction du délai de survenue de la première exacerbation de l’asthme avec l’association PF-salmétérol par rapport au PF seul a été observée dans les deux études, cependant cette réduction n’a été statistiquement significative que dans l’étude AUSTRI.
|
AUSTRI |
VESTRI |
|||
|
PF-Salmétérol (n = 5 834) |
PF en monothérapie (n = 5 845) |
PF-Salmétérol (n = 3 107) |
PF en monothérapie (n = 3 101) |
|
|
Nombre de sujets présentant une exacerbation de leur asthme |
480 (8 %) |
597 (10 %) |
265 (9 %) |
309 (10 %) |
|
PF-Salmétérol/PF Hazard ratio (IC 95 %) |
0,787 (0,698 ; 0,888) |
0,859 (0,729 ; 1,012) |
||
Médicaments anti-asthmatiques contenant du propionate de fluticasone utilisés pendant la grossesse
Une étude de cohorte épidémiologique rétrospective observationnelle a été réalisée sur la base de dossiers médicaux électroniques émanant du Royaume-Uni afin d’évaluer le risque de MCM (Malformations congénitales majeures) suite à l’exposition au propionate de fluticasone inhalé seul et à l’association PF/salmétérol comparativement à un traitement par CSI ne contenant pas de propionate de fluticasone, pendant le premier trimestre de la grossesse. Aucun comparateur par placebo n’a été inclus dans cette étude.
Au sein de la cohorte « asthme » de 5 362 grossesses exposées aux CSI au cours du premier trimestre, 131 MCM diagnostiquées ont été identifiées ; 1 612 (30 %) grossesses ont été exposées au propionate de fluticasone ou à l’association propionate de fluticasone/salmétérol, parmi lesquelles 42 MCM diagnostiquées ont été identifiées. Les « odds ratio » ajustés pour les MCMs diagnostiquées en un an étaient de 1,1 (IC 95 %; 0,5 – 2,3) pour les femmes présentant un asthme modéré et exposées au propionate de fluticasone par rapport à un traitement par CSI sans propionate de fluticasone et de 1,2 (IC 95 % ; 0,7 – 2,0) pour les femmes présentant un asthme important à sévère. Aucune différence dans le risque de MCM n’a été identifiée suite à l’exposition au propionate de fluticasone en monothérapie pendant le premier trimestre de la grossesse par rapport à l’association propionate de fluticasone/salmétérol. Les risques absolus de MCM quel que soit le degré de sévérité de l’asthme se situaient entre 2,0 et 2,9 pour 100 grossesses exposées au propionate de fluticasone, ce qui est comparable aux résultats d’une étude portant sur 15 840 grossesses non exposées à un traitement de l’asthme d’après la « General Practice Research Database » (2,8 MCMs pour 100 grossesses).
5.2. Propriétés pharmacocinétiques
Salmétérol
Le salmétérol agissant localement au niveau pulmonaire, les taux plasmatiques ne sont pas corrélés à l’effet thérapeutique. De plus, peu de données sont disponibles sur la pharmacocinétique du salmétérol après administration par voie inhalée car les concentrations plasmatiques observées aux doses thérapeutiques sont très faibles (au maximum 200 picogrammes/mL), et difficilement mesurables.
Propionate de fluticasone
La biodisponibilité absolue d'une dose unique de propionate de fluticasone inhalée chez les sujets sains est de l'ordre d'environ 5 à 11 % de la dose nominale, selon le dispositif d'inhalation utilisé. Chez les patients asthmatiques, on a observé une exposition systémique moins importante au propionate de fluticasone inhalé.
L'absorption systémique s'effectue principalement par voie pulmonaire ; elle est initialement rapide puis prolongée. Le reste de la dose inhalée peut être avalé, mais contribue de façon minime à l'exposition systémique du fait de la faible solubilité aqueuse et d'une biotransformation présystémique, entraînant une biodisponibilité orale inférieure à 1 %. L'exposition systémique augmente de manière linéaire avec l'augmentation de la dose inhalée.
L'élimination du propionate de fluticasone est caractérisée par une clairance plasmatique élevée (1 150 mL/min), un important volume de distribution à l'état d'équilibre (environ 300 L) et une demi-vie terminale d'environ 8 heures.
La liaison aux protéines plasmatiques est de 91 %.
Le propionate de fluticasone est éliminé très rapidement de la circulation systémique. Le produit est essentiellement métabolisé en un dérivé acide carboxylique inactif, par l'enzyme CYP3A4 du cytochrome P450. D'autres métabolites non identifiés sont également retrouvés dans les fécès.
La clairance rénale du propionate de fluticasone est négligeable. Moins de 5 % de la dose est excrétée dans l'urine, principalement sous forme de métabolites. La majorité de la dose est éliminée dans les fèces sous forme de métabolites et sous forme inchangée.
5.3. Données de sécurité préclinique
Au cours des études de reproduction menées chez l’animal, des malformations ont été observées après administration de glucocorticoïdes (fentes palatines, malformations osseuses). Cependant, ces résultats expérimentaux observés chez l’animal, ne semblent pas prédictifs d’un effet malformatif chez l’homme aux doses recommandées. Les études menées chez l’animal avec le salmétérol ont montré une toxicité embryofoetale seulement après exposition à de fortes doses. Après administration concomitante des deux principes actifs, il a été observé chez des rats recevant des doses de glucocorticoïdes connues pour induire des anomalies, une augmentation de la fréquence d’apparition de transposition de l’artère ombilicale et d’ossifications incomplètes au niveau de l’occipital. Ni le xinafoate de salmétérol ni le propionate de fluticasone n’ont montré d’effet potentiel en termes de toxicité génétique.
L’expérimentation animale, menée en administration quotidienne pendant deux ans, n’a pas mis en évidence d’effet toxique du gaz propulseur, le norflurane, lorsqu’il était administré à des doses nettement supérieures à celles qui peuvent être utilisées en thérapeutique.
6.4. Précautions particulières de conservation
Remettre fermement en place le capuchon de l'embout buccal et l’emboîter complètement.
Le flacon contient un liquide pressurisé. Ne pas exposer à une température supérieure à 50 °C. Ne pas perforer le flacon.
Comme pour la plupart des médicaments pressurisés en flacon, l'effet thérapeutique de ce médicament peut diminuer quand le flacon est froid.
6.5. Nature et contenu de l'emballage extérieur
Flacon en aluminium muni d'une valve doseuse adaptée et d'un poussoir d'activation en polypropylène avec un indicateur de doses et un capuchon.
Chaque flacon contient 120 doses.
Présentations :
1, 2 (conditionnement multiple 2 x 1) ou 3 (conditionnement multiple 3 x 1) flacons contenant 120 doses.
10 (conditionnement multiple 10 x 1) flacons contenant 120 doses – destiné à l'usage hospitalier uniquement.
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
Pas d'exigences particulières pour l'élimination.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
SWENSWEG 5
2031 GA HAARLEM
PAYS-BAS
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 301 564 5 2 : Flacon pressurisé (Aluminium) contenant 120 doses. Boîte de 1.
· 34009 550 582 1 2 : Flacon pressurisé (Aluminium) contenant 120 doses. Boîte de 2.
· 34009 550 582 3 6 : Flacon pressurisé (Aluminium) contenant 120 doses. Boîte de 3.
· 34009 550 582 4 3 : Flacon pressurisé (Aluminium) contenant 120 doses. Boîte de 10.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[À compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[À compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Liste I
ANSM - Mis à jour le : 09/04/2025
Propionate de fluticasone/salmétérol
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin ou votre pharmacien.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou à votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
2. Quelles sont les informations à connaître avant d'utiliser PROPIONATE DE FLUTICASONE/SALMETEROL TEVA 250 microgrammes/25 microgrammes/ dose, suspension pour inhalation en flacon pressurisé ?
3. Comment utiliser PROPIONATE DE FLUTICASONE/SALMETEROL TEVA 250 microgrammes/25 microgrammes/dose, suspension pour inhalation en flacon pressurisé ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver PROPIONATE DE FLUTICASONE/SALMETEROL TEVA 250 microgrammes/25 microgrammes/dose, suspension pour inhalation en flacon pressurisé ?
6. Contenu de l'emballage et autres informations.
1. QU’EST-CE QUE PROPIONATE DE FLUTICASONE/SALMETEROL TEVA 250 microgrammes/25 microgrammes/dose, suspension pour inhalation en flacon pressurisé ET DANS QUELS CAS EST-IL UTILISE ?
Classe pharmacothérapeutique : Adrénergiques en association avec des corticoïdes ou d'autres médicaments, à l'exclusion des anticholinergiques, code ATC : R03AK06.
· Le salmétérol est un bronchodilatateur de longue durée d’action. Les bronchodilatateurs aident à garder les bronches ouvertes. Cela permet de faciliter l’entrée et la sortie de l’air dans les poumons. L’effet dure au moins 12 heures.
· Le propionate de fluticasone est un corticoïde qui diminue l’inflammation et l’irritation dans les poumons.
Votre médecin vous a prescrit ce médicament pour aider à prévenir certains troubles respiratoires tels que l’asthme.
Vous devez utiliser PROPIONATE DE FLUTICASONE/SALMETEROL TEVA tous les jours comme indiqué par votre médecin. Cela permettra de contrôler correctement votre asthme.
PROPIONATE DE FLUTICASONE/SALMETEROL TEVA permet d’éviter la survenue d’essoufflement et de sifflement. Cependant, PROPIONATE DE FLUTICASONE/SALMETEROL TEVA ne doit pas être utilisé lorsque vous avez une crise soudaine d’essoufflement ou de sifflement. Dans ces cas, vous devez utiliser votre médicament bronchodilatateur dit « de secours » d’action rapide et de courte durée, comme le salbutamol. Vous devez toujours avoir sur vous votre inhalateur dit « de secours » d’action rapide et de courte durée.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER PROPIONATE DE FLUTICASONE/SALMETEROL TEVA 250 microgrammes/ 25 microgrammes/dose, suspension pour inhalation en flacon pressurisé ?
· si vous êtes allergique au salmétérol, au propionate de fluticasone ou à l'un des autres composants contenus dans ce médicament, mentionnés dans la rubrique 6.
Avertissements et précautions
Adressez-vous à votre médecin, pharmacien ou infirmier/ère avant d'utiliser PROPIONATE DE FLUTICASONE/SALMETEROL TEVA si vous avez :
· une maladie du cœur, y compris un rythme cardiaque irrégulier ou trop rapide,
· une hyperactivité de la thyroïde,
· une pression artérielle élevée,
· du diabète (PROPIONATE DE FLUTICASONE/SALMETEROL TEVA peut augmenter le taux de sucre dans votre sang),
· un faible taux de potassium dans votre sang,
· une tuberculose actuellement en cours d’évolution ou survenue dans le passé, ou toute autre infection pulmonaire.
Contactez votre médecin en cas de vision floue ou d’autres troubles visuels.
Enfants et adolescents
Sans objet.
Autres médicaments et PROPIONATE DE FLUTICASONE/SALMETEROL TEVA 250 microgrammes/25 microgrammes/dose, suspension pour inhalation en flacon pressurisé
Informez votre médecin ou pharmacien si vous utilisez, avez récemment utilisé ou pourriez utiliser tout autre médicament. Cela concerne les médicaments pour l’asthme et tout autre médicament y compris ceux obtenus sans ordonnance. Ceci est dû au fait que PROPIONATE DE FLUTICASONE/SALMETEROL TEVA peut ne pas être adapté à la prise simultanée d’autres médicaments.
Avant de commencer à utiliser PROPIONATE DE FLUTICASONE/SALMETEROL TEVA, informez votre médecin si vous prenez un des médicaments suivants :
· bêta-bloquants (comme l'aténolol, le propranolol et le sotalol). Les bêta-bloquants sont surtout utilisés dans le traitement de l'hypertension artérielle ou d'autres maladies cardiaques ;
· médicaments utilisés pour traiter des infections (comme le kétoconazole, l'itraconazole et l'érythromycine). Certains de ces médicaments peuvent augmenter le taux de propionate de fluticasone ou de salmétérol dans votre organisme. Cela peut augmenter le risque d’avoir des effets indésirables avec PROPIONATE DE FLUTICASONE/SALMETEROL TEVA, notamment des battements cardiaques irréguliers, ou rendre plus graves des effets indésirables ;
· corticoïdes (par voie orale ou par injection). Si vous avez pris ces médicaments récemment, il existe un risque que ce médicament exerce également un effet sur les glandes surrénales de votre organisme ;
· diurétiques utilisés pour traiter l'hypertension ;
· autres bronchodilatateurs (comme le salbutamol) ;
· médicaments contenant de la xanthine, souvent utilisés pour traiter l'asthme ;
· médicaments pour traiter les virus (y compris certains médicaments utilisés dans le traitement du VIH : ritonavir, cobicistat). Il se peut que votre médecin souhaite instaurer une surveillance particulière si vous prenez ces médicaments.
PROPIONATE DE FLUTICASONE/SALMETEROL TEVA 250 microgrammes/25 microgrammes/ dose, suspension pour inhalation en flacon pressurisé avec des aliments et boissons
Sans objet.
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin ou pharmacien avant de prendre ce médicament.
Conduite de véhicules et utilisation de machines
PROPIONATE DE FLUTICASONE/SALMETEROL TEVA n’a pas de raison d’affecter la capacité à conduire un véhicule ou à utiliser une machine.
PROPIONATE DE FLUTICASONE/SALMETEROL TEVA 250 microgrammes/25 microgrammes /dose, suspension pour inhalation en flacon pressurisé contient
Sans objet.
3. COMMENT UTILISER PROPIONATE DE FLUTICASONE/SALMETEROL TEVA 250 microgrammes/25 microgrammes/dose, suspension pour inhalation en flacon pressurisé ?
· Utilisez PROPIONATE DE FLUTICASONE/SALMETEROL TEVA tous les jours, jusqu’à avis contraire de votre médecin. Ne prenez pas plus que la dose recommandée. En cas de doute, vérifiez auprès de votre médecin ou de votre pharmacien.
· N’arrêtez pas PROPIONATE DE FLUTICASONE/SALMETEROL TEVA ou ne réduisez pas vous-même vos doses de PROPIONATE DE FLUTICASONE/SALMETEROL TEVA sans en avoir préalablement parlé à votre médecin.
· PROPIONATE DE FLUTICASONE/SALMETEROL TEVA doit être inhalé par la bouche pour aller dans les poumons.
Adultes et enfants âgés de 12 ans et plus
Deux inhalations deux fois par jour.
Utilisation chez les enfants et les adolescents
PROPIONATE DE FLUTICASONE/SALMETEROL TEVA est déconseillé chez les enfants de moins de 12 ans.
La posologie doit être ajustée à la plus faible dose permettant de contrôler efficacement les symptômes.
Lorsque les symptômes sont contrôlés par la plus faible posologie recommandée de PROPIONATE DE FLUTICASONE/SALMETEROL TEVA (125/25 microgrammes), il peut être alors envisagé d’utiliser une autre formulation de fluticasone/salmétérol par inhalation, à une concentration plus faible (50/25 microgrammes).
Vos symptômes doivent être bien contrôlés en utilisant PROPIONATE DE FLUTICASONE/SALMETEROL TEVA deux fois par jour. Si c’est le cas, votre médecin peut alors décider de réduire votre dose à une prise par jour. Votre dose pourrait donc être réduite à :
· une prise le soir si vous avez des symptômes pendant la nuit,
ou
· une prise le matin si vous avez des symptômes pendant la journée.
Il est très important de suivre les indications données par votre médecin sur le nombre de bouffées à inhaler ou l’intervalle de temps entre chaque prise de votre médicament.
Si vous utilisez PROPIONATE DE FLUTICASONE/SALMETEROL TEVA pour le traitement de votre asthme, votre médecin souhaitera vérifier régulièrement votre état clinique.
Si votre asthme ou votre essoufflement s’aggrave, consultez votre médecin immédiatement. Si vous entendez des sifflements bronchiques plus importants, si vous vous sentez plus souvent oppressé au niveau de la poitrine ou si vous avez plus souvent besoin d’utiliser votre traitement bronchodilatateur « de secours », continuez à utiliser PROPIONATE DE FLUTICASONE/SALMETEROL TEVA sans augmenter le nombre de bouffées. Votre état respiratoire pourrait s’aggraver et vous pourriez alors être davantage malade. Dans ce cas, consultez votre médecin, car il se peut que vous ayez besoin d’un traitement supplémentaire.
Instructions d’utilisation
· Votre médecin, votre infirmier/ère ou votre pharmacien devront vous montrer comment utiliser votre inhalateur. Ils devront vérifier régulièrement comment vous l'utilisez. Ne pas utiliser PROPIONATE DE FLUTICASONE/SALMETEROL TEVA correctement ou comme vous l’a prescrit votre médecin pourrait limiter son efficacité pour traiter votre asthme ;
· le médicament est contenu dans une cartouche pressurisée insérée dans un applicateur en plastique, et muni d'un embout buccal ;
· un indicateur de doses situé à l'avant de l'inhalateur indique le nombre de doses restantes. Quand vous utilisez l'inhalateur, l'indicateur tourne toutes les cinq à sept bouffées jusqu'au nombre inférieur suivant. L'indicateur indique le nombre approximatif de bouffées restantes dans l'inhalateur ;
· faites attention à ne pas laisser tomber l'inhalateur, car cela pourrait déclencher un décompte sur l’indicateur de doses.
Vérification du fonctionnement du dispositif
1. Lorsque vous utilisez l’inhalateur pour la première fois, testez son bon fonctionnement. Retirez le capuchon de l’embout buccal en pressant doucement les côtés, entre le pouce et l’index et tirez-le.
2. Afin de s’assurer qu’il fonctionne, agitez-le vigoureusement, éloignez l’embout buccal de vous et appuyez sur la cartouche pour libérer 4 bouffées dans l'air. L'indicateur de doses indiquera le nombre « 120 » qui correspond au nombre de bouffées contenues dans l'inhalateur. Si vous n'avez pas utilisé l'inhalateur pendant une semaine ou plus, agitez vigoureusement le flacon et libérez 2 bouffées du médicament dans l'air.
Utilisation de l'inhalateur
Il est important de commencer par respirer le plus lentement possible juste avant d'utiliser l'inhalateur.
1. Tenez-vous debout ou assis quand vous utilisez votre inhalateur.
2. Retirez le capuchon de l'embout buccal. Vérifiez que l'intérieur et l'extérieur de l'embout buccal sont propres et ne contiennent pas de corps étrangers (Figure A).
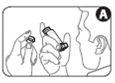
3. Agitez 4 ou 5 fois l'inhalateur afin d’éliminer tout corps étranger et d’assurer le mélange du contenu de l'inhalateur (Figure B).
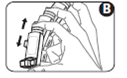
4. Tenez l’appareil bien à la verticale en plaçant le pouce à la base, sous l’embout buccal. Expirez autant que vous le pouvez (Figure C).
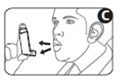
5. Placez l'embout buccal dans la bouche entre les dents. Fermez les lèvres autour. Ne mordez pas l'embout (Figure D).
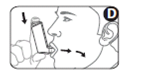
6. Inspirez par la bouche lentement et profondément. Juste après avoir commencé à inspirer à travers l’inhalateur, poussez fermement vers le bas sur le haut du flacon pour libérer une bouffée du médicament, tout en inspirant régulièrement et profondément (Figure D).
7. Retenez votre respiration, retirez l'inhalateur de votre bouche et relâchez la pression du doigt sur le haut de l'inhalateur. Continuez à retenir votre respiration durant quelques secondes ou aussi longtemps que vous le pouvez (Figure E).
8. Attendez environ 30 secondes entre chaque bouffée de médicament, et répétez les étapes 3 à 7.
9. Ensuite, rincez-vous la bouche à l'eau et recrachez la et/ou brossez-vous les dents. Ceci permettra d’éviter l’apparition d’une candidose ou d’une voix rauque.
10. Après l'utilisation, remettez toujours immédiatement le capuchon en place pour protéger l’embout buccal de la poussière. Quand le capuchon est fixé convenablement on peut entendre un « clic ». Si vous n’entendez pas de clic, tournez le capuchon dans l’autre sens et réessayez sans forcer.
Ne précipitez pas les étapes 4, 5, 6 et 7. Il est important de respirer le plus lentement possible juste avant d’utiliser l'inhalateur. Vous devez utiliser votre inhalateur debout face à un miroir les premières fois. Si vous voyez du « brouillard » sortir du haut de l’inhalateur ou des côtés de la bouche, recommencez à nouveau à partir de l’étape 3.
Comme avec tous les inhalateurs, les soignants doivent s’assurer que les enfants ou les adolescents auxquels PROPIONATE DE FLUTICASONE/SALMETEROL TEVA est prescrit, utilisent une technique d’inhalation correcte, comme décrit ci‑dessus.
Si vous avez des difficultés à utiliser l'inhalateur, il pourra vous être recommandé d’utiliser une chambre d'inhalation Volumatic ou AeroChamber Plus ou une autre chambre d'inhalation (en fonction des recommandations nationales). Avant d'utiliser pour la première fois une chambre d'inhalation ou si vous devez changer de chambre d'inhalation, consultez votre médecin, votre infirmier/ère ou votre pharmacien.
Vous devez envisager de remplacer l'inhalateur quand l'indicateur affiche « 40 » et que la couleur de l'indicateur de doses passe du vert au rouge. Arrêtez d'utiliser l'inhalateur quand l'indicateur affiche « 0 » parce que son contenu est insuffisant pour l'administration d'une dose complète. N’essayez jamais de modifier les chiffres sur l’indicateur de doses ou de détacher l’indicateur du poussoir. L'indicateur ne peut pas être réinitialisé et il est fixé de manière permanente au poussoir d'activation.
Nettoyage de l'inhalateur
Afin d'éviter un blocage de l'inhalateur, il est important de le nettoyer au moins une fois par semaine.
Pour nettoyer l'inhalateur :
· retirez le capuchon de l'embout buccal ;
· ne sortez jamais le flacon métallique du boîtier en plastique ;
· essuyez l'intérieur et l'extérieur de l'embout buccal, ainsi que le boîtier en plastique avec un tissu ou un mouchoir propre et sec ;
· remettez le capuchon sur l’embout buccal jusqu’à entendre un « clic » indiquant que celui-ci est fixé convenablement. Si vous n’entendez pas de clic, tournez le capuchon dans l’autre sens et réessayez sans forcer.
Ne plongez pas le flacon métallique dans l'eau.
Si vous avez utilisé plus de PROPIONATE DE FLUTICASONE/SALMETEROL TEVA 250 microgrammes/25 microgrammes/dose, suspension pour inhalation en flacon pressurisé que vous n'auriez dû
Il est important que vous utilisiez l'inhalateur en respectant les instructions. Si vous avez pris accidentellement une dose plus élevée que la dose recommandée, parlez-en à votre médecin ou à votre pharmacien. Vous pourriez remarquer une accélération de vos battements cardiaques et des tremblements. Vous pourriez également avoir des vertiges, des maux de tête, une faiblesse musculaire et des douleurs articulaires.
Si vous avez utilisé des doses trop élevées pendant une longue période, vous devez en parler à votre médecin ou à votre pharmacien. En effet, des doses trop importantes de PROPIONATE DE FLUTICASONE/SALMETEROL TEVA peuvent entraîner une diminution des hormones stéroïdiennes sécrétées par les glandes surrénales.
Si vous oubliez d'utiliser PROPIONATE DE FLUTICASONE/SALMETEROL TEVA 250 microgrammes/25 microgrammes/dose, suspension pour inhalation en flacon pressurisé
Ne prenez pas de dose double pour compenser la dose que vous avez oublié de prendre. Prenez juste la dose suivante à l’heure habituelle.
Si vous arrêtez d'utiliser PROPIONATE DE FLUTICASONE/SALMETEROL TEVA 250 microgrammes/25 microgrammes/dose, suspension pour inhalation en flacon pressurisé
Il est très important que vous preniez PROPIONATE DE FLUTICASONE/SALMETEROL TEVA tous les jours comme indiqué par votre médecin. Continuez votre traitement jusqu’à l’avis contraire de votre médecin. N’arrêtez pas ou ne réduisez pas les doses de PROPIONATE DE FLUTICASONE/SALMETEROL TEVA subitement. Cela pourrait rendre votre respiration plus difficile.
De plus, si vous arrêtez brusquement d’utiliser PROPIONATE DE FLUTICASONE/ SALMETEROL TEVA ou si vous en réduisez brusquement la dose, cela peut (très rarement) provoquer des problèmes des glandes surrénales (insuffisance surrénalienne) qui peuvent parfois entraîner des effets indésirables.
Ces effets indésirables peuvent inclure :
· douleurs d’estomac ;
· fatigue et perte d'appétit, nausées ;
· vomissements et diarrhée ;
· perte de poids ;
· maux de tête ou somnolence ;
· diminution du taux de sucre dans votre sang ;
· baisse de tension artérielle et convulsions (crises d’épilepsie).
L’insuffisance surrénalienne peut s’aggraver et vous pouvez présenter un des effets indésirables mentionnés ci-dessus lorsque votre corps est soumis à des facteurs de stress tels que de l’apparition de fièvre ou un traumatisme (comme un accident de voiture), une infection ou une intervention chirurgicale.
Si vous présentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Pour éviter l'apparition de ces symptômes, votre médecin peut vous prescrire un traitement supplémentaire par corticoïdes sous forme de comprimé (tel que la prednisolone).
Si vous avez d'autres questions sur l'utilisation de ce médicament, demandez plus d'informations à votre médecin, à votre pharmacien ou à votre infirmier/ère.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Afin de réduire le risque d'effets indésirables, votre médecin prescrira la dose la plus faible possible de PROPIONATE DE FLUTICASONE/SALMETEROL TEVA permettant de contrôler votre asthme.
Réactions allergiques : vous pouvez constater que votre essoufflement s’aggrave subitement, immédiatement après avoir utilisé PROPIONATE DE FLUTICASONE/SALMETEROL TEVA. Vous pouvez percevoir des sifflements bronchiques et tousser ou être essoufflé. Vous pouvez également ressentir des démangeaisons, remarquer une éruption cutanée (urticaire) ou un gonflement (généralement au niveau du visage, des lèvres, de la langue ou de la gorge), sentir que votre cœur se met soudainement à battre très rapidement ou vous sentir mal et avoir la tête qui tourne (malaise pouvant aller jusqu’à un évanouissement ou une perte de connaissance). Si vous ressentez l’un de ces symptômes ou s’ils apparaissent subitement après avoir utilisé PROPIONATE DE FLUTICASONE/SALMETEROL TEVA, arrêtez de prendre PROPIONATE DE FLUTICASONE/SALMETEROL TEVA et parlez-en à votre médecin immédiatement. Les réactions allergiques à PROPIONATE DE FLUTICASONE/SALMETEROL TEVA sont peu fréquentes (elles peuvent affecter jusqu'à 1 personne sur 100).
Les autres effets indésirables sont décrits ci-dessous :
Très fréquents (peuvent affecter plus de 1 personne sur 10)
· Maux de tête qui s'améliorent généralement avec la poursuite du traitement.
· Une augmentation du nombre de rhumes a été rapportée chez des patients atteints de BPCO.
Fréquents (peuvent affecter jusqu'à 1 personne sur 10)
· Candidose de la bouche et de la gorge (plaques douloureuses, jaune crème, en relief). Egalement langue irritée, voix rauque et irritation de la gorge. Rincer votre bouche avec de l’eau et la cracher immédiatement et/ou se brosser les dents après chaque prise de votre médicament peut permettre d’éviter ces effets. Votre médecin peut vous prescrire un traitement antifongique pour soigner la candidose.
· Douleurs et inflammations des articulations, douleurs musculaires.
· Crampes musculaires.
Les effets indésirables suivants ont également été rapportés chez des patients atteints de bronchopneumopathie chronique obstructive (BPCO) :
· Pneumonie (infection des poumons).
Informez votre médecin si vous présentez un des symptômes suivants pendant le traitement par PROPIONATE DE FLUTICASONE/SALMETEROL TEVA parce qu'ils peuvent être des symptômes d'infection des poumons :
o fièvre ou frissons ;
o augmentation de la production de mucus, changement de couleur du mucus ;
o augmentation de la toux ou augmentation de la gêne respiratoire.
· Irritation de la gorge. En prévention, rincez-vous la bouche à l'eau puis recrachez la immédiatement après chaque inhalation.
· Hématomes et fractures.
· Inflammation des sinus (sensation de tension ou de pesanteur du nez, des joues et derrière les yeux, avec parfois une douleur pulsatile).
· Diminution de la quantité de potassium dans votre sang (qui peut se manifester par des palpitations, une faiblesse musculaire, des crampes).
Peu fréquents (peuvent affecter jusqu'à 1 personne sur 100)
· Augmentation du taux de sucre (glucose) dans le sang (hyperglycémie). Si vous avez du diabète, une surveillance plus fréquente de votre taux de sucre dans le sang et un ajustement possible de votre traitement antidiabétique habituel peuvent être nécessaires.
· Opacités dans le cristallin (cataracte).
· Accélération rapide du rythme cardiaque (tachycardie).
· Tremblements et rythme cardiaque rapide ou irrégulier (palpitations) ; ils sont généralement sans gravité et diminuent lors de la poursuite du traitement.
· Douleur dans la poitrine.
· Sentiment d’inquiétude (principalement chez les enfants).
· Troubles du sommeil.
· Eruption cutanée allergique.
Rares (peuvent affecter jusqu'à 1 personne sur 1 000)
· Survenue brutale d’une difficulté à respirer ou de sifflements bronchiques juste après la prise de PROPIONATE DE FLUTICASONE/SALMETEROL TEVA. Si cela vous arrive, arrêtez d'utiliser PROPIONATE DE FLUTICASONE/SALMETEROL TEVA. Utilisez votre inhalateur dit « de secours » à action rapide pour vous aider à respirer et prévenez immédiatement votre médecin.
· PROPIONATE DE FLUTICASONE/SALMETEROL TEVA peut affecter la production normale d'hormones stéroïdiennes dans l'organisme, particulièrement si vous avez pris des doses élevées pendant de longues périodes. Les effets incluent :
o ralentissement de la croissance chez les enfants et les adolescents ;
o amincissement de la trame osseuse ;
o lésion du nerf optique dans l'œil (glaucome) ;
o prise de poids ;
o arrondissement (aspect en forme de lune) du visage (syndrome de Cushing).
Votre médecin s’assurera régulièrement que vous ne présentez pas ces effets indésirables, et que vous utilisez la plus faible dose de PROPIONATE DE FLUTICASONE/SALMETEROL TEVA permettant de contrôler votre asthme.
· Modifications du comportement, telles qu’activité et irritabilité inhabituelles (ces effets surviennent principalement chez les enfants).
· Irrégularité du rythme cardiaque (arythmies). Prévenez votre médecin, mais n'arrêtez pas de prendre PROPIONATE DE FLUTICASONE/SALMETEROL TEVA sauf si votre médecin vous le demande.
· Infection fongique de l'œsophage pouvant provoquer des difficultés pour avaler.
Fréquence indéterminée (la fréquence ne peut pas être estimée sur la base des données disponibles)
· Dépression ou agressivité. Ces effets sont davantage susceptibles de survenir chez les enfants.
· Vision floue.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou à votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER PROPIONATE DE FLUTICASONE/SALMETEROL TEVA 250 microgrammes/25 microgrammes/dose, suspension pour inhalation en flacon pressurisé ?
Tenir ce médicament hors de la vue et de la portée des enfants.
Immédiatement après l'utilisation, remettez en place le capuchon de l'embout buccal et emboitez-le jusqu’à entendre un « clic », sans forcer.
Ne pas exposer à une température supérieure à 50 °C. Ne conservez pas PROPIONATE DE FLUTICASONE/SALMETEROL TEVA dans un endroit froid, car l'inhalateur pourrait ne pas fonctionner correctement.
N'utilisez pas ce médicament après la date de péremption indiquée sur l'étiquette et la boîte après EXP. La date de péremption fait référence au dernier jour de ce mois.
Le flacon métallique contient un liquide pressurisé. Ne pas perforer le flacon.
Ne jetez aucun médicament au tout-à-l'égout ou avec les ordures ménagères. Demandez à votre pharmacien d'éliminer les médicaments que vous n'utilisez plus. Ces mesures contribueront à protéger l'environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
· Les substances actives sont :
Propionate de fluticasone.............................................................................. 250 microgrammes
Salmétérol...................................................................................................... 25 microgrammes
Sous forme de xinafoate de salmétérol
Par dose émise par la valve
Soit
Propionate de fluticasone.............................................................................. 220 microgrammes
Salmétérol...................................................................................................... 21 microgrammes
Pour une dose délivrée à la sortie de l’embout buccal.
Chaque flacon contient 120 doses.
Présentations :
1, 2 (conditionnement multiple 2 x 1) ou 3 (conditionnement multiple 3 x 1) flacons contenant 120 doses.
10 (conditionnement multiple 10 x 1) flacons contenant 120 doses – hôpital uniquement.
Toutes les présentations peuvent ne pas être commercialisées.
Titulaire de l’autorisation de mise sur le marché
SWENSWEG 5
2031 GA HAARLEM
PAYS-BAS
Exploitant de l’autorisation de mise sur le marché
100-110, ESPLANADE DU GÉNÉRAL DE GAULLE
92931 PARIS LA DEFENSE CEDEX
S&D Pharma CZ, spol. s r.o
Theodor 28
273 08 Pchery (Pharmos a.s. facility)
République Tchèque
Ou
arrow generiques
26 avenue tony garnier
69007 lyon
Ou
Cipla Europe NV
De Keyserlei 60C, Box-1301,
2018 Anvers
Belgique
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Ce médicament est autorisé dans les États membres de l'Espace Économique Européen sous les noms suivants : Conformément à la réglementation en vigueur.
[à compléter ultérieurement par le titulaire]
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).